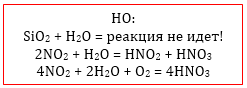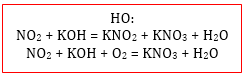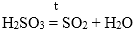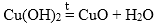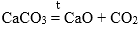Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → Na2O2
Калий, цезий, рубидий образуют преимущественно надпероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства основных оксидов.
Химические свойства кислотных оксидов.
Химические свойства амфотерных оксидов.
Химические свойства оксидов
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H2O → Щелочь |
Реакция идет, если образуется растворимое основание, а также Ca(OH)2: CaO + H2O → Ca(OH)2 MgO + H2O → Реакция не идет, ак как Mg(OH)2 нерастворим* |
| Амфотерный оксид | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H2O → Кислота |
Все реакции идут за исключением SiO2 (кварц, песок): SiO2 + H2O → реакция не идет |
* Источник: [2] «Я сдам ЕГЭ. Курс самоподготовки», стр. 143.
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na2O + CaO → реакция не идет
CO2 + SO3 → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом (исключения: CO2, SO2, о них подробнее ниже):
Na2O + SO3 → Na2SO4
CaO + CO2 → CaCO3
Na2O + ZnO → Na2ZnO2
Взаимодействие оксидов с кислотами
1. Как правило, основные и амфотерные оксиды взаимодействуют с кислотами:
Na2O + HNO3 → NaNO3 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H2SiO3. Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
CuO + H2SiO3 → реакция не идет.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
SO2 + 2H2S → 3S + 2H2O
SO3 + H2S → SO2 + H2O
SiO2 + 4HF(нед.) → SiF4 + 2H2O
С кислотами-окислителями (только если оксид можно окислить):
SO2 + HNO3 + H2O → H2SO4 + NO
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
SiO2 + 2NaOH → Na2SiO3 +H2O
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3 (если CO2 в избытке)
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
(кислота: H2ZnO2)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
(кислота: H2BeO2)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (алюминат натрия)
(кислота: HAlO2)
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
SiO2 + CaCO3 → CaSiO3 + CO2
P2O5 + 3CaCO3 → Ca3(PO4)2 + 3CO2
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
ZnO + 2KHCO3 → K2ZnO2 + 2CO2 + H2O
SiO2 + K2SO3 → K2SiO3 + SO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K2CO3 + SO2 → K2SO3 + CO2 (H2CO3 слабее и менее устойчива, чем H2SO3)
2. Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO2 + H2O + CaCO3 → Ca(HCO3)2
CO2 + H2O + MgCO3 → Mg(HCO3)2
В тестовых заданиях такие реакции могут быть записаны как:
MgCO3 + CO2 (р-р), т.е. используется раствор с углекислым газом и, следовательно, в реакцию необходимо добавить воду.
Это один из способов получения кислых солей.
Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
1. Реакции с CO, C и H2:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
CuO + H2 → Cu + H2O
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
ZnO + H2 → Zn + H2O
PbO + C → Pb + CO
PbO + CО → Pb + CO2
PbO + H2 → Pb + H2O
FeO + C → Fe + CO
FeO + CО → Fe + CO2
FeO + H2 → Fe + H2O
Fe2O3 + 3C → 2Fe + 3CO
Fe2O3 + 3CО → 2Fe + 3CO2
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
2. Восстановление активных металлов (до Al включительно) приводит к образованию карбидов, а не свободного металла:
CaO + 3C → CaC2 + 3CO
2Al2O3 + 9C → Al4C3 + 6CO
3. Восстановление более активным металлом:
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3.
4. Некоторые оксиды неметаллов также возможно восстановить до свободного неметалла:
2P2O5 + 5C → 4P + 5CO2
SO2 + C → S + CO2
2NO + C → N2 + CO2
2N2O + C → 2N2 + CO2
SiO2 + 2C → Si + 2CO
Только оксиды азота и углерода реагируют с водородом:
2NO + 2H2 → N2 + 2H2O
N2O + H2 → N2 + H2O
SiO2 + H2 → реакция не идет.
В случае углерода восстановления до простого вещества не происходит:
CO + 2H2 <=> CH3OH (t, p, kt)
Особенности свойств оксидов CO2 и SO2
1. Не реагируют с амфотерными гидроксидами:
CO2 + Al(OH)3 → реакция не идет
2. Реагируют с углеродом:
CO2 + C → 2CO
SO2 + C → S + CO2
3. С сильными восстановителями SO2 проявляет свойства окислителя:
SO2 + 2H2S → 3S + 2H2O
SO2 + 4HI → S + 2I2 + 2H2O
SO2 + 2C → S + CO2
SO2 + 2CO → S + 2CO2 (Al2O3, 500°C)
4. Сильные окислители окисляют SO2:
SO2 + Cl2 <=> SO2Cl2
SO2 + Br2 <=> SO2Br2
SO2 + NO2 → SO3 + NO
SO2 + H2O2 → H2SO4
5SO2 + 2KMnO4 +2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + 2KMnO4 + 4KOH → 2K2MnO4 +K2SO4 + 2H2O
SO2 + HNO3 + H2O → H2SO4 + NO
6. Оксид углерода (IV) CO2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
CO2 + 2Mg → 2MgO + C (t)
Особенности свойств оксидов азота (N2O5, NO2, NO, N2O)
1. Необходимо помнить, что все оксиды азота являются сильными окислителями. Совсем необязательно помнить какие продукты образуются в подобных реакциях, так как подобные вопросы возникают только в тестах. Нужно лишь знать основные восстановители, такие как C, CO, H2, HI и йодиды, H2S и сульфиды, металлы (и т.д.) и знать, что оксиды азота их с большой вероятностью окислят.
2NO2 + 4CO → N2 + 4CO2
2NO2 + 2S → N2 + 2SO2
2NO2 + 4Cu → N2 + 4CuO
N2O5 + 5Cu → N2 + 5CuO
2N2O5 + 2KI → I2 + 2NO2 + 2KNO3
N2O5 + H2S → 2NO2 + S + H2O
2NO + 2H2 → N2 + 2H2O
2NO + C → N2 + CO2
2NO + Cu → N2 + 2Cu2O
2NO + Zn → N2 + ZnO
2NO + 2H2S → N2 + 2S + 2H2O
N2O + H2 → N2 + H2O
2N2O + C → 2N2 + CO2
N2O + Mg → N2 + MgO
2. Могут окисляться сильными окислителями (кроме N2O5, так как степень окисления уже максимальная):
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
NO + KMnO4 + H2SO4 → HNO3 + K2SO4 + MnSO4 + H2O
5N2O + 2KMnO4 + 3H2SO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O.
3. Несолеобразующие оксиды N2O и NO не реагируют ни с водой, ни с щелочами, ни с обычными кислотами (кислотами-неокислителями).
Химические свойства CO как сильного восстановителя
1. Реагирует с некоторыми неметаллами:
2CO + O2 → 2CO2
CO + 2H2 <=> CH3OH (t, p, kt)
CO + Cl2 <=> COCl2 (фосген)
2. Реагирует с некоторыми сложными соединениями:
CO + KOH → HCOOK
CO + Na2O2 → Na2CO3
CO + Mg → MgO + C (t)
3. Восстанавливает некоторые металлы (средней и малой активности) и неметаллы из их оксидов:
CO + CuO → Cu + CO2
3CO + Fe2O3 → 2Fe + 3CO2
3CO + Cr2O3 → 2Cr + 3CO2
2CO + SO2 → S + 2CO2 (Al2O3, 500°C)
5CO + I2O5 → I2 + 5CO2
4CO + 2NO2 → N2 + 4CO2
3. С обычными кислотами и водой CO (также как и другие несолеобразующие оксиды) не реагирует.
Химические свойства SiO2
1. Взаимодействует с активными металлами:
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
2. Взаимодействует с углеродом:
SiO2 + 2C → Si + 2CO
(Согласно пособию «Курс самоподготовки» Каверина, SiO2 + CO → реакция не идет)
3 С водородом SiO2 не взаимодействует.
4. Реакции с растворами или расплавами щелочей, с оксидами и карбонатами активных металлов:
SiO2 + 2NaOH → Na2SiO3 +H2O
SiO2 + CaO → CaSiO3
SiO2 + BaO → BaSiO3
SiO2 + Na2CO3 → Na2SiO3 + CO2
SiO2 + CaCO3 → CaSiO3 + CO2
SiO2 + Cu(OH)2 → реакция не идет (из оснований оксид кремния реагирует только с щелочами).
5. Из кислот SiO2 взаимодействует только с плавиковой кислотой:
SiO2 + 4HF → SiF4 + 2H2O.
Свойства оксида P2O5 как сильного водоотнимающего средства
HCOOH + P2O5 → CO + H3PO4
2HNO3 + P2O5 → N2O5 + 2HPO3
2HClO4 + P2O5 → Cl2O7 + 2HPO3.
Термическое разложение некоторых оксидов
В вариантах экзамена такое свойство оксидов не встречается, но рассмотрим его для полноты картины:
Основные:
4CuO → 2Cu2O + O2 (t)
2HgO → 2Hg + O2 (t)
Кислотные:
2SO3 → 2SO2 + O2 (t)
2N2O → 2N2 + O2 (t)
2N2O5 → 4NO2 + O2 (t)
Амфотерные:
4MnO2 → 2Mn2O3 + O2 (t)
6Fe2O3 → 4Fe3O4 + O2 (t).
Особенности оксидов NO2, ClO2 и Fe3O4
1. Диспропорционирование: оксидам NO2 и ClO2 соответствуют две кислоты, поэтому при взаимодействии с щелочами или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла в случае NO2 и хлорат и хлорит в случае ClO2:
2N+4O2 + 2NaOH → NaN+3O2 + NaN+5O3 + H2O
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
В аналогичных реакциях с кислородом образуются только соединения с N+5, так как он окисляет нитрит до нитрата:
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
2Cl+4O2 + H2O → HCl+3O2 + HCl+5O3
2ClO2 + 2NaOH → NaClO2 + NaClO3 + H2O
2. Оксид железа (II,III) Fe3O4 (FeO·Fe2O3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 4H2O.
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Прежде чем начать говорить про химические свойства оксидов, нужно вспомнить о том, что все оксиды делятся на 4 типа, а именно основные, кислотные, амфотерные и несолеобразующие. Для того чтобы определить тип какого-либо оксида, прежде всего нужно понять — оксид металла или неметалла перед вами, а затем воспользоваться алгоритмом (его надо выучить!), представленным в следующей таблице:
| Оксид неметалла | Оксид металла |
| 1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl2O не относится к несолеобразующим оксидам | 1) Степень окисления металла +1 или +2 Вывод: оксид металла — основный Исключение: BeO, ZnO и PbO не относятся к основным оксидам |
| 2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 | 2) Степень окисления металла +3 или +4 Вывод: оксид амфотерный Исключение: BeO, ZnO и PbO амфотерны, несмотря на степень окисления +2 у металлов 3) Степень окисления металла +5, +6, +7 Вывод: оксид кислотный |
Помимо типов оксидов, указанных выше, введем также еще два подтипа основных оксидов, исходя из их химической активности, а именно активные основные оксиды и малоактивные основные оксиды.
- К активным основным оксидам отнесем оксиды щелочных и щелочноземельных металлов (все элементы IA и IIA групп, кроме водорода H, бериллия Be и магния Mg). Например, Na2O, CaO, Rb2O, SrO и т.д.
- К малоактивным основным оксидам отнесем все основные оксиды, которые не попали в список активных основных оксидов. Например, FeO, CuO, CrO и т.д.
Логично предположить, что активные основные оксиды часто вступают в те реакции, в которые не вступают малоактивные.
Следует отметить, что несмотря на то что фактически вода является оксидом неметалла (H2O), обычно ее свойства рассматривают в отрыве от свойств иных оксидов. Обусловлено это ее специфически огромным распространением в окружающем нас мире, в связи с чем в большинстве случаев вода является не реагентом, а средой, в которой может осуществляться бесчисленное множество химических реакций. Однако нередко она принимает и непосредственное участие в различных превращениях, в частности, некоторые группы оксидов с ней реагируют.
Какие оксиды реагируют с водой?
Из всех оксидов с водой реагируют только:
1) все активные основные оксиды (оксиды ЩМ и ЩЗМ);
2) все кислотные оксиды, кроме диоксида кремния (SiO2);
т.е. из вышесказанного следует, что с водой точно не реагируют:
1) все малоактивные основные оксиды;
2) все амфотерные оксиды;
3) несолеобразующие оксиды (NO, N2O, CO, SiO).
Примечание:
Оксид магния медленно реагирует с водой при кипячении. Без сильного нагревания реакция MgO с H2O не протекает.
Способность определить то, какие оксиды могут реагировать с водой даже без умения писать соответствующие уравнения реакций, уже позволяет получить баллы за некоторые вопросы тестовой части ЕГЭ.
Теперь давайте разберемся, как же все-таки те или иные оксиды реагируют с водой, т.е. научимся писать соответствующие уравнения реакций.
Активные основные оксиды, реагируя с водой, образуют соответствующие им гидроксиды. Напомним, что соответствующим оксиду металла является такой гидроксид, который содержит металл в той же степени окисления, что и оксид. Так, например, при реакции с водой активных основных оксидов K+12O и Ba+2O образуются соответствующие им гидроксиды K+1OH и Ba+2(OH)2:
K2O + H2O = 2KOH – гидроксид калия
BaO + H2O = Ba(OH)2 – гидроксид бария
Все гидроксиды, соответствующие активным основным оксидам (оксидам ЩМ и ЩЗМ), относятся к щелочам. Щелочами называют все хорошо растворимые в воде гидроксиды металлов, а также малорастворимый гидроксид кальция Ca(OH)2 (как исключение).
Взаимодействие кислотных оксидов с водой так же, как и реакция активных основных оксидов с водой, приводит к образованию соответствующих гидроксидов. Только в случае кислотных оксидов им соответствуют не основные, а кислотные гидроксиды, чаще называемые кислородсодержащими кислотами. Напомним, что соответствующей кислотному оксиду является такая кислородсодержащая кислота, которая содержит кислотообразующий элемент в той же степени окисления, что и в оксиде.
Таким образом, если мы, например, хотим записать уравнение взаимодействия кислотного оксида SO3 с водой, прежде всего мы должны вспомнить основные, изучаемые в рамках школьной программы, серосодержащие кислоты. Таковыми являются сероводородная H2S, сернистая H2SO3 и серная H2SO4 кислоты. Cероводородная кислота H2S, как легко заметить, не является кислородсодержащей, поэтому ее образование при взаимодействии SO3 с водой можно сразу исключить. Из кислот H2SO3 и H2SO4 серу в степени окисления +6, как в оксиде SO3, содержит только серная кислота H2SO4. Поэтому именно она и будет образовываться в реакции SO3 с водой:
H2O + SO3 = H2SO4
Аналогично оксид N2O5, содержащий азот в степени окисления +5, реагируя с водой, образует азотную кислоту HNO3, но ни в коем случае не азотистую HNO2, поскольку в азотной кислоте степень окисления азота, как и в N2O5, равна +5, а в азотистой — +3:
N+52O5 + H2O = 2HN+5O3
Исключение:
Оксид азота (IV) (NO2) является оксидом неметалла в степени окисления +4, т.е. в соответствии с алгоритмом, описанным в таблице в самом начале данной главы, его нужно отнести к кислотным оксидам. Однако не существует такой кислоты, которая содержала бы азот в степени окисления +4.
В случае оксида NO2 принято считать, что ему соответствуют сразу две кислоты, поскольку его взаимодействие с водой приводит к одновременному образованию двух кислот:
2NO2 + H2O = HNO2 + HNO3
Взаимодействие оксидов друг с другом
Прежде всего нужно четко усвоить тот факт, что среди солеобразующих оксидов (кислотных, основных, амфотерных) практически никогда не протекают реакции между оксидами одного класса, т.е. в подавляющем большинстве случаев невозможно взаимодействие:
1) основный оксид + основный оксид ≠
2) кислотный оксид + кислотный оксид ≠
3) амфотерный оксид + амфотерный оксид ≠
В то время, как практически всегда возможно взаимодействие между оксидами, относящимися к разным типам, т.е. практически всегда протекают реакции между:
1) основным оксидом и кислотным оксидом;
2) амфотерным оксидом и кислотным оксидом;
3) амфотерным оксидом и основным оксидом.
В результате всех таких взаимодействий всегда продуктом является средняя (нормальная) соль.
Рассмотрим все указанные пары взаимодействий более детально.
В результате взаимодействия:
MexOy + кислотный оксид, где MexOy – оксид металла (основный или амфотерный)
образуется соль, состоящая из катиона металла Me (из исходного MexOy) и кислотного остатка кислоты, соответствующей кислотному оксиду.
Для примера попробуем записать уравнения взаимодействия следующих пар реагентов:
Na2O + P2O5 и Al2O3 + SO3
В первой паре реагентов мы видим основный оксид (Na2O) и кислотный оксид (P2O5). Во второй – амфотерный оксид (Al2O3) и кислотный оксид (SO3).
Как уже было сказано, в результате взаимодействия основного/амфотерного оксида с кислотным образуется соль, состоящая из катиона металла (из исходного основного/амфотерного оксида) и кислотного остатка кислоты, соответствующей исходному кислотному оксиду.
Таким образом, при взаимодействии Na2O и P2O5 должна образоваться соль, состоящая из катионов Na+ (из Na2O) и кислотного остатка PO43-, поскольку оксиду P+52O5 соответствует кислота H3P+5O4. Т.е. в результате такого взаимодействия образуется фосфат натрия:
3Na2O + P2O5 = 2Na3PO4 — фосфат натрия
В свою очередь, при взаимодействии Al2O3 и SO3 должна образоваться соль, состоящая из катионов Al3+ (из Al2O3) и кислотного остатка SO42-, поскольку оксиду S+6O3 соответствует кислота H2S+6O4. Таким образом, в результате данной реакции получается сульфат алюминия:
Al2O3 + 3SO3 = Al2(SO4)3 — сульфат алюминия
Более специфическим является взаимодействие между амфотерными и основными оксидами. Данные реакции осуществляют при высоких температурах, и их протекание возможно благодаря тому, что амфотерный оксид фактически берет на себя роль кислотного. В результате такого взаимодействия образуется соль специфического состава, состоящая из катиона металла, образующего исходный основный оксид и «кислотного остатка»/аниона, в состав которого входит металл из амфотерного оксида. Формулу такого «кислотного остатка»/аниона в общем виде можно записать как MeO2x—, где Me – металл из амфотерного оксида, а х = 2 в случае амфотерных оксидов с общей формулой вида Me+2O (ZnO, BeO, PbO) и x = 1 – для амфотерных оксидов с общей формулой вида Me+32O3 (например, Al2O3, Cr2O3 и Fe2O3).
Попробуем записать в качестве примера уравнения взаимодействия
ZnO + Na2O и Al2O3 + BaO
В первом случае ZnO является амфотерным оксидом с общей формулой Me+2O, а Na2O – типичный основный оксид. Согласно сказанному выше, в результате их взаимодействия должна образоваться соль, состоящая из катиона металла, образующего основный оксид, т.е. в нашем случае Na+ (из Na2O) и «кислотного остатка»/аниона c формулой ZnO22-, поскольку амфотерный оксид имеет общую формулу вида Me+2O. Таким образом, формула получаемой соли при соблюдении условия электронейтральности одной ее структурной единицы («молекулы») будет иметь вид Na2ZnO2:
ZnO + Na2O =to=> Na2ZnO2
В случае взаимодействующей пары реагентов Al2O3 и BaO первое вещество является амфотерным оксидом с общей формулой вида Me+32O3, а второе — типичным основным оксидом. В этом случае образуется соль, содержащая катион металла из основного оксида, т.е. Ba2+ (из BaO) и «кислотного остатка»/аниона AlO2—. Т.е. формула получаемой соли при соблюдении условия электронейтральности одной ее структурной единицы («молекулы») будет иметь вид Ba(AlO2)2, а само уравнение взаимодействия запишется как:
Al2O3 + BaO =to=> Ba(AlO2)2
Как мы уже писали выше, практически всегда протекает реакция:
MexOy + кислотный оксид,
где MexOy – либо основный, либо амфотерный оксид металла.
Однако следует запомнить два «привередливых» кислотных оксида – углекислый газ (CO2) и сернистый газ (SO2). «Привередливость» их заключается в том, что несмотря на явные кислотные свойства, активности CO2 и SO2 недостаточно для их взаимодействия с малоактивными основными и амфотерными оксидами. Из оксидов металлов они реагируют только с активными основными оксидами (оксидами ЩМ и ЩЗМ). Так, например, Na2O и BaO, являясь активными основными оксидами, могут с ними реагировать:
CO2 + Na2O = Na2CO3
SO2 + BaO = BaSO3
В то время, как оксиды CuO и Al2O3, не относящиеся к активным основным оксидам, в реакцию с CO2 и SO2 не вступают:
CO2 + CuO ≠
CO2 + Al2O3 ≠
SO2 + CuO ≠
SO2 + Al2O3 ≠
Взаимодействие оксидов с кислотами
С кислотами реагируют основные и амфотерные оксиды. При этом образуются соли и вода:
FeO + H2SO4 = FeSO4 + H2O
Несолеобразующие оксиды не реагируют с кислотами вообще, а кислотные оксиды не реагируют с кислотами в большинстве случаев.
Когда все-таки кислотный оксид реагирует с кислотой?
Решая часть ЕГЭ с вариантами ответа, вы должны условно считать, что кислотные оксиды не реагируют ни с кислотными оксидами, ни с кислотами, за исключением следующих случаев:
1) диоксид кремния, будучи кислотным оксидом, реагирует с плавиковой кислотой, растворяясь в ней. В частности, благодаря этой реакции в плавиковой кислоте можно растворить стекло. В случае избытка HF уравнение реакции имеет вид:
SiO2 + 6HF = H2[SiF6] + 2H2O,
а в случае недостатка HF:
SiO2 + 4HF = SiF4 + 2H2O
2) SO2, будучи кислотным оксидом, легко реагирует с сероводородной кислотой H2S по типу сопропорционирования:
S+4O2 + 2H2S-2 = 3S0 + 2H2O
3) Оксид фосфора (III) P2O3 может реагировать с кислотами-окислителями, к которым относятся концентрированная серная кислота и азотная кислота любой концентрации. При этом степень окисления фосфора повышается от значения +3 до +5:
| P2O3 | + | 2H2SO4 | + | H2O | =to=> | 2SO2 | + | 2H3PO4 |
| (конц.) |
| 3P2O3 | + | 4HNO3 | + | 7H2O | =to=> | 4NO↑ | + | 6H3PO4 |
| (разб.) |
| P2O3 | + | 4HNO3 | + | H2O | =to=> | 2H3PO4 | + | 4NO2↑ |
| (конц.) |
4) Оксид серы (IV) SO2 может быть окислен азотной кислотой, взятой в любой концентрации. При этом степень окисления серы повышается с +4 до +6.
| 2HNO3 | + | SO2 | =to=> | H2SO4 | + | 2NO2↑ |
| (конц.) |
| 2HNO3 | + | 3SO2 | + | 2H2O | =to=> | 3H2SO4 | + | 2NO↑ |
| (разб.) |
Взаимодействие оксидов с гидроксидами металлов
С гидроксидами металлов как основными, так и амфотерными реагируют кислотные оксиды. При этом образуется соль, состоящая из катиона металла (из исходного гидроксида металла) и кислотного остатка кислоты, соответствующей кислотному оксиду.
SO3 + 2NaOH = Na2SO4 + H2O
Кислотные оксиды, которым соответствуют многоосновные кислоты, с щелочами могут образовывать как нормальные, так и кислые соли:
CO2 + 2NaOH = Na2CO3 + H2O
CO2 + NaOH = NaHCO3
P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 4KOH = 2K2HPO4 + H2O
P2O5 + 2KOH + H2O = 2KH2PO4
«Привередливые» оксиды CO2 и SO2, активности которых, как уже было сказано, не хватает для протекания их реакции с малоактивными основными и амфотерными оксидами, тем не менее, реагируют с большей частью соответствующих им гидроксидов металлов. Точнее, углекислый и сернистый газы взаимодействуют с нерастворимыми гидроксидами в виде их суспензии в воде. При этом образуются только основные соли, называемые гидроксокарбонатами и гидроксосульфитами, а образование средних (нормальных) солей невозможно:
2Zn(OH)2 + CO2 = (ZnOH)2CO3 + H2O (в растворе)
2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (в растворе)
Однако с гидроксидами металлов в степени окисления +3, например, такими, как Al(OH)3, Cr(OH)3 и т.д., углекислый и сернистый газ не реагируют вовсе.
Следует отметить также особую инертность диоксида кремния (SiO2), в природе наиболее часто встречаемого в виде обычного песка. Данный оксид является кислотным, однако из гидроксидов металлов способен реагировать только с концентрированными (50-60%) растворами щелочей, а также с чистыми (твердыми) щелочами при сплавлении. При этом образуются силикаты:
2NaOH + SiO2 =to=> Na2SiO3 + H2O
Амфотерные оксиды из гидроксидов металлов реагируют только со щелочами (гидроксидами щелочных и щелочноземельных металлов). При этом при проведении реакции в водных растворах образуются растворимые комплексные соли:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] — тетрагидроксоцинкат натрия
BeO + 2NaOH + H2O = Na2[Be(OH)4] — тетрагидроксобериллат натрия
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] — тетрагидроксоалюминат натрия
А при сплавлении этих же амфотерных оксидов со щелочами получаются соли, состоящие из катиона щелочного или щелочноземельного металла и аниона вида MeO2x—, где x = 2 в случае амфотерного оксида типа Me+2O и x = 1 для амфотерного оксида вида Me2+2O3:
ZnO + 2NaOH =to=> Na2ZnO2 + H2O
BeO + 2NaOH =to=> Na2BeO2 + H2O
Al2O3 + 2NaOH =to=> 2NaAlO2 + H2O
Cr2O3 + 2NaOH =to=> 2NaCrO2 + H2O
Fe2O3 + 2NaOH =to=> 2NaFeO2 + H2O
Следует отметить, что соли, получаемые сплавлением амфотерных оксидов с твердыми щелочами, могут быть легко получены из растворов соответствующих комплексных солей их упариванием и последующим прокаливанием:
Na2[Zn(OH)4] =to=> Na2ZnO2 + 2H2O
Na[Al(OH)4] =to=> NaAlO2 + 2H2O
Взаимодействие оксидов со средними солями
Чаще всего средние соли с оксидами не реагируют.
Однако следует выучить следующие исключения из данного правила, часто встречающиеся на экзамене.
Одним из таких исключений является то, что амфотерные оксиды, а также диоксид кремния (SiO2) при их сплавлении с сульфитами и карбонатами вытесняют из последних сернистый (SO2) и углекислый (CO2) газы соответственно. Например:
Al2O3 + Na2CO3 =to=> 2NaAlO2 + CO2
SiO2 + K2SO3 =to=> K2SiO3 + SO2
Также к реакциям оксидов с солями можно условно отнести взаимодействие сернистого и углекислого газов с водными растворами или взвесями соответствующих солей — сульфитов и карбонатов, приводящее к образованию кислых солей:
Na2CO3 + CO2 + H2O = 2NaHCO3
CaCO3 + CO2 + H2O = Ca(HCO3)2
Также сернистый газ при пропускании его через водные растворы или взвеси карбонатов вытесняет из них углекислый газ благодаря тому, что сернистая кислота является более сильной и устойчивой кислотой, чем угольная:
K2СO3 + SO2 = K2SO3 + CO2
ОВР с участием оксидов
Восстановление оксидов металлов и неметаллов
Аналогично тому, как металлы могут реагировать с растворами солей менее активных металлов, вытесняя последние в свободном виде, оксиды металлов при нагревании также способны реагировать с более активными металлами.
Напомним, что сравнить активность металлов можно либо используя ряд активности металлов, либо, если одного или сразу двух металлов нет в ряду активности, по их положению относительно друг друга в таблице Менделеева: чем ниже и левее металл, тем он более активен. Также полезно помнить, что любой металл из семейства ЩМ и ЩЗМ будет всегда активнее металла, не являющегося представителем ЩМ или ЩЗМ.
В частности, на взаимодействии металла с оксидом менее активного металла основан метод алюмотермии, используемый в промышленности для получения таких трудновосстанавливаемых металлов, как хром и ванадий:
Cr2O3 + 2Al =to=> Al2O3 + 2Cr
При протекании процесса алюмотермии образуется колоссальное количество тепла, а температура реакционной смеси может достигать более 2000oC.
Также оксиды практически всех металлов, находящихся в ряду активности правее алюминия, могут быть восстановлены до свободных металлов водородом (H2), углеродом (C) и угарным газом (CO) при нагревании. Например:
Fe2O3 + 3CO =to=> 2Fe + 3CO2
CuO + C =to=> Cu + CO
FeO + H2 =to=> Fe + H2O
Следует отметить, что в случае, если металл может иметь несколько степеней окисления, при недостатке используемого восстановителя возможно также неполное восстановление оксидов. Например:
Fe2O3 + CO =to=> 2FeO + CO2
4CuO + C =to=> 2Cu2O + CO2
Оксиды активных металлов (щелочных, щелочноземельных, магния и алюминия) с водородом и угарным газом не реагируют.
Однако оксиды активных металлов реагируют с углеродом, но иначе, чем оксиды менее активных металлов.
В рамках программы ЕГЭ, чтобы не путаться, следует считать, что в результате реакции оксидов активных металлов (до Al включительно) с углеродом образование свободного ЩМ, ЩЗМ, Mg, а также Al невозможно. В таких случаях происходит образование карбида металла и угарного газа. Например:
2Al2O3 + 9C =to=> Al4C3 + 6CO
CaO + 3C =to=> CaC2 + CO
Оксиды неметаллов нередко могут быть восстановлены металлами до свободных неметаллов. Так, например, оксиды углерода и кремния при нагревании реагируют с щелочными, щелочноземельными металлами и магнием:
CO2 + 2Mg =to=> 2MgO + C
SiO2 + 2Mg =to=> Si + 2MgO
При избытке магния последнее взаимодействие может приводить также к образованию силицида магния Mg2Si:
SiO2 + 4Mg =to=> Mg2Si + 2MgO
Оксиды азота могут быть относительно легко восстановлены даже менее активными металлами, например, цинком или медью:
Zn + 2NO =to=> ZnO + N2
2NO2 + 4Cu =to=> 4CuO + N2
Взаимодействие оксидов с кислородом
Для того чтобы в заданиях реального ЕГЭ суметь ответить на вопрос, реагирует ли какой-либо оксид с кислородом (O2), прежде всего нужно запомнить, что оксиды, способные реагировать с кислородом (из тех, что могут попасться вам на самом экзамене) могут образовать только химические элементы из списка:
углерод С, кремний Si, фосфор P, сера S, медь Cu, марганец Mn, железо Fe, хром Cr, азот N
Встречающиеся в реальном ЕГЭ оксиды любых других химических элементов с кислородом реагировать не будут (!).
Для более наглядного удобного запоминания перечисленных выше списка элементов, на мой взгляд, удобна следующая иллюстрация:
В первую очередь, среди перечисленных элементов следует рассмотреть азот N, т.к. отношение его оксидов к кислороду заметно отличается от оксидов остальных элементов приведенного выше списка.
Следует четко запомнить тот факт, что всего азот способен образовать пять оксидов, а именно:
Из всех оксидов азота с кислородом может реагировать только NO. Данная реакция протекает очень легко при смешении NO как с чистым кислородом, так и с воздухом. При этом наблюдается быстрое изменение окраски газа с бесцветной (NO) на бурую (NO2):
| 2NO | + | O2 | = | 2NO2 |
| бесцветный | бурый |
Для того чтобы дать ответ на вопрос — реагирует ли с кислородом какой-либо оксид любого другого из перечисленных выше химических элементов (т.е. С, Si, P, S, Cu, Mn, Fe, Cr) — прежде всего обязательно нужно запомнить их основные степени окисления (СО). Вот они:
| элемент | С | Si | P | S | Cu | Cr | Mn | Fe |
| его основные положительные СО | +2, +4 | +2, +4 | +3, +5 | +4, +6 | +1, +2 | +2, +3, +6 | +2, +4, +6, +7 | +2, +3, +6 |
Далее нужно запомнить тот факт, что из возможных оксидов указанных выше химических элементов, с кислородом будут реагировать только те, которые содержат элемент в минимальной, среди указанных выше, степени окисления. При этом степень окисления элемента повышается до ближайшего положительного значения из возможных:
| элемент |
Отношение его оксидов к кислороду |
| С |
Минимальная среди основных положительных степеней окисления углерода равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из оксидов C+2O и C+4O2 реагирует только CO. При этом протекает реакция: 2C+2O + O2 =to=> 2C+4O2 CO2 + O2 ≠ — реакция невозможна в принципе, т.к. +4 – высшая степень окисления углерода. |
| Si |
Минимальная среди основных положительных степеней окисления кремния равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из оксидов Si+2O и Si+4O2 реагирует только SiO. Из-за некоторых особенностей оксидов SiO и SiO2 возможно окисление лишь части атомов кремния в оксиде Si+2O. Т.е. в результате его взаимодействия с кислородом, образуется смешанный оксид, содержащий как кремний в степени окисления +2, так и кремний в степени окисления +4, а именно Si2O3 (Si+2O·Si+4O2): 4Si+2O + O2 =to=> 2Si+2,+42O3 (Si+2O·Si+4O2) SiO2 + O2 ≠ — реакция невозможна в принципе, т.к. +4 – высшая степень окисления кремния. |
| P |
Минимальная среди основных положительных степеней окисления фосфора равна +3, а ближайшая к нему положительная — +5. Таким образом, с кислородом из оксидов P+32O3 и P+52O5 реагирует только P2O3. При этом протекает реакция доокисления фосфора кислородом от степени окисления +3 до степени окисления +5: P+32O3 + O2 =to=> P+52O5 P+52O5 + O2 ≠ — реакция невозможна в принципе, т.к. +5 – высшая степень окисления фосфора. |
| S |
Минимальная среди основных положительных степеней окисления серы равна +4, а ближайшая к ней по значению положительная — +6. Таким образом, с кислородом из оксидов S+4O2, S+6O3 реагирует только SO2. При этом протекает реакция: 2S+4O2 + O2 =to=> 2S+6O3 2S+6O3 + O2 ≠ — реакция невозможна в принципе, т.к. +6 – высшая степень окисления серы. |
| Cu |
Минимальная среди положительных степеней окисления меди равна +1, а ближайшая к ней по значению — положительная (и единственная) +2. Таким образом, с кислородом из оксидов Cu+12O, Cu+2O реагирует только Cu2O. При этом протекает реакция: 2Cu+12O + O2 =to=> 4Cu+2O CuO + O2 ≠ — реакция невозможна в принципе, т.к. +2 – высшая степень окисления меди. |
| Cr |
Минимальная среди основных положительных степеней окисления хрома равна +2, а ближайшая к ней по значению положительная равна +3. Таким образом, с кислородом из оксидов Cr+2O, Cr+32O3 и Cr+6O3 реагирует только CrO, при этом окисляясь кислородом до соседней (из возможных) положительной степени окисления, т.е. +3: 4Cr+2O + O2 =to=> 2Cr+32O3 Cr+32O3 + O2 ≠ — реакция не протекает, несмотря на то что существует оксид хрома и в большей, чем +3, степени окисления (Cr+6O3). Невозможность протекания данной реакции связана с тем, что требуемый для ее гипотетического осуществления нагрев сильно превышает температуру разложения оксида CrO3. Cr+6O3 + O2 ≠ — данная реакция не может протекать в принципе, т.к. +6 – высшая степень окисления хрома. |
| Mn |
Минимальная среди основных положительных степеней окисления марганца равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из возможных оксидов Mn+2O, Mn+4O2, Mn+6O3 и Mn+72O7 реагирует только MnO, при этом окисляясь кислородом до соседней (из возможных) положительной степени окисления, т.е. +4: 2Mn+2O + O2 =to=> 2Mn+4O2 в то время, как: Mn+4O2 + O2 ≠ и Mn+6O3 + O2 ≠ — реакции не протекают, несмотря на то что существует оксид марганца Mn2O7, содержащий Mn в большей, чем +4 и +6, степени окисления. Связанно это с тем, что требуемый для дальнейшего гипотетического окисления оксидов Mn+4O2 и Mn+6O3 нагрев существенно превышает температуру разложения получаемых оксидов MnO3 и Mn2O7. Mn+72O7 + O2 ≠ — данная реакция невозможна в принципе, т.к. +7 – высшая степень окисления марганца. |
| Fe |
Минимальная среди основных положительных степеней окисления железа равна +2, а ближайшая к ней среди возможных — +3. Несмотря на то что для железа существует степень окисления +6, кислотного оксида FeO3, впрочем, как и соответствующей ему «железной» кислоты не существует. Таким образом, из оксидов железа с кислородом могут реагировать только те оксиды, которые содержат Fe в степени окисления +2. Это либо оксид Fe+2O, либо смешанный оксид железа Fe+2,+33O4 (железная окалина): 4Fe+2O + O2 =to=> 2Fe+32O3 или 6Fe+2O + O2 =to=> 2Fe+2,+33O4 смешанный оксид Fe+2,+33O4 может быть доокислен до Fe+32O3: 4Fe+2,+33O4 + O2 =to=> 6Fe+32O3 Fe+32O3 + O2≠ — протекание данной реакции невозможно в принципе, т.к. оксидов, содержащих железо в степени окисления выше, чем +3, не существует. |
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления –2. Лишь один химический элемент — фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Классификация оксидов, которую мы ещё раз с вами повторим:
- основные: металл в степени окисления +1 и +2;
- амфотерные: металл в степени окисления +3 и +4. Исключения: ZnO, BeO, SnO, PbO;
- кислотные: все неметаллы и металлы в степенях окисления +5, +6 и +7;
- несолеобразующие: NO, N2O, CO, SiO.
Физические свойства оксидов.
- По агрегатному состоянию оксиды делятся на три группы: твердые (K2O, Al2O3, P2O5), жидкие (SO3, Mn2O7), и газообразные (CO2, NO2, SO2).
- По растворимости в воде оксиды делятся на растворимые (SO2, CO2, K2O) и нерастворимые (CuO, FeO, SiO2, Al2O3). Все кислотные оксиды, кроме SiO2, растворимы в воде. Среди основных оксидо растворимыми являются только оксиды щелочных металлов и щелочноземельных металлов. Амфотерные оксиды не растворяются в воде.
Химические свойства основных оксидов
1. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием щелочей:
Оксид + H2O = Щелочь;
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
2. Общим свойством всех основных оксидов является их способность взаимодействовать с кислотами с образованием соли и воды:
Оксид + кислота = соль + H2O
CaO + H2SO4 = CaSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
3. Основные оксиды взаимодействуют с кислотными оксидами с образованием солей:
Основные оксид + кислотный оксид = Соль
3СaO + P2O5 = Ca3(PO4)2
BaO + CO2 = BaCO3
Химические свойства кислотных оксидов
1. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты:
Кислотный оксид + H2O = кислота
P2O5 + 3H2O = 2H3PO4
N2O5 + H2O = 2HNO3
2. Общим свойством всех кислотных оксидов является их способность взаимодействовать с овнованиями с образованием соли и воды:
кислотный оксид + основание = соль + H2O
P2O5 + 6NaOH = 2Na3PO4 + 6H2O
SO2 + Ca(OH)2 = CaSO3 + H2O
3. Кислотные оксиды взаимодействую с основными оксидами с образованием солей (при нагревании)
Ксилотный оксид + основные оксид = соль;
3CaO + P2O5 = Ca3(PO4)2
CrO3 + CaO = CaCrO4
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды — проявляют свойства основных оксидов.
Амфотерный оксид + кислота = соль + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2. Амфотерные оксиды взаимодействуют со щелочами с образованием солей и воды — проявляют свойства ксилотных оксидов.
Амфотерный оксид + щелочь = соль + H2O
ZnO + KOH = K2ZnO2 + H2O
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей.
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей.
Амфотерный оксид + основный оксид = соль
ZnO + Na2O = Na2ZnO2
Получение оксидов
1. Взаимодействие простых веществ с кислородом:
Металл или неметалл + O2 = Оксид
2. Разложение некоторых оксокислот:
Оксокислота = кислотный оксид + H2O
3. Разложение нерастворимых основний:
Нерастворимое основание = основный оксид + H2O;
4. Разложение некоторых солей:
Соль = основный оксид + кислотный оксид
Свойства основных оксидов
Материал по химии
- Основные оксиды с водой
- Основные оксиды с кислотными оксидами.
- Основные оксиды с кислотами.
- Основные оксиды с амфотерными оксидами
- Основные оксиды с CO, C, H2
- Основные оксиды с металлами
- Тренировка по свойствам основных оксидов
Основными оксидами называют оксиды металлов, в которых металл проявляет I или II валентность, например, CaO, MgO, FeO, Na2O, K2O (есть исключения: ZnO и BeO являются амфотерными – эти исключения нужно знать обязательно, они часто встречаются на ЕГЭ по химии. Есть и другие исключения, о которых мы не будем говорить, так как они не встречаются на ЕГЭ по химии).
Дальнейшие химические свойства основного оксида зависят от его состава, то есть от металла, который в этот оксид входит. Так, оксиды, образованные активными металлами (находятся в IА-группе ПС, к этой группе еще относят кальций, стронций и барий) растворяются в воде, но не взаимодействуют с типичными восстановителями – H2, C и CO, а оксиды переходных металлов (металлов B-подгрупп) – ровно наоборот.
Химические свойства основных оксидов можно записать в виде таблицы:
Таблица – химические свойства основных оксидов
|
Основные оксиды очень активных металлов (Li, Na, K, Rb, Cs, Fr, Ca, Sr, Ba) |
Основные оксиды остальных металлов (Mg, Cr, Fe) |
|
Растворимы в воде, при взаимодействии с ней образуют едкие основные гидроксиды — щелочи |
Не растворимы в воде и не реагируют с ней |
|
Реагируют с кислотными оксидами, образуя соль |
Реагируют с кислотными оксидами, образуя соль |
|
Реагируют с кислотами, образуя соль и воду |
Реагируют с кислотами, образуя соль и воду |
|
Реагируют с амфотерными оксидами |
Не реагируют с амфотерными оксидами |
|
Не восстанавливаются с помощью H2, C, CO |
Если образованны переходными металлами (металлами побочных подгрупп), то восстанавливаются с помощью H2, C, CO |
|
Реагируют с более активными металлами (если свободный металл стоит левее, чем металл в оксиде) |
Реагируют с более активными металлами (если свободный металл стоит левее, чем металл в оксиде) |
Основные оксиды с водой
Как было сказано выше, основные оксиды очень активных металлов реагируют с водой с образованием растворов щелочей (в скобках даны некоторые тривиальные названия, так как они встречаются на ЕГЭ и в сборниках Добротина и Доронькина):
K2O + H2O → 2KOH (тривиальное названия гидроксида калия – едкое кали)
Na2O + H2O → 2NaOH (тривиальное название гидроксида натрия – едкий натр)
Cs2O + H2O → 2CsOH
CaO + H2O → Ca(OH)2 (негашеная известь CaO превращается в гашеную известь – Ca(OH)2)
BaO + H2O → Ba(OH)2 (концентрированный раствор гидроксида бария называют баритовой водой)
Реакции растворения основного оксида экзотермические, то есть выделяют много теплоты, поэтому следует обращаться с такими основными оксидами очень аккуратно.
Основные оксиды с кислотными оксидами.
Общее уравнение взаимодействия основных и кислотных оксидов можно описать следующим выражением:
Основный оксид + кислотный оксид → соль
Это реакции соединения.
Например:
K2O + N2O5 → 2KNO3
CaO + SO3 → CaSO4
3Na2O + P2O5 → 2Na3PO4
Как понять, какую соль писать в продуктах? Самый простой способ – сложение, при котором на первом месте всегда будет металл, на втором – неметалл, в конце молекулы кислород, например:
Na2O + SiO2 → Na2SiO3 – силикат натрия получен сложением всех исходных элементов с учётом их индексов. Это самый простой метод, но он не всегда хорошо работает, в материале о кислотных оксидах мы подробно рассказали о самых удобных методах образования соли из оксидов: https://onlineclass.space/материал/химия/28/
Основные оксиды с кислотами.
При взаимодействии основного оксида с кислотой образуется соль и вода. Это реакции обмена. Понять, что за соль образуется в таких реакциях гораздо легче: она состоит из катиона металла (из основного оксида) и остатка кислоты (остаток кислоты – это то, что остается, если от неё отщепить все имеющиеся протоны водорода, например, остатком азотной кислоты — HNO3 будет нитрат-ион NO3‒, а остатком серной кислоты — H2SO4 является сульфат-ион SO42‒).
K2O + 2HNO3 → 2KNO3 + H2O
CuO + H2SO4 → CuSO4 + H2O
FeO + 2HCl → FeCl2 + H2O
Основные оксиды с амфотерными оксидами
При взаимодействии основного оксида, образованного активными металлами, с амфотерными оксидами образуется соль:
Na2O + Al2O3 → NaAlO2
K2O + ZnO → K2ZnO3
BaO + BeO → BaBeO2
Подробнее об этой теме Вы можете прочитать в материале:
https://onlineclass.space/материал/химия/30/
Основные оксиды с CO, C, H2
Оксиды переходных металлов реагируют с восстановителями до образования металла:
FeO + H2 → Fe + H2O
MnO + C → Mn + CO
CuO + CO → Cu + CO2
Основные оксиды с металлами
Более активные металлы вытесняют менее активные металлы из их оксидов. Чтобы определить, какой металл активнее, пользуются рядом активности металлов (электрохимический ряд напряжений): чем правее в нем стоит металл, тем он слабее.
Тренировка по свойствам основных оксидов
Для тренировки решите несколько заданий в формате ОГЭ и ЕГЭ по химии.
Задание 1
Задание в формате ЕГЭ с ответом:
Какие из перечисленных оксидов реагируют с водой?
- NiO
- Cs2O
- CuO
- SrO
- MgO
- K2O
Задание 2
Пример задания из КИМ ЕГЭ:
Какие из перечисленных оксидов реагируют с амфотерными оксидами?
- FeO
- Na2O
- CaO
- BaO
- MgO
- MnO
Задание 3
Задание по образцу ФИПИ:
Какие из перечисленных оксидов реагируют с H<sub>2</sub>?
- CuO
- BaO
- Na2O
- FeO
- CaO
- CrO
Задание 4
Попробуйте решить задание ЕГЭ:
C какими из перечисленных оксидов может взаимодействовать железо?
- K2O
- ZnO
- CuO
- MgO
- NiO
- Ag2O
Задание 5
C какими из перечисленных веществ реагирует Na2O?
- Ba(OH) 2
- Al2O3
- Fe
- H2O
- NH4NO3
- HClO4
Задание 6
С какими из перечисленных веществ реагирует FeO?
- C
- NaBr
- H2O
- ZnO
- Zn
- H2
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Из предложенного перечня выберите два оксида, которые реагируют с раствором соляной кислоты, но не реагируют с раствором гидроксида натрия.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: Демонстрационная версия ЕГЭ—2017 по химии
2
Из предложенного перечня выберите два вещества, которые реагируют как с оксидом серы(VI), так и с оксидом серы(IV).
1) гидроксид калия
2) соляная кислота
3) оксид кремния (IV)
4) оксид натрия
5) кислород
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
3
Из предложенного перечня выберите два оксида, которые реагируют как с , так и с
.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
4
Из предложенного перечня выберите два вещества, которые не реагируют с оксидом меди (II).
1) кислород
2) серная кислота
3) алюминий
4) водород
5) вода
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
5
Из предложенного перечня выберите два оксида, которые могут реагировать с кислородом.
1) оксид цинка
2) оксид углерода (II)
3) оксид железа (III)
4) оксид серы (IV)
5) оксид серы (VI)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Пройти тестирование по этим заданиям