ФИЗИЧЕСКАЯ ХИМИЯ
Химическая термодинамика
Внутренняя энергия системы. Теплота и работа. Первое начало термодинамики. Закон Гесса. Тепловой эффект реакции.
Внутренняя энергия системы (экстенсивное свойство).
Внутренняя энергия системы — энергия движения и взаимодействия частиц, из которых состоит тело (совокупность всех видов энергии частиц в системе).
Внутренняя энергия тела не зависит от положения тела относительно других тел и от скорости движения тела, от природы в-ва, его массы и параметров состояния сис-мы.
Внутренняя энергия слагается:
— из энергии хаотического движения молекул;
— из потенциальной энергии атомов, образующих молекулу или кристаллическую структуру;
— из внутриатомной энергии и т.д.
Внутренняя энергия тела может проявляться в форме теплоты или в форме работы, совершаемой телом.
Совокупность физических тел, изолированную от взаимодействия с другими телами, называют изолированной термодинамической системой. Состояние системы описывается с помощью параметров системы . К параметрам относятся объем V, температура Т. давление р, а также электрическая поляризация, намагниченность и др. При взаимодействии системы с внешними телами ее параметры изменяются. Уравнение, которое связывает между собой объем, температуру и давление называют уравнением состояния f = (p, V, T)=0. Внутренняя энергия тела складывается из кинетической энергии хаотичного теплового движения составляющих его частей (атомов или молекул) и потенциальнойэнергии их взаимодействия. Кинетическая и потенциальная энергия тела, как целого , во внутреннюю энергию не входит.
Теплота и работа.
Внутренняя энергия идеального газа определяется формулой
где i- число степеней свободы молекулы.
Теплота – это форма передачи энергии от одной части системы к другой. Мера – количество теплоты. Теплота связана с процессом, а не с состоянием системы и не является функцией состояния, зависит от пути процесса.
Первый способ передачи энергии (обмен энергии в виде тепла) реализуется при непосредственном контакте тел, имеющих различную температуру, путём обмена кинетической энергией между молекулами соприкасающихся тел. При этом энергия передаётся от более нагретого тела к менее нагретому, т.е. от тела, имеющего большую среднюю кинетическую энергию молекул, к телу с меньшей кинетической энергией молекул. Поскольку передача энергии этим способом происходит на молекулярном уровне, без видимого движения тел, то её называют микрофизической формой передачи энергии. Количество энергии, переданной первым способом от одного тела к другому, называют количеством теплоты, или просто теплотой.
Второй способ – Обмен энергией м/у сис-мой и внешней средой обуславливается работой, совершаемой системой или над системой.Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объём под действием внешнего давления. Иначе говоря, в этом случае передача энергии происходит при условии перемещения всего тела или его части в пространстве. Поэтому второй способ будет макроскопической формой передачи энергии. Этот способ называется передачей энергии в форме работы, а количество переданной энергии в процессе — работой.
В общем случае передача энергии в форме теплоты и в форме работы может происходить одновременно. При этом важно отметить, что в различных термодинамических процессах, в зависимости от условий их протекания, количество теплоты и работы будет также различно.
Следовательно, теплота и работа являются функциями процесса, а не состояния.
Энтальпия (Н) — термодинамическая функция, являющаяся функцией состояния как и внутренняя энергия (U). Ее величина определяется из простого соотношения:
Н = U + pV, (1.5)
где р — давление;
V — объем системы.
При рассмотрении процессов, происходящих в изохорических условиях удобно пользоваться внутренней энергией, а при рассмотрении изобарных процессов — энтальпией.
Подготовка к экзамену по физической химии
ФАЗОВОЕ РАВНОВЕСИЕ В ДВУХКОМПОНЕНТНЫХ СИСТЕМАХ – ДИАГРАММЫ ПЛАВКОСТИ
1.Понятие «изоморфизм» («неограниченный изоморфизм»), условия неограниченного изоморфизма. T-x-диаграмма плавкости изоморфной бинарной системы – фазовые поля, линии и особые точки, применение правила фаз Гиббса и правила рычага (проиллюстрируйте на примере).
Изоморфизм — близкое подобие структуры и химической связи двух веществ, при котором они образуют взаимные твёрдые растворы замещения в широком интервале концентраций. В пределе, когда твёрдые растворы замещения образуются при любом соотношении компонентов (т.наз. «неограниченный ряд твёрдых растворов») говорят о «полном» или «неограниченном» изоморфизме.
Условия неограниченного изоморфизма двух веществ:
—Один и тот же тип кристаллической структуры;
—Один и тот же тип химической связи;
—Параметры кристаллической решетки различаются не более чем на 10-15%
Пример изоморфной системы – система NaCl – AgCl (твёрдый раствор замещения с формулой Na1-xAgxCl, где параметр x может принимать любые значения на отрезке от 0 до 1).
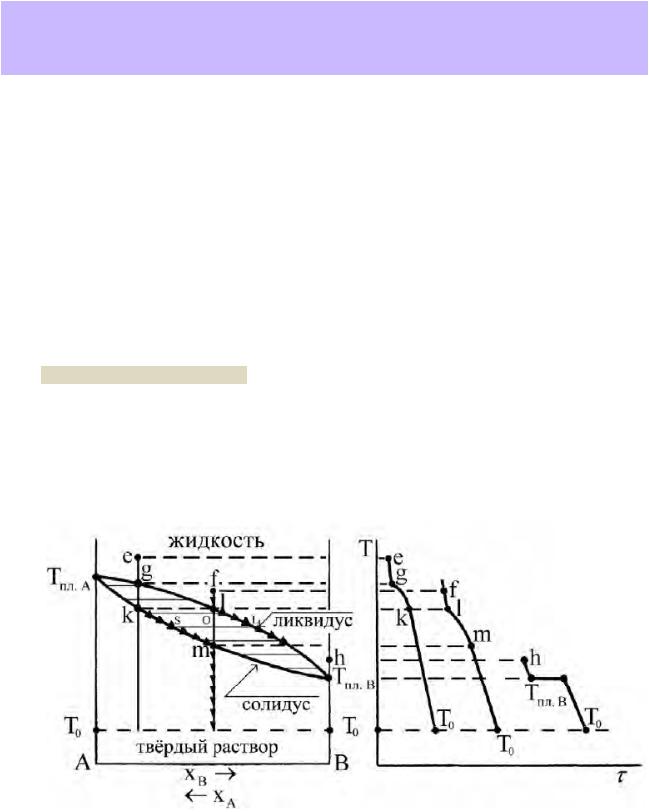
Диаграмма плавкости изоморфной системы NaCl – AgCl имеет наиболее простой вид (справочник, рис. 28.6, с.38). На ней мы видим две линии, сходящиеся в точках температур плавления чистых компонентов на боковых осях ординат. Над верхней линией область существования фазы жидкого раствора – расплава. При смещении координатного окна вверх по оси температур область жидкости не простирается безгранично – при p = const может быть достигнуто начало кипения. Под нижней линией расположена область фазы твёрдого раствора Na1-xAgxCl. Между линиями – гетерогенная двухфазная область равновесия насыщенных твёрдого и жидкого растворов (кристаллов и расплава).
Линия ликвидус – геометрическое место точек диаграммы, выражающих состояние насыщенного жидкого раствора, находящегося в равновесии с твёрдым раствором.
Линия солидус – геометрическое место точек диаграммы, выражающих состояние насыщенного твёрдого раствора, находящегося в равновесии с жидким раствором.
Линия сольвус – геометрическое место точек диаграммы, выражающих состояние насыщенного твёрдого раствора, находящегося в равновесии с другим твёрдым раствором.
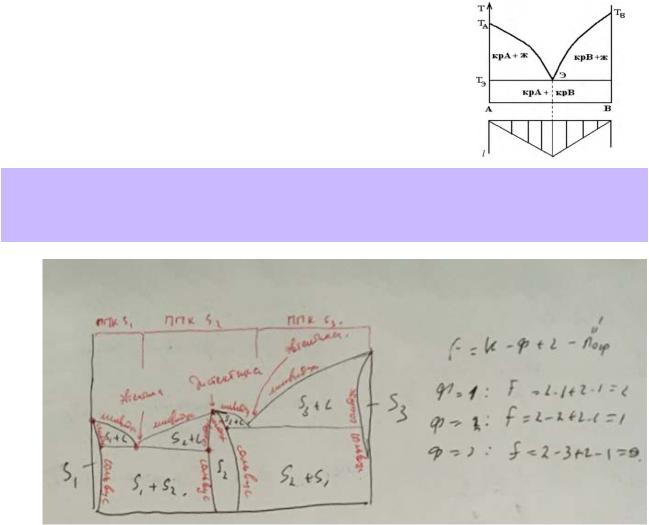
Правило фаз Гиббса: число степеней свободы f (вариантность состояния) равновесной термодинамической системы, на которую из внешних факторов влияют только p и T, равно числу независимых компонентов минус число фаз плюс два.
При наложении ограничений на параметры состояния (запрещающих их изменение) число степеней свободы уменьшается на количество ограничений:
Правило рычага: отношение чисел моль компонентов в двух равновесных фазах системы равно отношению длин противолежащих (по отношению к точкам фаз) отрезков, на которые делит конноду точка общего состава системы.
2.T-x-диаграммы плавкости бинарных систем: возможные фазовые равновесия и их выражение на диаграмме, применение правила фаз Гиббса. Шесть основных классов трёхфазных равновесий с участием твёрдых и жидких фаз (наименования, схемы).
(см. вопрос 1)
3.Эвтектическое равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите эвтектическое равновесие на диаграммах, приведённых в справочнике (2 – 3 примера), дайте необходимые пояснения.
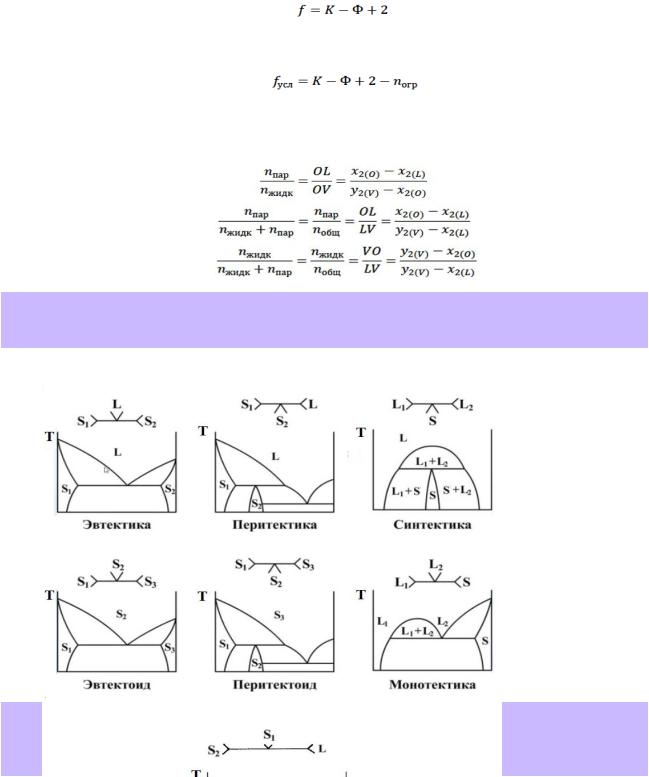
Эвтектическим равновесием (эвтектикой) в двухкомпонентной системе называется равновесие трёх фаз: двух твёрдых и одной жидкой, при нарушении которого жидкость всегда исчезает с понижением температуры.
(см. вопрос 2)
Фазовая реакция: S1+S2 L; число степеней свободы: f = 3 — Ф

Примеры: системы Al-Si — справочник стр.41 рис. 28.14
4.Перитектическое равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите перитектическое равновесие на диаграммах, приведённых в справочнике (2 – 3 примера), дайте необходимые пояснения.
Перитектическим равновесием (перитектикой) в двухкомпонентной системе называется равновесие трёх фаз: двух твёрдых и одной жидкой, при нарушении которого одна из твёрдых фаз всегда исчезает с повышением температуры.
(см. вопрос 2)
Фазовая реакция: L+S2 S1; число степеней свободы: f = 3 — Ф Примеры: системы Hg-Cd — справочник стр.41 рис. 28.13
5.Монотектическое равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите монотектическое равновесие на диаграммах, приведённых в справочнике, дайте необходимые пояснения.
Монотектика — равновесие жидкой фазы на основе одного компонента с твёрдой и жидкой фазой на основе другого компонента.
(см. вопрос 2)
Фазовая реакция: L1+S L2; число степеней свободы: f = 3 — Ф Примеры: системы Co-Bi — справочник стр.41 рис. 28.15
6.Синтектическое равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите пример синтектического равновесия на диаграмме, дайте необходимые пояснения.
Синтектика — равновесие двух жидких и твёрдой фазы (см. вопрос 2)
Фазовая реакция: S L1+L2; число степеней свободы: f = 3 — Ф Примеры: системы Na-Zn (нет в справочнике)
7.Эвтектоидное равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите пример эвтектоидного равновесия на диаграмме, дайте необходимые пояснения.
Превращение, подобное эвтектическому, происходящее путем распада твердого раствора на смесь из двух фаз называется эвтектоидным.
(см. вопрос 2)
Фазовая реакция: S1+S3 S2; число степеней свободы: f = 3 — Ф Примеры: системы Fe-C (нет в справочнике)
8.Перитектоидное равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите пример перитектоидного равновесия на диаграмме, дайте необходимые пояснения.
Превращение, подобное перетектическому, заключающиеся во взаимодействии двух твердых фаз и образовании новой твердой фазы, называется перитектоидным
(см. вопрос 2)
Фазовая реакция: S3+S2 S1; число степеней свободы: f = 3 — Ф Примеры: системы Ag-Al (нет в справочнике)
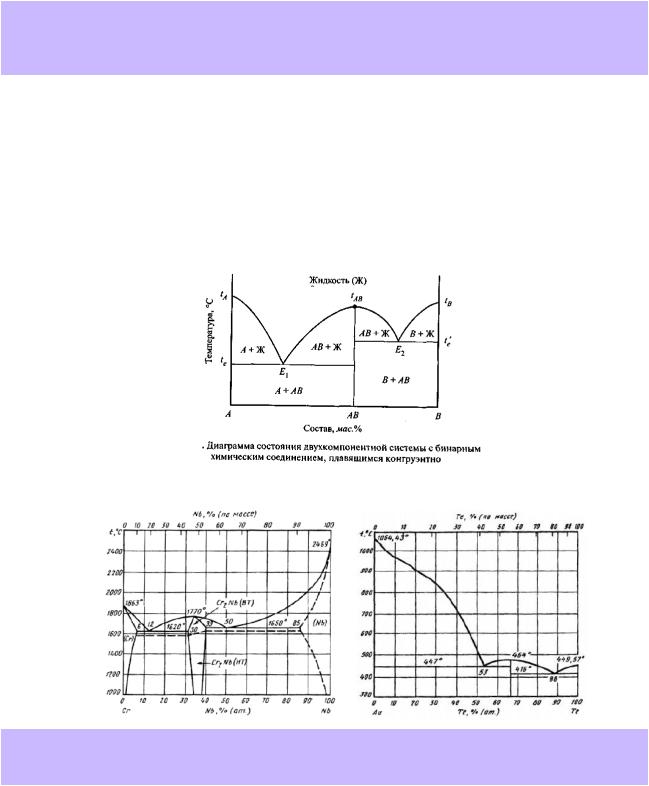
9.T-x-диаграмма плавкости бинарной системы с устойчивым химическим соединением, плавящимся конгруэнтно. Понятие конгруэнтного фазового превращения. Дистектическая точка (дистектика), её положение на диаграмме. Определение химической формулы устойчивого соединения (покажите на примере из справочника).
Устойчивым, плавящимся конгруэнтно называется химическое соединение, область гомогенности которого имеет точку конгруэнтного плавления (т. наз. дистектическую точку или дистектику). Это точка максимума на соприкасающихся линиях солидус и ликвидус, в которой процесс плавления протекает конгруэнтно – без изменения состава. В этой точке система подчиняется второму закону Гиббса-Коновалова: соприкасающиеся линии ликвидус и солидус имеют общую горизонтальную
касательную.
Это можно видеть на примере изоморфной системы LiCl-NaCl (справочник, рис.28.10, с.39)
Ещё примеры:
10.T-x-диаграмма плавкости бинарной системы с неустойчивым химическим соединением, плавящимся инконгруэнтно. Определение химической формулы соединения. Дайте необходимые пояснения на примере подходящей диаграммы из справочника.
Неустойчивым, плавящимся инконгруэнтно называется химическое соединение, область гомогенности которого не имеет точки конгруэнтного плавления. Фазы таких соединений при нагревании разлагаются, чаще всего, по перитектической реакции. В таких случаях верхняя точка области гомогенности фазы соединения лежит на перитектической конноде. Плавление таких соединений всегда протекает инконгруэнтно (не конгруэнтно): состав плавящейся твёрдой фазы отличается от состава образующейся жидкости.
Примером системы с неустойчивым химическим соединением, плавящимся инконгруэнтно, может служить система CsI – InI3 (рис. 17.6). В ней образуется узкая фаза

неустойчивого соединения Cs3InI6, разлагающаяся при нагревании по перитектической реакции на жидкий расплав и твёрдую фазу CsI.
11.Правило рычага – формулировка, вывод, применение. Проиллюстрируйте применение правила рычага на примере диаграммы плавкости бинарной системы (диаграмму выберите в справочнике).
Правило рычага: отношение чисел моль компонентов в двух равновесных фазах системы равно отношению длин противолежащих (по отношению к точкам фаз) отрезков, на которые делит конноду точка общего состава системы.
Правило рычага представляет собой следствие материального баланса системы и действует для любых двухфазных областей плоских диаграмм
Вывод правила рычага на примере равновесия «жидкость-пар»:
Суммарные количества моль компонентов в двух равновесных фазах системы при известных общем составе и составах фаз можно найти при помощи правила рычага
12.Уравнение Шредера (в интегральной форме), условия его применимости. Кривые свободного (спонтанного) охлаждения, их ход в случаях, когда из двухкомпонентного расплава кристаллизуется одна твёрдая фаза или две твёрдые фазы одновременно. Треугольник Таммана.
Уравнение Шредера:
Условия применимости уравнения Шредера:
1.В твердой фазе практически чистое вещество aS=xS=1
2.Поведение компонента в жидкой фазе то же, что и в идеальном растворе aL=xL
3.DплH = const в широком интервале температур
Простейший вариант термического анализа — кривые хода температуры во времени при свободном охлаждении образца после отключения нагревателя (кривые охлаждения). Процесс кристаллизации твердой фазы из жидкого расплава сопровождается выделением теплоты. При свободном охлаждении системы выделяющаяся в ней теплота кристаллизации частично или полностью компенсирует теплоотвод в окружающую среду. При этом на линиях зависимости температуры от времени возникают участки с пониженной скоростью охлаждения или даже температурные остановки.
Общие принципы анализа кривых свободного охлаждения
1.При свободном изобарном охлаждении однофазной системы (жидкого расплава или твёрдого раствора) система бивариантна, никаких эффектов на кривой охлаждения не наблюдается. Скорость охлаждения пропорциональна разности температур системы и окружающей среды и на начальном этапе охлаждения расплава может быть
довольно высокой.
2.В момент начала кристаллизации и в процессе кристаллизации одной твердой фазы из расплава система моновариантна. Скорость охлаждения уменьшается, снижается наклон кривой охлаждения к оси абсцисс. Это происходит в результате выделения теплоты кристаллизации.
3.В условиях инвариантного состояния: при кристаллизации чистых веществ, а также при трёхфазных состояниях, на кривой охлаждения возникают температурные остановки, продолжающиеся до тех пор, пока одна из фаз не исчезнет.
По продолжительности температурной остановки при температуре эвтектики можно уточнять состав эвтектической жидкости. Для этого следует приготовить ряд смесей различного состава с одинаковой общей массой. Провести запись кривых охлаждения и отложить длительность температурной остановки при эвтектической температуре как функцию исходного состава смеси (в массовых %). Это построение называется «треугольник Таммана», вершина треугольника указывает состав эвтектической жидкости.
13.Описание равновесной кристаллизации при изобарном охлаждении бинарной закрытой системы: поля первичной кристаллизации, путь процесса на T-x-диаграмме, кривые охлаждения, правило рычага. Дайте необходимые пояснения на примере диаграммы плавкости бинарной системы (диаграмму выберите в справочнике).

14.Т-х-диаграмма плавкости бинарной системы «A–B» характеризуется следующими особенностями:
●неограниченная взаимная растворимость компонентов в расплавленном состоянии;
●очень малая взаимная растворимость компонентов в твёрдом состоянии;
●температура плавления компонента A меньше температуры плавления, компонента B;
●образуется твердая фаза устойчивого химического соединения стехиометрического состава AB2 (возможны другие варианты формулы), участвующая в эвтектических равновесиях с фазой твердого A и с фазой твердого B;
●температура конгруэнтного плавления соединения AB2 находится в интервале между температурами плавления A и B.
Изобразите схематически описанную выше T-x-диаграмму плавкости системы «A–B», подпишите все фазовые поля, назовите линии и особые точки. Рассчитайте число степеней свободы для всех вариантов фазового равновесия, показанных на диаграмме.
15.Т-х-диаграмма плавкости бинарной системы «A–B» характеризуется следующими особенностями:
●неограниченная взаимная растворимость компонентов в расплавленном состоянии;
●очень малая взаимная растворимость компонентов в твёрдом состоянии;
●температура плавления компонента A больше температуры плавления компонента B;
●в системе образуется неустойчивое химическое соединение состава A3B (возможны другие варианты формулы), разлагающееся по перитектической реакции на твёрдую фазу A и расплав;
●твердая фаза химического соединения состава A3B участвует в эвтектическом равновесии с фазой твердого B.
Изобразите схематически описанную выше T-x-диаграмму плавкости системы «A–B», подпишите все фазовые поля, назовите линии и особые точки. Рассчитайте число степеней свободы для всех вариантов фазового равновесия, показанных на диаграмме.
16.Т-х-диаграмма плавкости бинарной системы «A–B» характеризуется следующими особенностями:
●ограниченная взаимная растворимость компонентов в расплавленном состоянии;
●очень малая взаимная растворимость компонентов в твёрдом состоянии;
●температура плавления компонента A больше температуры плавления компонента B;
●в системе образуется неустойчивое химическое соединение состава A2B (возможны другие варианты формулы), разлагающееся по синтектической реакции;
●твердая фаза химического соединения состава A2B участвует в эвтектических равновесиях с фазой твердого A и с фазой твёрдого B.
Изобразите схематически описанную выше T-x-диаграмму плавкости системы «A–B», подпишите все фазовые поля, назовите линии и особые точки. Рассчитайте число степеней свободы для всех вариантов фазового равновесия, показанных на диаграмме.
17.Приведите пример бинарной системы, имеющей диаграмму плавкости с одной эвтектикой (систему выберите в справочнике). Изобразите схематически эту диаграмму, запишите обозначения фазовых областей, и наименования линий. Покажите на диаграмме путь равновесной кристаллизации (изменение составов фаз) для расплава с содержанием одного из компонентов 30%. Укажите точки начала и окончания фазовых превращений и состояние системы на каждом участке процесса, изобразите схематически соответствующую кривую свободного охлаждения, объясните её вид. Треугольник Таммана, условия его получения.
(см. предыдущие вопросы)
18.Как по диаграмме плавкости системы с одной эвтектикой можно оценить значения теплоты плавления компонентов системы? Приведите пример соответствующей системы, запишите и назовите используемое уравнение, получите выражение для теплоты плавления. Назовите все используемые допущения.
По уравнению Шредера. См. вопрос 12.
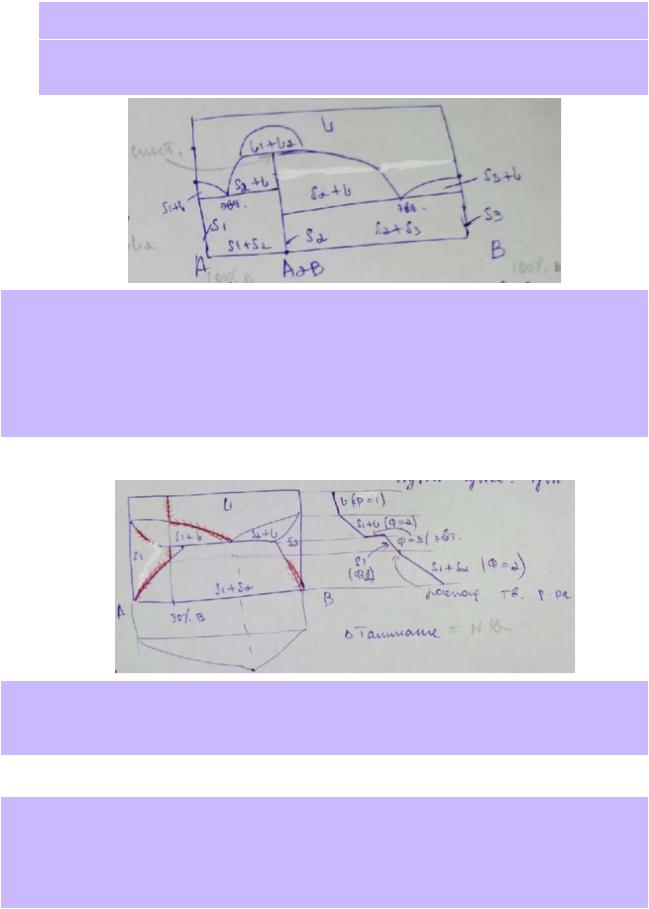
19.По приведённой в справочнике диаграмме плавкости системы Al – Si (рис. 28.14, стр.40) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Изобразите на диаграмме путь равновесной кристаллизации (изменение составов фаз) расплава с концентрацией 20 масс.% алюминия. Укажите температуры начала и окончания фазовых превращений, а также фазовый состав системы на каждом участке. Изобразите схематически соответствующую кривую охлаждения.
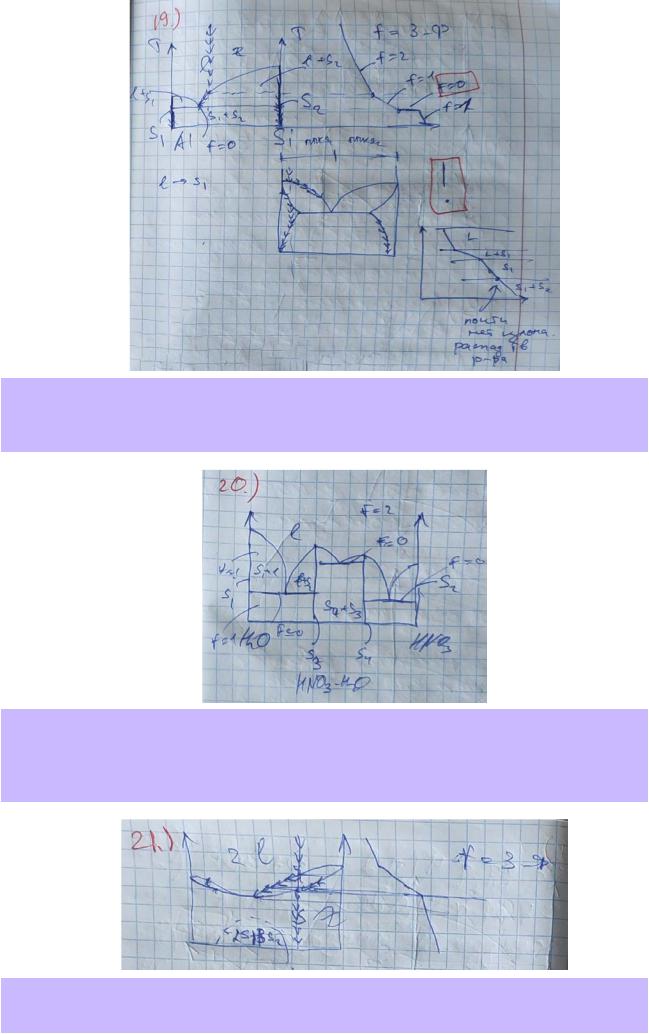
20.По приведённой в справочнике диаграмме плавкости системы H2O – HNO3 (рис.28.21, стр.41) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Если в системе образуются химические соединения, укажите их формулы и дайте их краткую характеристику.
21.По приведённой в справочнике диаграмме плавкости системы LiCl – NaCl (рис. 28.10, стр. 39) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Изобразите схематически на диаграмме путь процесса (изменение составов фаз) при изобарном (давление 1атм) нагревании от 300оС до 800оС раствора с концентрацией 70 мольн.% NaCl.
22.По приведённой в справочнике T-x-диаграмме плавкости системы Na – K для давления P=1 атм (рис. 28.22, стр.41) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Если в системе образуются химические соединения,
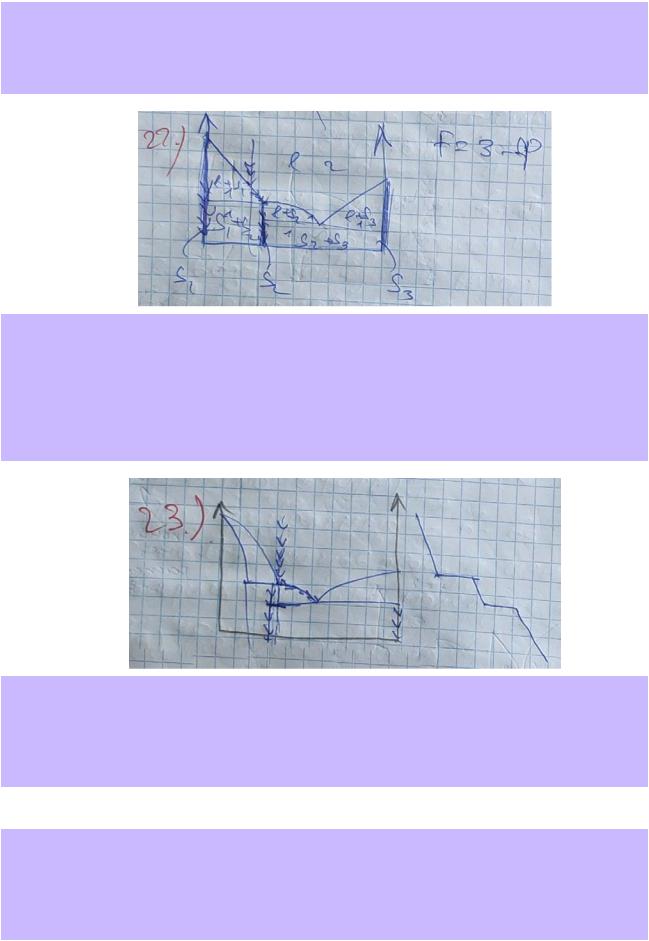
укажите их формулы и дайте их краткую характеристику. Изобразите на диаграмме путь равновесной кристаллизации (изменение составов фаз) расплава с концентрацией натрия 20 мольн%. Укажите температуры начала и окончания фазовых превращений, а также фазовый состав системы на каждом участке. Изобразите схематически соответствующую кривую охлаждения.
23.По приведённой в справочнике диаграмме плавкости системы Ag – Sb (рис.28.25, стр.42) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Если в системе образуются химические соединения, укажите их формулы и дайте их краткую характеристику. Изобразите на диаграмме путь равновесной кристаллизации (изменение составов фаз) расплава с концентрацией 30 масс% серебра. Укажите температуры начала и окончания фазовых превращений, а также фазовый состав системы на каждом участке. Изобразите схематически соответствующую кривую охлаждения.
24.По приведённой в справочнике диаграмме плавкости системы KBr–CuBr (рис. 28.23, стр. 41) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Если в системе образуются химические соединения, укажите их формулы и дайте их краткую характеристику. Изобразите на диаграмме путь равновесной кристаллизации (изменение составов фаз) при медленном изобарном (давление 1 атм)
охлаждении от 700оС до 100оС расплава с концентрацией 20 мольн.% CuBr.
Выполнить по аналогии с предыдущими вопросами.
25.По приведённой в справочнике T-x-диаграмме плавкости системы Co–Bi (рис. 28.15, стр.40) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Изобразите на диаграмме путь процесса (изменение составов фаз) при медленном охлаждении расплава с концентрацией 20 масс% Bi от 1500 оС до 200 оС. Укажите температуры начала и окончания фазовых превращений, а также фазовый состав системы на каждом участке.
Выполнить по аналогии с предыдущими вопросами.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Ставлю 10/10
Все нравится, очень удобный сайт, помогает в учебе. Кроме этого, можно заработать самому, выставляя готовые учебные материалы на продажу здесь. Рейтинги и отзывы на преподавателей очень помогают сориентироваться в начале нового семестра. Спасибо за такую функцию. Ставлю максимальную оценку.
Отлично
Лучшая платформа для успешной сдачи сессии
Познакомился со СтудИзбой благодаря своему другу, очень нравится интерфейс, количество доступных файлов, цена, в общем, все прекрасно. Даже сам продаю какие-то свои работы.
Отлично
Студизба ван лав ❤
Очень офигенный сайт для студентов. Много полезных учебных материалов. Пользуюсь студизбой с октября 2021 года. Серьёзных нареканий нет. Хотелось бы, что бы ввели подписочную модель и сделали материалы дешевле 300 рублей в рамках подписки бесплатными.
Отлично
Отличный сайт
Лично меня всё устраивает — и покупка, и продажа; и цены, и возможность предпросмотра куска файла, и обилие бесплатных файлов (в подборках по авторам, читай, ВУЗам и факультетам). Есть определённые баги, но всё решаемо, да и администраторы реагируют в течение суток.
Отлично
Маленький отзыв о большом помощнике!
Студизба спасает в те моменты, когда сроки горят, а работ накопилось достаточно. Довольно удобный сайт с простой навигацией и огромным количеством материалов.
Хорошо
Студ. Изба как крупнейший сборник работ для студентов
Тут дофига бывает всего полезного. Печально, что бывают предметы по которым даже одного бесплатного решения нет, но это скорее вопрос к студентам. В остальном всё здорово.
Отлично
Спасательный островок
Если уже не успеваешь разобраться или застрял на каком-то задание поможет тебе быстро и недорого решить твою проблему.
Отлично
Всё и так отлично
Всё очень удобно. Особенно круто, что есть система бонусов и можно выводить остатки денег. Очень много качественных бесплатных файлов.
Отлично
Отзыв о системе «Студизба»
Отличная платформа для распространения работ, востребованных студентами. Хорошо налаженная и качественная работа сайта, огромная база заданий и аудитория.
Хорошо
Отличный помощник
Отличный сайт с кучей полезных файлов, позволяющий найти много методичек / учебников / отзывов о вузах и преподователях.
Отлично
Отлично помогает студентам в любой момент для решения трудных и незамедлительных задач
Хотелось бы больше конкретной информации о преподавателях. А так в принципе хороший сайт, всегда им пользуюсь и ни разу не было желания прекратить. Хороший сайт для помощи студентам, удобный и приятный интерфейс. Из недостатков можно выделить только отсутствия небольшого количества файлов.
Отлично
Спасибо за шикарный сайт
Великолепный сайт на котором студент за не большие деньги может найти помощь с дз, проектами курсовыми, лабораторными, а также узнать отзывы на преподавателей и бесплатно скачать пособия.
Отлично
2023 | 21:34
Вы сейчас здесь:Главная Документы Физическая химия. Краткое содержание. Ответы на экзаменационные вопросы.
Физическая химия. Краткое содержание. Ответы на экзаменационные вопросы.

Подборка основных определений и краткое содержание тем и лекций по физической химии, которые проходят в первом семестре обучения некоторых ВУЗах химических и химико-технологических специальностей.
Ответы на вопросы по темам:
- Предмет и содержание курса.
- Химическая термодинамика и её особенности.
- Термодинамическая система и её параметры.
- Термодинамические процессы.
- Работа в изотермическом процессе, равновесные (обратимые) и неравновесные (необратимые) процессы.
- Равновесное состояние — нулевое начало термодинамики.
- Теплота и работа
- Внутренняя энергия и энтальпия.
- Основные понятия и формулировки, первое начало термодинамики для процессов в идеальном газе.
- Теплоемкость.
- Закон Гесса.
- Определение тепловых эффектов по теплоте образования и теплоте сгорания.
- Зависимость теплового эффекта от температуры, закон Кирхгофа.
- Критерии самопроизвольности процессов в изолированных системах, энтропия как основной из них.
- Второе начало термодинамики для обратимых и необратимых процессов
- Статистический смысл понятия энтропии, термодинамическая вероятность и формула Больцмана.
- Третье начало термодинамики, Постулат Планка. Расчет энтропии.
- Энергия Гиббса и энергия Гельмгольца.
- Критерии равновесных и самопроизвольных процессов.
- Максимальная работа в изохорно-изотермическом и изобарно-изотермическом процессах.
- Характеристические функции и термодинамические потенциалы.
- Зависимость энергий Гиббса и Гельмгольца от температуры, уравнения Гиббса — Гельмгольца.
- Химический потенциал реального газа, фугитивность.
- Активность и коэффициент активности.
- Константа равновесия химической реакции.
- Изотерма химической реакции.
- Химическая переменная и химическое сродство.
- Уравнения изобары и изохоры химической реакции.
- Элементы статистической термодинамики, сумма по состояниям
- Зависимость термодинамических функций от суммы по состояниям.
- Элементы неравновесной термодинамики.
- Основные понятия неравновесной термодинамики, поток и термодинамическая сила.
- Феноменологические уравнения и принцип Онзагера.
- Производство энтропии и теорема Пригожина.
- Основные понятия и определения, условия равновесия компонента в двух фазах гетерогенной системы.
- Основной закон фазового равновесия, правило фаз Гиббса.
- Тепловые эффекты фазовых переходов, уравнение Клаузиуса — Клапейрона.
- Диаграмма состояния гетерогенной однокомпонентной системы, диаграмма состояния воды.
- Физико-химический и термический анализы.
- Системы с эвтектикой.
- Системы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями. Правило рычага.
- Системы с твердыми растворами с неограниченной и ограниченной растворимостью компонентов.
- Системы с ограниченной растворимостью в жидкой фазе.
- Графическое изображение состава трехкомпонентной системы.
- Трехкомпонентные жидкие системы.
- Системы с тройной эвтектикой.
Скачать “Скачать «Краткое содержание. Ответы на экзаменационные вопросы по физической химии.»”
fizkhimia_33.pdf – Загружено 2255 раз – 990,08 КБ
Энергия, теплота, работа, внутренняя энергия, энтальпия.
Эквивалентность теплоты и работы. Классические опыты Джоуля.
Первое и второе начала термодинамики.
Направление процессов.
Энтропия. Свободная энергия Гиббса. Условия равновесия.
Теории Растворов.
Растворы газов в жидкостях. Зависимость растворимости газов в жидкостях от их природы, давления и температуры.
Закон Генри. Совместная растворимость газов. Влияние третьего компонента на растворимость газов.
Растворимость газов воде и нефти. Попутные газы. Газовый фактор.
Растворы жидкостей в жидкостях. Закон Рауля.
Идеальные растворы. Диаграммы равновесия пар-жидкость в бинарных системах.
Законы Коновалова. Фракционная перегонка.
Азеотропные растворы.
Молекулярное повышение температуры кипения. Ограниченная взаимная растворимость жидкостей.
Ограниченная взаимная растворимость жидкостей.
Растворы твердых веществ в жидкостях. Зависимость растворимости от температуры.
Молекулярное понижение температуры замерзания. Понятие об активности.
Фазовые переходы. Уравнение Клапейрона-Клаузиуса.
Поверхностная энергия и поверхностное натяжение.
Поверхностное натяжение растворов.
Внутреннее давление. Зависимость поверхностного натяжения от температуры.
Основы термодинамики адсорбции. Уравнение Гиббса.
Поверхностно-активные вещества (ПАВ).
Изменение поверхностной активности в гомологическом ряду ПАВ, правило Траубе.
Теория адсорбции Ленгмюра.
Адсорбция из растворов и газов на твердых поверхностях.
Уравнения адсорбции Шишковского, Фрейндлиха и БЭТ.
Определение геометрических размеров молекул ПАВ по значению величины предельной адсорбции. Основы хроматографии.
Мицеллярные растворы. Критическая концентрация мицеллообразования (ККМ)
Солюбилизация. Применение мицеллярных растворов.
Понятие о когезии и адгезии
Работа когезии и адгезии, уравнение Дюпре
Смачивание и растекание. Уравнение Юнга.
Применение ПАВ для управления процессами смачивания. Эффект Ребиндера.
Поднятие жидкостей в узких трубках (капиллярах). Уравнение капиллярного давления
Закон Томсона (Кельвина).
Капиллярная конденсация. Формула Жюрена.
Капиллярно — удержанная и пленочная нефть, методы их извлечения.
Роль капиллярных явлений в процессе движения нефти, воды и газа в пористых коллекторах.
Роль ПАВ в повышении коэффициента нефтеотдачи.
Понятие о дисперсных системах (ДС). Терминология и классификация.
Получение и очистка дисперсных систем (ДС).
Молекулярно-кинетические свойства дисперсных систем (ДС) (броуновское движение, диффузия, осмос).
Оптические свойства дисперсных систем (ДС). Рассеяние света малыми частицами. Уравнение Рэлея.
Вид золей в проходящем свете. Уравнение Ламберта-Бэра.
Суспензии и их свойства.
Седиментационный метод дисперсионного анализа.
Седиментационно-диффузионное равновесие в ДС.
Эмульсии. Классификация эмульсий и методы их получения.
Факторы, влияющие на агрегативную устойчивость эмульсий (величина межфазного натяжения, наличие двойного электрического слоя, структурно-механического барьера).
Явление обращения фаз.
Эмульгаторы и деэмульгаторы.
Нефтяные эмульсии, условия их образования. Стабилизаторы нефтяных эмульсий.
Методы разрушения нефтяных эмульсий. Применение эмульсий в нефтепромысловом деле.
Пены и их свойства. Пенообразователи и пеногасители.
Применение пен в нефтепромысловом деле.
| Creator | Дата: Суббота, 10.12.2016, 03:19 | Сообщение # 1 |
|
Группа: Администраторы Репутация: 6 Статус: Оффлайн |
Скачать ответы на экзаменационные вопросы по курсу физической химии.
Список вопросов: |
Департамент образования города Москвы
Государственное автономное профессиональное
образовательное учреждение города Москвы
«Московский образовательный комплекс имени Виктора Талалихина»
Левина В.Б.
Вопросы и задачи к экзаменационным билетам
по дисциплине
«Физическая и коллоидная химия»
Москва
2015
Вопросы к экзаменационным билетам по дисциплине
«Физическая и коллоидная химия»
1. Объяснить основные свойства агрегатных состояний вещества.
2. Охарактеризовать газообразное состояние вещества.
3. Охарактеризовать идеальные и реальные газы, управление Клайперона –
Менделеева.
4. Объяснить особенности жидкого агрегатного состояния вещества.
5. Объяснить особенности структуры жидкости, энергию поверхностного
слоя.
6. Охарактеризовать поверхностное натяжение жидкостей, явления
смачивания.
7. Охарактеризовать вязкость жидкостей, ее роль для технологии мясных
и молочных продуктов.
8. Объяснить особенности поведения газов при изменении
термодинамических параметров.
9. Объяснить особенности поведения жидкостей при изменении
термодинамических параметров.
10. Объяснить особенности поведения твердых веществ при изменении
термодинамических параметров.
11. Охарактеризовать основные понятия и определения термодинамики.
12. Объяснить сущность эктальпии.
13. Объяснить сущность энтропии.
14. Охарактеризовать тепловые эффекты химических реакций (сгорания,
образования, нейтрализации).
15. Объяснить закон Гесса (его следствия).
16. Объяснить основные понятия фазового равновесия.
17. Объяснить правило фаз Гиббса.
18. Дать общую характеристику и классификацию растворов, объяснить
их значение в технологии мясных и молочных продуктов.
19. Объяснить теорию растворов Д.И.Менделеева.
20. Объяснить явление осмоса.
21. Объяснить явления осмотического давления, закон Вант-Гоффа.
22. Объяснить закон Рауля, изменения температур кипения и замерзания
растворов.
23. Объяснить взаимную растворимость жидкостей, законы Коновалова.
24. Объяснить значение растворов, их свойств для технологии мясных и
молочных продуктов.
25. Объяснить сущность перегонки жидкостей с водяным паром.
26. Объяснить сущность ректификации и экстракции.
27. Объяснить понятие скорости химической реакции.
28. Объяснить закон действующих масс для скоростей химической
реакции.
29. Объяснить зависимость скорости химической реакции от температуры, правило Вант-Гоффа.
30. Объяснить сущность катализа, его виды.
31. Объяснить особенности ферментативного катализа.
32. Объяснить сущность процесса сорбции и адсорбции.
33. Охарактеризовать адсорбцию на границе газ – жидкость,
газ – твердое тело.
34. Охарактеризовать абсорбцию на границе жидкость – жидкость,
твердое тело – жидкость, изотерму адсорбции.
35. Охарактеризовать адсорбцию ионов на твердом адсорбенте.
36. Охарактеризовать ионообменную адсорбцию.
40. Объяснить зависимость величины адсорбции от термодинамических
факторов.
41. Объяснить значения сорбции и адсорбции в технологии мясных
и молочных продуктов.
42. Объяснить значение адсорбции в хроматографическом методе анализа.
43. Охарактеризовать коллоидные системы, их особенности, классификацию.
44. Объяснить роль дисперсных систем в технологии мясных и молочных
продуктов.
45. Охарактеризовать воздействие дисперсных систем на окружающую
среду.
46. Охарактеризовать методы получения коллоидных систем.
47. Объяснить понятие о стабилизаторах.
48. Охарактеризовать способы очистки коллоидных систем: диализ,
электролиз, ультрафильтрация.
49. Охарактеризовать броуновское движение частиц в коллоидных системах.
50. Охарактеризовать диффузию – седиментационное равновесие
коллоидных систем.
51. Охарактеризовать осмотическое давление в коллоидных системах.
52. Охарактеризовать оптические свойства коллоидных систем.
53. Объяснить электрокинетические свойства коллоидных систем
(электрофорез и электроосмос).
54. На конкретном примере объяснить строение мицеллы гидрозоля.
55. На конкретном примере объяснить строение двойного электрического,
смея мицеллы гидрозоля.
56. Объяснить механизм коагуляции золей электролитами.
57. Объяснить понятие коагуляции золей.
58. Объяснить понятия порога коагуляции.
59. Объяснить понятие структурных коллоидных систем.
60. Охарактеризовать гели, гелеобразования, тиоскопию.
61. Охарактеризовать связодисперсные системы кристаллизационного типа,
пептизации.
62. Охарактеризовать системы, содержащие коллоидные ПАВ.
63. Объяснить строение молекул коллоидных ПАВ.
64. Охарактеризовать свойства растворов коллоидных ПВА, солюбилизацию.
65. Охарактеризовать микрогетерогенные системы, их сходства и различие с
коллоидными системами.
66. Объяснить роль микрогетерогенных систем для технологии мясных и
молочных продуктов, их влияние на окружающую среду и человека.
67. Охарактеризовать классификацию микрогетерогенных систем, их
получение.
68. Охарактеризовать суспензии, их получение, устойчивость, методы
разрушения.
69. Охарактеризовать классификацию эмульсий, их использование в
технологии мясных и молочных продуктов.
70. Объяснить получение эмульсий, их устойчивость и методы разрушения.
71. Охарактеризовать пены, аэрозоли, порошки, их получения, устойчивость
и разрушения.
72. Объяснить особенности строения молекул ВМС.
73. Объяснить использование ВМС в технологии мясных и молочных продуктов.
74. Объяснить сущность процесса набухания, его виды, стадии набухания.
75. Объяснить роль процесса набухания в технологии мясных и молочных
продуктов.
76. Охарактеризовать растворение ВМС, их сходства и различии с
коллоидными растворами.
77. Охарактеризовать вязкость растворов ВМС.
78. Объяснить сущность процесса студнеобразования.
Задачи к экзаменационным билетам по дисциплине
«Физическая и коллоидная химия»
1. Стальной цилиндр объемом 20 л наполнен кислородом. При температуре
18о С, давление газа в цилиндре равно Па. Определить массу
кислорода, находящегося в баллоне.
2. Рассчитать объем газа при нормальных условиях, если при температуре
37оС и давлении 90 000Па объем его равен 20л.
3. Вычислите значение универсальной газовой постоянной по следующим
данным: при температуре 15оС и давлении оксиду азота (I) N2О
массой занимает объем
. Мольная масса оксида
азота М=44 кг/моль.
4. Рассчитать сколько диоксида углерода вмещается в баллоне емкостью
0,1 м3 при 20оС под давлением . Мольная масса диоксида
углерода М=44 кг/моль.
5. В сосуде объемом 500 см3 содержится 0,89г водорода при температуре
290К. Определить давление газа.
6. Газ принимает объем 2м3 при температуре 546К. Каким будет его объем
при температуре 960К.
7. Написать математическое выражение для скорости следующих реакций:
2AL+3Cl2=2ALCl3
2CO+O2↔2CO2
8. Во сколько раз увеличится скорость реакции, если давление увеличить
в пять раз?
2NO+O2→2NO2
9. Рассчитайте (в Дж) разность тепловых эффектов реакции
СН3СНО+Н2=С2Н3ОН, протекающий при температуре 310К, постоянном
давлении или постоянном объеме. Чему будет равна эта разность, если
температура повысится до 400К и спирт перевести в газообразное
состояние.
10. В результате растирения 20кг гелия при температуре 256К объем газа
увеличивается в 1000 раз. Рассчитайте изменение энтропии.
11. В какую сторону сместится равновесие при повышении температуры в
следующих системах:
1. СО+О2↔2СО2+669кДж
2. N2+3H2↔2NH3+92кДж
3. N2+O2↔2NO-181кДж
12. В какую сторону сместится равновесие при повышении давления в
следующих системах:
1. 2NO+O2↔2NO2 (гомогенная)
2. H2+J2↔2HJ (гомогенная)
3. CO2+C↔2CO (гетерогенная)
13. Написать математические выражения констант равновесия для
следующих систем:
2H2Se↔2H2+Se – 40,22кДж
FeO+CO↔Fe+CO2
14. Как изменится скорость прямой реакции N2+3H2↔2NH3, если давление
увеличить в 5 раз.
15. При состоянии равновесия системы N2+3H2↔2NH3
концентрация азота равна 0,5 моль/л;
водород – 10 моль/л, аммиака – 0,6 моль/л.
Вычислить константу равновесия реакции.
16. В какую сторону сместится равновесие реакции
N2+3H2↔2NH3+98,17кДж
При увеличении концентрации исходящих веществ, при повышении
давления и температуры?
17. Равновесное давление водяного пара, образующегося по реакции
Са(ОН)2=СаО+Н2О равно 120 мм. ртутного столба при Т 724К и 450 мм.
ртутного столба при Т=804К. Найти среднее значение теплового эффекта
этой реакции в данном интервале температуры.
18. Определить осмотическое давление 5%-ого раствора глюкозы при 18оС.
Плотности раствора принять равной единице. Молекулярная масса
глюкозы – 180.
19. Определить давление пара 30%-ого раствора мочевины при 50оС.
Давление пара воды при 50оС равно 12320Па.
20. При какой температуре будет замерзать 50% — ный раствор метилового
спирта (СН3ОН) в воде, криоскопическая постоянная которой
равна 1,98 С?
21. Определить давление пара над раствором, содержащим 0,005 кг глюкозы
в 0,1 кг воды при температуре 310К, если давление пара над числом
растворителем при этой же температуре равно 3590 Па.
22. Рассчитайте осмотическое давление 0,01М водного раствора сульфата
натрия при температуре 350К, если степень диссоциации равна 0,89.
23. Степень диссоциации сульфата цинка в 0,05М растворе равна 0,6. Как
велико должно быть осмотическое давление раствора 272К?
24. Вычислить потенциал серебра, погруженного в раствор своей соли при
температуре 256К с концентрацией ионов серебра 0,03 моль/м3.
25. Вычислить при 30оС э.д.с. гальванического элемента Якоби-Даниэля при
условии, что концентрация катионов меди и цинк в обоих полуэлементах
равна по 2 моль/м3.
26. Давление пара над серной кислотой при температуре 460К равно 630Па,
а при температуре 480К – 3560Па. Определите теплоту парообразования
серной кислоты, считая ее постоянной в указанном интервале
температуры.
27. Во сколько раз увеличится скорость реакции при температуре 540К, если
катализатор уменьшает энергию активации на ∆Е=60кДж/моль?
28. Определить степень электролитической диссоциации 0,02Н раствора
уксусной кислоты, эквивалентная электропроводность которого при
19оС равна 14,74Ом-1 см2 г экв-1.
29. Вычислить константу электролитической диссоциации 0,02Н раствора
уксусной кислоты, степень электролитической диссоциации которого
при температуре 20оС равна 0,0624.
30. Определить потенциал медного электрода в 350 см3 раствора при 27оС,
содержащего 2,6г CuSO4. Кажущаяся степень диссоциации соли в
растворе равна 65%.
31. Определить электродвижущую силу медно-цинкового гальванического
элемента при концентрации ионов в растворе равной 1г-ион/л,
температура 16оС.
Cu/Cu2+/KCl/Z2+/Zn
32. Определить поверхностное натяжение бензола при температуре 310 и
343К при условии, что полная поверхностная энергия не зависит от
температуры и для бензола составляет 62м Дж/м2. Температурный
коэффициент -0,13Дж/(м2К).
33. Золь диоксида кремния в воде содержит частицы сферической формы
диаметром 6·10-8м. Определить на какой высоте от начального уровня
частичная концентрация уменьшится в два раза. Плотность диоксида
кремния 2·103, температура 268К.
34. Определить осмотическое давление водного раствора, содержащего 25г
глюкозы и 8л раствора. Температура 30оС. Мольная масса глюкозы
180кг/к моль.
35. Определить сколько карбамида NH2CONH2 раствора в 100см3 воды,
если осмотическое давление раствора 30оС равно 1,28·105Па. Мольная
масса карбамида 60кг/к моль.
36. Написать формулу получения мицеллы гидроксида железа.
37. Изобразить схему строения мицеллы золя иодида серебра.
38. Порог коагуляции отрицательно заряженного гидрозоля сульфата
серебра под действием KCl равен 5,9·10-2моль/л. С помощью правила
Шульце-Гарди рассчитайте пороги коагуляции, вызываемой
следующими электролитами: K2SO4; MgCl2; MgSO4; AlCl3.
39. Рассчитайте толщину диффузного слоя на поверхности пластинки при
температуре 298К в водном растворе, 1л которого содержит 0,06г NaCl
и 0,01г CaCl2. Относительная диэлектрическая проницаемость раствора
равна 89,7. Во сколько раз изменится толщина диффузного слоя, если
раствор разбавить водой в 3 раза?
