Н
что это вообще когда-нибудь пригодится!
Ответы к экзамену
По
биохимии
1
СТРУКТУРА
И ФУНКЦИИ БЕЛКОВ 3
ФЕРМЕНТЫ 10
НУКЛЕИНОВЫЕ
КИСЛОТЫ И НУКЛЕОТИДЫ 20
ОБЩИЙ
ПУТЬ КАТАБОЛИЗМА 31
ОБМЕН
УГЛЕВОДОВ 45
ОБМЕН
БЕЛКОВ 56
ОБМЕН
ЛИПИДОВ 73
ОБМЕН
НУКЛЕОТИДОВ 85
ВИТАМИНЫ 90
ОБЩИЕ
ПРИНЦИПЫ РЕГУЛЯЦИИ МЕТАБОЛИЧЕСКИХ
ПРОЦЕССОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА 92
БИОХИМИЯ
ОРГАНОВ И ТКАНЕЙ 114
Сделано
второкурсницей с красными глазами,
ничего не соображающей в биохимии,
Трубицыной
Викторией Владимировной
БелГУ
июнь
2014
ВВЕДЕНИЕ
В БИОХИМИЮ
Вопрос
№1
Предмет
и задачи биологической и клинической
химии.
Биохимия
– это наука о химическом составе живой
материи, химических процессах, происходящих
в живых организмах, а также связи этих
превращений с деятельностью органов и
тканей.
Биохимия
–
это наука о молекулярных основах жизни.
-
Статическая
– химические формулы строения веществ -
Динамическая
– последовательность реакций и процессов -
Функциональная
– биохимия тканей и органов.
Предмет
— выяснение функционального, то есть
биологического назначения всех химических
веществ и физико-химических процессов
в живом организме, а также механизм
нарушения этих функций при разных
заболеваниях.
Современная
биохимия решает следующие задачи:
1.
Биотехнологическую, т.е. создание
фармацевтических препаратов (гормонов,
ферментов), регуляторов роста растений,
средств борьбы с вредителями, пищевых
добавок.
2.
Проводит разработку новых методов и
средств диагностики и лечения
наследственных заболеваний, канцерогенеза,
природы онкогенов и онкобелков.
3.
Проводит разработку методов генной и
клеточной инженерии для получения
принципиально новых пород животных и
форм растений с более ценными признаками.
4.
Изучает молекулярные основы памяти,
психики, биоэнергетики, питания и целый
ряд других задач.
Клиническая
химия (также известна как клиническая
биохимия или медицинская биохимия) —
область клинической лабораторной
диагностики, использующая методы
аналитической химии для исследования
биологических объектов на предмет
содержания определенных химических
веществ с целью диагностики заболеваний
или патологических состояний организма.
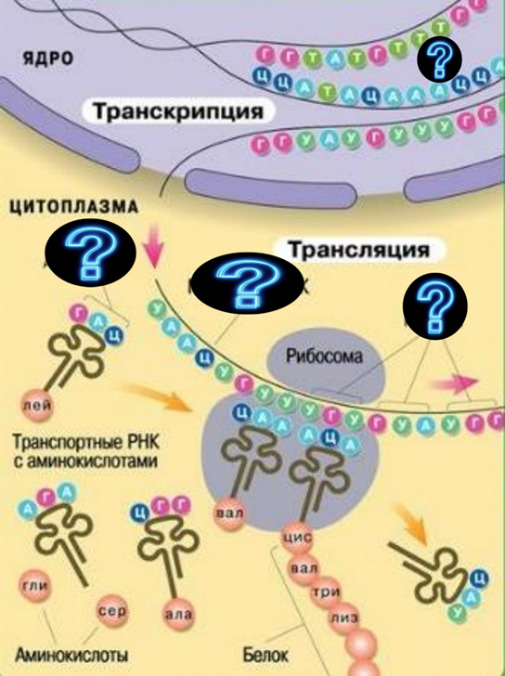
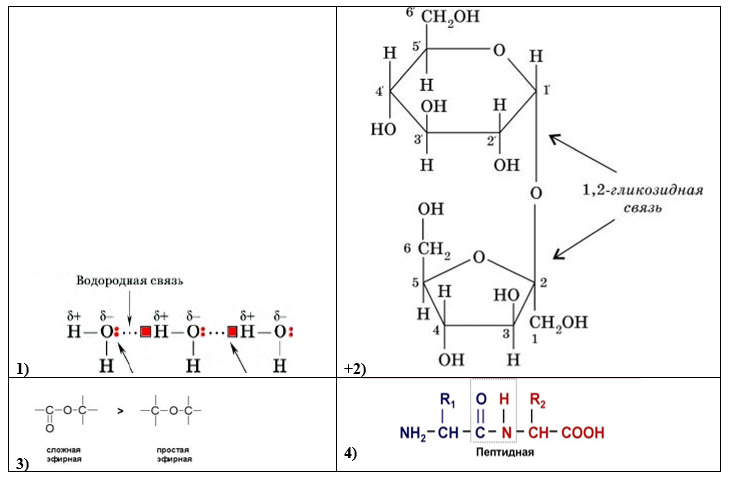
Структура и функции белков Вопрос №4
Аминокислоты
— структурные мономеры белков. Общая
характеристика, классификация (полярные,
неполярные, полярные незараженные).
Особенности образования пептидной
связи. Первичный уровень организации
белка.
Белки
– это биополимеры, состоящие из
α-аминокислотных остатков, соединенных
пептидной связью.
-
Пептиды – цепочка
до 10 аминокислотных остатков -
Полипептиды – более
10 аминокислотных остатков -
Протеины = белки –
от 6 000 аминокислотных остатков
Аминокислоты
(аминокарбоновые кислоты) — органические
соединения, в молекуле которых одновременно
содержатся карбоксильные и аминные
группы
В белках обнаружено
20 АМК.
П
нейтральном рН — в виде биполярных ионов.
Классификация по
заряду радикала:
-
неполярные
незаряженные (гидрофобные) — с алифатическим
(Ала, Вал, Лей, Иле, Мет, Про) и ароматическими
(Фен, Тпф) радикалами. Радикалы стремятся
к друг другу или другим гидрофобным
молекулам и поверхность их соприкосновения
с водой уменьшается. -
полярные незаряженные
— Сер, Тре, Тир (ОН-группы), Асн, Глн
(NH2-группа),
Цис (SH-группа),
Гли. Лучше растворяются, т.к. имеют
полярные функциональные группы. -
Полярные — полярные
отрицательно заряженные — Асп, Глу
(СООН-группа). При рН 7 радикал — анион. -
П
олярные
— полярные положительно заряженные —
Арг, Лиз, Гис. Наибольшая растворимость
в воде.
П
структура
– последовательность аминокислотных
остатков, соединенных пептидной связью.
Н
со свободной аминогруппы (N-конец),
завершается свободной карбоксильной
группой (С – конец). Нумерация с N-конца.
Названия всех аминокислот с окончанием
-ил, последней — как обычно.
При
рН > 7 (кровь) пептидная связь
енолизируется.
Наличие
С = С придает пептидной связи планарный
характер, т. е. вращение между N
и О затруднено, что делает первичную
структуру белков более жесткой.
NB!:
Первичная структура белка имеет важное
значение для индивидуальных (нативных)
свойств пептида, полипептида и белков,
Т. Е. последовательность аминокислот
в любом белке строго специфично и
детерминирована генами. Такая
последовательность аминокислот формирует
уникальную для каждого белка вторичную,
третичную и четвертичную структуру.
К
первичной структуре можно отнести
дисульфидные мостики, образованные
остатками цистеина.
– S
– S
–
Следовательно,
первичная структура стабилизируется
ковалентными связями между аминокислотными
остатками.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Ответы на экзамен по биохимии
ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ
для студентов лечебного, педиатрического и медико-профилактического факультетов
√1. Предмет и задачи биологической химии. Обмен веществ и энергии, ие¬рархическая структурная организация и самовоспроизведение как важ¬нейшие признаки живой материи.
√2. Гетеротрофные и аутотрофные организмы: различия по питанию и ис¬точникам энергии. Катаболизм и анаболизм.
√3. Многомолекулярные системы (метаболические цепи, мембранные про¬цессы, системы синтеза биополимеров, молекулярные регуляторные системы) как основные объекты биохимического исследования.
√4. Уровни структурной организации живого. Биохимия как молекулярный уровень изучения явлений жизни. Биохимия и медицина (медицинская биохимия).
√5. Основные разделы и направления в биохимии: биоорганическая химия, динамическая и функциональная биохимия, молекулярная биология.
√6. История изучения белков. Представление о белках как важнейшем клас¬се органических веществ и структурно-функциональном компоненте организма человека.
√7. Аминокислоты, входящие в состав белков, их строение и свойства. Пеп¬тидная связь. Первичная структура белков.
√8. Зависимость биологических свойств белков от первичной структуры. Видовая специфичность первичной структуры белков (инсулины разных животных).
√9. Конформация пептидных цепей в белках (вторичная и третичная струк¬туры). Слабые внутримолекулярные взаимодействия в пептидной цепи; дисульфидные связи.
√10.Основы функционирования белков. Активный центр белков и его спе¬цифическое взаимодействие с лигандом как основа биологической функции всех белков. Комплементарность взаимодействия молекул белка с лигандом. Обратимость связывания.
√11. Доменная структура и её роль в функционировании белков. Яды и ле¬карства как ингибиторы белков.
√12.Четвертичная структура белков. Особенности строения и функциониро¬вания олигомерных белков на примере гемсодержащего белка — гемо¬глобина.
√13.Лабильность пространственной структуры белков и их денатурация. Факторы, вызывающие денатурацию.
√14.Шапероны — класс белков, защищающий другие белки от денатурации в условиях клетки и облегчающий формирование их нативной конформации.
√15.Многообразие белков. Глобулярные и фибриллярные белки, простые и сложные. Классификация белков по их биологическим функциям и по семействам: (сериновые протеазы, иммуноглобулины).
√16.Иммуноглобулины, особенности строения, избирательность взаимодей¬ствия с антигеном. Многообразие антигенсвязывающих участков Н- и L-цепей. Классы иммуноглобулинов, особенности строения и функцио¬нирования.
√17.Физико-химические свойства белков. Молекулярный вес, размеры и форма, растворимость, ионизация, гидратация.
√18.Методы выделения индивидуальных белков: осаждение солями и орга¬ническими растворителями, гель-фильтрация, электрофорез, ионооб¬менная и аффинная хроматография.
√19.Методы количественного измерения белков. Индивидуальные особен¬ности белкового состава органов. Изменения белкового состава органов при онтогенезе и болезнях.
√20.История открытия и изучения ферментов. Особенности ферментативно¬го катализа. Специфичность действия ферментов. Зависимость скорости ферментативных реакций от температуры, рН, концентрации фермента и субстрата.
√21 .Классификация и номенклатура ферментов. Изоферменты. Единицы измерения активности и количества ферментов.
√22.Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере витаминов В6, РР, В2).
√23.Ингибиторы ферментов. Обратимое и необратимое ингибирование. Конкурентное ингибирование. Лекарственные препараты как ингибито¬ры ферментов.
√24.Регуляция действия ферментов: аллостерические ингибиторы и актива¬торы. Каталитический и регуляторный центры. Четвертичная структура аллостерических ферментов и кооперативные изменения конформации протомеров фермента.
√25.Регуляция активности ферментов путем фосфорилирования и дефосфорилирования. Участие ферментов в проведении гормонального сигнала.
√26.Различия ферментного состава органов и тканей. Органоспецифические ферменты. Изменение ферментов в процессе развития.
√27.Изменение активности ферментов при болезнях. Наследственные энзимопатии. Происхождение ферментов крови и значение их определения при болезнях.
√28.Применение ферментов для лечения болезней. Применение ферментов как аналитических реагентов при лабораторной диагностике (определе¬нии глюкозы, этанола, мочевой кислоты и т.д.). Иммобилизованные ферменты.
√29.Обмен веществ: питание, метаболизм и выделение продуктов метабо¬лизма. Органические и минеральные компоненты пищи. Основные и минорные компоненты.
√30.Основные пищевые вещества: углеводы, жиры, белки, суточная потреб¬ность, переваривание; частичная взаимозаменяемость при питании.
√31 .Незаменимые компоненты основных пищевых веществ. Незаменимые аминокислоты; пищевая ценность различных пищевых белков. Линолевая кислота — незаменимая жирная кислота.
√32.История открытия и изучения витаминов. Классификация витаминов. Функции витаминов.
√ЗЗ. Алиментарные и вторичные авитаминозы и гиповитаминозы. Гипервитаминозы. Примеры.
√34.Минеральные вещества пищи. Региональные патологии, связанные с недостаточностью микроэлементов в пище и воде.
√35.Понятие о метаболизме и метаболических путях. Ферменты и метабо¬лизм. Понятие о регуляции метаболизма. Основные конечные продукты метаболизма у человека.
√36.Исследования на целых организмах, органах, срезах тканей, гомогенатах, субклеточных структурах и на молекулярном уровне.
√37.Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Примеры.
√З8.Дегидрирование субстрата и окисление водорода (образование Н2О) как источник энергии для синтеза АТФ. НАД- и ФАД-зависимые дегидрогеназы, убихинон-дегидрогеназа, цитохромы и цитохромоксидаза.
√39.Окислительное фосфорилирование, коэффициент Р/О. Строение мито¬хондрий и структурная организация дыхательной цепи. Трансмембран¬ный электрохимический потенциал.
√40.Регуляция цепи переноса электронов (дыхательный контроль). Разоб¬щение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания.
√41.Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипо-, авитаминозов и других причин. Возрастная характеристика энергетического обеспечения организма питательными веществами.
√42.Образование токсических форм кислорода, механизм их повреждающе¬го действия на клетки. Механизмы устранения токсичных форм кисло¬рода.
√43.Катаболизм основных пищевых веществ — углеводов, жиров, белков. Понятие о специфических путях катаболизма и общих путях катаболиз¬ма.
√44.Окислительное декарбоксилирование пировиноградной кислоты. По¬следовательность реакций. Строение пируватдекарбоксилазного ком¬плекса.
√45.Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Связь между общими путями катаболизма и цепью переноса электронов и протонов.
√46.Механизмы регуляции цитратного цикла. Анаболические функции цик¬ла лимонной кислоты. Реакции, пополняющие цитратный цикл.
√47.Основные углеводы животных, их содержание в тканях, биологическая роль. Основные углеводы пищи. Переваривание углеводов.
√48.Глюкоза как важнейший метаболит углеводного обмена. Общая схема источников и путей расходования глюкозы в организме.
√49. Аэробный распад — основной путь катаболизма глюкозы у человека и других аэробных организмов. Последовательность реакций до образо¬вания пирувата (аэробный гликолиз).
√50.Распространение и физиологическое значение аэробного распада глю¬козы. Использование глюкозы для синтеза жиров в печени и в жировой ткани.
√51 .Анаэробный распад глюкозы (анаэробный гликолиз). Гликолитическая оксиредукция, пируват как акцептор водорода. Субстратное фосфорилирование. Распространение и физиологическое значение этого пути распада глюкозы.
√52. Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и мо¬лочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
√53. Представление о пентозофосфатном пути превращений глюкозы. Окислительные реакции (до стадии рибулозо-5-фосфата). Распростра¬нение и суммарные результаты этого пути (образование пентоз, НАДФН и энергетика).
√54. Свойства и распространение гликогена как резервного полисахарида. Биосинтез гликогена. Мобилизация гликогена.
√55. Особенности обмена глюкозы в разных органах и клетках: эритроциты, мозг, мышцы, жировая ткань, печень.
√56. Представление о строении и функциях углеводной части гликолипидов и гликопротеинов. Сиаловые кислоты.
√57. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы.
√58. Важнейшие липиды тканей человека. Резервные липиды (жиры) и липиды мембран (сложные липиды). Жирные кислоты липидов тканей человека.
√59. Незаменимые факторы питания липидной природы. Эссенциальные жирные кислоты: ω-3- и ω-6-кислоты как предшественники синтеза эйкозаноидов.
√60.Биосинтез жирных кислот, регуляция метаболизма жирных кислот.
√61.Химизм реакций β-окисления жирных кислот, энергетический итог.
√62. Биосинтез и использование кетоновых тел в качестве источников энер¬гии.
√бЗ.Пищевые жиры и их переваривание. Всасывание продуктов перевари¬вания. Нарушение переваривания и всасывания. Ресинтез триацилглицеринов в стенке кишечника.
√64.Образование хиломикронов и транспорт жиров. Роль апопротеинов в составе хиломикронов. Липопротеинлипаза.
√65.Биосинтез жиров в печени из углеводов. Структура и состав транспорт¬ных липопротеинов крови.
√66. Депонирование и мобилизация жиров в жировой ткани. Регуляция син¬теза и мобилизации жиров. Роль инсулина, глюкагона и адреналина.
√67.Основные фосфолипиды и гликолипиды тканей человека (глицерофосфолипиды, сфингофосфолипиды, гликоглицеролипиды, гликосфиголипиды). Представление о биосинтезе и катаболизме этих соединений.
√68.Нарушение обмена нейтрального жира (ожирение), фосфолипидов и гликолипидов. Сфинголипидозы.
√69.Строение и биологические функции эйкозаноидов. Биосинтез простагландинов и лейкотриенов.
√70.Холестерин как предшественник ряда других стероидов. Представление о биосинтезе холестерина. Написать ход реакций до образования мевалоновой кислоты. Роль гидроксиметилглутарил-КоА-редуктазы.
√71.Синтез желчных кислот из холестерина. Конъюгация желчных кислот, первичные и вторичные желчные кислоты. Выведение желчных кислот и холестерина из организма.
√72.ЛПНП и ЛПВП — транспортные, формы холестерина в крови, роль в об¬мене холестерина. Гиперхолестеринемия. Биохимические основы раз¬вития атеросклероза.
√73. Механизм возникновения желчнокаменной болезни (холестериновые камни). Применение хенодезокеихолевой кислоты для лечения желчно¬каменной болезни.
√74. Общая схема источников и путей расходования аминокислот в тканях. Динамическое состояние белков в организме.
√75. Переваривание белков. Протеиназы — пепсин, трипсин, химотрипсин; проферменты протеиназ и механизмы их превращения в ферменты. Субстратная специфичность протеиназ. Экзопептидазы и эндопептидазы.
√76. Диагностическое значение биохимического анализа желудочного и дуоденального сока. Дать краткую характеристику состава этих соков.
√77. Протеиназы поджелудочной железы и панкреатиты. Применение инги¬биторов протеиназ для лечения панкреатитов.
√78. Трансаминирование: аминотрансферазы; коферментная функция вита¬мина В6. Специфичность аминотрансфераз.
√79. Аминокислоты, участвующие в трансаминировании; особая роль глутаминовой кислоты. Биологическое значение реакций трансаминирования. Определение трансаминаз в сыворотке крови при инфаркте мио¬карда и болезнях печени.
√80. Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот. Биологическое значение.
√81. Основные источники аммиака в организме. Роль глутамата в обезвре¬живании и транспорте аммиака. Глутамин как донор амидной группы при синтезе ряда соединений.
√82. Глутаминаза почек; образование и выведение солей аммония. Актива¬ция глутаминазы почек при ацидозе.
√83. Биосинтез мочевины. Связь орнитинового цикла с ЦТК. Происхожде¬ние атомов азота мочевины. Нарушения синтеза и выведения мочеви¬ны. Гипераммонемии.
√84. Обмен безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Синтез глюкозы из аминокислот. Синтез аминокислот из глюкозы.
√85. Трансметилирование. Метионин и S-аденозилметионин. Синтез креа¬тина, адреналина и фосфатидилхолинов.
√86. Метилирование ДНК. Представление о метилировании чужеродных и лекарственных соединений.
√87. Источники и образование одноуглеродных групп. Тетрагидрофолиевая кислота и цианкобаламин и их роль в процессах трансметилирования.
√88. Антивитамины фолиевой кислоты. Механизм действия сульфанила¬мидных препаратов.
√89. Обмен фенилаланина и тирозина. Фенилкетонурия; биохимический де¬фект, проявление болезни, методы предупреждения, диагностика и ле¬чение.
√90. Алкаптонурия и альбинизм: биохимические дефекты, при которых они развиваются. Нарушение синтеза дофамина, паркинсонизм.
√91. Декарбоксилирование аминокислот. Структура биогенных аминов (гистамин, серотонин, γ-аминомасляная кислота, катехоламины). Функции биогенных аминов.
√92. Дезаминирование и гидроксилирование биогеных аминов (как реакции обезвреживания этих соединений).
√93. Нуклеиновые кислоты, химический состав, строение. Первичная струк¬тура ДНК и РНК, связи, формирующие первичную структуру.
√94. Вторичная и третичная структура ДНК. Денатурация, ренативация ДНК. Гибридизация, видовые различия первичной структуры ДНК.
√95. РНК, химический состав, уровни структурной организации. Типы РНК, функции. Строение рибосомы.
√96. Строение хроматина и хромосомы.
√97. Распад нуклеиновых кислот. Нуклеазы пищеварительного тракта и тка¬ней. Распад пуриновых нуклеотидов.
√98. Представление о биосинтезе пуриновых нуклеотидов; начальные ста¬дии биосинтеза (от рибозо-5-фосфата до 5-фосфорибозиламина).
√99. Инозиновая кислота как предшественник адениловой и гуаниловой ки¬слот.
√100. Представление о распаде и биосинтезе пиримидиновых нуклеотидов.
√101. Нарушения обмена нуклеотидов. Подагра; применение аллопуринола для лечения подагры. Ксантинурия. Оротацидурия.
√102. Биосинтез дезоксирибонуклеотидов. Применение ингибиторов синте¬за дезоксирибонуклеотидов для лечения злокачественных опухолей.
√103. Биосинтез ДНК, субстраты, источники энергии, матрица, ферменты. Понятие о репликативном комплексе. Этапы репликации.
√104. Синтез ДНК и фазы клеточного деления. Роль циклинов и циклинзависимых протеиназ в продвижении клетки по клеточному циклу.
√105. Повреждение и репарация ДНК. Ферменты ДНК-репарирующего ком¬плекса.
√106. Биосинтез РНК. РНК полимеразы. Понятие о мозаичной структуре ге¬нов, первичном транскрипте, посттранскрипционном процессинге.
√107. Биологический код, понятия, свойства кода, коллинеарность, сигналы терминации.
√108. Роль транспортных РНК в биосинтезе белков. Биосинтез аминоацил-т-РНК. Субстратная специфичность аминоацил-т-РНК-синтетаз.
√109. Последовательность событий на рибосоме при сборке полипептидной цепи. Функционирование полирибосом. Посттрансляционный процессинг белков.
√110. Адаптивная регуляция генов у про- и эукариотов. Теория оперона. Функционирование оперонов.
√111. Понятие о клеточной дифференцировке. Изменение белкового состава клеток при дифференцировке (на примере белкового состава полипеп¬тидных цепей гемоглобина).
√112. Молекулярные механизмы генетической изменчивости. Молекуляр¬ные мутации: типы, частота, значение.
√113. Генетическая гетерогенность. Полиморфизм белков в популяции че¬ловека (варианты гемоглобина, гликозилтрансферазы, группоспецифических веществ и др).
√114. Биохимические основы возникновения и проявления наследственных болезней (разнообразие, распространение).
√115. Основные системы межклеточной коммуникации: эндокринная, паракринная, аутокринная регуляция.
√116. Роль гормонов в системе регуляции метаболизма. Клетки-мишени и клеточные рецепторы гормонов.
√117. Механизмы передачи гормональных сигналов в клетки.
√118. Классификация гормонов по химическому строению и биологическим функциям.
√119. Строение, синтез и метаболизм иодтиронинов. Влияние на обмен ве¬ществ. Изменение метаболизма при гипо- и гипертиреозе. Причины и проявление эндемического зоба.
√120. Регуляция энергетического метаболизма, роль инсулина и контринсулярных гормонов в обеспечении гомеостаза.
√121. Изменения метаболизма при сахарном диабете. Патогенез основных симптомов сахарного диабета.
√122. Патогенез поздних осложнений сахарного диабета (макро- и микроангиопатии, нефропатия, ретинопатия, катаракта). Диабетическая кома.
√123. Регуляция водно-солевого обмена. Строение и функции альдостерона и вазопрессина.
√124. Система ренин-ангиотензин-альдостерон. Биохимические механизмы возникновения почечной гипертонии, отеков, дегидратации.
√125. Роль гормонов в регуляции обмена кальция и фосфатов (паратгормон, кальцитонин). Причины и проявления гипо- и гиперпаратироидизма.
√126. Строение, биосинтез и механизм действия кальцитриола. Причины и проявление рахита.
√127. Строение и секреция кортикостероидов. Изменения катаболизма при гипо- и гиперкортицизме.
√128. Регуляция синтезами секреции гормонов по принципу обратной связи.
√129. Половые гормоны: строение, влияние на обмен веществ и функции половых желез, матки и молочных желез.
√130. Гормон роста, строение, функции.
√131. Метаболизм эндогенных и чужеродных токсических веществ: реакции микросомального окисления и реакции конъюгации с глутатионом, глюкуроновой кислотой, серной кислотой.
√132. Металлотионеин и обезвреживание ионов тяжелых металлов. Белки теплового шока.
√133. Токсичность кислорода: образование активных форм кислорода (су¬пероксид анион, перекись водорода, гидроксильный радикал).
√134. Повреждение мембран в результате перекисного окисления липидов. Механизмы защиты от токсического действия кислорода: нефермен¬тативные (витамины Е, С, глутатион и др.) и ферментативные (супероксиддисмутаза, каталаза, глутатионпероксидаза).
√135. Биотрансформация лекарственных веществ. Влияние лекарств на ферменты, участвующие в обезвреживании ксенобиотиков.
√136. Основы химического канцерогенеза. Представление о некоторых хи¬мических канцерогенах: полициклические ароматические углеводоро¬ды, ароматические амины, диоксиды, митоксины, нитрозамины.
√137. Особенности развития, строения и метаболизма эритроцитов.
√138. Транспорт кислорода и диоксида углерода кровью. Гемоглобин плода (HbF) и его физиологическое значение.
√139. Полиморфные формы гемоглобинов человека. Гемоглобинопатии. Анемические гипоксии.
√140. Биосинтез гема и его регуляция. Нарушения синтеза тема. Порфирии.
√141. Распад гема. Обезвреживание билирубина. Нарушения обмена били¬рубина—желтухи: гемолитическая, обтурационная, печеночно-клеточная. Желтуха новорожденных.
√142. Диагностическое значение определения билирубина и других желч¬ных пигментов в крови и моче.
√143. Обмен железа: всасывание, транспорт кровью, депонирование. Нару¬шение обмена железа: железодефицитная анемия, гемохроматоз.
√144. Основные белковые фракции плазмы крови и их функции. Значение их определения для диагностики заболеваний. Энзимодиагностика.
√145. Свертывающая система крови. Этапы образования фибринового сгу¬стка. Внутренний и внешний пути свертывания и их компоненты.
√146. Принципы образования и последовательность фукционирования фер¬ментных комплексов прокоагулянтного пути. Роль витамина К в свертывании крови.
√147. Основные механизмы фибринолиза. Активаторы плазминогена как тромболитические средства. Основаные антикоагулянты крови: анти¬тромбин III, макроглобулин, антиконвертин. Гемофилии.
√148. Клиническое значение биохимического анализа крови.
√149. Основные мембраны клетки и их функции. Общие свойства мембран: жидкостность, поперечная асимметрия, избирательная проницаемость.
√150. Липидный состав мембран (фосфолипиды, гликолипиды, холестерин). Роль липидов в формировании липидного бислоя.
√151. Белки мембран — интегральные, поверхностные, «заякоренные». Зна¬чение посттрансляционных модификаций в образовании функцио¬нальных мембранных белков.
√152. Механизмы переноса веществ через мембраны: простая диффузия, первично-активный транспорт (Nа+-К+-АТФаза, Са2+-АТФаза), пас¬сивный симпорт и антипорт, вторично-активный транспорт.
√153. Трансмембранная передача сигнала. Участие мембран в активации внутриклеточных регуляторных систем — аденилатциклазной и инозитолфосфатной в передаче гормонального сигнала.
√154. Коллаген: особенности аминокислотного состава, первичной и про¬странственной структуры. Роль аскорбиновой кислоты в гидоксилировании пролина и лизина.
√155. Особенности биосинтеза и созревания коллагена. Проявления недос¬таточности витамина С.
√156. Особенности строения и функции эластина.
√157. Гликозаминогликаны и протеогликаны. Строение и функции. Роль гиалуроновой кислоты в организации межклеточного матрикса.
√158. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Роль этих белков в межклеточных взаимодей¬ствиях и развитии опухолей.
√159. Структурная организация межклеточного матрикса. Изменения соеди¬нительной ткани при старении, коллагенозах. Роль коллагеназы при заживлении ран. Оксипролинурия.
√160. Важнейшие белки миофибрилл: миозин, актин, актомиозин, тропомиозин, тропонин, актинин. Молекулярная структура миофибрилл.
√161. Биохимические механизмы мышечного сокращения и расслабления. Роль градиента одновалентных ионов и ионов кальция в регуляции мышечного сокращения и расслабления.
√162. Саркоплазматические белки: миоглобин, его строение и функции. Экстрактивные вещества мышц.
√163. Особенности энергетического обмена в мышцах. Креатинфосфат.
√164. Биохимические изменения при мышечных дистрофиях и денервации мышц. Креатинурия.
√165. Химический состав нервной ткани. Миелиновые мембраны: особенно¬сти состава и структуры.
√166. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы.
√167. Биохимия возникновения и проведения нервного импульса. Молеку¬лярные механизмы синаптической передачи.
√168. Медиаторы: ацетилхолин, катехоламины, серотонин, γ-аминомаслянная кислота, глутаминовая кислота, глицин, гистамин.
√169. Нарушения обмена биогенных аминов при психических заболеваниях. Предшественники катехоламинов и ингибиторы моноаминооксидазы в лечении депрессивных состояний.
√170. Физиологически активные пептиды мозга.
Скачать: Ответы на экзамен по биохимии
Скачать: bkh_ekzamen.zip
Размер: 2,6 Mb
Скачали: 925
Дата: 4-12-2016, 18:46
- 60
- 1
- 2
- 3
- 4
- 5
Похожее
- Биохимия — Березов, КоровкинБиохимия
- Биоорганическая химия Л.В.СущинскаяБиоорганическая химия / Химия
- Биоорганическая химияБиоорганическая химия / Химия
- Занятие #5 «Эпителиальные ткани»Гистология / Презентации
- Занятие #4 «Контрольное занятие. Диагностика микропрепаратов и электроннограмм по цитологии»Гистология / Презентации
Присоединяйся
Skip to content
- Главная
- Университеты
- БашГМУ
- Теория
- Биохимия, теория
Башкирский государственный медицинский университет
- Пособия
- Схемы
- Лекции
- Ответы на вопросы
- Теория для экзамена
Пособия
Схемы
Лекции
Ответы на вопросы
Теория к экзамену
Перед отправкой формы внимательно прочитайте то, что находится под каждым из них. В противном случае, ваше обращение может не дойти до нас.
Скачай Ответы на экзамен по биохимии и еще Экзамены в формате PDF Медицинская биохимия только на Docsity! Секта свидетелей Диска — vk.com/ss_disk Ответы на экзаменационные вопросы по БИОХИМИИ Слово от автора: Буду приводить со стрелочками, потому что так удобнее учить и запоминать. Однако советую их избегать, так как каждую стрелочку придется пояснить, а оно Вам надо? Вместо этого просто опишите словами содержание данной схемы. В вопросах же в которых требуется именно схема такое не прокатит. Так же стоит писать рекции даже в тех заданиях, в которых это не требуется, мало ли. Надеюсь, мы поняли друг друга, мой дорогой читатель! (С Уважением, Ваши загадочный ГД и менее загадочный СБ, сдавшие экзамен на отлично) P.s. если у вас высокий рейтинг и не только – прорешайте тесты с одним вариантом ответов, потому что тест решает многое и вас прямо на экзамене могут освободить и поставить автомат, если у вас рейтинг выше 0,91 с условием, что вы тест на экзамене напишите на 91 балл и выше из 100. Удачи. http://biokhimija.ru/ http://efront.ysmu.ru/dlstud/userpage.php 1.Первичная структура белка. Строение полипептидной цепи (формула тетрапептида). Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин А и F, структурные и функциональные отличия. Наследственные изменения первичной структуры — молекулярные болезни (серповидно-клеточная анемия). Первичная структура белка – последовательность чередования ам-к-т в полипептидной цепи. Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке Секта свидетелей Диска — vk.com/ss_disk энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию (процесс сворачивания в 3D структуры – фолдинг). Выделяют 4 уровня пространственной организации белков. Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная, образуется между а- амино и а-карбоксильными группами. Строение полипептидной цепи (формула тетрапептида) Читается с N-конца. Зависимость свойств и конформации белков от первичной структуры. Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Тип вторичной структуры белка определяется его первичной структурой. Например, в месте расположения остатка пролина (атомы пирролидинового кольца в пролине лежат в одной плоскости) пептидная цепь делает изгиб, и водородные связи между аминокислотами не образуются. Поэтому белки с высоким содержанием пролина (например, коллаген) не способны образовывать а-спираль. Радикалы аминокислот, несущие электрический заряд, также препятствуют спирализации. Где мало пролина (т.е. наоборот) – а-спираль, т.к. ничто не препятствует сворачиванию. Даже небольшие изменения первичной структуры белка в результате генных мутаций могут значительно изменять его свойства. Это приводит к нарушению нормальной функции белка, а следовательно, к развитию заболевания. Примеры полиморфизма белков, гемоглобин А и F, структурные и функциональные отличия. Роль фетального гемоглобина в период внутриутробного развития плода. Примерами полиморфизма: • гемоглобин человека (эмбриональный, фетальный, и А гемоглобин взрослого человека) • гены миоглобина • группа протеолитических ферментов: трипсин, химотрипсин, эластаза, тромбин и некоторые другие белки и ферменты. Полиморфизм белков — существование разных форм белка, выполняющих одинаковые или очень сходные функции (изобелки). Секта свидетелей Диска — vk.com/ss_disk структура белка. Примеры строения и функционирования олигомерных белков. Конформация белковой молекулы (вторичная и третичная структуры). Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль. Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН- группы принимают участие в образованииН- группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин, кератин, коллаген. α-Спираль — жёсткая структура, имеет вид стержня. Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направлены наружу. При этом СО-группа каждого аминокислотного остатка взаимодействует с NН- группы принимают участие в образованииH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи NН- группы принимают участие в образовании — Сα становится невозможным) , а также аминокислоты с заряженными радикалами, которые электростатически или механически препятствуют формированию α-спирали. Если в пределах одного витка (примерно 4 аминокислотных остатка) находятся два таких радикала (или более), они взаимодействуют и деформируют спираль. β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно) , напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя. Секта свидетелей Диска — vk.com/ss_disk Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны. Типы внутримолекулярных связей в белках. Гидрофобные связи возникают между неполярными гидрофобными радикалами и играют важную роль в образовании третичной структуры. Водородные связи образуются между полярными (гидрофильными) незаряженными группами радикалов, имеющими подвижный атом водорода и группами с электроотрицательным атомом. Секта свидетелей Диска — vk.com/ss_disk Ионные связи образуются между полярными (гидрофильными) ионогенными радикалами, имеющими противоположно заряженные группы. Дисульфидная связь – ковалентная образуется двумя сульфгидрильными (тиольными) группами радикалов цистеина, находящимися в разных местах полипептидной цепи(инсулин, иммуноглобулины). Фибриллярные и глобулярные белки (примеры). Глобулярные белки — имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся: Альбумин — белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония. Глобулины — белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония. Гистоны — входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина. Фибриллярные белки — имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными Секта свидетелей Диска — vk.com/ss_disk 1. Хромопротеин (мономер), присутствующий в мышечной ткани и обладающий большим сродством к кислороду; 2. Молекулярная масса этого белка около 16000 Да; 3. Имеет третичную структуру; 4. Представляет собой одну полипептидную цепь, соединённую с гемом; 5. Не обладает аллостерическими свойствами; 6. Создаёт в мышцах кислородный резерв, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Гемоглобин (Hb) – 1.Хромопротеин, присутствующий в эритроцитах; 2.Молекулярная масса его составляет около 65000 Да. 3.Молекула Hb А имеет четвертичную структуру; 4.Включает четыре субъединицы — полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом); 5.Относится к аллостерическим белкам; 6. Участвует в транспорте кислорода к тканям. 5.Первичная и вторичная структуры ДНК. Правила Чаргаффа. Принцип комплементарности. Типы связей в молекуле ДНК. Биологическая роль ДНК. Молекулярные болезни — следствие генных мутаций. Первичная и вторичная структуры ДНК. Принцип комплементарности. Нуклеотидные звенья макромолекул ДНК могут содержать аденин, гуанин, цитозин и тимин. Молекулярная масса ДНК достигает десятков миллионов а.е.м. Это самые длинные из известных макромолекул. При описании строения нуклеиновых кислот учитывают различные уровни организации макромолекул: первичную и вторичную структуру. (HbA), менее активным транспортёром кислорода, но болеенапомню, как выглядят основания, а уж рибозу и фосфат только ребенок не напишет) Секта свидетелей Диска — vk.com/ss_disk Первичная структура ДНК – это нуклеотидный состав и определенная последовательность нуклеотидных звеньев в полимерной цепи. Первичная структура нуклеиновых кислот стабилизируется 3′,5′-фосфодиэфирными связями. Эти связи образуются при взаимодействии гидроксильной группы в 3′-положении пентозного остатка каждого нуклеотида с фосфатной группой соседнего нуклеотида. Таким образом, на одном конце полинуклеотидной цепи имеется свободная 5′-фосфатная группа (5′-конец), а на другом — свободная гидроксильная группа в 3′- положении (3′-конец). Нуклеотидные последовательности принято записывать в направлении от 5′-конца к 3′-концу. Вторичная структура ДНК — две параллельные неразветвленные полинуклеотидные цепи, закрученные вокруг общей оси в двойную спираль. Такая пространственная структура удерживается множеством водородных связей, образуемых азотистыми основаниями, направленными внутрь спирали. Водородные связи возникают между пуриновым основанием одной цепи и пиримидиновым основанием другой цепи. Эти основания составляют комплементарные пары. Образование водородных связей между комплементарными парами оснований обусловлено их пространственным соответствием. Водородные связи между другими парами оснований не позволяют им разместиться в структуре двойной спирали. (HbA), менее активным транспортёром кислорода, но болеена рисунке дана вторичная структура, поэтому если писать первичную, то просто не рисовать вторую цепь) Типы связей в молекуле ДНК. Биологическая роль ДНК. Первичная структура нуклеиновых кислот стабилизируется 3′,5′- фосфодиэфирными связями. Молекула ДНК построена из двух полинуклеотидных цепей, связанных между собой водородными связями и ориентированных антипараллельно (то есть 3′-конец одной цепи расположен напротив 5′-конца другой цепи и наоборот); водородные связи образуются между комплементарными парами азотистых оснований. Аденину комплементарен тимин; эта пара стабилизируется двумя водородными связями. Гуанину комплементарен цитозин; эта пара стабилизируется тремя водородными связями. Чем больше в молекуле ДНК пар Г-Ц, тем больше её устойчивость к действию высоких температур и ионизирующего излучения; Секта свидетелей Диска — vk.com/ss_disk Обе цепи ДНК закручены в спираль, имеющую общую ось. Азотистые основания обращены внутрь спирали; кроме водородных, между ними возникают также гидрофобные взаимодействия. Рибозофосфатные части расположены по периферии, образуя остов спирали Комплементарность оснований определяет комплементарность цепей в молекулах ДНК. Комплементарность полинуклеотидных цепей служит химической основой главной функции ДНК – хранения, использования и передачи наследственных признаков. Правила Чаргаффа. Соотношения, выявленные Чаргаффом для аденина (А), тимина (Т), гуанина (Г) и цитозина (Ц), оказались следующими: Количество аденина равно количеству тимина, а гуанина — цитозину. Количество пуринов равно количеству пиримидинов. ДНК, выделенные из клеток различных биологических видов, отличаются друг от друга величиной коэффициента специфичности: (Г + Ц) / (А + Т) Молекулярные болезни — следствие генных мутаций. Молекулярные болезни — это большая группа заболеваний, в основе которых лежат нарушения в структуре молекул ДНК, т.е. генные мутации. Учитывая последнее, эти заболевания называют также генными болезнями. Генные мутации по механизму развития: точковые – транзиция (замена одного пурина на другой или одного пиримидина на другой) и трансверзия (замена пурина на пиримидин или наоборот); инверсия – перестановка нуклеотидов; делеция – выпадение одного или нескольких нуклеотидов; вставка – включение одного или нескольких нуклеотидов. По физиологическому проявлению генные мутации можно подразделить на: молчащие – замена основания не меняет смысла кодона, т.к. код вырожден, например, УУУ кодирует фен и УУЦ также кодирует фен; нейтральные – замена аминокислоты на другую, близкую по строению, например, лей на иле и т.п. При этом биологическая активность белка сохраняется; патогенные – нарушение аминокислотного состава белка и его биологической активности. Это приводит к молекулярным болезням или к гибели. полезные – происходит синтез белков с новыми свойствами (эти мутации приводят к появлению нового вида). 6.Переваривание белков. Протеиназы. Механизм активации протеиназ желудочно-кишечного тракта. Специфичность (избирательность) гидролиза пептидных связей. Гниение аминокислот (белков) в толстом кишечнике. Переваривание белков. Переваривание белков, то есть расщепление их до отдельных аминокислот, начинается в желудке и заканчивается в тонком кишечнике. Секта свидетелей Диска — vk.com/ss_disk Орнитин Путресцин 7.Дезкарбоксилирование аминокислот. Образование биогенных аминов – гистамина, серотонина, ГАМК (реакции). Роль биогенных аминов в регуляции метаболизма и функций. Распад биогенных аминов. Дезкарбоксилирование аминокислот. Декарбоксилирование аминокислот – отщепление карбоксильной группы от аминокислоты с образованием СО2. Продуктами реакций декарбоксилирования аминокислот являются биогенные амины, участвующие в регуляции обмена веществ и физиологических процессов в организме. Биогенные амины и их предшественники. Аминокислота Биогенный амин Гистидин Гистамин Глутамат γ-аминомасляная кислота (ГАМК) Тирозин Дофамин Триптофан Триптамин Серотонин Цистеин Тиоэтиламин Таурин Реакции декарбоксилирования аминокислот и их производных катализируют декарбоксилазы аминокислот. Кофермент – пиридоксальфосфат (производное витамина В6). Реакции являются необратимыми. Образование биогенных аминов – гистамина, серотонина, ГАМК (реакции). Роль биогенных аминов в регуляции метаболизма и функций. Некоторые аминокислоты непосредственно подвергаются декарбоксилированию. Реакция декарбоксилирования гистидина: Секта свидетелей Диска — vk.com/ss_disk Гистамин: обладает мощным сосудорасширяющим действием, особенно капилляров в очаге воспаления; стимулирует желудочную секрецию как пепсина, так и соляной кислоты, и используется для исследования секреторной функции желудка. Реакция декарбоксилирования глутамата: ГАМК – тормозный медиатор в центральной нервной системе. Ряд аминокислот подвергается декарбоксилированию после предварительного окисления. Продукт гидроксилирования триптофана превращается в серотонин: Серотонин образуется главным образом в клетках центральной нервной системы, обладает сосудосуживающим действием. Участвует в регуляции артериального давления, температуры тела, дыхания, почечной фильтрации. Распад биогенных аминов. В органах и тканях существуют специальные механизмы, предупреждающие накопление биогенных аминов. Основной путь инактивации биогенных аминов – окислительное дезаминирование с образованием аммиака – катализируется моно- и диаминооксидазами. Секта свидетелей Диска — vk.com/ss_disk Кофермент – ФАД (флавинадениндинуклеотид) 8.Непрямое дезаминирование аминокислот (реакции). Роль глутаматдегидрогеназы и глутаминовой кислоты. Реакции трансаминирования, ферменты, биологическое значение. Реакции трансаминирования, ферменты, биологическое значение. Трансаминирование аминокислот – перенос аминогруппы (NН- группы принимают участие в образованииН2-) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования катализируют ферменты – аминотрансферазы (HbA), менее активным транспортёром кислорода, но болееили трансаминазы). Реакция легко обратима. Кофермент: пиридоксальфосфат (производное витамина В6) Роль реакций трансаминирования в организме: участие в непрямом дезаминировании аминокислот; путь синтеза заменимых аминокислот; образующиеся в реакции α-кетокислоты могут включаться в общий путь катаболизма и глюконеогенез. Секта свидетелей Диска — vk.com/ss_disk Глутамин — нейтральное нетоксичное соединение, способное легко проходить через клеточные мембраны. В виде этой аминокислоты аммиак транспортируется в крови. В крови здоровых людей содержание глутамина существенно превышает содержание других аминокислот. Глутамин, помимо участия в синтезе белка, служит источником азота в биосинтезе гистидина, глюкозамина, пуриновых и пиримидиновых нуклеотидов. С кровью глутамин поступает в печень и почки. Здесь он под действием фермента глутаминазы превращается в глутамат и аммиак. При участии аспарагиназы также происходит образование аммиака из аспарагина. Аланин является транспортной формой аммиака, которая образуется преимущественно в мышцах. При интенсивной физической нагрузке источниками аммиака служат реакции дезаминирования аминокислот и аденозинмонофосфата (АМФ). Сначала аммиак превращается в аминогруппу глутамата в реакции восстановительного аминирования, катализируемой глутаматдегидрогеназой: Кофермент: НАД+ или НАДФ+ (производные витамина РР) Аллостерический, активаторы: АДФ и ГДФ; ингибиторы: АТФ, ГТФ и НАДН. (HbA), менее активным транспортёром кислорода, но болееменя терзают сомнения, потому что при повороте этой реакции вспядь активаторы и ингибиторы должны оказывать противоположное действие…) Образовавшийся глутамат переносит затем свою α-аминогруппу на пируват, всегда имеющийся в достаточном количестве, поскольку это продукт протекающего в мышцах гликолиза. Реакция катализируется аланинаминотрансферазой (привожу реакцию, ее надо будет написать наоборот, т.е. Глутамат + Пируват —— α-Кетоглутарат + Аланин). Секта свидетелей Диска — vk.com/ss_disk Кофермент: пиридоксальфосфат (производное витамина В6) Аланин (нейтральная аминокислота, не несущая суммарного заряда при значениях рН, близких к 7) выходит из клеток и доставляется кровью к печени. Здесь он под действием аланинаминотрансферазы передаёт свою аминогруппу α-кетоглутарату, в результате чего образуется глутамат. Кофермент: пиридоксальфосфат (производное витамина В6) Далее в реакции, катализируемой глутаматдегидрогеназой, глутамат дезаминируется с образованием α-кетоглутарата и аммиака, который в печени превращается в мочевину. 10. Биосинтез мочевины. Реакции синтеза мочевины, биологическая роль. Связь орнитинового цикла с превращениями фумаровой и аспарагиновой кислот. Причины гипераммониемии. Уремия, как следствие нарушения выведения мочевины из организма. Биосинтез мочевины Биосинтез мочевины – основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени. Эту последовательность реакций открыли Х.Кребс и К.Хензелейт в 1932 г. Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций. Реакции синтеза мочевины, биологическая роль. Две начальные реакции биосинтеза мочевины происходят в митохондриях клеток печени. Секта свидетелей Диска — К.сот/з$_91$К
1. МНз + С02 +2 АТФ
————
карбамоилфосфат-
синтетаза
МНЬ
с=о
`О-РОЗН2
карбамоил-
фосфат
+ 2 АДФ + Фн
Аллостерический активатор: М№-ацетил-глутамат
2 Нам ©
Е мн ‘<
СН2 В
МН СН —_—_ь о,
с=о = а орнитин-карбамоил- сна Фн
“о-Розн 12 трансфераза 1
СНАМН2 СН
карбамоил- | 1
фосфат соон ен
орнитин соон
цитруллин
Последующие реакции протекают в цитоплазме клеток печени.
3. Нм © МН
Е 6-н-—сн—соон
я Фоон Мн СН» соон
С 1 т дню
с 0% ая бы
Га и СН + НаР207
ТИ сн—мн»
соон соон
цитруллин аргинино-
сукцинат
4. МН МН М>
С-м—сн—соон й
в СН>-соОн ВН
с СН? $ сн—соон
< =
СН2 лиаза сна
СН-МНо СН На
соон соон
аргинино- аргинин
сукцинат
Секта свидетелей Диска — vk.com/ss_disk 12. Обмен фенилаланина и тирозина. Использование тирозина для синтеза катехоламинов, тироксина, меланинов. Распад фенилаланина до конечных метаболитов ЦТК. Наследственные нарушения обмена фенилаланина и тирозина (альбинизм, алкаптонурия, фенилкетонурия). Обмен фенилаланина и тирозина. Распад фенилаланина до конечных метаболитов ЦТК (HbA), менее активным транспортёром кислорода, но болееесли имеются в виду СО2 и Н2О тогда Секта свидетелей Диска — vk.com/ss_disk дела обстоят намного хуже и придется ацетил-КоА и ЩУК прогнать по ЦТК) Известен ряд врождённых нарушений обмена фенилаланина и тирозина. Фенилкетонурия – врождённое нарушение процесса гидроксилирования фенилаланина до тирозина. Заболевание чаще всего вызвано отсутствием или недостатком фермента фенилаланингидроксилазы (цифра 1), реже — нарушением образования тетрагидробиоптерина. Ранними симптомами фенилкетонурии являются: повышенная возбудимость и двигательная активность, рвота и трудности вскармливания, с 3 – 5-го месяца нарушается интеллектуальное развитие, исчезает реакция на окружающее. Со временем у детей появляются судороги. Волосы и глаза обычно менее пигментированы, чем у других членов семьи. При отсутствии лечения продолжительность жизни больных составляет 20 — 30 лет. Биохимическая основа фенилкетонурии – накопление фенилаланина в организме. Высокая концентрация аминокислоты стимулирует выработку фермента, превращающего фенилаланин в фенилпируват (HbA), менее активным транспортёром кислорода, но болееальтернативный путь обмена ФЕН). Путём восстановления фенилпируват переходит в фениллактат, а путём декарбоксилирования – в фенилацетат. Эти Секта свидетелей Диска — vk.com/ss_disk продукты наряду с фенилаланином в существенных количествах обнаруживаются в моче больных. Лечение больных фенилкетонурией основано на ограничении поступления фенилаланина в организм и снижения концентрации этой аминокислоты в плазме. Алкаптонурия – врожденное нарушение обмена фенилаланина, вызванное отсутствием фермента оксидазы гомогентизиновой кислоты (цифра 2). Это приводит к нарушению образования малеилацетоацетата, расщепляющегося далее до фумарата и ацетоацетата. В раннем детском возрасте единственным проявлением дефицита фермента является изменение окраски мочи. Гомогентизиновая кислота секретируется в просвет канальцев и в значительном количестве выводится с мочой. На воздухе она окисляется, а затем полимеризуется в окрашенное соединение, которое окрашивает пелёнки в чёрный цвет. Экскреция гомогентизиновой кислоты зависит от содержания фенилаланина и тирозина в пище. Следствием накопления гомогентизиновой кислоты в организме является охроноз — шиферно-голубой оттенок ушного и носового хрящей, вызванный накоплением в них пигмента. Развитие охроноза можно предотвратить, если с раннего возраста ограничивать поступление с пищей фенилаланина и тирозина. Альбинизм развивается при отсутствии в пигментных клетках фермента тирозиназы (цифра 3), которая участвует в образовании меланина. В результате волосы, кожа и глаза больного лишены этого пигмента. При альбинизме наблюдается повышение чувствительности к солнечным лучам и некоторое нарушения зрения. Использование тирозина для синтеза катехоламинов, тироксина, меланинов (HbA), менее активным транспортёром кислорода, но болеесхемы, схемы, схемы… Ну вот последняя конечно дебильная, но если ее объяснить словами, то покатит и так, а первую придется воспроизвести) Секта свидетелей Диска — vk.com/ss_disk Роль реакции превращения серина в глицин состоит в образовании активной формы тетрагидрофолиевой кислоты – NН- группы принимают участие в образовании5, NН- группы принимают участие в образовании10-метилен-ТГФК. Главную роль в реакциях обмена серина и глицина играют ферменты, в состав которых в качестве кофермента входит тетрагидрофолиевая кислота (ТГФК). ТГФК образуется в организме в результате восстановления фолиевой кислоты (витамина Вс). Реакционноспособными центрами в молекуле ТГФК являются атомы азота в положениях 5 и 10. Атомы водорода при NН- группы принимают участие в образовании5 и NН- группы принимают участие в образовании10 могут замещаться на различные одноуглеродные группы: метильную (-СН3), метиленовую (- СН2-), метенильную (=СН-), формильную (-СН=О) и некоторые другие. Основными источниками одноуглеродных групп в клетке служат серин и глицин. 5,10-Метилен-ТГФК: используется как донор метильной группы в реакциях биосинтеза тимидилового нуклеотида. 5,10-метенил-ТГФК и 10-формил-ТГФК (образуются при окислении 5,10-метилен-ТГФК): служат источниками атомов углерода в процессе биосинтеза пуриновых нуклеотидов (аденилового и гуанилового). 5-метил-ТГФК (образуется при восстановлении 5,10-метилен- ТГФК): поставляет метильную группу для регенерации метионина из гомоцистеина. 15. Строение и биологическая роль нуклеотидов (формула мононуклеотида) Секта свидетелей Диска — vk.com/ss_disk Нуклеиновыми кислотами или полинуклеотидами называются высокомолекулярные вещества, состоящие из нуклеотидов, соединённых в цепь 3′, 5′-фосфодиэфирными связями. Каждый нуклеотид состоит из азотистого основания, углевода (пентозы) и остатка фосфорной кислоты. Углеводы представлены рибозой и дезоксирибозой: Азотистое основание и пентоза, соединённые NН- группы принимают участие в образовании-гликозидной связью, образуют нуклеозид. Если в качестве пентозы в нуклеозиде присутствует рибоза, то это рибонуклеозид, а если дезоксирибоза — то это дезоксирибонуклеозид. Нуклеотиды представляют собой фосфорилированные нуклеозиды. Остаток фосфорной кислоты, как правило, присоединяется к гидроксильной группе пентозы в 5′-положении при помощи сложноэфирной связи. Минорные основания присутствуют в составе некоторых разновидностей рибонуклеиновых кислот. Роль этих оснований заключается, очевидно, в защите молекулы нуклеиновой кислоты от действия гидролитических ферментов Биологическая роль минорных азотистых оснований: • необходимы для формирования вторичной структуры НК (например, формирования петель в тРНК), • выполняют защитную функцию (например, метилированные участки в мРНК), • метилированные участки могут выполнять роль маркеров, по которым специальные регуляторные белки распознают участки повреждения в ДНК, участки начала матричных синтезов. Биологическая роль нуклеотидов: • Мономер ДНК и РНК. • Форма запасания энергии в клетке (например, АТФ, ГТФ). • Источник фосфатной группы (например, при фосфорилировании глюкозы). • Коферментная функция (НАД, НАДФ, ФАД). Секта свидетелей Диска — vk.com/ss_disk • Могут служить активаторами ферментов (это, в основном характерно для цАМФ и цГМФ) 16. Синтез гема и гемоглобина. Раекции синтеза гема до образования порфобилиногена. Распад гемоглобина, обмен желчных пигментов. Нарушения обмена желчных пигментов. Значение определения пигментов в диагностике желтух. Синтез гема и гемоглобина. Раекции синтеза гема до образования порфобилиногена. Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах — для образования цитохрома Р450. Исходными веществами в этом метаболическом пути являются аминокислота глицин и метаболит цикла Кребса сукцинил-КоА. Синтез происходит в ретикулоцитах (незрелых эритроцитах, содержащих клеточное ядро). Реакции идут в митохондриях и цитоплазме клеток. δ-аминолевулинат-синтаза: Кофакторы: пиридоксаль-5-фосфат и ионы Mg2+; Аллостерический ингибитор: гем, гемоглобин; δ-аминолевулинат-дегидратаза: Аллостерический ингибитор: гем, гемоглобин; Феррохелатаза: Секта свидетелей Диска — vk.com/ss_disk (гемолитическая), печёночная (паренхиматозная), подпечёночная (обтурационная или механическая). Надпечёночная (гемолитическая) желтуха вызвана массивным распадом эритроцитов в результате резус-конфликта, попадания в кровь веществ, вызывающих разрушение мембран эритроцитов и некоторых других заболеваниях. При этой форме желтухи: в крови повышено содержание непрямого билирубина; в моче повышено содержание стеркобилина, билирубин отсутствует; в кале повышено содержание стеркобилина. Печёночная (паренхиматозная) желтуха вызвана повреждением клеток печени при инфекциях и интоксикациях. При этой форме желтухи: в крови повышено содержание непрямого и прямого билирубина; в моче повышено содержание уробилина, присутствует билирубин; в кале понижено содержание стеркобилина. Подпечёночная (обтурационная) желтуха вызвана нарушением оттока желчи, например, при закупорке желчевыводящего протока камнем. При этой форме желтухи: в крови повышено содержание прямого билирубина (иногда и непрямого); в моче отсутствует стеркобилин, присутствует билирубин; в кале понижено содержание стеркобилина. (HbA), менее активным транспортёром кислорода, но болееЧисто теоретически, новорожденными занимаются кто? Педиатры и акушеры, правильно. Но акушеры нас интересуют мало. Поэтому все кроме педиатров смело переходят к следующему вопросу) Условно физиологическая желтуха новорождённых развивается у большинства здоровых новорождённых в первые дни после рождения и продолжается около двух недель. При различных заболеваниях, возникающих у новорождённых, а также у недоношенных детей желтушный период затягивается. Увеличение длительности гипербилирубинемии может привести к серьёзным последствиям: накоплению билирубина в ткани мозга (ядерная желтуха). Повышению содержания билирубина в крови новорождённых могут способствовать следующие особенности обмена веществ в их организме: замена фетального гемоглобина на гемоглобин А. В первые дни после рождения усиливается гемолиз эритроцитов, содержващих Секта свидетелей Диска — vk.com/ss_disk HbF; образуются новые эритроциты, содержащие HbA. HbF подвергается катаболизму; образуется значительное количество билирубина; отвлечение альбуминов плазмы для транспорта жирных кислот. Содержание углеводов в организме новорождённых сравнительно невелико; основным энергетическим субстратом являются жирные кислоты, концентрация которых в крови повышается, жирные кислоты транспортируются в комплексе с альбуминами; низкая активность глюкуронилтрансферазы в ткани печени. Замедление процессов конъюгации билирубина в печени затрудняет его выведение в кишечник; стерильность кишечника. В кишечнике новорождённого отсутствует микрофлора, поэтому билирубин не превращается в стеркобилиноген и может происходить его обратное всасывание в кровоток. 17. Биосинтез пуриновых нуклеотидов. Происхождение атомов N и C пуринового кольца. Резервные пути биосинтеза пуриновых нуклеотидов. Распад пуриновых нуклеотидов. Нарушения обмена пуринов. (HbA), менее активным транспортёром кислорода, но болеевопрос просто [censured] какой объемный, поэтому тут я привожу схемы и форулы, и объяснения реакций. Выбирайте что вам кажется более удобным) Биосинтез пуриновых нуклеотидов. 1. Синтез 5′-фосфорибозиламина Ключевым соединением в биосинтезе как пуриновых, так и пиримидиновых нуклеотидов является 5-фосфорибозил-1- пирофосфат (ФРПФ). Это соединение участвует также в синтезе коферментов НАД+ и НАДФ+. ФРПФ образуется при взаимодействии рибозо-5-фосфата и АТФ. Источниками рибозофосфата служат пентозофосфатный путь и распад нуклеотидов. Катализирует реакцию фермент ФРПФ-синтаза. ФРПФ-синтаза: Аллостерические эффеторы: концентрация неорганического фосфата; концентрация АМФ, ГМФ и ИМФ. Секта свидетелей Диска — vk.com/ss_disk ФРПФ-амидотрансфераза: Аллостерические ингибиторы: АМФ и ГМФ по принципу обратной связи Происхождение атомов N и C пуринового кольца. 2. Синтез инозинмонофосфата 5-фосфорибозиламин вовлекается в девять реакций, и в результате образуется первый пуриновый нуклеотид – инозинмонофосфорная кислота (ИМФ). В этих реакциях источниками атомов пуринового кольца являются глицин, аспартат, еще одна молекула глутамина, углекислый газ и производные тетрагидрофолиевой кислоты (ТГФК). В целом на синтез пуринового кольца затрачивается энергия 6 молекул АТФ. 3. Синтез аденозинмонофосфата и гуанозинмонофосфата Гуанозинмонофосфат (ГМФ) образуется в двух реакциях – сначала он окисляется ИМФ-дегидрогеназой до ксантозилмонофосфата, источником кислорода является вода, акцептором водорода – НАД. После этого работает ГМФ-синтетаза, она использует универсальный клеточный донор NН- группы принимают участие в образованииH2-групп – глутамин, источником энергии для реакции служит АТФ. Аденозинмонофосфат (АМФ) также образуется в двух реакциях, но в качестве донора NН- группы принимают участие в образованииH2-группы выступает аспарагиновая кислота. В первой, аденилосукцинат-синтетазной, реакции на присоединение аспартата используется энергия распада ГТФ, во второй реакции аденилосукцинат-лиаза производит удаление части аспарагиновой кислоты в виде фумарата. Короче, если вы ничего не поняли – смотрим схему и вникаем Секта свидетелей Диска — vk.com/ss_disk Реакции распада пуринов можно условно разделить на 5 стадий: 1. Дефосфорилирование АМФ и ГМФ – фермент 5′-нуклеотидаза. 2. Гидролитическое отщепление аминогрупы от С6 в аденозине – фермент дезаминаза. Образуется инозин. 3. Удаление рибозы от инозина (с образованием гипоксантина) и гуанозина (с образованием гуанина) с ее одновременным фосфорилированием – фермент нуклеозидфосфорилаза. 4. Окисление С2 пуринового кольца: гипоксантин при этом окисляется до ксантина (фермент ксантиноксидаза), гуанин дезаминируется до ксантина – фермент дезаминаза. Секта свидетелей Диска — vk.com/ss_disk 5. Окисление С8 в ксантине с образованием мочевой кислоты – фермент ксантиноксидаза. Около 20% мочевой кислоты удаляется с желчью через кишечник, где она разрушается микрофлорой до CO2 и воды. Остальная часть удаляется через почки. Нарушения обмена пуринов. В зависимости от длительности и тяжести гиперурикемия проявляется: Появление тофусов (греч. tophus – пористый камень, туф) – отложение уратных кристаллов в коже и подкожных слоях, в мелких суставах ног и рук, в сухожилиях, хрящах, костях и мышцах. Нефропатии в результате кристаллизации мочевой кислоты с поражением почечных канальцев и мочекаменная болезнь. Подагра – поражение мелких суставов. Подагра В крови мочевая кислота находится в форме ее солей – уратов натрия. Из-за низкой растворимости ураты способны оседать в зонах с пониженной температурой, например, в мелких суставах стоп и пальцев ног. Накапливающиеся в межклеточном веществе ураты некоторое время фагоцитируются, но фагоциты не способны разрушить пуриновое кольцо. В результате это приводит к гибели самих фагоцитов, к выходу лизосомальных ферментов, активации свободнорадикального окисления и развитию острой воспалительной реакции – развивается подагрический артрит. В 50-75% случаев первым признаком заболевания является мучительная ночная боль в больших пальцах ног. Основная причина: изменению активности ферментов метаболизма пуринов: увеличение активности ФРДФ-синтетазы – приводит к избыточному синтезу пуринов, уменьшение активности гипоксантин-гуанин-фосфорибозил- трансферазы – из-за этого ФРДФ не используется для реутилизации пуриновых оснований, а участвует в первой реакции их синтеза. В результате возрастает количество разрушающихся пуринов и одновременно повышается их образование. Оба ферментативных нарушения рецессивны и сцеплены с X- хромосомой. Подагрой страдает 0,3-1,7% взрослого населения земного шара, соотношение заболевших мужчин и женщин составляет 20: 1. Мочекаменная болезнь Мочекаменная болезнь заключается в образовании солевых кристаллов (камней) разной природы в мочевыводящих путях. Непосредственно образование мочекислых камней составляет около 15% от Секта свидетелей Диска — vk.com/ss_disk всех случаев этой болезни. Мочекислые камни в мочевыводящих путях откладываются примерно у половины больных подагрой. Причиной отложения кристаллов мочевой кислоты является гиперурикемия; повышенное выведение уратов натрия с мочой. увеличение кислотности мочи. При понижении рН мочи ниже 5,75 ураты (енольная форма) переходят в менее растворимую кетоформу и кристаллизуются в почечных канальцах. Синдром Леша-Нихана Болезнь Леша-Нихана (частота 1:300000) – это полное врожденное отсутствие активности гипоксантин-гуанин-фосфорибозил-трансферазы, фермента, отвечающего за реутилизацию пуриновых оснований. Признак рецессивный и сцеплен с Х-хромосомой. Впервые его описали в 1964 г в США студент-медик Майкл Леш и педиатр Уильям Нихан. Дети рождаются клинически нормальными, только к 4-6 месяцу обнаруживаются отклонения в развитии, а именно – отставание физического развития, повышенная возбудимость, рвота, периодическое повышение температуры. Выделение мочевой кислоты можно обнаружить еще раньше по оранжевой окраске пеленок. К концу первого года жизни симптомы нарастают, развивается нарушение координации движений, хореоатетоз, корковый паралич, спазм мышц ног. Наиболее характерный признак заболевания проявляется на 2-3-м году жизни – аутоагрессия или самокалечение – неодолимое стремление детей кусать себе губы, язык, суставы пальцев на руках и ногах. Гликогеноз I типа или болезнь Гирке (дефицит глюкозо-6- фосфатазы) Сопровождается повышением активности пентозофосфатного пути и приводит к повышению внутриклеточного уровня рибозо-5-фосфата, из которого синтезируется ФРПФ. Повышенный уровень ФРПФ приводит к увеличению синтеза пуринов de novo. Для данного заболевания характерен также лактатный ацидоз, приводящий к повышению порога секреции уратов почками; это способствует накоплению уратов в организме. Гипоурикемия (снижение содержания мочевой кислоты в крови). Может быть связана с понижением реабсорбции уратов из клубочкового фильтрата в почках. В этом случае наблюдается увеличение экскреции мочевой кислоты с мочой. Развивается и при недостаточности ксантиноксидазы, возникающей при генетическом дефекте фермента или при тяжёлом поражении печени. Это состояние сопровождается повышенной экскрецией гипоксантина и Секта свидетелей Диска — vk.com/ss_disk Функция рибосом. В процессе функционирования рибосомы осуществляет несколько функций: 1) специфическое связывание и удержание компонентов белоксинтезирующей системы [информационная, или матричная, РНК (иРНК): аминоацил-тРНК; пептидил-тРНК; гуанозинтрифосфат (ГТФ); белковые факторы трансляции EF — Т и EF — G]; 2) каталитические функции (образование пептидной связи, гидролиз ГТФ); 3) функции механического перемещения субстратов (иРНК, тРНК), или транслокации. Функции связывания (удержания) компонентов и катализа распределены между двумя рибосомными субчастицами. Адапторная функция тРНК и роль мРНК в синтезе белка. Аминокислоты и триплеты нуклеотидов, кодирующие их, не комплементарны друг другу. Поэтому должны существовать молекулы- адапторы, каждая из которых может взаимодействовать как с определённым кодоном, так и с соответствующей аминокислотой. Такими молекулами являются транспортные РНК. Каждая тРНК содержит триплет нуклеотидов – антикодон, который комплементарен строго определённому кодону мРНК. 3’-конец тРНК (акцепторный участок) является местом присоединения аминокислоты, соответствующей кодону мРНК. Молекулы иРНК могут содержать от 300 до 3 тыс. рибонуклеотидов и имеют линейную структуру. Являются посредником между ДНК и полипептидом. В процессе синтеза молекулы иРНК с молекулы ДНК переписывается информация о структуре полипептида. Далее молекулы иРНК переносят эту информацию из ядра в цитоплазму к рибосомам, где и происходит синтез полипептида. иРНК составляет ~ 0,5–1 % массы всех РНК клетки. Секта свидетелей Диска — vk.com/ss_disk 19. Биосинтез ДНК (репликация) и мРНК (транскрипция). Процессы «созревания» первичного транскрипта при образовании мРНК. Биосинтез ДНК (репликация) и мРНК (транскрипция). Репликация – процесс самоудвоения ДНК, или биосинтез дочерней молекулы ДНК, полностью идентичной исходной молекуле (матрице). Локализация процесса – клеточное ядро. Основные принципы репликации ДНК: комплементарность — синтезируемые цепи комплементарны матрице; антипараллельность — 5′-конец синтезируемой полинуклеотидной цепи находится напротив 3′-конца матрицы и наоборот; униполярность — синтез полинуклеотидных цепей происходит всегда в направлении 5′ — 3′; потребность в затравке — ферменты, синтезирующие ДНК, способны лишь наращивать существующую полинуклеотидную цепь, поэтому вначале синтезируется короткая цепь РНК (затравка или праймер), к которой присоединяются дезоксирибонуклеотиды; выполнившая свою роль РНК- затравка удаляется; прерывистость — одна из дочерних цепей (лидирующая) в процессе репликации растёт непрерывно, а другая (отстающая) — в виде фрагментов длиной в несколько сот нуклеотидов (фрагментов Оказаки); полуконсервативность — в результате репликации образуются две двойные дочерние ДНК, каждая из которых сохраняет (консервирует) в неизменном виде одну из половин материнской ДНК Транскрипция – биосинтез РНК на матрице ДНК. Процесс транскрипции также происходит в клеточном ядре. Основные принципы транскрипции: комплементарность — синтезируемые цепи комплементарны матрице; антипараллельность — 5′-конец синтезируемой полинуклеотидной цепи находится напротив 3′-конца матрицы и наоборот; униполярность — синтез полинуклеотидных цепей происходит всегда в направлении 5′ — 3′; беззатравочность — биосинтез РНК не требует наличия праймера; асимметричность — синтез дочерней цепи идёт только на одной цепи ДНК-матрицы, вторая при этом блокирована. Условия, необходимые для транскрипции: Матрица – участок одной из цепей ДНК; Секта свидетелей Диска — vk.com/ss_disk ДНК-зависимая РНК-полимераза – главный фермент, участвующий в транскрипции. Место присоединения фермента к ДНК – промотор; Субстраты и источники энергии – рибонуклеозидтрифосфаты (АТФ, ГТФ, УТФ, ЦТФ). Связываются с азотистыми основаниями транскрибируемой цепи ДНК водородными связями по принципу комплементарности. При участии ДНК-зависимой РНК-полимеразы образуются 3’,5’- фосфодиэфирные связи. Направление полимеризации цепи РНК – от 5’- конца к 3’-концу. Сигналом к окончанию транскрипции служат терминирующие последовательности нуклеотидов. В результате образуются первичные транскрипты – предшественники мРНК, тРНК и рРНК. Процессы «созревания» первичного транскрипта при образовании мРНК. Процессинг мРНК включает: вырезание неинформативных участков – интронов; сращивание (сплайсинг) информативных участков – экзонов; защиту концевых участков от действия нуклеаз: присоединение 7-метилгуанилата («колпачок») к 5’-концу 5’,5’- фосфодиэфирной связью; присоединение полиаденилового нуклеотида к 3’-концу. 20. Биосинтез белков. Генетический код. Последовательность реакций при синтезе полипептидной цепи (инициация, элонгация, терминация) в процессе трансляции на рибосомах. Посттрансляционная модификация молекул белков. Биосинтез белка — сложный многостадийный процесс синтеза полипептидной цепи из аминокислот, происходящий на рибосомах с участием молекул мРНК и тРНК. Процесс биосинтеза белка требует значительных затрат энергии. Генетический код. Генетический код – последовательность нуклеотидов, соответствующая определённым аминокислотам. Генетический код характеризуется свойствами: код триплетный – каждой аминокислоте соответствует тройка (триплет) нуклеотидов – кодон. Всего существует 43 = 64 кодона. Из них 61 является смысловым (то есть кодирует определённую аминокислоту) и 3 – бессмысленными (терминирующими); код неперекрывающийся – один и тот же нуклеотид ДНК или РНК не может принадлежать одновременно двум соседним кодонам; код непрерывный – отсутствуют «знаки препинания», вставки между кодонами в полинуклеотидной цепи; код вырожденный (множественный) – некоторые аминокислоты могут кодироваться более, чем одним триплетом нуклеотидов (так как кодонов 61, а аминокислот – 20); Секта свидетелей Диска — vk.com/ss_disk Индукция и репрессия синтеза в организме человека. Существуют два механизма регуляции синтеза белка – индукция и репрессия. Примером оперона, который регулируется по механизму индукции, является лактозный оперон, в состав которого наряду с геном- оператором входят 3 структурных гена, кодирующие ферменты катаболизма лактозы. Лактоза является индуктором данного оперона. При высокой концентрации лактозы в среде ферменты синтезируются, при низкой концентрации – нет. По механизму репрессии регулируется гистидиновый оперон, содержащий ген-оператор и 10 структурных генов, кодирующих ферменты, необходимые для биосинтеза гистидина. Гистидин является корепрессором данного оперона. При высокой концентрации гистидина в среде синтез ферментов прекращается, при отсутствии гистидина они синтезируются. Роль гормонов в регуляции действия генов. Особенностью регуляции транскрипции у эукариот является подчиненность этих процессов регулирующим влияниям со стороны гормонов организма. Последние часто играют роль индукторов транскрипции. Так, некоторые стероидные гормоны обратимо связываются особыми белками-рецепторами, образуя с ними комплексы. Активированный гормоном рецептор приобретает способность соединяться со специфическими участками хроматина, ответственными за регуляцию активности генов, в которых рецепторы узнают определенные последовательности ДНК. Примером участия гормонов в регуляции активности определенных генов может служить влияние тестостерона на развитие тканей организма по мужскому типу при наличии специфического белка-рецептора. Отсутствие последнего при мутации соответствующего гена не дает возможности гормону проникнуть в ядра клеток-мишеней и обеспечить включение определенного набора генов: развивается синдром тестикулярной феминизации, или синдром Морриса Ингибиторы матричных синтезов — антибиотики, интерфероны. Биосинтез белка является одним из наиболее сложных процессов, протекающих в клетках. Его прерывание или извращение возможно в результате нарушения любого из трёх матричных синтезов. Так, мутагены (бенз(а)пирен, линдан) нарушают репликацию ДНК и таким образом прерывают белоксинтезирующие процессы. Некоторые токсические вещества (госсипол) могут изменять скорость транскрипции. К Секта свидетелей Диска — vk.com/ss_disk лекарственным веществам, влияющим на биосинтез белка, относятся антибиотики и интерфероны. Антибиотики, блокирующие матричные биосинтезы, используются в лечении инфекционных заболеваний и злокачественных опухолей. Антибиотики, ингибирующие матричные биосинтезы Противоопухолевые препараты: актиномицин Д, рубомицин С, митомицин С Механизм действия: подавляют репликацию или транскрипцию, или оба эти процесса Противобактериальные препараты: тетрациклин, левомицетин, эритромицин, стрептомицин Механизм действия: ингибируют трансляцию в бактериальных (но не эукариотических) клетках Интерфероны — небольшие белки (гликопротеины), состоящие примерно из 160 аминокислотных остатков. Исследование механизма действия интерферонов показало, что они: ингибируют синтез белков, необходимых для репликации вирусов; стимулируют синтез фермента, катализирующего образование небольших количеств коротких олигоаденилатов: которые, являются активаторами рибонуклеазы — фермента, расщепляющего матричные и рибосомные РНК В результате синтез всех белков в инфицированных клетках прекращается. Клетки погибают, но вместе с ними останавливается размножение вирусов, и начинается выздоровление. Таким образом, жертвуя небольшим количеством клеток, организм защищает себя от болезни. 22. Роль печени в азотистом обмене. Пути использования фонда аминокислот в печени. Роль печени в азотистом обмене. Печень является органом, регулирующим поступление азотистых веществ в организм и их выведение. В периферических тканях постоянно протекают реакции биосинтеза с использованием свободных аминокислот, либо выделение их в кровь при распаде тканевых белков. Несмотря на это, уровень белков и свободных аминокислот в плазме крови остаётся постоянным. Это происходит благодаря тому, что в клетках печени имеется уникальный набор ферментов, катализирующих специфические реакции обмена белков. Аминокислоты подвергаются катаболическим реакциям с трансаминированием и дезаминированием, декарбоксилированию с образованием биогенных аминов. Происходят реакции синтеза холина и креатина благодаря переносу метильной группы от аденозилметионина. В печени идет утилизация избыточного азота и включение его в состав мочевины. Пути использования фонда аминокислот в печени. После приёма белковой пищи в клетки печени по воротной вене поступает большое количество аминокислот. Эти соединения могут Секта свидетелей Диска — vk.com/ss_disk претерпевать в печени ряд превращений, прежде чем поступить в общий кровоток. К этим реакциям относятся: использование аминокислот для синтеза белков; трансаминирование — путь синтеза заменимых аминокислот; осуществляет также взаимосвязь обмена аминокислот с глюконеогенезом и общим путём катаболизма; дезаминирование — образование α-кетокислот и аммиака; синтез мочевины — путь обезвреживания аммиака; синтез небелковых азотсодержащих веществ (холина, креатина, никотинамида, нуклеотидов и т.д.). В клетках печени синтезируются многие белки плазмы крови: альбумины (около 12 г в сутки), большинство α- и β-глобулинов, в том числе транспортные белки (ферритин, церулоплазмин, транскортин, ретинолсвязывающий белок и др.). Многие факторы свёртывания крови (фибриноген, протромбин, проконвертин, проакцелерин и др.) также синтезируются в печени. 23. Биологическая ценность пищевых белков. Количество и качество белков в питании человека. Заменимые и незаменимые аминокислоты. Комбинирование пищевых продуктов, взаимодополняющих по аминокислотному составу. В реальности нормы потребления белка устанавливаются, исходя из представлений о белковом составе пищевых продуктов, о соотношении полноценных и неполноценных белков в рационе. В России нормы суточного поступления пищевого белка установлены для взрослых на уровне 100-120 г (HbA), менее активным транспортёром кислорода, но болеепиздежжжж, ибо должно быть 1г/ 1кг тела); для детей 1 года жизни – 2-3 г на кг веса тела, у старших детей – около 1,5-2 г/кг веса. Животных белков должно быть не менее 60% от общего количества. Секта свидетелей Диска — vk.com/ss_disk Специфичность действия ферментов. Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента. 1. Стереоспецифичность – катализ только одного из стереоизомеров, например: специфичность к L- или D-аминокислотам – например, почти все ферменты человека взаимодействуют с L-аминокислотами, специфичность к цис- и трансизомерам. Например, аспартаза реагирует только с трансизомером – фумаровой кислотой, но не с малеатом (цис-изомер). 2. Абсолютная специфичность – фермент производит катализ только одного вещества. 3. Относительная групповая специфичность – превращение субстратов с некоторыми общими признаками. Например, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000. Механизмы специфичности В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы: 1. Теория Фишера (модель «жесткой матрицы», «ключ-замок») – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую. Секта свидетелей Диска — vk.com/ss_disk 2. Теория Кошланда (модель «индуцированного соответствия», «рука- перчатка») – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата. Классификация ферментов. В 1961 г в Москве V Международный биохимический союз принял современную классификацию ферментов. В соответствии с этой классификацией все ферменты делятся: на классы – по типу катализируемой реакции, каждый класс подразделяется на подклассы – по природе атакуемой химической группы, подклассы делятся на подподклассы – по характеру атакуемой связи или по природе акцептора. Выделяют 6 классов ферментов: I класс – Оксидоредуктазы — ускоряют реакции окисления — восстановления. Окисление процесс отнятия атомов Н (электронов) от субстрата, а восстановление — как присоединение атомов Н (электронов) к акцептору. Примеры подклассов: окисляющие СН-ОН-группы, альдегидные или кетогруппы, СН-СН группы, СН-NН-группы, SН- группы, действующие на пероксид водорода в качестве акцептора, действующие на пару доноров с включением молекулярного кислорода (монооксигеназы), действующие на один донор с включением молекулярного кислорода (диоксигеназы). II класс – Трансферазы— ускоряют реакции переноса функциональных групп и молекулярных остатков. Примеры подклассов: переносящие одноуглеродные группы (метилтрансферазы), остатки карбоновых кислот (ацилтрансферазы), переносящие гликозильные остатки (гликозилтрансферазы) азотистые группы (аминотрасферазы), фосфатные группы (фофсфотрансферазы, киназы (в качестве донора фасфата — АТФ). III класс – Гидролазы — ускоряют реакции гидролитического распада (с использованием воды). Примеры подклассов: действующие на Секта свидетелей Диска — vk.com/ss_disk сложноэфирные связи (эстеразы), гликозидные связи (гликозидазы), пептидные связи (пептидазы), непептидные С-NН- группы принимают участие в образовании- связи (амилазы). IV класс – Лиазы — ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи). Примеры подклассов: углерод-углерод-лиазы, углерод-азот-лиазы, углерод-кислород- лиазы, углерод-сера-лиазы. V класс – Изомеразы — ускоряют пространственные или структурные перестройки в пределах одной молекулы. Примеры подклассов: рацемазы (на субстраты с одним ассиметрическим атомом) и эпимеразы (с несколькими ассиметрическими атомами), цис-транс- изомеразы, внутримолекулярные оксидоредуктазы, внутримолекулярные трансферазы. VI класс – Лигазы — ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей. Примеры подклассов: образующие связи углерод-углерод, углерод-азот, углерод-кислород, углерод- сера. Изо- и мультиферменты. Изоферментами или изозимами называют множественные формы ферментов, которые существуют у одного и того же вида, в одной и той же ткани, и даже в одной и той же клетке. Все эти формы фермента катализируют одну и ту же реакцию, но различаются по своим кинетическим свойствам, а также по первичной структуре. Изоферменты играют регуляторную роль в обмене веществ и позволяют метаболизму в разных тканях лучше приспосабливаться к действию внутренних и внешних факторов. Примером фермента, у которого были обнаружены такие формы, может служить лактатдегидрогеназа, катализирующая обратимую окислительно- восстановительную реакцию: Мультиферменты (мультэнзимы) — надмолекулярные комплексы, в состав которых входят ферменты, катализирующие последовательные стадии превращения субстрата. Например, для в реакциях превращения метаболита A в метаболит D: комплекс ферментов Е1, Е2, Е3 является мультиферментом. Объединение нескольких ферментов в один комплекс имеет важное Секта свидетелей Диска — vk.com/ss_disk Функцией кофермента является участие в катализируемой реакции, причём количество кофермента и его химическое строение внешне остаются неизменными. В действительности кофермент является одним из субстратов ферментативной реакции, т.е. выступает как косубстрат. В ходе реакции кофермент претерпевает химические превращения, в точности противоположные тем, которые происходят в субстрате. Например, в окислительно-восстановительных реакциях молекула субстрата окисляется, а молекула кофермента восстанавливается. При последующих сопряжённых реакциях изменения в коферменте протекают в обратном направлении, и он воспроизводится в первоначальной форме. Классификация коферментов. По происхождению и химическому строению коферменты можно подразделить на витаминсодержащие (витаминные) и невитаминные. Витаминные коферменты. К первой группе относятся производные водорастворимых витаминов группы В. В их состав могут входить также адениловые нуклеотиды. Невитаминные коферменты. К невитаминным коферментам относятся в первую очередь пептидные и нуклеотидные коферменты. Конкурентное и неконкурентное ингибирование. Ингибирование — частичное или полное торможение ферментативной реакции под действием веществ различной химической природы. Вещества, вызывающие ингибирование ферментов, называют ингибиторами. Различают обратимое и необратимое ингибирование. Если ингибитор вызывает стойкое снижение скорости реакции, то это необратимое ингибирование. Если ингибитор соединяется с ферментом при помощи нековалентных связей, то возможно восстановление исходной активности фермента после удаления ингибитора, например, путём диализа. Такое ингибирование называется обратимым. Обратимое ингибирование можно разделить на конкурентное и неконкурентное. Особенности, характерные для конкурентного ингибирования: конкурентный ингибитор сходен по строению с субстратом. конкурентный ингибитор взаимодействует с активным центром фермента, образуя фермент-ингибиторный комплекс, и препятствует взаимодействию активного центра с субстратом, но не влияет на процесс Секта свидетелей Диска — vk.com/ss_disk распада фермент-субстратного комплекса с образованием продуктов реакции действие конкурентного ингибитора зависит от его концентрации: чем выше концентрация ингибитора, тем ниже скорость ферментативной реакции. действие конкурентного ингибитора можно снять, увеличив концентрацию субстрата. Особенности, характерные для неконкурентного ингибирования: неконкурентный ингибитор не сходен по строению с субстратом. неконкурентный ингибитор может взаимодействовать, как правило, не с активным центром фермента, а с другими участками в молекуле фермента. Поэтому фермент-ингибиторный комплекс может присоединять субстрат. Но ввиду изменения конформации активного центра сродство к субстрату будет понижено. действие неконкурентного ингибитора не зависит от его концентрации. действие неконкурентного ингибитора нельзя снять, увеличив концентрацию субстрата. Использование конкурентных ингибиторов как лекарственных препаратов. Ингибитор ксантиноксидазы (аллопуринол), фермента катаболизма пуринов, требуется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры. Ингибиторы гидроксиметилглутарил-КоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях. Ингибитор дигидрофолатредуктазы (метотрексат) используеися в качестве противоопухолевого препарата; Конкурент витамина К, непрямой антикоагулянт (дикумарол); Ингибитор ДОФА-декарбоксилазы (антигипертензинный препарат метил-ДОФА). Также к конкурентным ингибиторам относят антиметаболиты или псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре с n-аминобензойной кислотой, компонентом фолиевой кислоты. 26. Свойства ферментов. Зависимость скорости ферментативной реакции от концентрации фермента и субстрата, температуры и pH среды. Белковая природа ферментов обусловливает появление у них ряда свойств, в целом нехарактерных для неорганических катализаторов: Секта свидетелей Диска — vk.com/ss_disk олигодинамичность, специфичность, зависимость скорости реакции от температуры, рН среды, концентрации фермента и субстрата, присутствия активаторов и ингибиторов. Под олигодинамичностью ферментов понимают высокую эффективность действия в очень малых количествах. Такая высокая эффективность объясняется тем, что молекулы ферментов в процессе своей каталитической деятельности непрерывно регенерируют. Типичная молекула фермента может регенерировать миллионы раз в минуту. (HbA), менее активным транспортёром кислорода, но болеепримером может служить фермент реннин, вырабатываемый слизистой оболочкой желудка жвачных животных. Одна молекула его за 10 минут при 37°С способна вызывать коагуляцию (HbA), менее активным транспортёром кислорода, но болеествораживание) порядка миллиона молекул казеиногена молока) Зависимость скорости ферментативной реакции (V) от концентрации фермента [Е]. При высокой концентрации субстрата (многократно превышающей концентрацию фермента) и при постоянстве других факторов скорость ферментативной реакции пропорциональна концентрации фермента. Поэтому зная скорость реакции, катализируемой ферментом, можно сделать вывод о его количестве в исследуемом материале. Зависимость скорости реакции от концентрации субстрата [S]. График зависимости имеет вид гиперболы. При постоянной концентрации фермента скорость катализируемой реакции возрастает с увеличением концентрации субстрата до максимальной величины Vmax, после чего остаётся постоянной. Это следует объяснить тем, что при высоких концентрациях субстрата все активные центры молекул фермента оказываются связанными с молекулами субстрата. Любое избыточное количество субстрата может соединиться с ферментом лишь после того, как образуется продукт реакции и освободится активный центр. Секта свидетелей Диска — vk.com/ss_disk Индуцируемые (адаптивные) – синтез этих ферментов возрастает при наличии соответствующих стимулов (индукторов). 3. Аллостерическая регуляция Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы. Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами. В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции, она может быть как положительной, так и отрицательной. Например, фермент энергетического распада глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6- дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ – активаторами фермента. В регуляции синтеза холестерола ингибитором ключевого фермента этого процесса гидроксиметилглутарил-КоА-редуктазы выступает сам холестерол, что быстро и точно регулирует его количество в клетке. 4. Белок-белковое взаимодействие. Термин белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки Секта свидетелей Диска — vk.com/ss_disk изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. К примеру, мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона). 5. Ковалентная (химическая) модификация Ограниченный (частичный) протеолиз проферментов Многие белки синтезируются в форме неактивных предшественников, которые затем активируются в результате специфического расщепления одной или нескольких пептидных связей. Если каталитически активный белок называется ферментом (или энзимом), то неактивный предшественник фермента называется проферментом (или зимогеном). Ограниченный (частичный) протеолиз проферментов подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений. Секреция ряда ферментов за пределы клетки в неактивном состоянии позволяет предохранить клетки от повреждения (пищеварительные ферменты) или сохранить белок до наступления определенного момента (протромбин, фибриноген, белки комплемента). Секта свидетелей Диска — vk.com/ss_disk Фосфорилирование – дефосфорилирование ферментов – присоединение или отщепление фосфатной группы. В отличие от частичного протеолиза, это обратимое изменение каталитической активности ферментов. Такие ферменты могут существовать в двух формах – фосфорилированной и дефосфорилированной. В зависимости от конкретного случая, одна из этих форм будет обладать более высокой, а другая – более низкой каталитической активностью. Фосфорилированию обычно подвергаются остатки серина, реже тирозина или треонина. Донором фосфатной группы является молекула АТФ. Фосфорилирование происходит избирательно и затрагивает лишь небольшое число аминокислотных остатков, не обязательно в активном центре фермента. Присоединение фосфата приводит к изменению конформации фермента и его активности. Фосфатные группы, связанные с остатками аминокислот, удаляются путём гидролиза с образованием неорганической фосфорной кислоты. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы. Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированномсостоянии. Например, в мышцах ферменты гликогенфосф орилаза и гликогенсинта за при нагрузке фос форилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена и сжигание глюкозы, а гликогенсинтаза при этом неактивна. во время отдыха при синтезе гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной. 7.Ассоциация и диссоциация Характерны для олигомерных ферментов (имеющих 2 и более субъединиц). Ассоциация субъединиц чаще всего приводит к активации фермента, а диссоциация олигомерного фермента на отдельные Секта свидетелей Диска — vk.com/ss_disk которую фермент не добавляют. Спустя некоторое время реакцию останавливают путём добавления различных реагентов (изменяющих рН среды, вызывающих денатурацию белков и т.д.) и проводят анализ проб. Для того чтобы определить скорость ферментативной реакции, необходимо знать: разность концентраций субстрата или продукта реакции до и после инкубации; время инкубации; количество материала, взятое для анализа. Единицы активности ферментов. За единицу активности любого фермента принимать такое количество фермента, которое при заданных условиях катализирует превращение одного микромоля (10–6 моль) субстрата в единицу времени (1 мин, 1 час) Должна быть указана температура, при которой проводится реакция. Результаты измерений активности ферментов могут быть выражены в единицах общей, удельной и молекулярной активности. Общая активность За единицу общей активности фермента принимают такое количество фермента, которое катализирует превращение 1 мкмоль субстрата в единицу времени в расчёте на количество материала, взятого для исследования. Общая активность фермента рассчитывается с помощью формулы: где, а – активность фермента (общая), ΔСС – разность концентраций субстрата до и после инкубации; В – количество материала, взятого на анализ, t- время инкубации; n — разведение. Удельная активность За единицу удельной активности принимают такое количество фермента, которое катализирует превращение 1 мкмоль субстрата в единицу времени в расчёте на 1 мг белка пробы. Для вычисления удельной активности фермента необходимо общую активность разделить на содержание белка в пробе: Чем хуже очищен фермент, тем больше в пробе находится посторонних балластных белков, тем ниже удельная активность. В ходе очистки Секта свидетелей Диска — vk.com/ss_disk количество таких белков уменьшается, и соответственно удельная активность фермента повышается. Удельную активность определяют в том случае, когда нужно сопоставить активность разных препаратов одного и того же фермента. Если требуется сравнить активность разных ферментов, рассчитывают молекулярную активность. Молекулярная активность Молекулярная активность (или число оборотов фермента) – это количество моль субстрата, подвергающееся превращению под действием 1 моль фермента в единицу времени (обычно в 1 минуту). Разным ферментам присуща неодинаковая молекулярная активность. Уменьшение числа оборотов ферментов происходит под действием неконкурентных ингибиторов. Изменяя конформацию каталитического центра фермента, эти вещества понижают сродство фермента к субстрату, что приводит к уменьшению числа молекул субстрата, реагирующих с одной молекулой фермента в единицу времени. Основные направления использования ферментов в медицине. Использование ферментов в медицине происходит по четырем направлениям: энзимодиагностика, энзимотерапия, использование ферментов в медицинских технологиях и промышленности. применение ингибиторов ферментов Энзимодиагностика и энзимотерапия, использование ферментов как реагентов. Энзимодиагностика Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях: • при повреждении клеток в крови или других биологических жидкостях увеличивается концентрация внутриклеточных ферментов повреждённых клеток; • количество высвобождаемого фермента достаточно для его обнаружения; • активность ферментов в биологических жидкостях стабильна в течение достаточно длительного времени и отличается от нормальных значений; Секта свидетелей Диска — vk.com/ss_disk • ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах Примером может служить фермент ЛДГ, определение его активности в плазме крови необходимо при заболеваниях сердца, печени, скелетной мускулатуры. Увеличение активности α-амилазы в плазме крови и моче наблюдается при воспалительных процессах в поджелудочной и слюнных железах. Энзимотерапия Энзимотерапия – это использование ферментов в качестве лекарственных средств. • заместительная терапия – использование ферментов в случае их недостаточности; • элементы комплексной терапии – применение ферментов в сочетании с другой терапией. Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта (HbA), менее активным транспортёром кислорода, но болееФестал, Панзинорм форте, Мезим форте, Энзистал и др.), содержащие пепсин, трипсин, амилазу и т.п., и используемые для заместительной терапии при нарушениях переваривания веществ в желудочно-кишечном тракте. Тканевой фермент гиалуронидаза нужна организму для обратимого изменения проницаемости межклеточного вещества, в основе которого находится гиалуроновая кислота. Лекарственную форму гиалуронидазы – лидазу – вводят для размягчения рубцов, появления подвижности в суставах, рассасывания гематом. Цитохром С – белок, участвующий в процессах тканевого дыхания. Его применяют при асфиксии новорожденных, астматических состояниях, сердечной недостаточности, различных видах гепатита и т.п. Рибонуклеаза и дезоксирибонуклеаза входят в состав глазных капель для лечения вирусных конъюнктивитов. При нанесении на рану они разжижают гной, при ингаляциях уменьшают вязкость слизи, деполимеризуя нуклеиновые кислоты в мокроте. Трипсин ингалируют при бронхолегочных заболеваниях для разжижения густой и вязкой мокроты. Фицин используется в фармацевтической промышленности в качестве добавки к зубным пастам для удаления зубного налета. Коллагеназу применяют для ускорения отторжения некротизированных тканей, для очистки трофических язв. Использование ферментов в медицинских технологиях Специфичность ферментов к определенным субстратам широко нашла применение в настоящее время в лабораторной диагностике. Секта свидетелей Диска — vk.com/ss_disk Сбалансированный пищевой рацион. Диета, содержащая питательные вещества в соотношении, оптимальном для максимального удовлетворения пластических и энергетических потребностей организма человека, называется сбалансированным пищевым рационом. Считается, что самым благоприятным является соотношение белков, жиров и углеводов близкое к 1:1:4, при условии, что общая калорийность рациона соответствует энергозатратам данного человека. Белковая недостаточность в детском возрасте вызывает: снижение сопротивляемости организма инфекциям; остановку роста вследствие нарушения синтеза факторов роста; энергетическую недостаточность организма (истощение углеводных и жировых депо, катаболизм тканевых белков); потерю массы тела — гипотрофию. При белковом голодании наблюдаются отеки, которые возникают вследствие снижения содержания белков в крови (гипоальбуминемии) и нарушения распределения воды между кровью и тканями. Нарушение соотношения доли растительных и животных жиров в рационе приводит к изменению соотношения в крови различных классов липопротеинов и, как следствие, к ишемической болезни сердца и атеросклерозу. Избыток легкоусвояемых углеводов в рационе способствует развитию таких заболеваний как ожирение, сахарный диабет, кариес зубов. Недостаток балластных веществ (клетчатки) способствует развитию рака толстой кишки. Болезни нерационального потребления витаминов. Гипервитаминозы — заболевания, вызванные избыточным содержанием витаминов в организме. Характерны для жирорастворимых витаминов, способных накапливаться в клетках печени. Гиповитаминозы — заболевания, вызванные недостатком витаминов в организме. Авитаминозы — заболевания, вызванные полным отсутствием витамина в организме. Дефицит микроэлементов в воде и пище может приводить к развитию заболеваний. Например, недостаток железа и меди может вызывать анемию, недостаток фтора способствовать возникновению кариеса, при нехватке йода в пище и воде развивается эндемический зоб. 30. Ацетил-КоА: источники и основные пути использования в тканях. Компартментализация обмена ацетил-КоА. Компартментализация — сосредоточение ферментов в одном компартменте (определенной органелле). При поступлении глюкозы в клетки она в цитозоле окисляется до пирувата, пируват проходит через внутреннюю мембрану митохондрий и окисляется в матриксе до ацетил- КоА. Образовавшийся ацетил-КоА конденсируется с оксалоацетатом (ЩУК) с образованием цитрата, а цитрат выходит из митохондрии в цитозоль. Секта свидетелей Диска — vk.com/ss_disk Поступивший в цитозоль цитрат, во-первых, служит источником ацетил-КоА и восстановительных эквивалентов для синтеза высших жирных кислот, а, во-вторых, активирует фермент ацетил-КоАкарбоксилазу, стимулируя тем самым образование малонил-КоА, также необходимого для синтеза высших жирных кислот. В результате при избытке глюкозы в клетке запускается синтез жирных кислот. Ацетил-КоА — это центральный метаболит липидного обмена. Источники: Глюкоза; Глицерин; АК; (при кратковременной напряженной мышечной работе); Жирные к-ты (в-окисление при длительной мышечной работе, голодании, на холоде, при беременности и сахарном диабете). Пути использования, образовавшегося ацетил-КоА, зависят от функционального состояния клетки (энергетический заряд) и ее специфики. Если в клетке достаточно АТФ, то он используется на синтез жирных кислот, т.к. АТФ активирует ключевой фермент синтеза жирных кислот, а их накопление стимулирует синтез жира. Распад жира тормозится и бэта-окисление при этом тоже тормозится. Напряженная мышечная работа, стресс, увеличивающие секрецию катехоламинов активирует липолиз, бэта-окисление жирных; в этом случае активируется синтез кетоновых тел и ЦТК. Пути использования: окисляется в цикле Кребса (90%); используется в синтезе ЖК (9%); образование гидроксиметилглутарил-КоА (а из него либо холестерин, либо кетоновые тела -1%). 31. Катаболические и анаболические пути обмена. Функции метаболизма. Три стадии катаболизма основных питательных веществ в организме. Связь общего пути катаболизма с цепью переноса электронов и протонов и синтезом АТФ. Роль НАД- и ФАД- зависимых дегидрогеназ. Катаболические и анаболические пути обмена. Две стороны (фазы) метаболизма. Метаболизм складывается из двух противоположных сторон: катаболизма и анаболизма. Катаболизм – это фаза, в которой происходит последовательное расщепление сложных молекул до более простых, таких, как СО2, вода и аммиак. Процессы катаболизма сопровождаются выделением энергии. Эта энергия частично аккумулируется в форме макроэргического соединения – аденозинтрифосфата (АТФ). Секта свидетелей Диска — vk.com/ss_disk Анаболизм – это фаза метаболизма, в которой происходит образование (биосинтез) сложных молекул (белков, липидов, полисахаридов) из простых предшественников. Процессы биосинтеза протекают с затратой энергии. Источником этой энергии служит распад АТФ до АДФ и неорганического фосфата. Метаболические пути, выполняющие как катаболическую, так и анаболическую функцию, называют амфиболическими. Катаболическая и анаболическая фазы метаболизма тесно связаны между собой: Энергия, выделяемая в реакциях катаболизма, и аккумулированная в форме молекул АТФ, потребляется в анаболических процессах. В реакциях катаболизма образуются простые метаболиты, которые могут использоваться в реакциях биосинтеза (анаболизма). Функции метаболизма. Метаболизм (обмен веществ) – совокупность химических реакций, протекающих в живой клетке. Эти реакции протекают в определённой последовательности и тесно связаны между собой. Главные функции метаболизма в клетке: запасание энергии, которая добывается путем расщепления пищевых веществ, поступающих в организм, или путем преобразования энергии солнечного света; превращение молекул пищевых веществ в строительные блоки; сборку белков, нуклеиновых кислот, липидов, полисахаридов и прочих клеточных компонентов из строительных блоков; синтез и разрушение тех биомолекул, которые необходимы для выполнения специфических функций данной клетки. Метаболический путь — определенная последовательность ферментативных реакций в клетке. Промежуточные продукты реакций метаболического пути называются метаболитами. На каждой из стадий метаболического пути происходит небольшое химическое изменение метаболитов. В результате этих превращений исходная молекула превращается в конечный продукт метаболического пути. Три стадии катаболизма основных питательных веществ в организме. Катаболизм – совокупность химических реакций превращения высокомолекулярных соединений в низкомолекулярные. Это сложный ферментативный процесс, в котором принято выделять три основные стадии. На первой стадии крупные биомолекулы расщепляются на составляющие их строительные блоки: полисахариды превращаются в пентозы и гексозы, жиры – в жирные кислоты, глицерол и другие Секта свидетелей Диска — vk.com/ss_disk окисления НАДН2 и ФАДН2 на I и II комплексах, ингибирование ферментов ЦТК при участии НАДН и замедление катаболизма в клетке. Снижение протонного градиента возникает при исчерпании резервов АТФ и избытке АДФ, т.е. при работе клетки. В этом случае активно работает АТФ-синтаза и через канал Fо проходят в матрикс ионы Н+. При этом протонный градиент, естественно, снижается, поток электронов по цепи возрастает, и в результате повышается выкачивание ионов Н+ в межмембранное пространство и снова их быстрое «проваливание» через АТФ-синтазу внутрь митохондрий с синтезом АТФ. Ферментные комплексы I и II усиливают окисление НАДН2 и ФАДН2 (HbA), менее активным транспортёром кислорода, но болеекак источников электронов) и снимается ингибирующее влияние НАДН на ЦТК и пируватдегидрогеназный комплекс. Как итог – активируются реакции катаболизма углеводов и жиров. 32. Пировиноградная кислота: пути образования и использования в организме. Реакции окислительного декарбоксилирования ПВК. Строение пируватдегидрогеназного комплекса. Значение витаминных коферментов в декарбоксилировании пирувата. Пировиноградная кислота (ПВК) (она же альфа-кето-кислота): образуется в организме в основном за счет окисления глюкозы и некоторых аминокислот, а также может быть получена из АЛА в результате реакции трансаминирования. Используется в зависимости от условий: в анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. Здесь происходит его превращение до уксусной кислоты, переносчиком которой служит HSKoА. Пируват может быть превращён обратно в глюкозу в процессе глюконеогенеза, или в жирные кислоты или энергию через ацетил-КоА, в аминокислоту аланин, или в этанол (HbA), менее активным транспортёром кислорода, но болееможете написать каждую из этих реакций, но не надо) Суммарное уравнение отражает окислительное декарбоксилирование пирувата, восстановление НАД до НАДН и образование ацетил-SKoA. Превращение состоит из пяти последовательных реакций, осуществляется мультиферментным комплексом, прикрепленным к внутренней митохондриальной мембране со стороны матрикса. В составе комплекса насчитывают 3 фермента и 5 коферментов: Пируватдекарбоксилаза (Е1 на схеме реакций); Кофермент: тиаминдифосфат (ТДФ), катализирует 1-ю реакцию. Трансацилаза (Е2 на схеме реакций), ее коферментом Секта свидетелей Диска — vk.com/ss_disk Кофермент: липоевая кислота, HSKoA (производное витамина В3), катализирует 2-ю и 3-ю реакции. Дигидролипоат-дегидрогеназа (Е3); Кофермент – ФАД (флавинадениндинуклеотид, производное витамина В2), НАД (никтинамидадениндинуклеотид, производное витамина РР), катализирует 4-ю и 5-ю реакции. Суть первых трех реакций сводится к декарбоксилированию пирувата (Е1), окислению пирувата до ацетила и переносу ацетила на HSKoA (Е2). Оставшиеся 2 реакции необходимы для возвращения липоевой кислоты и ФАД в окисленное состояние (Е3). При этом образуется НАДН. (HbA), менее активным транспортёром кислорода, но болееа уж значение витаминных коферментов после реакций и так можно и самому написать просто описав словами реакцию) 33. Цикл трикарбоновых кислот: последовательность реакций, характеристика ферментов. Амфиболическая функция цитратного цикла. Связь с обменом углеводов, жиров, белков. Для тех, кто в танке был изначально и закончил курс биохимии понятия не имея, как запомнить эту дичь, привожу стишок (HbA), менее активным транспортёром кислорода, но болеекстати, я так же не запомнил в школе таблицу умножения и как-то сдал ЕГЭ) P.s. ЩУК – это оксалоацетат ЩУКа «съела» ацетат, Получается цитрат. Секта свидетелей Диска — vk.com/ss_disk Через cis-аконитат Будет он — изоцитрат. Водороду отдав НАД, он теряет СО2. Этому безмерно рад альфа -кето- глутарат. Окисление грядет: НАД похитит водород, В1 и липоат С коэнзимом А спешат, Отбирают СО2. А энергия едва В сукциниле появилась, Сразу АТФ родилась. И остался сукцинат. Вот добрался он до ФАДа — Водороды тому надо. Водороды, потеряв, Стал он просто фумарат. Фумарат воды напился, Да в малат и превратился. Тут к малату НАД пришел, Водороды приобрел. ЩУКа снова объявилась И тихонько затаилась Караулить ацетат… А теперь к делу… 1. конденсация ацетил-КоА с оксалоацетатом: цитратсинтаза; Аллостерические ингибиторы: высокие концентрации НАДН, сукцинил-КоА, цитрата. 2. превращение цитрата в изоцитрат через промежуточное образование цис-аконитата: аконитаза (гидроксильная группа перемещается в положение, благоприятствующее её последующему окислению) 3. дегидрирование изоцитрата с последующим выделением молекулы СО2 (декарбоксилированием) и образованием α- кетоглутарата (это – первая окислительно-восстановительная реакция в цикле Кребса, в результате которой образуется НАДН): Изоцитратдегидрогеназа; Аллостерический активатор: АДФ. Избыток НАДН Аллостерический ингибитор: избыток НАДН2 4. окислительное декарбоксилирование α-кетоглутарата: альфа- кетоглутаратдегидрогеназа (мультиферментным комплексом, таким же по составу, как и пируватдегидрогеназный) Секта свидетелей Диска — vk.com/ss_disk III. KoQН2-цитохром С-редуктаза (содержит акцепторы электронов: цитохромы b и с1, железосерные белки). IV. Цитохром С-оксидаза (содержит акцепторы электронов: цитохромы, а и а3, ионы меди Cu2+). В качестве промежуточных переносчиков электронов выступают убихинон (коэнзим Q) и цитохром с. Убихинон (KoQ) – жирорастворимое витаминоподобное вещество, способен легко диффундировать в гидрофобной фазе внутренней мембраны митохондрий. Биологическая роль коэнзима Q – перенос электронов в дыхательной цепи от флавопротеинов (HbA), менее активным транспортёром кислорода, но болеекомплексы I и II) к цитохромам (HbA), менее активным транспортёром кислорода, но болеекомплекс III). Цитохром С – сложный белок, хромопротеин, простетическая группа которого – гем – содержит железо с переменной валентностью (Fe3+ в окисленной форме и Fe2+ в восстановленной форме). Цитохром с является водорастворимым соединением и располагается на периферии внутренней митохондриальной мембраны в гидрофильной фазе. Биологическая роль цитохрома с – перенос электронов в дыхательной цепи от комплекса III к комплексу IV. Дегидрирование субстратов и окисление водорода как источник энергии для синтеза АТФ. Механизм синтеза АТФ описывает хемиосмотическая теория. Согласно этой теории, компоненты дыхательной цепи, расположенные во внутренней митохондриальной мембране, в ходе переноса электронов могут «захватывать» протоны из матрикса митохондрий и передавать их в межмембранное пространство. При этом наружная поверхность внутренней мембраны приобретает положительный заряд, а внутренняя – отрицательный, т.е. создаётся градиент концентрации протонов с более Секта свидетелей Диска — vk.com/ss_disk кислым значением рН снаружи. Так возникает трансмембранный потенциал (ΔСµНН+). Существует три участка дыхательной цепи, на которых он образуется. Эти участки соответствуют I, III и IV комплексам цепи переноса электронов. Протоны, выведенные в межмембранное пространство за счёт энергии переноса электронов, снова переходят в митохондриальный матрикс. Этот процесс осуществляется ферментом Н+-зависимой АТФ- синтетазой (Н+-АТФ-азой). Фермент состоит из двух частей: водорастворимой каталитической части (F1) и погружённого в мембрану протонного канала (F0). Переход ионов Н+ из области с более высокой в область с более низкой их концентрацией сопровождается выделением свободной энергии, за счёт которой синтезируется АТФ. Роль АТФ в организме. Энергия, аккумулированная в форме АТФ, используется в организме для обеспечения разнообразных биохимических и физиологических процессов. Запомните основные примеры использования энергии АТФ: • совместно с другими нуклеозидтрифосфатами является исходным продуктом при синтезе нуклеиновых кислот (ДНК, РНК); • является аллостерическим эффектором ряда ферментов. АТФ, присоединяясь к их аллостерическим центрам, усиливает или подавляет их активность, тем самым участвует в регуляции множества биохимических процессов; • служит непосредственным предшественником синтеза циклического аденозинмонофосфата (цАМФ) — вторичного месенджера (посредника) передачи гормонального сигнала в клетке; • известна роль АТФ в качестве медиатора синаптической передачи. А если по-русски объяснить принцип работы, получится следующее… В целом работа дыхательной цепи заключается в следующем: Секта свидетелей Диска — vk.com/ss_disk 1. Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи. 2. Электроны движутся по ферментам дыхательной цепи и теряют энергию. 3. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство. 4. В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды. 5. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ- синтазу. 6. При этом они теряют энергию, которая используется для синтеза АТФ. 35. Сопряжение окисления с фосфорилированием в дыхательной цепи. Н + — АТФ синтетаза мембран митохондрий. Коэффициент Р/О. Разобщение дыхания и фосфорилирования. Гипоэнергетические состояния. Сопряжение окисления с фосфорилированием в дыхательной цепи. АТФ образуется путём присоединения к АДФ остатка фосфорной кислоты. Этот процесс называется фосфорилированием. Таким образом, два процесса: процесс биологического окисления (передача протонов и электронов по дыхательной цепи) и процесс фосфорилирования (образование АТФ) являются сопряжёнными, так как энергия, образующаяся при окислении, используется для фосфорилирования. Поэтому образование АТФ за счёт энергии, выделяющейся при прохождении электронов по дыхательной цепи, называется окислительным фосфорилированием. Н+ — АТФ синтетаза мембран митохондрий. Протоны, выведенные в межмембранное пространство за счёт энергии переноса электронов, снова переходят в митохондриальный матрикс. Этот процесс осуществляется ферментом Н+-зависимой АТФ-синтетазой (Н+- АТФ-азой). Фермент состоит из двух частей: водорастворимой каталитической части (F1) и погружённого в мембрану протонного канала (F0). Переход ионов Н+ из области с более высокой в область с более низкой их концентрацией сопровождается выделением свободной энергии, за счёт которой синтезируется АТФ. компонент Fо (олигомицин-чувствительный) – функция каналообразующая, через него выкачанные наружу ионы водорода устремляются в матрикс, компонент F1 – функция каталитическая, именно он, используя энергию протонов, синтезирует АТФ. Коэффициент Р/О. Секта свидетелей Диска — vk.com/ss_disk 36. Переваривание и всасывание углеводов. Катаболизм лактозы и сахарозы. Особенности метаболизма фруктозы и галактозы. Наследственные заболевания углеводного обмена: галактоземия, непереносимость сахарозы и лактозы. Углеводы — полигидроксикарбонильные соединения и их производные, Их характерным признаком является наличие альдегидной или кетонной групп и не менее 2 гидроксильных групп. По структуре углеводы разделяют на моносахариды, олигосахариды и полисахариды. Переваривание и всасывание углеводов. Гидролиз крахмала начинается в ротовой полости. В слюне содержится фермент амилаза, частично расщепляющая крахмал. Основное место переваривания крахмала — тонкий кишечник. Туда поступает амилаза сока поджелудочной железы. Продуктом действия амилазы является мальтоза. Мальтоза далее расщепляется с помощью мальтазы до глюкозы, дисахарид лактоза (содержащаяся в молоке) расщепляется с помощью лактазы до глюкозы и галактозы. Дисахарид сахароза (содержащаяся в пищевом сахаре) расщепляется с помощью сахаразы до глюкозы и фруктозы. (HbA), менее активным транспортёром кислорода, но болеедля тех, кому не хватило конкретики) Амилаза слюны (и позже поджелудочной железы) расщепляет в крахмале только альфа-1,4-связи, причем: 1. Не концевые 2. Не примыкающие к альфа-1,6-связям В результате образуются мальтоза и мальтотриоза («концевые», недорасщепленные амилазой, расщепляемые мальтазой), а также альфа- декстраны (образуются из тех мономеров, которые соединены через альфа-1,6 и примыкающие к ним), для расщепления которых требуется уже изомальтаза. Сахароза расщепляется сахаразой до глюкозы и фруктозы. Лактоза — лактазой до глюкозы и галактозы. Под действием вышеуказанных ферментов образуются моносахариды, глюкоза и галактоза всасываются совместно с натрием, фруктоза же перемещается в энтероцит путем облегченной диффузии. Катаболизм лактозы и сахарозы. Особенности метаболизма фруктозы и галактозы. (HbA), менее активным транспортёром кислорода, но болеея так думаю это одно и то же, поэтому рисуем схемки и объясняем) Секта свидетелей Диска — К.сот/з$_91$К
Сахароза
+ Н2о
сахараза
Глюкоза Фруктоза
АТФ АТФ
елюкокиназа фрукттокиназа
АДФ АДФ
Глюкозо-6- Фруктозо-1-
фосфат фосфат
ЕЙ
в кгозо- {> ан
ря м ны
Фруктозо-6-
фосфат
Фосфо- АТФ Диоксиацетон- Глицер-
тю АДФ фосфат альдегид
Фруктозо-1,6- триозо-
дифосфат фосфат- АТФ
фруктозос- ызомерата триокиназа
Эифосфат- АДФ
аль олаза Глицеральдегид-
3-фосфат
реакции
епиуколуза
|
Пируват
Секта свидетелей Диска — vk.com/ss_disk Наследственные заболевания углеводного обмена: галактоземия, непереносимость сахарозы и лактозы. Известны врождённые дефекты ферментов обмена лактозы. Врождённый дефект фермента лактазы приводит к развитию непереносимости лактозы (HbA), менее активным транспортёром кислорода, но болееаналогичная ситуация с сахаразой и непереностимостью сахарозы). Употребление в пищу молока сопровождается диспептическими явлениями (рвота, диаррея, метеоризм). Другое наследственное заболевание – галактоземия – возникает при недостатке гексозофосфат-уридил-трансферазы. Для этого заболевания характерно повышение уровня галактозы в крови, катаракта, умственная отсталость. 37. Гликолиз – локализация в клетке и тканях, последовательность реакций, биологическая роль, энергетический баланс. Утилизация молочной кислоты в организме. Гликолиз – это ферментативный распад глюкозы в аэробных условиях до двух молекул пировиноградной кислоты (аэробный гликолиз), а в анаэробных условиях – до двух молекул молочной кислоты (анаэробный гликолиз). В анаэробных условиях гликолиз протекает в тканях без потребления кислорода и является единственным процессом, поставляющим АТФ, так как окислительное фосфорилирование в этих условиях не функционирует. Анаэробный гликолиз происходит во всех тканях, функционирующих в условиях гипоксии, прежде всего в скелетных мышцах. Гликолиз в эритроцитах даже в присутствии кислорода завершается образованием лактата, поскольку в этих клетках отсутствуют митохондрии. Гликолиз протекает в цитозоле клеток организма. Этот процесс катализируется одиннадцатью ферментами, которые выделены в высокоочищенном состоянии и хорошо изучены. Первый этап гликолиза Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов. Секта свидетелей Диска — vk.com/ss_disk Глюкозо-лактатный цикл (цикл Кори) – это связь глюконеогенеза в печени и образования лактата эритроцитах или мышцах из глюкозы. В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии. В скелетных мышцах накопление лактата является следствием гликолиза при очень интенсивной, максимальной мощности, работе, и чем более такая работа интенсивна, тем менее продолжительна. Но, хотя мы и говорим об аэробном окислении глюкозы, необходимо знать и помнить, что лактат образуется в мышце всегда: и при анаэробной, и при аэробной работе, однако в разных количествах. Образовавшийся лактат может утилизоваться только одним способом – превратиться в пировиноградную кислоту. Но, как уже указывалось, пируват токсичен для клеток и должен быть как можно быстрее утилизован. Сама мышца ни при работе, ни во время отдыха не занимается превращением лактата в пируват из-за наличия специфического изофермента ЛДГ-5. Если молочная кислота поступила в миокардиоциты, она быстро превращается в пируват, далее в ацетил-S-КоА и вовлекается в полное окисление до СО2 и Н2О. Большая часть лактата захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. 38. Дихотомический аэробный распад глюкозы: схема последовательности реакций, значение. Энергетический баланс аэробного окисления глюкозы. Аэробным называется окисление биологических субстратов с выделением энергии, протекающее при использовании кислорода в качестве конечного акцептора водорода в дыхательной цепи. В качестве доноров водорода выступают восстановленные формы коферментов (НАДН, ФАДН2и НАДФН), образующиеся в промежуточных реакциях окисления субстратов. Аэробное дихотомическое окисление глюкозы является основным путём катаболизма глюкозы в организме человека и может происходить во всех органах и тканях. В результате этих реакций глюкоза расщепляется до СО2 и Н2О, а выделяющаяся энергия аккумулируется в АТФ. В этом процессе можно условно выделить три стадии: превращение глюкозы в 2 молекулы пирувата в цитоплазме клеток (специфический путь распада глюкозы); окислительное декарбоксилирование пирувата с образованием ацетил-КоА в митохондриях; окисление ацетил-КоА в цикле Кребса в митохондриях. Секта свидетелей Диска — vk.com/ss_disk На каждом этапе процесса происходит образование восстановленных форм коферментов, которые окисляются ферментными комплексами дыхательной цепи с образованием АТФ путём окислительного фосфорилирования. Коферменты, образующиеся на второй и третьей стадиях аэробного окисления глюкозы, подвергаются непосредственному окислению в митохондриях. В то же время НАДН, образующийся в цитоплазме в реакциях первой стадии аэробного окисления, не способен проникать через митохондриальную мембрану. Перенос водорода с цитоплазматического НАДН в митохондрии происходит при помощи специальных челночных циклов, основным из которых является малат- аспартатный челночный механизм. Цитоплазматический НАДН восстанавливает оксалоацетат в малат, который проникает в митохондрию, где окисляется, восстанавливая митохондриальный НАД; в цитоплазму оксалоацетат возвращается в виде аспартата. Продукция АТФ в реакциях аэробного дихотомического окисления происходит также в трёх реакциях субстратного фосфорилирования – две из них в гликолизе, третья в цикле Кребса на уровне сукцинил-КоА. Энергетический баланс будет складываться из реакций субстратного и окислительного фосфорилирования. Одна глюкоза будет требовать 2АТФ на распад и дихотомически расщепляясь давать два глицеральдегид-3- Секта свидетелей Диска — vk.com/ss_disk фосфата которые каждый пройдя свой путь до СО2 и Н2О дадут каждая по 3АТФ в субстратном (HbA), менее активным транспортёром кислорода, но болееодно в ЦТК и два в специфическом пути распада) и 16АТФ в окислительном фосфорилировании (HbA), менее активным транспортёром кислорода, но более14АТФ от 5НАД (HbA), менее активным транспортёром кислорода, но болеепричем один из специфического пути) и 2АТФ от ФАД (HbA), менее активным транспортёром кислорода, но болееиз ЦТК)). Далее умножаем на два, т.к. глицеральдегид-3-фосфата тоже два из одной молекулы глюкозы и вычитаем 2АТФ, которая требуется для ее распада. Итог: 38АТФ 39. Роль печени в углеводном обмене. Источники глюкозы крови и пути метаболизма глюкозы в печени. В гепатоцитах активно протекают процессы углеводного обмена. Благодаря синтезу и распаду гликогена печень поддерживает концентрацию глюкозы в крови. Активный синтез гликогена происходит после приема пищи, когда концентрация глюкозы в крови воротной вены достигает 20 ммоль/л. Запасы гликогена в печени составляют от 30 до 100 г. При кратковременном голодании происходит гликогенолиз. Мобилизация гликогена обеспечивает потребности организма человека в глюкозе на протяжении первых 12 — 24 часов голодания) в случае длительного голодания основным источником глюкозы крови является глюконеогенез (процесс, обратный гликолизу; при этом барьеры, создаваемые необратимыми реакциями гликолиза, преодолеваются при помощи специальных ферментов, катализирующих обходные реакции), основными субстратами для которогоа служат лактат, глицерол и аминокислоты (за исключением лейцина). Эти соединения сначала превращаются в пируват или оксалоацетат — ключевые метаболиты глюконеогенеза. Печень осуществляет взаимопревращение сахаров, т.е. превращение гексоз (фруктозы, галактозы) в глюкозу. Активные реакции пентозофосфатного пути обеспечивают наработку НАДФН, необходимого для микросомального окисления и синтеза жирных кислот и холестерола из глюкозы.
Ставлю 10/10
Все нравится, очень удобный сайт, помогает в учебе. Кроме этого, можно заработать самому, выставляя готовые учебные материалы на продажу здесь. Рейтинги и отзывы на преподавателей очень помогают сориентироваться в начале нового семестра. Спасибо за такую функцию. Ставлю максимальную оценку.
Отлично
Лучшая платформа для успешной сдачи сессии
Познакомился со СтудИзбой благодаря своему другу, очень нравится интерфейс, количество доступных файлов, цена, в общем, все прекрасно. Даже сам продаю какие-то свои работы.
Отлично
Студизба ван лав ❤
Очень офигенный сайт для студентов. Много полезных учебных материалов. Пользуюсь студизбой с октября 2021 года. Серьёзных нареканий нет. Хотелось бы, что бы ввели подписочную модель и сделали материалы дешевле 300 рублей в рамках подписки бесплатными.
Отлично
Отличный сайт
Лично меня всё устраивает — и покупка, и продажа; и цены, и возможность предпросмотра куска файла, и обилие бесплатных файлов (в подборках по авторам, читай, ВУЗам и факультетам). Есть определённые баги, но всё решаемо, да и администраторы реагируют в течение суток.
Отлично
Маленький отзыв о большом помощнике!
Студизба спасает в те моменты, когда сроки горят, а работ накопилось достаточно. Довольно удобный сайт с простой навигацией и огромным количеством материалов.
Хорошо
Студ. Изба как крупнейший сборник работ для студентов
Тут дофига бывает всего полезного. Печально, что бывают предметы по которым даже одного бесплатного решения нет, но это скорее вопрос к студентам. В остальном всё здорово.
Отлично
Спасательный островок
Если уже не успеваешь разобраться или застрял на каком-то задание поможет тебе быстро и недорого решить твою проблему.
Отлично
Всё и так отлично
Всё очень удобно. Особенно круто, что есть система бонусов и можно выводить остатки денег. Очень много качественных бесплатных файлов.
Отлично
Отзыв о системе «Студизба»
Отличная платформа для распространения работ, востребованных студентами. Хорошо налаженная и качественная работа сайта, огромная база заданий и аудитория.
Хорошо
Отличный помощник
Отличный сайт с кучей полезных файлов, позволяющий найти много методичек / учебников / отзывов о вузах и преподователях.
Отлично
Отлично помогает студентам в любой момент для решения трудных и незамедлительных задач
Хотелось бы больше конкретной информации о преподавателях. А так в принципе хороший сайт, всегда им пользуюсь и ни разу не было желания прекратить. Хороший сайт для помощи студентам, удобный и приятный интерфейс. Из недостатков можно выделить только отсутствия небольшого количества файлов.
Отлично
Спасибо за шикарный сайт
Великолепный сайт на котором студент за не большие деньги может найти помощь с дз, проектами курсовыми, лабораторными, а также узнать отзывы на преподавателей и бесплатно скачать пособия.
Отлично
Тестовые задания по Биохимии
Правильный вариант ответа отмечен знаком +
1. Фолдинг – это:
1) формирование надмолекулярной структуры
2) фосфорилирование остатков серина в пептидной цепи
+3) формирование третичной структуры белка
4) формирование первичной структуры белка
2. Первичную структуру нуклеиновых кислот поддерживает связь:
1) ионная
2) гидрофобная
3) водородная
+ 4) сложноэфирная
3. Почему у сваренных вкрутую яиц желток и белок приобретают твердую консистенцию?
1) протекает ренатурация
+2) происходит денатурация
3) запускается гидролиз
4) выпадение в осадок
4. Название витамина А —
+1) ретинол
2) токоферол
3) рутин
4) убихинон
5. Конечным акцептором электронов в дыхательной цепи является:
1) убихинон
2) цитохромоксидазы
3) водород
+ 4) кислород
6. Каким свойством обусловлена способность молекул фосфолипидов самопроизвольно формировать бислои в водных растворах?
1) гидрофобность
2) гидрофильность
+3) амфифильность
4) амфотерность
7. К стероидным гормонам относятся:
1) эстрадиол, глюкагон, кортизол
2) глюкагон, тироксин, кортизол
3) тироксин, глюкагон, тестостерон
+4) эстрадиол, кортизол, тестостерон
8. Появление сладкого вкуса во рту связано с работой фермента:
1) фосфорилазы
+2) α-амилазы
3) лактазы
4) сахаразы
9. Ферменты глюконеогенеза находятся только в:
1) нейронах
+2) печени, почках
3) эритроцитах
4) мышцах
тест 10. Гликолизом называется процесс окисления глюкозы, который протекает в:
1) лизосомах
+ 2) цитоплазме
3) митохондриях
4) ЭПС
11. В состав аминокислот входят функциональные группы:
1) NO2 и ОН
2) NH2 и ОН
+3) NH2 и СООН
4) NO2 и СОН
12. Какой фрукт не содержит гликозид «амигдалин», который в процессе пищеварения гидролизуется до яда – цианистого водорода?
13. Укажите правильный набор терминов, соответствующий вопросительным знакам на картинке.
1) ДНК, кодон, т-РНК, ген
+2) ДНК, антикодон, м-РНК, кодоны
3) РНК, аминокислоты, т-РНК, антикодоны
4) РНК, антикодон, т-РНК, кодоны
14. Укажите верную последовательность процессов и продуктов, отмеченных цифрами.
1) ДНК→ трансляция → т-РНК → транскрипция → белок
2) ДНК → транскрипция → м-РНК → трансляция → р-РНК
3) Материнская ДНК → репликация → дочерняя ДНК → суперспирализация → кольцевая ДНК
+4) ДНК → транскрипция → м-РНК → трансляция → белок
15. Функции какой группы биоорганических веществ показаны на рисунке?
1) Углеводы
2) Белки
+3) Липиды
4) Нуклеиновые кислоты
16. Метаболитом цикла Кребса является:
1) Изоцитрат
2) Лактат
+3) Пируват
4) Глицерин
17. Денатурация белков чаще всего происходит при температуре:
1) 30-35 С
+2) 50-60 С
3) 10-20 С
4) 15-20 С
18. При синтезе белка аминокислота присоединяется к:
1) Клеточной мембране
2) Молекуле глюкозы
3) Молекуле р-РНК
+4) молекуле т-РНК
19. Процесс синтеза белка на рибосомах с использованием иРНК в качестве матрицы называется:
1) Трансформацией
2) Репарацией
3) Репликацией
+4) Трансляцией
тест-20. Конечный продукт β-окисления жирных кислот –
1) Лактат
2) Мочевина
+3) Ацетил-КоА
4) СО2 и Н2О
21. Ферментативный распад гликогена до глюкозы называется:
1) Гликоз
2) Глюконеогенез
+3) Гликогенолиз
4) Гликофосфорилирование
22. В результате дезаминирования аминокислот образуются:
1) Углеводы
2) Липиды
3) Нуклеотиды
+4) Кетокислоты
23. Избирательное действие фермента на субстрат —
1) Чувствительность
+2) Специфичность
3) Пластичность
4) Возбудимость
24. Наиболее богаты энергией:
+1) Жиры
2) Углеводы
3) Витамины
4) Белки
25. Глюконеогенез – это процесс образования:
1) Гликогена из глюкозы
2) Крахмала из гликогена
+3) Глюкозы из неуглеводных компонентов
4) Аминокислот из глюкозы
26. Небелковая часть сложного фермента называется:
1) Функциональной группой
2) Кофактором
3) Основанием
+4) Простетической группой
27. В ходе полного окисления молекулы глюкозы при аэробном дыхании образуется:
+1) 38 молекул АТФ
2) 36 молекул АТФ
3) 2 молекулы АТФ
4) 12 молекул АТФ
28. Какие связи разрушаются под действием амилазы?
29. Фруктоза относится к:
1) Пентозам
2) Тетрозам
3) Триозам
+4) Гексозам
тест_30. К аминокислотам не относится:
1) Метионин
2) Глутамин
3) Валин
+4) Глицерин
- Раздел: Биологические дисциплины → Биохимия
ПолесГУ, Пинск 2016, Жук О.Н., 5 курс экзамен 60 вопросов История развития представлений о биологически активных веществах.Определение важнейших понятий и терминов: биологически активные вещества (БАВ), лекарственные средства, гормоны, гормоноподобные вещества и нейромедиаторы, витамины и др. Представления о галеновых, негаленовых и новогаленовых препаратах.Классификация БАВ по…
- №1
- 234,85 КБ
- добавлен 02.03.2016 17:40
- описание отредактировано 02.03.2016 21:55
- Раздел: Биологические дисциплины → Биохимия
КазНУ им. аль-Фараби 2012, 90 вопросов Карбоновые кислоты Функции белков в природе. Ферменты их функции специфичность и строение. Полисахариды второго порядка. Аминокислоты — структурные компоненты белков. Принципы классификации моносахаридов, ди- и полисахаридов. Функции углеводов Основные представители моно-дисахаридов. Типы НК. Вторичная структура транспортной РНК. Основные…
- №2
- 1,00 МБ
- добавлен 19.05.2013 23:00
- описание отредактировано 19.05.2013 23:54
- Раздел: Биологические дисциплины → Биохимия
Выходные данные не известны, 11 стр. Биохимия и ее задачи Белки и их биологическая роль Биологическая роль белков: Физико-химические свойства белков: Классификация белков Характеристика простых белков Характеристика сложных белков ФЕРМЕНТЫ Свойства ферментов Молекулярные эффекты действия ферментов Теория кислотно-основного катализа Регуляция активности ферментов Обмен белков…
- №3
- 407,97 КБ
- добавлен 25.04.2013 22:40
- описание отредактировано 25.04.2013 23:13
- Раздел: Биологические дисциплины → Биохимия
Выходные данные не указаны, 168 стр. Часть А Классификация аминокислот. Физико-химические свойства и стереоизомерия аминокислот. Кислотно-основные свойства аминокислот. Что такое изоэлектрическая точка аминокислот? Напишите формулы оснóвных аминокислот. Амфотерные свойства -аминокислот. Заряженные аминокислоты. Напишите их формулы. Гомо- и гетероциклические аминокислоты….
- №4
- 3,33 МБ
- добавлен 03.05.2013 22:48
- описание отредактировано 07.05.2013 12:07
- Раздел: Биологические дисциплины → Биохимия
Выходные данные не указаны, 2 стр. Таблица характеристик витаминов: Витамин С (растворимый) Витамин А (ретинола ацетат, ретинола пальмитат) и каротин (жирорастворимый) Витамин В1 (тиамин) (водорастворимый) Витамин В2 (рибофлавин) (водорастворимый) Витамин В6 (пиридоксин) (водорастворимый) Витамин B11 (карнитин) (водорастворимый) Витамин В12 (цианокобаламин) (водорастворимый)…
- №5
- 19,97 КБ
- добавлен 20.05.2013 22:16
- описание отредактировано 20.05.2013 22:20
- Раздел: Биологические дисциплины → Биохимия
ЯГМУ, Ярославль, 8 стр.
Напишите формулу тетрайодтиронина и трийодтиронина. Из какой аминокислоты и где синтезируются эти гормоны?
Напишите формулу адреналина и норадреналина. Из какой аминокислоты и где синтезируется эти гормоны?
Напишите формулу циклического аденозинмонофосфата. Какую роль выполняет цАМФ в клетках.
Представьте в виде схемы образование молекулы инсулина из…
- №6
- 945,63 КБ
- добавлен 20.06.2016 14:50
- описание отредактировано 11.09.2016 16:10
- Раздел: Биологические дисциплины → Биохимия
РязГМУ, 2015 г., 3 стр. Общий белок Кислотность желудочного сока Определение пировиноградной кислоты Определение глюкозы β и пре- β–липопротеиды Определение мочевины Мочевая кислота Кальций Аскорбиновая кислота Тиамин и рибофлавин Сульфаниламиды Кетоновые тела и глюкоза Холестерин Гистамин Щелочная фосфатаза Гаптоглобин Билирубин Трансаминаза
- №7
- 26,12 КБ
- добавлен 23.02.2015 18:58
- описание отредактировано 23.02.2015 20:20
- Раздел: Биологические дисциплины → Биохимия
ТНУ, Симферополь, 2013. 3 стр. Термины: энергия Гиббса, энергия активации, энтальпия, энтропия, фермент-субстратный комплекс, общее уравнение ферментативного процесса.
- №8
- 15,55 КБ
- добавлен 04.04.2014 17:11
- описание отредактировано 05.04.2014 00:44
- Раздел: Биологические дисциплины → Биохимия
Тест по биохимии по теме «Обмен веществ», 50 вопросов
Правильные ответы отмечены звездочкой
- №9
- 22,82 КБ
- добавлен 25.02.2014 20:46
- описание отредактировано 26.02.2014 11:44
- Раздел: Биологические дисциплины → Биохимия
82 отв. Предмет и задачи биохимии. Ее значение для фармации и практической работы провизора.
Структура, молекулярная организация и функции биологических мембран.
Мембранный транспорт. Различия между активным и пассивным транспортом
Аминокислоты, входящие в состав белков. Общая характеристика и классификация.
Первичный уровень организации белка. Ковалентные связи между…
- №10
- 2,86 МБ
- дата добавления неизвестна
- описание отредактировано 30.04.2011 15:24
- Раздел: Биологические дисциплины → Биохимия
БГУ, Минск 2021. Ответы на вопросы к зачёту «Биотрансформация веществ» с 1 по 60. Биотрансформация веществ: предмет, задачи, значение для биологии, химии, медицины и др. Характеристика чрескожного поступления ксенобиотиков в организм и резорбция через слизистые оболочки. Характеристика перорального и ингаляционного поступления ксенобиотиков в организм. Характеристика транспорта…
- №11
- 3,54 МБ
- добавлен 25.05.2021 18:16
- описание отредактировано 26.05.2021 06:13
- Раздел: Биологические дисциплины → Биохимия
БГУ, Минск, 2022. 46 с. Факторы, обуславливающие безопасность пищевых продуктов. Критерии безопасности пищевых продуктов. Критерии безопасности пищевых продуктов. Токсикологическая оценка пищевых продуктов и сырья. Системы обеспечения качества и безопасности пищевых продуктов. Опасные факторы в оценке безопасности пищевых продуктов. Концепция Контрольной критической точки при…
- №12
- 4,61 МБ
- добавлен 31.01.2022 16:30
- описание отредактировано 08.02.2022 05:55
- Раздел: Биологические дисциплины → Биохимия
Белорусский государственный университет, Минск, Беларусь, преподаватель — Орёл Н.М., Биологический факультет, специальность — «Биохимия», 2016 г., 14 стр.
Контрольная является обязательным компонентом контроля знаний по курсу «Функциональная биохимия».
В документе даны ответы для подготовки на следующие вопросы:
Межклеточный матрикс, классификация компонентов….
- №13
- 784,18 КБ
- добавлен 15.06.2016 16:41
- описание отредактировано 05.11.2016 19:57
- Раздел: Биологические дисциплины → Биохимия
Белорусский государственный университет, Минск, Беларусь, преподаватель — Корик Е.О., Биологический факультет, 2016 г., 12 стр.
Контрольная является обязательным компонентом контроля знаний по курсу «Биологически активные вещества».
В документе даны ответы для подготовки на следующие вопросы:
Понятие о биологической активности.
Формирование представлений о биологической…
- №14
- 582,38 КБ
- добавлен 15.06.2016 18:08
- описание отредактировано 24.06.2016 14:45
- Раздел: Биологические дисциплины → Биохимия
Белорусский государственный университет, Минск, Беларусь, преподаватель — Корик Е.О., Биологический факультет, 2016 г., 13 стр.
Контрольная является обязательным компонентом контроля знаний по курсу «Метаболическая инженерия».
В документе даны ответы для подготовки на следующие вопросы:
Биологически активные аминокислоты. Роль в обмене веществ.
Возбуждающие аминокислоты….
- №15
- 500,71 КБ
- добавлен 15.06.2016 20:01
- описание отредактировано 24.06.2016 14:46
- Раздел: Биологические дисциплины → Биохимия
БГПУ им. М. Танка, Минск, Егорова В.П., 2021. 70 с. Предмет и задачи биохимии. Теоретическая и практическая значимость биохимии, связь с другими естественными науками. Объекты исследования. Аминокислоты, их классификация. Химическая структура и физико-химические свойства аминокислот. Заменимые и незаменимые аминокислоты. Реакционная способность аминокислот. Характеристика…
- №16
- 6,51 МБ
- добавлен 19.01.2021 17:30
- описание отредактировано 20.01.2021 08:17
- Раздел: Биологические дисциплины → Биохимия
НТУ ХПИ, Харьков, Огурцов А.Н., 2014, 10 с.
Вопросы:
В чём состоит специфика биомолекулярной механики?
Как изменяется роль гравитации и инерции в наномире по сравнению с миром макрообъектов? Объясните причину.
Что такое атомная гранулярность, и каково её значение для функционирования природных бионанообъектов?
В чём состоит специфика влияния теплового движения и диффузии в…
- №17
- 397,44 КБ
- добавлен 26.04.2014 19:19
- описание отредактировано 27.04.2014 23:33
- Раздел: Биологические дисциплины → Биохимия
НТУ ХПИ, Харьков, Огурцов А.Н., 2014, 7 с.
Вопросы:
Что называется активным центром фермента?
Назовите четыре отличия ферментативных реакций от неферментативных реакций.
Что такое «стандартный дефект» макромолекулы белка?
Какие четыре механизма играют главную роль при связывании субстрата в
активном центре фермента и образовании комплекса фермент-субстрат в воде?
Какие две…
- №18
- 431,29 КБ
- добавлен 26.04.2014 19:20
- описание отредактировано 27.04.2014 23:33
- Раздел: Биологические дисциплины → Биохимия
БГУ, Минск 2021. Ответы на экзаменационные вопросы «Аналитическая биохимия» с 26 по 50. Параметрические и непараметрические критерии сравнения двух зависимых групп Параметрические критерии сравнения нескольких групп Принципы планирования эксперимента с использованием лабораторных животных. Стандартизация лабораторных животных. Принципы выбора животных для биохимических…
- №19
- 323,79 КБ
- добавлен 14.02.2021 22:32
- описание отредактировано 15.02.2021 05:40
- Раздел: Биологические дисциплины → Биохимия
БГУ, Минск 2021. Ответы на экзаменационные вопросы «Аналитическая биохимия» с 1 по 25. Предмет аналитической биохимии. Основные особенности биохимического анализа. Специфические особенности анализа биологических проб. Общие принципы и составные части биохимического эксперимента. Стадии проведения биохимического анализа. Возможные источники артефактов на разных стадиях…
- №20
- 59,41 КБ
- добавлен 25.02.2021 22:55
- описание отредактировано 26.02.2021 05:24
- Раздел: Биологические дисциплины → Биохимия
Экзамен. НИУ «БелГУ», фармацевтический факультет, 2010-2011, 77 вопросов Предмет и задачи биохимии. ее значение для фармации и практической работы провизора Структура, молекулярная организация и функции биологических мембран Мембранный транспорт. различия между активным и пассивным транспортом Аминокислоты, входящие в состав белков. общая характеристика и классификация Первичный…
- №21
- 4,55 МБ
- добавлен 23.09.2015 01:10
- описание отредактировано 01.10.2017 20:15
- Раздел: Биологические дисциплины → Биохимия
Ярославль, ЯГМУ (Ярославский Государственный Медицинский Университет). 2015-2016 год. 102 вопроса. Экзамен по биохимии, педиатрический факультет, 2 курс. Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин А и F, структурные и функциональные отличия. Роль фетального гемоглобина в период…
- №22
- 11,09 МБ
- добавлен 13.06.2016 14:08
- описание отредактировано 13.06.2016 17:09
- Раздел: Биологические дисциплины → Биохимия
КазГУ, Казахстан, 2015 г., 30 вопросов Биологиялық қосылыстардың негізгі кластары, олардың құрамы мен тірі организмдер үшін маңызын ашып көрсетіңіз. Зат алмасу туралы жалпы ұғым. Анаболизм және катаболизм процестерін мысалдармен түсіндіріңіз, олардың арасындағы байланыстылықты көрсетіңіз. Ағзадағы судың атқаратын рөлі, оның ағза бойынша таралуы. Экзогенді және эндогенді су. Су…
- №23
- 131,39 КБ
- добавлен 14.05.2015 20:16
- описание отредактировано 14.05.2015 22:57
- Раздел: Биологические дисциплины → Биохимия
Гомельский государственный медицинский университет, Беларусь, 63 стр.
Схемы, формулы, полезные материалы в виде конспекта 1 семестр
- №24
- 187,57 МБ
- добавлен 09.02.2016 22:42
- описание отредактировано 09.02.2016 23:17
- Раздел: Биологические дисциплины → Биохимия
НГМУ, Новосибирск, Шарапов В.И., 8 стр., 2012 г.
Ферменты, Энергетический обмен, Витамины, Биохимия крови, Липидный обмен, Обмен белков и нуклеиновых кислот, Минеральный обмен.
- №25
- 89,66 КБ
- добавлен 16.06.2013 12:39
- описание отредактировано 17.06.2013 11:43
- Раздел: Биологические дисциплины → Биохимия
В данном документе содержутся тесты по биохимии с ответами по темам: белки, ферменты, обмен углеводов, регуляция обмена веществ, гормоны, витамины, биохимия крови, обмен липидов, мышцы, почки, невные соединения и ткани, обмен белков, матричные синтезы, биохимия печени, биологическое окисление, энергетический обмен, биохимия канцерогенеза. Подходит для студентов медицинских ВУЗов.
- №26
- 402,29 КБ
- дата добавления неизвестна
- описание отредактировано 04.11.2010 15:02
- Раздел: Биологические дисциплины → Биохимия
ЯГМУ, Ярославль, 17 стр. Укажите, какие метаболические процессы (реакции), происходящие в печени, обеспечивают поддержание нормального уровня глюкоза в крови. Опишите влияние гормонов на эти метаболические процессы. Напишите реакцию, катализируемую глюкокиназой. Охарактеризуйте функциональные отличия глюкокиназы от гексокиназы и значение этих различий для организма Перечислите…
- №27
- 6,02 МБ
- добавлен 20.06.2016 14:50
- описание отредактировано 20.06.2016 23:56
- Раздел: Биологические дисциплины → Биохимия
Автор неизвестен. Биохимия: шпаргалка. — М.: РИОР, 2010. — 34 с. ISBN: 978-5-369-00253-7 В шпаргалке в краткой и удобной форме приведены ответы на все основные вопросы, предусмотренные государственным образовательным стандартом и учебной программой по дисциплине «Биохимия». Книга позволит быстро получить основные знания по предмету, повторить пройденный материал, а также…
- №28
- 437,76 КБ
- добавлен 30.03.2012 22:42
- описание отредактировано 31.03.2012 20:24
- Раздел: Биологические дисциплины → Биохимия
Выходные данные не приведены. Автор не известен. 11 стр. Биохимия и ее задачи. Белки и их биологическая роль. Ферменты. Обмен веществ. Обмен белков. Гниение белков и обезвреживание его продуктов. Метаболизм аминокислот. Транскрипция (передача информации с ДНК на РНК) или биосинтез РНК. Матричный биосинтез. Генные мутации. Обмен углеводов. Патология углеводного обмена….
- №29
- 429,03 КБ
- добавлен 14.09.2012 15:40
- описание отредактировано 14.09.2012 20:25
- Раздел: Биологические дисциплины → Биохимия
ЮКГУ, Шымкент, 2013 .г, 1 стр.
Список незаменимых аминокислот и небольшая информация о них
Валин
Изолейцин
Лейцин
Треонин
Метионин
Лизин
Триптофан
Фенилаланин
- №30
- 12,63 КБ
- добавлен 30.03.2013 19:52
- описание отредактировано 01.04.2013 12:11
- Раздел: Биологические дисциплины → Биохимия
Выходные данные не указаны, 27 стр. Биохимия как наука, предмет, задачи. Краткая история развития. Макро-, микро- и ультрамикроэлементы в живом веществе. Соединения, входящие в состав организмов. Классификация протеиногенных аминокислот. Аминокислотный состав белков. Роль белков в строении живой материи. Основные функции белков. Физико-химические свойства белков. Методы синтеза…
- №31
- 107,41 КБ
- добавлен 20.01.2015 21:53
- описание отредактировано 20.01.2015 22:55
- Раздел: Биологические дисциплины → Биохимия
РязГМУ, экзамен, 2015 г., 30 стр. Аминокислоты-структур.мономеры белков.Строение и классиф-ия протеоиногенных аминокислот.Важ.физ-хим.св-ва аминокислот, их применение в медицине. Белки. Опр-е, харак-ые признаки.Развитие представ-ий о белковых веществах. Сод-ие и распред-е белков в орг-ме. Биолог.функция белков. Уровни структур.орг ции белка. Первичная структура…
- №32
- 680,28 КБ
- добавлен 23.02.2015 18:55
- описание отредактировано 23.02.2015 20:03
- Раздел: Биологические дисциплины → Биохимия
Белорусский государственный медицинский университет, экзамен, 56 вопросов Функции белков. Содержание белков в органах и тканях Аминокислотный состав белков Классификация аминокислот Физико-химические свойства белков. Понятие структурной организации белков Первичная и вторичная структура белка Третичная и четвертичная структура белка. Классификация белков Особенности белкового…
- №33
- 577,05 КБ
- добавлен 10.10.2015 16:34
- описание отредактировано 10.10.2015 19:38
- Раздел: Биологические дисциплины → Биохимия
Список вопросов:
Строение транспортной РНК
Жирорастворимые витамины
углеводы, биологическая роль, свойства, классификация
Ферменты, строение, свойства
Гормоны, строение, классификация.
Процессы элонгации и терминации в процессе биосинтеза белка
Сложные белки, классификация, представители.
Строение пуриновых и пиримидиновых оснований.
колиз и его биологическое значение…
- №34
- 154,82 КБ
- добавлен 06.03.2013 14:10
- описание отредактировано 06.03.2013 15:59
- Раздел: Биологические дисциплины → Биохимия
МГАВМиБ-МВА имени К.И. Скрябина шпаргалка к экзамену по разведению сельскохозяйственных животных 8 с. молек-дисп сист
Буферность, св-ва коллоидно-дисперсной системы, осмотическое давление, изотонический р-р, расчет рН буферных сист., строение мицелы, опред. знака частиц, буферные сист. крови, ионно-дисперсная сист., метод опред. активности реакции среды, коллоидно-дисперсная…
- №35
- 82,22 МБ
- добавлен 15.11.2016 00:47
- описание отредактировано 22.11.2016 23:40
- Раздел: Биологические дисциплины → Биохимия
БГУ, Минск, Биофак, 2018, 54 вопроса Биохимия — наука о веществах, которые входят в состав живой природы, и их превращениях, лежащих в основе разнообразных проявлений жизнедеятельности. Теоретическая и практическая значимость биохимии, связь с другими естественными науками. Краткая история развития биохимии. Классификация аминокислот. Химическая структура и физико-химические…
- №36
- 821,68 КБ
- добавлен 24.06.2018 16:38
- описание отредактировано 30.06.2018 18:15
- Раздел: Биологические дисциплины → Биохимия
Биохимия
Элементный состав организма человека
Понятие о метаболизме
Понятие о гомеостазе
Аминокислоты
Липопротеин
Фосфопротеин
Нейрогуморальная регуляция
шпаргалки по биохимии
- №37
- 1,28 МБ
- добавлен 16.10.2011 16:30
- описание отредактировано 17.10.2011 21:12
- Раздел: Биологические дисциплины → Биохимия
Нуклеотиды. Строение. Распад. Биосинтез ДНК. Репликация. Обратная транскрипция. Биосинтез РНК. Транскрипция. Биосинтез белков. Матричная теория биосинтеза белков. Трансляция и её этапы. Посттрансляционные изменения белков. Регуляция биосинтеза белка. Пути распада белков. Протеолитические ферменты. Обмен а/к-т. Превращение а/к-т по аминогруппе, по карбоксильной группе и боковому R.
- №38
- 2,78 МБ
- добавлен 18.09.2011 17:49
- описание отредактировано 19.09.2011 21:54
- Раздел: Биологические дисциплины → Биохимия
42 стр., 30 вопросов Биохимия как наука Гормоны Витамины Ферменты.
- №39
- 317,85 КБ
- добавлен 09.04.2013 21:07
- описание отредактировано 09.04.2013 22:00
- Раздел: Биологические дисциплины → Биохимия
Экзамен, ОмГАУ, Россия, 2012 белки биологическая ценность белков классификация белков характеристика сложных белков расщепление белков в желудке расщепление белков в тонком отделе кишечника расщепление белков в толстом отделе кишечника пути обезвреживания аммиака в организме гормоны цитозольный механизм действия гормонов мембранный механизм действия гормонов энергетические…
- №40
- 304,88 КБ
- добавлен 03.05.2012 19:58
- описание отредактировано 05.05.2012 23:51
- Раздел: Биологические дисциплины → Биохимия
Содержит характеристику этапов диссимиляции и ассимиляции. Фотосинтез. Хемосинтез. Цикл Кальвина
- №41
- 5,85 КБ
- дата добавления неизвестна
- описание отредактировано 28.12.2009 19:24
- Раздел: Биологические дисциплины → Биохимия
Темы: Белки, Липиды, витамины, гликолоз, ферменты, гормоны
- №42
- 110,77 КБ
- добавлен 13.03.2012 14:50
- описание отредактировано 13.03.2012 21:47
- Раздел: Биологические дисциплины → Биохимия
Шпаргалки на вопросы: ( меньше по объему ) с 1 по 17, с 39 по 51, 66.70,72,73,74,75,79, 80,81,82, отличаются от шпаргалок /file/479749/ на которые все ответы. Предмет и задачи биохимии. Ее значение для фармации и практической работы провизора. Структура, молекулярная организация и функции биологических мембран. Мембранный транспорт. Различия между активным и пассивным транспортом…
- №43
- 562,93 КБ
- дата добавления неизвестна
- описание отредактировано 30.04.2011 15:30
- Раздел: Биологические дисциплины → Биохимия
УрФУ, Екатеринбург, Биологический факультет, 2013 г., 62 вопроса Нуклеотиды: состав, строение, биологическая роль. Восстановительные эквиваленты клетки: НАД, НАДФ, ФАД. Структура и роль в организме (с примерами реакций). Понятие макроэргической связи. Структура и биохимическая роль АТФ (с примерами реакций). Пути образования АТФ. Креатинфосфат, аргининфосфат и другие…
- №44
- 346,22 КБ
- добавлен 04.06.2017 12:58
- описание отредактировано 04.06.2017 19:47
- Раздел: Биологические дисциплины → Биохимия
Шпоры к экзамену по биохимии для провизоров и фармацевтов.
Метаболизм
Гликолиз — центральный путь катаболизма глюкозы.
Пути превращения пирувата.
Анаэробный гликолиз. Спиртовое и молочно-кислое брожение.
Биомедицинское значение гликолиза. 2,3 -Бисфосфоглицератный шунт гликолиза и его биомедицинское значение.
Пируватдегидрогеназный комплекс и его биомедицинское значение….
- №45
- 176,09 КБ
- добавлен 11.12.2012 18:27
- описание отредактировано 13.12.2012 20:49
- Раздел: Биологические дисциплины → Биохимия
Шпоры по биохимии для стоматологов ЧГМА.
краткие ответы на общую и частную биохимию.
краткие ответы на 30 вопросов по стоматологии.
Белки
конформация пептидных цепей в белках (2 и 3 структур)
структура белка.
лабильность простр структуры. шапероны.
физ. -хим. св-ва белков
- №46
- 79,65 КБ
- дата добавления неизвестна
- описание отредактировано 17.06.2010 01:07
- Раздел: Биологические дисциплины → Биохимия
Часть 1. Биохимия гормонов Общие свойства, взаимодействие с рецепторами. Аденилатциклазная и инозитолфосфатная системы внутриклеточной передачи сигнала. Химическая структура гормонов. Механизмы действия эндокринной системы. Общая схема реализации эндокринных функций в организме. Эффекты, которые наблюдаются в клетках-мишенях под влиянием гормонов. Биосинтез и секреция гормонов…
- №47
- 60,94 КБ
- дата добавления неизвестна
- описание отредактировано 11.04.2010 01:23
- Раздел: Биологические дисциплины → Биохимия
Химия углеводов: биологическая роль углеводов классификация углеводов моносахариды основные реакции моносахаридов, продукты реакций и их свойства олигосахариды полисахариды гомополисахариды гетерополисахариды метаболизм углеводов переваривание и всасывание углеводов синтез и распад гликогена синтез гликогена (гликогенез) распад гликогена (гликогенолиз) гликолиз спиртовое…
- №48
- 5,63 МБ
- добавлен 15.09.2011 22:12
- описание отредактировано 18.09.2011 01:28
В этом разделе нет файлов.


 олярные
олярные