- ЕГЭ по химии
Окислитель и восстановитель. Реакции окислительно-восстановительные — Задание 29 ЕГЭ 2022 по химии .
Практика и критерии к заданию №29.
→ задание №29 практика (55 задач с решениями)
→ критерии оценивания
Источник: vk.com/chem4you
Примеры заданий:
[1] Из предложенного перечня выберите вещества, между которыми протекает окислительно-восстановительная реакция. В ходе этой реакции образуется окрашенный газ. Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Перечень веществ: фторид натрия, дихромат калия, хлороводород, серная кислота, иодид лития, гидроксид железа (II). Допустимо использование водных растворов.
[2] Из предложенного перечня выберите кислоту и вещество, между которыми протекает окислительно-восстановительная реакция с образованием газа. В ходе этой реакции в процессе восстановления участвует один электрон (в пересчете на один атом окислителя). Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Перечень веществ: серная кислота, иодоводород, ацетат бария, нитрит калия, хлорид натрия, гидроксид железа (III). Допустимо использование водных растворов.
[3] Из предложенного перечня выберите два вещества, между которыми протекает окислительно-восстановительная реакция. В ходе этой реакции выделяется газ. Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Перечень веществ: сернистый газ, хлорид меди (II), фосфор, серная кислота, ацетат калия, нитрат серебра. Допустимо использование водных растворов.
Смотрите также:
Всего: 583 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора и выпадением осадка. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, которые вступают в реакцию ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная окислительно-восстановительная реакция протекает с изменением окраски раствора. Выпадение осадка и выделение газа в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид бария, хлорид натрия, сульфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид бария, хлорид натрия, сульфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид бария, нитрат натрия, нитрат серебра (I). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид бария, нитрат натрия, нитрат серебра (I). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид стронция, хлорид калия, сульфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид стронция, хлорид калия, сульфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: гидроксид калия, силикат калия, хромат калия, гидроксид лития, нитрит натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: гидроксид калия, силикат калия, хромат калия, гидроксид лития, нитрит натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная окислительно-восстановительная реакция с изменением окраски раствора. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция, не сопровождающаяся выделением газа и выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с растворением осадка. Выделение газа и выпадение другого осадка в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, не включающая в себя процесс совместного гидролиза. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная окислительно-восстановительная реакция. Выпадение осадка и выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора. Выпадение осадка и выделение газа в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора и выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная окислительно-восстановительная реакция. Выделение газа и выпадение нового осадка в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора и выпадением осадка. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выделению газа и выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Всего: 583 1–20 | 21–40 | 41–60 | 61–80 …
Будьте в симбиозе со Studarium
Тренажер по теме: Окислительно-восстановительные реакции (задание С1 ЕГЭ по химии).
Подборка заданий С1
Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель:
- (K2Cr2O7 + H2S + … → Cr2(SO4)3 + S + … + H2O, H2S + … + H2SO4 → S+ Cr2(SO4)3 + … + …
- Cl2 + … = NaClO3 + … + H2O
- Si + …… + HF → SiF4 + NO + ……
- CrCl3 + H2O2 + … = Na2CrO4 + … + H2O
- HI + H2SO4 → … + H2S + …
- H2O2 + KMnO4 + … → … + MnSO4 + … + H2O
H2O2 + … + H2SO4 → O2 + … + MnSO4 + H2O.
КМnО4 + Н2О2 + ….. → МnSО4 + О2 +……. +……..
- Rb2O2 + RbMnO4 + … → … + … + Rb2SO4 + H2О
- KMnO4 + SnSO4 + … = MnSO4 + Sn(SO4)2 + …. + H2O
- PH3 + KMnO4 + … → … + MnSO4 + … + H2O
- CrCl3 + H2O2 + … → K2CrO4 + … + …
- KI+K2MnO4+…→…+ MnO2+…
- Cr2O3 + Br2 + NaOH → Na2CrO4 + … . + ….
- HClO3 + … + FeSO4 → Fe2(SO4)3 + … + …
- N2O + … H2SO4 → NO + … . + MnSO4 + …
- Fe2O3 + KNO3 + KOH = … + KNO2 + … Fe2O3 + KNO3 + … → K2FeO4 + … + …
- MnO2 + KClO3 + K2CO3 = … + … + CO2
- … + CrO3 + H2SO4 → Fe2(SO4)3 + … + H2O
- Na2O2 + … + H2SO4 → I2 + … + K2SO4 + …
- Na2O2 + KI + … ® … + K2SO4 + Na2SO4 + …
- CS2 + KMnO4 + …. = S + MnO2 + …. + ….
- H2S + KMnO4 + … → K2SO4 + 5S + … + …
- FeCl2 + KClO4 + HCl → … + Cl2 + … + …
- NaOCl + KI + … = NaCl + … + K2SO4 + ….
- FeSO4 + KMnO4 + ….. = Fe2(SO4)3 + ….. + K2SO4 + …..
- Cu + KNO3 +… → … + K2SO4 +NO + H2O
- K2Cr2O7 + Al + …..→ CrSO4 + Al2(SO4)3 + ….. + …..
- Zn + Na2SO3 + …→ ZnCl2 + H2S + …+ …
- SnCl2 + … + K2Cr2O7 = H2[SnCl6] + CrCl3 + … + … FeCl2 + HNO2 + … = … +N2 + Fe2(SO4 )3 +…
- K3[Cr(OH)6] + … + KOH → …. + KBr + H2O
- MnO2 + NaBiO3 + …. → ….+ BiONO3 + NaNO3 + H2O
- KNO3 + FeCl2 + … → NO + FeCl3 +… + …
- MnO2 + … + 2H2SO4 конц= К2SO4+ …+… + Br2
- NaNO2 + … + H2SO4 → … + Cr2(SO4)3 + … + …
- Na2SO3 + … + K2Cr2O7 = Na2SO4 + … + … + …
- KNO3 + … + Cr2O3 → K2CrO4 + KNO2 + …
- K2Cr2 O7 + … = Cl2 + CrCl3 + … + …
- . Br2 + MnSO4 + … = MnO2¯ + NaBr + … + …
- KI + H2SO4(конц) = … + H2S + … + H2O
- Zn + KClO3 + … + H2O = K2[Zn(OH)4] + …
- SnCl2 + K2Cr2O7 + HCl → SnCl4 + … + … + …
- PbO2 + Mn(NO3)2 + … = … + Pb(NO3)2 + H2O
- Cr2(SO4)3 + KClO3 + … → Na2CrO4 + KCl + … + …
- Cu2O + …… + 2KMnO4 = CuSO4 + MnSO4 + ….. + …..
- P + CuSO4 + … = … + Cu + H2SO4
РЕШЕНИЯ
1. K2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + 3S + K2SO4 + 7H2O
2Cr+6 + 6ē → 2Cr+3 1 восстановление
S-2 – 2ē → S0 3 окисление
K2Cr2O7 – окислитель за счет Cr+6
H2S – восстановитель за счет S-2
2. 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O
Cl20 – 10е → 2Cl+5 1 окисление
Cl20+ 2е → 2Cl-1 5 восстановление
Cl2 – окислитель и восстановитель
3. 3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Si0 – 4e → Si+4 1 окисление
N+5 + 1е ® N+4 4 восстановление
Si0 – восстановитель
HNO3 – окислитель за счет N+5
4. 2Cr+3 Cl3 + 3 H2O21- + 10 NaOH = 2 Na2Cr+6O4 + 6 NaCl + 8 H2O-2
Cr+3 — 3ē → Cr+6 2 окисление
O21- + 2ē → 2O-2 3 восстановление
CrСl3 (Cr+3) – восстановитель,
H2O2 (O-1) – окислитель
5. 8HI + H2SO4 → 4I2 + H2S + 4H2O
S+6 + 8 е = S-2 1 окисление
2I-1 — 2 е = I02 4 восстановление
HI – восстановитель за счет I-1 H2SO4 – окислитель за счет S+6
6. 5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2 SO4 +8H2O
Mn+7 + 5e → Mn+2 2 восстановление
2O -1 – 2e → O2 0 5 окисление
KMnO4 – окислитель за счет Mn+7
H2O2 – восстановитель за счет O -1
7. 5 Rb2O-12 + 2RbMn+7O4 + 8H2SO4 → 5O02 + 2Mn+2SO4 + 6Rb2SO4 + 8H2O
2O-1 -2e→ O02 5 окисление
Mn+7 +5e→Mn+2 2 восстановление
Rb2O2 – восстановитель за счет O-1
RbMnO4 – окислитель за счет Mn+7
8. 2KMn+7 O4 + 5Sn+2SO4 + 8Н2SO4 = 2Mn+2SO4 + 5Sn+4(SO4)2 + К2SO4 + 8H2O
Mn+7 +5е → Mn+2 2 восстановление
Sn+2 — 2е → Sn+4 5 окисление
KMnO4 – окислитель за счет Mn+7
SnSO4 – восстановитель за счет Sn+2
9. 5P-3H3 + 8KMn+7O4 + 12H2SO4 → 5H3P+5O4 + 8Mn+2SO4 + 4K2SO4 + 12H2O
P— 3 – 8 е → P+5 5 окисление
Mn+7+ 5 е → Mn+2 8 восстановление
PH3 – восстановитель за счет P-3
KMnO4 – окислитель за счет Mn+7
10. 2Cr+3Cl3 + 3H2O-12 + 10KOH → 2K2Cr+6O4 + 6KCl + 8H2O-2
Cr+3 – 3е → Cr+6 2 окисление
2O-1 + 2е → 2O-2 3 восстановление
Cr+3 в составе CrCl3 – восстановитель
O-1 в составе H2O2 – окислитель
11. 2KI + K2MnO4 + 2H2O→ I2+ MnO2+ 4KOH
2I– – 2 е → I20 1 окисление
Mn+6+ 2 е → Mn+4 1 восстановление
KI – восстановитель за счет I2
K2MnO4 – окислитель за счет Mn+6
12. Cr+32O-23 + 32 + 10NaOH = 2Na+12Cr+6O4 + 6NaBr-1 + 5H2O
Cr+3 -3e → Cr+6 2 окисление
Br02 +2e →2Br-1 3 восстановление
Cr2O3 – восстановитель за счет Cr+3
Br02 – окислитель
13. HClO3 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + HCl + 3H2O
Cl+5 + 6e → Cl-1 1 восстановление
2Fe+2 – 2e → 2Fe+3 3 окисление
HClO3 – окислитель за счет Cl+5
FeSO4 – восстановитель за счет Fe+2
14. 5 N2O + 3 H2SO4 + 2 KMnO4 = 10 NO + 2 MnSO4 + K2SO4 +3H2O
2N+1 – 2e = 2N+2 5 окисление
Mn+7 + 5e = Mn+2 2 восстановление
KMnO4 – окислитель за счет Mn+7
N2O – восстановитель за счет N+1
15. Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O
N+5 +2e N+3 3 восстановление
2Fe+3-6e 2Fe+6 1 окисление
Fe2O3 – восстановитель за счёт Fe+3
KNO3 – окислитель за счёт N+5
16. 3MnO2 + KClO3 + 3K2CO3 = 3K2MnO2 + KCl + 3CO2
Mn+4 – 2e → Mn+6 3 окисление
Cl+5 +6e →Cl-1 1 восстановление
KClO3 – окислитель за счет Cl+5
MnO2 – восстановитель за счет Mn+4
17. 6FeSO4 + 2CrO3 + 6H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + 6H2O
Cr+6 + 3e → Cr+3 1 восстановление
Fe+2 — 1e → Fe+3 3 окисление
CrO3 – окислитель за счет Cr+6
FeSO4 – восстановитель за счет Fe+2
18. Na2O2-1 + 2KI-1 + 2H2SO4 = I20 + Na2SO4 + K2SO4 + 2H2O-2
O-1 + 1e → O-2 2 восстановление
2I-1 – 2e → 2I0 1 окисление
Na2O2 окислитель за счет O-1
KI – восстановитель за счет I-1
19. 3CS2 + 4KMnO4 + 2KOH = 6S + 4MnO2 +3K2CO3 + H2O
2S-– 2 – 4 е → 2S0 3 окисление
Mn+7+ 3 е → Mn+4 4 восстановление
CS2 – восстановитель за счет S-– 2
KMnO4 – окислитель за счет Mn+7
20. 5H2S-2 + 2KMn+7O4+ 3H2SO4 → K2SO4 + 5S0 + 2MnSO4 + 8H2O
S-2 -2e → S0 5 окисление
Mn+7 +5e → Mn+2 2 восстановление
H2S – восстановитель за счет S-– 2
KMnO4 – окислитель за счет Mn+7
21. 14FeCl2 + 2KClO4 + 16HCl → 14FeCl3 + Cl2 + 2KCl + 8H2O
Fe+2 – 1е → Fe+3 14 окисление
2Cl+7 + 14е → Cl20 1 восстановление
FeCl2 – восстановитель за счет Fe+2
KClO4 – окислитель за счет Cl+7
22. NaOCl + 2 KI + H2SO4 = NaCl + I2 + K2SO4 + H2O
Cl+1 + 2e → Cl-1 1 восстановление
2I-1 – 2e → I2 1 окисление
NaOCl – окислитель за счет Cl+1
KI – восстановитель за счет I-1
23. 10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe2+3 (SO4)3 + 2Mn+2SO4 + K2SO4 + 8H2O
2Fe+2 – 2e = 2Fe+3 5 окисление
Mn+7 + 5e = Mn+2 2 восстановление
Fe SO4 – восстановитель за счет Fe+2
KMnO4 – окислитель за счет Mn+7
24. 3Cu0 + 2KN+5O3 +4H2SO4 → 3CuSO4 + K2SO4 + 2N+2O + 4H2O
Cu0─ 2e → Cu+2 3 окисление
N+5 +3e → N+2 2 восстановление
Cu0 – восстановитель
KN+5O3 – окислитель за счет N+5
25. 3K2Cr2+6O7 + 8Al0 + 21H2SO4 → 6Cr+2SO4 + 4Al2+3(SO4)3 + 3K2SO4 + 21H2O
2Cr+6 + 8 e→2Cr+2 3 восстановление
2Al0 – 6e → 2Al+3 4 окисление
Al0– восстановитель
K2Cr2O7 – окислитель за счет Cr+6
26. 3Zn + Na2SO3 + 8HCl = 3ZnCl2 + H2S + 2NaCl + 3H2O
Zn0 – 2ē → Zn+2 3 окисление
S+4 + 6ē → S-2 2 восстановление
Zn0 –восстановитель,
Na2SO3 – окислитель за счет S+4
27. 3SnCl2 + 20HCl + K2Cr2O7 = 3H2[SnCl6] + 2CrCl3 + 2KCl + 7H2O
Sn+2 -2e = Sn+4 3 окисление
2Cr+6 + 6e = 2Cr+3 1 восстановление
SnCl2 – восстановитель за счет Sn+2
K2Cr2O7 – окислитель за счет Cr+6
2 6. Fe+2 Cl2 +2 HN+3 O2 + 3H2SO4 →4 Fe+3 Cl3 +N2 0 + Fe2 +3(SO4 )3 +4H2O
Fe+2 – e → Fe+3 6 окисление
2N+3 + 6e → N2 0 1 восстановление
FeCl2 – восстановитель за счёт Fe+2
HNO2 – окислитель за счёт N+3
29. 2K3[Cr+3(OH)6] + 3Br02 + 4KOH → 2K2Cr+6O4 + 6KBr— + 8H2O
Cr + 3 – 3 е → Cr+6 2 окисление
Br20 + 2 е → 2Br— 3 восстановление
Br2 – окислитель
K3[Cr+3(OH)6] – восстановитель за счет Cr+3
30. 2Mn+4O2 + 3NaBi+5O3 + 4HNO3 → 2NaMn+7О4 + 3Bi+3ONO3 + NaNO3 + 2H2O
Mn + 4 – 3 е → Mn+7 2 окисление
Bi+5 + 2 е → Bi+3 3 восстановление
NaBiO3 – окислитель за счет Bi+5
MnO2 – восстановитель за счет Mn+4
31. KN+5O3 +3 Fe+2Cl2 + 4HCl → N+2O + 3Fe+3Cl3 +KCl + 2H2O
N+5 +3e → N+2 1 восстановление
Fe+2 –1e → Fe+3 3 окисление
KNO3 – окислитель за счет N+5
FeCl2 – восстановитель за счет Fe+2
32. MnO2 + 2КBr + 2H2SO4 конц= К2SO4+ MnSO4+2H2O + Br2
2Br-1 –2ē → Br02 1 окисление
Mn+4 +2ē → Mn+2 1 восстановление
MnO2– окислитель за счет Mn+4
КBr– восстановитель за счет Br -1
33. 3NaNO2 + K2Cr2O7 + 4H2SO4 → 3NaNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
N + 3 – 2 е → N+5 3 окисление
2Cr+6+ 6 е → 2Cr+3 1 восстановление
NaNO2 – восстановитель за счет N + 3
K2Cr2O7 – окислитель за счет Cr+6
34. 3Na2SO3 + 4H2SO4+ K2Cr2O7 = 3 Na2SO4 + Cr2(SO4)3 + 4H2O + K2SO4
S+4 –2e— → S+6 3 окисление
Cr+6 + 3 e—→ Cr+3 2 восстановление
Na2SO3 – восстановитель за счет S+4
K2Cr2O7 — окислитель за счет Cr+6
35. 3KNO3 + 4KOH + Cr2O3 = 2K2CrO4 + 3KNO2 + 2H2O
Cr+3 –3e— → Cr+6 2 окисление
N+5 + 2 e—→ N+3 3 восстановление
Cr2O3 – восстановитель за счет Cr+
KNO3 — окислитель за счет N+5
36. K2Cr2O7 + 14HCl = 3Cl2+ 2CrCl3 + 2KCl + 7H2O
2Cr+6 + 6е → 2Cr+3 1 восстановление
2Cl-1 – 2e → Cl20 3 окисление
K2Cr2O7 – окислитель за счёт Cr+6
HCl – восстановитель за счет Cl-1
37. Br2 + MnSO4 + 4NaOH ® MnO2¯ + 2NaBr + Na2SO4 +2H2O
Br20 + 2е →2 Br -1 1 восстановление
Mn+2 – 2e → Mn+4 1 окисление
Br20 – окислитель,
MnSO4 2 – восстановитель за счёт Mn+
38. 8KI-1 + 5H2S+6O4(конц) = 4I2 + H2S-2 + 4K2SO4 + 4H2O
2I-1– 2 е → I02 4 окисление
S+6+8е → S-2 1 восстановление
KI– восстановитель за счёт I-1
H2SO4 – окислитель за счёт S+6
39. 3Zn + KClO3 + 6КОН + 3H2O = 3K2[Zn(OH)4] + КСl
Zn0 – 2e → Zn2+ 3 окисление
Cl+5 + 6e → Cl-1 1 восстановление
Zn0 – восстановитель
KClO3 – окислитель за счет Cl+5
40. 3SnCl2 + K2Cr2O7 + 14HCl →3SnCl4 +2CrCl3 + 2КСl + 7H2O
Sn+2 -2е → Sn+4 3 окисление
2Cr+6 + 6е → 2Cr+3 1 восстановление
SnCl2 – восстановитель за счет Sn+2
K2Cr2O7 – окислитель за счет Cr+6
41. 5PbO2 + 2Mn(NO3)2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
Pb+4 +2е = Pb+2 5 восстановление
Mn+2 – 5е = Mn+7 2 окисление
PbO2 – окислитель за счёт Pb+4
Mn(NO3)2 – восстановитель за счёт Mn+2
42. Cr2+3(SO4)3 + KCl+5O3 + 10NaOH → 2Na2Cr+6O4 + KCl-1 + 3Na2SO4 + 5H2O
2Cr+3 – 6e— → 2Cr+6 1 окисление
Cl+5 + 6e— → Cl-1 1 восстановление
Cr2+3(SO4)3 – восстановитель за счёт Cr+3
KCl+5O3 – окислитель за счёт Cl+5
43. 5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
2Cu +1 – 2 e →2Cu+2 5
Mn +7 +5 e → Mn+2 2
Cu2O – восстановитель за счет Cu +1
KMnO4 – окислитель за счет Mn +7
44. 2P + 5CuSO4 + 8H2O = 2H3PO4 + 5Cu + 5H2SO4
Cu +2 + 2 e → Cu0 5
P 0 – 5 e → P +5 2
P 0 – восстановитель
CuSO4 – окислитель за счет Cu +2
За это задание ты можешь получить 2 балла. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 36.8%
Ответом к заданию 29 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Для выполнения задания используйте следующий перечень веществ: цинк, пиросерная кислота, сульфат бария, сульфид калия, нитрат цинка. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Образование осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$Zn^{0} + H_2S_2^{+6}O_7 → Zn^{+2}SO_4 + H_2S^{–2} + H_2O$
$2S^{+6} + 16ē = 2S^{–2}$ |·1 процесс восстановления
$Zn^{0} – 2ē = Zn^{+2}$ |·8 процесс окисления
$2S^{+6} + 8Zn^{0} = 2S^{–2} + 8Zn^{+2}$
$S^{+6} (H_2S_2O_7$ за счёт $S^{+6}$) — окислитель,
$Zn^{0}$ — восстановитель.
Молекулярное уравнение:
$8Zn + 5H_2S_2O_7 = 8ZnSO_4 + 2H_2S + 3H_2O$
Ответ:
Задача 2
Для выполнения задания используйте следующий перечень веществ: хромит калия, хлор, гидроксид калия, хлорид калия, нитрат серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Образование осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$KCr^{+3}O_2 + Cl_2^{0} + KOH → K_2Cr^{+6}O_4 + KCl^{–1} + H_2O$
$Cl_2^{0} + 2ē = 2Cl^{–1}$ |·3 процесс восстановления
$Cr^{+3}– 3ē = Cr^{+6}$ |·2 процесс окисления
$3Cl_2^{0} + 2Cr^{+3} = 6Cl^{–1} + 2Cr^{+6}$
$Cl_2^{0}$ — окислитель,
$Cr^{+3} (KCrO_2$ за счёт $Cr^{+3}$) — восстановитель.
Молекулярное уравнение:
$2KCrO_2 + 3Cl_2 + 8KOH = 2K_2CrO_4 + 6KCl + 4H_2O$
Ответ:
Задача 3
Для выполнения задания используйте следующий перечень веществ: сульфид натрия, концентрированная азотная кислота, сульфат натрия, хлорид цинка, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Образование осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$Na_2S^{–2} + HN^{+5}O_{3(конц.)} → Na_2S^{+6}O_4 + N^{+4}O_2 + H_2O$
$N^{+5} + 1ē = N^{+4}$ |·8 процесс восстановления
$S^{–2} – 8ē = S^{+6}$ |·1 процесс окисления
$8N^{+5} + S^{–2} = 8N^{+4} + S^{+6}$
$N^{+5} (HNO_3$ за счёт $N^{+5}$) — окислитель,
$S^{–2} (Na_2S$ за счёт $S^{–2}$) — восстановитель.
Молекулярное уравнение:
$Na_2S + 8HNO_{3(конц.)} = Na_2SO_4 + 8NO_2 + 4H_2O$
Ответ:
Задача 4
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, йодид натрия, хлорид бария, серная кислота, йод. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием вещества тёмного цвета с характерным запахом. В ходе этой реакции наблюдается выделение газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$NaN^{+5}O_3 + NaI^{–1} + H_2SO_4 → N^{+2}O + I_2^{0} + Na_2SO_4 + H_2O$
$2I^{–1} – 2ē = I_2^{0}$ |·3 процесс окисления
$N^{+5} + 3ē = N^{+2}$ |·2 процесс восстановления
$6I^{–1} + 2N^{+5} = 3I_2^{0} + 2N^{+2}$
$N^{+5} (NaNO_3$ за счёт $N^{+5}$) — окислитель,
$I^{–1} (NaI$ за счёт $I^{–1}$) — восстановитель.
Молекулярное уравнение:
$2NaNO_3 + 6NaI + 4H_2SO_4 = 2NO + 3I_2 + 4Na_2SO_4 + 4H_2O$
Ответ:
Задача 5
Для выполнения задания используйте следующий перечень веществ: карбонат калия, оксид марганца(IV), гидроксид калия, хлорид кальция, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Образование осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$Mn^{+4}O_2 + KN^{+5}O_3 + K_2CO_3 → K_2Mn^{+6}O_4 + KN^{+3}O_2 + CO_2$
$Mn^{+4} – 2ē = Mn^{+6}$ |·1 процесс окисления
$N^{+5} + 2ē = N^{+3}$ |·1 процесс восстановления
$Mn^{+4} + N^{+5} = Mn^{+6} + N^{+3}$
$N^{+5} (KNO_3$ за счёт $N^{+5}$) — окислитель,
$Mn^{+4} (MnO_2$ за счёт $Mn^{+4}$) — восстановитель.
Молекулярное уравнение:
$MnO_2 + KNO_3 + K_2CO_3 = K_2MnO_4 + KNO_2 + CO_2$
Ответ:
Задача 6
Для выполнения задания используйте следующий перечень веществ: гипохлорит калия, оксид азота(II), едкое кали, хлорид цинка, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием раствора двух солей. Образование осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$N^{+2}O + KCl^{+1}O + KOH → KN^{+5}O_3 + KCl^{–1} + H_2O$
$N^{+2} – 3ē = N^{+5}$ |·2 процесс окисления
$Cl^{+1} + 2ē = Cl^{–1}$ |·3 процесс восстановления
$2N^{+2} + 3Cl^{+1} = 2N^{+5} + 3Cl^{–1}$
$Cl^{+1} (KClO$ за счёт $Cl^{+1}$) — окислитель,
$N^{+2} (NO$ за счёт $N^{+2}$) — восстановитель.
Молекулярное уравнение:
$2NO + 3KClO + 2KOH = 2KNO_3 + 3KCl + H_2O$
Ответ:
Задача 7
Для выполнения задания используйте следующий перечень веществ: сульфит натрия, йодат натрия, серная кислота, сульфат натрия, сульфид серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием вещества тёмного цвета с характерным запахом. Образование газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$Na_2S^{+4}O_3 + NaI^{+5}O_3 + H_2SO_4 → Na_2S^{+6}O_4 + I_2^{0} + H_2O$
$2I^{+5} + 10ē = I_2^{0}$ |·1 процесс восстановления
$S^{+4} – 2ē = S^{+6}$ |·5 процесс окисления
$2I^{+5} + 5S^{+4} = I_2^{0} + 5S^{+6}$
$I^{+5} (NaIO_3$ за счёт $I^{+5}$) — окислитель,
$S^{+4} (Na_2SO_3$ за счёт $S^{+4}$) — восстановитель.
Молекулярное уравнение:
$5Na_2SO_3 + 2NaIO_3 + H_2SO_4 = 6Na_2SO_4 + I_2 + H_2O$
Ответ:
Задача 8
Для выполнения задания используйте следующий перечень веществ: перманганат калия, сульфат марганца(II), сернистый газ, гидроксид калия, сульфид серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с обесцвечиванием раствора. Образование осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$S^{+4}O_2 + KMn^{+7}O_4 + H_2O → Mn^{+2}S^{+6}O_4 + K_2S^{+6}O_4 + H_2S^{+6}O_4$
$Mn^{+7} + 5ē = Mn^{+2}$ |·2 процесс восстановления
$S^{+4} – 2ē = S^{+6}$ |·5 процесс окисления
$2Mn^{+7} + 5S^{+4} = 2Mn^{+2} + 5S^{+6}$
$Mn^{+7} (KMnO_4$ за счёт $Mn^{+7}$) — окислитель,
$S^{+4} (SO_2$ за счёт $S^{+4}$) — восстановитель.
Молекулярное уравнение:
$5SO_2 + 2KMnO_4 + 2H_2O = 2MnSO_4 + K_2SO_4 + 2H_2SO_4$
Ответ:
Задача 9
Для выполнения задания используйте следующий перечень веществ: аммиак, феррат натрия, серная кислота, гидроксокарбонат меди(II), сульфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Образование осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$N^{–3}H_3 + Na_2Fe^{+6}O_4 + H_2SO_4 → N_2^{0} + Fe_2^{+3}(SO_4)_3 + Na_2SO_4 + H_2O$
$2Fe^{+6} + 6ē = 2Fe^{+3}$ |·1 процесс восстановления
$2N^{–3} – 6ē = N_2^{0}$ |·1 процесс окисления
$2Fe^{+6} + 2N^{–3} = 2Fe^{+3} + N_2^0$
$Fe^{+6} (Na_2FeO_4$ за счёт $Fe^{+6}$) — окислитель,
$N^{–3} (NH_3$ за счёт $N^{–3}$) — восстановитель.
Молекулярное уравнение:
$2NH_3 + 2Na_2FeO_4 + 5H_2SO_4 = N_2 + Fe_2(SO_4)_3 + 2Na_2SO_4 + 8H_2O$
Ответ:
Задача 10
Для выполнения задания используйте следующий перечень веществ: хлорид серебра, оксид хрома(VI), серная кислота, вода, нитрат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$H_2S_2^{+2}O_3 + Cr^{+6}O_3 + H_2SO_4 → Cr_2^{+3}(S^{+6}O_4)_3 + H_2O$
$2Cr^{+6} + 6ē = 2Cr^{+3}$ |·4 процесс восстановления
$2S^{+2} – 8ē = 2S^{+6}$ |·3 процесс окисления
$8Cr^{+6} + 6S^{+2} = 8Cr^{+3} + 6S^{+6}$
$Cr^{+6} (CrO_3$ за счёт $Cr^{+6}$) — окислитель,
$S^{+2} (H_2S_2O_3$ за счёт $S^{+2}$) — восстановитель.
Молекулярное уравнение:
$3H_2S_2O_3 + 8CrO_3 + 6H_2SO_4 = 4Cr_2(SO_4)_3 + 9H_2O$
Ответ:
Задача 11
Для выполнения задания используйте следующий перечень веществ: сульфит натрия, оксид кремния(IV), ортофосфат кальция, перманганат калия, нитрат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием осадка бурого цвета. В ходе этой реакции не наблюдается выделение газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$Na_2S^{+4}O_3 + KMn^{+7}O_4 + H_2O → Na_2S^{+6}O_4 + Mn^{+4}O_2 + KOH$
$Mn^{+7} + 3ē = Mn^{+4}$ |·2 процесс восстановления
$S^{+4} – 2ē = S^{+6}$ |·3 процесс окисления
$2Mn^{+7} + 3S^{+4} = 2Mn^{+4} + 3S^{+6}$
$Mn^{+7} (KMnO_4$ за счёт $Mn^{+7}$) — окислитель,
$S^{+4} (Na_2SO_3$ за счёт $S^{+4}$) — восстановитель.
Молекулярное уравнение:
$3Na_2SO_3 + 2KMnO_4 + H_2O = 3Na_2SO_4 + 2MnO_2 + 2KOH$
Ответ:
Задача 12
Для выполнения задания используйте следующий перечень веществ: пероксид водорода, перманганат калия, разбавленная серная кислота, гидроксид натрия, хлорид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. В ходе этой реакции наблюдается обесцвечивание раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$H_2O_2^{–1} + KMn^{+7}O_4 + H_2SO_4 → O_2^{0} + Mn^{+2}SO_4 + K_2SO_4 + H_2O$
$Mn^{+7} + 5ē = Mn^{+2}$ |·2 процесс восстановления
$2O^{–1} – 2ē = O_2^0$ |·5 процесс окисления
$2Mn^{+7} + 10O^{–1} = 2Mn^{+2} + 5O_2^0$
$Mn^{+7} (KMnO_4$ за счёт $Mn^{+7}$) — окислитель,
$O^{–1} (H_2O_2$ за счёт $O^{–1}$) — восстановитель.
Молекулярное уравнение:
$5H_2O_2 + 2KMnO_4 + 3H_2SO_4 = 5O_2 + 2MnSO_4 + K_2SO_4 + 8H_2O$
Можно писать реакцию в нейтральной среде
$H_2O_2^{–1} + KMn^{+7}O_4 → O_2^{0} + Mn^{+4}O_2 + KOH + H_2O$
Ответ:
Задача 13
Для выполнения задания используйте следующий перечень веществ: аммиак, перманганат калия, гидроксид калия, хлорид железа(III), нитрат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с обесцвечиванием раствора. В ходе этой реакции наблюдается образование осадка и выделение газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$N^{–3}H_3 + KMn^{+7}O_4 → N_2^0 + Mn^{+4}O_2 + KOH + H_2O$
$Mn^{+7} + 3ē = Mn^{+4}$ |·2 процесс восстановления
$2N^{–3} – 6ē = N_2^0$ |·1 процесс окисления
$2Mn^{+7} + 2N^{–3} = 2Mn^{+4} + N_2^0$
$Mn^{+7} (KMnO_4$ за счёт $Mn^{+7}$) — окислитель,
$N^{–3} (NH_3$ за счёт $N^{–3}$) — восстановитель.
Молекулярное уравнение:
$2NH_3 + 2KMnO_4 = N_2 + 2MnO_2 + 2KOH + 2H_2O$
Ответ:
Задача 14
Для выполнения задания используйте следующий перечень веществ: оксид хрома(III), нитрат калия, карбонат калия, гидросульфат натрия, хлорид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Образование осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$Cr_2^{+3}O_3 + KN^{+5}O_3 + K_2CO_3 → K_2Cr^{+6}O_4 + KN^{+3}O_2 + СO_2$
$N^{+5} + 2ē = N^{+3}$ |·3 процесс восстановления
$2Cr^{+3} – 6ē = 2Cr^{+6}$ |·1 процесс окисления
$3N^{+5} + 2Cr^{+3} = 3N^{+3} + 2Cr^{+6}$
$N^{+5} (KNO_3$ за счёт $N^{+5}$) — окислитель,
$Cr^{+3} (Cr_2O_3$ за счёт $Cr^{+3}$) — восстановитель.
Молекулярное уравнение:
$Cr_2O_3 + 3KNO_3 + 2K_2CO_3 = 2K_2CrO_4 + 3KNO_2 + 2CO_2$
Ответ:
Задача 15
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, щавелевая кислота, серная кислота, нитрат бария, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Образование осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$KMn^{+7}O_4 + H_2(C_2)^{+6}O_4 + H_2SO_4 → C^{+4}O_2 + Mn^{+2}SO_4 + K_2SO_4 + H_2O$
$(2C)^{+6} – 2ē = 2C^{+4}$ |·5 процесс окисления
$Mn^{+7} + 5ē = Mn^{+2}$ |·2 процесс восстановления
$5(2C)^{+6} + 2Mn^{+7} = 10C^{+4} + 2Mn^{+2}$
$Mn^{+7} (KMnO_4$ за счёт $Mn^{+7}$) — окислитель,
$(2C)^{+6} (H_2C_2O_4$ за счёт $(2C)^{+6}$) — восстановитель.
Молекулярное уравнение:
$2KMnO_4 + 5H_2C_2O_4 + 3H_2SO_4 = 10CO_2 + 2MnSO_4 + K_2SO_4 + 8H_2O$
Ответ:
Задача 16
Для выполнения задания используйте следующий перечень веществ: нитрит натрия, сульфат кальция, серная кислота, хлорид железа(II), нитрат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа без цвета и запаха. Образование осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$NaN^{+3}O_2 + Fe^{+2}Cl_2 + H_2SO_4 → N_2^{0} + Fe^{+3}Cl_3 + Fe_2^{+3}(SO_4)_3 + Na_2SO_4 + 4H_2O$
$2N^{+3} + 6ē = N_2^0$ |·1 процесс восстановления
$Fe^{+2} – 1ē = Fe^{+3}$ |· 6 процесс окисления
$2N^{+3} + 6Fe^{+2} = N_2^{0} + 6Fe^{+3}$
$N^{+3} (NaN^{+3}O_2$ за счёт $N^{+3}$) — окислитель,
$Fe^{+2} (Fe^{+2}Cl_2$ за счёт $Fe^{+2}$) — восстановитель.
Молекулярное уравнение:
$2NaNO_2 + 6FeCl_2 + 4H_2SO_4 = N_2 + 4FeCl_3 + Fe_2(SO_4)_3 + Na_2SO_4 + 4H_2O$
Ответ:
Задача 17
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, гидроксид натрия, сульфид меди(II), сульфат цинка, оксид хрома(III). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета вещества. Образование осадка или выделение газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительновосстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$Cr_2^{+3}O_3 + NaN^{+5}O_3 + NaOH → Na_2Cr^{+6}O_4 + NaN^{+3}O_2 + H_2O$
$N^{+5} + 2ē = N^{+3}$ |·3 процесс восстановления
$2Cr^{+3} – 6ē = 2Cr^{+6}$ |·1 процесс окисления
$3N^{+5} + 2Cr^{+3} = 3N^{+3} + 2Cr^{+6}$
$N^{+5} (NaN^{+5}O_3$ за счёт $N^{+5}$) — окислитель,
$Cr^{+3} (Cr_2^{+3}O_3$ за счёт $Cr^{+3}$) — восстановитель.
Молекулярное уравнение:
$Cr_2O_3 + 3NaNO_3 + 4NaOH = 2Na_2CrO_4 + 3NaNO_2 + 2H_2O$
Ответ:
Задача 18
Для выполнения задания используйте следующий перечень веществ: хлорид хрома(II), бихромат натрия, соляная кислота, карбонат магния, сульфат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Образование осадка или выделение газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительновосстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
$Cr^{+2}Cl_2 + Na_2Cr_2^{+6}O_7 + HCl → Cr^{+3}Cl_3 + NaCl + H_2O$
$Cr^{+2} – ē = Cr^{+3}$ | · 6 процесс окисления
$2Cr^{+6} + 6ē = 2Cr^{+3}$ |·1 процесс восстановления
$6Cr^{+2} + 2Cr^{+6} = 6Cr^{+3} + 2Cr^{+3}$
$Cr^{+2}$ ($CrCl_2$ за счёт $Cr^{+2}$) — восстановитель,
$Cr^{+6}$ ($Na_2Cr_2O_7$ за счёт $Cr^{+6}$) — окислитель.
Молекулярное уравнение:
$6CrCl_2 + Na_2Cr_2O_7 + 14HCl = 8CrCl_3 + 2NaCl + 7H_2O$
Ответ:
Задача 19
Для выполнения задания используйте следующий перечень веществ: йодид калия, йодат калия, серная кислота, гидросульфид калия, сульфат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
$5KI + KIO_3 + 3H_2SO_4 = 3I_2 + 3K_2SO_4 + 3H_2O$
$5 |2I^{–1} – 2ē = I_2^0$
$1 |2I^{+5} + 10ē = I_2^0$
Ответ:
Задача 20
Для выполнения задания используйте следующий перечень веществ: хлорид железа(II), концентрированная серная кислота, гидроксид натрия, йод, гидроксид железа(III). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
$2FeCl_2 + 4H_2SO_4 = Fe_2(SO_4)_3 + SO_2 + 4HCl + 2H_2O$
$1∣ S^{+6} + 2ē = S^{+4}$
$1∣ 2Fe^{+2} – 2ē = 2Fe^{+3}$
Ответ:
Рекомендуемые курсы подготовки
Задания на окислительно-восстановительные реакции. Типичные окислители и восстановители.
Задание №1
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления -3. Число верных ответов может быть любым.
- 1. N2H4
- 2. FeSO4
- 3. KNH2
- 4. NH4NO3
- 5. N2O5
Решение
Ответ: 34
Задание №2
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления -2. Число верных ответов может быть любым.
- 1. NH4HS
- 2. P2O3
- 3. H2O2
- 4. CaSO3
- 5. NO
Решение
Ответ: 1245
Задание №3
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления -1. Число верных ответов может быть любым.
- 1. KF
- 2. ZnS
- 3. CaH2
- 4. KClO3
- 5. FeBr3
Решение
Ответ: 135
Задание №4
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +1. Число верных ответов может быть любым.
- 1. KOH
- 2. BeSO4
- 3. N2O
- 4. Cu2O
- 5. HF
Решение
Ответ: 1345
Задание №5
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +2. Число верных ответов может быть любым.
- 1. CO
- 2. BaO2
- 3. Zn3(PO4)2
- 4. FeI2
- 5. Na2[Zn(OH)4]
Решение
Ответ: 12345
Задание №6
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +3. Число верных ответов может быть любым.
1) нитрат аммония
2) нитрит калия
3) нитрид натрия
4) фосфин
5) хлорид фосфора (III)
Решение
Ответ: 25
Задание №7
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +4. Число верных ответов может быть любым.
1) перекись водорода
2) гашеная известь
3) пирит
4) песок
5) мел
Решение
Ответ: 45
Задание №8
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +5. Число верных ответов может быть любым.
1) фосфорный ангидрид
2) азотная кислота
3) поташ
4) поваренная соль
5) бертолетова соль
Решение
Ответ: 125
Задание №9
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +6. Число верных ответов может быть любым.
1) хлорная известь
2) песок
3) серный ангидрид
4) дихромат калия
5) веселящий газ
Решение
Ответ: 34
Задание №10
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +7. Число верных ответов может быть любым.
1) перхлорат аммония
2) пероксид водорода
3) песок
4) сернистый газ
5) перманганат калия
Решение
Ответ: 15
[adsp-pro-3]
Задание №11
Из приведенного списка ионов выберите два таких, которые могут проявлять только окислительные свойства
- 1. MnO4—
- 2. NO2—
- 3. SO32-
- 4. Cr2O72-
- 5. Cl—
Решение
Ответ: 14
Задание №12
Из приведенного списка ионов выберите те, которые могут проявлять только восстановительные свойства
- 1. S2-
- 2. ClO3—
- 3. Br—
- 4. Fe3+
- 5. Sn2+
Решение
Ответ: 13
Задание №13
Из приведенного списка ионов выберите те, которые могут проявлять как окислительные, так и восстановительные свойства
- 1. Cr3+
- 2. CrO42-
- 3. SO32-
- 4. F—
- 5. I—
Решение
Ответ: 13
Задание №14
Из приведенного списка ионов выберите те, которые могут проявлять только окислительные свойства
- 1. NO3—
- 2. Cr2O72-
- 3. Br—
- 4. Cl—
- 5. ClO3—
Решение
Ответ: 12
Задание №15
Из приведенного списка ионов выберите те, которые могут проявлять только восстановительные свойства
- 1. CO32-
- 2. SiO32-
- 3. S2-
- 4. K+
- 5. Br—
Решение
Ответ: 35
Задание №16
Из приведенного списка ионов выберите два таких, которые могут проявлять как окислительные, так и восстановительные свойства
- 1. Fe2+
- 2. Cu+
- 3. CrO42-
- 4. Be2+
- 5. Rb+
Решение
Ответ: 12
Задание №17
Из приведенного списка ионов выберите два таких, которые могут проявлять только окислительные свойства
- 1. Fe2+
- 2. Cr3+
- 3. SO32-
- 4. MnO4—
- 5. PO43-
Решение
Ответ: 45
Задание №18
Из приведенного списка ионов выберите два таких, которые могут проявлять только восстановительные свойства
- 1. Pb2+
- 2. Cl—
- 3. Br—
- 4. Cs+
- 5. Rb+
Решение
Ответ: 23
Задание №19
Из приведенного списка ионов выберите два таких, которые могут проявлять как окислительные, так и восстановительные свойства
- 1. ClO3—
- 2. NO2—
- 3. ClO4—
- 4. NO3—
- 5. SO42-
Решение
Ответ: 12
Задание №20
Из приведенного списка ионов выберите два таких, которые могут проявлять только окислительные свойства
- 1. F—
- 2. ClO—
- 3. Al3+
- 4. ClO4—
- 5. Cl—
Решение
Ответ: 34
[adsp-pro-3]
Задание №21
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) CaCO3 → CO2 + CaO
2) NH4Cl → NH3 + HCl
3) Cu(OH)2 → CuO + H2O
4) NH4NO3 → N2O + 2H2O
5) 2H2O2 → 2H2O + O2
Решение
Ответ: 45
Задание №22
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) H2 + Cl2 → 2HCl
2) BaO + H2O → Ba(OH)2
3) Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
4) Ba + 2H2O → Ba(OH)2 + H2
5) 2KBr + Cl2 → 2KCl + Br2
Решение
Ответ: 23
Задание №23
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) 4KClO3 → KCl + 3KClO4
2) 2KMnO4 → K2MnO4 + MnO2 + O2
3) K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
4) 2Fe(OH)3 → Fe2O3 + 3H2O
5) NH4NO3 + NaOH → NH3 + NaNO3 + H2O
Решение
Ответ: 12
Задание №24
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) KOH + SO2 → KHSO3
2) 2KOH + 2NO2 → KNO2 + KNO3 + H2O
3) 2KOH + CO2 → K2CO3 + H2O
4) 2KOH + Si + H2O → K2SiO3 + 2H2
5) 6KOH + 3S → 2K2S + K2SO3 + 3H2O
Решение
Ответ: 13
Задание №25
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) 3Na2S + 2FeCl3 → 2FeS + S + 6NaCl
2) K2S + H2S → 2KHS
3) Li2S + 4H2O2 → Li2SO4 + 4H2O
4) Rb2S + 2HCl → 2RbCl + H2S
5) Cs2S + Cu(NO3)2 → 2CsNO3 + CuS
Решение
Ответ: 13
Задание №26
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) 2HCl + Sr(OH)2 → SrCl2 + 2H2O
2) 2HBr + Cl2 → Br2 + 2HCl
3) 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
4) 4HBr + MnO2 → MnBr2 + Br2 + 2H2O
5) 8HI + Fe3O4 → 3FeI2 + I2 + 4H2O
Решение
Ответ: 13
Задание №27
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) FeO + 4HNO3 → Fe(NO3) 3 + NO2 + 2H2O
2) FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl
3) 2Fe(OH)3 + 6HI → 2FeI2 + I2 + 6H2O
4) FeS + 2HCl → FeCl2 + H2S
5) FeCO3 → FeO + CO2
Решение
Ответ: 13
Задание №28
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) CuO + H2SO4 → CuSO4 + H2O
2) Cu2O + 6HNO3 → 2Cu(NO3)2 + 2NO2 + 3H2O
3) 2Cu(OH)2 + 4HI → 2CuI + I2 + 4H2O
4) Cu(NO3)2 + H2S → CuS + 2HNO3
5) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Решение
Ответ: 14
Задание №29
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) 2NO2 + 2RbOH → RbNO2 + RbNO3 + H2O
2) N2O5 + H2O → 2HNO3
3) NH4Cl + NaOH → NaCl + NH3 + H2O
4) NH4Cl + NaNO2 → NaCl + N2 +2H2O
5) Na3N + 3H2O → 3NaOH + NH3
Решение
Ответ: 14
Задание №30
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) 2Al + 3Cl2 → 2AlCl3
2) AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
3) Fe2O3 + 2Al → Al2O3 + 2Fe
4) Na[Al(OH)4] + CO2 → NaHCO3 + Al(OH)3
5) 2AlBr3 + 3Cl2 → 2AlCl3 + 3Br2
Решение
Ответ: 24
[adsp-pro-3]
Задание №31
Из приведенного списка реагентов выберите две таких, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. LiF + Cl2
- 2. KBr + Cl2
- 3. CsI + Br2
- 4. RbCl + I2
- 5. NaF + I2
Решение
Ответ: 23
Задание №32
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. Mg + CuSO4
- 2. Fe + AgNO3
- 3. Al2(SO4)3 + Fe2(SO4)3
- 4. Sn + Cu
- 5. Ag + KF
Решение
Ответ: 12
Задание №33
Из приведенного списка реагентов выберите те, между которыми возможно протекание окислительно-восстановительной реакции.
- 1. Al + CuO
- 2. Al + Mg
- 3. Al + Fe2O3
- 4. Al + CaO
- 5. Al + Na
Решение
Ответ: 13
Задание №34
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. H2S + HCl
- 2. HBr + HI
- 3. HBr + KMnO4
- 4. HCl + K2Cr2O7
- 5. H2O + H2
Решение
Ответ: 34
Задание №35
Из приведенного списка реагентов выберите те, между которыми возможно протекание окислительно-восстановительной реакции.
1) H3PO4 + HNO3
2) NH3 + O2
3) NH3 + H2
4) KMnO4 + K2Cr2O7
5) H2 + O2
Решение
Ответ: 25
Задание №36
Из приведенного списка реагентов выберите те, между которыми возможно протекание окислительно-восстановительной реакции.
- 1. S + O2
- 2. Al + O2
- 3. H2SO4 + O2
- 4. HNO3 + CO2
- 5. KMnO4 + KNO3
Решение
Ответ: 12
Задание №37
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. BaBr2 + Cl2
- 2. BeF2 + Cl2
- 3. CuI + Br2
- 4. FeF3 + Br2
- 5. ZnO + O2
Решение
Ответ: 13
Задание №38
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
1) SO3 + O2
2) P2O3 + O2
3) KMnO4 + O2
4) K2CrO4 + KMnO4
5) SO2 + H2O2
Решение
Ответ: 25
Задание №39
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
1) H2O2 + K2SO3
2) Fe(NO3)2 + HNO3
3) Cu + Al
4) O2 + CuSO4
5) SO3 + CO2
Решение
Ответ: 12
Задание №40
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. Zn + KNO3
- 2. K + O2
- 3. HI + HBr
- 4. HCl + KMnO4
- 5. Fe + Cu
Решение
Ответ: 24
[adsp-pro-3]
Задание №41
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. KMnO4
- 2. MnSO4
- 3. H2O
- 4. K2CrO4
- 5. Fe
Решение
Ответ: 14
Задание №42
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. HI
- 2. LiOH
- 3. NH3
- 4. Fe2O3
- 5. Cl2
Решение
Ответ: 13
Задание №43
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. K2SO3
- 2. Na2Cr2O7
- 3. HNO3
- 4. CO
- 5. HCl
Решение
Ответ: 23
Задание №44
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. H2
- 2. CO
- 3. H2SO4
- 4. H3PO4
- 5. HNO3
Решение
Ответ: 12
Задание №45
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. Al
- 2. KMnO4
- 3. NaF
- 4. ZnS
- 5. Na2Cr2O7
Решение
Ответ: 25
Задание №46
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. KBrO3
- 2. H2O
- 3. O2
- 4. Zn
- 5. C
Решение
Ответ: 45
Задание №47
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. BeO
- 2. HBr
- 3. Sn
- 4. K2Cr2O7
- 5. O2
Решение
Ответ: 45
Задание №48
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. O3
- 2. N2O5
- 3. Al
- 4. K
- 5. Cl2
Решение
Ответ: 34
Задание №49
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. K2Cr2O7
- 2. H2
- 3. Ca(OH)2
- 4. BaSO3
- 5. HNO3
Решение
Ответ: 15
Задание №50
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. PH3
- 2. MgO
- 3. HI
- 4. NaMnO4
- 5. F2
Решение
Ответ: 13
[adsp-pro-3]
Задание №51
Установите соответствие между уравнением реакции и свойством аммиака в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО АММИАКА |
|
А) NH3 + HCl → NH4Cl Б) AI2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4 В) 4NH3 + 3O2 → 2N2 + 6H2O |
1) окислитель 2) восстановитель 3) окислитель и восстановитель 4) не проявляет окислительно-восстановительных свойств |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 442
Задание №52
Установите соответствие между уравнением реакции и свойством выделенного вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) K2SO3 + 2HBr → 2KBr + SO2 + H2O Б) Na2SO3 + H2O2 → Na2SO4 + H2O В) SO2 + 2H2S → 3S + 2H2O |
1) не проявляет окислительно-восстановительных свойств 2) окислитель 3) восстановитель 4) и окислитель, и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №53
Установите соответствие между уравнением реакции и свойством выделенного вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) 2NaNO2 + 2NaI + 2H2SO4 → 2Na2SO4 + I2 + 2NO + 2H2O Б) 5KNO2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 5KNO3 + 3H2O В) 4NO2 + O2 + 2H2O → 4HNO3 |
1) окислитель и восстановитель 2) не проявляет окислительно-восстановительных свойств 3) окислитель 4) восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 344
Задание №54
Установите соответствие между уравнением реакции и свойством фосфора в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ФОСФОРА |
|
А) P + 5HNO3 → H3PO4 +5NO2 + H2O Б) 3K + P → K3P В) 2P + 5Cl2 → 2PCl5 |
1) восстановитель 2) окислитель и восстановитель 3) не проявляет окислительно-восстановительных свойств 4) окислитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 141
Задание №55
Установите соответствие между уравнением реакции и свойством элемента железа в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ЖЕЛЕЗА |
|
А) 2FeCl2 + Cl2 → 2FeCl3 Б) 2FeCl2 + 4H2SO4 → Fe2(SO4)3 + 4HCl + SO2 + 2H2O В) FeO + 2HBr → FeBr2 + H2O |
1) окислитель 2) восстановитель 3) окислитель и восстановитель 4) не проявляет окислительно-восстановительных свойств |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 224
Задание №56
Установите соответствие между уравнением реакции и свойством выделенного в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) 2KBr + 2H2SO4 → Br2 + K2SO4 + SO2 + 2H2O Б) NaBr + AgNO3 → AgBr + NaNO3 В) HBr + KHCO3 → KBr + CO2 + H2O |
1) не проявляет окислительно-восстановительных свойств 2) окислитель 3) восстановитель 4) окислитель и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 311
Задание №57
Установите соответствие между уравнением реакции и свойством выделенного в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) CuSO4 + Ba(OH)2 → BaSO4 + Cu(OH)2 Б) 2CuSO4 + 4KI → 2CuI + I2 + 2K2SO4 В) CuCl2 + Cu → 2CuCl |
1) окислитель и восстановитель 2) не проявляет окислительно-восстановительных свойств 3) окислитель 4) восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 233
Задание №58
Установите соответствие между уравнением реакции и свойством выделенного вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) 4H2O2 + PbS → PbSO4 + 4H2O Б) H2O2 + Cl2 → O2 + 2HCl В) 2H2O2 → 2H2O + O2 |
1) восстановитель 2) окислитель и восстановитель 3) не проявляет окислительно-восстановительных свойств 4) окислитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 412
Задание №59
Установите соответствие между уравнением реакции и свойством выделенного в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) CrCl3 + 3AgNO3 → 3AgCl + Cr(NO3)3 Б) 2CrCl3 + Zn → ZnCl2 + 2CrCl2 В) CrCl3 + 3NH3 +3H2O → Cr(OH)3 + 3NH4Cl |
1) окислитель 2) восстановитель 3) окислитель и восстановитель 4) не проявляет окислительно-восстановительных свойств |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 414
Задание №60
Установите соответствие между уравнением реакции и свойством серы в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) 3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O Б) S + Zn → ZnS В) 2S + Cl2 → S2Cl2 |
1) не проявляет окислительно-восстановительных свойств 2) окислитель 3) восстановитель 4) окислитель и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 423
[adsp-pro-3]
Задание №61
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
K2Cr2O7 + HBr → KBr + CrBr3 + Br2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
K2Cr2O7 + 14HBr = 2KBr + 2CrBr3 + 3Br2 + 7H2O
Задание №62
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
NaMnO4 + HCl → NaCl + MnCl2 + Cl2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2NaMnO4 + 16HCl = 2NaCl + 2MnCl2 + 5Cl2 + 8H2O
Задание №63
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
HNO3 + PH3 → H3PO4 + NO2 +H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
8HNO3 + PH3 = H3PO4 + 8NO2 +4H2O
Задание №64
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
FeCl3 + K2S → FeS + S + KCl
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Задание №65
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cu + HNO3(разб) → Cu(NO3)2 + NO + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Задание №66
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Al + H2SO4 → Al2(SO4)3 + H2S + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
8Al + 15H2SO4 = 4Al2(SO4)3 + 3H2S + 12H2O
Задание №67
<
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cl2 + KOH → KCl + KClO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Задание №68
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
C + HNO3 → CO2 + NO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
C + 4HNO3 = CO2 + 4NO2 + 2H2O
Задание №69
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cr(OH)3 + H2O2 + KOH → K2CrO4 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
Задание №70
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KNO3 + KOH + MnO2 → K2MnO4 + KNO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KNO3 + 2KOH + MnO2 = K2MnO4 + KNO2 + H2O
[adsp-pro-3]
Задание №71
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KClO3 + HCl → KCl + Cl2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
Задание №72
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
I2 + KOH → KI + KIO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3I2 + 6KOH = 5KI + KIO3 + 3H2O
Задание №73
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Pb + HNO3 → Pb(NO3)2 + NO + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O
Задание №74
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
Задание №75
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KMnO4 + Na2SO3 + H2SO4 → K2SO4 + Na2SO4 + MnSO4 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2KMnO4 + 5Na2SO3 + 3H2SO4 = K2SO4 + 5Na2SO4 + 2MnSO4 + 3H2O
Задание №76
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
K2Cr2O7 + FeSO4 + H2SO4 → K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
K2Cr2O7 + 6FeSO4 + 7H2SO4 = K2SO4 + Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O
Задание №77
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cl2 + KOH + Fe(OH)3 → K2FeO4 + KCl + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Cl2 + 10KOH + 2Fe(OH)3 = 2K2FeO4 + 6KCl + 8H2O
Задание №78
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
H2SO4 + S → SO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2H2SO4 + S = 3SO2 + 2H2O
Задание №79
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KNO3 + Al + KOH + H2O → K[Al(OH)4] + NH3
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3KNO3 + 8Al + 5KOH + 18H2O → 8K[Al(OH)4] + 3NH3
Задание №80
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Al2S3 + HNO3 → Al2(SO4)3 + NO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Al2S3 + 24HNO3 = Al2(SO4)3 + 24NO2 + 12H2O
[adsp-pro-3]
Задание №81
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Ca3(PO4)2 + C + SiO2 → CaSiO3 + CO + P
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 5CO + 2P
Задание №82
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
PH3 + HNO3 → H3PO4 + NO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
Задание №83
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
NO2 + O2 + H2O → HNO3
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4NO2 + O2 + 2H2O = 4HNO3
Задание №84
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
NH3 + O2 → N2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4NH3 + 3O2 = 2N2 + 6H2O
Задание №85
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
S + NaOH → Na2S + Na2SO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Задание №86
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KMnO4 + K2SO3 + H2O → K2SO4 + MnO2 + KOH
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2KMnO4 + 3K2SO3 + H2O = 3K2SO4 + 2MnO2 + 2KOH
Задание №87
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Br2 + NaOH → NaBr + NaBrO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3H2O
Задание №88
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KBrO3 + HBr → KBr + Br2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KBrO3 + 6HBr = KBr + 3Br2 + 3H2O
Задание №89
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Al2S3 + O2 → Al2O3 + SO2
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2Al2S3 + 9O2 = 2Al2O3 + 6SO2
Задание №90
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O
[adsp-pro-3]
Задание №91
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cr(OH)3 + Br2 + KOH → K2CrO4 + KBr + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2Cr(OH)3 + 3Br2 + 10KOH = 2K2CrO4 + 6KBr + 8H2O
Задание №92
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
K2Cr2O7 + CrCl2 + HCl → KCl + CrCl3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
K2Cr2O7 + 6CrCl2 + 14HCl = 2KCl + 8CrCl3 + 7H2O
Задание №93
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + H2О
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2О
Задание №94
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KNO3 + MnO2 + KOH → K2MnO4 + KNO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KNO3 + MnO2 + 2KOH = K2MnO4 + KNO2 + H2O
Задание №95
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Fe2O3 + HI → FeI2 + I2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Fe2O3 + 6HI → 2FeI2 + I2 + 3H2O
Задание №96
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Fe(NO3)3 → Fe2O3 + NO2 + O2
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Задание №97
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cu2O + HNO3 → Cu(NO3)2 + NO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2 + 3H2O
Задание №98
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cu + H2SO4 → CuSO4 + SO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Задание №99
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Задание №100
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KNO3 + Zn + KOH + H2O → K2[Zn(OH)4] + NH3
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KNO3 + 4Zn + 7KOH + 6H2O → 4K2[Zn(OH)4] + NH3
[adsp-pro-10]
Открытый урок элективного курса
«Решение задач повышенной сложности по химии. Подготовка к ЕГЭ. 11 класс»
Тема урока: «Окислительно-восстановительные реакции. Электронно-ионный метод составления уравнений ОВР. Системный подход к решению задания ЕГЭ №30»
Тип урока: Изучение новой темы на основе комплексного применения ранее полученных знаний.
Основные цели и задачи:
А) Образовательные:
* сформировать у обучающихся понятия о важнейших окислителях и восстановителях;
* научить общим принципам составления уравнений ОВР, протекающих в растворах (электронно-ионный метод);
* научить прогнозировать окислительные или восстановительные свойства веществ, а также продукты их восстановления или окисления в зависимости от условий;
* научить системному подходу к решению задания №30 в формате ЕГЭ.
Б) Развивающие:
* развивать мышление учащихся, научить их делать логические выводы из наблюдений;
* развивать умение выделять общие и существенные признаки; отличать несущественные признаки; умение применять знания на практике;
* закрепить умения и навыки химического эксперимента, умение работать со справочным материалом (таблицы, опорные схемы, справочники и т.д.);
* развивать познавательные умения: выделять главное, вести конспект, делать выводы.
В) Воспитательные:
* формировать интерес учащихся к изучению химии, умение использовать приобретённые знания в практических целях (например, применение ОВР для получения металлов и других веществ; роль окислительно-восстановительных процессов в коррозии металлов и защита от неё и т.д.);
* воспитание мотивации к обучению, ответственного и серьёзного отношения к занятиям;
* воспитание дисциплинированности, умения работать в коллективе, уважения к учителю и одноклассникам.
Интегративная учебная проблема: «Почему одни вещества в реакции проявляют свойства восстановителя, а другие – окислителя? Как безошибочно определить роль того или иного вещества в ОВР, а также продукты их превращений?»
Тип урока: урок усвоения нового материала.
Технологии: проблемное, исследовательское, групповое и дифференцированное обучение; ИКТ.
Форма организации учебной деятельности учащихся: частично-поисковая деятельность, создание проблемных ситуаций; индивидуальная работа и в группах.
Учебно-методическое и материально-техническое обеспечение:
— учебник О.С. Габриеляна «Химия. 11 класс»;
— Комплекс материалов для подготовки учащихся к ЕГЭ по химии (под ред. Кавериной А.А.)
— таблица растворимости веществ в воде;
— электрохимический ряд напряжения металлов; опорные схемы по теории ОВР;
— мультимедийные средства (ПК, проектор и экран для демонстрации слайдов);
— доска ученическая, мел.
Оборудование: карточки задания для самостоятельной работы.
Ход урока
Учитель:
Мы продолжаем изучать окислительно-восттановительные процессы. Давайте вспомним основные положения теории ОВР:
-
Какие реакции относятся к ОВР?
-
Дайте определение понятия «степень окисления».
-
Как определяется степень окисления атома элемента в молекуле вещества?
-
Что такое окисление? Восстановление? Могут ли эти процессы существовать независимо друг от друга?
-
Что такое окислитель и восстановитель?
-
Как изменяется степень окисления в процессах окисления и восстановления?
-
Можно ли подбирать коэффициенты при составлении уравнений ОВР «на глазок»? Какие вам известны приемы при подборе коэффициентов?
Какое важнейшее правило лежит в основе составления электронного баланса?
Ответы учеников:
-
ОВР – это реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ.
-
Степень окисления (С.О.) – это условный заряд атома элемента в молекуле, вычисленный из предположения, что молекула состоит только из ионов. Положительная С.О. определяется числом электронов, оттянутых от данного атома, а отрицательная – числом электронов, смещённых от других атомов.
-
Чтобы рассчитать С.О. элемента в соединении, необходимо знать постоянные степени окисления некоторых химических элементов, а также то, что алгебраическая сумма степеней окисления всех атомов в молекуле вещества равна нулю. С.О. простых веществ равна нулю!
-
Окислением называется отдача электронов атомом, молекулой или ионом. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Эти два взаимопротивоположных процесса неразрывно связаны между собой: не существует окисления без восстановления и наоборот.
-
Вещество, атомы, молекулы или ионы которого в процессе реакции отдают электроны, называется восстановителем. Вещество, атомы, молекулы или ионы которого в процессе реакции принимают электроны, называется окислителем.
-
В процессе окисления С.О. восстановителя повышается. При восстановлении С.О. окислителя понижается.
-
Изменение С.О. элементов в ОВР обусловлено распространением электронов между окислителем и восстановителем. При этом число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Метод электронного баланса основан на сравнении С.О. атомов в исходных и конечных веществах, для чего составляют электронные уравнения и на их основе вычисляют коэффициенты.
Учитель:
Для ОВР, протекающих в растворах, существенную роль играет среда раствора, так как часто продукты восстановления большинства окислителей зависят от реакции среды, в которой протекает данная ОВР. Метод электронного баланса для таких ОВР имеет ряд недостатков: не учитывает реально существующие ионы в растворе; не позволяет прогнозировать продукты ОВР.
Влияние среды раствора, в котором протекает восстановление перманганат-иона, можно отразить следующей схемой:
Mn2+←(H+)← MnO4—→(OH—)→MnO42-
↓
(H2O)
↓
MnO2
Рассмотрим реакцию восстановления перманганата калия нитритом натрия в сернокислой среде. Нитрит натрия в результате окисления превращается в нитрат натрия. Катионы Mn2+, образующиеся в результате восстановления перманганата калия, связываются сульфат-ионами в сульфат марганца (II).
KMnO4 + NaNO2 + H2SO4 → MnSO4 + NaNO3 + K2SO4 + H2O.
Электронный баланс: Mn+7 (+5е—) → Mn+2│5 │2
N+3 (- 2e—) → N+5 │2 │5
2KMnO4 + 5 NaNO2 +3 H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O.
Как видно, при составлении электронных уравнений мы вычленяем отдельные атомы, которые на самом деле в растворе отсутствуют.
В электронно-ионном методе (метод полуреакций) коэффициенты находят с помощью электронно-ионных уравнений. Последние отличаются от электронных уравнений (метод электронного баланса) тем, что в них учитывают ионы, образующиеся в результате диссоциации реагирующих веществ и реально существующие в водном растворе (учитель предлагает написать данное уравнение в полной ионной форме, после чего выписать из него частицы, несущие в себе окислитель и восстановитель и продукты их превращений).
При составлении электронно-ионных уравнений следует учитывать изменение не только зарядов ионов, но, весьма часто, и их состава, например, при восстановлении перманганат-иона по схеме: MnO4— → Mn2+, и во многих других случаях. Такие взаимные переходы сопряжены в общем случае с участием в них молекул воды или содержащихся в расвторе ионов Н+ и ОН—. Если реакция идет в кислой среде, то при составлении полуреакций используют ионы Н— или молекулы Н2О; в щелочной среде – ионы ОН— или молекулы Н2О; в нейтральной среде – ионы Н+, ОН— и молекулы Н2О.
При составлении электронно-ионных уравнений необходимо обратить внимание на число атомов кислорода в исходных и образующихся частицах – молекулах, ионах. В связи с этим целесообразно опираться на следующие правила:
Правило 1
Если исходная частица (А) содержит кислорода больше, чем образующаяся (Б), то освобождающийся кислород связывается в кислых растворах ионами Н+ в воду (1), а нейтральных и щелочных растворах – в гидроксид-ионы (2):
-
О2- + 2Н+ → Н2О или А + Н+ → Б + Н2О
-
О2- + Н2О → 2ОН— или А + Н2О → Б + ОН—
Правило 2
Если исходная частица (А) содержит кислорода меньше, чем образующаяся (Б), то недостаток атомов кислорода восполняется в кислых и нейтральных растворах за счет молекул воды (1), а в щелочных – за счет гидроксид-ионов (2):
-
Н2О → О2- + 2Н+ или А + Н2О → Б + 2Н+
-
2ОН— → О2- + Н2О или Б + ОН— → Б + Н2О
В соответствии с вышеописанными правилами составим электронно-ионные уравнения (полуреакции).
Рассмотрим последовательность, которой рекомендуется придерживаться при составлении окислительно – восстановительных реакций.
Пример 1. При окислении K2SO3 перманганатом калия в кислой среде последний восстанавливается в ионы 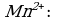
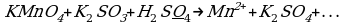
Решение. Составляем электронно-ионные уравнения по этапам.
1 этап.
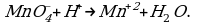
Так как в ионе 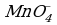
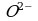
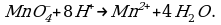
Чтобы стрелку заменить знаком равенства, надо, чтобы равенство было не только по числу атомов элементов, но и по зарядам.
Подсчитаем суммарные заряды в левой и правой частях полуреакции:
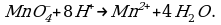
+7 +2
Для сохранения равенства зарядов левую часть схемы следует дополнить пятью электронами:

2 этап. Составляем полуреакцию процесса окисления:
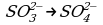
Так как в исходном ионе содержится меньше кислорода, чем в образующемся, то недостаток атомов кислорода восполним за счет молекулы воды:
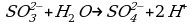
Число атомов каждого элемента одинаково в левой и правой частях схемы; для восполнения условия равенства зарядов из левой части вычитаем два электрона:

3 этап. Запишем две полуреакции вместе и по правилам нахождения наименьшего кратного определим множители, на которые надо умножить обе полуреакции:


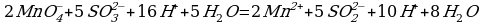
Производим сокращение:

Из этого уравнения видно, что окисление ионов 
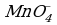
4 этап. Составляем молекулярное уравнение. Для этого к левой части ионного уравнения приписываем каждому иону противоион, такое же число ионов приписываем к правой части уравнения:
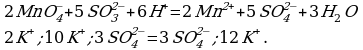
При написании продуктов реакции необходимо учитывать, что каждый ион из верхней строчки соединится с противоположным ионом из нижней (2 иона 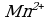
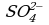
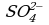
Записываем молекулярное уравнение:
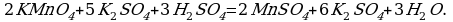
Как мы с вами убедились, данную реакцию можно уравнять как с помощью метода электронного баланса, так и с позиции метода полуреакций. Однако, существуют такие ОВР, уравнения которых невозможно составить, опираясь на метод электронного баланса:
FeSO4 + KMnO4 + H2O → ?
Метод полуреакций позволит нам правильно спрогнозировать продукты данной ОВР. Окислителем являются перманганат-ионы MnO4—, которые в нейтральной среде восстанавливается до MnO2↓, а восстановителем – ионы Fe2+, которые могут быть окислены в ионы Fe3+. Cоставим электронно-ионные уравнения и просуммируем их с учетом коэффициентов:
Fe2+ (-e—)→ Fe3+ │1│3
MnO4— + 2H2O (+3e—)→ MnO2↓ + 4OH— │3 │1
3Fe2+ + MnO4— + 2H2O → 3Fe3+ + MnO2↓ + 4OH— (суммарное уравнение в сокращенной ионной форме)
Как видно, в продуктах ОВР имеем одновременно ионы Fe3+ и OH—, которые будут взаимодействовать между собой с образованием гидроксокатиона FeOH+:
3Fe3+ + 4OH— → 3FeOH+ + OH—.
Cледовательно, правая часть суммарного уравнения преображается следующим образом:
… → 3FeOH+ + OH— + MnO2↓
Преобразуем сокращенную ионную форму ОВР в молекулярную и получим:
3FeSO4 + KMnO4 + 2H2O = 3FeOHSO4 + MnO2 + KOH
Задания для самостоятельного выполнения (раздается группам учеников на карточках):
Карточка 1.
Cоставьте уравнение реакции восстановления дихромата калия концентрированной соляной кислотой.
Решение:
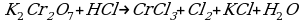
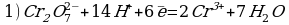
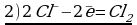
Сr2O72- + 14H+ + 6Cl— = 2Cr3+ + 3Cl2 + 7H2O
K2Сr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Комментарий:
Восстановитель (HCl) в ходе реакции дополнительно выполняет функцию солеобразователя. Одна молекула K2Cr2O7 окисляет шесть модекул HCl, образуя три молекулы хлора (3Cl2), а восемь молекул HCl расходуются на образование солей (2KCl+2CrCl3).
Карточка 2.
Cоставьте уравнение реакции окисления хлорида хрома (III) бромной водой в щелочной среде.
Решение:
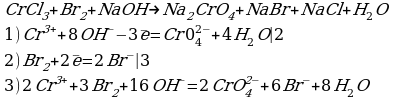
Комментарий:
Из этого ионного уравнения видна роль щелочи: окисление ионов Cr3+ в 

4)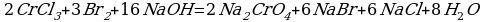
Учитель:
По опыту сдачи ЕГЭ в 2018 году мы знаем насколько усложнилось задание №30 второй части. Если раньше требовалось доставить пропущенные вещества в левой и правой частях уравнения и подобрать коэффициенты методом электронного баланса, то теперь перед выпускником стоит сложнейшая задача — самому выбрать окислитель, восстановитель и реакцию среды, в которой протекает ОВР, а также спрогнозировать продукты ОВР. Это на порядок усложняет данное задание.
Предлагаю разработать системный подход к решению данного задания. Для этого мы должны четко представлять себе, какие свойства (окислительные или восстановительные ?) способно проявлять то или иное вещество. В качестве вспомогательного материала будем использовать составленную ранее таблицу, в которой отражены не только важнейшие окислители и восстановители, но также наиболее типичные превращения веществ.
Важнейшие восстановители и окислители
|
Воссстановители |
Окислители |
|
Все металлы (Ме0): Ме0 – ne— → Me+n Уголь (углерод, кокс): С0 – 2е— → С+2 С0 – 4е— → С+4 Оксид углерода (II): С+2О – 2е— → С+4О2 Сульфид-ион (сероводород, сульфиды): S-2 – 2e— → S0 (часто) S-2 – 6e— → S+4 (реже) S-2 – 8e— → S+6 (реже) Сернистая кислота и ее соли (сульфиты): (SO3)-2 – 2e— → (SO4)-2 Галогенид-ионы Наl— (Cl—, Br—, I—): 2Hal— — 2e— → Hal02 Хлорид олова (II): SnCl2 -2e— → SnCl4 Сульфат железа (II); 2FeSO4 -2e— → Fe2(SO4)3 Cульфат марганца (II); (MnO4)-2 ß (+OH)Mn+2(+H+) à (MnO4)— ↓ (+H2O) MnO2 Сульфат хрома (II) CrSO4: 2CrSO4 – 2e— → Cr2(SO4)3 Сульфат хрома (III) Cr2(SO4)3: (CrO4)-2 ß (+OH—) Cr+3 (+H+) à (Cr2O7)-2 Азотистая кислота и ее соли (нитриты): (NO2)— — 2e— → (NO3)— Аммиак NH3: NO ß NH3 à N2 ↓ NO2 Фосфористая кислота Н3РО3 и ее соли (фосфиты): (РО3)-3 – 2е— → (РО4)-3 Перекись водорода Н2О2 и пероксиды щелочных и щелочноземельных металлов (Na2O2): (O2)-2 — 2e— → O20↑ Катод при электролизе |
Галогены Hal20 (F2, Cl2, Br2): Hal20 + 2e— → 2Hal— Перманганат-ион (MnO4)—: (MnO4)-2 ß (+OH—)(MnO4)—(+H+) à Mn+2 (+Н2О)↓ MnO2 Ди(би)хромат-ион (Сr2O7)-2: (CrO4)-2ß (+OH—)(Сr2 O7)-2(+H+) à Cr+3 (+H2O)↓ Cr(OH)3 Азотная кислота HNO3: HNO3 (конц.) + малоакт.Ме → NO2 HNO3 (разб.) + малоакт.Ме → NO HNO3 (разб.) + активный Ме → N2, N2O HNO3 (оч.разб.) + активный Ме → NH4NO3 Кислород О2: О2 +4е— → 2О-2 Перекись водорода Н2О2 и пероксиды щелочных и щелочноземельных металлов (Na2O2): (O2)-2 + 2e— → 2O-2 В кислой среде: Н2О2 + 2Н+ + 2е— → 2Н2О В щелочной среде: Н2О2 + 2е— → 2ОН— Концентрированная серная кислота: H2SO4 (конц.) + малоакт.Ме → SO2 H2SO4 (конц.) + среднеакт.Ме → S0 H2SO4 (конц.) + активныйМе → H2S Оксид меди (II): СuO + e → Cu+ СuO + 2e → Cu0 Оксид серебра: Ag2O +2e— → 2Ag0 Хлорид железа (III): FeCl3 + e— → FeCl2 Оксид свинца (IV): PbO2 + 2e— → Pb+2 ( в кислой среде, напр., PbCl2) Анионы (ClO)—, (ClO2)—, (ClO3)—, (ClO4)— при восстановлении переходят в Cl— или Cl20 Анод при электролизе |
Таким образом, решение задания №30 можно представить в виде следующего пошагового алгоритма:
1 ШАГ
На основании данной таблицы и понимания зависимости окислительно-восстановительных свойств сложных веществ от степени окисления элементов, входящих в состав молекул, делаем вывод об ОВ-свойствах данных в задании веществ. При этом присваиваем выбранным веществам «ярлычок»: «окислитель», «восстановитель», «ОВ-двойственность».
2 ШАГ
Помним, что в перечень веществ могут входить «лишние» вещества, которые не участвуют в предполагаемых ОВР (но участвуют в РИО, см. Задание №31), а также вещества, которые могут быть использованы в качестве среды раствора. Им мы тоже присваиваем «ярлычки»: «среда», «РИО», «лишнее».
3 ШАГ
После того как «развесили ярлычки» начинаем составлять левую часть уравнения ОВР: выбираем из перечня веществ восстановитель, окислитель и среду раствора.
4 ШАГ
Зватем, прогнозируя продукты ОВР, составляем правую часть уравнения. Для сложных реакций на стадии прогнозирования можно воспользоваться методом полуреакций.
5 ШАГ
Составляем электронные уравнения окисления и восстановления (электронный баланс) и определяем коэффициенты.
Пример решения задания №30 ЕГЭ
Задание:
Перечень веществ: водород, гидроксид магния, серная кислота (конц.), магний, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Решение:
ШАГ 1.
Запишем химические формулы веществ из предложенного перечня:
H2, Mg(OH)2, H2SO4 (конц.), Mg, KMnO4.
Определим окислительно-восстановительные свойства веществ – присвоим веществам «ярлычки»:
H2 – восстановитель, но по отношению к магнию – окислитель (t0);
Mg(OH)2 – не будет проявлять ОВ-свойств, т.к. в состав вещества входят химические элементы с постоянной С.О. («РИО»);
H2SO4 (конц.) – окислитель (за счет S+6);
Mg – восстановитель;
KMnO4 – окислитель в растворе (за счет Mn+7).
ШАГ 2.
Выберем вещества, между которыми возможна ОВР: Mg и H2SO4 (конц.)
ШАГ 3.
Составим левую часть уравнения:
Mg + H2SO4(конц.)→ …
ШАГ 4.
Прогнозируем продукты:
Mg окисляется в ион Mg2+, который в условиях данной реакции входит в состав соли – сульфата магния MgSO4;
H2SO4 (конц.) восстанавливается металлом, расположенным в ряду напряжений до алюминия, до сероводорода H2S.
Концентрированная серная кислота в данной ОВР играет двоякую роль – окислителя и среды (солеобразователя), при этом в продуктах образуется также вода.
Таким образом, схема данной ОВР имеет вид:
Mg + H2SO4 (конц.) → MgSO4 + H2S + Н2О
ШАГ 5.
Составляем уравнения электронного баланса и определяем коэффициенты:
Mg0 – 2e— → Mg+2 │2 │8│4
S+6 + 8e— → S-2 │8 │2 │1
Окончательное уравнение ОВР:
4Mg + 5H2SO4 (конц.) → 4MgSO4 + H2S + 4Н2О
Задания для самостоятельного выполнения с последующим обменом между группами:
Вариант 1.
Перечень веществ: йодоводород, фтор,хлорат калия, йод, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Вариант 2.
Перечень веществ: оксид хрома (III), сероводород, гидроксид калия, серная кислота, хлор. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.

