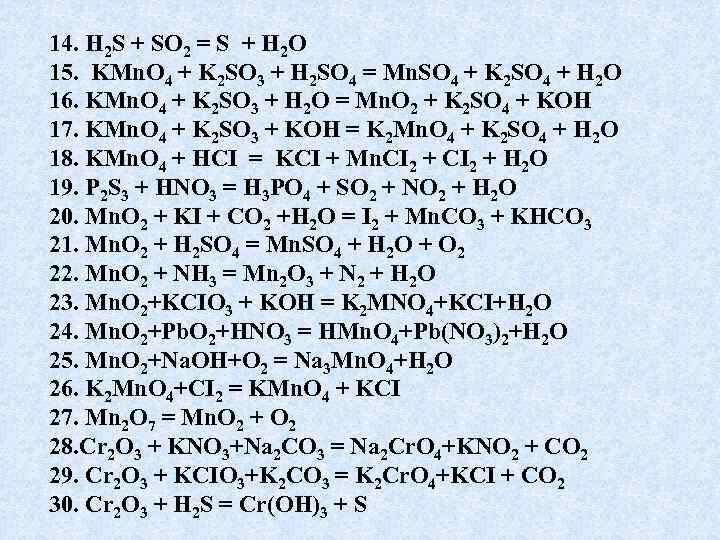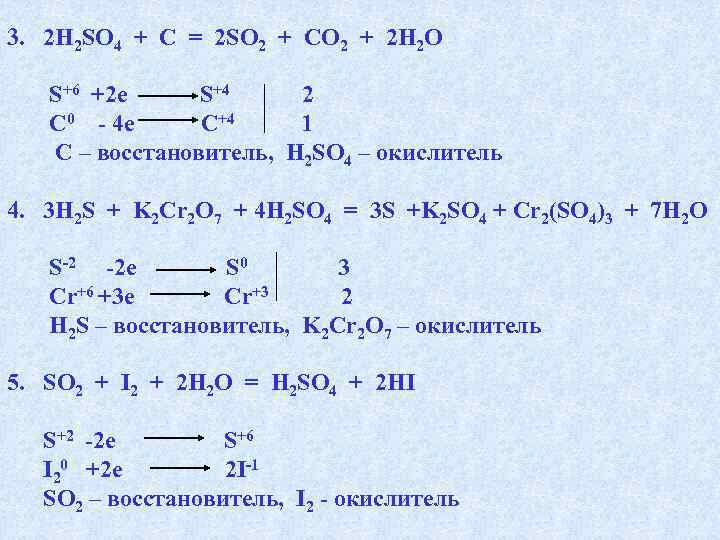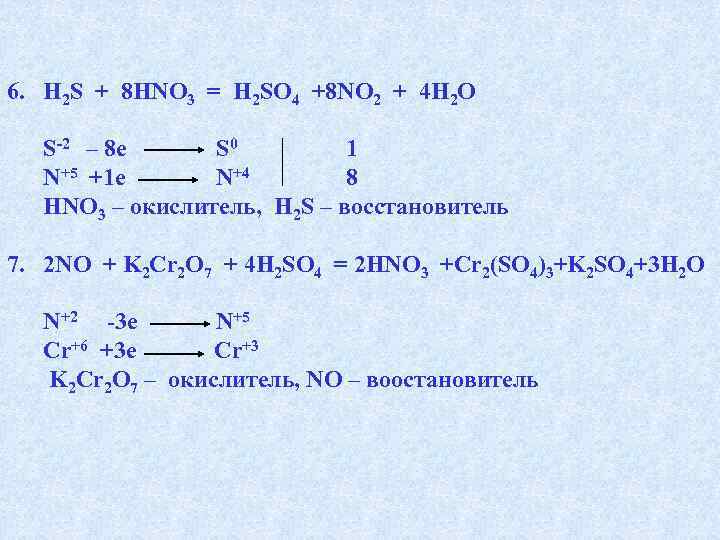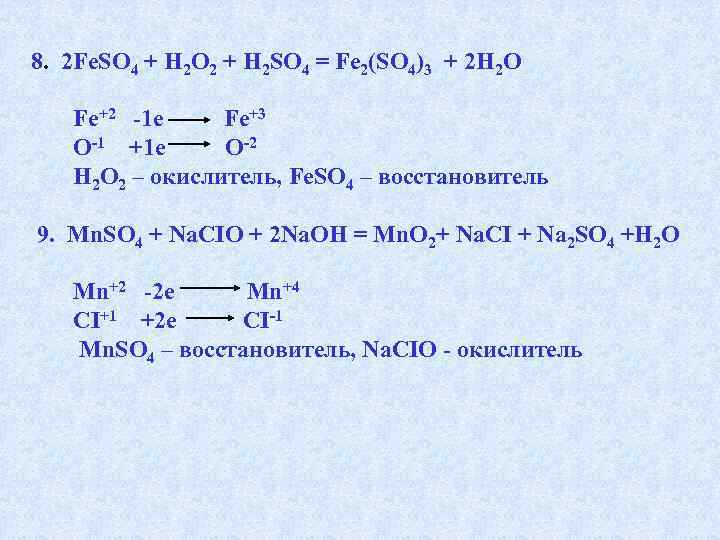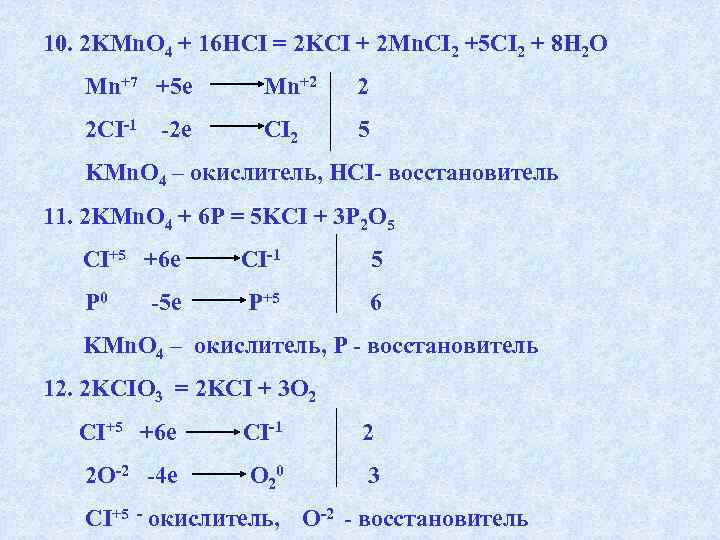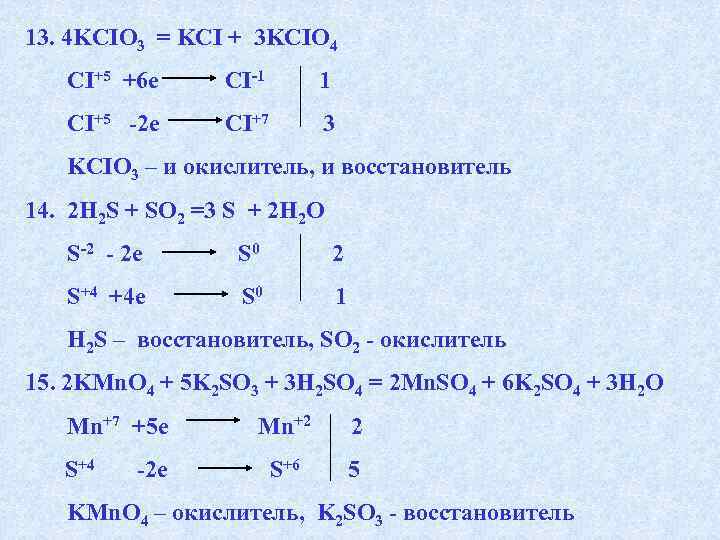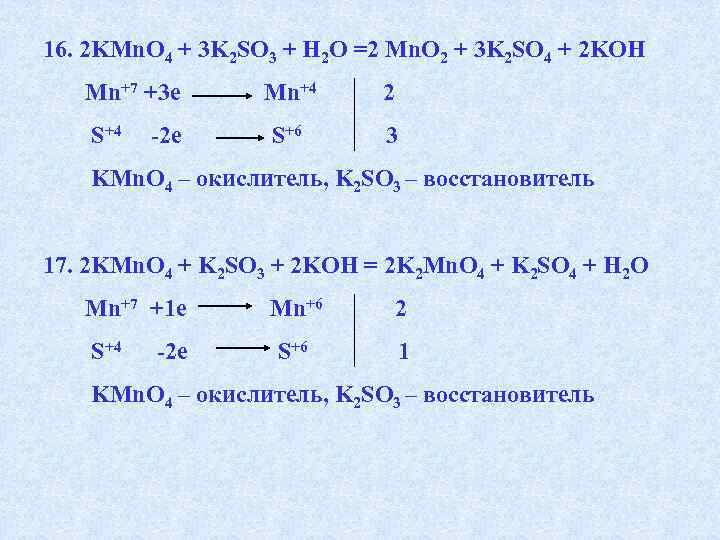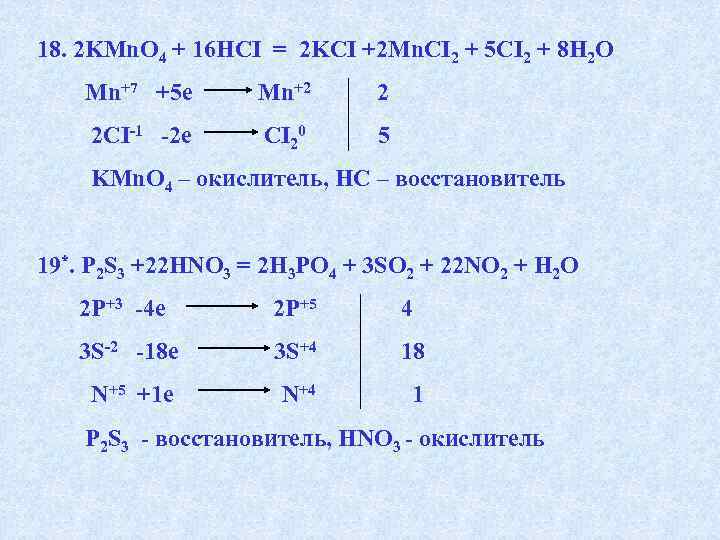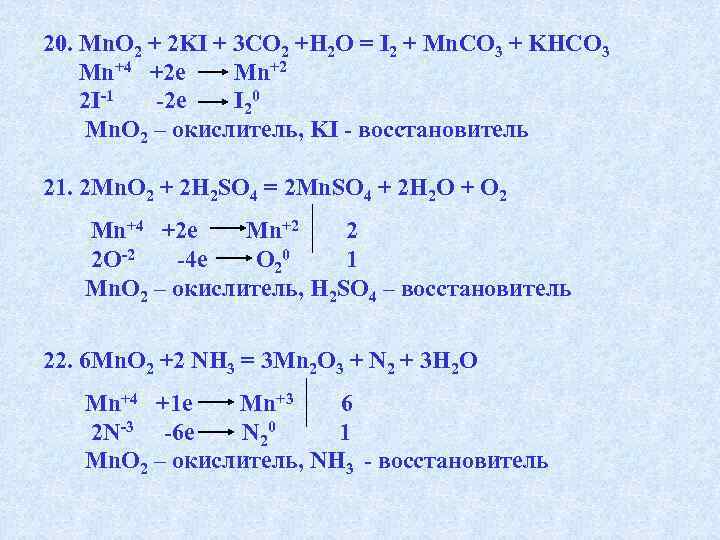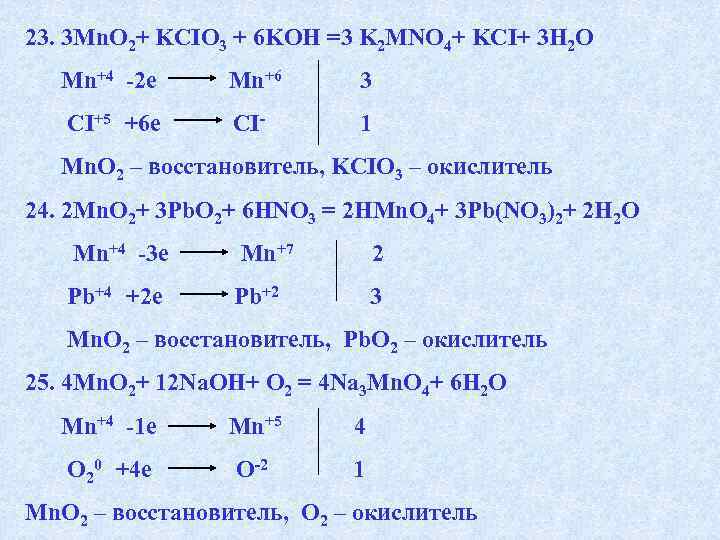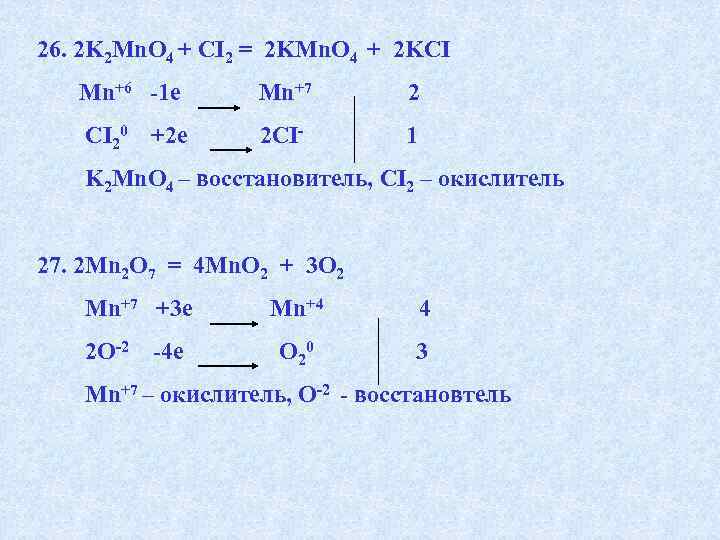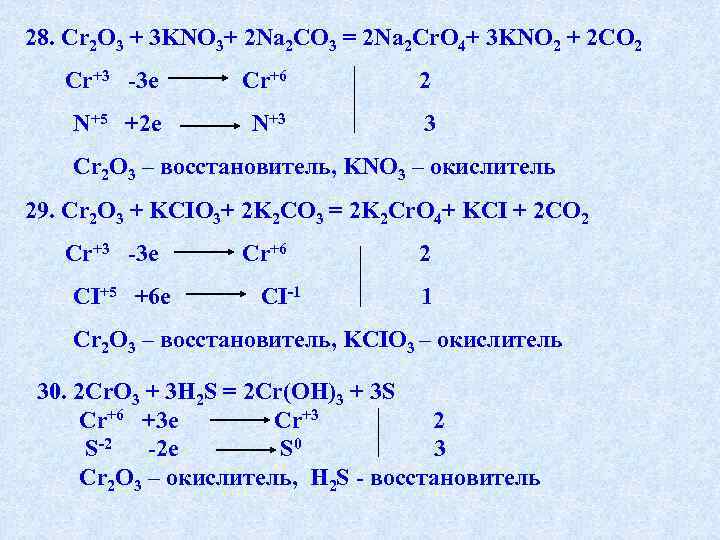Реакции
окислительно-восстановительные (№ 10)
1)Установите
соответствие между уравнением реакции и формулой вещества, являющегося
окислителем в данной реакции: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
|
УРАВНЕНИЕ РЕАКЦИИ |
ОКИСЛИТЕЛЬ |
|
А) SO2 + NO2 = SO3 + |
1) |
2) Установите
соответствие между схемой реакции и степенью окисления окислителя:
|
СХЕМА РЕАКЦИИ |
СТЕПЕНЬ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ |
|
А) H2S+Cl2+H2O→HCl+H2SO4 |
1) +4 |
3)Установите
соответствие между уравнением реакции и формулой вещества, являющегося
восстановителем в данной реакции:
|
УРАВНЕНИЕ РЕАКЦИИ |
ВОССТАНОВИТЕЛЬ |
|
А) 2NH3 + 2K = 2KNH2 + H2 |
1) NO |
4)Установите
соответствие между уравнением реакции и изменением степени окисления окислителя
в данной реакции:
|
УРАВНЕНИЕ РЕАКЦИИ |
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ |
|
А) 2NH3+2Na=2NaNH2+H2 |
1) −1→0 |
5) Установите
соответствие между уравнением реакции и изменением степени окисления окислителя
в данной реакции
|
УРАВНЕНИЕ РЕАКЦИИ |
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ |
|
А) SO2+NO2=SO3+NO |
1) –1→0 |
6)Установите
соответствие между схемой окислительно-восстановительной реакции и веществом,
которое является в ней восстановителем:
|
СХЕМА РЕАКЦИИ |
ФОРМУЛА ВОССТАНОВИТЕЛЯ |
|
А) Br2+KOH→KBr+KBrO3 |
1) Br2 |
7)Установите
соответствие между уравнением реакции и формулой вещества, являющегося
восстановителем в данной реакции:
|
УРАВНЕНИЕ РЕАКЦИИ |
ВОССТАНОВИТЕЛЬ |
|
А) SO2+NO2=SO3+NO |
1) NH3 |

соответствие между изменением степени окисления хлора в реакции и формулами
исходных веществ, которые вступают в эту реакцию:
|
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ |
ФОРМУЛЫ ИСХОДНЫХ ВЕЩЕСТВ |
|
А) Cl0→Cl– |
1) KClO3 (нагревание) |
9)Установите
соответствие между формулой вещества и степенью окисления хрома:
|
ФОРМУЛА ВЕЩЕСТВА |
СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА |
|
А) NaCrO2 |
1) +7 |
10)Установите
соответствие между формулой вещества и степенью окисления азота:
|
ФОРМУЛА ВЕЩЕСТВА |
СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА |
|
А) NF3 |
1) –3 |
11) Установите
соответствие между схемой окислительно-восстановительной реакции и
коэффициентом перед формулой восстановителя:
|
СХЕМА РЕАКЦИИ |
КОЭФФИЦИЕНТ ПЕРЕД ВОССТАНОВИТЕЛЕМ |
|
А) NH3+CuO→Cu+N2+H2O |
1) 2 |
12) Установите
соответствие между схемой реакции и формулой вещества, которое в данной реакции
является окислителем:.
|
СХЕМА РЕАКЦИИ |
ФОРМУЛА ОКИСЛИТЕЛЯ |
|
А) H2S + Br2 → S + HBr |
1) |
13) Установите
соответствие между схемой окислительно-восстановительной реакции и веществом,
которое является в ней окислителем:
|
СХЕМА РЕАКЦИИ |
ФОРМУЛА ОКИСЛИТЕЛЯ |
|
А) Cl2 + KOH → KCl + KClO3 |
1) |
14) Установите
соответствие между схемой реакции и степенью окисления восстановителя
|
СХЕМА РЕАКЦИИ |
СТЕПЕНЬ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ |
|
А) NH4Cl + CuO → N2 + Cu + |
1) +3 |
15) Установите
соответствие между изменением степени окисления хрома и уравнением реакции, в
которой это изменение происходит:
|
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ |
УРАВНЕНИЕ РЕАКЦИИ |
|
А) Cr+3 → Cr0 |
1) |
16) Установите
соответствие между изменением степени окисления хлора в реакции и формулами
веществ, которые вступают в эту реакцию
|
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ |
ФОРМУЛЫ ИСХОДНЫХ ВЕЩЕСТВ |
|
А) Cl0 → Cl– |
1) KClO3 (нагревание) |
17)Установите
соответствие между схемой окислительно-восстановительной реакции и формулой
вещества, которое является в ней восстановителем:
|
СХЕМА РЕАКЦИИ |
ФОРМУЛА ВОССТАНОВИТЕЛЯ |
|
А) Cl2 + H2O → HCl + HClO |
1) |
18) Установите
соответствие между схемой реакции и свойством серы, которое она проявляет в
этой реакции:
|
СХЕМА РЕАКЦИИ |
СВОЙСТВО СЕРЫ |
|
А) SO3 + NaOH → Na2SO4 + |
1) является окислителем |
19) Установите
соответствие между уравнением реакции и формулой вещества, являющегося
восстановителем в данной реакции:
|
УРАВНЕНИЕ РЕАКЦИИ |
ВОССТАНОВИТЕЛЬ |
|
А) 2NH3 + 2Na = 2NaNH2 + H2 |
1) |
20) Установите
соответствие между формулой вещества и степенью окисления серы в нём:
|
ФОРМУЛА ВЕЩЕСТВА |
СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ |
|
А) Na2S2 |
1) –2 |
21) Установите
соответствие между уравнением реакции и изменением степени окисления
восстановителя в данной реакции:
|
УРАВНЕНИЕ РЕАКЦИИ |
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ |
|
А) 2NH3 + 2Na = 2NaNH2 + H2 |
1) +2 → 0 |
22) Установите
соответствие между схемой окислительно-восстановительной реакции и веществом,
которое является в ней восстановителем:
|
СХЕМА РЕАКЦИИ |
ВОССТАНОВИТЕЛЬ |
|
А) Cl2 + H2O → HCl + HClO |
1) |
23) Установите
соответствие между реагентами и схемами превращения элемента азота:.
|
РЕАГЕНТЫ |
СХЕМА ПРЕВРАЩЕНИЯ |
|
А) азот и литий |
1) N0→N+3 |
24) Установите
соответствие между схемой реакции и степенью окисления восстановителя:
|
СХЕМА РЕАКЦИИ |
СТЕПЕНЬ ОКИСЛЕНИЯ |
|
А) HCl + MnO2 → MnCl2 + H2O |
1) +4 |
25) Установите
соответствие между схемой окислительно-восстановительной реакции и
коэффициентом перед окислителем:
|
СХЕМА РЕАКЦИИ |
КОЭФФИЦИЕНТ ПЕРЕД ОКИСЛИТЕЛЕМ |
|
А) NH3 + CuO → N2 + Cu |
1) 6 |
26)Установите
соответствие между уравнением реакции и формулой вещества, являющегося
окислителем в данной реакции
|
УРАВНЕНИЕ РЕАКЦИИ |
ОКИСЛИТЕЛЬ |
|
А) SO2 + NO2 = SO3 + |
1) |
Материал подготовлен по материалам вебинара «Организация подготовки к ЕГЭ по химии: окислительно-восстановительные реакции»

Задание №30, рассматривающее окислительно-восстановительные реакции, — задание высокого уровня сложности. Чтобы получить высший балл (3) за его выполнение, в ответе ученика должно быть:
- определение степени окисления элементов, которые являются окислителем и восстановителем;
- окислитель и восстановитель (элементы или вещества);
- процессы окисления и восстановления, и на их основе составленный электронный (электронно-ионный) баланс;
- определение недостающих в уравнении реакции веществ.
Однако ученики часто пропускают, не расставляют коэффициенты, не указывают окислитель и восстановитель, степени окисления. Каким же образом нужно организовать работу на уроке, чтобы достичь хороших результатов на экзамене?

Особое внимание в учебнике О. С. Габриеляна для 10 класса, предназначенного для изучения предмета в объеме 3–4 часов в неделю, уделено прикладным темам: в пособии освещаются связанные с химией вопросы экологии, медицины, биологии и культуры. В 11 классе происходит завершение и обобщение курса.
Тематическое планирование
Естествознание. Базовый уровень. 11 класс. Книга для учителя
1. Подготовка к экзамену должна осуществляться в процессе преподавания учебного предмета и нельзя сводить подготовку только к тренировке в выполнении заданий, аналогичных заданиям экзаменационной работы. Такое «натаскивание» не развивает мышление, не углубляет понимание. А ведь, между прочим, в экзаменационном задании указано, что допускаются иные формулировки ответа, не искажающие его смысла. Это значит, что творчески, с пониманием подойдя к решению поставленной задачи, можно получить высший балл за выполнение, даже если ответ сформулирован иначе.
Главная задача подготовки к экзамену — целенаправленная работа по повторению, систематизации и обобщению изученного материала, по приведению в систему знаний ключевых понятий курса химии. Конечно, обязателен опыт проведения реального химического эксперимента.
Вебинары для учителей химии
Открытые уроки по химии
2. Есть перечень тем и понятий, которые школьникам совсем нельзя забывать. Среди них:
- правила для определения степеней окисления атомов (в простых веществах степень окисления элементов равна нулю, высшая (максимальная) степень окисления элементов II—VII групп, как правило, равна номеру группы, в которой находится элемент в периодической таблице, низшая (минимальная) степень окисления металлов равна нулю и т.д.);
- важнейшие окислители и восстановители, а также то, что процесс окисления всегда сопровождается процессом восстановления;
- окислительно-восстановительная двойственность;
- типы ОВР (межмолекулярные, внутримолекулярные, реакции конпропорционирования, реакции диспропорционирования (самоокисления-самовосстановления)).
УМК «Химия» (углубленный уровень, линия УМК Н. Е. Кузнецовой) позволяет максимально полно подготовиться к экзамену по теме «Окислительно-восстановительные реакции». В учебном пособии подробно рассматривается, что такое степень окисления, какие реакции можно назвать окислительно-восстановительными. Расписано по пунктам, как правила вычисления степени окисления.

Углубленное изучение химии в 10–11 классах предполагает проведение занятий в объеме 105 часов. Учебники ориентированы как на достижение предметных результатов в области «Естественные науки», так и на разностороннее личностное развитие школьников.
Мастер-класс доктора физико-математических наук В. В. Еремина (МГУ им. М.В. Ломоносова)
Олег Габриелян: «Химия — экспериментальный предмет»
В таблицу занесены типы окислительно-восстановительных реакций, факторы, влияющие на протекание реакций (фото страниц). Подробно разобраны примеры, а, кроме того, есть задания по теме «ОВР» в формате ЕГЭ.
Например:
«Используя метод электронного баланса, составьте уравнение химической реакции:
N2O + KMnO4 + … = NO2 + … + K2SO4 + Н2О
Укажите окислитель и восстановитель».
Впрочем, для отработки решения задач даны самые разные примеры. Например, в пособии «Химия. Углубленный уровень. 11 класс. Контрольные работы» есть такие:
«Исходя из теории окислительно-восстановительных процессов, укажите схемы невозможных реакций.
-
SO2 + H2S → S + H2O
-
S + H2SO4 → SO2 + H2O
-
S + H2SO4 → H2S + H2O
-
K2SO3 + K2Cr2O7 + H2SO4 → K2SO4 + K2CrO4 + H2O
-
KMnO4 + HCl → Cl2 + MnCl2 + KCl + H2O
-
I2 + SO2 + H2O → HIO3 + H2SO4
Ответ обоснуйте. Преобразуйте схемы возможных процессов в уравнения реакций. Укажите окислитель и восстановитель»
«Составьте уравнения реакций в соответствии со схемой изменения степеней окисления атомов углерода: С0 → С–4 → С–4 → С+4 → С+2 → С–2».
«Даны вещества: углерод, оксид азота(IV), оксид серы (IV), водный раствор гидроксида калия. Напишите уравнения четырёх возможных реакций между этими веществами, не повторяя пары реагентов».
Все это позволяет максимально полно изучить тему окислительно-восстановительных реакций и отработать решение самых разных задач.
Методические пособия для учителей по химии
Технологическая карта урока
Смотреть вебинар «Организация подготовки к ЕГЭ по химии: окислительно-восстановительные реакции»
*С мая 2017 года объединенная издательская группа «ДРОФА-ВЕНТАНА» входит в корпорацию «Российский учебник». В корпорацию также вошли издательство «Астрель» и цифровая образовательная платформа «LECTA». Генеральным директором назначен Александр Брычкин, выпускник Финансовой академии при Правительстве РФ, кандидат экономических наук, руководитель инновационных проектов издательства «ДРОФА» в сфере цифрового образования (электронные формы учебников, «Российская электронная школа», цифровая образовательная платформа LECTA). До прихода в издательство «ДРОФА» занимал позицию вице-президента по стратегическому развитию и инвестициям издательского холдинга «ЭКСМО-АСТ».
Сегодня издательская корпорация «Российский учебник» обладает самым крупным портфелем учебников, включенных в Федеральный перечень — 485 наименований (примерно 40%, без учета учебников для коррекционной школы). Издательствам корпорации принадлежат наиболее востребованные российскими школами комплекты учебников по физике, черчению, биологии, химии, технологии, географии, астрономии — областям знаний, которые нужны для развития производственного потенциала страны. В портфель корпорации входят учебники и учебные пособия для начальной школы, удостоенные Премии Президента в области образования. Это учебники и пособия по предметным областям, которые необходимы для развития научно-технического и производственного потенциала России.
Задания на окислительно-восстановительные реакции. Типичные окислители и восстановители.
Задание №1
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления -3. Число верных ответов может быть любым.
- 1. N2H4
- 2. FeSO4
- 3. KNH2
- 4. NH4NO3
- 5. N2O5
Решение
Ответ: 34
Задание №2
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления -2. Число верных ответов может быть любым.
- 1. NH4HS
- 2. P2O3
- 3. H2O2
- 4. CaSO3
- 5. NO
Решение
Ответ: 1245
Задание №3
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления -1. Число верных ответов может быть любым.
- 1. KF
- 2. ZnS
- 3. CaH2
- 4. KClO3
- 5. FeBr3
Решение
Ответ: 135
Задание №4
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +1. Число верных ответов может быть любым.
- 1. KOH
- 2. BeSO4
- 3. N2O
- 4. Cu2O
- 5. HF
Решение
Ответ: 1345
Задание №5
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +2. Число верных ответов может быть любым.
- 1. CO
- 2. BaO2
- 3. Zn3(PO4)2
- 4. FeI2
- 5. Na2[Zn(OH)4]
Решение
Ответ: 12345
Задание №6
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +3. Число верных ответов может быть любым.
1) нитрат аммония
2) нитрит калия
3) нитрид натрия
4) фосфин
5) хлорид фосфора (III)
Решение
Ответ: 25
Задание №7
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +4. Число верных ответов может быть любым.
1) перекись водорода
2) гашеная известь
3) пирит
4) песок
5) мел
Решение
Ответ: 45
Задание №8
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +5. Число верных ответов может быть любым.
1) фосфорный ангидрид
2) азотная кислота
3) поташ
4) поваренная соль
5) бертолетова соль
Решение
Ответ: 125
Задание №9
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +6. Число верных ответов может быть любым.
1) хлорная известь
2) песок
3) серный ангидрид
4) дихромат калия
5) веселящий газ
Решение
Ответ: 34
Задание №10
Из приведенного списка соединений выберите те, в которых присутствуют атомы в степени окисления +7. Число верных ответов может быть любым.
1) перхлорат аммония
2) пероксид водорода
3) песок
4) сернистый газ
5) перманганат калия
Решение
Ответ: 15
[adsp-pro-3]
Задание №11
Из приведенного списка ионов выберите два таких, которые могут проявлять только окислительные свойства
- 1. MnO4—
- 2. NO2—
- 3. SO32-
- 4. Cr2O72-
- 5. Cl—
Решение
Ответ: 14
Задание №12
Из приведенного списка ионов выберите те, которые могут проявлять только восстановительные свойства
- 1. S2-
- 2. ClO3—
- 3. Br—
- 4. Fe3+
- 5. Sn2+
Решение
Ответ: 13
Задание №13
Из приведенного списка ионов выберите те, которые могут проявлять как окислительные, так и восстановительные свойства
- 1. Cr3+
- 2. CrO42-
- 3. SO32-
- 4. F—
- 5. I—
Решение
Ответ: 13
Задание №14
Из приведенного списка ионов выберите те, которые могут проявлять только окислительные свойства
- 1. NO3—
- 2. Cr2O72-
- 3. Br—
- 4. Cl—
- 5. ClO3—
Решение
Ответ: 12
Задание №15
Из приведенного списка ионов выберите те, которые могут проявлять только восстановительные свойства
- 1. CO32-
- 2. SiO32-
- 3. S2-
- 4. K+
- 5. Br—
Решение
Ответ: 35
Задание №16
Из приведенного списка ионов выберите два таких, которые могут проявлять как окислительные, так и восстановительные свойства
- 1. Fe2+
- 2. Cu+
- 3. CrO42-
- 4. Be2+
- 5. Rb+
Решение
Ответ: 12
Задание №17
Из приведенного списка ионов выберите два таких, которые могут проявлять только окислительные свойства
- 1. Fe2+
- 2. Cr3+
- 3. SO32-
- 4. MnO4—
- 5. PO43-
Решение
Ответ: 45
Задание №18
Из приведенного списка ионов выберите два таких, которые могут проявлять только восстановительные свойства
- 1. Pb2+
- 2. Cl—
- 3. Br—
- 4. Cs+
- 5. Rb+
Решение
Ответ: 23
Задание №19
Из приведенного списка ионов выберите два таких, которые могут проявлять как окислительные, так и восстановительные свойства
- 1. ClO3—
- 2. NO2—
- 3. ClO4—
- 4. NO3—
- 5. SO42-
Решение
Ответ: 12
Задание №20
Из приведенного списка ионов выберите два таких, которые могут проявлять только окислительные свойства
- 1. F—
- 2. ClO—
- 3. Al3+
- 4. ClO4—
- 5. Cl—
Решение
Ответ: 34
[adsp-pro-3]
Задание №21
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) CaCO3 → CO2 + CaO
2) NH4Cl → NH3 + HCl
3) Cu(OH)2 → CuO + H2O
4) NH4NO3 → N2O + 2H2O
5) 2H2O2 → 2H2O + O2
Решение
Ответ: 45
Задание №22
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) H2 + Cl2 → 2HCl
2) BaO + H2O → Ba(OH)2
3) Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
4) Ba + 2H2O → Ba(OH)2 + H2
5) 2KBr + Cl2 → 2KCl + Br2
Решение
Ответ: 23
Задание №23
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) 4KClO3 → KCl + 3KClO4
2) 2KMnO4 → K2MnO4 + MnO2 + O2
3) K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
4) 2Fe(OH)3 → Fe2O3 + 3H2O
5) NH4NO3 + NaOH → NH3 + NaNO3 + H2O
Решение
Ответ: 12
Задание №24
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) KOH + SO2 → KHSO3
2) 2KOH + 2NO2 → KNO2 + KNO3 + H2O
3) 2KOH + CO2 → K2CO3 + H2O
4) 2KOH + Si + H2O → K2SiO3 + 2H2
5) 6KOH + 3S → 2K2S + K2SO3 + 3H2O
Решение
Ответ: 13
Задание №25
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) 3Na2S + 2FeCl3 → 2FeS + S + 6NaCl
2) K2S + H2S → 2KHS
3) Li2S + 4H2O2 → Li2SO4 + 4H2O
4) Rb2S + 2HCl → 2RbCl + H2S
5) Cs2S + Cu(NO3)2 → 2CsNO3 + CuS
Решение
Ответ: 13
Задание №26
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) 2HCl + Sr(OH)2 → SrCl2 + 2H2O
2) 2HBr + Cl2 → Br2 + 2HCl
3) 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
4) 4HBr + MnO2 → MnBr2 + Br2 + 2H2O
5) 8HI + Fe3O4 → 3FeI2 + I2 + 4H2O
Решение
Ответ: 13
Задание №27
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) FeO + 4HNO3 → Fe(NO3) 3 + NO2 + 2H2O
2) FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl
3) 2Fe(OH)3 + 6HI → 2FeI2 + I2 + 6H2O
4) FeS + 2HCl → FeCl2 + H2S
5) FeCO3 → FeO + CO2
Решение
Ответ: 13
Задание №28
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) CuO + H2SO4 → CuSO4 + H2O
2) Cu2O + 6HNO3 → 2Cu(NO3)2 + 2NO2 + 3H2O
3) 2Cu(OH)2 + 4HI → 2CuI + I2 + 4H2O
4) Cu(NO3)2 + H2S → CuS + 2HNO3
5) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Решение
Ответ: 14
Задание №29
Из приведенного списка реакций выберите две таких, которые относятся к окислительно-восстановительным
1) 2NO2 + 2RbOH → RbNO2 + RbNO3 + H2O
2) N2O5 + H2O → 2HNO3
3) NH4Cl + NaOH → NaCl + NH3 + H2O
4) NH4Cl + NaNO2 → NaCl + N2 +2H2O
5) Na3N + 3H2O → 3NaOH + NH3
Решение
Ответ: 14
Задание №30
Из приведенного списка реакций выберите две таких, которые не относятся к окислительно-восстановительным
1) 2Al + 3Cl2 → 2AlCl3
2) AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
3) Fe2O3 + 2Al → Al2O3 + 2Fe
4) Na[Al(OH)4] + CO2 → NaHCO3 + Al(OH)3
5) 2AlBr3 + 3Cl2 → 2AlCl3 + 3Br2
Решение
Ответ: 24
[adsp-pro-3]
Задание №31
Из приведенного списка реагентов выберите две таких, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. LiF + Cl2
- 2. KBr + Cl2
- 3. CsI + Br2
- 4. RbCl + I2
- 5. NaF + I2
Решение
Ответ: 23
Задание №32
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. Mg + CuSO4
- 2. Fe + AgNO3
- 3. Al2(SO4)3 + Fe2(SO4)3
- 4. Sn + Cu
- 5. Ag + KF
Решение
Ответ: 12
Задание №33
Из приведенного списка реагентов выберите те, между которыми возможно протекание окислительно-восстановительной реакции.
- 1. Al + CuO
- 2. Al + Mg
- 3. Al + Fe2O3
- 4. Al + CaO
- 5. Al + Na
Решение
Ответ: 13
Задание №34
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. H2S + HCl
- 2. HBr + HI
- 3. HBr + KMnO4
- 4. HCl + K2Cr2O7
- 5. H2O + H2
Решение
Ответ: 34
Задание №35
Из приведенного списка реагентов выберите те, между которыми возможно протекание окислительно-восстановительной реакции.
1) H3PO4 + HNO3
2) NH3 + O2
3) NH3 + H2
4) KMnO4 + K2Cr2O7
5) H2 + O2
Решение
Ответ: 25
Задание №36
Из приведенного списка реагентов выберите те, между которыми возможно протекание окислительно-восстановительной реакции.
- 1. S + O2
- 2. Al + O2
- 3. H2SO4 + O2
- 4. HNO3 + CO2
- 5. KMnO4 + KNO3
Решение
Ответ: 12
Задание №37
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. BaBr2 + Cl2
- 2. BeF2 + Cl2
- 3. CuI + Br2
- 4. FeF3 + Br2
- 5. ZnO + O2
Решение
Ответ: 13
Задание №38
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
1) SO3 + O2
2) P2O3 + O2
3) KMnO4 + O2
4) K2CrO4 + KMnO4
5) SO2 + H2O2
Решение
Ответ: 25
Задание №39
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
1) H2O2 + K2SO3
2) Fe(NO3)2 + HNO3
3) Cu + Al
4) O2 + CuSO4
5) SO3 + CO2
Решение
Ответ: 12
Задание №40
Из приведенного списка реагентов выберите те, между которыми при обычных условиях возможно протекание окислительно-восстановительной реакции.
- 1. Zn + KNO3
- 2. K + O2
- 3. HI + HBr
- 4. HCl + KMnO4
- 5. Fe + Cu
Решение
Ответ: 24
[adsp-pro-3]
Задание №41
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. KMnO4
- 2. MnSO4
- 3. H2O
- 4. K2CrO4
- 5. Fe
Решение
Ответ: 14
Задание №42
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. HI
- 2. LiOH
- 3. NH3
- 4. Fe2O3
- 5. Cl2
Решение
Ответ: 13
Задание №43
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. K2SO3
- 2. Na2Cr2O7
- 3. HNO3
- 4. CO
- 5. HCl
Решение
Ответ: 23
Задание №44
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. H2
- 2. CO
- 3. H2SO4
- 4. H3PO4
- 5. HNO3
Решение
Ответ: 12
Задание №45
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. Al
- 2. KMnO4
- 3. NaF
- 4. ZnS
- 5. Na2Cr2O7
Решение
Ответ: 25
Задание №46
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. KBrO3
- 2. H2O
- 3. O2
- 4. Zn
- 5. C
Решение
Ответ: 45
Задание №47
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. BeO
- 2. HBr
- 3. Sn
- 4. K2Cr2O7
- 5. O2
Решение
Ответ: 45
Задание №48
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. O3
- 2. N2O5
- 3. Al
- 4. K
- 5. Cl2
Решение
Ответ: 34
Задание №49
Из приведенного списка веществ выберите те, которые проявляют выраженные окислительные свойства
- 1. K2Cr2O7
- 2. H2
- 3. Ca(OH)2
- 4. BaSO3
- 5. HNO3
Решение
Ответ: 15
Задание №50
Из приведенного списка веществ выберите те, которые проявляют выраженные восстановительные свойства
- 1. PH3
- 2. MgO
- 3. HI
- 4. NaMnO4
- 5. F2
Решение
Ответ: 13
[adsp-pro-3]
Задание №51
Установите соответствие между уравнением реакции и свойством аммиака в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО АММИАКА |
|
А) NH3 + HCl → NH4Cl Б) AI2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4 В) 4NH3 + 3O2 → 2N2 + 6H2O |
1) окислитель 2) восстановитель 3) окислитель и восстановитель 4) не проявляет окислительно-восстановительных свойств |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 442
Задание №52
Установите соответствие между уравнением реакции и свойством выделенного вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) K2SO3 + 2HBr → 2KBr + SO2 + H2O Б) Na2SO3 + H2O2 → Na2SO4 + H2O В) SO2 + 2H2S → 3S + 2H2O |
1) не проявляет окислительно-восстановительных свойств 2) окислитель 3) восстановитель 4) и окислитель, и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №53
Установите соответствие между уравнением реакции и свойством выделенного вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) 2NaNO2 + 2NaI + 2H2SO4 → 2Na2SO4 + I2 + 2NO + 2H2O Б) 5KNO2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 5KNO3 + 3H2O В) 4NO2 + O2 + 2H2O → 4HNO3 |
1) окислитель и восстановитель 2) не проявляет окислительно-восстановительных свойств 3) окислитель 4) восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 344
Задание №54
Установите соответствие между уравнением реакции и свойством фосфора в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ФОСФОРА |
|
А) P + 5HNO3 → H3PO4 +5NO2 + H2O Б) 3K + P → K3P В) 2P + 5Cl2 → 2PCl5 |
1) восстановитель 2) окислитель и восстановитель 3) не проявляет окислительно-восстановительных свойств 4) окислитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 141
Задание №55
Установите соответствие между уравнением реакции и свойством элемента железа в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ЖЕЛЕЗА |
|
А) 2FeCl2 + Cl2 → 2FeCl3 Б) 2FeCl2 + 4H2SO4 → Fe2(SO4)3 + 4HCl + SO2 + 2H2O В) FeO + 2HBr → FeBr2 + H2O |
1) окислитель 2) восстановитель 3) окислитель и восстановитель 4) не проявляет окислительно-восстановительных свойств |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 224
Задание №56
Установите соответствие между уравнением реакции и свойством выделенного в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) 2KBr + 2H2SO4 → Br2 + K2SO4 + SO2 + 2H2O Б) NaBr + AgNO3 → AgBr + NaNO3 В) HBr + KHCO3 → KBr + CO2 + H2O |
1) не проявляет окислительно-восстановительных свойств 2) окислитель 3) восстановитель 4) окислитель и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 311
Задание №57
Установите соответствие между уравнением реакции и свойством выделенного в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) CuSO4 + Ba(OH)2 → BaSO4 + Cu(OH)2 Б) 2CuSO4 + 4KI → 2CuI + I2 + 2K2SO4 В) CuCl2 + Cu → 2CuCl |
1) окислитель и восстановитель 2) не проявляет окислительно-восстановительных свойств 3) окислитель 4) восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 233
Задание №58
Установите соответствие между уравнением реакции и свойством выделенного вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) 4H2O2 + PbS → PbSO4 + 4H2O Б) H2O2 + Cl2 → O2 + 2HCl В) 2H2O2 → 2H2O + O2 |
1) восстановитель 2) окислитель и восстановитель 3) не проявляет окислительно-восстановительных свойств 4) окислитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 412
Задание №59
Установите соответствие между уравнением реакции и свойством выделенного в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) CrCl3 + 3AgNO3 → 3AgCl + Cr(NO3)3 Б) 2CrCl3 + Zn → ZnCl2 + 2CrCl2 В) CrCl3 + 3NH3 +3H2O → Cr(OH)3 + 3NH4Cl |
1) окислитель 2) восстановитель 3) окислитель и восстановитель 4) не проявляет окислительно-восстановительных свойств |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 414
Задание №60
Установите соответствие между уравнением реакции и свойством серы в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) 3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O Б) S + Zn → ZnS В) 2S + Cl2 → S2Cl2 |
1) не проявляет окислительно-восстановительных свойств 2) окислитель 3) восстановитель 4) окислитель и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 423
[adsp-pro-3]
Задание №61
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
K2Cr2O7 + HBr → KBr + CrBr3 + Br2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
K2Cr2O7 + 14HBr = 2KBr + 2CrBr3 + 3Br2 + 7H2O
Задание №62
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
NaMnO4 + HCl → NaCl + MnCl2 + Cl2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2NaMnO4 + 16HCl = 2NaCl + 2MnCl2 + 5Cl2 + 8H2O
Задание №63
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
HNO3 + PH3 → H3PO4 + NO2 +H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
8HNO3 + PH3 = H3PO4 + 8NO2 +4H2O
Задание №64
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
FeCl3 + K2S → FeS + S + KCl
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Задание №65
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cu + HNO3(разб) → Cu(NO3)2 + NO + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Задание №66
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Al + H2SO4 → Al2(SO4)3 + H2S + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
8Al + 15H2SO4 = 4Al2(SO4)3 + 3H2S + 12H2O
Задание №67
<
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cl2 + KOH → KCl + KClO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Задание №68
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
C + HNO3 → CO2 + NO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
C + 4HNO3 = CO2 + 4NO2 + 2H2O
Задание №69
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cr(OH)3 + H2O2 + KOH → K2CrO4 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
Задание №70
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KNO3 + KOH + MnO2 → K2MnO4 + KNO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KNO3 + 2KOH + MnO2 = K2MnO4 + KNO2 + H2O
[adsp-pro-3]
Задание №71
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KClO3 + HCl → KCl + Cl2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
Задание №72
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
I2 + KOH → KI + KIO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3I2 + 6KOH = 5KI + KIO3 + 3H2O
Задание №73
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Pb + HNO3 → Pb(NO3)2 + NO + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O
Задание №74
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
Задание №75
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KMnO4 + Na2SO3 + H2SO4 → K2SO4 + Na2SO4 + MnSO4 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2KMnO4 + 5Na2SO3 + 3H2SO4 = K2SO4 + 5Na2SO4 + 2MnSO4 + 3H2O
Задание №76
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
K2Cr2O7 + FeSO4 + H2SO4 → K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
K2Cr2O7 + 6FeSO4 + 7H2SO4 = K2SO4 + Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O
Задание №77
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cl2 + KOH + Fe(OH)3 → K2FeO4 + KCl + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Cl2 + 10KOH + 2Fe(OH)3 = 2K2FeO4 + 6KCl + 8H2O
Задание №78
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
H2SO4 + S → SO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2H2SO4 + S = 3SO2 + 2H2O
Задание №79
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KNO3 + Al + KOH + H2O → K[Al(OH)4] + NH3
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3KNO3 + 8Al + 5KOH + 18H2O → 8K[Al(OH)4] + 3NH3
Задание №80
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Al2S3 + HNO3 → Al2(SO4)3 + NO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Al2S3 + 24HNO3 = Al2(SO4)3 + 24NO2 + 12H2O
[adsp-pro-3]
Задание №81
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Ca3(PO4)2 + C + SiO2 → CaSiO3 + CO + P
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 5CO + 2P
Задание №82
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
PH3 + HNO3 → H3PO4 + NO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
Задание №83
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
NO2 + O2 + H2O → HNO3
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4NO2 + O2 + 2H2O = 4HNO3
Задание №84
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
NH3 + O2 → N2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4NH3 + 3O2 = 2N2 + 6H2O
Задание №85
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
S + NaOH → Na2S + Na2SO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Задание №86
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KMnO4 + K2SO3 + H2O → K2SO4 + MnO2 + KOH
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2KMnO4 + 3K2SO3 + H2O = 3K2SO4 + 2MnO2 + 2KOH
Задание №87
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Br2 + NaOH → NaBr + NaBrO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3H2O
Задание №88
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KBrO3 + HBr → KBr + Br2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KBrO3 + 6HBr = KBr + 3Br2 + 3H2O
Задание №89
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Al2S3 + O2 → Al2O3 + SO2
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2Al2S3 + 9O2 = 2Al2O3 + 6SO2
Задание №90
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O
[adsp-pro-3]
Задание №91
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cr(OH)3 + Br2 + KOH → K2CrO4 + KBr + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2Cr(OH)3 + 3Br2 + 10KOH = 2K2CrO4 + 6KBr + 8H2O
Задание №92
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
K2Cr2O7 + CrCl2 + HCl → KCl + CrCl3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
K2Cr2O7 + 6CrCl2 + 14HCl = 2KCl + 8CrCl3 + 7H2O
Задание №93
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + H2О
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2О
Задание №94
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KNO3 + MnO2 + KOH → K2MnO4 + KNO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KNO3 + MnO2 + 2KOH = K2MnO4 + KNO2 + H2O
Задание №95
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Fe2O3 + HI → FeI2 + I2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Fe2O3 + 6HI → 2FeI2 + I2 + 3H2O
Задание №96
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Fe(NO3)3 → Fe2O3 + NO2 + O2
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Задание №97
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cu2O + HNO3 → Cu(NO3)2 + NO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2 + 3H2O
Задание №98
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Cu + H2SO4 → CuSO4 + SO2 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Задание №99
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Задание №100
В приведенной схеме реакции расставьте коэффициенты методом электронного баланса:
KNO3 + Zn + KOH + H2O → K2[Zn(OH)4] + NH3
Полученное уравнение впишите в поле ответа, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ:
KNO3 + 4Zn + 7KOH + 6H2O → 4K2[Zn(OH)4] + NH3
[adsp-pro-10]
ЕГЭ — 2017 ХИМИЯ Задания части II № 30 «ОВР» Дистанционные консультации и задания для самоподготовки обучающихся 9 и 211 классов Учитель- Овчарова Ольга Эдуардовна Санкт-Петербург 2016
ИСПОЛЬЗУЯ МЕТОД ЭЛЕКТРОННОГО БАЛАНСА, СОСТАВТЕ УРАВНЕНИЯ РЕАКЦИЙ. ОПРЕДЕЛИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ. 1. H 2 SO 4 + Zn = H 2 S + Zn. SO 4 + H 2 O 2. Ca 3(PO 4)2 + AI = Ca 3 Р 2 + AI 2 O 3 3. H 2 SO 4 + C = SO 2 + CO 2 + H 2 O 4. H 2 S +K 2 Cr 2 O 7+ H 2 SO 4 =S +K 2 SO 4 + Cr 2(SO 4)3 + H 2 O 5. SO 2 + I 2 + H 2 O = H 2 SO 4 + HI 6. H 2 S + HNO 3 = H 2 SO 4 +NO 2 + H 2 O 7. NO +K 2 Cr 2 O 7 +H 2 SO 4= HNO 3 +Cr 2(SO 4)3+K 2 SO 4+H 2 O 8. Fe. SO 4 + H 2 O 2 + H 2 SO 4 = Fe 2(SO 4)3 + H 2 O 9. Mn. SO 4+Na. CIO +Na. OH=Mn. O 2+ Na. CI+ Na 2 SO 4+H 2 O 10. KMn. O 4 + HCI = KCI + Mn. CI 2 + H 2 O 11. KCIO 3 + P = KCI + P 2 O 5 12. KCIO 3 = KCI + O 2 13. KCIO 3 = KCI + KCIO 4
14. H 2 S + SO 2 = S + H 2 O 15. KMn. O 4 + K 2 SO 3 + H 2 SO 4 = Mn. SO 4 + K 2 SO 4 + H 2 O 16. KMn. O 4 + K 2 SO 3 + H 2 O = Mn. O 2 + K 2 SO 4 + KOH 17. KMn. O 4 + K 2 SO 3 + KOH = K 2 Mn. O 4 + K 2 SO 4 + H 2 O 18. KMn. O 4 + HCI = KCI + Mn. CI 2 + H 2 O 19. P 2 S 3 + HNO 3 = H 3 PO 4 + SO 2 + NO 2 + H 2 O 20. Mn. O 2 + KI + CO 2 +H 2 O = I 2 + Mn. CO 3 + KHCO 3 21. Mn. O 2 + H 2 SO 4 = Mn. SO 4 + H 2 O + O 2 22. Mn. O 2 + NH 3 = Mn 2 O 3 + N 2 + H 2 O 23. Mn. O 2+KCIO 3 + KOH = K 2 MNO 4+KCI+H 2 O 24. Mn. O 2+Pb. O 2+HNO 3 = HMn. O 4+Pb(NO 3)2+H 2 O 25. Mn. O 2+Na. OH+O 2 = Na 3 Mn. O 4+H 2 O 26. K 2 Mn. O 4+CI 2 = KMn. O 4 + KCI 27. Mn 2 O 7 = Mn. O 2 + O 2 28. Cr 2 O 3 + KNO 3+Na 2 CO 3 = Na 2 Cr. O 4+KNO 2 + CO 2 29. Cr 2 O 3 + KCIO 3+K 2 CO 3 = K 2 Cr. O 4+KCI + CO 2 30. Cr 2 O 3 + H 2 S = Cr(OH)3 + S
ЕГЭ — 2017 ХИМИЯ БЛОК ЗАДАНИЙ № 30 (ПРАВИЛЬНЫЕ РЕШЕНИЯ)
ИСПОЛЬЗУЯ МЕТОД ЭЛЕКТРОННОГО БАЛАНСА, СОСТАВТЕ УРАВНЕНИЯ РЕАКЦИЙ. ОПРЕДЕЛИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ. 1. 5 H 2 SO 4 + 4 Zn = H 2 S + 4 Zn. SO 4 + 4 H 2 O Zn 0– 2 e Zn+2 4 S+6 + 8 e S-2 1 Zn – восстановитель, H 2 SO 4 — окислитель 2. 3 Ca 3(PO 4)2 + 16 AI = 3 Ca 3 Р 2 + 8 AI 2 O 3 P+5 + 8 e P-3 3 AI 0 — 3 e AI+3 8 AI – восстановитель, Ca 3(PO 4)2 — окислитель
3. 2 H 2 SO 4 + C = 2 SO 2 + CO 2 + 2 H 2 O S+6 +2 e S+4 2 C 0 — 4 e C+4 1 C – восстановитель, H 2 SO 4 – окислитель 4. 3 H 2 S + K 2 Cr 2 O 7 + 4 H 2 SO 4 = 3 S +K 2 SO 4 + Cr 2(SO 4)3 + 7 H 2 O S-2 -2 e S 0 3 Cr+6 +3 e Cr+3 2 H 2 S – восстановитель, K 2 Cr 2 O 7 – окислитель 5. SO 2 + I 2 + 2 H 2 O = H 2 SO 4 + 2 HI S+2 -2 e S+6 I 20 +2 e 2 I-1 SO 2 – восстановитель, I 2 — окислитель
6. H 2 S + 8 HNO 3 = H 2 SO 4 +8 NO 2 + 4 H 2 O S-2 – 8 e S 0 1 N+5 +1 e N+4 8 HNO 3 – окислитель, H 2 S – восстановитель 7. 2 NO + K 2 Cr 2 O 7 + 4 H 2 SO 4 = 2 HNO 3 +Cr 2(SO 4)3+K 2 SO 4+3 H 2 O N+2 -3 e N+5 Cr+6 +3 e Cr+3 K 2 Cr 2 O 7 – окислитель, NO – воостановитель
8. 2 Fe. SO 4 + H 2 O 2 + H 2 SO 4 = Fe 2(SO 4)3 + 2 H 2 O Fe+2 -1 e Fe+3 O-1 +1 e O-2 H 2 O 2 – окислитель, Fe. SO 4 – восстановитель 9. Mn. SO 4 + Na. CIO + 2 Na. OH = Mn. O 2+ Na. CI + Na 2 SO 4 +H 2 O Mn+2 -2 e Mn+4 CI+1 +2 e CI-1 Mn. SO 4 – восстановитель, Na. CIO — окислитель
10. 2 KMn. O 4 + 16 HCI = 2 KCI + 2 Mn. CI 2 +5 CI 2 + 8 H 2 O Mn+7 +5 e Mn+2 2 2 CI-1 CI 2 5 -2 e KMn. O 4 – окислитель, HCI- восстановитель 11. 2 KMn. O 4 + 6 P = 5 KCI + 3 P 2 O 5 CI+5 +6 e P 0 -5 e CI-1 5 P+5 6 KMn. O 4 – окислитель, P — восстановитель 12. 2 KCIO 3 = 2 KCI + 3 O 2 CI+5 +6 e CI-1 2 2 O-2 -4 e O 20 3 CI+5 — окислитель, O-2 — восстановитель
13. 4 KCIO 3 = KCI + 3 KCIO 4 CI+5 +6 e CI-1 1 CI+5 -2 e CI+7 3 KCIO 3 – и окислитель, и восстановитель 14. 2 H 2 S + SO 2 =3 S + 2 H 2 O S-2 — 2 e S 0 2 S+4 +4 e S 0 1 H 2 S – восстановитель, SO 2 — окислитель 15. 2 KMn. O 4 + 5 K 2 SO 3 + 3 H 2 SO 4 = 2 Mn. SO 4 + 6 K 2 SO 4 + 3 H 2 O Mn+7 +5 e S+4 -2 e Mn+2 2 S+6 5 KMn. O 4 – окислитель, K 2 SO 3 — восстановитель
16. 2 KMn. O 4 + 3 K 2 SO 3 + H 2 O =2 Mn. O 2 + 3 K 2 SO 4 + 2 KOH Mn+7 +3 e S+4 -2 e Mn+4 2 S+6 3 KMn. O 4 – окислитель, K 2 SO 3 – восстановитель 17. 2 KMn. O 4 + K 2 SO 3 + 2 KOH = 2 K 2 Mn. O 4 + K 2 SO 4 + H 2 O Mn+7 +1 e S+4 -2 e Mn+6 2 S+6 1 KMn. O 4 – окислитель, K 2 SO 3 – восстановитель
18. 2 KMn. O 4 + 16 HCI = 2 KCI +2 Mn. CI 2 + 5 CI 2 + 8 H 2 O Mn+7 +5 e Mn+2 2 2 CI-1 -2 e CI 20 5 KMn. O 4 – окислитель, HC – восстановитель 19*. P 2 S 3 +22 HNO 3 = 2 H 3 PO 4 + 3 SO 2 + 22 NO 2 + H 2 O 2 Р+3 -4 е 2 P+5 4 3 S-2 -18 e 3 S+4 18 N+5 +1 e N+4 1 P 2 S 3 — восстановитель, HNO 3 — окислитель
20. Mn. O 2 + 2 KI + 3 CO 2 +H 2 O = I 2 + Mn. CO 3 + KHCO 3 Mn+4 +2 e Mn+2 2 I-1 -2 e I 20 Mn. O 2 – окислитель, KI — восстановитель 21. 2 Mn. O 2 + 2 H 2 SO 4 = 2 Mn. SO 4 + 2 H 2 O + O 2 Mn+4 +2 e Mn+2 2 2 O-2 -4 e O 20 1 Mn. O 2 – окислитель, H 2 SO 4 – восстановитель 22. 6 Mn. O 2 +2 NH 3 = 3 Mn 2 O 3 + N 2 + 3 H 2 O Mn+4 +1 e Mn+3 6 2 N-3 -6 e N 20 1 Mn. O 2 – окислитель, NH 3 — восстановитель
23. 3 Mn. O 2+ KCIO 3 + 6 KOH =3 K 2 MNO 4+ KCI+ 3 H 2 O Mn+4 -2 e Mn+6 3 CI+5 +6 e CI- 1 Mn. O 2 – восстановитель, KCIO 3 – окислитель 24. 2 Mn. O 2+ 3 Pb. O 2+ 6 HNO 3 = 2 HMn. O 4+ 3 Pb(NO 3)2+ 2 H 2 O Mn+4 -3 e Mn+7 2 Pb+4 +2 e Pb+2 3 Mn. O 2 – восстановитель, Pb. O 2 – окислитель 25. 4 Mn. O 2+ 12 Na. OH+ O 2 = 4 Na 3 Mn. O 4+ 6 H 2 O Mn+4 -1 e Mn+5 4 O 20 +4 e O-2 1 Mn. O 2 – восстановитель, O 2 – окислитель
26. 2 K 2 Mn. O 4 + CI 2 = 2 KMn. O 4 + 2 KCI Mn+6 -1 e Mn+7 2 CI 20 +2 e 2 CI- 1 K 2 Mn. O 4 – восстановитель, CI 2 – окислитель 27. 2 Mn 2 O 7 = 4 Mn. O 2 + 3 O 2 Mn+7 +3 e Mn+4 4 2 О-2 -4 e О 20 3 Mn+7 – окислитель, О-2 — восстановтель
28. Cr 2 O 3 + 3 KNO 3+ 2 Na 2 CO 3 = 2 Na 2 Cr. O 4+ 3 KNO 2 + 2 CO 2 Cr+3 -3 e Cr+6 2 N+5 +2 e N+3 3 Cr 2 O 3 – восстановитель, KNO 3 – окислитель 29. Cr 2 O 3 + KCIO 3+ 2 K 2 CO 3 = 2 K 2 Cr. O 4+ KCI + 2 CO 2 Cr+3 -3 e СI+5 +6 e Cr+6 CI-1 2 1 Cr 2 O 3 – восстановитель, KCIO 3 – окислитель 30. 2 Cr. O 3 + 3 H 2 S = 2 Cr(OH)3 + 3 S Cr+6 +3 e Cr+3 2 S-2 -2 e S 0 3 Cr 2 O 3 – окислитель, H 2 S — восстановитель
Основные правила составления окислительно-восстановительных реакций
(скачать pdf файл)
Существует несколько основных правил, которые сильно упрощают составление окислительно-восстановительных реакций. Более подробно эти и другие правила рассматривается на других страницах этого раздела, но для ЕГЭ достаточно знать правила из этого списка.
Правило 1. Реакции простых веществ: металлов и неметаллов с щелочами, кислотами и солями:
1.1) Из металлов только Al, Zn и Be взаимодействуют со щелочами с выделением водорода:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
1.2) Из неметаллов только S, P, Si и галогены реагируют с щелочами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2.1) Металлы (стоящие в ряду активности металлов до H2) реагируют с кислотами-неокислителями с выделением водорода:
2HCl + Fe → FeCl2 + H2
H2SO4(р) + Fe → FeSO4 + H2
2.2) Все металлы, кроме Pt и Au, реагируют с кислотами-окислителями без выделения водорода:
2H2SO4(к) + 2Ag → Ag2SO4 + SO2
6H2SO4(к) + 2Fe → Fe2(SO4)3 + 3SO2
2.3) Более сильные металлы вытесняют более слабые из растворов их солей:
Fe + CuSO4 → FeSO4 + Cu
3) Неметаллы не реагируют с кислотами-неокислителями:
C + HCl → реакция не идет
4) Такие неметаллы, как S, C, P могут реагировать с солями, проявляющими окислительные свойства (KClO3, KNO3 в расплавленном состоянии):
6P + 5KClO3 → 3P2O5 + 5KCl
C + 2KNO3 (расплав) → CO2
S + 2KNO3 (расплав) → SO2
5) Важная реакция получения фосфора:
5C + 3SiO2 + Ca3(PO4)2 → 5CO
6) Из неметаллов только S, C, и P реагируют с кислотами-окислителями (в рамках ЕГЭ), а также I2 с HNO3(к):
Правило 2. Фосфор
1) Наиболее устойчивая степень окисления фосфора +5, следовательно, любые другие соединения фосфора окисляются сильными окислителями до этой степени окисления (с образованием P2O5 или фосфат-иона):
PH3 + 8KMnO4 + 11KOH → K3PO4 + 8K2MnO4 + 7H2O
6P + 5KClO3 → 5KCl + 3P2O5
3P2O3 + 4HNO3 + 7H2O → 6H3PO4 + 4NO
Правило 3. Азот
1) Аммиак, как правило, окисляется до азота N2:
8NH3 + 3KBrO4 → 3KBr + 4N2
2NH3 + 3CuO → 3Cu + N2
Исключением является каталитическое окисление аммиака:
4NH3 + 5O2 → 4NO
Обычное горение аммиака протекает с образованием N2 (как и горение любых органических азотсодержащих соединений):
4NH3 + 3O2 → 2N2
2) Нитрит-ионы окисляются до нитрат-ионов:
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2
3) Нитрит-ионы восстанавливаются до азота в реакциях с солями аммония:
NaNO2 + NH4Cl → N2
Ca(NO2)2 + (NH4)2SO4 → 2N2
4) Нитрит-ионы восстанавливаются до оксида азота (II) в реакциях с типичными восстановителями: HI, йодидами, солями Fe+2 и др.:
2KNO2 + 2KI + 2H2SO4 → 2NO
HNO2 + 2HI → 2NO
Следующий тип реакций встречается в вариантах Ю.Н. Медведева.
5) Нитрат-ионы являются сильными окислителями при сплавлении с соединениями Cr, Mn, Fe в щелочной среде и с некоторыми неметаллами (восстанавливаются до нитритов):
3NaNO3 + Cr2O3 + 4KOH → 3NaNO2 + 2K2CrO4 + 2H2O
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
2NaNO3 + FeSO4 + 4NaOH → 2NaNO2 + Na2FeO4 + Na2SO4 + 2H2O
2KNO3(расплав) + C → 2KNO2 + CO2
2KNO3(расплав) + S → 2KNO2 + SO2
6) Нитрат-ионы являются сильными окислителями в кислотной среде:
2KNO3 + Cu + 2H2SO4 → CuSO4 + 2NO2
7) Восстановление нитратов до аммиака в реакциях с такими металлами, как Al, Zn, Mg (встречается очень редко):
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3
KNO3 + 4Mg + 6H2O → NH3


Правило 4. Кислород
1) Перекись водорода окисляется до кислорода O2 типичными окислителями:
KMnO4, K2Cr2O7, галогены, соли кислородсодержащих кислот хлора (например, KClO3) и некоторыми другими.
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO

2) Перекись водорода восстанавливается до H2O типичными восстановителями:
KI (HI, йодиды), K2SO3 (SO2, сульфиты), KNO2 (нитриты), PbS (H2S, сульфиды), соединения Cr+3 в щелочной среде, соединения Fe+2, NH3 и некоторыми другими.
H2O2 + Na2SO3 → Na2SO4 + H2O
H2O2 + KNO2 → KNO3 + H2O
3H2O2 + 2NaCrO2 + 2NaOH → 2Na2CrO4 + 4H2O
Свойства пероксида водорода с примерами
Правило 5. Галогены
1) Галогены диспропорционируют в щелочах:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2) Простые вещества галогены и соединения галогенов в любой положительной степени окисления восстанавливаются, как правило, до галогенид-ионов (т.е. до ст. ок. -1) в реакциях с типичными восстановителями:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
KClO3 + 6Fe(OH)2 + 18HCl → 6FeCl3 + KCl + 15H2O
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2Br2 + CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
3) Галогенид-ионы окисляются, как правило, до простых веществ: Cl2, Br2, I2:
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
16HCl + 2KMnO4 → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
4) Йодид меди восстанавливает серную кислоту до SO2, тогда как йодиды активных металлов до H2S:
2CuI + 4H2SO4(конц.) → I2 + 2SO2 + 2CuSO4 + 4H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
5) Концентрированной серной кислотой окисляются только бромид- и йодид-ионы. В первом случае образуется SO2, во втором H2S.
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O.
6) Более сильные галогены вытесняют менее сильные из галогенидов. В ряду F2, Cl2, Br2, I2 окислительные свойства ослабевают.
Cl2 + 2NaI → I2 + 2NaCl
Cl2 + NaF → реакция не идет, так как Cl2 — более слабый окислитель чем F2.
Все галогены вытесняют серу из сульфидов:
(NH4)2S + Br2 → S + 2NH4Br.
Правило 6. Сера
1) Сульфид-ионы обычно окисляются до S типичными окислителями: Br2, I2, растворами солей K2Cr2O7, KMnO4 и др.:
3Na2S + K2Cr2O7 + 7H2SO4 → 3S
5Na2S + 2KMnO4 + 16HCl → 5S
H2S + Br2 → S
H2S + H2O2 → S
2) С H2SO4(к) сероводород и сульфиды реагируют с образованием SO2, аналогично реакции кислоты с серой:
S + H2SO4(конц.) → 3SO2
H2S + 3H2SO4(конц.) → 4SO2
K2S + 4H2SO4(конц.) → K2SO4 + 4SO2
В этой реакции сульфид-ион окисляется до SO2: S–2 -6e → S+4.
Часть сульфат-ионов восстанавливается также до SO2 и часть остается для образования соли K2SO4.
3) Окисление H2S и сульфидов до сульфат-ионов протекает в реакциях с такими окислителями, как Cl2 в воде, H2O2, HNO3(конц.) при нагревании:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
H2S + 8HNO3(конц.) → H2SO4 + 8NO2
PbS + 4H2O2 → PbSO4 + 4H2O (черный сульфид свинца превращается в белый сульфат)
4) Сульфит-ионы любыми окислителями окисляются до сульфат-иона:
3Na2SO3 + 2KMnO4 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
3K2SO3 + 2K2CrO4 + 5H2O → 2Cr(OH)3 + 3K2SO4 + 4KOH.
5) Взаимодействие серной кислоты с простыми и сложными веществами
Правило 7. Медь
1) Соединения Cu+2 окисляют соединения S+4 и I– (восстанавливаясь до Cu+1):
2CuCl2 + SO2 + 2H2O → 2CuCl
2Cu(NO3)2 + 4KI → 2CuI

В реакции с аммиаком выделяется металлическая медь:
3CuO + 2NH3 → N2
2) Йодиды меди реагируют с H2SO4(к) с образованием SO2, тогда как йодиды щелочных металлов с образованием H2S:
2CuI + 4H2SO4 → 2CuSO4 + I2 + 2SO2 + 4H2O
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S + 4H2O
3) Медь по-разному реагирует с галогенами:
Cu + Cl2 → CuCl2
Cu + Br2 → CuBr2
2Cu + I2 → 2CuI (соль меди +1)
4) Медь в степени окисления +2 восстанавливается самой медью:
CuO + Cu → Cu2O (t)
CuCl2 + Cu → 2CuCl (t).
Правило 8. Железо
1) Соединения Fe+3 окисляют соединения S–2, S+4, I– и некоторые слабые металлы (восстанавливаясь до Fe+2):
Fe2O3 + 6HI → 2FeI2 + I2
2FeCl3 + 3Na2S → 2FeS

2FeCl3 + H2S → 2FeCl2 + S
2FeCl3 + Na2SO3 +H2O → 2FeCl2 + Na2SO4 + 2HCl
2FeCl3 + Cu → CuCl2 + 2FeCl2 (соль железа +2)
Fe2(SO4)3 + Cu → CuSO4 + 2FeSO4 (соль железа +2)
2Fe(NO3)3 + Fe → 3Fe(NO3)2 (соль железа +2)
2) В кислой среде соединения Fe+2 окисляются такими окислителями, как KMnO4, K2Cr2O7, Na2O2, HNO3, H2SO4(к) и др. до солей Fe+3:
6FeCl2 + Na2Cr2O7 + 14HCl → 6FeCl3 + 2CrCl3 + 2NaCl + 7H2O
2FeSO4 + Na2O2 + 2H2SO4 → Fe2(SO4)3 + Na2SO4 + 2H2O
3) В щелочной среде образуется гидроксид железа (III):
FeCl2 + KMnO4 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2FeSO4 + 2KMnO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
4) Железо по-разному реагирует с галогенами:
2Fe + 3F2 → 2FeF3
2Fe + 3Cl2 → 2FeCl3
2Fe + 3Br2 → 2FeBr3
Fe + I2 → FeI2 (соль железа +2)
5) Соединения Fe+2, Fe+3 также могут быть окислены до степени окисления +6 (до ферратов, например, Na2FeO4) очень сильными окислителями, но на ЕГЭ знание этих реакций не проверяется (источник: вебинары от разработчиков экзамена):
3FeSO4 + 2NaClO3 + 12NaOH → 3Na2FeO4 + 2NaCl + 3Na2SO4 + 6H2O.
Правило 9. Марганец
1) В кислой среде образуются соли Mn+2:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2) В щелочной среде образуется манганат-ион MnO42– (зеленого цвета):
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3
3) В нейтральной среде образуется осадок бурого цвета MnO2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2
2KMnO4 + 3K2S + 4H2O → 2MnO2

K2MnO4 + Na2S + 2H2O → S

Правило 10. Хром
1) Восстановление дихроматов в кислой среде протекает с образованием солей Cr+3:
Na2Cr2O7 + 6NaI + 7H2SO4 → Cr2(SO4)3 + 3I2
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
2) Окисление соединений Cr+2 в кислой среде протекает с образованием солей Cr+3:
6CrCl2 + K2Cr2O7 + 14HCl → 8CrCl3 + 2KCl + 7H2O
2CrCl2 + 4H2SO4(конц.) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
3) Окисление соединений Cr+3 очень сильными окислителями с щелочами или с карбонатами щелочных металлов протекает с образованием хроматов (типичные окислители: KNO3, Cl2, KClO3, H2O2 и др. в щел. среде):
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
Cr2(SO4)3 + 3Cl2 + 16KOH → 2K2CrO4 + 6KCl + 3K2SO4 + 8H2O
2Cr(OH)3 + KClO3 + 4NaOH → 2Na2CrO4 + KCl + 5H2O
2Cr(OH)3 + 3H2O2 + 4KOH → 2K2CrO4 + 8H2O
4) Соединения Cr+6 в различных средах:
В щелочной среде устойчивы соли хромовой кислоты (хроматы, желтого цвета), например, Na2CrO4.
В кислой среде устойчивы соли дихромовой кислоты (дихроматы, оранжевого цвета), например, Na2Cr2O7.
CrO3 + 2KOH → K2CrO4 + H2O
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O (в кислотной среде желтая окраска переходит в оранжевую).
Na2Cr2O7 + 2NaOH → 2Na2CrO4 + H2O (в щелочной среде оранжевая окраска переходит в желтую).
Правило 11. Среда раствора
1) С карбонатами щелочных металлов реакции протекают аналогично щелочной среде реакции:
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
2) Если в реакцию вступает оксид серы (IV) SO2 в нейтральном растворе, то реакция протекает аналогично кислой среде раствора:
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4.
Поэтому очень важно не зубрить окислительно-восстановительные реакции, а знать какие соединения проявляют окислительные, а какие восстановительные свойства, и знать основные правила, приведенные выше.
Окислительно-восстановительные реакции. Коррозия металлов и способы защиты от нее
Признаки окислительно-восстановительных реакций
Многообразие классификаций химических реакций по различным признакам (числу и характеру реагирующих и образовавшихся веществ, направлению, фазовому составу, тепловому эффекту, использованию катализатора) можно дополнить еще одним признаком. Этот признак — изменение степени окисления атомов химических элементов, образующих реагирующие вещества.
Например, в реакции
${Ag}↖{+1}{N}↖{+5}{O_3}↖{-2}+{H}↖{+1}{Cl}↖{-1}={Ag}↖{+1}{Cl}↖{-1}+{H}↖{+1}{N}↖{+5}{O_3}↖{-2}$
степени окисления атомов химических элементов после реакции не изменились. А вот в реакции взаимодействия соляной кислоты с цинком
$2{H}↖{+1}{Cl}↖{-1}+{Zn}↖{0}={Zn}↖{+2}{Cl_2}↖{-1}+{H_2}↖{0}$
атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород — с $+1$ на $0$, а цинк — с $0$ на $+2$. Следовательно, в этой реакции каждый атом водорода получил по одному электрону:
$2H^{+}+2e↖{-}→H_2^0,$
а каждый атом цинка отдал два электрона:
${Zn}↖{0}-2e↖{-}→Zn^{+2}.$
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
Окислитель и восстановитель. Окисление и восстановление
Под восстановлением понимают процесс присоединения электронов атомами, ионами или молекулами.
Степень окисления при этом понижается.
Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, т.е. восстанавливаясь:
${Cl^0+1ē}↙{text»атом хлора»}→{Cl^{-1}}↙{text»хлорид-ион»},$
${S^{0}+2ē}↙{text»атом серы»}→{S^{-2}}↙{text»хлорид-ион»}.$
Электроны могут присоединяться и к положительным ионам, превращая их при этом в атомы:
${Cu^{+2}+2ē}↙{text»ион меди(II)»}→{Cu^0}↙{text»атом меди»},$
${Fe^{+3}+3ē}↙{text»ион железа(III)»}→{Fe^{0}}↙{text»атом железа»}.$
Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается:
${Fe^{+3}+1ē}↙{text»ион железа(III)»}→{Fe^{+2}}↙{text»ион железа»},$
${Sn^{+4}+2ē}↙{text»ион олова(IV)»}→{Sn^{+2}}↙{text»ион олова(II)»}.$
Атомы, ионы или молекулы, принимающие электроны, называются окислителями.
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами.
Например, атомы металлов, теряя электроны, превращаются в положительные ионы, т.е. окисляются:
${Na^{0}-1ē}↙{text»атом натрия»}→{Na^{+1}}↙{text»ион натрия»},$
${Al^{0}-3ē}↙{text»атом алюминия»}→{Al^{+3}}↙{text»ион алюминия»}.$
Отдавать свои электроны могут отрицательные ионы:
${Cl^{-1}-1ē}↙{text»хлорид-ион»}→{Cl^{0}}↙{text»атом хлора»},$
${S^{-2}-2ē}↙{text»сульфид-ион»}→{S^{0}}↙{text»атом серы»}.$
Терять электроны могут и некоторые положительные ионы с низшими степенями окисления:
${Cu^{+1}-1ē}↙{text»ион меди(I)»}→{Cu^{+2}}↙{text»ион меди(II)»},$
${Fe^{+2}-1ē}↙{text»ион железа(II)»}→{Fe^{+3}}↙{text»ион железа(III)»}.$
Можно отметить, что при этом степень окисления повышается.
Атомы, ионы или молекулы, отдающие электроны, называются восстановителями.
Окисление всегда сопровождается восстановлением и наоборот, т.е. окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления может быть представлена так, как это изображено на схеме ниже.
Зная формулу вещества и определив степени окисления атомов химических элементов в нем, нетрудно предсказать, какие свойства будет проявлять каждый элемент и вещество в целом. Например, азот в азотной кислоте $H{N}↖{+5}O_3$ имеет максимальное значение степени окисления $+5$, т.е. он потерял все электроны, поэтому азот и азотная кислота будут проявлять только окислительные свойства.
Азот в аммиаке ${N}↖{-3}{H_3}↖{+1}$ имеет минимальное значение степени окисления $-3$, т.е. он не сможет принять больше ни одного электрона, и поэтому аммиак будет проявлять только восстановительные свойства.
Оксид азота (II) ${N}↖{+2}{O}↖{-2}$. Азот в этом соединении имеет промежуточное значение степени окисления и поэтому может проявлять как окислительные (например, $N^{+2}+2ē→N^0$ или $N^{+2}+5ē→N^{-3}$), так и восстановительные (например, $N^{+2}-2ē→N^{+4}$) свойства.
Метод электронного баланса
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления.
Например, реакция взаимодействия алюминия с хлоридом меди (II) описывается схемой:
${Cu}↖{+2}{Cl_2}↖{-1}+{Al}↖{0}→{Al}↖{+3}{Cl_3}↖{-1}+{Cu}↖{0},$
а электронные уравнения будут иметь вид:
${Cu^{+2}+2ē→Cu^0}↙{text»окислитель»}↖{text»восстановитель»}|3,$
${Al^{0}-3ē→Al^{+3}}↙{text»окислитель»}↖{text»восстановитель»}|2.$
Молекулярное уравнение этой реакции:
$3CuCl_2+2Al=2AlCl_3+3Cu$.
Покажем, как с помощью метода электронного баланса можно расставить коэффициенты в уравнении сложной окислительно-восстановительной реакции. Известно, что первое правило ряда напряжений металлов о взаимодействии металлов с растворами кислот не распространяется на концентрированную серную кислоту и азотную кислоту любой концентрации.
В отличие от соляной кислоты, в которой окислителем атомов металла были катионы водорода, в серной и азотной кислотах окислителями являются атомы серы и азота из сульфат-ионов и нитрат- ионов. Поэтому $H_2SO_4$(конц.) и $HNO_3$(любой концентрации) взаимодействуют с металлами, стоящими в ряду напряжений как до водорода, так и после него, восстанавливаясь при этом до $SO_2$, $NO$ и т.д. Например, при взаимодействии разбавленной азотной кислоты с медью получаются нитрат меди (II), оксид азота (II) и вода. Запишем формулы исходных и конечных веществ с указанием степеней окисления:
${H}↖{+1}{N}↖{+5}{O_3}↖{-2}+{Cu}↖{0}→{Cu}↖{+2}({N}↖{+5}{O_3}↖{-2})_{2}+{N}↖{+2}{O}↖{-2}+{H_2}↖{+1}{O}↖{-2}.$
Подчеркнем знаки химических элементов, изменивших свои степени окисления:
$H{N}↙{-}↖{+5}O_{3}+{Cu}↙{=}↖{0}→{Cu}↙{=}↖{+2}(NO_3)_2+{N}↙{-}↖{+2}O+H_2O.$
Составим электронные уравнения, т.е. отразим процессы отдачи и присоединения электронов:
${N^{+5}+3ē→N^{+2}}↙{text»окислитель»}↖{text»восстановление»}|2,$
${Cu^{0}-2ē→Cu^{+2}}↙{text»восстановитель»}↖{text»окисление»}|3.$
Ставим коэффициент $3$ перед $Cu^0$ и перед формулой нитрата меди (II), в котором $Cu^{+2}$, так как с такими значениями степеней окисления медь встречается по одному разу. Коэффициент $2$ поставим только перед формулой вещества с $N^{+2}$, так как это значение степени окисления для азота в схеме реакции встречается только один раз, а вот перед $HNO_3$ коэффициент не запишем, ибо $N^{+5}$ встречается еще раз в формуле $Cu(NO_3)_2$. Наша запись имеет вид:
$HNO_3+3Cu→3Cu(NO_3)_2+2NO+H_2O.$
Теперь уравняем число атомов азота. После реакции оно равно $3·2=6$ из $Cu(NO_3)_2$ и еще два атома из $2NO$, всего $8$.
Поэтому перед $HNO_3$ запишем коэффициент $8$:
$8HNO_3+3Cu→3Cu(NO_3)_2+2NO+H_2O.$
и уравняем число атомов водорода:
$8HNO_3+3Cu→3Cu(NO_3)_2+2NO+4H_2O.$
Проверим правильность расстановки коэффициентов, подсчитав число атомов кислорода до и после реакции: до реакции — $24$ атома и после реакции — $24$ атома. Коэффициенты расставлены правильно, поэтому заменим в уравнении стрелку на знак равенства:
$8HNO_3+3Cu=3Cu(NO_3)_2+2NO+4H_2O.$
Коррозия металлов
При взаимодействии металлов с веществами окружающей среды на их поверхности образуются соединения, обладающие совершенно иными свойствами, чем сами металлы. В обычной жизни мы часто повторяем слова «ржавчина», «ржавление», видя коричнево-желтый налет на изделиях из железа и его сплавов. Ржавление — это частный случай коррозии.
Коррозия — это процесс самопроизвольного разрушения металлов под влиянием внешней среды.
Однако разрушению подвергаются практически все металлы, в результате чего многие их свойства ухудшаются (или совсем теряются): уменьшаются прочность, пластичность, блеск, снижается электропроводность, а также возрастает трение между движущимися деталями машин, изменяются размеры деталей и т.д.
Коррозия металлов бывает сплошной и местной.
Первая не так опасна, как вторая, ее проявления могут быть учтены при проектировании конструкций и аппаратов. Значительно опаснее местная коррозия, хотя потери металла здесь могут быть и небольшими. Один из наиболее опасных ее видов — точечная. Она заключается в образовании сквозных поражений, т.е. точечных полостей — питтингов, при этом снижается прочность отдельных участков, уменьшается надежность конструкций, аппаратов, сооружений.
Коррозия металлов наносит большой экономический вред. Человечество несет огромные материальные потери в результате разрушения трубопроводов, деталей машин, судов, мостов, различного оборудования.
Коррозия приводит к уменьшению надежности работы металлоконструкций. Учитывая возможное разрушение, приходится завышать прочность некоторых изделий (например, деталей самолетов, лопастей турбин), а значит, увеличивать расход металла, что требует дополнительных экономических затрат.
Коррозия приводит к простоям производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции в результате разрушения газо-, нефте- и водопроводов. Нельзя не учитывать и ущерб природе, а значит, и здоровью человека, нанесенный в результате утечки нефтепродуктов и других химических веществ. Коррозия может приводить к загрязнению продукции, а следовательно, к снижению ее качества. Затраты на возмещение потерь, связанных с коррозией, колоссальны. Они составляют $30%$ годового производства металлов во всем мире.
Из всего сказанного следует, что очень важной проблемой является изыскание способов защиты металлов и сплавов от коррозии. Они весьма разнообразны. Но для их выбора необходимо знать и учитывать химическую сущность процессов коррозии.
По химической природе коррозия — это окислительно-восстановительный процесс. В зависимости от среды, в которой он протекает, различают несколько видов коррозии.
Виды коррозии
Наиболее часто встречающиеся виды коррозии: химическая и электрохимическая.
I. Химическая коррозия происходит в не проводящей электрический ток среде. Такой вид коррозии проявляется в случае взаимодействия металлов с сухими газами или жидкостями-неэлектролитами (бензином, керосином и др.). Такому разрушению подвергаются детали и узлы двигателей, газовых турбин, ракетных установок. Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах.
Например:
$2{Fe}↖{0}+3{S}↖{+4}O_2+3{O_2}↖{0}→↖{t}{Fe_2}↖{+3}({S}↖{+6}{O_4}↖{-2})_3,$
$2{Fe}↖{0}+3{Cl_3}↖{0}→2{Fe}↖{+3}{Cl_3}↖{-1},$
$2{Zn}↖{0}+{O_2}↖{0}→2{Zn}↖{+2}{O}↖{-2}.$
Большинство металлов окисляется кислородом воздуха, образуя на поверхности оксидные пленки. Если эта пленка прочная, плотная, хорошо связана с металлом, то она защищает металл от разрушения. Такие защитные пленки появляются у $Zn, Al, Cr, Ni, Pb, Sn, Nb, Ta$ и др. У железа она рыхлая, пористая, легко отделяется от поверхности и поэтому не способна защитить металл от дальнейшего разрушения.
II. Электрохимическая коррозия происходит в токопроводящей среде (в электролите с возникновением внутри системы электрического тока). Как правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны), а другие — роль катода (принимают электроны).
Рассмотрим разрушение железного образца в присутствии примеси олова.
На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит:
${Fe}↖{0}-2e=Fe^{2+}$ (анод).
Таким образом, железо (его основная часть) служит анодом. Поток электронов перемещается к олову — металлу с меньшей активностью, на нем накапливается избыточное количество электронов. Таким образом, участки олова могут «поделиться» электронами, поэтому на них возможны процессы восстановления. Примесь олова выполняет роль катода.
В зависимости от среды электролита на катоде могут идти различные процессы. В одном случае будет наблюдаться выделение газа ($Н_2$). В другом — образование ржавчины, состоящей в основном из $Fe_2O_3·nH_2O$.
Итак, электрохимическая коррозия — окислительно-восстановительная реакция, происходящая в средах, проводящих ток (в отличие от химической коррозии). Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего включения, которые являются менее активными проводниками (это может быть и неметалл).
На аноде (более активном металле) идет окисление атомов металла с образованием катионов (растворение).
На катоде (менее активном проводнике) идет восстановление ионов водорода или молекул кислорода с образованием соответственно $Н_2↑$ или гидроксид-ионов $ОН^-$.
Катионы водорода и растворенный кислород — важнейшие окислители, вызывающие электрохимическую коррозию.
Скорость коррозии тем больше, чем сильнее отличаются металлы (металл и примеси) по своей активности (для металлов — чем дальше друг от друга они расположены в ряду напряжений). Значительно усиливается коррозия при увеличении температуры.
Электролитом может служить морская вода, речная вода, конденсированная влага и, конечно же, хорошо известные вам электролиты — растворы солей, щелочей, кислот.
Вы, очевидно, помните, что зимой для удаления снега и льда с тротуаров используют техническую соль (хлорид натрия, иногда хлорид кальция). Образующиеся растворы стекают в канализационные трубопроводы, создавая тем самым благоприятную среду для электрохимической коррозии подземных коммуникаций.
Способы защиты от коррозии
Уже при проектировании металлических конструкций и их изготовлении предусматривают меры защиты от коррозии:
1. Шлифование поверхности изделий, чтобы на них не задерживалась влага.
2. Применение легированных сплавов, содержащих специальные добавки: хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой (например, $Cr_2O_3$). Общеизвестны легированные стали — нержавейки, из которых изготавливают предметы домашнего обихода (ножи, вилки, ложки), детали машин, инструменты.
3. Нанесение защитных покрытий. Рассмотрим их виды.
А. Неметаллические — неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато дешевы.
Б. Химические — искусственно создаваемые поверхностные пленки: оксидные, нитридные, силицидные, полимерные и др. Например, все стрелковое оружие и детали многих точных приборов подвергают воронению — это процесс получения тончайшей пленки оксидов железа на поверхности стального изделия. Получаемая искусственная оксидная пленка очень прочная (в основном состава ${Fe}↖{+2}{Fe_2}↖{+3}O_4$ и придает изделию красивый черный цвет и синий отлив. Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол. Наносят их двумя способами: нагретое изделие помещают в порошок полимера, который плавится и приваривается к металлу, или поверхность металла обрабатывают раствором полимера в низкокипящем растворителе, который быстро испаряется, а полимерная пленка остается на изделии.
В. Металлические — это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные пленки. Нанесение хрома на поверхность — хромирование, никеля — никелирование, цинка — цинкование, олова — лужение и т.д. Покрытием может служить и пассивный в химическом отношении металл — золото, серебро, медь.
4. Электрохимические методы защиты.
А. Протекторная (анодная) — к защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и других стальных изделий используют магний, алюминий, цинк.
Б. Катодная — металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность ее анодного разрушения.
5. Специальная обработка электролита или другой среды, в которой находится защищаемая металлическая конструкция.
А. Введение веществ-ингибиторов, замедляющих коррозию.
Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавлением пивных дрожжей, муки, крахмала. Эти примеси и были одними из первых ингибиторов. Они не позволяли кислоте действовать на оружейный металл, в результате растворялись только окалина и ржавчина. Уральские оружейники применяли для этих целей «травильные супы» — растворы серной кислоты с добавкой мучных отрубей.
Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении прекрасно «укрощается» производными бутиламина, а серная кислота — азотной кислотой, летучий диэтиламин впрыскивают в различные емкости. Отметим, что ингибиторы действуют только на металл, делая его пассивным по отношению к среде, например, к раствору кислоты. Науке известно более $5$ тыс. ингибиторов коррозии.
Б. Удаление растворенного в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.
Всего: 583 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора и выпадением осадка. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, которые вступают в реакцию ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная окислительно-восстановительная реакция протекает с изменением окраски раствора. Выпадение осадка и выделение газа в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид бария, хлорид натрия, сульфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид бария, хлорид натрия, сульфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид бария, нитрат натрия, нитрат серебра (I). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид бария, нитрат натрия, нитрат серебра (I). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид стронция, хлорид калия, сульфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: хлорид фосфора (III), азотная кислота, хлорид стронция, хлорид калия, сульфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: гидроксид калия, силикат калия, хромат калия, гидроксид лития, нитрит натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: гидроксид калия, силикат калия, хромат калия, гидроксид лития, нитрит натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная окислительно-восстановительная реакция с изменением окраски раствора. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция, не сопровождающаяся выделением газа и выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с растворением осадка. Выделение газа и выпадение другого осадка в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, не включающая в себя процесс совместного гидролиза. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная окислительно-восстановительная реакция. Выпадение осадка и выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора. Выпадение осадка и выделение газа в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора и выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная окислительно-восстановительная реакция. Выделение газа и выпадение нового осадка в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора и выпадением осадка. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выделению газа и выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Всего: 583 1–20 | 21–40 | 41–60 | 61–80 …