1. Окислители и восстановители
2. Классификация окислительно–восстановительных реакций
3. Основные правила составления ОВР
4. Общие закономерности протекания ОВР
5. Основные схемы ОВР
5.1. Схема восстановления перманганатов
5.2. Схема восстановления хроматов/бихроматов
5.3. Разложение нитратов
5.4. Окислительные свойства азотной кислоты
5.5. Взаимодействие металлов с серной кислотой
5.6. Пероксид водорода
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
-
перманганат калия (KMnO4);
-
дихромат калия (K2Cr2O7);
-
азотная кислота (HNO3);
-
концентрированная серная кислота (H2SO4);
-
пероксид водорода (H2O2);
-
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
-
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2Al0 + Fe+32O3 → Al+32O3 + 2Fe0,
C0 + 4HN+5O3(конц) = C+4O2 ↑ + 4N+4O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
(N-3H4)2Cr+62O7 → N20 ↑+ Cr+32O3 + 4 H2O,
2 NaN+5O-23 → 2 NaN+3O2 + O02↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2S-2 + S+4O2 = 3S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается, а восстановитель окисляется.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K+2S-2 + 2K+Mn+7O-24 = 2K+2Mn+6O-24 + S0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S-2 -2e = S0
Mn+7 + 1e = Mn+6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn+7 в кислой среде восстанавливается до Mn+2, а в щелочной — до Mn+6);
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N+5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3);
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N+5.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2+. Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны. В нейтральном растворе марганец восстанавливается до степени окисления +4, с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6. Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S + 2 KMnO4 + 8 H2SO4 = 5 S + 2 MnSO4 + 6 K2SO4 + 8 H2O,
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
K2S + 2 KMnO4 –(KOH)= 2 K2MnO4 + S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P-3, As-3= P+5, As+5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III). Соединения хрома Cr+3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6].
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As+5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 + O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО + 4NO2 + O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N+5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I) («веселящий газ») и вода:
NH4NO3 → N2O + 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N+3 и восстановителя N-3
NH4NO2 → N2 + 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 + 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO3)2 → 2FeO + 4NO2 + O2 при 60°C
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N+4); оксид азота (II) NO (N+2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3. Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV) NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu+ 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота (I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na+ 10HNO3 = 8NaNO3 + N2O + 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H+, которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например:
Fe + H2SO4(разб) = FeSO4 + H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S+4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 + 2H2S+6O4(конц) = Cu+2SO4 + S+4O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 + 5H2S+6O4(конц) → 4Na2+SO4 + H2S—2 + 4H2O
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
S+4O2 + H2O2-1 → H2S+6O4-2
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например:
2KMn+7O4 + 5H2O2-1 + 3H2SO4 → 5O20 + 2Mn+2SO4 + K2SO4 + 8H2O
Основные правила составления окислительно-восстановительных реакций
(скачать pdf файл)
Существует несколько основных правил, которые сильно упрощают составление окислительно-восстановительных реакций. Более подробно эти и другие правила рассматривается на других страницах этого раздела, но для ЕГЭ достаточно знать правила из этого списка.
Правило 1. Реакции простых веществ: металлов и неметаллов с щелочами, кислотами и солями:
1.1) Из металлов только Al, Zn и Be взаимодействуют со щелочами с выделением водорода:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
1.2) Из неметаллов только S, P, Si и галогены реагируют с щелочами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2.1) Металлы (стоящие в ряду активности металлов до H2) реагируют с кислотами-неокислителями с выделением водорода:
2HCl + Fe → FeCl2 + H2
H2SO4(р) + Fe → FeSO4 + H2
2.2) Все металлы, кроме Pt и Au, реагируют с кислотами-окислителями без выделения водорода:
2H2SO4(к) + 2Ag → Ag2SO4 + SO2
6H2SO4(к) + 2Fe → Fe2(SO4)3 + 3SO2
2.3) Более сильные металлы вытесняют более слабые из растворов их солей:
Fe + CuSO4 → FeSO4 + Cu
3) Неметаллы не реагируют с кислотами-неокислителями:
C + HCl → реакция не идет
4) Такие неметаллы, как S, C, P могут реагировать с солями, проявляющими окислительные свойства (KClO3, KNO3 в расплавленном состоянии):
6P + 5KClO3 → 3P2O5 + 5KCl
C + 2KNO3 (расплав) → CO2
S + 2KNO3 (расплав) → SO2
5) Важная реакция получения фосфора:
5C + 3SiO2 + Ca3(PO4)2 → 5CO
6) Из неметаллов только S, C, и P реагируют с кислотами-окислителями (в рамках ЕГЭ), а также I2 с HNO3(к):
Правило 2. Фосфор
1) Наиболее устойчивая степень окисления фосфора +5, следовательно, любые другие соединения фосфора окисляются сильными окислителями до этой степени окисления (с образованием P2O5 или фосфат-иона):
PH3 + 8KMnO4 + 11KOH → K3PO4 + 8K2MnO4 + 7H2O
6P + 5KClO3 → 5KCl + 3P2O5
3P2O3 + 4HNO3 + 7H2O → 6H3PO4 + 4NO
Правило 3. Азот
1) Аммиак, как правило, окисляется до азота N2:
8NH3 + 3KBrO4 → 3KBr + 4N2
2NH3 + 3CuO → 3Cu + N2
Исключением является каталитическое окисление аммиака:
4NH3 + 5O2 → 4NO
Обычное горение аммиака протекает с образованием N2 (как и горение любых органических азотсодержащих соединений):
4NH3 + 3O2 → 2N2
2) Нитрит-ионы окисляются до нитрат-ионов:
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2
3) Нитрит-ионы восстанавливаются до азота в реакциях с солями аммония:
NaNO2 + NH4Cl → N2
Ca(NO2)2 + (NH4)2SO4 → 2N2
4) Нитрит-ионы восстанавливаются до оксида азота (II) в реакциях с типичными восстановителями: HI, йодидами, солями Fe+2 и др.:
2KNO2 + 2KI + 2H2SO4 → 2NO
HNO2 + 2HI → 2NO
Следующий тип реакций встречается в вариантах Ю.Н. Медведева.
5) Нитрат-ионы являются сильными окислителями при сплавлении с соединениями Cr, Mn, Fe в щелочной среде и с некоторыми неметаллами (восстанавливаются до нитритов):
3NaNO3 + Cr2O3 + 4KOH → 3NaNO2 + 2K2CrO4 + 2H2O
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
2NaNO3 + FeSO4 + 4NaOH → 2NaNO2 + Na2FeO4 + Na2SO4 + 2H2O
2KNO3(расплав) + C → 2KNO2 + CO2
2KNO3(расплав) + S → 2KNO2 + SO2
6) Нитрат-ионы являются сильными окислителями в кислотной среде:
2KNO3 + Cu + 2H2SO4 → CuSO4 + 2NO2
7) Восстановление нитратов до аммиака в реакциях с такими металлами, как Al, Zn, Mg (встречается очень редко):
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3
KNO3 + 4Mg + 6H2O → NH3


Правило 4. Кислород
1) Перекись водорода окисляется до кислорода O2 типичными окислителями:
KMnO4, K2Cr2O7, галогены, соли кислородсодержащих кислот хлора (например, KClO3) и некоторыми другими.
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO

2) Перекись водорода восстанавливается до H2O типичными восстановителями:
KI (HI, йодиды), K2SO3 (SO2, сульфиты), KNO2 (нитриты), PbS (H2S, сульфиды), соединения Cr+3 в щелочной среде, соединения Fe+2, NH3 и некоторыми другими.
H2O2 + Na2SO3 → Na2SO4 + H2O
H2O2 + KNO2 → KNO3 + H2O
3H2O2 + 2NaCrO2 + 2NaOH → 2Na2CrO4 + 4H2O
Свойства пероксида водорода с примерами
Правило 5. Галогены
1) Галогены диспропорционируют в щелочах:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2) Простые вещества галогены и соединения галогенов в любой положительной степени окисления восстанавливаются, как правило, до галогенид-ионов (т.е. до ст. ок. -1) в реакциях с типичными восстановителями:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
KClO3 + 6Fe(OH)2 + 18HCl → 6FeCl3 + KCl + 15H2O
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2Br2 + CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
3) Галогенид-ионы окисляются, как правило, до простых веществ: Cl2, Br2, I2:
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
16HCl + 2KMnO4 → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
4) Йодид меди восстанавливает серную кислоту до SO2, тогда как йодиды активных металлов до H2S:
2CuI + 4H2SO4(конц.) → I2 + 2SO2 + 2CuSO4 + 4H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
5) Концентрированной серной кислотой окисляются только бромид- и йодид-ионы. В первом случае образуется SO2, во втором H2S.
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O.
6) Более сильные галогены вытесняют менее сильные из галогенидов. В ряду F2, Cl2, Br2, I2 окислительные свойства ослабевают.
Cl2 + 2NaI → I2 + 2NaCl
Cl2 + NaF → реакция не идет, так как Cl2 — более слабый окислитель чем F2.
Все галогены вытесняют серу из сульфидов:
(NH4)2S + Br2 → S + 2NH4Br.
Правило 6. Сера
1) Сульфид-ионы обычно окисляются до S типичными окислителями: Br2, I2, растворами солей K2Cr2O7, KMnO4 и др.:
3Na2S + K2Cr2O7 + 7H2SO4 → 3S
5Na2S + 2KMnO4 + 16HCl → 5S
H2S + Br2 → S
H2S + H2O2 → S
2) С H2SO4(к) сероводород и сульфиды реагируют с образованием SO2, аналогично реакции кислоты с серой:
S + H2SO4(конц.) → 3SO2
H2S + 3H2SO4(конц.) → 4SO2
K2S + 4H2SO4(конц.) → K2SO4 + 4SO2
В этой реакции сульфид-ион окисляется до SO2: S–2 -6e → S+4.
Часть сульфат-ионов восстанавливается также до SO2 и часть остается для образования соли K2SO4.
3) Окисление H2S и сульфидов до сульфат-ионов протекает в реакциях с такими окислителями, как Cl2 в воде, H2O2, HNO3(конц.) при нагревании:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
H2S + 8HNO3(конц.) → H2SO4 + 8NO2
PbS + 4H2O2 → PbSO4 + 4H2O (черный сульфид свинца превращается в белый сульфат)
4) Сульфит-ионы любыми окислителями окисляются до сульфат-иона:
3Na2SO3 + 2KMnO4 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
3K2SO3 + 2K2CrO4 + 5H2O → 2Cr(OH)3 + 3K2SO4 + 4KOH.
5) Взаимодействие серной кислоты с простыми и сложными веществами
Правило 7. Медь
1) Соединения Cu+2 окисляют соединения S+4 и I– (восстанавливаясь до Cu+1):
2CuCl2 + SO2 + 2H2O → 2CuCl
2Cu(NO3)2 + 4KI → 2CuI

В реакции с аммиаком выделяется металлическая медь:
3CuO + 2NH3 → N2
2) Йодиды меди реагируют с H2SO4(к) с образованием SO2, тогда как йодиды щелочных металлов с образованием H2S:
2CuI + 4H2SO4 → 2CuSO4 + I2 + 2SO2 + 4H2O
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S + 4H2O
3) Медь по-разному реагирует с галогенами:
Cu + Cl2 → CuCl2
Cu + Br2 → CuBr2
2Cu + I2 → 2CuI (соль меди +1)
4) Медь в степени окисления +2 восстанавливается самой медью:
CuO + Cu → Cu2O (t)
CuCl2 + Cu → 2CuCl (t).
Правило 8. Железо
1) Соединения Fe+3 окисляют соединения S–2, S+4, I– и некоторые слабые металлы (восстанавливаясь до Fe+2):
Fe2O3 + 6HI → 2FeI2 + I2
2FeCl3 + 3Na2S → 2FeS

2FeCl3 + H2S → 2FeCl2 + S
2FeCl3 + Na2SO3 +H2O → 2FeCl2 + Na2SO4 + 2HCl
2FeCl3 + Cu → CuCl2 + 2FeCl2 (соль железа +2)
Fe2(SO4)3 + Cu → CuSO4 + 2FeSO4 (соль железа +2)
2Fe(NO3)3 + Fe → 3Fe(NO3)2 (соль железа +2)
2) В кислой среде соединения Fe+2 окисляются такими окислителями, как KMnO4, K2Cr2O7, Na2O2, HNO3, H2SO4(к) и др. до солей Fe+3:
6FeCl2 + Na2Cr2O7 + 14HCl → 6FeCl3 + 2CrCl3 + 2NaCl + 7H2O
2FeSO4 + Na2O2 + 2H2SO4 → Fe2(SO4)3 + Na2SO4 + 2H2O
3) В щелочной среде образуется гидроксид железа (III):
FeCl2 + KMnO4 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2FeSO4 + 2KMnO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
4) Железо по-разному реагирует с галогенами:
2Fe + 3F2 → 2FeF3
2Fe + 3Cl2 → 2FeCl3
2Fe + 3Br2 → 2FeBr3
Fe + I2 → FeI2 (соль железа +2)
5) Соединения Fe+2, Fe+3 также могут быть окислены до степени окисления +6 (до ферратов, например, Na2FeO4) очень сильными окислителями, но на ЕГЭ знание этих реакций не проверяется (источник: вебинары от разработчиков экзамена):
3FeSO4 + 2NaClO3 + 12NaOH → 3Na2FeO4 + 2NaCl + 3Na2SO4 + 6H2O.
Правило 9. Марганец
1) В кислой среде образуются соли Mn+2:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2) В щелочной среде образуется манганат-ион MnO42– (зеленого цвета):
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3
3) В нейтральной среде образуется осадок бурого цвета MnO2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2
2KMnO4 + 3K2S + 4H2O → 2MnO2

K2MnO4 + Na2S + 2H2O → S

Правило 10. Хром
1) Восстановление дихроматов в кислой среде протекает с образованием солей Cr+3:
Na2Cr2O7 + 6NaI + 7H2SO4 → Cr2(SO4)3 + 3I2
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
2) Окисление соединений Cr+2 в кислой среде протекает с образованием солей Cr+3:
6CrCl2 + K2Cr2O7 + 14HCl → 8CrCl3 + 2KCl + 7H2O
2CrCl2 + 4H2SO4(конц.) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
3) Окисление соединений Cr+3 очень сильными окислителями с щелочами или с карбонатами щелочных металлов протекает с образованием хроматов (типичные окислители: KNO3, Cl2, KClO3, H2O2 и др. в щел. среде):
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
Cr2(SO4)3 + 3Cl2 + 16KOH → 2K2CrO4 + 6KCl + 3K2SO4 + 8H2O
2Cr(OH)3 + KClO3 + 4NaOH → 2Na2CrO4 + KCl + 5H2O
2Cr(OH)3 + 3H2O2 + 4KOH → 2K2CrO4 + 8H2O
4) Соединения Cr+6 в различных средах:
В щелочной среде устойчивы соли хромовой кислоты (хроматы, желтого цвета), например, Na2CrO4.
В кислой среде устойчивы соли дихромовой кислоты (дихроматы, оранжевого цвета), например, Na2Cr2O7.
CrO3 + 2KOH → K2CrO4 + H2O
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O (в кислотной среде желтая окраска переходит в оранжевую).
Na2Cr2O7 + 2NaOH → 2Na2CrO4 + H2O (в щелочной среде оранжевая окраска переходит в желтую).
Правило 11. Среда раствора
1) С карбонатами щелочных металлов реакции протекают аналогично щелочной среде реакции:
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
2) Если в реакцию вступает оксид серы (IV) SO2 в нейтральном растворе, то реакция протекает аналогично кислой среде раствора:
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4.
Поэтому очень важно не зубрить окислительно-восстановительные реакции, а знать какие соединения проявляют окислительные, а какие восстановительные свойства, и знать основные правила, приведенные выше.
Окислительно – восстановительные реакции в неорганической химии.
|
Восстановители |
Продукты окисления |
Условия |
|
1. Металлы , м |
М+, М2+, М3+ |
кислая и нейтральная среда |
|
2. Металлы, образующие амфотерные гидроксиды: Ве, Zn, Al |
[Zn(OH)4]2-, [Al(OH)4]—, ZnO22-, AlO2— |
(сплавление) |
|
3. Углерод, С |
СО СО2 |
в кислой среде |
|
4. Оксид углерода (II), СО |
СО2 |
|
|
5. Сера, S |
SO2, SO42-, SO32- |
|
|
6. Сероводород, H2S, cульфиды, S2- |
S SO2 H2SO4, SO42- |
|
|
7. Оксид серы (IV), SO2, cернистая кислота H2SO3, сульфиты SO32-(Na2SO3) |
SO3 H2SO4, SO42-(Na2SO4) |
|
|
8. Фосфор, Р, фосфорин РН3, фосфиты РО33- |
Р2О5 Н3РО4, РО43- |
|
|
9. Аммиак, NH3 |
N2 NO |
|
|
10.Азотистая кислота, HNO2, нитриты NO2—(KNO2) |
HNO3 NO3—(KNO3) |
|
|
11. Галогеноводороды, кислоты HCl, HBr, HI и их соли |
Cl2, Br2, I2 |
|
|
12. Катионы Cr3+ |
CrO42 — Cr2O72 — |
|
|
13. Катионы Fe2+, Cu+ |
Fe3+, Cu2+ |
|
|
14. Катионы Mn2+ |
MnO2 MnO42- MnO4— |
|
|
15. Пероксид водорода, Н2О2 |
О2 + Н+ О2 + Н2О |
|
|
Окислители |
Продукты восстановления |
Условия |
|
1. Галогены, F2, Cl2, Br2, I2 |
F —, Cl —, Br —, I — |
|
|
2. Оксокислоты, хлора, брома и их соли: HClO, HBrO, HClO3,HBrO3 |
Cl —, Br — |
|
|
3. Кислород, О2 |
O2- |
|
|
4. Озон, О3 |
Н2О + О2 ОН — + О2 |
|
|
5. Сера, S |
S2- |
|
|
6. Оксид серы (VI), SO3 |
SO2 |
|
|
7. Оксид серы (IV), SO2 |
S |
|
|
8. Азотистая кислота, HNO2, нитриты, NO2— |
NO N2 |
|
|
9. Оксид азота (IV), NO2 более сильный окислитель, чем HNO3, |
NO N2 NH3 |
|
|
10. Нитраты, NO3— |
NO2— NH3 |
|
|
11. Хроматы, CrO42-, дихроматы, Cr2O72- |
[Cr(OH)6]3- Cr(OH)3 Cr3+ |
|
|
12. Катионы, Fe3+, Cu2+ |
Fe2+, Cu+ |
|
|
13. Перманганаты, MnO4 — |
Mn2+ + H2O MnO2 + щелочь MnO42- + H2O |
|
|
14. Пероксид водорода, Н2О2 |
Н2О ОН — |
|
|
15. H2SO4 (конц.), HNO3 |
рассмотрены отдельно |
При составлении уравнений ОВР важно уверенно находить среди реагирующих веществ окислитель и восстановитель. Некоторые вещества могут быть только восстановителями. Это металлы и вещества, которые содержат элемент, изменяющий степень окисления, в низшей степени окисления (например: NH3, PH3, H2S, HCl, HBr, HI и их соли). Фтор и сложные вещества, содержащие элемент в высшей степени окисления, могут быть только окислителями (например: HNO3, H2SO4, SO3, KMnO4, K2CrO4, K2Cr2O7).
Вещества, которые содержат элементы в промежуточной степени окисления, могут проявлять, в зависимости от природы реагента – партнёра, как окислительные, так и восстановительные свойства. Это – все неметаллы (кроме фтора): N2, NO, HNO2, KNO2, H2O2, S, SO2 и другие.
Пользуясь данными таблицы 1, составим некоторые уравнения ОВР:
2KI + 2SO3 = I2 + SO2 + K2SO4
восст. — ль окисл. – ль продукт продукт побочный
окисл. – я восст. – я продукт
SO2 + NO2 = SO3 + NO
восст. – ль окисл. – ль продукт продукт
окисл. – я восст. – я
В этой реакции оксид серы (IV) проявляет восстановительные свойства, т.к. реагирует с сильным окислителем – NO2.
2H2S + SO2 = 3S + 2H2O
восст. – ль окисл. – ль продукт побочный
окисл. – я продукт
и восст. – я
В данной реакции SO2 проявляет окислительные свойства, т.к. реагирует с более сильным восстановителем – H2S.
На ход окислительно – восстановительных реакций в растворах влияет среда, в которой протекает реакция и, поэтому, окислительно – восстановительный процесс между одними и теми же веществами в разных средах приводит к образованию различных продуктов. Для создания кислой среды обычно используют разбавленную серную кислоту.
Азотную и соляную применяют редко, т.к. первая является сильным окислителем, а вторая способна окисляться. Для создания щелочной среды применяют растворы гидроксидов калия или натрия.
Примеры влияния среды на характер продуктов ОВР:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
восст.-ль окисл.-ль среда продукт продукт побочные
окисл.-я восст.-я продукты
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2↓ + 2KOH
восст.-ль окисл.-ль среда продукт продукт побочный
окисл.-я восст.-я продукт
Na2SO3 + 2KMnO4 + 4KOH = Na2SO4 + 2K2MnO4 + 2H2O
восст.-ль окисл.-ль среда продукт продукт побочный
окисл.-я восст.-я продукт
16HBr + 2NaMnO4 = 5Br2 + 2MnBr2 + 2NaBr + 8H2O
восст.-ль окисл.-ль продукт продукт побочные
≈ среда окисл.-я восст.-я продукты
4KMnO4 + 4KOH = 4K2MnO4 + O2 + 2H2O
Остановимся на некоторых, наиболее часто встречающихся в заданиях ЕГЭ. окислительно – восстановительных реакциях.
✱ Кислоты – сильные окислители.
Это серная кислота концентрированная и азотная кислота в любом виде. Они окисляют почти все металлы и такие неметаллы, как углерод, фосфор, серу, и многие сложные вещества.
Возможные продукты восстановления этих кислот:
H2SO4 → SO2 → S → H2S
HNO3 → NO2 → NO → N2O → N2 → NH3(NH4NO3)
При взаимодействии с металлами получаются три вещества: соль, вода и продукт восстановления кислоты, который зависит от концентрации кислоты, активности металла и температуры.
Чем меньше концентрация кислоты. А металл более активен, тем больше степень восстановления кислоты.
Представим возможные направления взаимодействия этих кислот с различными веществами в виде схем:
H2SO4 концентр.
не реагирует не реагирует восстанавливается восстанавливается
с Au, Pt и на холоде до SO2 с неактивными до SO2, S или H2S
некоторыми с Fe,Al, Cr металлами и с металлами средней
другими неметаллами активности и активными,
металлами со сложными
веществами
Cu + H2SO4 концентр. = CuSO4 + SO2 + 2H2O
Zn + 2H2SO4 концентр.= ZnSO4 +SO2 + 2H2O
3Zn + 4H2SO4 концентр. = 3ZnSO4 + S↓ + 4H2O
4Zn + 5H2SO4 концентр. = 4ZnSO4 + H2S + 4H2O
HNO3 концентр.
не реагирует не реагирует восстанавливается восстанавливается
с Au, Pt и на холоде до NO2 с неактив — до NO, N2O, N2 или
некоторыми с Fe, Al, Cr ными металлами, NH4NO3 (если кислота
другими неметаллами, очень разбавлена или
металлами сложными сказано, что газ
веществами не выделялся) с металлами
средней активности и
активными
Cu + 4HNO3 концентр. = Cu (NO3)2 + 2NO2 + 2H2O
HNO3 разбавл.
не реагирует не реагирует восстанавливается восстанавливается
с Au, Pt и на холоде до NO с неактивными до NO, N2O, N2 или
некоторыми с Fe, Al, Cr металлами, неметаллами, NH4NO3 (если кислота
другими сложными веществами очень разбавлена или
металлами сказано, что газ не вы –
делялся) с металлами
средней активности и
активными
3Cu + 8HNO3 разбавл.. = 3Cu (NO3)2 + 2NO + 4H2O
Al + 4HNO3 разбавл. = Al (NO3)3 + NO + 2H2O
8Al + 30HNO3 разбавл. = 8Al (NO3)3 + 3N2O + 15H2O
10Al + 36HNO3 разбавл. = 10Al (NO3)3 + 3N2 + 18H2O
8Al + 30HNO3 разбавл. = 8Al (NO3)3 + 3NH4NO3 + 5H2O
Концентрированные H2SO4 и HNO3 реагируют с Fe, Al, Cr только при нагревании:
2Fe + 6H2SO4 концентр. = Fe2 (SO4)3 + 3SO2 + 3H2O
Fe + 6HNO3 концентр. = Fe (NO3)3 + 3NO2 + 3H2O
Концентрированная H2SO4 и HNO3 в любом виде окисляют неметаллы — восстановители — углерод, фосфор, серу — до соответствующих кислот.
C + 4HNO3 концентр. = CO2 + 2H2O + 4NO2
3C + 4HNO3 разбавл. = 3CO2 + 2H2O + 4NO
C + 2H2SO4 концентр. = CO2 + 2H2O + 2SO2
P + 5HNO3 концентр. = H3PO4 + 5NO2 + H2O
3P + 5HNO3 разбавл. + 2H2O = 3H3PO4 + 5NO
2P + 5H2SO4 концентр. = 2H3PO4 + 5SO2 + 2H2O
S +6HNO3 концентр. = H2SO4 + 6NO3 + 2H2O
S + 2HNO3 разбавл. = H2SO4 + 2NO
S +2H2SO4 концентр. = 3SO2 +2H2O
Концентрированная азотная кислота окисляет йод до йодноватой кислоты:
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
Взаимодействие этих кислот со сложными веществами рассмотрим в следующем разделе.
Особое значение имеет ОВР между соляной и азотной кислотами. Смесь трёх объёмов соляной кислоты и одного объёма концентрированной азотной называют «царская водка», в ней растворяется даже золото, которое алхимики считали царём металлов:
3HCl +HNO3 = Cl2 + NOCl + 2H2O
✱ Окислительно – восстановительные реакции, а не реакции обмена.
В ряде случаев между веществами, которые проявляют сильные восстановительные и окислительные свойства, возможны только ОВР, а не реакции обмена.
Рассмотрим следующие варианты:
1. Окислители – соединения железа (III), восстановители – сульфиды, йодиды. При этом катион Fe3+ восстанавливается до катиона Fe2+, сульфид – анион S2-окисляется до серы S0, а йодид – анион I— окисляется до йода I2.
В зависимости от количественного соотношения реагирующих веществ могут получиться различные соединения железа (II):
2FeCl3 + H2S = S↓ + 2FeCl2 + 2HCl
2FeCl3 + Na2S = S↓ + 2FeCl2 + 2NaCl
или 2FeCl3 + 3Na2S = S↓ + FeS + 6NaCl
Fe2(SO4)3 + H2S = S↓ + 2FeSO4 +H2SO4
Fe(OH)3 + 6HI = 2FeI2 + I2↓ + 6H2O
Fe2O3 + 6HI = 2FeI2 + I2↓ + 3H2O
2FeCl3 +2HI = 2FeCl2 + I2↓ + 2HCl
2FeCl3 + 2KI = 2FeCl2 + I2↓ + 2KCl
или 2FeCl3 + 6KI = 2FeI2 + I2↓ + 6KCl
Fe2(SO4)3 + 2KI = 2FeSO4 + I2↓ + K2SO4
Fe2(SO4)3 + BaI2 = 2FeSO4 + I2↓ + BaSO4↓
2. Окислители – соединения меди (II), восстановители — йодиды. При этом катион Cu2+ восстанавливается до катиона Cu+, а йодид – анион окисляется до йода I2 :
2CuSO4 + 4KI = 2CuI↓ + I2↓ + 2K2SO4
2CuCl2 + 4KI = 2CuI↓ + I2↓ + 4KCl
2CuCl2 + 4HI = 2CuI↓ + I2↓ + 4HCl
3. Окислитель – азотная кислота, восстановитель – сульфиды, йодиды, сульфиты. При этом азотная кислота, в зависимости от концентрации, восстанавливается до NO2 (концентрированная), до NO (разбавленная); сульфид – анион S2- окисляется до серы S0 или сульфат – аниона SO42-, йодид – анион – до йода I2, a сульфит – анион SO32- — до сульфат – аниона SO42- :
8HNO3 концентр. + CuS = CuSO4 + 8NO2 + 4H2O
или 4HNO3 концентр.+ CuS = S↓ + 2NO2 + Cu(NO3)2 + 2H2O
8HNO3 разбавл.+ 3CuS = 3S↓ + 2NO + 3Cu(NO3)2 + 4H2O
4HNO3 концентр.+ Na2S = S↓ + 2NO2 + 2NaNO3 + 2H2O
24HNO3 концентр.+ Al2S3 = Al2(SO4)3 + 24NO2 + 12H2O
2HNO3 разбавл.+ H2S = 3S↓ + 2NO + 4H2O
8HNO3 концентр.+ H2S = H2SO4 + 8NO2 + 4H2O
или 2HNO3 концентр.+ H2S = S↓ + 2NO2 + 2H2O
2HNO3 разбавл.+ 3K2SO3 = 3K2SO4 + 2NO + H2O
6HNO3 концентр.+ HI = HIO3 + 6NO2 + 3H2O
2HNO3 концентр.+ 2KI = I2 + 2NO2 + H2O
4. Окислитель – азотная кислота или серная концентрированная кислота, восстановитель – соединения железа (II). При этом азотная кислота восстанавливается до NO2 или NO, серная – до SO2, а катион Fe2+ окисляется до катиона Fe3+ :
Fe(OH)2 + 4HNO3 концентр. = Fe(NO3)3 + NO2 + 3H2O
FeO + 4HNO3 концентр. = Fe(NO3)3 + NO2 + 2H2O
3Fe(NO3)2 + 4НNO3 разбавл. = 3Fe(NO3)2 + NO + 2H2O
2Fe(OH)2 + 4H2SO4 концентр. = Fe2(SO4)3 + SO2 + 6H2O
5. Окислитель – серная кислота концентрированная, восстановитель – сульфиды, йодиды и бромиды. При этом серная кислота восстанавливается до SO2, S или
H2S; сульфид – анион S2- окисляется до серы S, SO2 или H2SO4; йодид – анион до йода I2, бромид – анион до брома Br2 :
CuS + 4H2SO4 концентр. = CuSO4 + 4SO2 + 4H2O
H2S + H2SO4 концентр. = S↓ + SO2 + 2H2O
или H2S + H2SO4 концентр. = 4SO2 + 4H2O
8HI + H2SO4 концентр. = 4I2↓ + H2S + 4H2O
или 6HI + H2SO4 концентр.= 3I2↓ + S↓ + 4H2O
2HI + H2SO4 концентр. = I2↓ + SO2 + 2H2O
8KI + 9H2SO4 концентр. = I2↓ + H2S + 8KHSO4 + 4H2O —
наиболее вероятный вариант подуктов,
или 6KI + 2H2SO4 концентр. = 3I2↓ + H2S + 3K2SO4 + 4H2O
2HBr + H2SO4 концентр. = Br2 + SO2 + 2H2O
2KBr + 2H2SO4 концентр. = Br2 + SO2 + K2SO4 + 2H2O
6KBr + 2H2SO4 концентр. = 3Br2 + S↓ + 3K2SO4 + 2H2O
6. Железная окалина – Fe3O4, это смесь двух оксидов — FeO и Fe2O3. Поэтому при взаимодействии с сильными окислителями она окисляется до соединения железа (III) за счёт катионов Fe2+ — восстановителей, а при взаимодействии с сильными восстановителями восстанавливается до соединения железа (II) за счёт катионов Fe3+ — окислителей:
Fe3O4 + 10HNO3 концентр. = 3Fe(NO3)3 + NO2 + 5H2O
3Fе3O4 + 28HNO3 разбавл. = 9Fe(NO3)3 + NO + 14H2O
Fe3O4 + 8HI = 3FeI2 + I2↓ + 4H2O
При взаимодействии с большинством кислот происходит реакция обмена, получаются две соли:
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
Fe3O4 + 4H2SO4 разбавл. = FeSO4 + Fe2(SO4)3 + 4H2O
✱ Реакции диспропорционирования.
Это реакции, в которых атомы одного и того же элемента, входящие в состав одного и того же исходного вещества, повышают и понижают степень окисления. Они очень часто встречаются в заданиях С-2, поэтому их нужно запомнить тем, кто хочет сдать ЕГЭ на высокий балл.
- Все галогены, кроме F2, диспропорционируют в растворах всех щелочей. При комнатной температуре или на холоде получаются две соли – МГ, МГО и Н2О; при нагревании – две соли: МГ, МГО3 и Н2О.
Cl2 +2KOH = KCl + KClO + H2O – на холоде,
3Cl2 + 6KOH = 5KCl +KClO3 + 3H2O – при нагревании,
2Br2 + 2Sr(OH)2 = SrBr2 + Sr(BrO)2 + H2O – на холоде,
6Br2 + 6Sr(OH)2 = 5SrBr2 + Sr(BrO3)2 + 6H2O – при нагревании
Аналогично происходят реакции с растворами карбонатов:
Cl2 + K2CO3 = KCl + KClO + CO2 – на холоде,
3Cl2 + 3K2CO3 = 5KCl + KClO3 + 3CO2 – при нагревании.
2. Диспропорционирование серы в растворах щелочей:
3S + 6KOH = 2K2S + K2SO3 + 3H2O или 4S + 6KOH = K2S2O3 + 2K2S +3H2O
3. Диспропорционирование фосфора в растворах щелочей.
4P + 3KOH + 3H2O = PH3 + 3KH2PO2
8P + 3Ba(OH)2 + 6H2O = 2PH3 + 3Ba(H2PO2)2
P4 (белый фосфор) + 3KOH + 3H2O = PH3 + 3KH2PO2
4. Диспропорционирование оксида азота (IV) в воде и щелочах:
2NO2 + H2O = HNO2 + HNO3
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
5. Другие реакции диспропорционирования:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH
4NaClO3 = 3NaClO4 + NaCl
4K2SO3 = 3K2SO4 + K2S
ClO2 + H2O = HCl + HClO3
В завершении этой статьи хочу отметить, что не так уж страшны окислительно – восстановительные уравнения, как это кажется на первый взгляд. Знание основных закономерностей поможет их составлении.
Теория
| 1. | Окислительно-восстановительные реакции | |
| 2. | Окислительно-восстановительные свойства веществ | |
| 3. | Электронный баланс |
Задания
| 1. |
Понятия
Сложность: |
1 |
| 2. |
Окисление и восстановление
Сложность: |
1 |
| 3. |
Частицы
Сложность: |
1 |
| 4. |
Формулы частиц
Сложность: |
2 |
| 5. |
Процессы окисления и восстановления
Сложность: |
2 |
| 6. |
Выбери реакцию
Сложность: |
2 |
| 7. |
Коэффициенты
Сложность: |
2 |
| 8. |
Сумма коэффициентов
Сложность: |
3 |
| 9. |
Окислитель
Сложность: |
3 |
Экзаменационные задания (подписка)
| 1. |
Как на ЕГЭ. Окислительно-восстановительные свойства серы
Сложность: |
1 |
| 2. |
Как на ЕГЭ. Окислитель, восстановитель
Сложность: |
1 |
| 3. |
Как на ЕГЭ. ОВР
Сложность: |
1 |
Тесты
| 1. |
Тренировка по теме Окислительно-восстановительные реакции
Сложность: среднее |
13 |
Материалы для учителей
| 1. | Методическое описание |
Открытый урок элективного курса
«Решение задач повышенной сложности по химии. Подготовка к ЕГЭ. 11 класс»
Тема урока: «Окислительно-восстановительные реакции. Электронно-ионный метод составления уравнений ОВР. Системный подход к решению задания ЕГЭ №30»
Тип урока: Изучение новой темы на основе комплексного применения ранее полученных знаний.
Основные цели и задачи:
А) Образовательные:
* сформировать у обучающихся понятия о важнейших окислителях и восстановителях;
* научить общим принципам составления уравнений ОВР, протекающих в растворах (электронно-ионный метод);
* научить прогнозировать окислительные или восстановительные свойства веществ, а также продукты их восстановления или окисления в зависимости от условий;
* научить системному подходу к решению задания №30 в формате ЕГЭ.
Б) Развивающие:
* развивать мышление учащихся, научить их делать логические выводы из наблюдений;
* развивать умение выделять общие и существенные признаки; отличать несущественные признаки; умение применять знания на практике;
* закрепить умения и навыки химического эксперимента, умение работать со справочным материалом (таблицы, опорные схемы, справочники и т.д.);
* развивать познавательные умения: выделять главное, вести конспект, делать выводы.
В) Воспитательные:
* формировать интерес учащихся к изучению химии, умение использовать приобретённые знания в практических целях (например, применение ОВР для получения металлов и других веществ; роль окислительно-восстановительных процессов в коррозии металлов и защита от неё и т.д.);
* воспитание мотивации к обучению, ответственного и серьёзного отношения к занятиям;
* воспитание дисциплинированности, умения работать в коллективе, уважения к учителю и одноклассникам.
Интегративная учебная проблема: «Почему одни вещества в реакции проявляют свойства восстановителя, а другие – окислителя? Как безошибочно определить роль того или иного вещества в ОВР, а также продукты их превращений?»
Тип урока: урок усвоения нового материала.
Технологии: проблемное, исследовательское, групповое и дифференцированное обучение; ИКТ.
Форма организации учебной деятельности учащихся: частично-поисковая деятельность, создание проблемных ситуаций; индивидуальная работа и в группах.
Учебно-методическое и материально-техническое обеспечение:
— учебник О.С. Габриеляна «Химия. 11 класс»;
— Комплекс материалов для подготовки учащихся к ЕГЭ по химии (под ред. Кавериной А.А.)
— таблица растворимости веществ в воде;
— электрохимический ряд напряжения металлов; опорные схемы по теории ОВР;
— мультимедийные средства (ПК, проектор и экран для демонстрации слайдов);
— доска ученическая, мел.
Оборудование: карточки задания для самостоятельной работы.
Ход урока
Учитель:
Мы продолжаем изучать окислительно-восттановительные процессы. Давайте вспомним основные положения теории ОВР:
-
Какие реакции относятся к ОВР?
-
Дайте определение понятия «степень окисления».
-
Как определяется степень окисления атома элемента в молекуле вещества?
-
Что такое окисление? Восстановление? Могут ли эти процессы существовать независимо друг от друга?
-
Что такое окислитель и восстановитель?
-
Как изменяется степень окисления в процессах окисления и восстановления?
-
Можно ли подбирать коэффициенты при составлении уравнений ОВР «на глазок»? Какие вам известны приемы при подборе коэффициентов?
Какое важнейшее правило лежит в основе составления электронного баланса?
Ответы учеников:
-
ОВР – это реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ.
-
Степень окисления (С.О.) – это условный заряд атома элемента в молекуле, вычисленный из предположения, что молекула состоит только из ионов. Положительная С.О. определяется числом электронов, оттянутых от данного атома, а отрицательная – числом электронов, смещённых от других атомов.
-
Чтобы рассчитать С.О. элемента в соединении, необходимо знать постоянные степени окисления некоторых химических элементов, а также то, что алгебраическая сумма степеней окисления всех атомов в молекуле вещества равна нулю. С.О. простых веществ равна нулю!
-
Окислением называется отдача электронов атомом, молекулой или ионом. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Эти два взаимопротивоположных процесса неразрывно связаны между собой: не существует окисления без восстановления и наоборот.
-
Вещество, атомы, молекулы или ионы которого в процессе реакции отдают электроны, называется восстановителем. Вещество, атомы, молекулы или ионы которого в процессе реакции принимают электроны, называется окислителем.
-
В процессе окисления С.О. восстановителя повышается. При восстановлении С.О. окислителя понижается.
-
Изменение С.О. элементов в ОВР обусловлено распространением электронов между окислителем и восстановителем. При этом число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Метод электронного баланса основан на сравнении С.О. атомов в исходных и конечных веществах, для чего составляют электронные уравнения и на их основе вычисляют коэффициенты.
Учитель:
Для ОВР, протекающих в растворах, существенную роль играет среда раствора, так как часто продукты восстановления большинства окислителей зависят от реакции среды, в которой протекает данная ОВР. Метод электронного баланса для таких ОВР имеет ряд недостатков: не учитывает реально существующие ионы в растворе; не позволяет прогнозировать продукты ОВР.
Влияние среды раствора, в котором протекает восстановление перманганат-иона, можно отразить следующей схемой:
Mn2+←(H+)← MnO4—→(OH—)→MnO42-
↓
(H2O)
↓
MnO2
Рассмотрим реакцию восстановления перманганата калия нитритом натрия в сернокислой среде. Нитрит натрия в результате окисления превращается в нитрат натрия. Катионы Mn2+, образующиеся в результате восстановления перманганата калия, связываются сульфат-ионами в сульфат марганца (II).
KMnO4 + NaNO2 + H2SO4 → MnSO4 + NaNO3 + K2SO4 + H2O.
Электронный баланс: Mn+7 (+5е—) → Mn+2│5 │2
N+3 (- 2e—) → N+5 │2 │5
2KMnO4 + 5 NaNO2 +3 H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O.
Как видно, при составлении электронных уравнений мы вычленяем отдельные атомы, которые на самом деле в растворе отсутствуют.
В электронно-ионном методе (метод полуреакций) коэффициенты находят с помощью электронно-ионных уравнений. Последние отличаются от электронных уравнений (метод электронного баланса) тем, что в них учитывают ионы, образующиеся в результате диссоциации реагирующих веществ и реально существующие в водном растворе (учитель предлагает написать данное уравнение в полной ионной форме, после чего выписать из него частицы, несущие в себе окислитель и восстановитель и продукты их превращений).
При составлении электронно-ионных уравнений следует учитывать изменение не только зарядов ионов, но, весьма часто, и их состава, например, при восстановлении перманганат-иона по схеме: MnO4— → Mn2+, и во многих других случаях. Такие взаимные переходы сопряжены в общем случае с участием в них молекул воды или содержащихся в расвторе ионов Н+ и ОН—. Если реакция идет в кислой среде, то при составлении полуреакций используют ионы Н— или молекулы Н2О; в щелочной среде – ионы ОН— или молекулы Н2О; в нейтральной среде – ионы Н+, ОН— и молекулы Н2О.
При составлении электронно-ионных уравнений необходимо обратить внимание на число атомов кислорода в исходных и образующихся частицах – молекулах, ионах. В связи с этим целесообразно опираться на следующие правила:
Правило 1
Если исходная частица (А) содержит кислорода больше, чем образующаяся (Б), то освобождающийся кислород связывается в кислых растворах ионами Н+ в воду (1), а нейтральных и щелочных растворах – в гидроксид-ионы (2):
-
О2- + 2Н+ → Н2О или А + Н+ → Б + Н2О
-
О2- + Н2О → 2ОН— или А + Н2О → Б + ОН—
Правило 2
Если исходная частица (А) содержит кислорода меньше, чем образующаяся (Б), то недостаток атомов кислорода восполняется в кислых и нейтральных растворах за счет молекул воды (1), а в щелочных – за счет гидроксид-ионов (2):
-
Н2О → О2- + 2Н+ или А + Н2О → Б + 2Н+
-
2ОН— → О2- + Н2О или Б + ОН— → Б + Н2О
В соответствии с вышеописанными правилами составим электронно-ионные уравнения (полуреакции).
Рассмотрим последовательность, которой рекомендуется придерживаться при составлении окислительно – восстановительных реакций.
Пример 1. При окислении K2SO3 перманганатом калия в кислой среде последний восстанавливается в ионы 
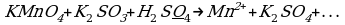
Решение. Составляем электронно-ионные уравнения по этапам.
1 этап.
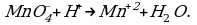
Так как в ионе 
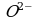
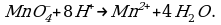
Чтобы стрелку заменить знаком равенства, надо, чтобы равенство было не только по числу атомов элементов, но и по зарядам.
Подсчитаем суммарные заряды в левой и правой частях полуреакции:
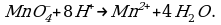
+7 +2
Для сохранения равенства зарядов левую часть схемы следует дополнить пятью электронами:

2 этап. Составляем полуреакцию процесса окисления:
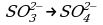
Так как в исходном ионе содержится меньше кислорода, чем в образующемся, то недостаток атомов кислорода восполним за счет молекулы воды:
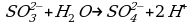
Число атомов каждого элемента одинаково в левой и правой частях схемы; для восполнения условия равенства зарядов из левой части вычитаем два электрона:

3 этап. Запишем две полуреакции вместе и по правилам нахождения наименьшего кратного определим множители, на которые надо умножить обе полуреакции:


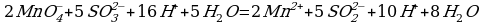
Производим сокращение:

Из этого уравнения видно, что окисление ионов 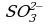
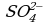
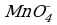
4 этап. Составляем молекулярное уравнение. Для этого к левой части ионного уравнения приписываем каждому иону противоион, такое же число ионов приписываем к правой части уравнения:
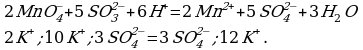
При написании продуктов реакции необходимо учитывать, что каждый ион из верхней строчки соединится с противоположным ионом из нижней (2 иона 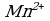
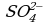
Записываем молекулярное уравнение:
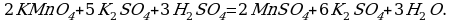
Как мы с вами убедились, данную реакцию можно уравнять как с помощью метода электронного баланса, так и с позиции метода полуреакций. Однако, существуют такие ОВР, уравнения которых невозможно составить, опираясь на метод электронного баланса:
FeSO4 + KMnO4 + H2O → ?
Метод полуреакций позволит нам правильно спрогнозировать продукты данной ОВР. Окислителем являются перманганат-ионы MnO4—, которые в нейтральной среде восстанавливается до MnO2↓, а восстановителем – ионы Fe2+, которые могут быть окислены в ионы Fe3+. Cоставим электронно-ионные уравнения и просуммируем их с учетом коэффициентов:
Fe2+ (-e—)→ Fe3+ │1│3
MnO4— + 2H2O (+3e—)→ MnO2↓ + 4OH— │3 │1
3Fe2+ + MnO4— + 2H2O → 3Fe3+ + MnO2↓ + 4OH— (суммарное уравнение в сокращенной ионной форме)
Как видно, в продуктах ОВР имеем одновременно ионы Fe3+ и OH—, которые будут взаимодействовать между собой с образованием гидроксокатиона FeOH+:
3Fe3+ + 4OH— → 3FeOH+ + OH—.
Cледовательно, правая часть суммарного уравнения преображается следующим образом:
… → 3FeOH+ + OH— + MnO2↓
Преобразуем сокращенную ионную форму ОВР в молекулярную и получим:
3FeSO4 + KMnO4 + 2H2O = 3FeOHSO4 + MnO2 + KOH
Задания для самостоятельного выполнения (раздается группам учеников на карточках):
Карточка 1.
Cоставьте уравнение реакции восстановления дихромата калия концентрированной соляной кислотой.
Решение:
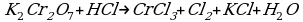
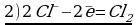
Сr2O72- + 14H+ + 6Cl— = 2Cr3+ + 3Cl2 + 7H2O
K2Сr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Комментарий:
Восстановитель (HCl) в ходе реакции дополнительно выполняет функцию солеобразователя. Одна молекула K2Cr2O7 окисляет шесть модекул HCl, образуя три молекулы хлора (3Cl2), а восемь молекул HCl расходуются на образование солей (2KCl+2CrCl3).
Карточка 2.
Cоставьте уравнение реакции окисления хлорида хрома (III) бромной водой в щелочной среде.
Решение:
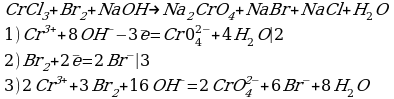
Комментарий:
Из этого ионного уравнения видна роль щелочи: окисление ионов Cr3+ в 

4)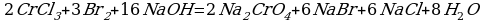
Учитель:
По опыту сдачи ЕГЭ в 2018 году мы знаем насколько усложнилось задание №30 второй части. Если раньше требовалось доставить пропущенные вещества в левой и правой частях уравнения и подобрать коэффициенты методом электронного баланса, то теперь перед выпускником стоит сложнейшая задача — самому выбрать окислитель, восстановитель и реакцию среды, в которой протекает ОВР, а также спрогнозировать продукты ОВР. Это на порядок усложняет данное задание.
Предлагаю разработать системный подход к решению данного задания. Для этого мы должны четко представлять себе, какие свойства (окислительные или восстановительные ?) способно проявлять то или иное вещество. В качестве вспомогательного материала будем использовать составленную ранее таблицу, в которой отражены не только важнейшие окислители и восстановители, но также наиболее типичные превращения веществ.
Важнейшие восстановители и окислители
|
Воссстановители |
Окислители |
|
Все металлы (Ме0): Ме0 – ne— → Me+n Уголь (углерод, кокс): С0 – 2е— → С+2 С0 – 4е— → С+4 Оксид углерода (II): С+2О – 2е— → С+4О2 Сульфид-ион (сероводород, сульфиды): S-2 – 2e— → S0 (часто) S-2 – 6e— → S+4 (реже) S-2 – 8e— → S+6 (реже) Сернистая кислота и ее соли (сульфиты): (SO3)-2 – 2e— → (SO4)-2 Галогенид-ионы Наl— (Cl—, Br—, I—): 2Hal— — 2e— → Hal02 Хлорид олова (II): SnCl2 -2e— → SnCl4 Сульфат железа (II); 2FeSO4 -2e— → Fe2(SO4)3 Cульфат марганца (II); (MnO4)-2 ß (+OH)Mn+2(+H+) à (MnO4)— ↓ (+H2O) MnO2 Сульфат хрома (II) CrSO4: 2CrSO4 – 2e— → Cr2(SO4)3 Сульфат хрома (III) Cr2(SO4)3: (CrO4)-2 ß (+OH—) Cr+3 (+H+) à (Cr2O7)-2 Азотистая кислота и ее соли (нитриты): (NO2)— — 2e— → (NO3)— Аммиак NH3: NO ß NH3 à N2 ↓ NO2 Фосфористая кислота Н3РО3 и ее соли (фосфиты): (РО3)-3 – 2е— → (РО4)-3 Перекись водорода Н2О2 и пероксиды щелочных и щелочноземельных металлов (Na2O2): (O2)-2 — 2e— → O20↑ Катод при электролизе |
Галогены Hal20 (F2, Cl2, Br2): Hal20 + 2e— → 2Hal— Перманганат-ион (MnO4)—: (MnO4)-2 ß (+OH—)(MnO4)—(+H+) à Mn+2 (+Н2О)↓ MnO2 Ди(би)хромат-ион (Сr2O7)-2: (CrO4)-2ß (+OH—)(Сr2 O7)-2(+H+) à Cr+3 (+H2O)↓ Cr(OH)3 Азотная кислота HNO3: HNO3 (конц.) + малоакт.Ме → NO2 HNO3 (разб.) + малоакт.Ме → NO HNO3 (разб.) + активный Ме → N2, N2O HNO3 (оч.разб.) + активный Ме → NH4NO3 Кислород О2: О2 +4е— → 2О-2 Перекись водорода Н2О2 и пероксиды щелочных и щелочноземельных металлов (Na2O2): (O2)-2 + 2e— → 2O-2 В кислой среде: Н2О2 + 2Н+ + 2е— → 2Н2О В щелочной среде: Н2О2 + 2е— → 2ОН— Концентрированная серная кислота: H2SO4 (конц.) + малоакт.Ме → SO2 H2SO4 (конц.) + среднеакт.Ме → S0 H2SO4 (конц.) + активныйМе → H2S Оксид меди (II): СuO + e → Cu+ СuO + 2e → Cu0 Оксид серебра: Ag2O +2e— → 2Ag0 Хлорид железа (III): FeCl3 + e— → FeCl2 Оксид свинца (IV): PbO2 + 2e— → Pb+2 ( в кислой среде, напр., PbCl2) Анионы (ClO)—, (ClO2)—, (ClO3)—, (ClO4)— при восстановлении переходят в Cl— или Cl20 Анод при электролизе |
Таким образом, решение задания №30 можно представить в виде следующего пошагового алгоритма:
1 ШАГ
На основании данной таблицы и понимания зависимости окислительно-восстановительных свойств сложных веществ от степени окисления элементов, входящих в состав молекул, делаем вывод об ОВ-свойствах данных в задании веществ. При этом присваиваем выбранным веществам «ярлычок»: «окислитель», «восстановитель», «ОВ-двойственность».
2 ШАГ
Помним, что в перечень веществ могут входить «лишние» вещества, которые не участвуют в предполагаемых ОВР (но участвуют в РИО, см. Задание №31), а также вещества, которые могут быть использованы в качестве среды раствора. Им мы тоже присваиваем «ярлычки»: «среда», «РИО», «лишнее».
3 ШАГ
После того как «развесили ярлычки» начинаем составлять левую часть уравнения ОВР: выбираем из перечня веществ восстановитель, окислитель и среду раствора.
4 ШАГ
Зватем, прогнозируя продукты ОВР, составляем правую часть уравнения. Для сложных реакций на стадии прогнозирования можно воспользоваться методом полуреакций.
5 ШАГ
Составляем электронные уравнения окисления и восстановления (электронный баланс) и определяем коэффициенты.
Пример решения задания №30 ЕГЭ
Задание:
Перечень веществ: водород, гидроксид магния, серная кислота (конц.), магний, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Решение:
ШАГ 1.
Запишем химические формулы веществ из предложенного перечня:
H2, Mg(OH)2, H2SO4 (конц.), Mg, KMnO4.
Определим окислительно-восстановительные свойства веществ – присвоим веществам «ярлычки»:
H2 – восстановитель, но по отношению к магнию – окислитель (t0);
Mg(OH)2 – не будет проявлять ОВ-свойств, т.к. в состав вещества входят химические элементы с постоянной С.О. («РИО»);
H2SO4 (конц.) – окислитель (за счет S+6);
Mg – восстановитель;
KMnO4 – окислитель в растворе (за счет Mn+7).
ШАГ 2.
Выберем вещества, между которыми возможна ОВР: Mg и H2SO4 (конц.)
ШАГ 3.
Составим левую часть уравнения:
Mg + H2SO4(конц.)→ …
ШАГ 4.
Прогнозируем продукты:
Mg окисляется в ион Mg2+, который в условиях данной реакции входит в состав соли – сульфата магния MgSO4;
H2SO4 (конц.) восстанавливается металлом, расположенным в ряду напряжений до алюминия, до сероводорода H2S.
Концентрированная серная кислота в данной ОВР играет двоякую роль – окислителя и среды (солеобразователя), при этом в продуктах образуется также вода.
Таким образом, схема данной ОВР имеет вид:
Mg + H2SO4 (конц.) → MgSO4 + H2S + Н2О
ШАГ 5.
Составляем уравнения электронного баланса и определяем коэффициенты:
Mg0 – 2e— → Mg+2 │2 │8│4
S+6 + 8e— → S-2 │8 │2 │1
Окончательное уравнение ОВР:
4Mg + 5H2SO4 (конц.) → 4MgSO4 + H2S + 4Н2О
Задания для самостоятельного выполнения с последующим обменом между группами:
Вариант 1.
Перечень веществ: йодоводород, фтор,хлорат калия, йод, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Вариант 2.
Перечень веществ: оксид хрома (III), сероводород, гидроксид калия, серная кислота, хлор. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Скачать материал

Скачать материал


- Сейчас обучается 30 человек из 23 регионов


- Сейчас обучается 113 человек из 49 регионов


- Курс добавлен 13.12.2022


Описание презентации по отдельным слайдам:
-
1 слайд
Окислительно-восстановительные реакции
(теория для подготовки задания № 29 КИМ ЕГЭ по химии 2023)
Подготовила: учитель химии МАОУ « Гимназия № 31»
Усачева Е.С. -
2 слайд
При составлении уравнений ОВР важно уверенно находить среди реагирующих веществ окислитель и восстановитель. Некоторые вещества могут быть только восстановителями. Это металлы и вещества, которые содержат элемент, изменяющий степень окисления, в низшей степени окисления (например: NH3, PH3, H2S, HCl, HBr, HI и их соли). Фтор и сложные вещества, содеожащие элемент в высшей степени окисления, могут быть только окислителями (например: HNO3, H2SO4, SO3, KMnO4, K2CrO4, K2Cr2O7).
-
3 слайд
Вещества, которые содержат элементы в промежуточной степени окисления, могут проявлять, в зависимости от природы реагента – партнёра, как окислительные, так и восстановительные свойства. Это – все неметаллы (кроме фтора): N2, NO, HNO2, KNO2, H2O2, S, SO2 и другие.
-
4 слайд
На ход окислительно – восстановительных реакций в растворах влияет среда, в которой протекает реакция и, поэтому, окислительно – восстановительный процесс между одними и теми же веществами в разных средах приводит к образованию различных продуктов. Для создания кислой среды обычно используют разбавленную серную кислоту.
Азотную и соляную применяют редко, т.к. первая является сильным окислителем, а вторая способна окисляться. Для создания щелочной среды применяют растворы гидроксидов калия или натрия. -
5 слайд
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
восст.-ль окисл.-ль среда продукт продукт побочные
окисл.-я восст.-я продукты3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
восст.-ль окисл.-ль среда продукт продукт побочный
окисл.-я восст.-я продуктNa2SO3 + 2KMnO4 + 4KOH = Na2SO4 + 2K2MnO4 + 2H2O
восст.-ль окисл.-ль среда продукт продукт побочный
окисл.-я восст.-я продуктПримеры влияния среды на характер продуктов ОВР:
-
6 слайд
Кислоты – сильные окислители.
Это серная кислота концентрированная и азотная кислота в любом виде. Они окисляют почти все металлы и такие неметаллы, как углерод, фосфор, серу, и многие сложные вещества.
Возможные продукты восстановления этих кислот:H2SO4 SO2 S H2S
HNO3 NO2 NO N2O N2 NH3(NH4NO3)При взаимодействии с металлами получаются три вещества: соль, вода и продукт восстановления кислоты, который зависит от концентрации кислоты, активности металла и температуры.
Чем меньше концентрация кислоты. А металл более активен, тем больше степень восстановления кислоты. -
7 слайд
Представим возможные направления взаимодействия этих кислот с различными веществами в виде схем:
-
-
-
10 слайд
Cu + H2SO4 концентр. = CuSO4 + SO2 + 2H2O
Zn + 2H2SO4 концентр.= ZnSO4 +SO2 + 2H2O
3Zn + 4H2SO4 концентр. = 3ZnSO4 + S + 4H2O
4Zn + 5H2SO4 концентр. = 4ZnSO4 + H2S + 4H2OCu + 4HNO3 концентр. = Cu (NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 разбавл.. = 3Cu (NO3)2 + 2NO + 4H2O
Al + 4HNO3 разбавл. = Al (NO3)3 + NO + 2H2O
8Al + 30HNO3 разбавл. = 8Al (NO3)3 + 3N2O + 15H2O
10Al + 36HNO3 разбавл. = 10Al (NO3)3 + 3N2 + 18H2O
8Al + 30HNO3 разбавл. = 8Al (NO3)3 + 3NH4NO3 + 5H2O -
11 слайд
2Fe + 6H2SO4 концентр. = Fe2 (SO4)3 + 3SO2 + 3H2O
Fe + 6HNO3 концентр. = Fe (NO3)3 + 3NO2 + 3H2OКонцентрированные H2SO4 и HNO3 реагируют с Fe, Al, Cr только при нагревании:
-
12 слайд
C + 4HNO3 концентр. = CO2 + 2H2O + 4NO2
3C + 4HNO3 разбавл. = 3CO2 + 2H2O + 4NO
C + 2H2SO4 концентр. = CO2 + 2H2O + 2SO2
P + 5HNO3 концентр. = H3PO4 + 5NO2 + H2O
3P + 5HNO3 разбавл. + 2H2O = 3H3PO4 + 5NO
2P + 5H2SO4 концентр. = 2H3PO4 + 5SO2 + 2H2O
S +6HNO3 концентр. = H2SO4 + 6NO3 + 2H2O
S + 2HNO3 разбавл. = H2SO4 + 2NO
S +2H2SO4концентр. = 3SO2 +2H2OКонцентрированная H2SO4 и HNO3 в любом виде окисляют неметаллы — восстановители — углерод, фосфор, серу — до соответствующих кислот.
-
13 слайд
Концентрированная азотная кислота окисляет йод до йодноватой кислоты:
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
Взаимодействие этих кислот со сложными веществами рассмотрим в следующем разделе.
Особое значение имеет ОВР между соляной и азотной кислотами. Смесь трёх объёмов соляной кислоты и одного объёма концентрированной азотной называют «царская водка», в ней растворяется даже золото, которое алхимики считали царём металлов:
3HCl +HNO3 = Cl2 + NOCl + 2H2O -
14 слайд
В ряде случаев между веществами, которые проявляют сильные восстановительные и окислительные свойства, возможны только ОВР, а не реакции обмена.
Окислительно – восстановительные реакции, а не реакции обмена.
-
15 слайд
1. Окислители – соединения железа (III), восстановители – сульфиды, йодиды. При этом катион Fe3+ восстанавливается до катиона Fe2+, сульфид – анион S2-окисляется до серы S0, а йодид – анион I- окисляется до йода I2.
Рассмотрим следующие варианты:
-
16 слайд
2FeCl3 + H2S = S + 2FeCl2 + 2HCl
2FeCl3 + Na2S = S + 2FeCl2 + 2NaCl
или 2FeCl3 + 3Na2S = S + FeS + 6NaClВ зависимости от количественного соотношения реагирующих веществ могут получиться различные соединения железа (II):
-
17 слайд
Fe2(SO4)3 + H2S = S + 2FeSO4 +H2SO4
Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
2FeCl3 +2HI = 2FeCl2 + I2 + 2HCl
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
или 2FeCl3 + 6KI = 2FeI2 + I2 + 6KCl
Fe2(SO4)3 + 2KI = 2FeSO4 + I2 + K2SO4
Fe2(SO4)3 + BaI2 = 2FeSO4 + I2 + BaSO4 -
18 слайд
2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
2CuCl2 + 4HI = 2CuI + I2 + 4HCl2. Окислители – соединения меди (II), восстановители — йодиды. При этом катион Cu2+ восстанавливается до катиона Cu+, а йодид – анион окисляется до йода I2 :
-
19 слайд
3. Окислитель – азотная кислота, восстановитель – сульфиды, йодиды, сульфиты. При этом азотная кислота, в зависимости от концентрации, восстанавливается до NO2 (концентрированная), до NO (разбавленная); сульфид – анион S2- окисляется до серы S0 или сульфат – аниона SO42-, йодид – анион – до йода I2, a сульфит – анион SO32- — до сульфат – аниона SO42- :
-
20 слайд
8HNO3 концентр. + CuS = CuSO4 + 8NO2 + 4H2O
или 4HNO3 концентр.+ CuS = S + 2NO2 + Cu(NO3)2 + 2H2O
8HNO3 разбавл.+ 3CuS = 3S + 2NO + 3Cu(NO3)2 + 4H2O
4HNO3 концентр.+ Na2S = S + 2NO2 + 2NaNO3 + 2H2O
24HNO3 концентр.+ Al2S3 = Al2(SO4)3 + 24NO2 + 12H2O
2HNO3 разбавл.+ H2S = 3S + 2NO + 4H2O
8HNO3 концентр.+ H2S = H2SO4 + 8NO2 + 4H2O
или 2HNO3 концентр.+ H2S = S + 2NO2 + 2H2O
2HNO3 разбавл.+ 3K2SO3 = 3K2SO4 + 2NO + H2O
6HNO3 концентр.+ HI = HIO3 + 6NO2 + 3H2O
2HNO3 концентр.+ 2KI = I2 + 2NO2 + H2O -
21 слайд
4. Окислитель – азотная кислота или серная концентрированная кислота, восстановитель – соединения железа (II). При этом азотная кислота восстанавливается до NO2 или NO, серная – до SO2, а катион Fe2+ окисляется до катиона Fe3+ :
-
22 слайд
Fe(OH)2 + 4HNO3 концентр. = Fe(NO3)3 + NO2 + 3H2O
FeO + 4HNO3 концентр. = Fe(NO3)3 + NO2 + 2H2O
3Fe(NO3)2 + 4НNO3 разбавл. = 3Fe(NO3)2 + NO + 2H2O
2Fe(OH)2 + 4H2SO4 концентр. = Fe2(SO4)3 + SO2 + 6H2O -
23 слайд
5. Окислитель – серная кислота концентрированная, восстановитель – сульфиды, йодиды и бромиды. При этом серная кислота восстанавливается до SO2, S или
H2S; сульфид – анион S2- окисляется до серы S, SO2 или H2SO4; йодид – анион до йода I2, бромид – анион до брома Br2 :
-
24 слайд
CuS + 4H2SO4 концентр. = CuSO4 + 4SO2 + 4H2O
H2S + H2SO4 концентр. = S + SO2 + 2H2O
или H2S + H2SO4 концентр. = 4SO2 + 4H2O
8HI + H2SO4 концентр. = 4I2 + H2S + 4H2O
или 6HI + H2SO4 концентр.= 3I2 + S + 4H2O
2HI + H2SO4 концентр. = I2 + SO2 + 2H2O
8KI + 9H2SO4 концентр. = I2 + H2S + 8KHSO4 + 4H2O —
наиболее вероятный вариант продуктов,
или 6KI + 2H2SO4 концентр. = 3I2 + H2S + 3K2SO4 + 4H2O
2HBr + H2SO4 концентр. = Br2 + SO2 + 2H2O
2KBr + 2H2SO4 концентр. = Br2 + SO2 + K2SO4 + 2H2O
6KBr + 2H2SO4 концентр. = 3Br2 + S + 3K2SO4 + 2H2O -
25 слайд
. Железная окалина – Fe3O4, это смесь двух оксидов — FeO и Fe2O3. Поэтому при взаимодействии с сильными окислителями она окисляется до соединения железа (III) за счёт катионов Fe2+ — восстановителей, а при взаимодействии с сильными восстановителями восстанавливается до соединения железа (II) за счёт катионов Fe3+ — окислителей:
Fe3O4 + 10HNO3 концентр. = 3Fe(NO3)3 + NO2 + 5H2O
3Fе3O4 + 28HNO3 разбавл. = 9Fe(NO3)3 + NO + 14H2O
Fe3O4 + 8HI = 3FeI2 + I2 + 4H2OПри взаимодействии с большинством кислот происходит реакция обмена, получаются две соли:
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
Fe3O4 + 4H2SO4 разбавл. = FeSO4 + Fe2(SO4)3 + 4H2O -
26 слайд
Реакции диспропорционирования.
Это реакции, в которых атомы одного и того же элемента, входящие в состав одного и того же исходного вещества, повышают и понижают степень окисления. Они очень часто встречаются в заданиях С-2, поэтому их нужно запомнить тем, кто хочет сдать ЕГЭ на высокий балл.
Все галогены, кроме F2, диспропорционируют в растворах всех щелочей. При комнатной температуре или на холоде получаются две соли – МГ, МГО и Н2О; при нагревании – две соли: МГ, МГО3 и Н2О.Cl2 +2KOH = KCl + KClO + H2O – на холоде,
3Cl2 + 6KOH = 5KCl +KClO3 + 3H2O – при нагревании,
2Br2 + 2Sr(OH)2 = SrBr2 + Sr(BrO)2 + H2O – на холоде,
6Br2 + 6Sr(OH)2 = 5SrBr2 + Sr(BrO3)2 + 6H2O – при нагреванииАналогично происходят реакции с растворами карбонатов:
Cl2 + K2CO3 = KCl + KClO + CO2 – на холоде,
3Cl2 + 3K2CO3 = 5KCl + KClO3 + 3CO2 – при нагревании. -
27 слайд
2. Диспропорционирование серы в растворах щелочей:
3S + 6KOH = 2K2S + K2SO3 + 3H2O или 4S + 6KOH = K2S2O3 + 2K2S +3H2O
3. Диспропорционирование фосфора в растворах щелочей.
4P + 3KOH + 3H2O = PH3 + 3KH2PO2
8P + 3Ba(OH)2 + 6H2O = 2PH3 + 3Ba(H2PO2)2
P4 (белый фосфор) + 3KOH + 3H2O = PH3 + 3KH2PO24. Диспропорционирование оксида азота (IV) в воде и щелочах:
2NO2 + H2O = HNO2 + HNO3
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O5. Другие реакции диспропорционирования:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH
4NaClO3 = 3NaClO4 + NaCl
4K2SO3 = 3K2SO4 + K2S
ClO2 + H2O = HCl + HClO3
Краткое описание документа:
В презентации собран теоретический материал по окислительно-восстановительным реакциям,рассмотрены основные окислители и восстановители,их поведение в разных средах.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 154 748 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы
- 08.02.2023
- 44
- 1


- 08.02.2023
- 38
- 1

- 08.02.2023
- 139
- 8

- 07.02.2023
- 50
- 0
- 07.02.2023
- 213
- 25
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Специфика преподавания конституционного права с учетом реализации ФГОС»
-
Курс повышения квалификации «История и философия науки в условиях реализации ФГОС ВО»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Организация маркетинга в туризме»
-
Курс повышения квалификации «Психодинамический подход в консультировании»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Курс профессиональной переподготовки «Организация маркетинговой деятельности»
-
Курс профессиональной переподготовки «Технический контроль и техническая подготовка сварочного процесса»



































