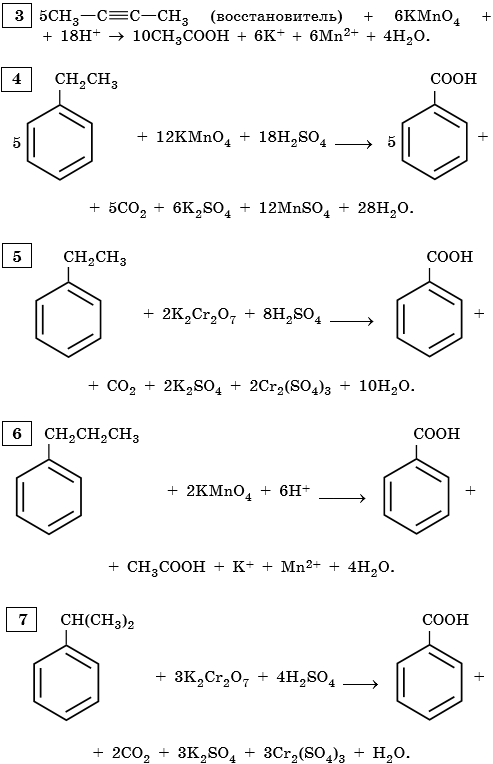
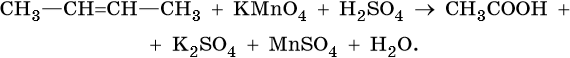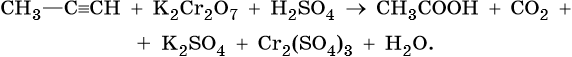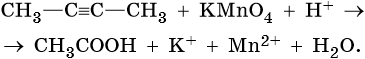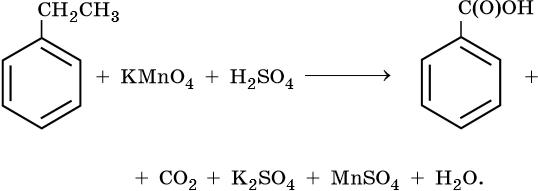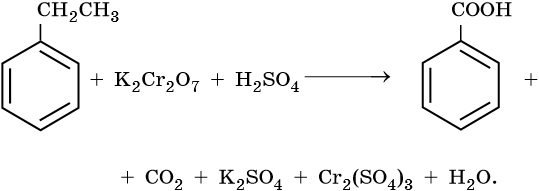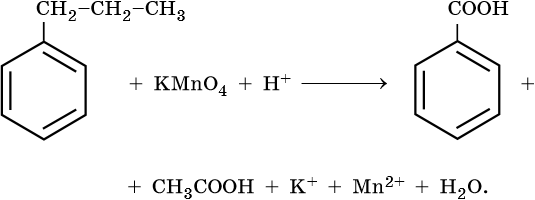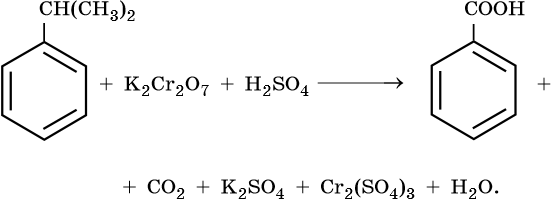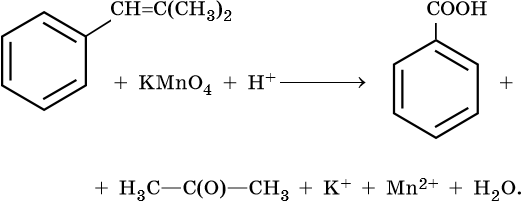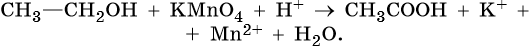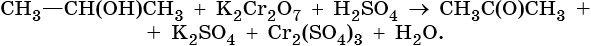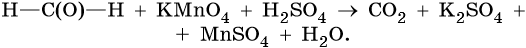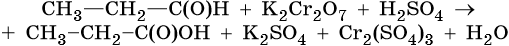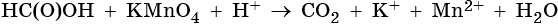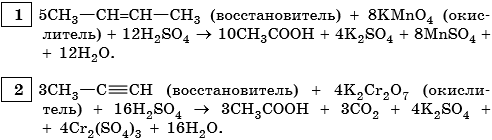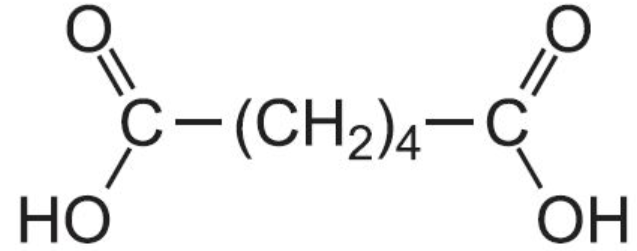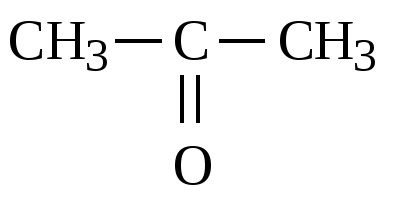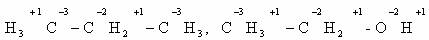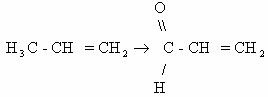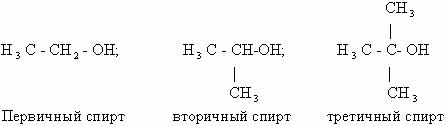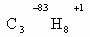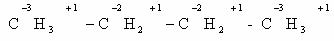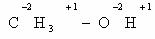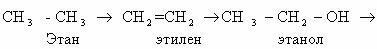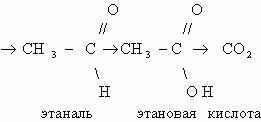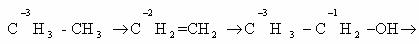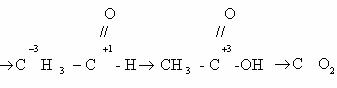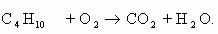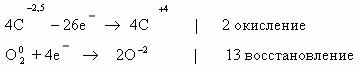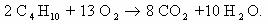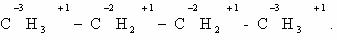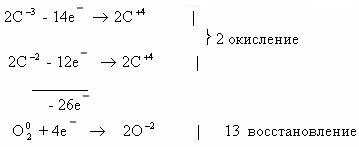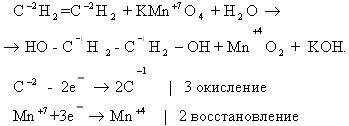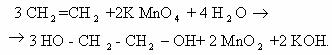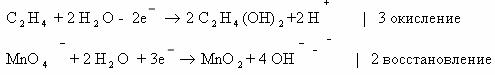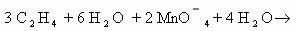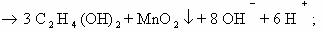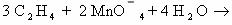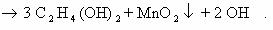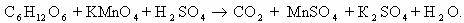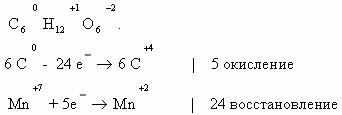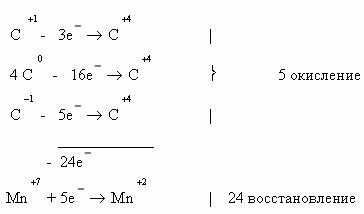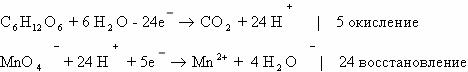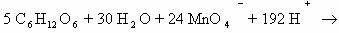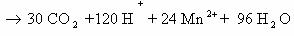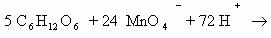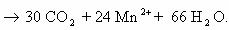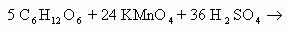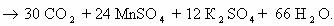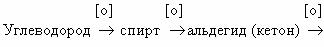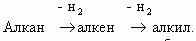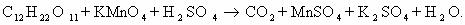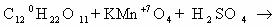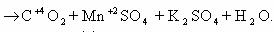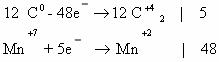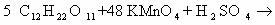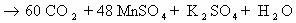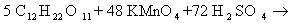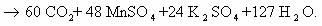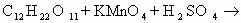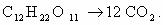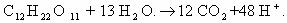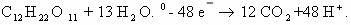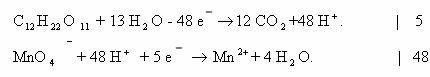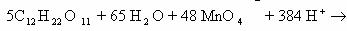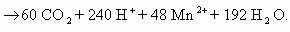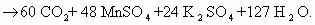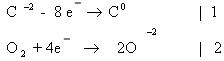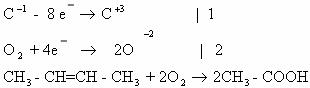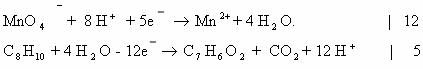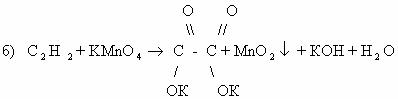II. ОВР в органической химии.
Степени окисления атомов в органических соединениях.
|
Углеводороды |
Спирты |
Альдегиды, кетоны |
Карбоновые кислоты |
|
-2 +1 -2 +1 CH2=CH2 |
-2 +1 -2 +1 CH3-OH |
0 ⸗O-2 0 -2 H-C-H (HCHO) |
+2 -2-2 HCOOH |
|
-2 -1 -3 CH2=CH-CH3 |
-3 -1 -2 CH3-CH2-OH |
-3 +1 ⸗O-2 CH3-C- H -3 +1 -2 (CH3CHO) |
-3 +3-2- 2 CH3COOH |
|
-3 -1 -1 -3 CH3-CH=CH-CH3 |
-1 -1 CH2-CH2 І І OH OH |
-3 +2 -3 CH3-C- CH3 ǁ O-2 |
+3 -2 -2 C OOH І+3-2-2 C OOH |
|
-3 0 -1 -3 CH3-C=CH-CH3 І -3 CH3 |
-1 0 -3 CH2-CH-CH3 І І OH OH |
||
|
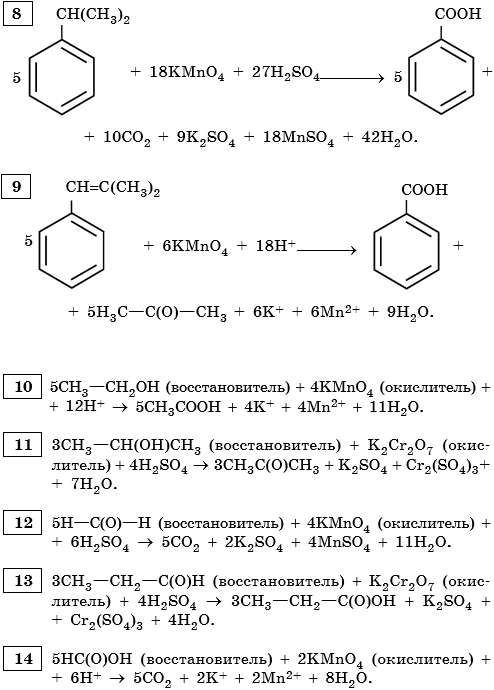
-3 0 0 -3 CH3-CH2-CH-CH3 І І OH OH |
Углеводороды.
В кислой среде:
1) CH2=CH2 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + H2O + CO2
-2 -2 +7 +2 +4
5CH2=CH2 + 12KMnO4 + 18H2SO4 → 6K2SO4 + 12MnSO4 + 10CO2 + 28H2O
2C-2 – 12e— → 2C+4 | 12 | 5 – окисляется, восстановитель;
Mn+7 + 5e— → Mn+2 | 5 |12 — восстанавливается, окислитель
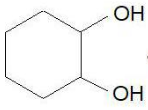
2) C2H2 – окисляется окислителями в кислой среде до щавелевой кислоты.
-1 -1 k. H2SO4, KMnO4 (K2Cr2O7) COOH
CHΞCH ―――――――→ І (HOOC-COOH)
COOH
-2 -1 -3 +7 +4 -3 +3
3)CH2=CH-CH3 + 2KMnO4 + 3H2SO4 → CO2 + CH3-COOH + K2SO4 +
+2
2MnSO4 + 4H2O
Mn+7 + 5e— → Mn+2 | 5e— | 2 — восст-тся, окислитель;
C-1 — 4e— → C+3 |} 10e—| 1 — окисляется, восстановитель
-3 -1 -1 -3 +7 -3 +3
4) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3-COOH + 4K2SO4 +
+2
8MnSO4 + 12H2O
Mn+7 + 5e— → Mn+2 |4| | 8Mn+7 +40e— →8Mn+2 — восстанавливается, окислитель;
| |× 2 |
C-1 — 4e— → C+3 |5| | 10C-1 — 40e— → 10C+3 — окисляется, восстановитель
-3 0 -1 -3 -3 +3 -2 -2 -3 +2 -3
5) CH3-C‡ CH-CH3 + 6KMnO4 + 9H2SO4 → 5CH3-COOH + 5CH3-C-CH3
+ 3K2SO4 + 6MnSO4 +9H2O
| ǁ
-3 O-2
CH3
Mn+7 + 5e— → Mn+2 |× 6| 6Mn+7+30e—→ 6Mn+2
C-1 — 4e— → C+3 | | 5C-1— 20e— → 5C+3
C0 — 2e— → C+2 | | 5C0 10e— → 5C+2
↙͞ ͞͞͞ ͞ ͞͞ ͞ ͞ ͞ ͞ ͞ ͞͞ ͞ ͞↘
-1 -1 +7 C+3OOH +2
6) 5CHΞCH + 8KMnO4 + 12H2SO4 → 5 І +4K2SO4 +8MnSO4+ 12H2O C+3OOH
только ацетилен!
2C-1 — 8e— → 2C+3 |× 5
Mn+7 + 5e— → Mn+2 |× 8
Гомологи ацетилена окисляются до одноосновных карбоновых кислот.
-1 0 -3 +7 -3 +3 +4 +2
7)5CHΞC-CH3 +8KMnO4 +12H2SO4 → 5CH3-COOH +5CO2 +4K2SO4+ 8MnSO4 + 12H2O
—3 0 0 -3 +7 -3 +3 +2

Ароматические углеводороды.
-1 -3 +7 -1 +3 +2
9) 5C6H5 -CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Mn+7 + 5e— → Mn+2 |× 6
C-3 — 6e— → C+3 |× 5
—1 -2 -3 +7 -1 +3 +4 +2
10) 5C6H5 -CH2CH3 + 12KMnO4 + 18H2SO4 → 5C6H5-COOH + 5CO2 + 6K2SO4 + 12MnSO4 + 28H2O
Mn+7 + 5e— → Mn+2 | 5e—|× 12
C-2 — 6e— → C+4 | |
|}12e—|× 5
C-3 — 6e— → C+3 | |
-1 -3 +7 -1 +3 +2
11) 5 C6H4(CH3)2 + 12KMnO4 + 18H2SO4 → 5 C6H4(COOH)2 + 6K2SO4 + 12MnSO4 + 28H2O
1,2-диметилбензол орто-фталевая кислота
2C-3 — 12e— → 2C+3 |12e—|× 5
Mn+7 + 5e— → Mn+2 | 5e— |× 12
-1 -1 -2 +7 -1 +3 +4 +2
12) C6H5—CH=CH2 + 2KMnO4 + 3H2SO4 → C6H5COOH + CO2 + K2SO4 + 2MnSO4 + 4H2O
Mn+7 + 5e— → Mn+2 | 5e—|× 2
C-1 — 4e— → C+3 | |
|} 10e—|× 1
C-2 — 6e— → C+4 | |
В нейтральной среде:
-2 -2 +7 -1 -1 +4
1) 3CH2=CH2 + 2KMnO4 + 4H2O → CH2-CH2 + 2MnO2 + 2KOH 2C-2 — 2e— → 2C-1 |× 3
І І Mn+7 + 3e— → Mn+4 |× 1
OH OH
2) 3CH3–CH=CH– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– CH3 + 2MnO2 + 2KOH
І І
OH OH
3) C6H5—CH=CH2 + 2KMnO4 + 4H2O → C6H5—CH– CH2 + 2MnO2 + 2KOH
І І
OH OH
00C
4) 3CH3–CH=CH2 + 2KMnO4 + 4H2O —→ 3CH3–CH–CH + 2MnO2 + 2KOH
І І
OH OH
C+3OOK
5) 3CHΞCH + 8KMnO4 → 5 І + 8MnO2 + 2KOH + 2H2O
C+3OOK
только ацетилен!
6) 3CH3–CH=CH–СH2– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– СH2– CH3 + 2MnO2 + 2KOH
І І
OH OH
7) CH3–CH=C– CH3 + 2KMnO4 → CH3-C- CH3 + CH3-COOH + 2MnO2 + 2KOH
І ǁ
CH3 O
Реакция присоединения против правила Марковникова:
+ — H2O2
CH3—CH=CH2 + HBr ——→ CH3—CH2—CH2 — 1-бромпропан
|
Br
При наличии атома хлора в молекуле реакция также идёт против правила, т.к. меняется поляризация молекулы:
— + + —
CH2—CH=CH2 + HBr ——→ CH2—CH2—CH2 — 1-бром-3-хлорпропан
| | |
Cl Cl Br
Спирты.
-3 -1 -2 +7 -3 +3 +2
1) CH3-CH2-OH + 4KMnO4 + 6H2SO4 → 5CH3-COOH + 2K2SO4 + 4MnSO4 + 11H2O
-3 -1 -2 +6 -3 +3 +3
2) CH3-CH2-OH + 2K2Cr2O7 + 8H2SO4 → 3CH3-COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
+6 -2 +2 +3
3) 2K2Cr2O7 + 3CH3OH + 8H2SO4 → HCOOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
-3 +1 -2 -3 +7 -3 +2 -2 -3 +4
4) 5CH3-CH-CH2-CH3 + 2KMnO4 → 5CH3-C-CH2-CH3 + 2MnO2 + 2KOH + 4H2O
І ǁ
OH O
-1 -1 -2 +7 -1 +3 +2
5) 5C6H5 -CH2OH + 4KMnO4 + 6H2SO4 → 5C6H5-COOH + 2K2SO4 + 4MnSO4 + 11H2O
-2 +7 +4 +2
6) 5CH3-OH + 6KMnO4 + 9H2SO4 → 5CO2 + 3K2SO4 + 6MnSO4 + 19H2O
-3 -1 -2 +7 +4 -3 +3
7) 3CH3-CH2-OH + 4KMnO4 → 4MnO2 + KOH + 4H2O + 3CH3-COOK
Альдегиды.
0 +7 +4 +2
1) 5HCHO + 4KMnO4 + 6H2SO4 → 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O
-3 +1 +6 -3 +3 +3
2) 3CH3CHO + K2Cr2O7 + 4H2SO4 → 3CH3-COOH + Cr2(SO4)3 + K2SO4 + 4H2O
-3 +1 +7 -3 +3 +2
3) 5CH3CHO + 2KMnO4 + 3H2SO4 → 5CH3-COOH + K2SO4 + 2MnSO4 + 3H2O
-3 +1 +7 -3 +3 +4
4) 3CH3CHO + 2KMnO4 + KOH → 3CH3-COOK + 2MnO2 + 2H2O
OH
|
5) HC-(CH2)7 -CH3 HC-(CH2)7 -CH3
3 ǁ + 2KMnO4 + 4H2O → 3 | + 2KOH + 2MnO2
HC-(CH2)7 –COOH HC-(CH2)7 -COOH
стеариновая кислота |
OH
9,10 — диоксистеариновая кислота
Другие реакции органических соединений.
Углеводороды.
t0, кат.
1) 2C4H10 + 5 O2 ——→ 4CH3-COOH + 2H2O
2) 3CH3–CH=CH– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– CH3 + 2MnO2 + 2KOH
І І
OH OH
Pd+2
3) 2CH2=CH2 + O2 —→ 2CH3CHO
Ароматические углеводороды.
1) 5С6H4ClC2H5 +12KMnO4 +18H2SO4 → 5C6H4СlCOOH+ 5CO2 +6K2SO4 +12MnSO4+ 28H2O
(орто-,пара- изомеры) (орто-, пара- изомеры)
t0
2) 5 O2N-С6H4-CH3 + 6KMnO4 + 9H2SO4 → 5 O2N-С6H4-COOH + 3K2SO4 + 6MnSO4 + 14H2O
(пара- изомер) (пара- изомер)
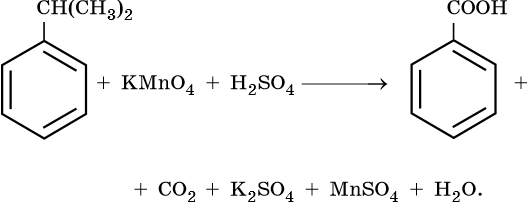
3) 5С6H5CH(CH3)2 +18KMnO4 + 27H2SO4 →5C6H5COOH +10CO2+9K2SO4 +18MnSO4+48H2O
KMnO4
4) CHΞC-С6H4-CH3 ——→ С6H4-(COOH)2
(орто — изомер) орто – фталевая кислота
5) 3С6H5-CH2 -CH=CH2 + 2KMnO4 + 4H2O → 3С6H5-CH2 –CH–CH2 + 2KOH + 2H2O
| |
OH OH
6) 5C6H5—CH2 — CH=CH2 + 16KMnO4 + 24H2SO4 → 5C6H5COOH + 10CO2 + 8K2SO4 + 16MnSO4 + 34H2O
+ —
7) O2N-С6H4-COOH + 3Fe + 7HCl → С6H4(COOH)NH3Cl + 3FeCl3 + 2H2O
Получение.
1) Al4C3 + 12H2O → 4Al(OH)4 + 3CH4
2) Al4C3 + 12HCl → 4AlCl3 + 3CH4
3) CaC2 + 2H2O → Ca(OH)2 + C2H2
Спирты.
1) 3CH2–CH=CH–CH2 + 2KMnO4 + 4H2O → 3CH2–CH–CH–CH2 + 2KOH + 2MnO2
| | | | | |
OH OH OH OH OH OH
2) 3CH3-CH2-OH + K2Cr2O7 + 4H2SO4 → 3CH3-CHO + 2Cr2(SO4)3 + K2SO4 + 7H2O
ацеталь
Альдегиды.
1) CH3CHO + 2NaMnO4 + 3NaOH → CH3-COONa + 2Na2MnO4 + 2H2O
Карбоновые кислоты.
+6 +3 +4 +3
1)K2Cr2O7 +3HOOC-COOH +4H2SO4 → 6CO2 + Cr2(SO4)3 + K2SO4 +7H2O
Соли карбоновых кислот.
электролиз
1) 2CH3-COONa ———→ H2 + C2H6 + 2NaOH + 2CO2
Скачать материал

Скачать материал


- Сейчас обучается 30 человек из 23 регионов


- Сейчас обучается 113 человек из 49 регионов


- Курс добавлен 13.12.2022


Описание презентации по отдельным слайдам:
-
1 слайд
Организация подготовки к ЕГЭ по химии задание №33: окислительно-восстановительные реакции
с участием органических веществ
Минакова А.П., учитель химии
МБОУ «Гимназия №44» г. Курска -
2 слайд
В цепочках превращений органических веществ в подавляющем большинстве заданий встречаются ОВР. Эксперт имеет право начислить балл только в том случае, если записано уравнение, а не схема реакции, т.е. верно расставлены коэффициенты. В реакциях с участием неорганических окислителей (перманганат калия, соединения хрома (VI), пероксид водорода и др.) сделать это бывает непросто, без электронного баланса.
-
3 слайд
.
Изменение степени окисления атомов углерода в молекулах органических соединений -
4 слайд
Степени окисления атома углерода
-
5 слайд
КMnO4
K2Cr2O7
Основные окислители
MnSO4
MnO2
K2MnO4
Cr2(SO4)3
Cr(OH)3
K3[Cr(OH)6]
O3 и H2O2
Сине-зеленый -
-
7 слайд
Алканы
При обычных условиях алканы устойчивы к действию таких окислителей, как растворы KMnO4, K2Cr2O7.
В результате контролируемого каталитического окисления алканов кислородом в определенных условиях, т.е. при различных температурах и давлении, можно получить спирты, альдегиды, кетоны и карбоновые кислоты, например:Обратите внимание на то, что реакция каталитического окисления бутана используется в промышленности для получения уксусной кислоты
-
8 слайд
Алкены
При мягком окислении алкены превращаются в гликоли (двухатомные спирты), среда нейтральная или слабощелочная. Реакция Вагнера.
3CH2=CH2 + 2 KMnO4 + 4 H2O ——> 3 CH2OH-CH2OH + 2 KOH + 2MnO2
Слабощелочная среда (в общем виде):
R-CH=CH-R+ 2KMnO4+2KOH→R-CH(OH)-CH(OH)-R+2K2MnO4
WO3
Окисление алкенов концентрированным раствором перманганата калия KMnO4 или бихромата калия K2Cr2O7 в кислой среде сопровождается разрывом не только π-, но σ-связи. В зависимости от строения алкена в результате этой реакции образуются карбоновые кислоты, CO2 и кетоны. -
9 слайд
По продуктам окисления алкена можно определить положение двойной связи в его молекуле:
-
10 слайд
Алкены разветвленного строения, содержащие углеводородный радикал у атома углерода, соединенного двойной связью, при окислении образуют смесь карбоновой кислоты и кетона:
Алкены разветвленного строения, содержащие углеводородные радикалы у обоих атомов углерода, соединенных двойной связью, при окислении образуют смесь кетонов:
-
11 слайд
Алкены
CH3-CH=CH-CH3+O3+H2O= +H2O2CH3-CH=CH-CH3+O3+H2O= 2 +H2O2
CH3-CH(CH3)=CH-CH3+O3+H2O= +CH3-COH+H2O2 -
12 слайд
Пример:
3CH3 — CH = CH — CH = CH2+4KMnO4+8 H2O= 4KOH+4MnO2+3CH3 — CH — CH — CH — CH2
│ │ │ │
OH OH OH OH
пентадиен — 1,4 пентантетраол — 1,2,3,4Алкадиены
С5H8+4KMnO4+6H2SO4=2CO2+C3H4O4+2K2SO4+4MnSO4+8H2O
Малоновая кислота
Уравнение окисления бутадиена-1,3 избытком раствора перманганата калия в кислой среде: 5CH2=CH-CH=CH2 + 22KMnO4 + 33H2SO4 =20CO2+ 11K2SO4 + 22MnSO4 + 48H2OCH2=C=CH2 +KMnO4=CH2OH-CO-CH2OH +K2MnO4+H2O
1,3-дигидроксиацетон -
13 слайд
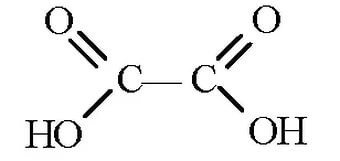
Под действием сильных окислителей образуют двухосновные карбоновые кислоты с тем же числом атомов углерода.
В зависимости от условий каталитическим окислением воздухом
циклогексана получают циклогексанол, циклогексанон или
адипиновую кислоту
При действии сильных окислителей (KMnO4, K2Cr2O7 и др.)
циклоалканы образуют двухосновные карбоновые кислоты с тем
же числом атомов углерода:
Циклоалканы -
14 слайд
+2 KMnO4+3H2SO4=HOOC-(CH2)2-COOH+2MnSO4+K2SO4+2H2O
Янтарная к-та
+2 KMnO4+3H2SO4=HOOC-(CH2)3-COOH+2MnSO4+K2SO4+4H2O
глутаровая к-та
+2 KMnO4+3H2SO4=HOOC-(CH2)4-COOH+2MnSO4+K2SO4+4H2O
Циклогексан окисляется до адипиновой кислоты, используемой в производстве полиамидных волокон – капрона и нейлона
+O2→
+H2O
kat -
15 слайд
5 + 8KMnO 4 + 12H 2 SO 4 = 5HOOC(CH 2 ) 3 COOH + 4K 2 SO 4 + 8MnSO 4+
+ 12H 2 OГлутаровая к-та
CH 3
+ 2KMnO 4 + 4H 2 O=
3
CH 3
OH
OH
3
+ 2MnO 2 + 2KOH -
16 слайд
Ацетилен окисляется водным раствором KMnO4 до оксалата калия K2C2O4:
АЛКИНЫ
В мягких условиях алкины с неконцевой тройной связью окисляются до
α-кетонов:
В жестких условиях алкины с неконцевой тройной связью окисляются до карбоновых кислот:
Алкины, содержащие тройную связь у крайнего атома углерода,
окисляются в жестких условиях с образованием карбоновой кислоты и
СО2: -
17 слайд
+H2O2=
Можно окислить озоном с образованием диальдегида:
Бензол
Устойчив к окислителям при комнатной температуре
Не реагирует с водными растворами KMnO4, K2Cr2O7 и других окислителей
2 -
18 слайд
Более сильные окислители – KMnO4 в кислой среде или хромовая смесь при нагревании окисляют метильную группу до карбоксильной:
В нейтральной или слабощелочной среде образуется не сама бензойная кислота, а ее соль — бензоат калия:
Окисляются относительно легко
Окислению подвергается боковая цепь
Мягкие окислители (MnO2) окисляют метильную группу
до альдегидной группы:
бензальдегид
Гомологи бензола
С6Н5СН3 + MnO2 →C6H5− CОН -
19 слайд
Под действием сильных окислителей (KMnO4 в кислой среде или
хромовой смеси) окисление идет по α-углеродному атому с образованием бензойной кислоты
Гомологи бензола
Окисление гомологов бензола с одной боковой цепью под действием
KMnO4 в кислой среде или хромовой смеси приводит к образованию
бензойной кислоты -
20 слайд
Реакция анилина с хромовой смесью. Получается чёрный анилин.
3 C6H5NH2 + 2 K2Cr2O7 + 11 H2SO4 → 3 C6H4O2 + 2 K2SO4 + 2 Cr2(SO4)3+ 3 NH4HSO4+
8 H2O
Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты: -
21 слайд
В нейтральной или слабощелочной среде при окислении перманганатом калия KMnO4 образуются соль карбоновой кислоты и карбонат калия:
-
22 слайд
Окисление первичных спиртов
до альдегидов до карбоновых кислотМетанол окисляется до СО2:
-
23 слайд
Окисление предельных одноатомных спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. -
24 слайд
Для окисления вторичных спиртов наиболее часто используют бихромат калия в кислой среде при комнатной температуре или небольшом нагревании. Применяют также KMnO4 и MnO2.
Для окисления первичных спиртов до альдегидов обычно используют реактив Джонсона или комплекс CrO3 c пиридином. Перманганат калия не применяют для окисления спиртов в альдегиды, т.к. реакция не останавливается на стадии образования альдегида, и окисление идет дальше до кислоты. Однако широкое применение нашел MnO2. Этот реагент не затрагивает кратные связи, поэтому может быть использован для получения и непредельных альдегидов и кетонов:Третичные спирты устойчивы к действию окислителей: они не окисляются ни в нейтральной, ни в щелочной среде. Но если в третичном спирте у атома углерода, соседнего с С-ОН-группой, есть атом водорода, то такие спирты окисляются в кислой среде, с отщеплением воды, образованием в качестве промежуточного продукта алкена и разрывом С-С -связи:
-
25 слайд
Например, окисление этанола дихроматом калия на холоде заканчивается получением уксусной кислоты, а при нагревании – ацетальдегида:
3CH3–CH2OH + 2K2Cr2O7 + 8H2SO4 = 3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O,
3CH3–CH2OH + K2Cr2O7 + 4H2SO4 = 3CH3–CHO + K2SO4 + Cr2(SO4)3 + 7H2O.
ṯ
Окисление хромовой смесью вторичного спирта -
26 слайд
5CH3-CH2-OH+4KMnO4+6H2SO4=5CH3COOH+2K2SO4+4MnSO4+11H2O
CH3-CH2-OH+4KMnO4+5KOH= CH3COOK+4K2MnO4+4H2O
3CH3-CH2-OH+4KMnO4=3 CH3COOK+4MnO2+KOH+4H2O
Окислителем одноатомных спиртов может быть перекись водорода
CH3-CH2-OH+2H2O2= CH3–COOH+3H2OОкисление предельных одноатомных спиртов
+ 4K2Cr2O7 + 16H2SO4 = 3HOOC-(CH2)4-COOH + 4Cr2(SO4)3 + 4K2SO4 +19H2OОкисление циклогексанола до адипиновой кислоты
-
27 слайд
Вторичные спирты окисляются до кетонов:
Третичные спирты устойчивы к окислению!
Окисление трет-бутанола в «жёстких» условиях: -
28 слайд
Окисление гликолей
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.5СН2(ОН) – СН2(ОН) + 8КMnO4+12H2SO4→5HOOC – COOH +8MnSO4 +4К2SO4 + +22Н2О
3СН2(ОН) – СН2(ОН) + 8КMnO4→3KOOC – COOK +8MnO2 +2КОН +8Н2О
Глицерин, такими сильными окислителями как КMnO4 и K2Cr2O7, может окисляться до CO2 и H2O:
14 КMnO4+ 3C3H5(OH)3→7K2CO3+14MnO2+12H2O+2CO2
3C3H5(OH)3+7 K2Cr2O7-+28H2SO4→9 CO2+40 H2O+7K2SO4+7Cr2(SO4)3
-
29 слайд
6КMnO4+9H2SO4→
5
5H
H
+6MnSO4 +3К2SO4 + 24Н2О
Окисление многоатомных спиртов происходит ступенчато, при этом первичные спиртовые группы превращаются в альдегидные, а вторичные – в кетонные. Первичные спиртовые группы могут окисляться до карбоксильных
2КMnO4+3H2SO4→
+2MnSO4 +К2SO4 + 6Н2О -
30 слайд
КMnO4
H2SO4
+ CO2 ↑+ -
31 слайд
+H2O2→
+H2O
Окисление фенола
пирокатехин
3
+2K2Cr2O7-+8H2SO4→3
+ 2K2SO4 + 2Cr2(SO4)3 + 11H2O
бензохинон -
32 слайд
C6H5-CH(OH)-CH3+H2O2→C6H5-CO-CH3+2H2O
C6H5CH(OH)CH3 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + C6H5COOH +СО2 +5H2O
3C6H5CH(OH)CH3 + K2Cr2O7 + 4H2SO4 = 3C6H5COCH3 + Cr2(SO4)3 + K2SO4 + 7H2O
Окисление ароматических спиртов -
33 слайд
Альдегиды легко окисляются до карбоновых кислот
Ароматические альдегиды
легко окисляются даже кислородом воздуха
Метаналь окисляется до CО2
Окисление альдегидов и кетонов -
34 слайд
Качественные реакции на альдегиды
Окисление гидроксидом меди(II)
Реакция «серебряного зеркала»
Соль, а не кислота! -
35 слайд
Кетоны окисляются с трудом, слабые окислители на них не действуют
Под действием сильных окислителей происходит разрыв С—С связей по обе стороны карбонильной группы с образованием кислот
Кетоны несимметричного строения преимущественно окисляются со стороны менее гидрированного
атома углерода при карбонильной
группе (правило Попова – Вагнера):Окисление циклических кетонов
-
36 слайд
Окисление альдегидов
5CH3–CH=O + 2KMnO4 + 3H2SO4 = 5CH3–COOH + 2MnSO4 + K2SO4 + 3H2O,
3CH3CH=O + 2KMnO4 = CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CH=O + KMnO4+2KOH= CH3COOK+ K2MnO4+ H2O
5H–CH=O + 4KMnO4 + 6H2SO4 = 5CO2+ 4MnSO4 + 2K2SO4 + 11H2O
3H–CH=O + 4KMnO4 + 2KOH= 3K2CO3 +4MnO2 + 4H2O
3CH3–CH=O + K2Cr2O7 + 4H2SO4 = 3CH3–COOH + Cr2(SO4)3 + K2SO4 + 4H2O,
CH3–CH=O + 2[Ag(NH3)2]OH = CH3–COONH4 + 2Ag + 3NH3 + H2O
HCOH+ 2[Ag(NH3)2]OH =(NH4)2CO3+ 2Ag+ 2NH3 + H2OCH3–CH=O + 2Cu(OH)2 = CH3COOH + Cu2O + 2H2O
CH3CH=O + Br2 + 3NaOH → CH3COONa + 2NaBr + 2H2O
-
37 слайд
Окисление карбоновых кислот
Непредельные карбоновые кислотыокисляются водным раствором KMnO4 в слабощелочной среде с образованием дигидрооксикислот и их солей:
В кислой среде происходит разрыв углеродного скелета по месту двойной связи С=С с образованием смеси кислот:
Среди одноосновных карбоновых кислот легко окисляется только
муравьиная кислота
НСООН+2Ag[(NH3)2]ОН → (NH4)2CO3 + H2O+2Ag+ 2NH3 -
38 слайд
Особые свойства щавелевой кислоты
Легко окисляется под действием KMnO4 в кислой среде при нагревании до CО2 (метод перманганатометрии):
При нагревании подвергается декарбоксилированию
Под действием концентрированной H2SO4 при нагревании
щавелевая кислота и ее соли (оксалаты) разлагаются до СО и СО2 -
39 слайд
Окисление карбоновых кислот
Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
5НСООН + 2KMnO4 + 3H2SO4= 5CO2+ 2MnSO4 + K2SO4 + 8H2O
3НСООН + 2KMnO4 + 4KOH= 3K2CO3 +2MnO2 + 5H2O
5НOOC-СООН + 2KMnO4 + 3H2SO4= 10CO2+ 2MnSO4 + K2SO4 + 8H2O
НСООН + HgCl2 = CO2 + Hg + 2HClHCOOH+ Cl2 = CO2 +2HCl
HOOC-COOH+ Cl2 =2CO2 +2HCl
НСООН + 2[Ag(NH3)2]OH → NH4HCО3 +3NH3↑+ Н2O +2Ag↓
НСООН + 2Cu(OH)2 → CO2 + Cu2O↓ + 3H2O
-
40 слайд
Окисление глюкозы до глюконовой кислоты реактивом Толленса
гидроксидом меди Cu(OH)2 в щелочной среде
бромной водой
Окисление моносахаридов -
41 слайд
Окисление глюкозы до глюкаровой (сахарной) кислоты
разбавленной азотной кислотой HNO3
Окисление глюкозы до муравьиной кислоты
под действием иодной кислоты HIO4 (периодатное окисление)
Окисление моносахаридов -
42 слайд
Реакции, вызывающие трудности
C6H5-NH2+HCl=[C6H5-NH3]Cl
C6H5-NH2+CH3Br=[C6H5-NH2CH3]Cl
C6H5-NH2+CH3-COCl=C6H5-NH-CO-CH3+HCl
C6H5-NH2+C2H5-COOH=C6H5-NH-CO-C2H5+H2O
C6H5-NH2+HNO2=C6H5-OH+N2+H2O
C6H5-NH2+3Br2=C6H2Br3NH2+HBr
C6H5-NH2+NaNO2+2HCl=C6H5-NNCl+2H2O+NaCl
Гидролизуется при t до N2 фенола и HCl -
43 слайд
Реакции, вызывающие трудности
R-NO2+9Fe+4H2O→4R-NH2+3Fe3O4
R-NO2+3Zn+7HCl→R-NH3Cl+3ZnCl2+2H2O
R-NO2+3Fe+7HCl→R-NH3Cl+3FeCl2+2H2O
R-NO2+2Al+2NaOH+4H2O→R-NH2+2Na[Al(OH)4]CH3CH2OH + PCl5 = C2H5Cl + POCl3+HCl
CH3CH2OH + PCl3 = 3C2H5Cl + H3РO3 -
44 слайд
Реакции, вызывающие трудности
-
45 слайд
В составлении презентации были использованы материалы:
1. О.В. Архангельская, И.А. Тюльков. Задачи по теме «Уравнения окислительно-восстановительных реакций»
2. Л.И. Асановой, материалы вебинара по теме: «Организация подготовки к ЕГЭ по химии: окислительно-восстановительные реакции с участием органических веществ»
3. Л.И. Асанова, Е.Н. Стрельникова Окислительно-восстановительные реакции. Практикум по химии, Москва «ВАКО», 2018 г
4. И.И. Новошинский, Н.С. Новошинская Готовимся к ЕГЭ. Органическая химия. Пособие для учащихся, «Русское слово», 2013 г
5. О.Э. Сикорская Классы органических соединений. Пособие для подготовки к экзамену, «Веста», Владикавказ 2015 г
6. О.Э. Сикорская ХИМИЯ ОВР с участием органических соединений. Учебное пособие для подготовки к ЕГЭ, «Веста», Владикавказ 2014 г
7. Н.Е. Дерябина органическая химия. Книга 1. Углеводороды и их монофункциональные производные. Учебник-тетрадь. М.: ИПО «У Никитских ворот», 2012 г
8. ФИПИ школе. ЕГЭ Химия. Типовые экзаменационные варианты под редакцией А.А. Кавериной 2014-2018 гг
9. В.Н. Доронькин и др. ЕГЭ – 2018 Химия. Новые задания высокого уровня сложности, ЛЕГИОН, Ростов – на – Дону 2017 г
10. Сайт https://ege.sdamgia.ru/ и др
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 154 748 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы


«Биотопливо- взгляд в будущее»
- Учебник: «Химия (углублённый уровень)», Еремин В.В., Кузьменко Н.Е., Дроздов А.А. и др./ Под ред. Лунина В.В.
- Тема: § 65. Особенности современной нау
- 12.03.2018
- 1013
- 5

Амин 11 класс Химия
- Учебник: «Химия (углублённый уровень)», Еремин В.В., Кузьменко Н.Е., Дроздов А.А. и др./ Под ред. Лунина В.В.
- Тема: § 13. Амин
- 11.03.2018
- 1282
- 1

Рейтинг:
4 из 5
- 05.03.2018
- 4412
- 89



- 05.02.2018
- 1371
- 27

Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Экономика: инструменты контроллинга»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Страхование и актуарные расчеты»
-
Курс повышения квалификации «Источники финансов»
-
Курс профессиональной переподготовки «Организация деятельности помощника-референта руководителя со знанием иностранных языков»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Корпоративная культура как фактор эффективности современной организации»
-
Курс профессиональной переподготовки «Организация деятельности специалиста оценщика-эксперта по оценке имущества»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
Тренировочные задания. Окислительно-восстановительные реакции с участием органических веществ
1. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
2. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
3. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
4. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
5. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
6. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
7. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
8. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
9. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
10. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
11. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
12. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
13. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
14. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
Ответы
Вы завершили курс по самостоятельной подготовке к ЕГЭ по химии. Если остались пробелы — закройте их с онлайн репетитором. Выбрать репетитора можно на сайте — http://profi-teacher.ru/school-predmety/repetitors-ximii/
Окислительно-восстановительные реакции в органической химии
-
Реакции горения
Углеводороды и кислородсодержащие ― CO2 и H2O
Галогенсодержащие ― H-Hal, CO2 и H2O
Азотсодержащие ― N2, CO2 и H2O
-
Окисление углеводородов с кратной связью сильными окислителями (KMnO4 или K2Cr2O7)
Нейтральная среда:
В нейтральной среде на месте кратной связи происходит разрыв пи-связи с присоединением гидроксо-групп. За счет чего образуется многоатомный спирт.
CH3-CH=CH2 + [O] → CH3-CH(OH)-CH2(OH)
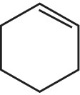
Кислая среда:
В кислой среде происходит полный разрыв кратной связи: рвется и сигма-связь, и пи-связь.
Ацетилен и этилен образуют разные продукты.
CH2=CH2 + [O] → 2CO2
CH≡CH + [O] →
Из фрагмента с одним атомом углерода всегда образуется CO2, а из двух и более атомов углерода (линейного строения) ― карбоновая кислота.
CH3-CH=CH2 + [O] → 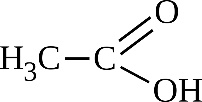

Если при кратной связи есть заместитель, то образуется кетон.
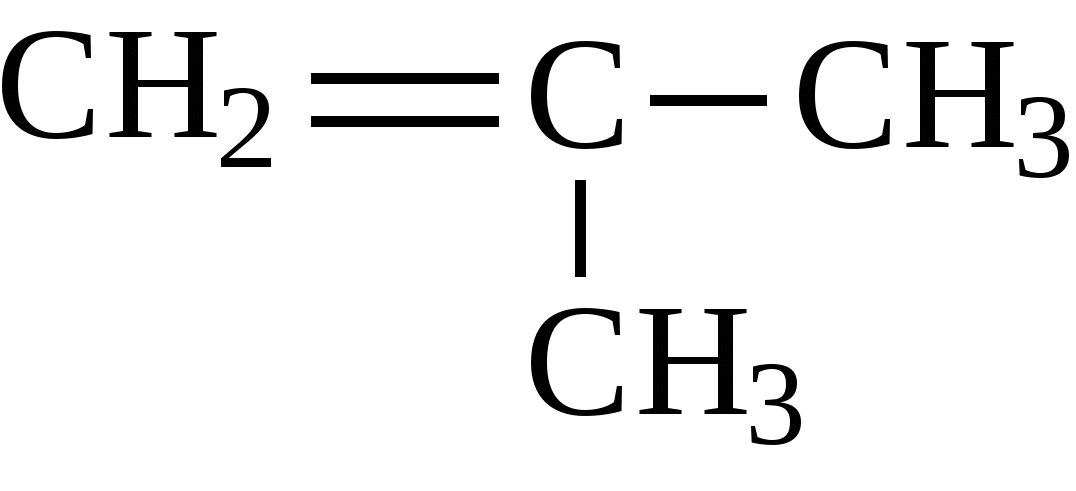
Гомологи бензола и стирол разрываются по альфа атом углерода. Оставшиеся фрагменты углерода из заместителей превращаются либо в углекислый газ, либо в карбоновую кислоту, а часть с бензолом ― всегда в бензойную кислоту.
Щелочная среда:
Все то же самое, что и в кислой среде, только из-за присутствия катионов металла образуется соль карбоновой кислоты (вместо карбоновой кислоты), либо карбонат (вместо углекислого газа).
Ряд окислительно-восстановительных превращений.
первичные спирты ― альдегиды ― карбоновые кислоты ― углекислый газ
вторичные спирты ― кетоны ― углекислый газ
Окислительно-восстановительные процессы издавна интересовали
химиков и даже алхимиков. Среди химических реакций, происходящих в природе,
быту и технике, огромное множество составляют окислительно-восстановительные:
сгорание топлива, окисление питательных веществ, тканевое дыхание, фотосинтез,
порча пищевых продуктов и т.д. В таких реакциях могут участвовать как
неорганические вещества, так и органические. Однако если в школьном курсе
неорганической химии разделы, посвященные окислительно-восстановительным
реакциям, занимают значительное место, то в курсе органической химии на этот
вопрос обращено недостаточно внимания.
Что же представляют собой восстановительно-окислительные
процессы?
Все химические реакции можно разделить на два типа. К
первому относятся реакции, протекающие без изменения степени окисления атомов,
входящих в состав реагирующих веществ.
Ко второму типу относятся все реакции, идущие с изменением
степени окисления атомов, входящих в состав реагирующих веществ.
Реакции, протекающие с изменением степени окисления атомов,
входящих в состав реагирующих веществ, называются
окислительно-восстановительными.
С современной точки зрения изменение степени окисления
связано с оттягиванием или перемещением электронов. Поэтому наряду с
приведенным можно дать и такое определение восстановительно-окислительных
реакций: это такие реакции, при которых происходит переход электронов от одних
атомов, молекул или ионов к другим.
Рассмотрим основные положения, относящиеся к теории
окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электроном атомом,
молекулой или ионом электронов, степени окисления при этом повышаются.
2. Восстановлением называется процесс присоединения
электронов атомом, молекулой или ионом, степень окисления при этом понижается.
3. Атомы, молекулы или ионы, отдающие электроны, называются
восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы,
присоединяющие электроны, называются окислителями. Во время реакции они
восстанавливаются.
4. Окисление всегда сопровождается восстановлением;
восстановление всегда связано с окислением, что можно выразить уравнениями.
Поэтому окислительно-восстановительные реакции представляют
собой единство двух противоположных процессов – окисления и восстановления. В
этих реакциях число электронов, отдаваемых восстановителем, равно числу
электронов, присоединяемых окислителем. При этом независимо от того, переходят
ли электроны с одного атома на другой полностью или лишь частично оттягиваются
к одному из атомов, условно говорят только об отдаче и присоединения
электронов.
Окислительно-восстановительные реакции органических веществ
– важнейшее свойство, объединяющее эти вещества. Склонность органических
соединений к окислению связывают с наличием кратных связей, функциональных
групп, атомов водорода при атоме углерода, содержащем функциональную группу.
Применение понятия «степени окисления» (СО) в органической
химии очень ограничено и реализуется, прежде всего, при составлении уравнений окислительно-восстановительных
реакций. Однако, учитывая, что более или менее постоянной состав продуктов
реакции возможен только при полном окислении (горении) органических веществ,
целесообразность расстановки коэффициентов в реакциях неполного окисления
отпадает. По этой причине обычно ограничиваются составлением схемы превращений
органических соединений.
Нам представляется важным указывать значение СО атома
углерода при изучении всей совокупности свойств органических соединений.
Систематизация сведений об окислителях, установление связи между строением
органических веществ и их СО помогут научить учащихся [1, 2]:
— Выбирать лабораторные и промышленные окислители;
Находить зависимость окислительно-восстановительной
способности органического вещества от его строения;
— Устанавливать связь между классом органических веществ и
окислителем нужной силы, агрегатного состояния и механизма действия;
— Предсказывать условия проведения реакции и ожидаемые
продукты окисления.
Определение степени окисления атомов в органических веществах
Степень окисления любого атома углерода в органическом
веществе равна алгебраической сумме всех его связей с более
электроотрицательных элементов (Cl, O,
S,N, и др.), учитываемых со
знаком «+», и связей с атомами водорода (или другого более
электроположительного элемента), учитываемых со знаком «-». При этом связи с
соседними атомами углерода не учитываются [1].
Определим степени окисления атомов углерода в молекулах
предельного углеводорода пропана и спирта этанола:
Последовательное окисление органических веществ можно
представить в виде следующей цепочки превращений:
Насыщенный углеводород 



CO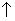
Генетическая связь между классами органических соединений представляется
здесь как ряд окислительно–восстановительных реакций, обеспечивающих переход от
одного класса органических соединений к другому. Завершают его продукты полного
окисления (горения) любого из представителей классов органических соединений.
Приложение. Таблица №1.
Изменение СО у атомов углерода в молекуле углерода в
молекулах органических соединений приведены в таблице. Из данных таблицы
видно, что при переходе от одного класса органических соединений к другому и
увеличения степени разветвленности углеродного скелета молекул соединений
внутри отдельного класса степень окисления атома углерода, ответственного за
восстанавливающую способность соединения, изменяется. Органические вещества, в
молекулах которых содержатся атомы углерода с максимальными (- и +) значениями
СО (-4, -3, +2, +3), вступают в реакцию полного окисления-горения, но устойчивых
к воздействию мягких окислителей и окислителей средней силы. Вещества, в
молекулах которых содержится атомы углерода в СО -1; 0; +1, окисляются легко,
восстановительные способности их близки, поэту их неполное окисление может быть
достигнуто за счет одного из известных окислителей малой и средней силы. Эти
вещества могут проявлять двойственную природу, выступая и в качестве
окислителя, подобно тому, как это присуще неорганическим веществам.
Окисление и восстановление органических веществ
Повышенная склонность органических соединений к окислению обусловлена
наличием в молекуле веществ [1, 2]:
- кратных связей (именно поэтому так легко окисляются алкены,
алканы, алкадиены); - определенных функциональных групп – сульфидной -SH, гидроксильной –OH (фенольной и
спиртовой), аминной — NH;
- активированных алкильных групп, расположенных по соседству
с кратными связям, например пропен может быть окислен до непредельного
альдегида акролеина (кислородом воздуха в присутствии водяных паров на
висмут- молибденовых катализаторах):
- атомов водорода при атоме углерода, содержащем функциональную
группу.
Сравним первичные, вторичные и третичные спирты по
реакционной способности к окислению:
Первичные и вторичные спирты, имеющие атомы водорода при
атоме углерода, несущем функциональную группу; окисляются легко: первые – до
альдегидов, вторые до кетонов. При этом структура углеродного скелета исходного
спирта сохраняется. Третичные спирты, в молекулах которых нет атома водорода
при атоме углерода, содержащем группу ОН, в обычных условиях не окисляются. В
жестких условиях (при действии сильных окислителей и при высоких температурах)
они могут быть окислены до смеси низкомолекулярных карбоновых кислот, т.е.
происходит деструкция углеродного скелета.
Существуют два подхода к определению степеней окисления
элементов в органических веществах.
1. Вычисляют среднюю степень окисления атома углерода в
молекуле органического соединения, например пропана.
Такой подход оправдан, если в ходе реакции в органическом
веществе разрушаются все химические связи (горение, полное разложение).
Отметим, что формально дробные степени окисления,
вычисленные таким образом, могут быть и в случае неорганических веществ.
Например, в соединении КО
кислорода равна – 1/2.
2. Определяют степень окисления каждого атома углерода,
например в бутане.
В этом случае степень окисления любого атома углерода в
органическом соединении равна алгебраической сумме чисел всех связей с атомами
более электроотрицательных элементов, учитываемых со знаком «+», и числа связей
с атомами водорода (или другого более электроположительного элемента),
учитываемых со знаком «-». При этом связи с атомами углерода не учитывают.
В качестве простейшего примера определим степень окисления
углерода в молекуле метанола.
Атом углерода связан с тремя атомами водорода (эти связи
учитываются со знаком « — »), одной связью – с атомом кислорода (ее учитывают
со знаком «+»). Получаем:
-3 + 1 = -2
Таким образом, степень окисления углерода в метаноле равна
-2.
Вычисленная степень окисления углерода хотя и условное
значение, но оно указывает на характер смещения электронной плотности в
молекуле, а ее изменение в результате реакции свидетельствует об имеющем место
окислительно-восстановительном процессе.
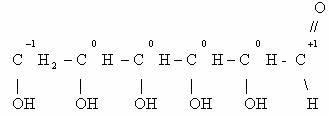
Рассмотрим цепочку превращений веществ:
При каталитическом дегидрировании этана получается этилен;
продукт гидратации этилена – этанол; его окисление приведет к этаналю, а затем
– к уксусной кислоте; при ее сгорании образуется углекислый газ и вода.
Определим степени окисления каждого атома углерода в
молекулах перечисленных веществ.
Можно заметить, что в ходе каждого из этих превращений
постоянно меняется степень окисления одного из атомов углерода. В направлении
от этана к оксиду углерода (IV) происходит увеличение
степени окисления атома углерода.
Несмотря на то, что в ходе любых
окислительно-восстановительных реакций происходит как окисление, так и
восстановление, их классифицируют в зависимости оттого, что происходит
непосредственно с органическим соединением (если оно окисляется, говорят о
процессе окисления, если восстанавливается – о процессе восстановления).
Так, в реакции этанола с перманганатом калия этанол будет
окисляться, а перманганат калия – восстанавливается. Реакцию называют
окислением этанола.
Составление окислительно – восстановительных уравнений
Для составления уравнений окислительно- восстановительных
реакций используют как метод электронного баланса, так и метод полуреакций
(электронно — ионный метод). Рассмотрим несколько примеров окислительно-
восстановительных реакций с участием органических веществ [1-3].
1. Горение н-бутана.
Схема реакции имеет вид:
Составим полное уравнение химической реакции методом
баланса.
Среднее значение степени окисления углерода в н-бутане:
10/4 = 2,5.
Степень окисления углерода в оксиде углерода(IV) равна +4.
Составим схему электронного баланса:
C учетом найденных коэффициентов
уравнение химической реакции горения н-бутана будет выглядеть следующим
образом:
Коэффициенты для этого уравнения можно найти и другим
методом, о котором уже упоминалось. Рассчитав степени окисления каждого из
атомов углерода, видим, что они различаются:
В этом случае схема электронного баланса будет выглядеть
так:
Так как в ходе горения н-бутана в его молекулах разрушаются
все химические связи, то в данном случае первый подход вполне оправдан, тем
более что схема электронного баланса, составленная вторым способом, несколько
сложнее.
2. Реакция окисления этилена раствором перманганата калия в
нейтральной среде на холоду (реакция Вагнера).
Расставим коэффициенты в уравнении реакции методом
электронного баланса.
Полное уравнение химической реакции будет выглядеть так:
Для определения коэффициентов можно воспользоваться и методом
полуреакций. Этилен окисляется в этой реакции до этиленгликоля, а перманганат –
ионы восстанавливаются с образованием диоксида марганца.
Схемы соответствующих полуреакций:
Суммарное электронно-ионное уравнение:
3. Реакции окисления глюкозы перманганата калия в кислой
среде.
А. Метод электронного баланса.
Первый вариант
Второй вариант
Рассчитаем степени окисления каждого из атомов углерода в
молекуле глюкозы:
Схема электронного баланса усложняется по сравнению с
предыдущими примерами:
Б. Метод полуреакций в данном случае выглядит следующим
образом:
Суммарное ионное уравнение:
Молекулярное уравнение реакции глюкозы перманганататом
калия:
В органической химии целесообразно использовать определение
окисления как увеличение содержания кислорода или уменьшение содержания
водорода [4]. Восстановление в таком случае определяется как уменьшение
содержания кислорода или увеличение содержания водорода. При таком определении
последовательное окисление органических веществ можно представить следующей
схемой:
или
Практика показывает, что подбор коэффициентов в реакциях
окисления органических веществ вызывает определенные затруднения, так как
приходится иметь дело с весьма непривычными степенями окисления.[4]. Некоторые
учащиеся из-за отсутствия опыта продолжают отождествлять степень окисления с
валентностью и, вследствие этого, неправильно определяют степень окисления
углерода в органических соединениях. Валентность углерода в этих соединениях
всегда равна четырем, а степень окисления может принимать различные значения
(от -3 до +4, в том числе дробные значения). Непривычным моментом при окислении
органических веществ является нулевая степень окисления атома углерода в
некоторых сложных соединениях. Если преодолеть психологический барьер,
составление таких уравнений не представляет сложности, например:
Степень окисления атома углерода в сахарозе равна нулю.
Переписываем схему реакции с указанием степеней окисления атомов, которые их меняют:
Составляем электронные уравнения и находим коэффициенты при
окислителе и восстановителе и продуктах их окисления и восстановления:
Подставим полученные коэффициенты в схему реакции:
Оставшиеся коэффициенты подбираем в такой
последовательности: K

H


уравнение имеет вид:
Многие вузы включают в билеты для вступительных экзаменов
задания по подбору коэффициентов в уравнениях ОВР электронным методом(методом
полуреакций). Если в школе и уделяется хоть какое-то внимание этому методу, то,
в основном при окислении неорганических веществ. Попробуем применить метод
полуреакций для выше приведенного примера окисления сахарозы перманганатом
калия в кислой среде.
Первое преимущество этого метода заключается в том, что нет
необходимости сразу угадывать и записывать продукты реакции. Они достаточно
легко определяются в ходе уравнения. Окислитель в кислой среде наиболее полно
проявляет свои окислительные свойства, например, анион MnO
катион Mn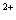
окисляются до CO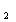
Запишем в молекулярном виде превращения сахарозы:
В левой части не хватает 13 атомов кислорода, чтобы
устранить это противоречие, прибавим 13 молекул H
Левая часть теперь содержит 48 атомов водорода, они
выделяются в виде катионов Н
Теперь уравняем суммарные заряды справа и слева:
Схема полуреакций готова. Составление схемы второй полуреакции
обычно не вызывает затруднений:
Объединим обе схемы:
Сократив обе части уравнения на 65 H
240 Н
ионное уравнение окислительно-восстановительной реакции:
Упражнения. Расставьте коэффициенты методом
электронного баланса в уравнениях реакций:
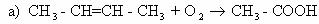
Вариант 1.
Вариант 2.
б) С

СО

в) СН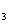

KMnO

СН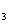

г) С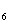
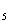
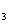



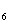
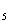
MnSO



д) СН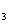
+Н

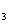

Упражнения. Расставьте коэффициенты методом
электронного баланса:
а) С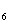
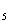

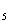


С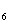
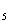




H
12MnO

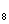
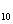


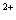
48H
5C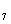
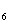


5С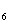
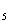

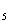



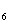
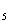





в) C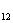
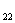
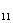


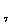
H








г) CH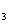


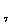








д) СН






ЛИТЕРАТУРА
1. Матч Дж. Органическая химия. Реакции, механизмы и
структура: В 4т./ Пер. с англ.- М.: Мир, 1987-1988.
2. Карцова А.А, Левкин А. Н. Окислительно-восстановительные
реакции в органической химии // Химия в школе. — 2004. — №2. – С.55-61.
3. Хомченко Г.П., Савостьянова К.И. Окислительно-восстановительные
реакции: Пособие для учащихся . М.- : Просвещение , 1980.
4. Шарафутдинов В. Окислительно-восстановительные реакции в
органической химии // Башкортостан уkытыусыhы. — 2002. — №5. – С.79 -81.
В окислительно-восстановительных реакциях органические вещества
чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических соединений зависит от доступности электронов при взаимодействии с окислителем. Все известные факторы, вызывающие увеличение электронной плотности в молекулах органических соединений (например, положительные индуктивный и мезомерные эффекты), будут повышать их способность к окислению и наоборот.
Склонность органических соединений к окислению возрастает с ростом их
нуклеофильности
, что соответствует следующим рядам:

Рост нуклеофильности в ряду
Рассмотрим
окислительно-восстановительные реакции
представителей важнейших классов
органических веществ
с некоторыми неорганическими окислителями.
Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
3C
2
H
4
+ 2KMnO
4
+ 4H
2
O → 3CH
2
OH–CH
2
OH + 2MnO
2
+ 2KOH
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH
3
CH=CHCH
2
CH
3
+ 8KMnO
4
+ 12H
2
SO
4
→ 5CH
3
COOH + 5C
2
H
5
COOH + 8MnSO
4
+ 4K
2
SO
4
+ 17H
2
O
2) 5CH
3
CH=CH
2
+ 10KMnO
4
+ 15H
2
SO
4
→ 5CH
3
COOH + 5CO
2
+ 10MnSO
4
+ 5K
2
SO
4
+ 20H
2
O
3) CH
3
CH=CHCH
2
CH
3
+ 8KMnO
4
+ 10KOH → CH
3
COOK + C
2
H
5
COOK + 6H
2
O + 8K
2
MnO
4
4) CH
3
CH=CH
2
+ 10KMnO
4
+ 13KOH → CH
3
COOK + K
2
CO
3
+ 8H
2
O + 10K
2
MnO
4
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:
Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH
3
C≡CH + 8KMnO
4
+ 12H
2
SO
4
→ 5CH
3
COOH + 5CO
2
+ 8MnSO
4
+ 4K
2
SO
4
+ 12H
2
O
Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO
4
→ 3KOOC –COOK +8MnO
2
+2КОН +2Н
2
О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
5CH≡CH +8KMnO
4
+12H
2
SO
4
→ 5HOOC –COOH +8MnSO
4
+4К
2
SO
4
+12Н
2
О
CH≡CH + 2KMnO
4
+3H
2
SO
4
→ 2CO
2
+ 2MnSO
4
+ 4H
2
O + K
2
SO
4
Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C
6
H
5
CH
3
+2KMnO
4
→ C
6
H
5
COOK + 2MnO
2
+ KOH + H
2
O
C
6
H
5
CH
2
CH
3
+ 4KMnO
4
→ C
6
H
5
COOK + K
2
CO
3
+ 2H
2
O + 4MnO
2
+ KOH
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
5С
6
Н
5
СН
3
+6КMnO
4
+9 H
2
SO
4
→ 5С
6
Н
5
СООН+6MnSO
4
+3K
2
SO
4
+ 14H
2
O
5C
6
H
5
–C
2
H
5
+ 12KMnO
4
+ 18H
2
SO
4
→ 5C
6
H
5
COOH + 5CO
2
+ 12MnSO
4
+ 6K
2
SO
4
+ 28H
2
O
Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C
2
H
5
OH + K
2
Cr
2
O
7
+ 4H
2
SO
4
→ 3CH
3
CHO + K
2
SO
4
+ Cr
2
(SO
4
)
3
+ 7H
2
O
С избытком окислителя (KMnO
4
, K
2
Cr
2
O
7
) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
5C
2
H
5
OH + 4KMnO
4
+ 6H
2
SO
4
→ 5CH
3
COOH + 4MnSO
4
+ 2K
2
SO
4
+ 11H
2
O
3CH
3
–CH
2
OH + 2K
2
Cr
2
O
7
+ 8H
2
SO
4
→ 3CH
3
–COOH + 2K
2
SO
4
+ 2Cr
2
(SO
4
)
3
+ 11H
2
O
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
Двухатомный спирт, этиленгликоль HOCH
2
–CH
2
OH, при нагревании в кислой среде с раствором KMnO
4
или K
2
Cr
2
O
7
легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН
2
(ОН) – СН
2
(ОН) + 8КMnO
4
+12H
2
SO
4
→ 5HOOC –COOH +8MnSO
4
+4К
2
SO
4
+22Н
2
О
3СН
2
(ОН) – СН
2
(ОН) + 8КMnO
4
→ 3KOOC –COOK +8MnO
2
+2КОН +8Н
2
О
Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO
4
, K
2
Cr
2
O
7
, [Ag(NH
3
)
2
]OH, Cu(OH)
2
. Все реакции идут при нагревании:
3CH
3
CHO + 2KMnO
4
→ CH
3
COOH + 2CH
3
COOK + 2MnO
2
+ H
2
O
3CH
3
CHO + K
2
Cr
2
O
7
+ 4H
2
SO
4
→ 3CH
3
COOH + Cr
2
(SO
4
)
3
+ 7H
2
O
CH
3
CHO + 2KMnO
4
+ 3KOH → CH
3
COOK + 2K
2
MnO
4
+ 2H
2
O
5CH
3
CHO + 2KMnO
4
+ 3H
2
SO
4
→ 5CH
3
COOH + 2MnSO
4
+ K
2
SO
4
+ 3H
2
O
CH
3
CHO + Br
2
+ 3NaOH → CH
3
COONa + 2NaBr + 2H
2
O

реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
CH
3
CH=O + 2[Ag(NH
3
)
2
]OH → CH
3
COONH
4
+ 2Ag + H
2
O + 3NH
3
CH
3
–CH=O + 2Cu(OH)
2
→ CH
3
COOH + Cu
2
O + 2H
2
O
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
5HCOH + 4KMnO
4
(
изб
)
+ 6H
2
SO
4
→ 4MnSO
4
+ 2K
2
SO
4
+ 5CO
2
+ 11H
2
O
3СН
2
О + 2K
2
Cr
2
O
7
+ 8H
2
SO
4
→ 3CO
2
+2K
2
SO
4
+ 2Cr
2
(SO
4
)
3
+ 11H
2
O
HCHO + 4[Ag(NH
3
)
2
]OH → (NH
4
)
2
CO
3
+ 4Ag↓ + 2H
2
O + 6NH
3
HCOH + 4Cu(OH)
2
→ CO
2
+ 2Cu
2
O↓+ 5H
2
O
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:
Карбоновые кислоты.
Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl
2
=CO
2
+ Hg + 2HCl
HCOOH+ Cl
2
= CO
2
+2HCl
HOOC-COOH+ Cl
2
=2CO
2
+2HCl
Муравьиная кислота
, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2↑ + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается:
HCOOH →(t) CO↑ + H2O
Каталитическое окисление алканов:
Каталитическое окисление алкенов:
Окисление фенолов:




![КMnO4K2Cr2O7Основные окислителиMnSO4MnO2K2MnO4Cr2(SO4)3Cr(OH)3K3[Cr(OH)6]O3 и... КMnO4K2Cr2O7Основные окислителиMnSO4MnO2K2MnO4Cr2(SO4)3Cr(OH)3K3[Cr(OH)6]O3 и...](https://documents.infourok.ru/8509b6c1-c05a-4b74-b1c8-29c15f3150e5/0/slide_05.jpg)




































![Реакции, вызывающие трудностиC6H5-NH2+HCl=[C6H5-NH3]ClC6H5-NH2+CH3Br=[C6H5-N... Реакции, вызывающие трудностиC6H5-NH2+HCl=[C6H5-NH3]ClC6H5-NH2+CH3Br=[C6H5-N...](https://documents.infourok.ru/8509b6c1-c05a-4b74-b1c8-29c15f3150e5/0/slide_42.jpg)