Тренировочные задания. Окислительно-восстановительные реакции с участием органических веществ
1. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
2. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
3. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
4. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
5. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
6. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
7. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
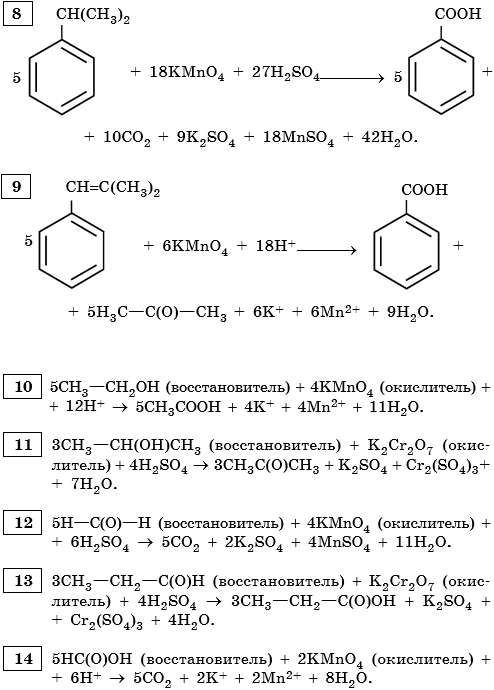
8. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
9. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
10. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
11. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
12. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
13. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
14. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
Ответы
Вы завершили курс по самостоятельной подготовке к ЕГЭ по химии. Если остались пробелы — закройте их с онлайн репетитором. Выбрать репетитора можно на сайте — http://profi-teacher.ru/school-predmety/repetitors-ximii/
Скачать материал

Скачать материал


- Сейчас обучается 30 человек из 23 регионов


- Сейчас обучается 113 человек из 49 регионов


- Курс добавлен 13.12.2022


Описание презентации по отдельным слайдам:
-
1 слайд
Организация подготовки к ЕГЭ по химии задание №33: окислительно-восстановительные реакции
с участием органических веществ
Минакова А.П., учитель химии
МБОУ «Гимназия №44» г. Курска -
2 слайд
В цепочках превращений органических веществ в подавляющем большинстве заданий встречаются ОВР. Эксперт имеет право начислить балл только в том случае, если записано уравнение, а не схема реакции, т.е. верно расставлены коэффициенты. В реакциях с участием неорганических окислителей (перманганат калия, соединения хрома (VI), пероксид водорода и др.) сделать это бывает непросто, без электронного баланса.
-
3 слайд
.
Изменение степени окисления атомов углерода в молекулах органических соединений -
4 слайд
Степени окисления атома углерода
-
5 слайд
КMnO4
K2Cr2O7
Основные окислители
MnSO4
MnO2
K2MnO4
Cr2(SO4)3
Cr(OH)3
K3[Cr(OH)6]
O3 и H2O2
Сине-зеленый -
-
7 слайд
Алканы
При обычных условиях алканы устойчивы к действию таких окислителей, как растворы KMnO4, K2Cr2O7.
В результате контролируемого каталитического окисления алканов кислородом в определенных условиях, т.е. при различных температурах и давлении, можно получить спирты, альдегиды, кетоны и карбоновые кислоты, например:Обратите внимание на то, что реакция каталитического окисления бутана используется в промышленности для получения уксусной кислоты
-
8 слайд
Алкены
При мягком окислении алкены превращаются в гликоли (двухатомные спирты), среда нейтральная или слабощелочная. Реакция Вагнера.
3CH2=CH2 + 2 KMnO4 + 4 H2O ——> 3 CH2OH-CH2OH + 2 KOH + 2MnO2
Слабощелочная среда (в общем виде):
R-CH=CH-R+ 2KMnO4+2KOH→R-CH(OH)-CH(OH)-R+2K2MnO4
WO3
Окисление алкенов концентрированным раствором перманганата калия KMnO4 или бихромата калия K2Cr2O7 в кислой среде сопровождается разрывом не только π-, но σ-связи. В зависимости от строения алкена в результате этой реакции образуются карбоновые кислоты, CO2 и кетоны. -
9 слайд
По продуктам окисления алкена можно определить положение двойной связи в его молекуле:
-
10 слайд
Алкены разветвленного строения, содержащие углеводородный радикал у атома углерода, соединенного двойной связью, при окислении образуют смесь карбоновой кислоты и кетона:
Алкены разветвленного строения, содержащие углеводородные радикалы у обоих атомов углерода, соединенных двойной связью, при окислении образуют смесь кетонов:
-
11 слайд
Алкены
CH3-CH=CH-CH3+O3+H2O= +H2O2CH3-CH=CH-CH3+O3+H2O= 2 +H2O2
CH3-CH(CH3)=CH-CH3+O3+H2O= +CH3-COH+H2O2 -
12 слайд
Пример:
3CH3 — CH = CH — CH = CH2+4KMnO4+8 H2O= 4KOH+4MnO2+3CH3 — CH — CH — CH — CH2
│ │ │ │
OH OH OH OH
пентадиен — 1,4 пентантетраол — 1,2,3,4Алкадиены
С5H8+4KMnO4+6H2SO4=2CO2+C3H4O4+2K2SO4+4MnSO4+8H2O
Малоновая кислота
Уравнение окисления бутадиена-1,3 избытком раствора перманганата калия в кислой среде: 5CH2=CH-CH=CH2 + 22KMnO4 + 33H2SO4 =20CO2+ 11K2SO4 + 22MnSO4 + 48H2OCH2=C=CH2 +KMnO4=CH2OH-CO-CH2OH +K2MnO4+H2O
1,3-дигидроксиацетон -
13 слайд
Под действием сильных окислителей образуют двухосновные карбоновые кислоты с тем же числом атомов углерода.
В зависимости от условий каталитическим окислением воздухом
циклогексана получают циклогексанол, циклогексанон или
адипиновую кислоту
При действии сильных окислителей (KMnO4, K2Cr2O7 и др.)
циклоалканы образуют двухосновные карбоновые кислоты с тем
же числом атомов углерода:
Циклоалканы -
14 слайд
+2 KMnO4+3H2SO4=HOOC-(CH2)2-COOH+2MnSO4+K2SO4+2H2O
Янтарная к-та
+2 KMnO4+3H2SO4=HOOC-(CH2)3-COOH+2MnSO4+K2SO4+4H2O
глутаровая к-та
+2 KMnO4+3H2SO4=HOOC-(CH2)4-COOH+2MnSO4+K2SO4+4H2O
Циклогексан окисляется до адипиновой кислоты, используемой в производстве полиамидных волокон – капрона и нейлона
+O2→
+H2O
kat -
15 слайд
5 + 8KMnO 4 + 12H 2 SO 4 = 5HOOC(CH 2 ) 3 COOH + 4K 2 SO 4 + 8MnSO 4+
+ 12H 2 OГлутаровая к-та
CH 3
+ 2KMnO 4 + 4H 2 O=
3
CH 3
OH
OH
3
+ 2MnO 2 + 2KOH -
16 слайд
Ацетилен окисляется водным раствором KMnO4 до оксалата калия K2C2O4:
АЛКИНЫ
В мягких условиях алкины с неконцевой тройной связью окисляются до
α-кетонов:
В жестких условиях алкины с неконцевой тройной связью окисляются до карбоновых кислот:
Алкины, содержащие тройную связь у крайнего атома углерода,
окисляются в жестких условиях с образованием карбоновой кислоты и
СО2: -
17 слайд
+H2O2=
Можно окислить озоном с образованием диальдегида:
Бензол
Устойчив к окислителям при комнатной температуре
Не реагирует с водными растворами KMnO4, K2Cr2O7 и других окислителей
2 -
18 слайд
Более сильные окислители – KMnO4 в кислой среде или хромовая смесь при нагревании окисляют метильную группу до карбоксильной:
В нейтральной или слабощелочной среде образуется не сама бензойная кислота, а ее соль — бензоат калия:
Окисляются относительно легко
Окислению подвергается боковая цепь
Мягкие окислители (MnO2) окисляют метильную группу
до альдегидной группы:
бензальдегид
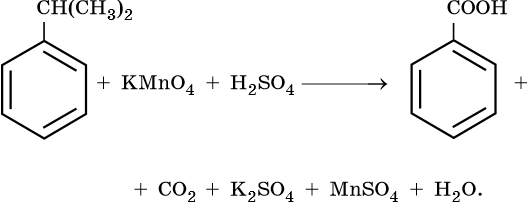
Гомологи бензола
С6Н5СН3 + MnO2 →C6H5− CОН -
19 слайд
Под действием сильных окислителей (KMnO4 в кислой среде или
хромовой смеси) окисление идет по α-углеродному атому с образованием бензойной кислоты
Гомологи бензола
Окисление гомологов бензола с одной боковой цепью под действием
KMnO4 в кислой среде или хромовой смеси приводит к образованию
бензойной кислоты -
20 слайд
Реакция анилина с хромовой смесью. Получается чёрный анилин.
3 C6H5NH2 + 2 K2Cr2O7 + 11 H2SO4 → 3 C6H4O2 + 2 K2SO4 + 2 Cr2(SO4)3+ 3 NH4HSO4+
8 H2O
Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты: -
21 слайд
В нейтральной или слабощелочной среде при окислении перманганатом калия KMnO4 образуются соль карбоновой кислоты и карбонат калия:
-
22 слайд
Окисление первичных спиртов
до альдегидов до карбоновых кислотМетанол окисляется до СО2:
-
23 слайд
Окисление предельных одноатомных спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. -
24 слайд
Для окисления вторичных спиртов наиболее часто используют бихромат калия в кислой среде при комнатной температуре или небольшом нагревании. Применяют также KMnO4 и MnO2.
Для окисления первичных спиртов до альдегидов обычно используют реактив Джонсона или комплекс CrO3 c пиридином. Перманганат калия не применяют для окисления спиртов в альдегиды, т.к. реакция не останавливается на стадии образования альдегида, и окисление идет дальше до кислоты. Однако широкое применение нашел MnO2. Этот реагент не затрагивает кратные связи, поэтому может быть использован для получения и непредельных альдегидов и кетонов:Третичные спирты устойчивы к действию окислителей: они не окисляются ни в нейтральной, ни в щелочной среде. Но если в третичном спирте у атома углерода, соседнего с С-ОН-группой, есть атом водорода, то такие спирты окисляются в кислой среде, с отщеплением воды, образованием в качестве промежуточного продукта алкена и разрывом С-С -связи:
-
25 слайд
Например, окисление этанола дихроматом калия на холоде заканчивается получением уксусной кислоты, а при нагревании – ацетальдегида:
3CH3–CH2OH + 2K2Cr2O7 + 8H2SO4 = 3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O,
3CH3–CH2OH + K2Cr2O7 + 4H2SO4 = 3CH3–CHO + K2SO4 + Cr2(SO4)3 + 7H2O.
ṯ
Окисление хромовой смесью вторичного спирта -
26 слайд
5CH3-CH2-OH+4KMnO4+6H2SO4=5CH3COOH+2K2SO4+4MnSO4+11H2O
CH3-CH2-OH+4KMnO4+5KOH= CH3COOK+4K2MnO4+4H2O
3CH3-CH2-OH+4KMnO4=3 CH3COOK+4MnO2+KOH+4H2O
Окислителем одноатомных спиртов может быть перекись водорода
CH3-CH2-OH+2H2O2= CH3–COOH+3H2OОкисление предельных одноатомных спиртов
+ 4K2Cr2O7 + 16H2SO4 = 3HOOC-(CH2)4-COOH + 4Cr2(SO4)3 + 4K2SO4 +19H2OОкисление циклогексанола до адипиновой кислоты
-
27 слайд
Вторичные спирты окисляются до кетонов:
Третичные спирты устойчивы к окислению!
Окисление трет-бутанола в «жёстких» условиях: -
28 слайд
Окисление гликолей
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.5СН2(ОН) – СН2(ОН) + 8КMnO4+12H2SO4→5HOOC – COOH +8MnSO4 +4К2SO4 + +22Н2О
3СН2(ОН) – СН2(ОН) + 8КMnO4→3KOOC – COOK +8MnO2 +2КОН +8Н2О
Глицерин, такими сильными окислителями как КMnO4 и K2Cr2O7, может окисляться до CO2 и H2O:
14 КMnO4+ 3C3H5(OH)3→7K2CO3+14MnO2+12H2O+2CO2
3C3H5(OH)3+7 K2Cr2O7-+28H2SO4→9 CO2+40 H2O+7K2SO4+7Cr2(SO4)3
-
29 слайд
6КMnO4+9H2SO4→
5
5H
H
+6MnSO4 +3К2SO4 + 24Н2О
Окисление многоатомных спиртов происходит ступенчато, при этом первичные спиртовые группы превращаются в альдегидные, а вторичные – в кетонные. Первичные спиртовые группы могут окисляться до карбоксильных
2КMnO4+3H2SO4→
+2MnSO4 +К2SO4 + 6Н2О -
30 слайд
КMnO4
H2SO4
+ CO2 ↑+ -
31 слайд
+H2O2→
+H2O
Окисление фенола
пирокатехин
3
+2K2Cr2O7-+8H2SO4→3
+ 2K2SO4 + 2Cr2(SO4)3 + 11H2O
бензохинон -
32 слайд
C6H5-CH(OH)-CH3+H2O2→C6H5-CO-CH3+2H2O
C6H5CH(OH)CH3 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + C6H5COOH +СО2 +5H2O
3C6H5CH(OH)CH3 + K2Cr2O7 + 4H2SO4 = 3C6H5COCH3 + Cr2(SO4)3 + K2SO4 + 7H2O
Окисление ароматических спиртов -
33 слайд
Альдегиды легко окисляются до карбоновых кислот
Ароматические альдегиды
легко окисляются даже кислородом воздуха
Метаналь окисляется до CО2
Окисление альдегидов и кетонов -
34 слайд
Качественные реакции на альдегиды
Окисление гидроксидом меди(II)
Реакция «серебряного зеркала»
Соль, а не кислота! -
35 слайд
Кетоны окисляются с трудом, слабые окислители на них не действуют
Под действием сильных окислителей происходит разрыв С—С связей по обе стороны карбонильной группы с образованием кислот
Кетоны несимметричного строения преимущественно окисляются со стороны менее гидрированного
атома углерода при карбонильной
группе (правило Попова – Вагнера):Окисление циклических кетонов
-
36 слайд
Окисление альдегидов
5CH3–CH=O + 2KMnO4 + 3H2SO4 = 5CH3–COOH + 2MnSO4 + K2SO4 + 3H2O,
3CH3CH=O + 2KMnO4 = CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CH=O + KMnO4+2KOH= CH3COOK+ K2MnO4+ H2O
5H–CH=O + 4KMnO4 + 6H2SO4 = 5CO2+ 4MnSO4 + 2K2SO4 + 11H2O
3H–CH=O + 4KMnO4 + 2KOH= 3K2CO3 +4MnO2 + 4H2O
3CH3–CH=O + K2Cr2O7 + 4H2SO4 = 3CH3–COOH + Cr2(SO4)3 + K2SO4 + 4H2O,
CH3–CH=O + 2[Ag(NH3)2]OH = CH3–COONH4 + 2Ag + 3NH3 + H2O
HCOH+ 2[Ag(NH3)2]OH =(NH4)2CO3+ 2Ag+ 2NH3 + H2OCH3–CH=O + 2Cu(OH)2 = CH3COOH + Cu2O + 2H2O
CH3CH=O + Br2 + 3NaOH → CH3COONa + 2NaBr + 2H2O
-
37 слайд
Окисление карбоновых кислот
Непредельные карбоновые кислотыокисляются водным раствором KMnO4 в слабощелочной среде с образованием дигидрооксикислот и их солей:
В кислой среде происходит разрыв углеродного скелета по месту двойной связи С=С с образованием смеси кислот:
Среди одноосновных карбоновых кислот легко окисляется только
муравьиная кислота
НСООН+2Ag[(NH3)2]ОН → (NH4)2CO3 + H2O+2Ag+ 2NH3 -
38 слайд
Особые свойства щавелевой кислоты
Легко окисляется под действием KMnO4 в кислой среде при нагревании до CО2 (метод перманганатометрии):
При нагревании подвергается декарбоксилированию
Под действием концентрированной H2SO4 при нагревании
щавелевая кислота и ее соли (оксалаты) разлагаются до СО и СО2 -
39 слайд
Окисление карбоновых кислот
Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
5НСООН + 2KMnO4 + 3H2SO4= 5CO2+ 2MnSO4 + K2SO4 + 8H2O
3НСООН + 2KMnO4 + 4KOH= 3K2CO3 +2MnO2 + 5H2O
5НOOC-СООН + 2KMnO4 + 3H2SO4= 10CO2+ 2MnSO4 + K2SO4 + 8H2O
НСООН + HgCl2 = CO2 + Hg + 2HClHCOOH+ Cl2 = CO2 +2HCl
HOOC-COOH+ Cl2 =2CO2 +2HCl
НСООН + 2[Ag(NH3)2]OH → NH4HCО3 +3NH3↑+ Н2O +2Ag↓
НСООН + 2Cu(OH)2 → CO2 + Cu2O↓ + 3H2O
-
40 слайд
Окисление глюкозы до глюконовой кислоты реактивом Толленса
гидроксидом меди Cu(OH)2 в щелочной среде
бромной водой
Окисление моносахаридов -
41 слайд
Окисление глюкозы до глюкаровой (сахарной) кислоты
разбавленной азотной кислотой HNO3
Окисление глюкозы до муравьиной кислоты
под действием иодной кислоты HIO4 (периодатное окисление)
Окисление моносахаридов -
42 слайд
Реакции, вызывающие трудности
C6H5-NH2+HCl=[C6H5-NH3]Cl
C6H5-NH2+CH3Br=[C6H5-NH2CH3]Cl
C6H5-NH2+CH3-COCl=C6H5-NH-CO-CH3+HCl
C6H5-NH2+C2H5-COOH=C6H5-NH-CO-C2H5+H2O
C6H5-NH2+HNO2=C6H5-OH+N2+H2O
C6H5-NH2+3Br2=C6H2Br3NH2+HBr
C6H5-NH2+NaNO2+2HCl=C6H5-NNCl+2H2O+NaCl
Гидролизуется при t до N2 фенола и HCl -
43 слайд
Реакции, вызывающие трудности
R-NO2+9Fe+4H2O→4R-NH2+3Fe3O4
R-NO2+3Zn+7HCl→R-NH3Cl+3ZnCl2+2H2O
R-NO2+3Fe+7HCl→R-NH3Cl+3FeCl2+2H2O
R-NO2+2Al+2NaOH+4H2O→R-NH2+2Na[Al(OH)4]CH3CH2OH + PCl5 = C2H5Cl + POCl3+HCl
CH3CH2OH + PCl3 = 3C2H5Cl + H3РO3 -
44 слайд
Реакции, вызывающие трудности
-
45 слайд
В составлении презентации были использованы материалы:
1. О.В. Архангельская, И.А. Тюльков. Задачи по теме «Уравнения окислительно-восстановительных реакций»
2. Л.И. Асановой, материалы вебинара по теме: «Организация подготовки к ЕГЭ по химии: окислительно-восстановительные реакции с участием органических веществ»
3. Л.И. Асанова, Е.Н. Стрельникова Окислительно-восстановительные реакции. Практикум по химии, Москва «ВАКО», 2018 г
4. И.И. Новошинский, Н.С. Новошинская Готовимся к ЕГЭ. Органическая химия. Пособие для учащихся, «Русское слово», 2013 г
5. О.Э. Сикорская Классы органических соединений. Пособие для подготовки к экзамену, «Веста», Владикавказ 2015 г
6. О.Э. Сикорская ХИМИЯ ОВР с участием органических соединений. Учебное пособие для подготовки к ЕГЭ, «Веста», Владикавказ 2014 г
7. Н.Е. Дерябина органическая химия. Книга 1. Углеводороды и их монофункциональные производные. Учебник-тетрадь. М.: ИПО «У Никитских ворот», 2012 г
8. ФИПИ школе. ЕГЭ Химия. Типовые экзаменационные варианты под редакцией А.А. Кавериной 2014-2018 гг
9. В.Н. Доронькин и др. ЕГЭ – 2018 Химия. Новые задания высокого уровня сложности, ЛЕГИОН, Ростов – на – Дону 2017 г
10. Сайт https://ege.sdamgia.ru/ и др
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 154 748 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы


«Биотопливо- взгляд в будущее»
- Учебник: «Химия (углублённый уровень)», Еремин В.В., Кузьменко Н.Е., Дроздов А.А. и др./ Под ред. Лунина В.В.
- Тема: § 65. Особенности современной нау
- 12.03.2018
- 1013
- 5

Амин 11 класс Химия
- Учебник: «Химия (углублённый уровень)», Еремин В.В., Кузьменко Н.Е., Дроздов А.А. и др./ Под ред. Лунина В.В.
- Тема: § 13. Амин
- 11.03.2018
- 1282
- 1

Рейтинг:
4 из 5
- 05.03.2018
- 4412
- 89



- 05.02.2018
- 1371
- 27

Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Экономика: инструменты контроллинга»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Страхование и актуарные расчеты»
-
Курс повышения квалификации «Источники финансов»
-
Курс профессиональной переподготовки «Организация деятельности помощника-референта руководителя со знанием иностранных языков»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Корпоративная культура как фактор эффективности современной организации»
-
Курс профессиональной переподготовки «Организация деятельности специалиста оценщика-эксперта по оценке имущества»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
II. ОВР в органической химии.
Степени окисления атомов в органических соединениях.
|
Углеводороды |
Спирты |
Альдегиды, кетоны |
Карбоновые кислоты |
|
-2 +1 -2 +1 CH2=CH2 |
-2 +1 -2 +1 CH3-OH |
0 ⸗O-2 0 -2 H-C-H (HCHO) |
+2 -2-2 HCOOH |
|
-2 -1 -3 CH2=CH-CH3 |
-3 -1 -2 CH3-CH2-OH |
-3 +1 ⸗O-2 CH3-C- H -3 +1 -2 (CH3CHO) |
-3 +3-2- 2 CH3COOH |
|
-3 -1 -1 -3 CH3-CH=CH-CH3 |
-1 -1 CH2-CH2 І І OH OH |
-3 +2 -3 CH3-C- CH3 ǁ O-2 |
+3 -2 -2 C OOH І+3-2-2 C OOH |
|
-3 0 -1 -3 CH3-C=CH-CH3 І -3 CH3 |
-1 0 -3 CH2-CH-CH3 І І OH OH |
||
|
-3 0 0 -3 CH3-CH2-CH-CH3 І І OH OH |
Углеводороды.
В кислой среде:
1) CH2=CH2 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + H2O + CO2
-2 -2 +7 +2 +4
5CH2=CH2 + 12KMnO4 + 18H2SO4 → 6K2SO4 + 12MnSO4 + 10CO2 + 28H2O
2C-2 – 12e— → 2C+4 | 12 | 5 – окисляется, восстановитель;
Mn+7 + 5e— → Mn+2 | 5 |12 — восстанавливается, окислитель
2) C2H2 – окисляется окислителями в кислой среде до щавелевой кислоты.
-1 -1 k. H2SO4, KMnO4 (K2Cr2O7) COOH
CHΞCH ―――――――→ І (HOOC-COOH)
COOH
-2 -1 -3 +7 +4 -3 +3
3)CH2=CH-CH3 + 2KMnO4 + 3H2SO4 → CO2 + CH3-COOH + K2SO4 +
+2
2MnSO4 + 4H2O
Mn+7 + 5e— → Mn+2 | 5e— | 2 — восст-тся, окислитель;
C-1 — 4e— → C+3 |} 10e—| 1 — окисляется, восстановитель
-3 -1 -1 -3 +7 -3 +3
4) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3-COOH + 4K2SO4 +
+2
8MnSO4 + 12H2O
Mn+7 + 5e— → Mn+2 |4| | 8Mn+7 +40e— →8Mn+2 — восстанавливается, окислитель;
| |× 2 |
C-1 — 4e— → C+3 |5| | 10C-1 — 40e— → 10C+3 — окисляется, восстановитель
-3 0 -1 -3 -3 +3 -2 -2 -3 +2 -3
5) CH3-C‡ CH-CH3 + 6KMnO4 + 9H2SO4 → 5CH3-COOH + 5CH3-C-CH3
+ 3K2SO4 + 6MnSO4 +9H2O
| ǁ
-3 O-2
CH3
Mn+7 + 5e— → Mn+2 |× 6| 6Mn+7+30e—→ 6Mn+2
C-1 — 4e— → C+3 | | 5C-1— 20e— → 5C+3
C0 — 2e— → C+2 | | 5C0 10e— → 5C+2
↙͞ ͞͞͞ ͞ ͞͞ ͞ ͞ ͞ ͞ ͞ ͞͞ ͞ ͞↘
-1 -1 +7 C+3OOH +2
6) 5CHΞCH + 8KMnO4 + 12H2SO4 → 5 І +4K2SO4 +8MnSO4+ 12H2O C+3OOH
только ацетилен!
2C-1 — 8e— → 2C+3 |× 5
Mn+7 + 5e— → Mn+2 |× 8
Гомологи ацетилена окисляются до одноосновных карбоновых кислот.
-1 0 -3 +7 -3 +3 +4 +2
7)5CHΞC-CH3 +8KMnO4 +12H2SO4 → 5CH3-COOH +5CO2 +4K2SO4+ 8MnSO4 + 12H2O
—3 0 0 -3 +7 -3 +3 +2

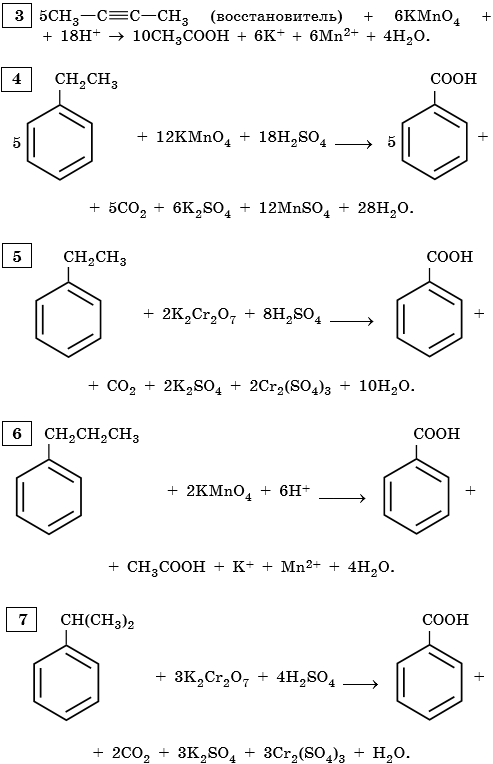
Ароматические углеводороды.
-1 -3 +7 -1 +3 +2
9) 5C6H5 -CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Mn+7 + 5e— → Mn+2 |× 6
C-3 — 6e— → C+3 |× 5
—1 -2 -3 +7 -1 +3 +4 +2
10) 5C6H5 -CH2CH3 + 12KMnO4 + 18H2SO4 → 5C6H5-COOH + 5CO2 + 6K2SO4 + 12MnSO4 + 28H2O
Mn+7 + 5e— → Mn+2 | 5e—|× 12
C-2 — 6e— → C+4 | |
|}12e—|× 5
C-3 — 6e— → C+3 | |
-1 -3 +7 -1 +3 +2
11) 5 C6H4(CH3)2 + 12KMnO4 + 18H2SO4 → 5 C6H4(COOH)2 + 6K2SO4 + 12MnSO4 + 28H2O
1,2-диметилбензол орто-фталевая кислота
2C-3 — 12e— → 2C+3 |12e—|× 5
Mn+7 + 5e— → Mn+2 | 5e— |× 12
-1 -1 -2 +7 -1 +3 +4 +2
12) C6H5—CH=CH2 + 2KMnO4 + 3H2SO4 → C6H5COOH + CO2 + K2SO4 + 2MnSO4 + 4H2O
Mn+7 + 5e— → Mn+2 | 5e—|× 2
C-1 — 4e— → C+3 | |
|} 10e—|× 1
C-2 — 6e— → C+4 | |
В нейтральной среде:
-2 -2 +7 -1 -1 +4
1) 3CH2=CH2 + 2KMnO4 + 4H2O → CH2-CH2 + 2MnO2 + 2KOH 2C-2 — 2e— → 2C-1 |× 3
І І Mn+7 + 3e— → Mn+4 |× 1
OH OH
2) 3CH3–CH=CH– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– CH3 + 2MnO2 + 2KOH
І І
OH OH
3) C6H5—CH=CH2 + 2KMnO4 + 4H2O → C6H5—CH– CH2 + 2MnO2 + 2KOH
І І
OH OH
00C
4) 3CH3–CH=CH2 + 2KMnO4 + 4H2O —→ 3CH3–CH–CH + 2MnO2 + 2KOH
І І
OH OH
C+3OOK
5) 3CHΞCH + 8KMnO4 → 5 І + 8MnO2 + 2KOH + 2H2O
C+3OOK
только ацетилен!
6) 3CH3–CH=CH–СH2– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– СH2– CH3 + 2MnO2 + 2KOH
І І
OH OH
7) CH3–CH=C– CH3 + 2KMnO4 → CH3-C- CH3 + CH3-COOH + 2MnO2 + 2KOH
І ǁ
CH3 O
Реакция присоединения против правила Марковникова:
+ — H2O2
CH3—CH=CH2 + HBr ——→ CH3—CH2—CH2 — 1-бромпропан
|
Br
При наличии атома хлора в молекуле реакция также идёт против правила, т.к. меняется поляризация молекулы:
— + + —
CH2—CH=CH2 + HBr ——→ CH2—CH2—CH2 — 1-бром-3-хлорпропан
| | |
Cl Cl Br
Спирты.
-3 -1 -2 +7 -3 +3 +2
1) CH3-CH2-OH + 4KMnO4 + 6H2SO4 → 5CH3-COOH + 2K2SO4 + 4MnSO4 + 11H2O
-3 -1 -2 +6 -3 +3 +3
2) CH3-CH2-OH + 2K2Cr2O7 + 8H2SO4 → 3CH3-COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
+6 -2 +2 +3
3) 2K2Cr2O7 + 3CH3OH + 8H2SO4 → HCOOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
-3 +1 -2 -3 +7 -3 +2 -2 -3 +4
4) 5CH3-CH-CH2-CH3 + 2KMnO4 → 5CH3-C-CH2-CH3 + 2MnO2 + 2KOH + 4H2O
І ǁ
OH O
-1 -1 -2 +7 -1 +3 +2
5) 5C6H5 -CH2OH + 4KMnO4 + 6H2SO4 → 5C6H5-COOH + 2K2SO4 + 4MnSO4 + 11H2O
-2 +7 +4 +2
6) 5CH3-OH + 6KMnO4 + 9H2SO4 → 5CO2 + 3K2SO4 + 6MnSO4 + 19H2O
-3 -1 -2 +7 +4 -3 +3
7) 3CH3-CH2-OH + 4KMnO4 → 4MnO2 + KOH + 4H2O + 3CH3-COOK
Альдегиды.
0 +7 +4 +2
1) 5HCHO + 4KMnO4 + 6H2SO4 → 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O
-3 +1 +6 -3 +3 +3
2) 3CH3CHO + K2Cr2O7 + 4H2SO4 → 3CH3-COOH + Cr2(SO4)3 + K2SO4 + 4H2O
-3 +1 +7 -3 +3 +2
3) 5CH3CHO + 2KMnO4 + 3H2SO4 → 5CH3-COOH + K2SO4 + 2MnSO4 + 3H2O
-3 +1 +7 -3 +3 +4
4) 3CH3CHO + 2KMnO4 + KOH → 3CH3-COOK + 2MnO2 + 2H2O
OH
|
5) HC-(CH2)7 -CH3 HC-(CH2)7 -CH3
3 ǁ + 2KMnO4 + 4H2O → 3 | + 2KOH + 2MnO2
HC-(CH2)7 –COOH HC-(CH2)7 -COOH
стеариновая кислота |
OH
9,10 — диоксистеариновая кислота
Другие реакции органических соединений.
Углеводороды.
t0, кат.
1) 2C4H10 + 5 O2 ——→ 4CH3-COOH + 2H2O
2) 3CH3–CH=CH– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– CH3 + 2MnO2 + 2KOH
І І
OH OH
Pd+2
3) 2CH2=CH2 + O2 —→ 2CH3CHO
Ароматические углеводороды.
1) 5С6H4ClC2H5 +12KMnO4 +18H2SO4 → 5C6H4СlCOOH+ 5CO2 +6K2SO4 +12MnSO4+ 28H2O
(орто-,пара- изомеры) (орто-, пара- изомеры)
t0
2) 5 O2N-С6H4-CH3 + 6KMnO4 + 9H2SO4 → 5 O2N-С6H4-COOH + 3K2SO4 + 6MnSO4 + 14H2O
(пара- изомер) (пара- изомер)
3) 5С6H5CH(CH3)2 +18KMnO4 + 27H2SO4 →5C6H5COOH +10CO2+9K2SO4 +18MnSO4+48H2O
KMnO4
4) CHΞC-С6H4-CH3 ——→ С6H4-(COOH)2
(орто — изомер) орто – фталевая кислота
5) 3С6H5-CH2 -CH=CH2 + 2KMnO4 + 4H2O → 3С6H5-CH2 –CH–CH2 + 2KOH + 2H2O
| |
OH OH
6) 5C6H5—CH2 — CH=CH2 + 16KMnO4 + 24H2SO4 → 5C6H5COOH + 10CO2 + 8K2SO4 + 16MnSO4 + 34H2O
+ —
7) O2N-С6H4-COOH + 3Fe + 7HCl → С6H4(COOH)NH3Cl + 3FeCl3 + 2H2O
Получение.
1) Al4C3 + 12H2O → 4Al(OH)4 + 3CH4
2) Al4C3 + 12HCl → 4AlCl3 + 3CH4
3) CaC2 + 2H2O → Ca(OH)2 + C2H2
Спирты.
1) 3CH2–CH=CH–CH2 + 2KMnO4 + 4H2O → 3CH2–CH–CH–CH2 + 2KOH + 2MnO2
| | | | | |
OH OH OH OH OH OH
2) 3CH3-CH2-OH + K2Cr2O7 + 4H2SO4 → 3CH3-CHO + 2Cr2(SO4)3 + K2SO4 + 7H2O
ацеталь
Альдегиды.
1) CH3CHO + 2NaMnO4 + 3NaOH → CH3-COONa + 2Na2MnO4 + 2H2O
Карбоновые кислоты.
+6 +3 +4 +3
1)K2Cr2O7 +3HOOC-COOH +4H2SO4 → 6CO2 + Cr2(SO4)3 + K2SO4 +7H2O
Соли карбоновых кислот.
электролиз
1) 2CH3-COONa ———→ H2 + C2H6 + 2NaOH + 2CO2
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д30 C1 № 1
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
2
Задания Д30 C1 № 49
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
3
Задания Д30 C1 № 226
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
4
Задания Д30 C1 № 269
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
5
Задания Д30 C1 № 312
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
Пройти тестирование по этим заданиям
Задания 30 (2021). Окислительно-восстановительные реакции.
Источник текстов условий задач — паблик Вконтакте И.С. Ермолаева «ЕГЭ по химии на максимум».
Авторы решений: Знайченко Е.И.
Задание №1
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция,в ходе которой образуется бесцветный раствор и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
1⋅| P-3 – 8e ⟶ P+5
8⋅| N+5 +1e ⟶ N+4
P-3 (PH3) – восстановитель;
N+5 (NO2) – окислитель.
Задание №2
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
гидрокарбонат калия, нитрат алюминия, азотная кислота, оксид фосфора(V), сульфид меди(II), гидроксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется окрашенный раствор, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
CuS + 10HNO3 = Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
1⋅| S-2 – 8e ⟶ S+6
8⋅| N+5 + 1e ⟶ N+4
S-2 (CuS) – восстановитель;
N+5 (HNO3) – окислитель
(допускается альтернативный вариант записи:
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O)
Задание №3
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется в растворе две соли и кислота, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 +2H2SO4
5⋅| S+4 -2e ⟶ S+6
2⋅| Mn+7 +5e ⟶ Mn+2
S+4 (SO2) – восстановитель;
Mn+7 (KMnO4) – окислитель
Задание №4
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется зеленый раствор, не образуется осадок, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
2NaMnO4 + NaNO2 +2NaOH = 2Na2MnO4 +NaNO3 +H2O
1⋅| N+3 -2e ⟶ N+5
2⋅| Mn+7 + 1e ⟶ Mn+6
N+3 (NaNO2) – восстановитель;
Mn+7 (NaMnO4) – окислитель
Задание №5
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
аммиак, перманганат калия, гидросульфат лития, нитрат стронция, йод, сульфит натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
2KMnO4 + 3Na2SO3 +H2O = 2KOH + 2MnO2 + 3Na2SO4
3⋅| S+4 -2e ⟶ S+6
2⋅| Mn+7 +3e ⟶ Mn+4
S+4 (Na2SO3) – восстановитель;
Mn+7 (KMnO4) – окислитель
[adsp-pro-3]
Задание №6
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Первый вариант ответа:
2KMnO4 + 3CaSO3 + H2O = 2KOH + 2MnO2 + 3CaSO4
3⋅| S+4 -2e ⟶ S+6
2⋅| Mn+7 + 3e ⟶ Mn+4
S+4 (CaSO3) – восстановитель;
Mn+7 (KMnO4) – окислитель
Второй вариант ответа:
2H2O + 2KMnO4 + 3Mn(NO3)2 = 5MnO2 + 2KNO3 + 4HNO3
3⋅| Mn+2 -2e ⟶ Mn+4
2⋅| Mn+7 + 3e ⟶ Mn+4
Mn+2 (Mn(NO3)2) – восстановитель;
Mn+7 (KMnO4) — окислитель
Задание №7
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота (разб.), нитрат калия, медь. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой выделяется газ, не образуется осадок, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Cu + 2KNO3 + 2H2SO4 = CuSO4 + K2SO4 +2NO2 + 2H2O
1⋅| Cu0 -2e ⟶ Cu+2
2⋅| N+5 +1e ⟶ N+4
Cu0 – восстановитель;
N+5 (KNO3) – окислитель
Задание №8
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой в растворе образуются три соли, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
3⋅|2Fe+2 – 2e- → 2Fe+3
1⋅|2Cr+6 + 6e— → 2Cr+3
Fe+2(FeSO4) – восстановитель, Cr+6(K2Cr2O7) — окислитель
Задание №9
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется простое вещество, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
2KMnO4 +16HBr = 2KBr + 2MnBr2 + 5Br2 +8H2O
5⋅| 2Br-1 -2e ⟶ Br20
2⋅| Mn+7 +5e ⟶ Mn+2
Br-1 (HBr) –восстановитель;
Mn+7 (KMnO4) – окислитель
Задание №10
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которых образуется два кислотных оксида, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
2⋅| С0 -4e ⟶ С4
1⋅| S+6 +2e ⟶ S+4
C0 – восстановитель;
S+6 (H2SO4) – окислитель
[adsp-pro-3]
Задание №11
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия . Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется осадок, выделяется газ, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
2KMnO4 + 2NH3 = 2KOH + N2 + 2MnO2 +2H2O
2⋅| 2N-3 -6e ⟶ N20
1⋅| Mn+7 +3e ⟶ Mn+4
N-3 (NH3) – восстановитель;
Mn+7 (KMnO4) – окислитель
Задание №12
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, йод, фторид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется кислота, одна молекула восстановителя отдает десять электронов, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
10HNO3 + I2 = 2HIO3 + 10NO2 + 4H2O
1⋅| I20 -10e ⟶2I+5
10⋅| N+5 + 1e ⟶ N+4
I20 – восстановитель;
N+5 (HNO3) – окислитель
Задание №13
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид серы(VI), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется щелочь, выделяется газ, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
3Na2O2 +2NH3 = 6NaOH + N2
1⋅| 2N-3 -6e ⟶ N20
3⋅| 2O-1 +2e ⟶ 2O-2
N-3 (NH3) – восстановитель;
O-1 (Na2O2) – окислитель
Задание №14
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
4H2SO4 + PH3 = H3PO4 + 4SO2 +4H2O
4⋅| P-3 -8e ⟶ P+5
1⋅| S+6 +2e ⟶ S+4
P-3 (PH3) – восстановитель;
S+6 (H2SO4) – окислитель
Задание №15
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия. Допустимо использование водных растворов солей.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
1⋅| S+4 -2e ⟶ S+6
1⋅| Br20 +2e ⟶ 2Br -1
S+4 (SO2) – восстановитель;
Br20 – окислитель
[adsp-pro-3]
[adsp-pro-10]
Задания 30 и 31 из реального ЕГЭ по химии-2021 — ответы и решения, все задачи на окислительно-восстановительную реакцию и реакции ионного обмена из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.»
Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания.
Примечания:
1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества.
2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации.
3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту.
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
Задание 30. Из предложенного перечня веществ выберите те, которые вступают в окислительно-восстановительную реакцию с образованием бесцветного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня веществ выберите те, между которыми реакция ионного обмена протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
1 | P-3 — 8e → P+5
8 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Фосфор в степени окисления -3 (или фосфин) является восстановителем.
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Ba2+ + 2OH— + 2H+ + 2NO3— = Ba2+ + 2NO3— + 2H2O
OH— + H+ = H2O
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием окрашенного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
8 | N+5 + e → N+4
1 | S-2 — 8e → S+6
Азот в степени окисления +5 (или азотная кислота) является окислителем .
Сера в степени окисления -2 (или сульфид меди (II)) является восстановителем.
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием в растворе двух солей и кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена и происходит растворение белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2 | Mn+7 + 5e → Mn+2
5 | S+4 — 2e → S+6
Марганец в степени окисления +7 (или перманганат калия) является окислителем
Сера в степени окисления +4 (или оксид серы (IV)) является восстановителем
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
Mg(OH)2 + 2H+ + 2Br— = Mg2+ + 2Br— + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием зеленого раствора и без образования осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми реакция ионного обмена протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NaMnO4 + NaNO2 + 2NaOH = 2Na2MnO4 + NaNO3 + H2O
2 | Mn+7 + 1e → Mn+6
1 | N+3 — 2e → N+5
Марганец в степени окисления +7 (или перманганат натрия) является окислителем.
Азот в степени окисления +3 (или нитрит натрия) является восстановителем.
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2
HCO3— + H+ = H2O + CO2
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого вещества и без выделения газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит натрия) является восстановителем
LiHSO4 + Sr(NO3)2 = SrSO4 + LiNO3 + HNO3
Li+ + HSO4— + Sr2+ + 2NO3— = SrSO4 + Li+ + H+ + 2NO3—
Sr2+ + HSO4— = SrSO4 + H+
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3CaSO3 + H2O = 2MnO2 + 3CaSO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит кальция) является восстановителем
K2HPO4 + 2HCl = 2KCl + H3PO4
2K+ + HPO42- + 2H+ + 2Cl— = 2K+ + 2Cl— + H3PO4
HPO42- + 2H+ = H3PO4
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми в растворе протекает окислительно-восстановительная реакция с образованием трех солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
1 | Cr+6 + 3e → Cr+3
3 | Fe+2 — e → Fe+3
Хром в степени окисления + 6 (или дихромат калия) является окислителем
Железо в степени окисления + 2 (или сульфат железа (II)) является восстановителем
FeSO4 + (NH4)2CO3 = FeCO3 + (NH4)2SO4
Fe2+ + SO42- + 2NH4+ + CO32- = FeCO3 + 2NH4+ + SO42-
Fe2+ + CO32- = FeCO3
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и не сопровождается выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Cu + 2KNO3 + 2H2SO4 = CuSO4 + 2NO2 + K2SO4 + 2H2O
1 | Cu0 — 2e → Cu+2
2 | N+5 + e → N+4
Азот в степени окисления + 5 (или нитрат калия) является окислителем
Медь в степени окисления 0 является восстановителем
СaBr2 + (NH4)2HPO4 = CaHPO4 + 2NH4Br
Ca2+ + 2Br— + 2NH4+ + HPO42- = CaHPO4 + 2NH4+ + 2Br—
Ca2+ + HPO42- = CaHPO4
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 16HBr = 2MnBr2 + 2KBr + 5Br2 + 8H2O
2 | Mn+7 + 5e → Mn+2
5 | 2Br— — 2e → Br20
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Бром в степени окисления -1 (или бромоводород) является восстановителем
(CH3COO)2Ba + KHSO4 = BaSO4 + CH3COOK + CH3COOH
Ba2+ + 2CH3COO— + K+ + HSO4— = BaSO4 + CH3COO— + K+ + CH3COOH
Ba2+ + CH3COO— + HSO4— = BaSO4 + CH3COOH
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием двух кислотных оксидов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
C + H2SO4 = 2CO2 + 2SO2 + H2O
1 | C0 — 4e → C+4
2 | S+6 + 2e → S+4
Сера в степени окисления + 6 (или серная кислота) является окислителем
Углерод в степени окисления 0 является восстановителем
FeCl3 + 3NaHCO3 = Fe(OH)3 + 3CO2 + 3NaCl
Fe3+ + 3Cl— + 3Na+ + 3HCO3— = Fe(OH)3 + 3CO2 + 3Na+ + 3Cl—
Fe3+ + 3HCO3— = Fe(OH)3 + 3CO2
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
1 | 2N-3 — 6e → N20
2 | Mn+7 + 3e → Mn+4
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Азот в степени окисления -3 (или аммиак) является восстановителем
3NaH2PO4 + 6KOH = 2K3PO4 + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 6K+ + 6OH— = 6K+ + 2PO43- + 3Na+ + PO43- + 6H2O
H2PO4— + 2OH— = PO43- + 2H2O
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. При этом одна молекула восстановителя . отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
I2 + 10HNO3 = 10NO2 + 2HIO3 + 4H2O
1 | I20 — 10e → 2I—
10 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем
Йод в степени окисления 0 является восстановителем
NH4F + HNO3 = NH4NO3 + HF
NH4+ + F— + H+ + NO3— = NH4+ + NO3— + HF
F— + H+ = HF
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием щелочи и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием средней соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 3Na2O2 = N2 + 6NaOH
1 | 2N-3 — 6e → N20
6 | O-1 + 1e → O-2
Азот в степени окисления -3 (или аммиак) является восстановителем
Кислород в степени окисления -1 (или пероксид натрия) является окислителем
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Na+ + H2PO4— + 2Na+ + 2OH— = 3Na+ + PO43- + 2H2O
H2PO4— + 2OH— = PO43- + 2H2O
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием бесцветного раствора кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием окрашенного раствора и без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
1 | P-3 — 8e → P+5
4 | S+6 + 2e → S+4
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2Cr(OH)3 + 6H+ + 3SO42- = 2Cr3+ + 3SO42- + 6H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает в растворе с образованием двух кислот. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
1 | S+4 — 2e → S+6
1 | Br20 + 2e → 2Br—
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2


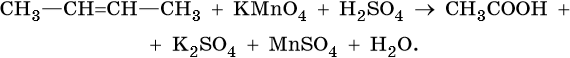
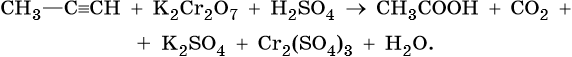
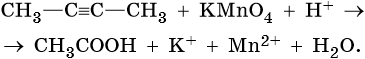
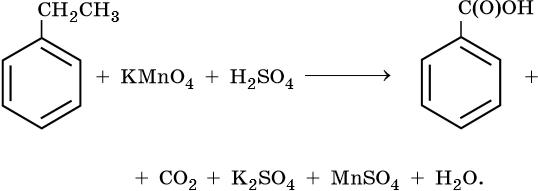
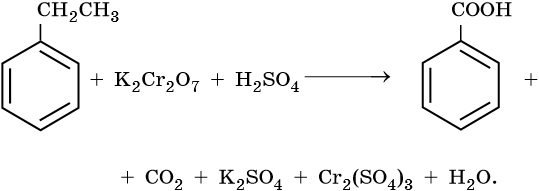
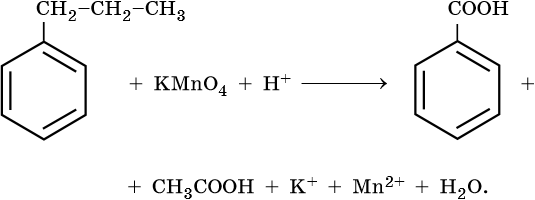
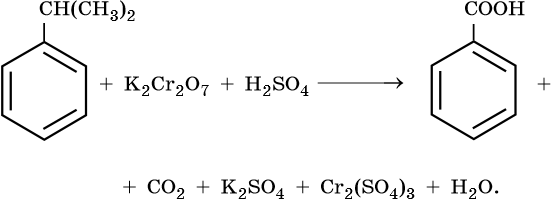
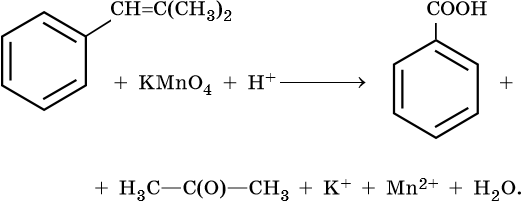
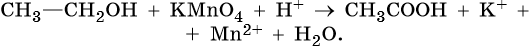
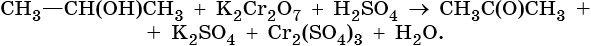
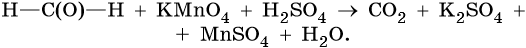
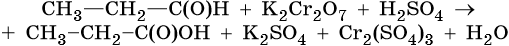
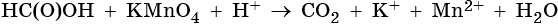
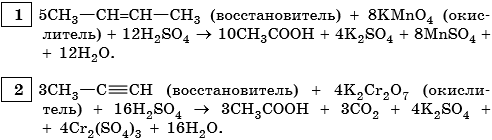



![КMnO4K2Cr2O7Основные окислителиMnSO4MnO2K2MnO4Cr2(SO4)3Cr(OH)3K3[Cr(OH)6]O3 и... КMnO4K2Cr2O7Основные окислителиMnSO4MnO2K2MnO4Cr2(SO4)3Cr(OH)3K3[Cr(OH)6]O3 и...](https://documents.infourok.ru/8509b6c1-c05a-4b74-b1c8-29c15f3150e5/0/slide_05.jpg)




































![Реакции, вызывающие трудностиC6H5-NH2+HCl=[C6H5-NH3]ClC6H5-NH2+CH3Br=[C6H5-N... Реакции, вызывающие трудностиC6H5-NH2+HCl=[C6H5-NH3]ClC6H5-NH2+CH3Br=[C6H5-N...](https://documents.infourok.ru/8509b6c1-c05a-4b74-b1c8-29c15f3150e5/0/slide_42.jpg)



