Скачать материал

Скачать материал


- Сейчас обучается 30 человек из 23 регионов


- Сейчас обучается 113 человек из 49 регионов


- Курс добавлен 13.12.2022


Описание презентации по отдельным слайдам:
-
1 слайд
Окислительно-восстановительные реакции. Задание 30 ЕГЭ по химии.
Учитель химии МАОУ «Лицей №9» г. Пермь
Бондарцова Ксения Владимировна -
2 слайд
Источник: http://fipi.ru/sites/default/files/document/1566460019/himiya_2019.pdf
-
3 слайд
Возможные причины низкого процента выполнения задания 30
Большой объём необходимых для выполнения задания знаний;
Разрозненность теоретического материала;
Отсутствие алгоритма действий при выполнении задания. -
4 слайд
Цель: повысить уровень знаний учащихся в теме окислительно-восстановительные реакции.
Задачи:
разобрать основные окислители/восстановители и продукты их восстановления/окисления, оформить в доступной форме (в виде таблицы);
Потренироваться на заданиях из тренировочных и реальных вариантов ЕГЭ разных лет;
Отработать алгоритм написания электронного баланса и расстановки коэффициентов. -
5 слайд
Для наилучшего усвоения материала, во время просмотра презентации учащиеся заполняют таблицу по окислителям и восстановителям
-
6 слайд
Вид и формулировка задания 30:
-
-
8 слайд
Важнейшие окислители
Cl2, Br2, O2 @;
HN+5O3 @, H2S+6O4(конц.) @;
KMn+7O4, Mn+4O2@;
K2Cr+62O7, K2Cr+6O4@;
KCl+1O, KCl+5O3 @;
H2O2,соединения Fe(III)@ -
9 слайд
Простые вещества неметаллы в процессе восстановления приобретают низшую степень окисления:
Cl20 + 2e-→ 2 Cl-
Br20 + 2e-→ 2 Br-
O20 + 4e-→ 2 O-2⇑
-
10 слайд
Изменение степени окисления азотной кислоты
-
11 слайд
Изменение степени окисления азотной кислоты
Al, Fe, Cr, Co, Ni – в концентрированных растворах пассивируются, реакция идёт при t;
Au, Pt, Ir, Rh – реакция не идёт. -
12 слайд
Взаимодействие концентрированной азотной кислоты с неметаллами
Взаимодействие с сульфидами:
HNO3 (конц) окисляет углерод, серу и фосфор до высших кислот:
S + 6 HNO3 = H2SO4 + 6NO2+ 2H2O;
P + 5 HNO3 = H3PO4 + 5NO2 +H2O. -
13 слайд
Нитрат-ион проявляет окислительные свойства не только в кислой, но и щелочной среде, при этом в растворах NO3 восстанавливается активными металлами до NH3:
4Zn + KNO3 + 7 KOH + H2O → 4K2[Zn(OH)4] + NH3
⇑ -
14 слайд
Концентрированная серная кислота с металлами:
-
15 слайд
При взаимодействии с углеродом концентрированная серная кислота реагирует с выделением сернистого газа:
С + 2H2SO4 = CO2 + 2SO2 + 2H2O
⇑ -
16 слайд
Окислительные свойства перманганата калия в зависимости от среды
-
17 слайд
Окислительные свойства Mn+4O2
MnO2 + 4HCl → Cl2 + MnCl2 + H2O
⇑ -
18 слайд
Хромат и дихромат калия
-
19 слайд
Хромат и дихромат калия в зависимости от среды восстанавливаются следующим образом:
⇑ -
20 слайд
Кислородсодержащие кислоты галогенов и их соли восстанавливаются до степени окисления -1:
-
21 слайд
Окислительная способность кислот падает с возрастанием силы кислоты
⇑ -
22 слайд
H2O2 – окислитель в реакциях с иодидами (KI), сульфидами (PbS), нитритами (KNO2), сульфитами (NaSO3), соединениями Cr+3 – восстанавливается до H2O
⇑ -
23 слайд
Соединения железа (III)
-
24 слайд
Соединения железа (III)
⇑ -
25 слайд
Важнейшие восстановители
металлы, неметаллы: S, P, C@;
Сульфиды (S-2), иодиды (I-), бромиды (Br-), а также H2S-2, HI-, HBr-, HCl-,
N-3H3, P-3H3@;
Нитриты (N+4O2), сульфиты (S+4O3);
соединения Fe(II)@, Cr(III), соединения Cr(II)@, Cu(I);
Н2, C, С+2О, H2O-12@ -
26 слайд
Вещества, в которых элемент находится в низшей степени окисления, такие как сульфиды (S-2), иодиды (I-), бромиды (Br-), а также H2S-2, HI-, HBr-,HCl-,N-3H3, P-3H3…
Восстанавливаются до 0 степени окисления, т. е. образуются простые вещества -
-
28 слайд
Окисление железа
-
-
30 слайд
Азот и сера в нитритах и сульфитах приобретают высшую степень окисления
⇑ -
-
32 слайд
H2O-12 – окисляется до кислорода.
⇑ -
33 слайд
Простые вещества неметаллы
⇑ -
34 слайд
Алгоритм написания ОВР:
Найти в списке возможные окислители и восстановители;
Определить есть ли необходимость в указании реактива среды (кислоты, основания);
Написать уравнение реакции, расставить степени окисления в окислителях, восстановителях и продуктах их взаимодействия;
Написать электронный баланс, вычислить коэффициенты, согласно отданным и принятым электронам;
Выписать окислитель и восстановитель с указанием степени окисления. -
-
-
-
38 слайд
Для выполнения задания используйте следующий перечень веществ: гипохлорит калия, гидроксид калия, сульфат железа (III), оксид хрома (III), оксид магния. Допустимо использование водных растворов.
-
39 слайд
Полезные ссылки:
https://chemrise.ru/theory/rules_chromium_11
https://internat.msu.ru/media/uploads/2012/05/Vebinar-MGU_13_04_2018_1-StahanovaSV.pdf
https://vk.com/chemistry_100
Краткое описание документа:
Муниципальное автономное образовательное учреждение
«Лицей № 9» г. Перми, Пермский край
Методическая разработка практического занятия на тему:
«Окислительно-восстановительные реакции. Задание 30 ЕГЭ.»
Подготовила: учитель химии
Бондарцова К. В.
Пермь, 2019
Согласно отчету на сайте ФИПИ в 2019 году с заданием 30 ЕГЭ по химии справились 36,8 % учеников сдававших экзамен, также отмечено, что задание 30 играет важную роль в дифференциации учащихся по знаниям. Причинами такого низкого процента выполнения задания могут быть:
1) Большой объём необходимых для выполнения задания знаний;
2) Разрозненность теоретического материала;
3) Отсутствие алгоритма действий при выполнении задания.
В данном материале представлены материалы по структурированию знаний об окислительно-восстановительных реакциях и их применению на практике. Материал рассчитан для применения его на занятиях в 11 классе, на серию уроков. Предполагается, что учащиеся уже имеют определённый набор знаний по свойствам химических веществ, знают названия веществ, умеют составлять формулы веществ по названиям и умеют определять степени окисления в сложных веществах, знают элементы с постоянными и переменными степенями окисления.
Цель: повысить уровень знаний учащихся в теме ОВР.
Задачи:
— разобрать основные окислители/восстановители и продукты их восстановления/окисления, оформить в доступной форме (в виде таблицы);
— потренироваться на заданиях из тренировочных и реальных вариантов ЕГЭ разных лет;
— отработать алгоритм написания электронного баланса и расстановки коэффициентов.
Для наилучшего усвоения материала, во время просмотра презентации учащиеся заполняют таблицу по окислителям и восстановителям, примерный вид таблицы представлен ниже:
|
Окислители |
|||
|
Элемент (в-во) |
Условия |
Восстанавливается до |
Пример реакции |
|
Простые вещества неметаллы галогены, O2 |
Cl20 + 2e—→ 2 Cl— Br20 + 2e—→ 2 Br— O20 + 4e—→ 2 O-2 |
Br2+ SO2→H2SO4 + HBr+ H2O ! Cl2+KOH→KCl + KClO3+H2O |
|
|
HN+5O3 |
N+4O2 |
(Li-Pd) + HNO3(сильноконц)→ MeNO3+ NO2 + H2O (Сu-Pd) + HNO3( конц)→ MeNO3+ NO2 + H2O |
|
|
N+2O |
(Mn-Pb) + HNO3( конц)→ MeNO3+ NO + H2O (Сu-Pd) + HNO3( разб)→ MeNO3+ NO + H2O |
||
|
N+12O |
(Li-Al) + HNO3(конц)→ MeNO3+ N2O + H2O (Mn-Pb) + HNO3( разб)→ MeNO3+ N2O + H2O |
||
|
N02 |
(Li-Al) + HNO3(разб)→ MeNO3+ N2 + H2O (Mn-Pb) + HNO3( очразб)→ MeNO3+ N2 + H2O |
||
|
N-3H4NO3 |
HNO3(очразб)+ (Li-Al) → MeNO3+ NH4NO3 + H2O; |
||
|
KN+5O3 |
N-3H3 |
4Zn + KNO3 + 7 KOH + H2O → 4K2[Zn(OH)4] + NH3 KNO3+4Mg + 6H2O→ NH3 + Mg(OH)2 + KOH |
|
|
Сплавление в щелочной среде |
N+3O21- |
KNO3+ MnO2+ 2KOH→ KNO2+ K2MnO4+ H2O |
|
|
H2S+6O4(конц) |
Сильные восстановители Li- Zn, HI, KI |
H2S-2 |
Ca + H2SO4(конц) → CaSO4+ H2S + H2O |
|
Сd-Pb |
S0 |
||
|
Слабые восстановители:S, С, P, средне- и малоактивные металлы (Fe, Cu, Ag), CuI, H2S (соли), соли Fe(II) |
S+4O2 |
||
|
KMn+7O4 |
H+ |
Mn2+ |
|
|
H2O |
Mn+4O2 |
||
|
OH— |
Mn+6O42- |
||
|
Mn+4O2 |
H+ |
Mn2+ |
|
|
K2Cr+62O7, K2Cr+6O4 |
H+ |
Cr3+ (соли) |
|
|
H2O |
Cr3+(OH)3 |
||
|
OH— |
[Cr3+(OH)6]3- |
||
|
HCl+1O, HCl+5O3 KCl+1O, KCl+5O3 |
Cl-1 |
||
|
H2O-12 |
иодидами (KI), сульфидами (PbS), нитритами (KNO2), сульфитами (NaSO3), соед. Cr+3 |
H2O-2 |
|
|
Соединения железа (III) |
иодидами (KI), сульфидами (PbS), SO2, металлы |
Соединения железа (II) |
|
|
Восстановители |
|||
|
Элемент(в-во) |
Условия |
Oкисляется до |
Пример реакции |
|
S0, P0, C0 |
Кислоты-окислители |
S+4, P+5, С+4, |
|
|
сульфиды (S-2), иодиды (I—), бромиды (Br—), а также H2S-2, HI—, HBr—,HCl—,N-3H3, P-3H3 |
При использовании сильных окислителей (KMnO4, HNO3,K2Cr+62O7) S-2→ S+6 (сульфаты, серная кислота) |
Восстанавливаются до 0 степени окисления, т. е. образуются простые вещества, кроме P-3→ P+5 |
|
|
Нитриты (N+4O2—), сульфиты (S+4O32-) |
До высшей степени окисления |
||
|
H2O-12 |
Типичные окислители KMnO4, галогены, кислородсодержащие кислоты хлора и их соли,нитраты, K2Cr+62O7 |
O20 |
|
|
Fe0, Fe+2, Fe+3 |
Fe+6 |
||
|
Fe(II) |
Fe(III) |
||
|
Cr+2 |
Cr+3 |
||
|
Cr+3 |
Cr+6 Хроматы |
Во время написания окислительно-восстановительных реакций предлагается пользоваться следующим алгоритмом:
- Найти в списке возможные окислители и восстановители;
- -Определить есть ли необходимость в указании реактива среды (кислоты, основания);
- -Написать уравнение реакции, расставить степени окисления в окислителях, восстановителях и продуктах их взаимодействия;
- -Написать электронный баланс, вычислить коэффициенты, согласно отданным и принятым электронам;
- -Выписать окислитель и восстановитель с указанием степени окисления.
- Данный практикум может помочь одиннадцатиклассникам в написании 30 задания
ЕГЭ по химии.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 154 748 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы

- 30.10.2019
- 391
- 0

- 30.10.2019
- 225
- 0

- 30.10.2019
- 143
- 0



- 30.10.2019
- 3845
- 541


Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Введение в сетевые технологии»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС медицинских направлений подготовки»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Организация маркетинга в туризме»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Риск-менеджмент организации: организация эффективной работы системы управления рисками»
-
Курс профессиональной переподготовки «Эксплуатация и обслуживание общего имущества многоквартирного дома»
-
Курс профессиональной переподготовки «Теория и методика музейного дела и охраны исторических памятников»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
Слайд 1
Окислительно-восстановительные реакции Составила: у читель химии МБОУ « ОБОЯНСКАЯ СОШ №1» КЛИМОВА Т. А.
Слайд 2
ОСНОВНЫЕ ПОНЯТИЯ ОВР ( окислительно -восстановительные реакции) СО (степень окисления) Восстановитель Окислитель Восстановление Окисление
Слайд 3
ВХОДНОЙ КОНТРОЛЬ 1. (А 5) C тепень окисления +3 атом хлора имеет в соединении 1) CI 2 O 7 2) CI 2 O 5 3) Ba(CIO 2 ) 2 4)KCIO 3 2. ( B2 ) Установите соответствие между формулой соли и степенью окисления хрома в ней A) K 2 CrO 4 1) 0 Б) CaCr 2 O 7 2) +2 В) CrO 2 F 2 3) +3 Г) Ba 3 [Cr(OH) 6 ] 2 4) +4 5) +5 6) +6
Слайд 4
ВХОДНОЙ КОНТРОЛЬ 3. ( A 5) Максимальную степень окисления азот проявляет в соединении NH 4 CI 2) NO 2 3) NH 4 NO 3 NOF 4. (В2) Установите соответствие между схемой реакции и названием восстановителя в ней А) Ca + H 2 →CaH 2 кальций Б) NH 3 + Ca → Ca (NH 2 ) 2 + H 2 2) водород В) N 2 + H 2 → NH 3 3) аммиак Г) NH 3 +CI 2 → NH 4 CI + N 2 4) азот 5) хлор
Слайд 5
Входной контроль 5. (В2) Установите соответствие между схемой реакции и формулой окислителя в ней Схема реакции Ок — ль А) K 2 CO 3 + Br 2 → KBr + KBrO 3 + CO 2 1) K 2 CO 3 Б) Br 2 + CI 2 → BrCI 2) Br 2 В) Br 2 + I 2 → IBr 3) CI 2 Г) HBr + HBrO 3 →Br 2 +H 2 O 4) I 2 5) HBr 6) HBrO 3
Слайд 6
Входной контроль 6 . (В2) Установите соответствие между схемой реакции и формулой недостающего вещества Схема реакции Формула А) S + HNO 3 конц → … + NO 2 + H 2 O 1) SO 2 Б) H 2 S + CI 2 → … + HCI 2) H 2 SO 4 В) S + O 2 →… 3) SO 3 Г) Cu + H 2 SO 4 конц → С uSO 4 + … + H 2 O 4) S 5) H 2 SO 3
Слайд 7
самопроверка 1. 3 2. 6 6 6 3 3. 3 4. 1 1 2 3 5. 2 3 2 6 6. 2 4 1 1
Слайд 8
Типы овр 1. М ежмолекулярные ОВР – окислитель и восстановитель входят в состав молекул разных веществ FeCI 3 + KI = FeCI 2 + I 2 + KCI (расставьте коэффициенты методом э лектронного баланса)
Слайд 9
Типы овр 2. Внутримолекулярные ОВР – и окислитель, и восстановитель входят в состав одного вещества ( NH 4 ) 2 Cr 2 O 7 = N 2 + Cr 2 O 3 + H 2 O (расставьте коэффициенты методом э лектронного баланса)
Слайд 10
Типы овр Реакции самоокисления-самовосстановления ( диспропорционирования ) – один и тот же элемент является и восстановителем и окислителем NO 2 + H 2 O = HNO 3 + HNO 2 (расставьте коэффициенты методом электронного баланса)
Слайд 11
Возможные со Галогены VII A группа (F, CI, Br, I) F – не имеет положительных СО, в соединениях СО = -1, F 2 0 Остальные галогены (на примере CI) +7 – CI 2 O 7 , HCIO 4 , соли MeCIO 4 +6 – CIO 3 +5 – CI 2 O 5 , HCIO 3 , соли MeCIO 3 +4 – CIO 2 +3 – CI 2 O 3 , HCIO 2 , соли MeCIO 2 +1 – CI 2 O, HCIO, соли MeCIO 0 – простые вещества CI 2 -1 – HCI, соли MeCI , PCI 5
Слайд 12
Возможные со Халькогены VI A группа ( O, S, Se, Te , Po) К ислород имеет СО= +2 в соединении OF 2 , -2 в пероксидах ( H 2 O 2 ), обычно в соединениях СО = -2 , простое вещество СО = 0. Остальные халькогены ( на примере S) +6 –SO 3 , H 2 SO 4 , H 2 S 2 O 7 , соли MeSO 4 , MeHSO 4 + 4- SO 2 , H2SO 3 , соли (MeHSO 3 , MeSO 3 ), SCI 4 +2 – SCI 2 +1 – S 2 CI 2 0 – простое вещество -1 – FeS 2 -2 – H 2 S, соли ( MeS , MeHS ) , CS 2
Слайд 13
Возможные со Элементы V А группы Азот +5 – N 2 O 5 , HNO 3 , соли MeNO 3 +4 – NO 2 +3 – N 2 O 3 , HNO 2 , соли MeNO 2 , NF 3 +2 – NO +1 – N 2 O 0 – простое вещество N 2 -3 – NH 3 , NH 4 OH (NH 3 ·H 2 O), соли NH 4 KO, MeN , MeNH 2 , MeNH
Слайд 14
Возможные со Элементы V А группы Фосфор +5 – P 2 O 5 , HPO 3 , H 3 PO 4 , соли (MePO 4 , MeH 2 PO 4 , MeHPO 4 ), PCI 5 , P 2 S 5 +3 – P 2 O 3 , PCI 3 , P 2 S 3 0 – простое вещество -3 – PH 3 , соли MeP
Слайд 15
Возможные со Элементы IV А группы Углерод +4 – CO 2 , H 2 CO 3 , соли (MeCO 3 , MeHCO 3 ), CS 2 , CCI 4 +3 – H 2 C 2 O 4 +2- CO, HCOOH, HCN 0 – простое вещество -1 – C 2 H 2 , CaC 2 -2 – C 2 H 4 -4 – CH 4 , AI 4 C 3 Кремний +4 – SiO 2 , H 2 SiO 3 , H 4 SiO 4 , соли MeSiO 3 , MeSiO 4 , SiCI 4 0 – простое вещество -4 – SiH 4 , Mg 2 SI, силициды
Слайд 16
Возможные со Водород + 1 – H 2 O, MeOH , H KO , MeH KO 0 – простое вещество -1 – гидриды MeH
Слайд 17
Важнейшие восстановители Все простые вещества металлы. Сложные вещества, содержащие элементы с низшим значением СО (8 — № группы) CH 4 , SiH 4 , NH 3 , PH 3 , Na 3 N ( нитриды ) , Ca 3 P 2 ( фосфиды ) , H 2 S и сульфиды ( MeS ), HCI, HBr , HI и галогениды металлов ( MeCI , MeBr , MeI ), гидриды металлов ( MeH )
Слайд 18
ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ F 2 , O 2 Сложные вещества, содержащие элементы с максимальным значением СО: KMnO 4 , K 2 Cr 2 O 7 , K 2 CrO 4 , HNO 3 и ее соли MeNO 3 , H 2 SO 4 концентрированная , PbO 2 , HCIO 4 и ее соли
Слайд 19
Среди веществ с промежуточным значение СО выступают обычно в роли окислителей: CI 2 , Br 2 , HCIO и ее соли MeCIO , KCIO 3 , MnO 2 , соли железа ( III) — FeCI 3 ; Среди веществ с промежуточным значение СО выступают обычно в роли восстановителей : H 2 , C, CO, Na 2 SO 3 , соли железа (II) — FeSO 4 .
Слайд 20
Элемент с промежуточным значение СО может быть как восстановителем, так и окислителем. Чем будет такой элемент в данной конкретной ситуации, зависит от второго вещества, с которым будет протекать реакция. Например , Na 2 SO 3 (в-ль) + KMnO 4 ( ок -ль), значит S +4 будет повышать СО и перейдет в S +6 . Другая ситуация: Na 2 SO 3 (о-ль) + H 2 S (в-ль), значит S +4 будет понижать СО и перейдет в S 0
Слайд 21
Правила составления ОВР в кислой среде В левой части уравнения обязательно присутствует формула кислоты, в правой части уравнения будет в качестве продукта реакции H 2 O . Если в левой части уравнения в кислой среде соединения марганца , то в правой части уравнения будут соли Mn +2 , связанные с кислотным остатком, который есть в исходной кислоте. Ионы других металлов также образуют соль с кислотным остатком исходной кислоты.
Слайд 22
Примеры KMnO 4 + HBr = MnBr 2 + Br 2 + …+… PH 3 + KMnO 4 +H 2 SO 4 = = MnSO 4 + H 3 PO 4 +…+…
Слайд 23
Правила составления ОВР в кислой среде Если в кислой среде в левой части уравнения KMnO 4 и неизвестное исходное вещество, а в правой части уравнения получается простое вещество неметалл, то неизвестным веществом будет соль этого неметалла с минимальным значением СО Например: KMnO 4 +… + H 2 SO 4 = = MnSO 4 +Br 2 +… +H 2 O
Слайд 24
Правила составления ОВР в кислой среде Если в левой части уравнения в качестве окислителя K 2 Cr 2 O 7 или K 2 CrO 4 и реакция идет в кислой среде, то в правой части уравнения будет соль Cr +3 и кислотного остатка, участвующей в реакции кислоты. Побочным продуктом этой реакции будет H 2 O .
Слайд 25
Примеры K 2 Cr 2 O 7 + HI = CrI 3 + I 2 +… +… K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = = Cr 2 (SO 4 ) 3 + …+ …
Слайд 26
Правила составления ОВР в кислой среде Если ОВР идет в кислой среде, но в ней не участвуют соли, следовательно в продуктах реакции могут быть простые вещества, оксиды, новые кислоты и вода. При составлении уравнения следить за тем, чтобы в правой части не было веществ, которые вступят в реакцию между собой. Например, PH 3 в левой части уравнения (в кислой среде Р -3 переходит в Р +5 , но это не Р 2 О 5 , а Н 3 РО 4 , т.к. Р 2 О 5 +Н 2 О = Н 3 РО 4 ), а Н 3 РО 4 в правой части уравнения
Слайд 27
Примеры 1) PH 3 + HBrO 3 = … + Br 2 +… 2) H 2 S + HMnO 4 = S+ MnO 2 +…
Слайд 28
Правила составления ОВР в щелочной среде Если в левой части уравнения присутствует формула щелочи, то в правой части уравнения будет в качестве побочного продукта реакции H 2 O , а элементы меняющие значения СО будут содержаться в кислотных остатках продуктов реакции В щелочной среде c оединения марганца превращаются в манганаты , например K 2 MnO 4 — манганат калия В щелочной среде соединения хрома превращаются в хроматы, например Na 2 CrO 4 — хромат натрия
Слайд 29
Примеры ОВР в щелочной среде Na 2 SO 3 + … + KOH = K 2 MnO 4 + … + H 2 O MnO 2 + Cl 2 + … → K 2 MnO 4 + …+ H 2 O Cr 2 (SO 4 ) 3 + … + NaOH = = Na 2 CrO 4 + NaBr + … +H 2 O 4) NO + KCIO +… = KNO 3 + KCI +… 5) I 2 + K 2 SO 3 + …= K 2 SO 4 + …+ H 2 O
Слайд 30
Правила составления ОВР в нейтральной среде ОВР идет в нейтральной среде, если в левой части уравнения стоит формула H 2 O При протекании ОВР в нейтральной среде в правой части уравнения есть либо формулы кислот, либо формулы оснований KMnO4 и другие соединения марганца в нейтральной среде превращается в MnO2 Соединения хрома в нейтральной среде превращаются в Cr(OH) 3 или Cr 2 O 3
Слайд 31
Примеры ОВР в нейтральной среде K 2 S + … + KBrO 4 = S + KBr +KOH KNO 3 + Mg +… = NH 3 + Mg(OH) 2 +… NO + HBrO 4 +… = HNO 3 + Br 2 KNO 2 + … + H 2 O = MnO 2 + … + KOH KMnO 4 + MnSO 4 + H 2 O = MnO 2 + … +… K 2 Cr 2 O 7 + Na 2 SO 3 + … = Cr ( OH ) 3 + … + KOH
Слайд 32
ОВР с участием H 2 O 2 H 2 O 2 в зависимости от веществ, которые участвуют в реакции может быть как окислителем, так и восстановителем. Если пероксид водорода ведет себя как восстановитель ( в присутствии окислителей), то в продуктах реакции будет кислород – простое вещество. Если пероксид водорода ведет себя как окислитель, то в продуктах реакции будет вода.
Слайд 33
Примеры ОВР с участием H 2 O 2 CrCI 3 + H 2 O 2 + …= K 2 CrO 4 + … + H 2 O KMnO 4 + H 2 O 2 + … = MnSO 4 +…+O 2 + H 2 O
1
Первый слайд презентации: ЕГЭ по химии: окислительно-восстановительные реакции в неорганической химии
Изображение слайда
2
Слайд 2: Задани е 30. «Реакции окислительно-восстановительные»
2
Проверяемые элементы содержания
Требования к уровню подготовки выпускников
Степень окисления химических
элементов.
Окислитель и восстановитель.
Реакции окислительно-
восстановительные
Определять
степень окисления химических элементов в соединении;
окислитель и восстановитель.
Применять основные положения
химических теорий для анализа строения и свойств веществ.
Объяснять
сущность окислительно- восстановительных реакций. Составлять
уравнения химических реакций
Задани е 30. «Реакции окислительно-восстановительные»
Изображение слайда
3
Слайд 3: Основные принципы организации подготовки обучающихся к экзамену
Подготовка к экзамену должна осуществляться в процессе преподавания учебного предмета.
Нельзя сводить подготовку к экзамену только к тренировке в выполнении заданий, аналогичных заданиям
экзаменационной работы!
Главная задача подготовки к экзамену — целенаправленная работа по повторению, систематизации и обобщению
изученного материала, по приведению в систему знаний
ключевых понятий курса химии.
Необходим опыт проведения реального химического эксперимента!
9
Основные принципы организации подготовки обучающихся к экзамену
Изображение слайда
4
Слайд 4: Какие важнейшие понятия и правила темы
«ОВР» следует усвоить обучающимся?
Правила для определения степеней окисления атомов
В простых веществах степень окисления элементов равна нулю
Высшая (максимальная) степень окисления элементов II—VII групп, как правило, равна номеру группы, в которой находится элемент в периодической таблице Д.И. Менделеева
Низшая (минимальная) степень окисления металлов равна нулю. Низшая степень окисления неметаллов обычно равна:
− (8 − номер группы, в которой находится элемент)
Значения степеней окисления элемента между высшей и
низшей степенями окисления называются промежуточными
Алгебраическая сумма степеней окисления всех атомов в
нейтральной молекуле равна нулю, а в сложном ионе – заряду
иона
4
Какие важнейшие понятия и правила темы
«ОВР» следует усвоить обучающимся?
Изображение слайда
5
Слайд 5: Правила для определения степеней окисления атомов
Некоторые элементы во всех сложных соединениях имеют
постоянную степень окисления :
Элементы с постоянной
степенью окисления
Степень
окисления
Щелочные металлы: Li, Na, K, Rb, Cs, Fr
+1
Все элементы II группы, кроме Hg: Be, Mg, Ca, Sc, Ba, Ra, Zn, Cd
+2
А л ю мин и й Al
+3
Фтор F
−1
5
Правила для определения степеней окисления атомов
Изображение слайда
6
Слайд 6: Правила для определения степеней окисления атомов
Водород и кислород в большинстве сложных соединений имеют постоянные степени окисления, но есть исключения:
Элемент
Степень окисления в большинстве соединений
Исключения
Н
+1
Гидриды активных металлов : LiH, NaH, KH, CaH 2 и др. – степень окисления водорода равна -1
O
−2
Пероксиды водорода и металлов : H 2 O 2, Na 2 O 2, BaO 2 и др. – степень окисления кислорода равна -1.
Фторид кислорода OF 2 – степень окисления кислорода равна +2
Правила для определения степеней окисления атомов
Все остальные элементы имеют в сложных соединениях
переменные степени окисления
6
Изображение слайда
7
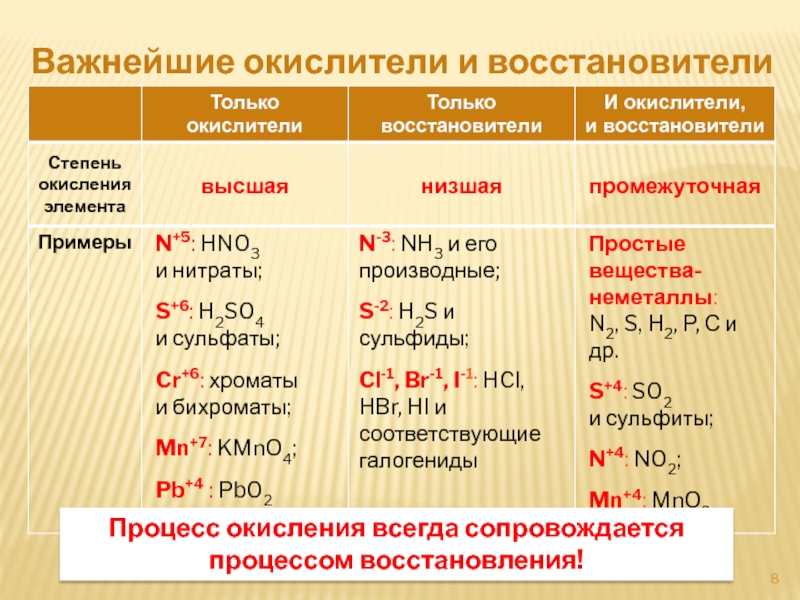
Слайд 7: Важнейшие окислители и восстановители
Только
окислители
Только в о с с т анов и тели
И окислители,
и восстановители
Степень оки с л ения элемента
высшая
низшая
промежуточная
Примеры
N +5 : HNO 3
и нитраты;
S +6 : H 2 SO 4
и сульфаты;
Cr +6 : хроматы и бихроматы;
Mn +7 : KM nO 4 ;
Pb +4 : PbO 2
N -3 : NH 3 и его произв о д н ые;
S -2 : H 2 S и сульфиды;
Cl -1, Br -1, I — 1 : HCl, HBr,
HI и соответствующие галогениды
Простые веществ а —
неметаллы :
N 2, S, H 2, P, С и др.
S +4 : SO 2
и сульфиты;
N +4 : NO 2 ;
Mn +4 : MnO 2
Процесс окисления всегда сопровождается процессом восстановления!
13
Важнейшие окислители и восстановители
Изображение слайда
8
Слайд 8: Важнейшие окислители
Окислители
Продукты реакции. Примеры
1. Простые вещества-неметаллы
Галогены F 2, Cl 2, Br 2, I 2
В кислой среде : галогеноводороды HF, HCl, HBr, HI :
4Cl 2 + H 2 S + 4H 2 O = 8 HCl + H 2 SO 4
В щелочной среде : соли галогеноводородных кислот:
3I 2 + 6NaOH = NaIO 3 + 5 NaI + 3H 2 O
Кислород О 2
О -2 (как правило):
2Mg + O 2 = 2 MgO
Сера S
С водородом и металлами при нагревании
сероводород Н 2 S и сульфиды (соответственно): S + H 2 = H 2 S
2Al + 3S = Al 2 S 3
8
Изображение слайда
9
Слайд 9: Важнейшие окислители
Окислители
Продукты реакции. Примеры
2. Кислородсодержащие кислоты и их соли, в состав которых обычно входят атомы элементов в высшей степени окисления
Азотная кислота
HNO 3
Чем активнее восстановитель и чем меньше концентрация кислоты, тем глубже протекает восстановление азота:
концентрация кислоты
NO 2 NO N 2 O N 2 NH 4 +
+4 +2 +1 0 −3
| | | | |
активность восстановителя
9
Изображение слайда
10
Слайд 10: Важнейшие окислители
Окислители
Продукты реакции. Примеры
Концентрированная азотная кислота HNO 3
С малоактивными металлами и с неметаллами
преимущественно образуется NO 2 ( бурый газ ):
Cu + 4HNO 3 (конц.) = Cu(NO 3 ) 2 + 2 NO 2 + 2H 2 O P + 5HNO 3 (конц.) = H 3 PO 4 + 5 NO 2 + H 2 O
Разбавленная
азотная кислота HNO 3
С малоактивными металлами преимущественно образуется NO :
Сu + 8HNO 3 (разб.) = 3Cu(NO 3 ) 2 + 2 NO + 4H 2 O
С активными металлами преимущественно образуется
N 2 O или N 2 ( в действительности — смесь продуктов восстановления азотной кислоты! ):
4Zn + 10HNO 3 (разб.) = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
5Zn + 12HNO 3 (разб.) = 5Zn(NO 3 ) 2 + N 2 + 6H 2 O
Очень разбавленная
азотная кислота HNO 3
С активными металлами возможно образование NH 3
( NH 4 NO 3 ):
4Mg + 10HNO 3 (оч.разб.) = 4Mg(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O 16
Изображение слайда
11
Слайд 11: Важнейшие окислители
Окислители
Продукты реакции. Примеры
Нитрат-ион NO 3 ¯
В растворах под действием активных металлов — NH 3, в расплавах – соответствующие нитриты :
в раст в о р е:
4Zn + KNO 3 + 7KOH + 6H 2 O = 4 K 2 [Zn(OH) 4 ] + NH 3
в расплаве:
Zn + NaNO 3 + 2NaOH = Na 2 ZnO 2 + NaNO 2 + H 2 O
11
Изображение слайда
12
Слайд 12: Важнейшие окислители
Окислители
Продукты реакции. Примеры
Концентрированная серная кислота H 2 SO 4
Чем активнее восстановитель и чем выше концентрация кислоты, тем глубже протекает восстановление серы:
концентрация кислоты
SO 2 S Н 2 S
+ 4 0 — 2
| | |
активность восстановителя
12
Изображение слайда
13
Слайд 13: Важнейшие окислители
Окислители
Продукты реакции. Примеры
Концентрированная серная кислота H 2 SO 4
С малоактивными металлами (Cu, Ag и др.), HBr и
некоторыми неметаллами (С, S) — SO 2 :
2Ag + 2H 2 SO 4 (конц.) = Ag 2 SO 4 + SO 2 + 2H 2 O
2HBr + H 2 SO 4 (конц.) = Br 2 + SO 2 + 2H 2 O
C + 2H 2 SO 4 (конц.) = CO 2 + 2 SO 2 + 2H 2 O
С активными металлами (Zn, Mg, Al, Ca и др.) —
свободная сера S или сероводород H 2 S :
3Mg + 4H 2 SO 4 (конц.) = 3MgSO 4 + S + 4H 2 O
8Al + 15H 2 SO 4 (конц.) = 4Al 2 (SO 4 ) 3 + 3 H 2 S + 12H 2 O
13
Изображение слайда
14
Слайд 14: Важнейшие окислители
Окислители
Продукты реакции. Примеры
Перманганат калия
KMnO 4,
манганат калия K 2 MnO 4,
оксид марганца(IV) MnO 2
В кислой среде — соли Мn 2+ (обесцвечивание):
2KMnO 4 + 5K 2 SO 3 + 3H 2 SO 4 = 2 MnSO 4 + 6K 2 SO 4 + 3H 2 O K 2 MnO 4 + 2K 2 S + 4H 2 SO 4 = MnSO 4 + 2S + 3K 2 SO 4 + 4H 2 O MnO 2 + 2Fe(NO 3 ) 2 + 4HNO 3 = Mn(NO 3 ) 2 + 2Fe(NO 3 ) 3 + 2H 2 O
В нейтральной или слабощелочной среде KMnO 4 и K 2 MnO 4
восстанавливаются до MnO 2 ( бурый осадок )
2KMnO 4 + 3NaNO 2 + H 2 O = 2 MnO 2 + 3NaNO 3 +2KOH K 2 MnO 4 + K 2 S + 2H 2 O = S + MnO 2 + 4KOH
В сильнощелочной среде — K 2 MnO 4 ( раствор зеленого цвета ):
2KMnO 4 + Na 2 SO 3 + 2KOH = 2 K 2 MnO 4 + Na 2 SO 4 + H 2 O
14
Изображение слайда
15
Слайд 15: Продукты восстановления KMnO 4 в различных средах
KMnO 4
Среда
Схема полуреакции
Кислая
Mn +7 + 5e — → Mn +2 (обесцвечивание)
MnO ¯ + 8H + + 5e — → Mn 2+ + 4H O
4 2
Нейтральная
Mn +7 + 3e — → Mn +4
¯ — ¯
MnO 4 + 2H 2 O + 3e → MnO 2 ↓ + 4OH
бурый осадок
Щелочная
Mn +7 + e — → Mn +6
¯ — 2-
MnO 4 + e → MnO 4
раствор зеленого цвет а
15
Изображение слайда
16
Слайд 16: Важнейшие окислители
Окислители
Продукты реакции. Примеры
Хроматы (K 2 CrO 4 )
и б и х роматы ( K 2 Cr 2 O 7 )
В кислой среде — соединения Cr +3 (соответствующие соли
CrCl 3, Cr 2 (SO 4 ) 3, Cr(NO 3 ) 3 ):
K 2 Cr 2 O 7 + 3H 2 S + 4H 2 SO 4 = Cr 2 (SO 4 ) 3 + 3S + K 2 SO 4 + 7H 2 O
Кислородсодержащие кислоты хлора и брома (HClO, HClO 3, HClO 4,
HBrO 3 ) и их соли
Ионы Cl‾ и Br‾ :
HClO 3 + S + H 2 O = HCl + H 2 SO 4
3KClO 4 + 8Al + 12H 2 SO 4 = 3 KCl + 4Al 2 (SO 4 ) 3 + 12H 2 O KBrO + MnCl 2 + 2KOH = KBr + MnO 2 + 2KCl + H 2 O
К и сл о р о д с о д е рж а щ ие кислоты иода (HIO 3, HIO 4 ) и их соли
Иод I 2, под действием более сильных восстановителей образует иодид-ион I‾ :
HIO 3 + 5HI = 3 I 2 + 3H 2 O
7KI + KIO 4 + 4H 2 SO 4 = 4 I 2 + 4K 2 SO 4 + 4H 2 O
HIO 3 + 3H 2 S = HI + 3S + 3H 2 O
22
Изображение слайда
17
Слайд 17: Важнейшие окислители
Окислители
Продукты реакции. Примеры
3. Ион Н + и катионы металлов в высшей степени окисления (Fe 3+, Cu 2+, Hg 2+ и др.)
Ион Н +
Водород Н 2 :
2HCl + Mg = MgCl 2 + H 2
Катионы металлов в высшей степени
окисления (Fe 3+, Cu 2+, Hg 2+ )
Ионы с более низкой степенью окисления :
2CuSO 4 + 4KI = 2 CuI + I 2 + 2K 2 SO 4
2FeCl 3 + H 2 S = 2 FeCl 2 + S + 2HCl
17
Изображение слайда
18
Слайд 18: Важнейшие восстановители
Восстановители
Продукты реакции. Примеры
1. Активные металлы (щелочные, щелочноземельные, Zn, Al, Fe и
др.) и некоторые неметаллы (H 2, C, P, Si)
Активные металлы
В кислой среде — соответствующие катионы (соли):
Fe + H 2 SO 4 (разб.) = FeSO 4 + H 2
В щелочной среде металлы Zn и Al — соответственно
гидроксоцинкаты или гидроксоалюминаты :
4Zn + NaNO 3 + 7NaOH + 6H 2 O = NH 3 + 4 Na 2 [Zn(OH) 4 ]
2Al + 2NaOH + 6H 2 O = 2 Na[Al(OH) 4 ] + 3H 2
18
Изображение слайда
19
Слайд 19: Важнейшие восстановители
Восстановители
Продукты реакции. Примеры
Неметаллы
Углерод — СО или СО 2 :
С + FeO = Fe + CO
C + 4HNO 3 ( конц.) = CO 2 + 4NO 2 + 2H 2 O
Фосфор под действием сильных окислителей окисляется до Н 3 РО 4 :
P + 5HNO 3 (конц.) = H 3 PO 4 + 5NO 2 + H 2 O
19
Изображение слайда
20
Слайд 20: Важнейшие восстановители
Восстановители
Продукты реакции. Примеры
2. Бескислородные кислоты (HCl, HBr, HI, H 2 S) и их соли;
гидриды щелочных и щелочноземельных металлов (NaH, CaH 2 и др.)
Бескислородные
кислоты (HCl, HBr, HI, H 2 S) и их соли
Нейтральные атомы или молекулы, способные в некоторых случаях к дальнейшему окислению :
8KI + 5H 2 SO 4 = H 2 S + 4 I 2 + 4K 2 SO 4 + 4H 2 O
H 2 S + 4Cl 2 + 4H 2 О = 8HCl + H 2 SO 4
При обжиге сульфидов p- и d- элементов — SO 2 :
2ZnS + 3O 2 = 2ZnO + 2 SO 2 HgS + O 2 = Hg + SO 2
Гидриды щелочных и щелочноземельных металлов
Водород Н 2 :
NaH + H 2 O = NaOH + H 2
26
Изображение слайда
21
Слайд 21: Важнейшие восстановители
Восстановители
Продукты реакции. Примеры
3. Катионы металлов в низшей степени окисления (Fe 2+, Cu + Sn 2+ и др.)
,
Соединения с более высокой степенью окисления металла:
SnCl 2 + Cl 2 = SnCl 4
6CuCl + K 2 Cr 2 O 7 + 14HCl(разб.) = 6 CuCl 2 + 2CrCl 3 + 2KCl + 7H 2 O
6FeSO 4 + KClO 3 + 3H 2 SO 4 = 3 Fe 2 (SO 4 ) 3 + KCl + 3H 2 O
Катион Cr 3+ проявляет сильную восстановительную активность в щелочной среде, окисляясь до хромат-иона CrO 4 2- ( но не до бихромат-иона Cr 2 O 7 2- ! ):
Сr 2 (SO 4 ) 3 + 16NaOH + 3Br 2 = 2 Na 2 CrO 4 + 6NaBr + 3Na 2 SO 4 + 8H 2 O
27
Изображение слайда
22
Слайд 22: Оки с ли т е льн о -во с ста нови т е льная двойственность
Окислитель
Восстановитель
Азотистая кислота НNO 2 и нитриты
Под действием сильных восстановителей ( H 2 S, HI, KI ) восстанавливаются, как правило, до NO (иногда — до других соединений азота в более низких степенях окисления):
2HNO 2 + 2HI = 2 NO + I 2 + 2H 2 O
Под действием сильных окислителей ( KMnO 4, K 2 Cr 2 O 7, KClO 3 и др.) окисляются до азотной кислоты HNO 3 или её солей :
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5 NaNO 3 +
+ 2MnSO 4 + K 2 SO 4 + 3H 2 O
Иод в свободном состоянии
Восстанавливается до I¯ 1 :
I 2 + H 2 S = S + 2 HI
3I 2 + 2P = 2 PI 3
I 2 + Fe + = FeI 2
Под действием сильных окислителей ( Сl 2, HNO 3, KBrO 3 и др.) окисляется до иодноватой кислоты НIO 3 или её солей:
I 2 + 5Cl 2 + 6H 2 O = 2 HIO 3 + 10HCl I 2 + 2KBrO 3 = 2 KIO 3 + Br 2
28
Изображение слайда
23
Слайд 23: Окислительно-восстановительная двойственность
Окислитель
Восстановитель
Сера в свободном состоянии и соединения серы в степени окисления +4 (SO 2, H 2 SO 3, сульфиты)
Cера S
Водородом Н 2 и металлами
восстанавливается до S -2 :
S + H 2 = H 2 S
S + Fe = FeS
Под действием О 2, Сl 2, конц. H 2 SO 4, конц. HNO 3, KMnO 4, K 2 Cr 2 O 7 и др. окисляется до S +4 или S +6 :
S + 2H 2 SO 4 (конц.) = 3 SO 2 + 2H 2 O
S + 2KMnO 4 = К 2 SO 4 + 2MnO 2
SO 2, H 2 SO 3 и сульфиты
Сероводородом Н 2 S, углер одом С, активными металлами восстанавливаются до S 0 или S -2 :
Н 2 SO 3 + 2H 2 S = 3 S + 3H 2 O SO 2 + C = S + CO 2
Na 2 SO 3 + 3Zn + 8HCl = H 2 S +
+ 3ZnCl 2 + 2NaCl + 3H 2 O
Под действием сильных окислителей
( О 2, KClO 3, HClO 4, KMnO 4, K 2 Cr 2 O 7, конц.
HNO 3 и др.) окисляются до S +6 :
SO 2 + 2HNO 3 (конц.) = H 2 SO 4 + 2NO 2 3K 2 SO 3 + K 2 Cr 2 O 7 + 4H 2 SO 4 = 4 K 2 SO 4 +
+ Cr 2 (SO 4 ) 3 + 4H 2 O
29
Изображение слайда
24
Слайд 24: Окисли т е льно — во с станови т е льная двойственность
Окислитель
Восстановитель
Пероксид водорода Н 2 О 2
Восстанавливается до
кислорода O -2 :
4H 2 O 2 + PbS = PbSO 4 + 4 H 2 O
Окисляется до кислорода О 2 :
3H 2 O 2 + 2KMnO 4 = 3 O 2 + 2MnO 2 + 2KOH + 2H 2 O
24
Изображение слайда
Тип ОВР
Примеры
1. Межмолекулярные: элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ
I 2 + H 2 S = 2HI + S
2. Внутримолекулярные: элемент-окислитель и элемент-восстановитель входят в состав одного вещества
2NaNO 3 = 2NaNO 2 + O 2
3. Реакции конпропорционирования: функции окислителя и восстановителя выполняет один и тот же элемент в разных степенях окисления, который входит в состав разных веществ или в состав одного и того же вещества
5HI + HIO 3 = 3I 2 + 3H 2 O
(межмолекулярное
конпропорционирование)
NH 4 NO 2 = N 2 + 2H 2 O
(внутримолекулярное
конпропорционирование)
25
Изображение слайда
26
Последний слайд презентации: ЕГЭ по химии: окислительно-восстановительные реакции в неорганической химии: Типы ОВР
Тип ОВР
Примеры
4. Реакции ди с пр о по р ц и о н и р ов а н и я (самоокисления-
самовосстановления): атомы одного и того же элемента в одной и той же степени окисления являются и окислителем и восстановителем.
Характерны для соединений, в которых элемент находится в промежуточной степени окисления
2 H 2 O 2 = O 2 + 2H 2 O
3 S + 6KOH = K 2 SO 3 + 2K 2 S + 3H 2 O
Г 2 – Cl 2 или Br 2 :
3 Г 2 + 6NaOH = NaClO 3 + 5NaCl + 3H 2 O (при нагревании)
Г 2 + 2NaOH = NaClO + NaCl + H 2 O (на холоде)
3 I 2 + 6NaOH = NaIO 3 + 5NaI + 3H 2 O
P 4 + 3KOH + 3H 2 O = PH 3 + 3KH 2 PO 2
2 NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
3 HNO 2 = HNO 3 + 2NO + H 2 О
4 K 2 SO 3 = 3K 2 SO 4 + K 2 S (600 о С)
26
Изображение слайда
1
Готовимся к ЕГЭ Окислительно- восстановительные реакции Из опыта работы учителя химии «МОУ СОШ 73» г. Оренбурга Кочулевой Л. Р.
2
Окислительно- восстановительные реакции (ОВР) — – химические реакции, в которых происходит изменение степеней окисления атомов, входящих в состав реагирующих веществ.
3
Степень окисления Степень окисления атомов элементов простых веществ равна нулю Степень окисления атомов элементов простых веществ равна нулю Степень окисления водорода в соединениях +1, кроме гидридов Степень окисления водорода в соединениях +1, кроме гидридов Степень окисления кислорода в соединениях -2, кроме пероксидов и соединений с фтором Степень окисления кислорода в соединениях -2, кроме пероксидов и соединений с фтором Сумма всех степеней окисления атомов в соединении равна нулю Сумма всех степеней окисления атомов в соединении равна нулю Сумма всех степеней окисления атомов в ионе равна значению заряда иона Сумма всех степеней окисления атомов в ионе равна значению заряда иона Mgº, Cl 2 º, O 2 º HCl, H 2 O, NaH H 2 O, Н 2 О 2, OF H 2 SO 4 2(+1)+6+4(-2)= SO 4 6+4(-2)=-2
4
Распознавание уравнений ОВР Запишите значения степеней окисления атомов всех элементов в уравнении реакции Запишите значения степеней окисления атомов всех элементов в уравнении реакции Определите изменяется ли степень окисления атомов элементов. Определите изменяется ли степень окисления атомов элементов PbO + 2HCl PbCl 2 + H 2 O PbO + 2HCl PbCl 2 + H 2 O Степень окисления не изменяется => реакция не окислительно- восстановительная PbO 2 + 2HCl PbCl 2 + Cl 2 + 2H 2 O PbO 2 + 2HCl PbCl 2 + Cl 2 + 2H 2 O Степень окисления изменяется => реакция окислительно-восстановительная
5
Распознавание окислителя и восстановителя SO 2 + 2H 2 S 3S + 2H 2 O SO 2 + 2H 2 S 3S + 2H 2 O SO 2 4 SO 2 4 окислитель 3 окислитель H 2 S -2 H 2 S восстановитель восстановитель
6
Метод электронного баланса SO 2 + 2H 2 S 3S + 2H 2 O SO 2 + 2H 2 S 3S + 2H 2 O _ _ 0 S S S +4 e S 1 S S S +4 e S 1 _ _ +4 0 взял e – восстановление +4 0 взял e – восстановление +4 +(-4)=0 +4 +(-4)= _ _ 0 S S S – 2 e S 2 S S S – 2 e S 2 _ _ -2 0 отдал e – окисление -2 0 отдал e – окисление -2 — (-2)= (-2)=0
7
Влияние среды на характер протекания реакции +7 Mn _ (MnO 4 ) + H H 2 O — OH 2+ Mn +6 Mn 2- (MnO 4 ) +4 MnO 2
8
Используя метод электронного баланса, составьте уравнение реакции: FeSO 4 +KMnO 4 +… …+K 2 SO 4 +K 2 MnO 4 Степень окисления Mn изменяется от +7 до +6 в щелочной среде! Степень окисления Mn изменяется от +7 до +6 в щелочной среде! FeSO 4 окисляется в щелочной среде до Fe(OH) 3 FeSO 4 окисляется в щелочной среде до Fe(OH) 3 FeSO 4 +KMnO 4 +3KOH Fe(OH) 3 +K 2 SO 4 +K 2 MnO 4 FeSO 4 +KMnO 4 +3KOH Fe(OH) 3 +K 2 SO 4 +K 2 MnO 4 FeSO 4 – восстановитель, KMnO 4 – окислитель FeSO 4 – восстановитель, KMnO 4 – окислитель
9
Используя метод электронного баланса, составьте уравнение pеакции: Zn+KMnO 4 +… …+K 2 SO 4 +MnSO 4 +Н 2 О Степень окисления Mn изменяется от +7 до +2 в кислой среде! Степень окисления Mn изменяется от +7 до +2 в кислой среде! Электронный баланс: Электронный баланс: Mn e — Mn +2 2 Mn e — Mn +2 2 Zn 0 – 2e — Zn +2 5 Zn 0 – 2e — Zn Zn+2KMnO 4 +8H 2 SO 4 5ZnSO 4 + 5Zn+2KMnO 4 +8H 2 SO 4 5ZnSO 4 + +K 2 SO 4 +2MnSO 4 +8Н 2 О
10
Используя метод электронного баланса, составьте уравнение реакции: K 2 SO 3 +KMnO 4 +… …+MnO 2 +… Степень окисления Mn изменяется от +7 до +4 в нейтральной среде! Степень окисления Mn изменяется от +7 до +4 в нейтральной среде! Электронный баланс: Электронный баланс: Mn e — Mn +4 2 Mn e — Mn +4 2 S +4 – 2e — S +6 3 S +4 – 2e — S K 2 SO 3 +2KMnO 4 +H 2 O 3K 2 SO 4 +2MnO 2 +2KОH
11
Влияние среды на характер протекания реакции +6 Cr 2- (Cr 2 O 7 ) 2- (CrO 4 ) + H H 2 O — OH 3+ Cr [Cr(OH) 6 ] 3- Cr(OH) 3
12
Используя метод электронного баланса, составьте уравнение pеакции: H 2 S+K 2 Cr 2 O 7 +… …+Cr 2 (SO 4 ) 3 +…+H 2 O Соли Cr(III) образуются в кислой среде! Соли Cr(III) образуются в кислой среде! Электронный баланс: Электронный баланс: 2Cr e — 2Cr Cr e — 2Cr +3 1 S -2 – 2e — S 0 3 S -2 – 2e — S 0 3 3H 2 S+K 2 Cr 2 O 7 +4H 2 SO 4 3H 2 S+K 2 Cr 2 O 7 +4H 2 SO 4 3S +Cr 2 (SO 4 ) 3 +K 2 SO 4 +7H 2 O
13
Используя метод электронного баланса, составьте уравнение pеакции: H 2 S+K 2 CrO 4 +… …+Cr(OH) 3 +KOH Гидроксид хрома(III) образуется в нейтральной среде. Гидроксид хрома(III) образуется в нейтральной среде. Электронный баланс: Электронный баланс: Cr +6 +3e — Cr +3 2 Cr +6 +3e — Cr +3 2 S -2 – 2e — S 0 3 S -2 – 2e — S 0 3 3H 2 S+2K 2 CrO 4 +2H 2 O 3S +2Cr(OH) 3 +4KOH
14
Используя метод электронного баланса, составьте уравнение pеакции: K 2 CrO 4 +H 2 O 2 +… K 3 [Cr(OH) 6 ]+O 2 +… Комплексный анион [Cr(OH) 6 ]3- образуется в щелочной среде. Комплексный анион [Cr(OH) 6 ]3- образуется в щелочной среде. Электронный баланс: Электронный баланс: Cr +6 +3e — Cr +3 2 Cr +6 +3e — Cr O -1 – 2e — O 2 3 2O -1 – 2e — O 2 3 2K 2 CrO 4 +3H 2 O 2 +2KOH+2H 2 O 2K 3 [Cr(OH) 6 ]+3O 2 2K 2 CrO 4 +3H 2 O 2 +2KOH+2H 2 O 2K 3 [Cr(OH) 6 ]+3O 2 Т.к. в правой части уравнения в составе гидроксокомплекса содержится уже 6 атомов водорода, вода переносится в левую часть уравнения.
15
Используя метод электронного баланса, составьте уравнение pеакции: NaCrO 2 +…+NaOH …+NaBr +H 2 O Соединения хрома(III) при окислении в щелочной среде образуют хроматы (CrO 4 2- ). Степень окисления хрома увеличивается от +3 до +6, следовательно NaCrO 2 является восстановителем, а окислителем будет служить Br 2, степень окисления которого снижается от 0 до -1. Соединения хрома(III) при окислении в щелочной среде образуют хроматы (CrO 4 2- ). Степень окисления хрома увеличивается от +3 до +6, следовательно NaCrO 2 является восстановителем, а окислителем будет служить Br 2, степень окисления которого снижается от 0 до -1. Электронный баланс: Электронный баланс: Cr +3 -3e — Cr +6 2 Cr +3 -3e — Cr +6 2 Br 2 +2e — 2Br — 3 Br 2 +2e — 2Br — 3 2NaCrO 2 +3Br 2 +8NaOH 2 Na 2 CrO 4 +6NaBr +4H 2 O 2NaCrO 2 +3Br 2 +8NaOH 2 Na 2 CrO 4 +6NaBr +4H 2 O
16
ОВР азотной кислоты
17
ОВР азотной кислоты ОВР азотной кислоты Ca + 10HNO 3 (конц.) 4Ca(NO 3 ) 2 + N 2 O + 5H 2 O 0 _ +2 0 _ +2 Ca – 2 e Ca 4 +5 _ _ +1 2N + 8 e 2N 1 Ca – восстановитель HNO 3 – окислитель Cu + 4HNO 3 (конц.) Cu(NO 3 ) 2 +2NO 2 + 2H 2 O
18
ОВР азотной кислоты S 0 + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O S 0 + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O B 0 + 3HNO 3 (конц)= H 3 B +3 O 3 + 3NO 2 B 0 + 3HNO 3 (конц)= H 3 B +3 O 3 + 3NO 2 3P 0 + 5HNO 3 + 2H 2 O = 5NO + 3H 3 P +5 O 4 3P 0 + 5HNO 3 + 2H 2 O = 5NO + 3H 3 P +5 O 4 P 0 + 5HNO 3 (конц) = 5NO 2 + H 3 P +5 O 4 +H 2 O P 0 + 5HNO 3 (конц) = 5NO 2 + H 3 P +5 O 4 +H 2 O
19
ОВР азотной кислоты ОВР азотной кислоты FeS HNO 3 (конц.) Fe(NO 3 ) 3 +2H 2 SO 4 +15NO 2 +7H 2 O +2 _ _ +3 Fe – 1 e Fe _ – 15 e 1 – 15 e 1 -1 _ _ +6 2S – 14 e 2S +5 _ _ +4 N + e N 15 N + e N 15 FeS 2 – восстановитель HNO 3 – окислитель
20
ОВР с участием органических соединений Окисление алкенов в нейтральной среде: C 2 H 4 + 2KMnO 4 + 2H 2 O CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH C 2 H 4 + 2KMnO 4 + 2H 2 O CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH Окисление алкенов в кислой среде: CH 3 CH=CH 2 +2KMnO 4 +3H 2 SO 4 CH 3 COOH +CO 2 +2MnSO 4 +K 2 SO 4 +4H 2 O CH 3 CH=CH 2 +2KMnO 4 +3H 2 SO 4 CH 3 COOH +CO 2 +2MnSO 4 +K 2 SO 4 +4H 2 O Окисление алкенов в щелочной среде: CH 3 CH=CH KMnO KOH CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4
21
Окисление алкинов в нейтральной среде: в нейтральной среде: 3CH CH +8KMnO 4 3KOOC – COOK +8MnO 2 +2КОН +2Н 2 О 2C -1 – 8e — 2C C -1 – 8e — 2C +3 3 Mn +7 +3e — Mn +4 8 Mn +7 +3e — Mn +4 8 в кислой среде: в кислой среде: 5CH CH +8KMnO 4 +12H 2 SO 4 5HOOC– COOH +8MnSO 4 +4К 2 SO 4 +12Н 2 О CH CH + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
22
Окисление гомологов бензола H O H O H C H C | | O – H | | O – H KMnO 4 + 9H 2 SO MnSO 4 + 3K 2 SO 4 +4H 2 O восстано- окисли- среда восстано- окисли- среда витель тель витель тель -3 _ _ +3 С – 6 e C 5 +7 _ _ +2 Mn + 5 e Mn 6
23
Окисление гомологов бензола Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до карбоксильных групп, остальные атомы углерода – до углекислого газа. Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до карбоксильных групп, остальные атомы углерода – до углекислого газа. 5C 6 H 5 -CH 2 CH KMnO 4 +18H 2 SO 4 5C 6 H 5 -CH 2 CH KMnO 4 +18H 2 SO 4 5С 6 Н 5 СООН+CO 2 +12MnSO 4 +6K 2 SO 4 +28H 2 O 5С 6 Н 5 СООН+CO 2 +12MnSO 4 +6K 2 SO 4 +28H 2 O C -2 -5e — C +3 5 C -2 -5e — C +3 5 C -3 -7e — C +4 C -3 -7e — C +4 Mn +7 +5e — Mn Mn +7 +5e — Mn +2 12
24
Окисление стирола В нейтральной среде: 3C 6 H 5 -CH =CH 2 +2 KMnO 4 + H 2 O 3C 6 H 5 -CH =CH 2 +2 KMnO 4 + H 2 O 3C 6 H 5 -CH(OH) -CH 2 (OH)+2MnO 2 +2KOH В кислой среде: C 6 H 5 -CH=CH 2 +2KMnO 4 +3H 2 SO 4 C 6 H 5 -CH=CH 2 +2KMnO 4 +3H 2 SO 4 С 6 Н 5 СООН+CO 2 +2MnSO 4 +K 2 SO 4 +H 2 O
25
Окисление спиртов 3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4 ) 3 + 7H 2 O 3СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 3СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 3KOOC – COOK +8MnO 2 +2КОН +8Н 2 О 5СН 2 (ОН) – СН 2 (ОН) + 8КMnO H 2 SO 4 5СН 2 (ОН) – СН 2 (ОН) + 8КMnO H 2 SO 4 5HOOC – COOH +8MnSO 4 +4К 2 SO 4 +22Н 2 О 5HOOC – COOH +8MnSO 4 +4К 2 SO 4 +22Н 2 О
26
Окисление альдегидов 3CH 3 CH=O + 2KMnO 4 = CH 3 COOH + 3CH 3 CH=O + 2KMnO 4 = CH 3 COOH + + 2CH 3 COOK + 2MnO 2 + H 2 O 3CH 3 CH=O + K 2 Cr 2 O 7 + 4H 2 SO 4 = = 3CH 3 COOH + Cr 2 (SO 4 ) 3 + 7H 2 O 3СН 2 О + 2K 2 Cr 2 O 7 + 8H 2 SO 4 = = 3CO 2 +2K 2 SO 4 + 2Cr 2 (SO 4 ) H 2 O
27
Окисление карбоновых кислот НСООН + HgCl 2 =CO 2 + Hg + 2HCl НСООН + HgCl 2 =CO 2 + Hg + 2HCl HCOOH+ Cl 2 = CO 2 +2HCl HCOOH+ Cl 2 = CO 2 +2HCl HOOC-COOH+ Cl 2 =2CO 2 +2HCl HOOC-COOH+ Cl 2 =2CO 2 +2HCl
28
Список источников и литературы Список источников и литературы 1. Ахлебинин А.К., Нифантьев Э.Е., Анфилов К.Л. Органическая химия. Решение качественных задач. – М.: Айрис-пресс, Ахлебинин А.К., Нифантьев Э.Е., Анфилов К.Л. Органическая химия. Решение качественных задач. – М.: Айрис-пресс, Габриелян О.С. Химия: пособие для школьников старших классов и поступающих в вузы. – М.: Дрофа, Габриелян О.С. Химия: пособие для школьников старших классов и поступающих в вузы. – М.: Дрофа, Слета Л.А. Химия: Справочник. – Харьков: Фолио; М.: ООО «Издательство АСТ», Слета Л.А. Химия: Справочник. – Харьков: Фолио; М.: ООО «Издательство АСТ», Новошинский И.И., Новошинская Н.С. Переходные металлы. – Краснодар: «Советская Кубань», Новошинский И.И., Новошинская Н.С. Переходные металлы. – Краснодар: «Советская Кубань», (сообщества «Химоза» и «Подготовка к ЕГЭ по химии») 5. (сообщества «Химоза» и «Подготовка к ЕГЭ по химии»)
1. Готовимся к ЕГЭ
Окислительновосстановительные
реакции
Из опыта работы учителя химии «МОУ СОШ № 73»
г. Оренбурга Кочулевой Л. Р.
2. Окислительно-восстановительные реакции (ОВР) —
Окислительновосстановительные реакции
(ОВР) – химические реакции, в
которых происходит
изменение степеней
окисления атомов,
входящих в состав
реагирующих веществ.
3. Степень окисления
Степень окисления атомов элементов
простых веществ равна нулю
Степень окисления водорода в
соединениях +1, кроме гидридов
Степень окисления кислорода в
соединениях -2, кроме пероксидов и
соединений с фтором
Сумма всех степеней окисления атомов
в соединении равна нулю
Сумма всех степеней окисления атомов
в ионе равна значению заряда иона
Mgº, Cl2º, O2º
+1
+1
-1
HCl, H2O, NaH
-2
-1
+2
H2O, Н2О2, OF2
+1 +6 -2
H2SO4
2(+1)+6+4(-2)=0
+6 -2
SO4
6+4(-2)=-2
4. Распознавание уравнений ОВР
Запишите значения степеней окисления атомов
всех элементов в уравнении реакции
Определите изменяется ли степень окисления
атомов элементов.
+2 -2
+1 -1
+2 -1
+1 -2
PbO + 2HCl → PbCl2 + H2O
Степень окисления не изменяется => реакция не окислительновосстановительная
+4 -2
+1 -1
+2 -1
0
+1
-2
PbO2 + 2HCl → PbCl2 + Cl2 + 2H2O
Степень окисления изменяется => реакция окислительно-восстановительная
5. Распознавание окислителя и восстановителя
+4 -2
+1 -2
0
SO2 + 2H2S → 3S + 2H2O
+4
SO2
окислитель
4
3
2
1
0
-1
-2
H2S
восстановитель
6. Метод электронного баланса
+4 -2
+1
0
-2
SO2 + 2H2S → 3S + 2H2O
+4
0
S →S
_
+4
0
S +4 e → S
1
_
+4 → 0
взял e – восстановление
+4 +(-4)=0
-2
0
S →S
-2 → 0
-2 — (-2)=0
_
-2
0
S–2e→S
_
отдал e – окисление
2
7. Влияние среды на характер протекания реакции
+
H
2+
Mn
+7
Mn
H2O
MnO2↓
_
(MnO4)
+4
—
OH
+6
Mn
2-
(MnO4)
8. Используя метод электронного баланса, составьте уравнение реакции: FeSO4+KMnO4+…→…+K2SO4+K2MnO4
Степень окисления Mn изменяется
от +7 до +6 в щелочной среде!
FeSO4 окисляется в щелочной среде
до Fe(OH)3
FeSO4+KMnO4+3KOH→ Fe(OH)3
+K2SO4+K2MnO4
FeSO4 – восстановитель, KMnO4 –
окислитель
9. Используя метод электронного баланса, составьте уравнение pеакции: Zn+KMnO4+…→…+K2SO4+MnSO4 +Н2О
Степень окисления Mn изменяется от
+7 до +2 в кислой среде!
Электронный баланс:
Mn+7 + 5e- → Mn+2 2
Zn0 – 2e- → Zn+2
5
5Zn+2KMnO4+8H2SO4→5ZnSO4 +
+K2SO4+2MnSO4 +8Н2О
10. Используя метод электронного баланса, составьте уравнение реакции: K2SO3+KMnO4+…→…+MnO2 +…
Степень окисления Mn изменяется
от +7 до +4 в нейтральной среде!
Электронный баланс:
Mn+7 + 3e- → Mn+4 2
S+4 – 2e- → S+6
3
3K2SO3+2KMnO4+H2O→3K2SO4+2MnO2
+2KОH
11. Влияние среды на характер протекания реакции
+
H
Cr
+6
Cr
3+
H2O
Cr(OH)3↓
2-
(Cr2O7 )
2-
(CrO4)
—
OH
[Cr(OH)6]3-
12. Используя метод электронного баланса, составьте уравнение pеакции: H2S+K2Cr2O7+…→…+Cr2(SO4)3+…+H2O
Соли Cr(III) образуются в кислой
среде!
Электронный баланс:
2Cr+6 + 6e- →2Cr+3 1
S-2 – 2e- → S0
3
3H2S+K2Cr2O7+4H2SO4 →
3S ↓ +Cr2(SO4)3+K2SO4+7H2O
13. Используя метод электронного баланса, составьте уравнение pеакции: H2S+K2CrO4+…→…+Cr(OH)3 ↓ +KOH
Гидроксид хрома(III) образуется в
нейтральной среде.
Электронный баланс:
Cr+6 +3e- →Cr+3
2
S-2 – 2e- → S0
3
3H2S+2K2CrO4+2H2O →3S↓ +2Cr(OH)3 ↓
+4KOH
14. Используя метод электронного баланса, составьте уравнение pеакции: K2CrO4+H2O2+…→K3[Cr(OH)6]+O2↑+…
Комплексный анион [Cr(OH)6]3образуется в щелочной среде.
Электронный баланс:
Cr+6 +3e- →Cr+3
2
2O-1 – 2e- → O2
3
2K2CrO4+3H2O2+2KOH+2H2O
→2K3[Cr(OH)6]+3O2↑
Т.к. в правой части уравнения в составе гидроксокомплекса содержится уже
6 атомов водорода, вода переносится в левую часть уравнения.
15. Используя метод электронного баланса, составьте уравнение pеакции: NaCrO2+…+NaOH→…+NaBr +H2O
Соединения хрома(III) при окислении в щелочной среде
образуют хроматы (CrO42-). Степень окисления хрома
увеличивается от +3 до +6, следовательно NaCrO2
является восстановителем, а окислителем будет служить
Br2, степень окисления которого снижается от 0 до -1.
Электронный баланс:
Cr+3-3e-→ Cr+6 2
Br2+2e-→2Br- 3
2NaCrO2+3Br2+8NaOH→2 Na2 CrO4+6NaBr +4H2O
16. ОВР азотной кислоты
17. ОВР азотной кислоты
0
+5
+2
+1
4Ca + 10HNO3(конц.) → 4Ca(NO3)2 + N2O + 5H2O
0
_
+2
Ca – 2 e → Ca
+5
_
+1
2N + 8 e → 2N
4
1
Ca – восстановитель
HNO3 – окислитель
0
+5
+2
+4
Cu + 4HNO3(конц.)→Cu(NO3)2 +2NO2 + 2H2O
18. ОВР азотной кислоты
S0 + 6HNO3(конц) = H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 (конц)= H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O = 5NO + 3H3P+5O4
P0 + 5HNO3 (конц) = 5NO2 + H3P+5O4+H2O
19. ОВР азотной кислоты
+2 -1
+5
+3
+6
+4
FeS2 + 18HNO3(конц.)→Fe(NO3)3+2H2SO4+15NO2+7H2O
+2
_
+3
Fe – 1 e → Fe
-1
_
+6
_
– 15 e
1
2S – 14 e → 2S
+5
_
+4
N+ e→N
FeS2 – восстановитель
HNO3 – окислитель
15
20. ОВР с участием органических соединений
Окисление алкенов в нейтральной среде:
C2H4 + 2KMnO4 + 2H2O→ CH2OH–CH2OH +
2MnO2 + 2KOH
Окисление алкенов в кислой среде:
CH3CH=CH2 +2KMnO4 +3H2SO4
→CH3COOH +CO2 +2MnSO4 +K2SO4 +4H2O
Окисление алкенов в щелочной среде:
CH3CH=CH2 + 10KMnO4 + 13KOH→ CH3COOK +
K2CO3 + 8H2O + 10K2MnO4
21. Окисление алкинов
в нейтральной среде:
3CH≡CH +8KMnO4→3KOOC – COOK +8MnO2
+2КОН +2Н2О
2C-1 – 8e- → 2C+3
3
Mn+7 +3e- →Mn+4
8
в кислой среде:
5CH≡CH +8KMnO4 +12H2SO4 →5HOOC– COOH
+8MnSO4 +4К2SO4 +12Н2О
CH≡CH + 2KMnO4 +3H2SO4 =2CO2 + 2MnSO4
+ 4H O + K SO
22. Окисление гомологов бензола
H
↓-3
H→C ←H
|
O
+3
C
|
+7
5
+2
+ 6KMnO4 + 9H2SO4 → 5
восстано- окисливитель
тель
-3
_
+3
С–6e→C
+7
_
O–H
среда
5
+2
Mn + 5 e → Mn
6
+ 6MnSO4 + 3K2SO4 +4H2O
23. Окисление гомологов бензола
Обратите внимание, что только α-углеродные
атомы (непосредственно связанные с бензольным
кольцом) окисляются до карбоксильных групп,
остальные атомы углерода – до углекислого газа.
5C6H5-CH2CH3 + 12KMnO4+18H2SO4→
→5С6Н5СООН+CO2+12MnSO4 +6K2SO4 +28H2O
C-2 -5e- →C+3
5
C-3 -7e- →C+4
Mn+7 +5e-→Mn+2 12
24. Окисление стирола
В нейтральной среде:
3C6H5-CH =CH2+2 KMnO4+ H2O→
3C6H5-CH(OH) -CH2(OH)+2MnO2+2KOH
В кислой среде:
C6H5-CH=CH2 +2KMnO4+3H2SO4→
С6Н5СООН+CO2+2MnSO4 +K2SO4 +H2O
25. Окисление спиртов
3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO +
K2SO4 + Cr2(SO4)3 + 7H2O
3СН2(ОН) – СН2(ОН) + 8КMnO4→
3KOOC – COOK +8MnO2 +2КОН +8Н2О
5СН2(ОН) – СН2(ОН) + 8КMnO4-+12H2SO4→
→5HOOC – COOH +8MnSO4 +4К2SO4 +22Н2О
26. Окисление альдегидов
3CH3CH=O + 2KMnO4 = CH3COOH +
+ 2CH3COOK + 2MnO2 + H2O
3CH3CH=O + K2Cr2O7 + 4H2SO4 =
= 3CH3COOH + Cr2(SO4)3 + 7H2O
3СН2О + 2K2Cr2O7 + 8H2SO4 =
= 3CO2 +2K2SO4 + 2Cr2(SO4)3 + 11H2O
27. Окисление карбоновых кислот
НСООН + HgCl2 =CO2 + Hg + 2HCl
HCOOH+ Cl2 = CO2 +2HCl
HOOC-COOH+ Cl2 =2CO2 +2HCl
28. Список источников и литературы
Список источников и
литературы
1. Ахлебинин А.К., Нифантьев Э.Е., Анфилов К.Л.
Органическая химия. Решение качественных задач. – М.:
Айрис-пресс, 2006
2. Габриелян О.С. Химия: пособие для школьников старших
классов и поступающих в вузы. – М.: Дрофа, 2006
3. Слета Л.А. Химия: Справочник. – Харьков: Фолио; М.:
ООО «Издательство АСТ», 2000
4. Новошинский И.И., Новошинская Н.С. Переходные
металлы. – Краснодар: «Советская Кубань», 2006
4.http://www1.ege.edu.ru/
5. http://www.it-n.ru (сообщества «Химоза» и «Подготовка
к ЕГЭ по химии»)
Слайды и текст этой презентации
Слайд 1Подготовка К ЕГЭ по химии
задание №30
окислительно – восстановительные реакции
Панфилова
Анна Евгеньевна
учитель химии МОУ «СОШ ст. Курдюм
им. Героя Советского Союза
П.Т. Пономарева»
2018 г.

Слайд 22 балла
2 балла
Задания №30 — 31 (ЕГЭ 2019 г.)
(с
единым контекстом)
Экзаменуемому следует записать
только по одному варианту ответа на
задания 30 и 31!

Слайд 3Перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат
бария, гидроксид калия. Допустимо использование водных растворов веществ.
Задание №30 (ЕГЭ
2019 г.)

Слайд 4Перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат
бария, гидроксид калия. Допустимо использование водных растворов веществ.
Задание №31 (ЕГЭ
2019 г.)

Слайд 5Задание №30 (ЕГЭ 2019 г.)
Проверяемые умения:
Определять степень окисления химических
элементов, окислитель и восстановитель;
Прогнозировать продукты окислительно-восстановительных реакций, в том числе
с учетом характера среды (кислой, щелочной, нейтральной);
Составлять уравнения окислительно-восстановительных реакций:
Составлять электронный баланс, на его основе расставлять коэффициенты в уравнениях реакций

Слайд 7Записываем формулы веществ
K2Cr2O7 , K2CO3 , Na2SO3 , H2SO4
,
SiO2
Определяем степени окисления атомов
K+12Cr+62O-27 , K+12C+4O-23
Na+12S+4O-23 , H+12S+6O-24 ,
Si+4O-22

Слайд 8Важнейшие окислители и восстановители
Процесс окисления всегда сопровождается процессом восстановления!
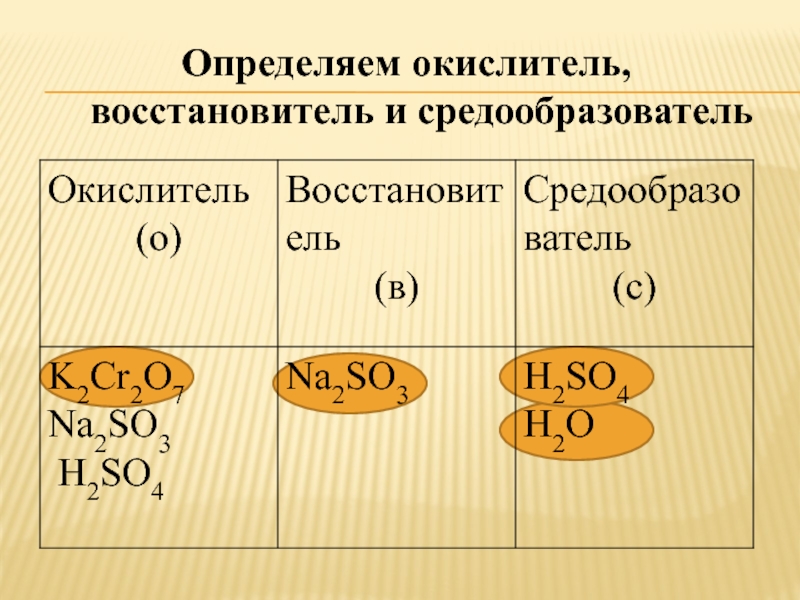
Слайд 9Определяем окислитель, восстановитель и средообразователь
Слайд 10Окислительно-восстановительные свойства соединений хрома
зеленый
жёлтый

Слайд 11
Среда кислая
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 +
Cr2(SO4)3 + K2SO4 + 4H2O

Слайд 12Среда нейтральная (слабощелочная за счет гидролиза сульфита)
3Na2SO3 + K2Cr2O7
+ 4H2O = 3Na2SO4 + 2Cr(OН)3 + 2KOН

Слайд 13Алгоритм выполнения задания №30
1. Правильно записать формулы веществ из
предложенного перечня
2. Определить степени окисления элементов, входящих в состав веществ
3.
Выбрать вещество – окислитель, вещество – восстановитель, вещество – средообразователь
4. Спрогнозировать продукты ОВР с учетом характера среды
5. Составить уравнение ОВР
6. Составить электронный баланс, на его основе расставить коэффициенты в уравнении реакции
7. Указать окислитель и восстановитель

Слайд 15 Оксид марганца (IV), серная кислота, сульфид меди
(II), хлорид калия, гидрокарбонат калия
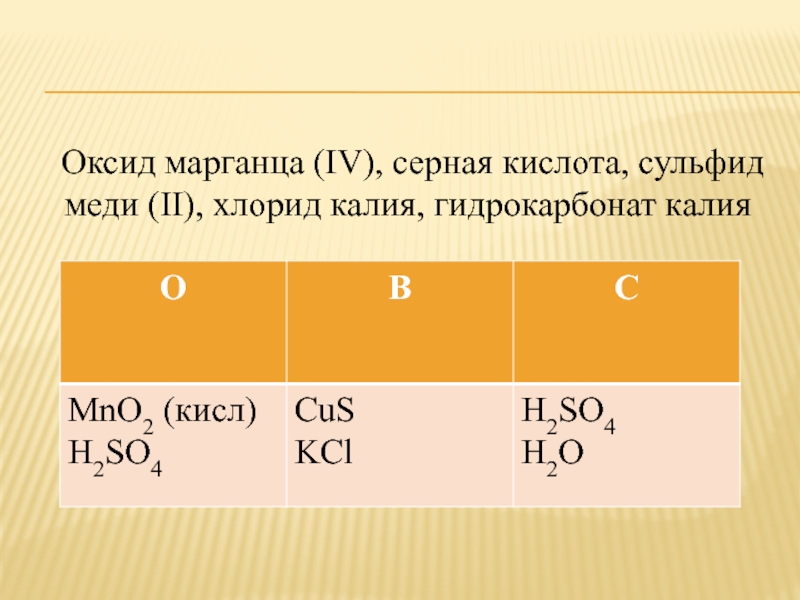
Слайд 16CuS + 4H2SO4 = CuSO4 + 4SO2 +4H2O
MnO2 +
2KCl + 2H2SO4 = MnSO4 + Cl2 + K2SO4 +
2H2O
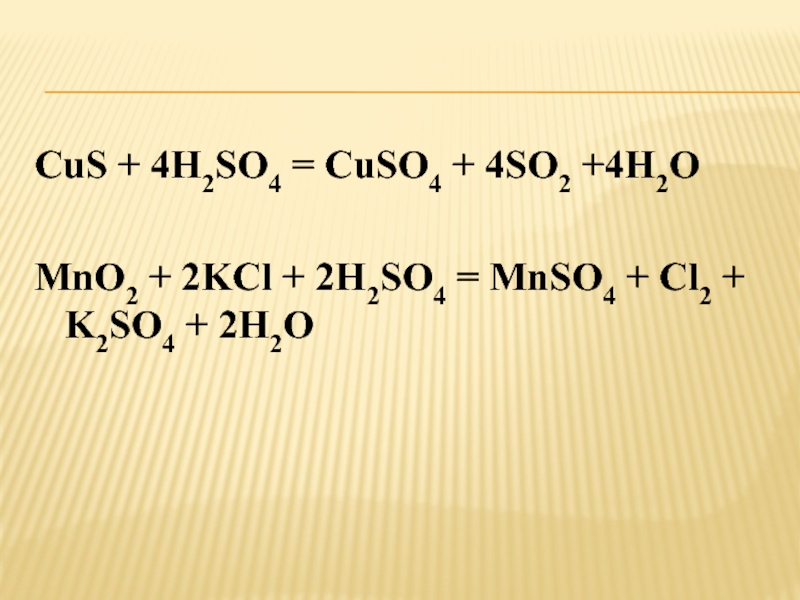
Слайд 17 Хлор, фтор, фтороводород, хлорат калия, гидроксид натрия.
2KClO3 = 2KCl + 3O2 НЕЛЬЗЯ!
Cl2 + H2O = HCl
+ HClO НЕЛЬЗЯ!
Cl2 + 2NaOH = NaCl + NaClO + H2O
KClO3 + F2 +2 NaOH = KClO4 + 2NaF + H2O

Слайд 18Задания для тренировки
1. KIO3 + … +
H2SO4 → I2 + K2SO4 + H2O
2. KNO2 + K2Cr2O7
+ … → KNO3 + Cr(NO3)3 + H2O
3. P + HClO3 + … → HCl + …
4. SO2 + K2Cr2O7 + … → K2SO4 + … + H2O
5. Al + K2Cr2O7 + … → … + Cr2(SO4)3 + K2SO4 + H2O
6. NH3 + KClO → N2 + KCl + … .
7. Cl2 + NH3· H2O → NH4Cl + N2 + … .
8. KMnO4 + NH3 → MnO2 + N2 + … + …
9. Zn + KNO3 + … → NH3 + K2ZnO2 + … .
10. SO2 + KMnO4 + … → MnSO4 + … + H2SO4
11. K2Cr2O7 + HCl (разб) + FeCl2 → FeCl3 + … + KCl + … .
12. KNO3 + K2CO3 + Cr2O3 → KNO2 + … + CO2
13. FeSO4 + H2SO4 + MnO2 → Fe2(SO4)3 + … + … .
14. NaBr + NaBrO3 + H2SO4 → … + Na2SO4 + H2O

Слайд 19 15. NaI + H2SO4 (конц) → …
+ H2S + Na2SO4 + …
16. Na2O2 + FeSO4 +
… → Fe2(SO4)3 + Na2SO4 + …
17. Be + NaOH + H2O → … + H2
18. H2O2 + Na3[Cr(OH)6] → … + H2O + NaOH
19. Na2Cr2O7 + H2S + H2SO4 → … + … + H2O + Na2SO4
20. H2S + K2Cr2O7 + H2SO4 → … + … + … + …
21. FeSO4 + H2O2 + H2SO4 → … + …
22. MnSO4 + NaClO + NaOH → MnO2 + … + … + …
23. C + H2SO4(конц) → … + … + …
24. KMnO4 + Na2S + H2SO4 → … + … + Na2SO4 + K2SO4 + H2O
25. KMnO4 + K2S + H2O → … + … + KOH
26. NaMnO4 + Na2SO3 + … → Na2MnO4 + … + H2O
27. K2Cr O4 + (NH4)2S + KOH + H2O → … + S + NH3

Слайд 20Новый вариант №30 (фипи)
1. Иодид
калия, серная кислота, гидроксид алюминия, оксид марганца(IV), нитрат магния.
2. сероводород, концентрированная азотная кислота, сульфат алюминия, оксид фосфора(V), нитрат меди(II).
3. пероксид водорода, гидроксид калия, оксид хрома(III), фосфат серебра, сульфат аммония.
4. дихромат калия, серная кислота, карбонат аммония, оксид кремния, нитрит калия.
5. хромат натрия, бромид натрия, фторид калия, серная кислота, нитрат магния.
6. бром, нитрат бария, сульфат аммония, концентрированная соляная кислота, перманганат калия.
7. нитрат аммония, дихромат калия, серная кислота, сульфид калия, фторид магния.

Слайд 21 8. сульфат аммония, гидроксид калия, перманганат калия,
нитрит калия, оксид меди(II).
9. концентрированная соляная кислота, оксид
фосфора(V), оксид марганца(IV), фторид аммония, нитрат кальция.
10. концентрированная соляная кислота, оксид углерода(IV), перманганат калия, фосфат калия, нитрат железа(III).
11. нитрат цинка, сульфит натрия, бром, гидроксид калия, оксид меди(II).
12. хлорат калия, гидроксид натрия, сульфат алюминия, оксид хрома(III), оксид магния.
13. фтороводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота.
14. хромат натрия, серная кислота, гидрокарбонат магния, оксид фосфора(V), нитрит натрия.

Слайд 2215. гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная
кислота.
16. сульфит калия, дихромат калия, серная кислота, гидроксид хрома(III),
оксид кремния.
17. перманганат калия, иодид калия, фторид аммония, ацетат натрия, сульфат магния.
18. гипохлорит натрия, гидроксид натрия, фторид цинка, оксид хрома(III), оксид кремния.
19. сера, концентрированная азотная кислота, оксид углерода(IV), фторид серебра, ацетат кальция.
20. перманганат калия, фосфин, серная кислота, нитрат лития, гидроксид алюминия.

МБОУ «Сергачская СОШ № 5»
Учитель химии Сычёва И.А.
Окислительно- восстановительные реакции
ФИПИ 2016
K 2 S + … + KBrO 4 = S + KBr + …
KNO 3 + … + Mg = Mg(OH) 2 + NH 3 + …
NO + … + HBrO 4 = HNO 3 + Br 2
KMnO 4 + HBr = Br 2 + MnBr 2 + … + …
KMnO 4 + Р H 3 + … = H 3 PO 4 + MnSO 4 + … + …
PH 3 + HBrO 3 = Br 2 + … + …
K 2 Cr 2 O 7 + K 2 SO 3 + … = Cr 2 (SO 4 ) 3 + … + …
K 2 Cr 2 O 7 + HI= I 2 + CrI 3 + … + …
HBr + HBrO 4 = Br 2 + …
NH 3 + KBr O 4 = KBr + N 2 + …





































































