Окислительные свойства азотной кислоты
02-Янв-2015 | Нет комментариев | Лолита Окольнова
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
автор статьи — Саид Лутфуллин
Азотная кислота – в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
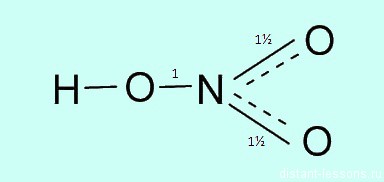
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV.
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5
Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
HNO3 + Ме → нитрат + H2O + продукт восстановленного азота
Два нюанса:
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
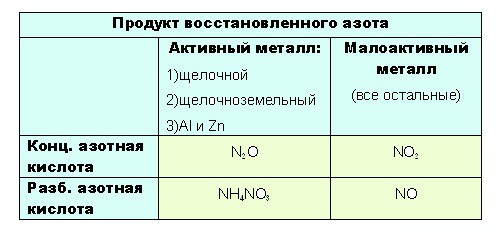
Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:
Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
Определить какой именно продукт будет образовываться можно чисто логически:
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH4NO3 или N2O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn. Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N2O, а при взаимодействии с разб. азотной кислотой NH4NO3.
4Ba + 10HNO3(конц.) → 4Ba(NO3)2 + 5H2O + N2O↑
4Ba + 10HNO3(разб.) → 4Ba(NO3)2 + 3H2O + NH4NO3
8Li + 10HNO3(конц.) → 8LiNO3 + 5H2O + N2O↑
8Li + 10HNO3(разб.) → 8LiNO3 + 3H2O + NH4NO3
8Al + 30HNO3(конц.) (t)→ 8Al(NO3)3 + 15H2O + 3N2O↑
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или O2.
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO. Ну а с конц. азотной NO2:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
Fe + 6HNO3(конц.) (t)→ Fe(NO3)3 + 3H2O + 3NO2↑
Fe + 4HNO3(разб.) → Fe(NO3)3 + 2H2O + NO↑
(обратите внимание, что железо окисляется до высшей степени окисления)
Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO↑
Если тяжело сразу понять всю логичность выбора, вот таблица:
Азотная кислота окисляет неметаллы до высших оксидов.
Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO2 или NO соответственно.
При окислении неметаллов концентрированной азотной кислотой образуется бурый газ (NO2), а если кислота разбавленная, то образуется NO. Схемы реакций следующие:
неметалл + HNO3(разб.) → соединение неметалла в высшей степени окисления + NO
неметалл + HNO3(конц.) → соединение неметалла в высшей степени окисления + NO2
C + 4HNO3(конц.) → CO2↑ + 2H2O + 4NO2↑
3C + 4HNO3(разб.) → 3CO2↑ + 2H2O + 4NO↑
(угольная кислота не образуется, так как она не стабильна)
P + 5HNO3(конц.) → H3PO4 + H2O + 5NO2↑
3P + 5HNO3(разб.) + 2H2O → 3H3PO4 + 5NO↑
B + 3HNO3(конц.) → H3BO3 + 3NO2↑
B + HNO3(разб.) + H2O → H3BO3 + NO↑
S + 6HNO3(конц.) → H2SO4 + 2H2O + 6NO2↑
S + 2HNO3(разб.) → H2SO4 + 2NO↑
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
2HNO3(конц.) + H2S → S↓ + 2NO2 + 2H2O
H2S + 8HNO3(конц.) → H2SO4 + 8NO2↑ + 4H2O
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
CuS + 8HNO3(конц.) → CuSO4 + 4H2O + 8NO2↑
- азотная кислота настолько сурова, что может окислить даже ГАЛОГЕН. Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO3:
10HNO3(конц.) + I2 (t)→ 2HIO3 + 10NO2↑ + 4H2O
10HNO3(разб.) + 3I2 (t)→ 6HIO3 + 10NO↑ + 2H2O
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
NaCl(тв.) + HNO3(конц.) → HCl↑ + NaNO3
NaF(тв.) + HNO3(конц.) → HF↑ + NaNO3
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO2:
8HNO3(конц.) + 6KBr(тв.) → 3Br2 + 4H2O + 6KNO3 + 2NO2↑
4HNO3(конц.) + 2NaI(тв.) → 2NaNO3 + 2NO2↑ + 2H2O + I2↓
Образовавшийся иод окисляется дальше до иодноватой кислоты, поэтому реакцию можно записать сразу:
7HNO3(конц.) + NaI → NaNO3 + 6NO2↑ + 3H2O + HIO3
То же самое происходит при взаимодействии с иодо- и бромоводородами:
2HNO3(конц.) + 2HBr → Br2 + 2NO2↑ + 2H2O
6HNO3(конц.) + HI → HIO3 + 6NO2↑ + 3H2O
Реакции с золотом, магнием, медью и серебром
Обсуждение: «Окислительные свойства азотной кислоты»
(Правила комментирования)
3. Химические свойства соединений азота с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 3.1. Аммиак в реакциях, как правило, окисляется до азота:
4NH3 + 3O2 → 2N2
8NH3 + 3Cl2 → N2
2NH3 + 3CuO → 3Cu + N2
2NH4Cl + 4CuO → 3Cu + N2
2NH3 + 3H2O2 → N2
2NH3 + 2K2FeO4 + 5H2SO4 → Fe2(SO4)3 + N2
8NH3 + 3KBrO4 → 3KBr + 4N2
2NH3 + 3KClO → 3KCl + N2
4NH3 + 3Ca(ClO)2 → 3CaCl2 + 2N2
2NH3 + 2NaMnO4 → 2MnO2

2NH3 + 6NaMnO4 + 6NaOH → 6Na2MnO4 + N2
2NH3×H2O + 2KMnO4 → 2MnO2

Исключение:
В присутствии катализатора аммиак окисляется кислородом до оксида азота (II), а не простого вещества:
4NH3 + 5O2 → 2NO
Правило 3.2. Нитриды (и для аналогии фосфиды) активных металлов легко реагируют с водой и растворами кислот:
1. Реакции с водой:
Mg3N2 + H2O → 3Mg(OH)2 + 2NH3
Na3N + H2O → NaOH + NH3
Ca3P2 + 6H2O → 3Ca(OH)2 +2PH3
2. В реакциях с кислотами образуются соли (в случае нитридов) или фосфин (в случае фосфидов):
Ca3N2 + HCl → 3CaCl2 + 2NH4Cl
Zn3P2 + 6HCl → 3ZnCl2 + 2PH3
3.3. Взаимодействие азотной кислоты с простыми и сложными веществами
Нитраты
Правило 3.4. С металлами (Al, Zn, Mg) в щелочной среде нитраты восстанавливаются до аммиака:
Сначала выделяется атомарный водород, который и восстанавливает нитрат до аммиака.
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3
Правило 3.5. При сплавлении в щелочной среде нитраты восстанавливаются до нитритов:
3NaNO3 + Cr2O3 + 4KOH → 3NaNO2 + 2K2CrO4 + 2H2O
3NaNO3 + Cr2O3 + 2Na2CO3 → 3NaNO2 + 2Na2CrO4 + 2CO2
KNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
2NaNO3 + FeSO4 + 4NaOH → 2NaNO2 + Na2FeO4 + Na2SO4 + 2H2O
3NaNO3 + Fe2O3 + NaOH → 3NaNO2 + 2Na2FeO4 + 2H2O
3KNO3 + Fe + 2KOH → 3KNO2 + K2FeO4 + H2O
Правило 3.6. Неметаллами нитраты восстанавливаются до нитритов:
2KNO3 + C → 2KNO2 + CO2
2KNO3 + S → 2KNO2 + SO2
Правило 3.7. В кислотной среде нитраты также являются сильными окислителями:
Cu + 2KNO3 + 2H2SO4 → CuSO4 + 2NO2
3Cu + 2KNO3 + 4H2SO4 → 3CuSO4 + 2NO
Правило 3.8. С солями аммония, по сути, идет разложение нитрата аммония:
KNO3 + NH4Cl → N2O

Правило 3.9. В случае нитрата слабого металла именно метал будет окислителем, а не азот:
8AgNO3 + PH3 + 4H2O → Ag + H3PO4 + HNO3
Правило 3.10. Термическое разложение нитратов:
MNO3 → MNO2 + O2
M – металл, находящийся в ряду напряжений металлов левее Mg, исключая Li.
MNO3 → MO + NO2

M – металл, находящийся в ряду напряжений металлов от Mg до Cu (Mg и Cu включительно), а также Li.
MNO3 → M + NO2

M – металл, находящийся в ряду напряжений металлов правее Cu.
Если металл, входящий в состав соли, может быть окислен (выделяющимися газами), то при разложении образуется оксид с более высокой степенью окисления металла:
4Fe(NO3)2 → 2Fe2O3 + 8NO2

Mn(NO3)2 → MnO2 + 2NO2
Нитриты
Правило 3.11. Сильными окислителями нитриты окисляются до нитратов:
3KNO2 + 2CrO3 + 3H2SO4 → 3KNO3 + Cr2(SO4)3 + 3H2O
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
NaNO2 + 2KMnO4 + 2KOH → NaNO3 + 2K2MnO4 + H2O
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2
KNO2 + H2O2 → KNO3 + H2O
KNO2 + I2 + H2O → KNO3 + 2HI
Правило 3.12. В реакциях с типичными восстановителями (I–, Fe+2 и др.) нитриты восстанавливаются до NO:
2KNO2 + 2KI + 2H2SO4 → 2NO

HNO2 + 2HI → 2NO

Исключение: реакции нитритов с солями аммония, выделяется азот:
NaNO2 + NH4Cl → N2
Ca(NO2)2 + (NH4)2SO4 → 2N2
Оксиды азота
Правило 3.13. Оксид азота (IV) диспропорционирует в реакциях с водой и растворами щелочей и карбонатов щелочных металлов:
Т.к. оксиду NO2 соответствуют две кислоты, при взаимодействии с щелочью или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла:
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
3NO2 + H2O → 2HNO3 + NO
В аналогичных реакциях с кислородом образуются только соединения с N+5 :
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
Правило 3.14. Сильными окислителями NO, как правило, окисляется до N+5 :
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
Но есть и исключения:
2NO + O2 → 2NO2
NO в роли окислителя:
2NO + 2SO2 → N2
2NO + 2Cu → N2
Правило 3.15. В реакциях с типичными восстановителями NO2, как правило, восстанавливается до NO или N2:
2NO2 + P2O3 + 4KOH → 2NO
6NO2 + FeI2 → Fe(NO3)3 + I2 + 3NO
10NO2 + 4P → P2O5 + 10NO
NO2 + SO2 → SO3 + NO
2NO2 + 2C → N2
2NO2 + 2S → N2
2NO2 + 4Cu → N2
Правило 3.16. Как и у всех оксидов азота, у N2O преобладают окислительные свойства, что делает возможным окисление металлов:
N2O + Cu → CuO + N2
N2O + Cu2O → 2CuO + N2
Азотная кислота в овр
Азотная
кислота может окислять металлы, неметаллы,
сложные вещества. При окислении неметаллов
и сложных веществ концентрированная
азотная кислота, как правило
восстанавливается до оксида азота (IV),
разбавленная – до оксида азота (II)
Схема
4. Поведение концентрированной азотной
кислоты в ОВР

Cхема
5. Поведение разбавленной азотной кислоты
в ОВР
Особенно
часто в ЕГЭ встречаются уравнения
реакций окисления сульфидов азотной
кислотой. Концентрированная азотная
кислота окисляет соединения серы до
сульфатов, разбавленная – окисляет
сульфиды до свободной серы.
Рассмотрим
примеры:
CuS
+ 8HNO3
(конц.)
=
CuSO4
+ 8NO2
+ 4H2O
3H2S
+ 2HNO3
(разб.)
=
3S
+ 2NO
+ 4H2O
Серная кислота
Схема
6. Поведение концентрированной серной
кислоты в ОВР
Приведем
примеры:
H2SO4
+
2HBr
= Br2
+ SO2
+
2H2O
(бромоводород – слабый восстановитель)
H2SO4
+
8HI
= 4I2
+ H2
S+
4H2O
(йододород – сильный восстановитель)
Галогены
и
их кислородные соединения восстанавливаются
до галогенид-анионов:
KClO3
+3KNO2
= KCl
+ 3KNO3
Ферраты
восстанавливаются до солей железа
(III):
2K2FeO4
+
16HCl = 3Cl2
+ 2FeCl3
+
4KCl + 8H2O
Наиболее
часто встречающиеся в ЕГЭ восстановители:
сероводород, сульфиды, сульфиты, нитриты,
галогениды, аммиак, невысшие оксиды
(марганца, фосфора, серы), соли железа
(II),
марганца (II),
хрома (II)
и (III),
металлы.
Наибольшее
разнообразие продуктов дают соединения
серы:
С
хема
7. Окисление соединений серы

С
остальными восстановителями всё
достаточно однозначно:
Нитриты
окисляются до нитратов, галогениды
окисляются до свободных галогенов (в
случае очень сильных окислителей – до
галогенат-анионов ГалО3
–
).
Аммиак
окисляется, как правило, до азота.
Невысшие
оксиды фосфора и серы в безводной среде
– до высших оксидов, в нейтральной и
кислой среде – до высших кислот, в
щелочной среде – до солей высших кислот.
Оксид
марганца (IV)
– до манганата в щелочной среде,
перманганата – в кислой среде.
Соли
железа (II)
– до солей железа (III)
в кислой среде, до гидроксида железа
(III)
– в нейтральной и щелочной среде, очень
сильные окислители в щелочной среде
приводят к окислению до феррата.
Соли
марганца (II)
– в нейтральной среде до оксид марганца
(IV),
в щелочной среде – до манганата, в кислой
в присутствии очень сильного окислителя
– до перманганата.
Соли
хрома (II)
окисляются до солей хрома (III),
соли хрома (III)
— в щелочной среде до хроматов, в кислой
– до дихроматов.
Задание
Предположите
продукты реакций, расставьте коэффициенты.
Выбранные Вами продукты реакций
обоснуйте.
Пример выполнения домашнего задания:
Задание:
дихромат калия с водным раствором
сероводорода.
Решение:
Дихромат калия – окислитель, сероводород
– восстановитель, среда будет близка
к нейтральной, так как сероводород –
очень слабая кислота, а растворимость
сероводорода незначительная.
В
нейтральной среде дихромат восстанавливается
до гидроксида хрома (III)
(схема 3), а сероводород окисляется до
серы (схема 7)
K2Cr2O7
+ 3H2S
+ H2O
= 3S + 2Cr(OH)3
+ 2KOH
1)
перманганат калия с нитритом натрия в
растворе гидроксида калия;
2)
сероводород с водным раствором хромата
калия;
3)
алюминий с очень разбавленной азотной
кислотой (см. таблицу 1);
4)
фосфор с концентрированной серной
кислотой;
5)
сульфит калия с концентрированной
азотной кислотой;
6)
бромат калия с йодидом калия в сернокислом
растворе;
7)
сульфат железа (II)с
концентрированной серной кислотой;

сульфат хрома (III)
с бромом в растворе гидроксида калия;
9)
нитрат натрия с раствором гидроксида
натрия в присутствии алюминия;
10)
феррат калия с водным раствором аммиака.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1. Окислители и восстановители
2. Классификация окислительно–восстановительных реакций
3. Основные правила составления ОВР
4. Общие закономерности протекания ОВР
5. Основные схемы ОВР
5.1. Схема восстановления перманганатов
5.2. Схема восстановления хроматов/бихроматов
5.3. Разложение нитратов
5.4. Окислительные свойства азотной кислоты
5.5. Взаимодействие металлов с серной кислотой
5.6. Пероксид водорода
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
-
перманганат калия (KMnO4);
-
дихромат калия (K2Cr2O7);
-
азотная кислота (HNO3);
-
концентрированная серная кислота (H2SO4);
-
пероксид водорода (H2O2);
-
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
-
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2Al0 + Fe+32O3 → Al+32O3 + 2Fe0,
C0 + 4HN+5O3(конц) = C+4O2 ↑ + 4N+4O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
(N-3H4)2Cr+62O7 → N20 ↑+ Cr+32O3 + 4 H2O,
2 NaN+5O-23 → 2 NaN+3O2 + O02↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2S-2 + S+4O2 = 3S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается, а восстановитель окисляется.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K+2S-2 + 2K+Mn+7O-24 = 2K+2Mn+6O-24 + S0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S-2 -2e = S0
Mn+7 + 1e = Mn+6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn+7 в кислой среде восстанавливается до Mn+2, а в щелочной — до Mn+6);
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N+5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3);
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N+5.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2+. Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны. В нейтральном растворе марганец восстанавливается до степени окисления +4, с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6. Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S + 2 KMnO4 + 8 H2SO4 = 5 S + 2 MnSO4 + 6 K2SO4 + 8 H2O,
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
K2S + 2 KMnO4 –(KOH)= 2 K2MnO4 + S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P-3, As-3= P+5, As+5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III). Соединения хрома Cr+3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6].
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As+5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 + O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО + 4NO2 + O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N+5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I) («веселящий газ») и вода:
NH4NO3 → N2O + 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N+3 и восстановителя N-3
NH4NO2 → N2 + 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 + 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO3)2 → 2FeO + 4NO2 + O2 при 60°C
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
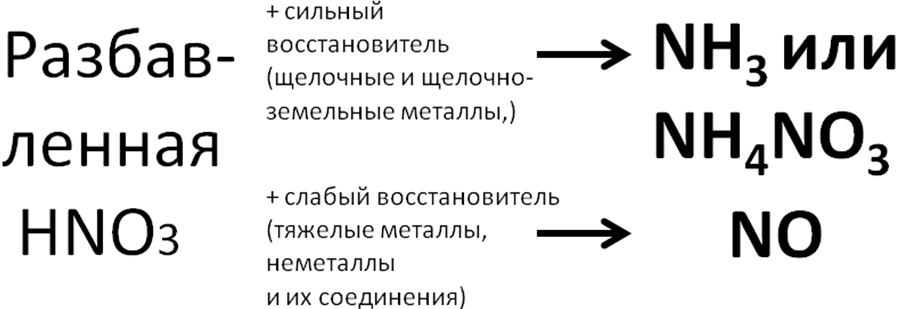
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N+4); оксид азота (II) NO (N+2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3. Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV) NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu+ 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота (I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na+ 10HNO3 = 8NaNO3 + N2O + 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H+, которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например:
Fe + H2SO4(разб) = FeSO4 + H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S+4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 + 2H2S+6O4(конц) = Cu+2SO4 + S+4O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 + 5H2S+6O4(конц) → 4Na2+SO4 + H2S—2 + 4H2O
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
S+4O2 + H2O2-1 → H2S+6O4-2
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например:
2KMn+7O4 + 5H2O2-1 + 3H2SO4 → 5O20 + 2Mn+2SO4 + K2SO4 + 8H2O
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары
желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной
кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

Получение
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
NH3 + O2 → (кат. Pt) NO + H2O
NO + O2 → NO2
NO2 + H2O + O2 → HNO3
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
Химические свойства
- Кислотные свойства
- Термическое разложение
- Реакции с неметаллами
- Реакции с металлами
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии
выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в
темном месте.
HNO3 → (hv) NO2 + H2O + O2
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2,
если разбавленная — до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой
именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием
нитрата и преимущественно NO2.
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2,
NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка
с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит
за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так
как оксидная пленка на поверхности металлов разрушается.
Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Соли азотной кислоты — нитраты NO3—
Получение
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
MgO + HNO3 → Mg(NO3)2 + H2O
Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O

Нитрат аммония получают реакция аммиака с азотной кислотой.
NH3 + HNO3 → NH4NO3
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная
кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
Химические свойства
- Реакции с металлами, основаниями и кислотами
- Разложение нитратов
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате
реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
AgNO3 + KCl → AgCl↓ + KNO3

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.

Pb(NO3)2 → (t) PbO + NO2 + O2
NaNO3 → (t) NaNO2 + O2
Cu(NO3)2 → (t) CuO + NO2 + O2
PtNO3 → (t) Pt + NO2 + O2

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Муниципальное автономное
общеобразовательное учреждение- средняя общеобразовательная школа № 1 имени
В.И. Фадеева станицы Калининской
Консультация по химии
для подготовки к единому
государственному экзамену
на тему «Азотная кислота»
Выполнила:
Учитель химии
Каблучкина Наталья Борисовна
Ст. Калининская
2014г
Задачи занятия:
Обобщить
знания об азотной кислоте, полученные в курсе неорганической и органической
химии.
На
примере азотной кислоты повторить классификацию и основные свойства кислот в
свете ТЭД, закономерности протекания ОВР, реакции гидролиза и электролиза,
решение задач на растворы, по алгоритму.
Продолжить
отработку умений выполнять тестовые задания части А,В,С единого
государственного экзамена.
Оборудование:
—
опорные схемы по теории,
—
раздаточные таблицы по взаимодействию азотной кислоты с металлами,
—
тестовые задания.
Ход занятия
1. Организационный момент.
Приветствие
учащихся. Сообщение темы и цели занятия.
2.Учитель обобщает материал по данной теме с
использованием опорных схем на экране компьютера:
Азотная
кислота
НNO3 (N+5,
NIV)
— одноосновная
— кислородсодержащая
— сильный электролит
— сильный окислитель
Получают: NH3
→ NO → NO2
→HNO3
Физ. свойства:
Ж, беcцветная, дымящая,
резкий запах,
tкип.
= 860С,
Хим. свойства:
1.
Нестойкая, разлагается на свету, при t
4НNO3
→ 4NO2↑ + 2Н2О + О2↑
( желтеет при неправильном хранении)
2.
Диссоциирует НNO3
→Н+ + NO3—
кислотные свойства
+ основные, амфотерные оксиды
+ основания
+ соли слабых кислот
3.
Окисляет все металлы, кроме Аu, Pt
с образованием
трёх продуктов:
Ме + НN+5O3 → соль +
вода + ↑ соед. N+4,
N+2,
N+1,
N20
, N-3
|
HNO3 |
-не Au,Pt |
||||||
|
Концентрированная (пассивация |
Разбавленная |
||||||
|
активные |
неактивные в-ва |
неактивные в-ва |
активные |
активные |
|||
|
|
|
NO↑ |
N2↑ |
NH3 ( NH4NO3) |
|||
|
HNO3 концентрированная
|
кислота или 4HNO3 2HNO3 |
||||||
4.Реагирует
с органическими веществами( алканы, арены,
фенол, анилин, целлюлоза, белки)
реакции замещения — нитрования
НNO3
→ НО — NO2 –
нитрогруппа
СН4 + HNO3
→ СН3—
NO2 + Н2О
С6Н6 + HNO3
→ С6Н5—
NO2 + Н2О
Качественная реакция на нитраты
нитрат
+ конц. Н2SO4 + Cu → … + NO2↑
Разложение нитратов
(по
ряду активности металлов)
|
1. Металлы левее магния |
KNO3 à КNO2 + O2 |
|
2. до |
Mg(NO3) металла* + NO2 + O2 |
|
3. |
|
3.Учащиеся
задают вопросы, используя записи собственного конспекта и предложенных
опорных схем.
Например: — Что
значит пассивация?
— Какая кислота называется оксикислотой?
— Как правильно записать качественные реакции на нитраты?
— Какие соли называются силитрами?
4.
Отработка умения записывать уравнения ОВР химических
реакций и расставлять коэффициенты методом электронного баланса.
Два
ученика у доски работают с уравнениями:
Cu
+ 4HNO3(конц) = Cu(NO3)2
+ 2H2O + 2NO2
3Cu
+ 8HNO3(разб) = 3Cu(NO3)2
+ 4H2O + 2NO
5. Выполнение
учащимися тестовых заданий и задания уровня С .
Учащиеся
работают дифференцированно: 2 ученика с заданиями С у доски, 3 ученика с
заданиями В вместе, остальные с заданиями А самостоятельно. Учитель выполняет
роль консультанта.
Часть
А
1.Какой
оксид реагирует с раствором НNO3,
но не реагирует с раствором NaOH?
1)
CO 3) P2O5
2)
SO3 4) MgO
2.
Азотная кислота реагирует с каждым веществом набора:
1)
KOH и Na2СO3
2)
HCl и NaOH
3) CuO
и KNO3
4) Fe2O3
и H2SO4
3.В
схеме превращений NH3⎯→ X ⎯→ Y⎯→ НNO3 ⎯→ Y
веществами
«X» и «Y» являются соответственно
1) NO2
и NO
2) NO и NO2
3)
Н2 и Н2О
4)
HCl и H2O
4.Взаимодействие
азотной кислоты с аммиаком относится к реакциям
1)
соединения, необратимым
2)
обмена, обратимым
3)
замещения, обратимым
4)
обмена, необратимым
5.В
отличие от этилена, этан реагирует с
1)
хлором
2)
водородом
3)
азотной кислотой
4)
кислородом
6.
Наибольшее количество нитрат-ионов образуется в растворе при диссоциации 1 моль
1)
нитрата натрия
2)
нитрата меди(II)
3)
нитрата алюминия
4)
нитрата кальция
7.
Одинаковую реакцию среды имеют растворы нитрата меди(II) и
1)
хлорида кальция
2)
нитрата натрия
3)
сульфата алюминия
4)
ацетата натрия
8.
Окислительные свойства азотная кислота проявляет в реакции, схема которой:
1) НNO3+ NH3
→ NH4NO3
2) НNO3+
KOH →
KNO3+
H2O
3) НNO3 + P
→ H3 PO4
+ NO2
4) НNO3+ CuO
→ Cu(NO3)2
+ H2O
Часть
В
В-1. Установите
соответствие между формулой соли и её способностью к гидролизу.
ФОРМУЛА СОЛИ СПОСОБНОСТЬ
К ГИДРОЛИЗУ
1) NН4NO3
А) по катиону
2) Ва(NO3)2
Б) по аниону
3) Аl(NO3)3
В) по катиону и аниону
Г) гидролизу не подвергается
В-2. Установите
соответствие между формулой вещества и продуктом, который образуется на аноде в
результате электролиза водного раствора этого вещества.
|
ФОРМУЛА |
ПРОДУКТ |
|
А) AgNO3 Б) HNO3 В) NaNO3 |
1) оксид 2) азот 3) 4) |
В-3. Определите массу воды, которую надо добавить к 20
г раствора азотной
кислоты с массовой долей 70% для получения раствора
азотной кислоты
с массовой долей 5%. (Запишите число с точностью до
целых.)
Ответ: ___________ г.
В-4. Рассчитайте объём оксида азота (+4), полученный
при разложении 126 г азотной кислоты. %. (Запишите число с точностью до
десятых.)
Ответ: ___________ л.
Часть С
С-1. Используя метод электронного баланса,
составьте уравнение реакции
НNO3
+ СuS
→ СuSO4
+ … + H2O
Укажите окислитель и восстановитель.
С- 2. Сплав серебра с медью массой 0,5 кг
обработали раствором азотной кислоты. К полученному раствору добавили соляную
кислоту. Масса образовавшегося осадка равна 430 г. Определите массовую долю
серебра в сплаве.
6. Разбор
выполненных заданий:
Ответы на
задания части А с комментариями.
Ответы на
задания части В с комментариями.
Комментарии
выполненных на доске заданий части С.