3. Химические свойства соединений азота с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 3.1. Аммиак в реакциях, как правило, окисляется до азота:
4NH3 + 3O2 → 2N2
8NH3 + 3Cl2 → N2
2NH3 + 3CuO → 3Cu + N2
2NH4Cl + 4CuO → 3Cu + N2
2NH3 + 3H2O2 → N2
2NH3 + 2K2FeO4 + 5H2SO4 → Fe2(SO4)3 + N2
8NH3 + 3KBrO4 → 3KBr + 4N2
2NH3 + 3KClO → 3KCl + N2
4NH3 + 3Ca(ClO)2 → 3CaCl2 + 2N2
2NH3 + 2NaMnO4 → 2MnO2

2NH3 + 6NaMnO4 + 6NaOH → 6Na2MnO4 + N2
2NH3×H2O + 2KMnO4 → 2MnO2

Исключение:
В присутствии катализатора аммиак окисляется кислородом до оксида азота (II), а не простого вещества:
4NH3 + 5O2 → 2NO
Правило 3.2. Нитриды (и для аналогии фосфиды) активных металлов легко реагируют с водой и растворами кислот:
1. Реакции с водой:
Mg3N2 + H2O → 3Mg(OH)2 + 2NH3
Na3N + H2O → NaOH + NH3
Ca3P2 + 6H2O → 3Ca(OH)2 +2PH3
2. В реакциях с кислотами образуются соли (в случае нитридов) или фосфин (в случае фосфидов):
Ca3N2 + HCl → 3CaCl2 + 2NH4Cl
Zn3P2 + 6HCl → 3ZnCl2 + 2PH3
3.3. Взаимодействие азотной кислоты с простыми и сложными веществами
Нитраты
Правило 3.4. С металлами (Al, Zn, Mg) в щелочной среде нитраты восстанавливаются до аммиака:
Сначала выделяется атомарный водород, который и восстанавливает нитрат до аммиака.
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3
Правило 3.5. При сплавлении в щелочной среде нитраты восстанавливаются до нитритов:
3NaNO3 + Cr2O3 + 4KOH → 3NaNO2 + 2K2CrO4 + 2H2O
3NaNO3 + Cr2O3 + 2Na2CO3 → 3NaNO2 + 2Na2CrO4 + 2CO2
KNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
2NaNO3 + FeSO4 + 4NaOH → 2NaNO2 + Na2FeO4 + Na2SO4 + 2H2O
3NaNO3 + Fe2O3 + NaOH → 3NaNO2 + 2Na2FeO4 + 2H2O
3KNO3 + Fe + 2KOH → 3KNO2 + K2FeO4 + H2O
Правило 3.6. Неметаллами нитраты восстанавливаются до нитритов:
2KNO3 + C → 2KNO2 + CO2
2KNO3 + S → 2KNO2 + SO2
Правило 3.7. В кислотной среде нитраты также являются сильными окислителями:
Cu + 2KNO3 + 2H2SO4 → CuSO4 + 2NO2
3Cu + 2KNO3 + 4H2SO4 → 3CuSO4 + 2NO
Правило 3.8. С солями аммония, по сути, идет разложение нитрата аммония:
KNO3 + NH4Cl → N2O

Правило 3.9. В случае нитрата слабого металла именно метал будет окислителем, а не азот:
8AgNO3 + PH3 + 4H2O → Ag + H3PO4 + HNO3
Правило 3.10. Термическое разложение нитратов:
MNO3 → MNO2 + O2
M – металл, находящийся в ряду напряжений металлов левее Mg, исключая Li.
MNO3 → MO + NO2

M – металл, находящийся в ряду напряжений металлов от Mg до Cu (Mg и Cu включительно), а также Li.
MNO3 → M + NO2

M – металл, находящийся в ряду напряжений металлов правее Cu.
Если металл, входящий в состав соли, может быть окислен (выделяющимися газами), то при разложении образуется оксид с более высокой степенью окисления металла:
4Fe(NO3)2 → 2Fe2O3 + 8NO2

Mn(NO3)2 → MnO2 + 2NO2
Нитриты
Правило 3.11. Сильными окислителями нитриты окисляются до нитратов:
3KNO2 + 2CrO3 + 3H2SO4 → 3KNO3 + Cr2(SO4)3 + 3H2O
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
NaNO2 + 2KMnO4 + 2KOH → NaNO3 + 2K2MnO4 + H2O
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2
KNO2 + H2O2 → KNO3 + H2O
KNO2 + I2 + H2O → KNO3 + 2HI
Правило 3.12. В реакциях с типичными восстановителями (I–, Fe+2 и др.) нитриты восстанавливаются до NO:
2KNO2 + 2KI + 2H2SO4 → 2NO

HNO2 + 2HI → 2NO

Исключение: реакции нитритов с солями аммония, выделяется азот:
NaNO2 + NH4Cl → N2
Ca(NO2)2 + (NH4)2SO4 → 2N2
Оксиды азота
Правило 3.13. Оксид азота (IV) диспропорционирует в реакциях с водой и растворами щелочей и карбонатов щелочных металлов:
Т.к. оксиду NO2 соответствуют две кислоты, при взаимодействии с щелочью или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла:
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
3NO2 + H2O → 2HNO3 + NO
В аналогичных реакциях с кислородом образуются только соединения с N+5 :
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
Правило 3.14. Сильными окислителями NO, как правило, окисляется до N+5 :
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
Но есть и исключения:
2NO + O2 → 2NO2
NO в роли окислителя:
2NO + 2SO2 → N2
2NO + 2Cu → N2
Правило 3.15. В реакциях с типичными восстановителями NO2, как правило, восстанавливается до NO или N2:
2NO2 + P2O3 + 4KOH → 2NO
6NO2 + FeI2 → Fe(NO3)3 + I2 + 3NO
10NO2 + 4P → P2O5 + 10NO
NO2 + SO2 → SO3 + NO
2NO2 + 2C → N2
2NO2 + 2S → N2
2NO2 + 4Cu → N2
Правило 3.16. Как и у всех оксидов азота, у N2O преобладают окислительные свойства, что делает возможным окисление металлов:
N2O + Cu → CuO + N2
N2O + Cu2O → 2CuO + N2
1. Положение азота в периодической системе химических элементов
2. Строение атома азота
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения азота
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и кремнием
7.1.3. Взаимодействие с водородом и фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
Аммиак
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с серной кислотой
3.2. Взаимодействие с азотной кислотой
3.3. Взаимодействие с солями
Соли аммония
Способы получения солей аммония
Химические свойства солей аммония
Оксиды азота
1. Оксид азота (I)
2. Оксид азота (II)
3. Оксид азота (III)
4. Оксид азота (IV)
5. Оксид азота (V)
Азотная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация азотной кислоты
2.3. Взаимодействие с основными и амфотерными оксидами и гидроксидами
2.4. Вытеснение более слабых кислот из солей
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
2.7. Окисление сложных веществ
2.8. Взаимодействие с белками
Азотистая кислота
Соли азотной кислоты — нитраты
Соли азотистой кислоты — нитриты
Азот
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии:
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5
азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III)
азотистая кислота нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3
нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (3000оС-5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка.
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например, хлорид аммония реагирует с нитратом серебра:
NH4Cl + AgNO3 → AgCl + NH4NO3
3. Средние соли аммония можно получить из кислых солей аммония. При добавлении аммиака кислая соль переходит в среднюю.
Например, гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
NH4НCO3 + NH3 → (NH4)2CO3
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты, почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4+ + Cl–
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Например, карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
Соли аммония реагируют с щелочами с образованием аммиака.
Например, хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону, т.к. гидроксид аммония — слабое основание:
NH4Cl + Н2O ↔ NH3 ∙ H2O + HCl
NH4+ + HOH ↔ NH3 ∙ H2O + H+
4. При нагревании соли аммония разлагаются. При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
NH4HS → NH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
NH4NO2 → N2 + 2H2O
190 – 245° C:
NH4NO3 → N2O + 2H2O
При температуре 250 – 300°C:
2NH4NO3 → 2NO + 4H2O
При температуре выше 300°C:
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II) | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Оксид азота (I) – это несолеобразующий оксид. Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
NH4NO3 → N2O + 2H2O
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + H2 → N2 + H2O
N2O + Mg → N2 + MgO
N2O + 2Cu → N2 + Cu2O
3N2O + 2NH3 → 4N2 + 3H2O
N2O + H2O + SO2 → N2 + H2SO4
Еще пример: оксид азота (I) окисляет углерод и фосфор при нагревании:
N2O + C → N2 + CO
5N2O + 2Р → 5N2 + Р2O5
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например, N2O окисляется раствором перманганата в серной кислоте:
5N2O + 3H2SO4 + 2KMnO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 + NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 + O2 → 2NO
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака:
4NH3 + 5O2 → 4NO + 6H2O
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO + O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
NO + O3 → NO2 + O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO + 2H2 → N2 + 2H2O
2NO + 2SO2 → 2SO3 + N2
Оксид азота (III)
Оксид азота (III), азотистый ангидрид – кислотный оксид. За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: можно получить при низкой температуре из оксидов азота:
NO2 + NO ↔ N2O3
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O ↔ 2HNO2
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами:
Например, оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
N2O3 + 2NaOH → 2NaNO2 + H2O
N2O3 + Na2O → 2NaNO2
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2NO + O2 → 2NO2
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
2NO2 + H2O → HNO3 + HNO2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O + O2 → 4HNO3
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O → 2HNO3 + NO
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 → Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода образуются только нитраты:
4NO2 + 4NaOH + O2 → 4NaNO3 + 2H2O
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор, уголь, сера, оксид серы (IV) окисляется до оксида серы (VI):
2NO2 + 2S → N2 + 2SO2
2NO2 + 2C → N2 + 2CO2
10NO2 + 8P → 5N2 + 4P2O5
NO2 + SO2 → SO3 + NO
4. Оксид азота (IV) димеризуется:
2NO2 ⇄ N2O4
Оксид азота (V)
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота:
2NO2 + O3 → N2O5 + O2
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V):
2HNO3 + P2O5 → 2HPO3 + N2O5
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
N2O5 + H2O → 2HNO3
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например, оксид азота (V) реагирует с гидроксидом натрия:
N2O5 + 2NaOH → 2NaNO3 + H2O
Еще пример: оксид азота (V) реагирует с оксидом кальция:
N2O5 + CaO → Ca(NO3)2
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель.
Например, он окисляет серу:
2N2O5 + S → SO2 + 4NO2
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
2N2O5 → 4NO2 + O2
Азотная кислота
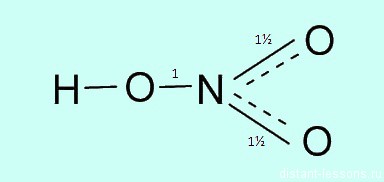
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет йодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С + 4HNO3 → 3СО2 + 4NO + 2H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотистая кислота
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства.
1. Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 + 2NO + H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 + NaOH → NaNO2 + H2O
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 + 4H2O
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов (до Mg в электрохимическом ряду) разлагаются до нитрита и кислорода.
Например, разложение нитрата натрия:
2KNO3 → 2KNO2 + O2
Исключение – литий.
Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов (от Mg до Cu, включая магний и медь) и литий разлагаются до оксида металла, оксида азота (IV) и кислорода:
Например, разложение нитрата меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Нитраты малоактивных металлов (правее Cu) – разлагаются до металла, оксида азота (IV) и кислорода.
Например, нитрат серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат марганца (II) разлагается до оксида марганца (IV):
Mn(NO3)2 → MnO2 + 2NO2
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители.
Например, смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
2KNO3 + 3C + S → N2 + 3CO2 + K2S
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные.
Кислород, галогены и пероксид водорода окисляют нитриты до нитратов:
2KNO2 + O2 → 2KNO3
KNO2 + H2O2 → KNO3 + H2O
KNO2 + H2O + Br2 → KNO3 + 2HBr
Лабораторные окислители — перманганаты, дихроматы — также окисляют нитриты до нитратов:
5KNO2 + 3H2SO4 + 2KMnO4 → 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
3KNO2 + 4H2SO4 + K2Cr2O7 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
В кислой среде нитриты выступают в качестве окислителей.
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
2KNO2 + 2H2SO4 + 2KI → 2NO + I2 + 2K2SO4 + 2H2O
2KNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO + K2SO4 + 2H2O
При взаимодействии с очень сильными восстановителями (алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
NaNO2 + 2Al + NaOH + 6H2O → 2Na[Al(OH)4] + NH3
Смесь нитратов и нитритов также проявляет окислительные свойства. Например, смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
3KNO2 + Cr2O3 + KNO3 → 2K2CrO4 + 4NO
Окислительные свойства азотной кислоты
02-Янв-2015 | Нет комментариев | Лолита Окольнова
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
автор статьи — Саид Лутфуллин
Азотная кислота – в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV.
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5
Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
HNO3 + Ме → нитрат + H2O + продукт восстановленного азота
Два нюанса:
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:
Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
Определить какой именно продукт будет образовываться можно чисто логически:
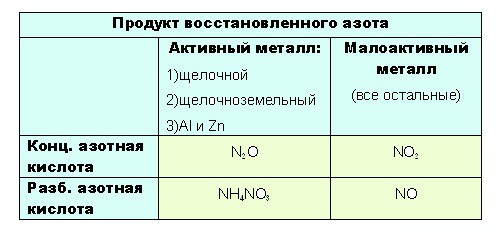
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH4NO3 или N2O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn. Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N2O, а при взаимодействии с разб. азотной кислотой NH4NO3.
4Ba + 10HNO3(конц.) → 4Ba(NO3)2 + 5H2O + N2O↑
4Ba + 10HNO3(разб.) → 4Ba(NO3)2 + 3H2O + NH4NO3
8Li + 10HNO3(конц.) → 8LiNO3 + 5H2O + N2O↑
8Li + 10HNO3(разб.) → 8LiNO3 + 3H2O + NH4NO3
8Al + 30HNO3(конц.) (t)→ 8Al(NO3)3 + 15H2O + 3N2O↑
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или O2.
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO. Ну а с конц. азотной NO2:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
Fe + 6HNO3(конц.) (t)→ Fe(NO3)3 + 3H2O + 3NO2↑
Fe + 4HNO3(разб.) → Fe(NO3)3 + 2H2O + NO↑
(обратите внимание, что железо окисляется до высшей степени окисления)
Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO↑
Если тяжело сразу понять всю логичность выбора, вот таблица:
Азотная кислота окисляет неметаллы до высших оксидов.
Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO2 или NO соответственно.
При окислении неметаллов концентрированной азотной кислотой образуется бурый газ (NO2), а если кислота разбавленная, то образуется NO. Схемы реакций следующие:
неметалл + HNO3(разб.) → соединение неметалла в высшей степени окисления + NO
неметалл + HNO3(конц.) → соединение неметалла в высшей степени окисления + NO2
C + 4HNO3(конц.) → CO2↑ + 2H2O + 4NO2↑
3C + 4HNO3(разб.) → 3CO2↑ + 2H2O + 4NO↑
(угольная кислота не образуется, так как она не стабильна)
P + 5HNO3(конц.) → H3PO4 + H2O + 5NO2↑
3P + 5HNO3(разб.) + 2H2O → 3H3PO4 + 5NO↑
B + 3HNO3(конц.) → H3BO3 + 3NO2↑
B + HNO3(разб.) + H2O → H3BO3 + NO↑
S + 6HNO3(конц.) → H2SO4 + 2H2O + 6NO2↑
S + 2HNO3(разб.) → H2SO4 + 2NO↑
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
2HNO3(конц.) + H2S → S↓ + 2NO2 + 2H2O
H2S + 8HNO3(конц.) → H2SO4 + 8NO2↑ + 4H2O
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
CuS + 8HNO3(конц.) → CuSO4 + 4H2O + 8NO2↑
- азотная кислота настолько сурова, что может окислить даже ГАЛОГЕН. Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO3:
10HNO3(конц.) + I2 (t)→ 2HIO3 + 10NO2↑ + 4H2O
10HNO3(разб.) + 3I2 (t)→ 6HIO3 + 10NO↑ + 2H2O
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
NaCl(тв.) + HNO3(конц.) → HCl↑ + NaNO3
NaF(тв.) + HNO3(конц.) → HF↑ + NaNO3
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO2:
8HNO3(конц.) + 6KBr(тв.) → 3Br2 + 4H2O + 6KNO3 + 2NO2↑
4HNO3(конц.) + 2NaI(тв.) → 2NaNO3 + 2NO2↑ + 2H2O + I2↓
Образовавшийся иод окисляется дальше до иодноватой кислоты, поэтому реакцию можно записать сразу:
7HNO3(конц.) + NaI → NaNO3 + 6NO2↑ + 3H2O + HIO3
То же самое происходит при взаимодействии с иодо- и бромоводородами:
2HNO3(конц.) + 2HBr → Br2 + 2NO2↑ + 2H2O
6HNO3(конц.) + HI → HIO3 + 6NO2↑ + 3H2O
Реакции с золотом, магнием, медью и серебром
Обсуждение: «Окислительные свойства азотной кислоты»
(Правила комментирования)
-
Теоретические сведения.
-
Перманганат калия как окислитель.
-
Дихромат и хромат как окислители.
-
Повышение степеней окисления хрома и марганца.
-
Азотная кислота с металлами.
-
Серная кислота с металлами.
-
Диспропорционирование.
-
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
-
Диспропорционирование оксида азота (IV) и солей.
-
Активность металлов и неметаллов.
-
Электрохимический ряд напряжений металлов.
-
Особенности поведения некоторых окислителей и восстановителей.
-
Необходимые навыки.
-
Последовательность расстановки коэффициентов в уравнении.
-
Возможные ошибки.
-
Ответы и решения к заданиям с пояснениями.
Автор статьи — профессиональный репетитор О. В. Овчинникова.
Вторая часть на ЕГЭ по химии включает 6 заданий, и каждое из них требует развёрнутого ответа. Для сдачи экзамена на высокий балл потребуется научиться решать все. Первым идёт задание 29, где нужно составить окислительно-восстановительную реакцию, используя вещества из списка. Вот один из вариантов формулировки:
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительновосстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Это задание в последние годы заметно усложнили. Если ранее было достаточно найти любые два вещества, между которыми протекает окислительно-восстановительная реакция (ОВР), записать её и уравнять методом электронного баланса, то теперь необходимо также знать визуальные признаки взаимодействия этих веществ.
Нам подойдёт реакция, которая описана в условии, любую другую не зачтут. Из-за этого для выполнения данного задания на ЕГЭ требуется не только научиться уравнивать ОВР методом электронного баланса, проработать огромное количество материала, связанного с химическими свойствами веществ, но и запомнить, что происходит в процессе большинства из данных реакций внешне. Звучит страшно, но надо понимать: всё это пригодится вам и в других заданиях.
Приведённая ниже информация поможет понять, на что обратить внимание.
к оглавлению ▴
Теоретические сведения.
Перманганат калия как окислитель.
| Среда, куда переходит | в кислой среде |
в нейтральной среде |
в щелочной среде |
| Образующееся соединение марганца | (соль той кислоты, которая участвует в реакции) |
Манганат |
|
| Внешние признаки реакции | Обесцвечивание тёмно-фиолетового раствора | Обесцвечивание тёмно-фиолетового раствора и выпадение бурого осадка | Раствор из тёмно-фиолетового становится зелёным |
к оглавлению ▴
Дихромат и хромат как окислители.
| кислая среда | нейтральная среда | щелочная среда |
| Соли тех кислот, которые участвуют в реакции: |
||
| Раствор из оранжевого (жёлтого) становится зелёным | Выпадение зелёного осадка, обесцвечивание оранжевого раствора |
к оглавлению ▴
Повышение степеней окисления хрома и марганца.
к оглавлению ▴
Азотная кислота с металлами.
— не выделяется водород, образуются продукты восстановления азота.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| Неактивные металлы (правее алюминия включительно) + конц. Кислота; Неметаллы + конц. Кислота |
Активные металлы (левее Mg включительно) + конц. Кислота | Активные металлы (левее Mg включительно) + разб Кислота | Металлы от алюминия до железа включительно + разб. кислота | Неактивные металлы (правее кобальта включительно) + разб. Кислота |
| Пассивация: с холодной концентрированной азотной кислотой не реагируют: |
||||
| Не реагируют с азотной кислотой ни при какой концентрации: |
к оглавлению ▴
Серная кислота с металлами.
— разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее в ряду напряжений, при этом выделяется водород;
— при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
к оглавлению ▴
Диспропорционирование.
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
к оглавлению ▴
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
| Сера + щёлочь |
|
| Фосфор + щелочь |
|
| Хлор, бром, иод + вода (без нагревания) Хлор, бром, иод + щелочь (без нагревания) |
|
| Бром, иод + вода (при нагревании) Хлор, бром, иод + щелочь (при нагревании) |
к оглавлению ▴
Диспропорционирование оксида азота (IV) и солей.
к оглавлению ▴
Активность металлов и неметаллов.
Для анализа активности металлов используют либо электрохимический ряд напряжений металлов, либо их положение в Периодической таблице. Чем активнее металл, тем легче он будет отдавать электроны и тем более хорошим восстановителем он будет в окислительно-восстановительных реакциях.
Электрохимический ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au
Активность неметаллов так же можно определить по их положению в таблице Менделеева.
В заданиях ЕГЭ считается, что азот — более активный неметалл, чем хлор.
На самом деле по поводу того, кто имеет большую электроотрицательность – азот или хлор, давно идут споры. Мы придерживаемся позиции, что хлор в данном противостоянии побеждает – он находится в седьмой группе, до устойчивого состояния ему не хватает одного электрона, в отличие от азота, которому не хватает трёх.
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.
Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).
Таблица электроотрицательности (Х) некоторых атомов
|
Элемент |
X |
Элемент |
X |
|
Cs |
0,79 |
H |
2,20 |
|
K |
0,82 |
C |
2,55 |
|
Na |
0,93 |
S |
2,58 |
|
Li |
0,98 |
I |
2,66 |
|
Ca |
1,0 |
Br |
2,96 |
|
Mg |
1,31 |
N |
3,04 |
|
Be |
1,57 |
Cl |
3,16 |
|
Si |
1,90 |
O |
3,44 |
|
B |
2,04 |
F |
3,98 |
|
P |
2,19 |
к оглавлению ▴
Особенности поведения некоторых окислителей и восстановителей.
а) кислородсодержащие соли и кислоты хлора в реакциях с восстановителями обычно переходят в хлориды:
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет отрицательную и положительную степени окисления — они встречаются в нулевой степени окисления (выделяется простое вещество).
к оглавлению ▴
Необходимые навыки.
- Расстановка степеней окисления.
Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю.Задание 1: Расставьте степени окисления в веществах:
- Расстановка степеней окисления в органических веществах.
Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0.Задание 2: Определите степень окисления атомов углерода, обведённых рамкой вместе с неуглеродным окружением:
2-метилбутен-2:
–
=
ацетон:
уксусная кислота:
–
- Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда.
Пример:
В этой реакции надо увидеть, что иодид калия
может являться только восстановителем, поэтому нитрит калия
будет принимать электроны, понижая свою степень окисления.
Причём в этих условиях (разбавленный раствор) азот переходит изв ближайшую степень окисления
.
- Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя.
В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
Самая частая проблема — с дихроматом калия, когда он в роли окислителя переходит в
:
Эти же двойки нельзя забыть при уравнивании, ведь они указывают число атомов данного вида в уравнении.
Задание 3: Какой коэффициент нужно поставить перед
и перед
Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием?
- Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты.Задание 5: Определите среду и вещества в каждой реакции:
- Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться.
Задание 6: В какой стороне реакции окажется вода? Bо что перейдёт цинк?
Задание 7: Мягкое и жесткое окисление алкенов.
Допишите и уравняйте реакции, предварительно расставив степени окисления в органических молекулах:(хол. р-р.)
- Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше:
Задание 8: Какие продукты ещё получатся? Допишите и уравняйте реакцию:
- Во что переходят реагенты в реакции?
Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу изв
, обычно окисление идёт только до
.
И наоборот, если— сильный восстановитель и может восстановить серу из
до
, то
— только до
.
Задание 9: Во что перейдёт сера? Допишите и уравняйте реакции:
(конц.)
- Проверьте, чтобы в реакции был и окислитель, и восстановитель.
Задание 10: Сколько ещё продуктов в этой реакции, и каких?
- Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Задание 11: Кто из этих галогенов окислитель, а кто восстановитель?
- Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Пероксид водорода — вещество с двойственной природой, в роли окислителя (которая ему более характерна) переходит в воду, а в роли восстановителя — переходит в свободный газообразный кислород.
Задание 12: Какую роль выполняет пероксид водорода в каждой реакции?
к оглавлению ▴
Последовательность расстановки коэффициентов в уравнении.
Сначала проставьте коэффициенты, полученные из электронного баланса.
Помните, что удваивать или сокращать их можно только вместе. Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
-
Задание 13: Допишите и уравняйте:
Не спешите, пересчитывая атомы кислорода! Не забывайте умножать, а не складывать индексы и коэффициенты.
Число атомов кислорода в левой и правой части должно сойтись!
Если этого не произошло (при условии, что вы их считаете правильно), значит, где-то ошибка.
к оглавлению ▴
Возможные ошибки.
- Расстановка степеней окисления: проверяйте каждое вещество внимательно.
Часто ошибаются в следующих случаях:а) степени окисления в водородных соединениях неметаллов: фосфин
— степень окисления у фосфора — отрицательная;
б) в органических веществах — проверьте ещё раз, всё ли окружение атомаучтено;
в) аммиак и соли аммония — в них азот всегда имеет степень окисления;
г) кислородные соли и кислоты хлора — в них хлор может иметь степень окисления;
д) пероксиды и надпероксиды — в них кислород не имеет степени окисления, бывает
, а в
— даже
;
е) двойные оксиды:— в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов.
Задание 14: Допишите и уравняйте:
Задание 15: Допишите и уравняйте:
- Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот.
Пример: в реакции
свободный хлор часто теряется. Получается, что электроны к марганцу прилетели из космоса…
- Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.Задание 16: Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
к оглавлению ▴
Ответы и решения к заданиям с пояснениями.
Задание 1:
Задание 2:
2-метилбутен-2: –
=
ацетон:
уксусная кислота: –
Задание 3:
Так как в молекуле дихромата 2 атома хрома, то и электронов они отдают в 2 раза больше — т.е. 6.
Задание 4:
Так как в молекуле два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент
.
Задание 5:
Если среда щелочная, то фосфор будет существовать в виде соли — фосфата калия.
Если среда кислая, то фосфин переходит в фосфорную кислоту.
Задание 6:
Так как цинк — амфотерный металл, в щелочном растворе он образует гидроксокомплекс. В результате расстановки коэффициентов обнаруживается, что вода должна присутствовать в левой части реакции:
Задание 7:
Электроны отдают два атома в молекуле алкена. Поэтому мы должны учесть общее количество отданных всей молекулой электронов:
(хол. р-р.)
Обратите внимание, что из 10 ионов калия 9 распределены между двумя солями, поэтому щелочи получится только одна молекула.
Задание 8:
В процессе составления баланса мы видим, что на 2 иона приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Задание 9:
(перманганат не очень сильный окислитель в растворе; обратите внимание, что вода переходит в процессе уравнивания вправо!)
(конц.)
(концентрированная азотная кислота очень сильный окислитель)
Задание 10:
Не забудьте, что марганец принимает электроны, при этом хлор их должен отдать.
Хлор выделяется в виде простого вещества.
Задание 11:
Чем выше в подгруппе неметалл, тем более он активный окислитель, т.е. хлор в этой реакции будет окислителем. Йод переходит в наиболее устойчивую для него положительную степень окисления , образуя йодноватую кислоту.
Задание 12:
(пероксид — окислитель, т.к. восстановитель — )
(пероксид — восстановитель, т.к. окислитель — перманганат калия)
(пероксид — окислитель, т.к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
Задание 13:
Задание 14:
Задание 15:
Задание 16:
(водный раствор)
(щелочная среда)
(водный раствор)
(кислая среда)
Читаем дальше: Задача С2 на ЕГЭ по химии.
Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Задание 29 на ЕГЭ по химии. Особенности, советы, рекомендации.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.03.2023
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 769 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Установите соответствие между названием вещества и степенью окисления азота в нём: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
A) гидросульфид аммония
Б) нитрат железа (II)
B) нитрит натрия
Г) азотистая кислота
СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
1) −3
2) −2
3) +1
4) +2
5) +3
6) +5
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СВОЙСТВО АЗОТА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: Демонстрационная версия ЕГЭ—2022 по химии, Демонстрационная версия ЕГЭ—2023 по химии
Верны ли следующие суждения о химических свойствах азота?
А. Азот реагирует с водородом только при высокой температуре и наличии катализатора.
Б. Одно из немногих веществ с которыми азот реагирует при комнатной температуре без участия катализатора — литий.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В реактор постоянного объёма поместили некоторое количество азота и кислорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходная концентрация азота и кислорода составляет 0,7 моль/л и 0,5 моль/л соответственно, а равновесная концентрация оксида азота(II) — 0,5 моль/л.
Определите равновесную концентрацию и
Выберите из списка номера правильных ответов.
1) 0 моль/л
2) 0,1 моль/л
3) 0,25 моль/л
4) 0,35 моль/л
5) 0,45 моль/л
6) 0,55 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходная концентрация кислорода составила 0,8 моль/л, а равновесная концентрация оксида азота(II) и оксида азота(IV) — 1,9 моль/л и 0,4 моль/л соответственно.
Определите исходную концентрацию и равновесную концентрацию
Выберите из списка номера правильных ответов.
1) 0,4 моль/л
2) 0,6 моль/л
3) 0,9 моль/л
4) 1,4 моль/л
5) 1,9 моль/л
6) 2,3 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходная концентрация кислорода составила 0,6 моль/л, а равновесные концентрации оксида азота(II) и оксида азота(IV) — 1,4 моль/л и 0,8 моль/л соответственно.
Определите исходную концентрацию и равновесную концентрацию
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,9 моль/л
4) 1,8 моль/л
5) 2,0 моль/л
6) 2,2 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В реактор постоянного объёма поместили некоторое количество азота и кислорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходные концентрации азота и кислорода составили 0,5 моль/л и 0,9 моль/л соответственно, а равновесная концентрация оксида азота(II) — 1 моль/л.
Определите равновесные концентрации и
Выберите из списка номера правильных ответов.
1) 0 моль/л
2) 0,1 моль/л
3) 0,25 моль/л
4) 0,4 моль/л
5) 0,45 моль/л
6) 0,6 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В реактор постоянного объёма поместили некоторое количество азота и кислорода. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом исходные концентрации азота и кислорода составили 0,4 моль/л и 0,3 моль/л соответственно, а равновесная концентрация оксида азота(II) — 0,5 моль/л.
Определите равновесные концентрации и
Выберите из списка номера правильных ответов.
1) 0 моль/л
2) 0,05 моль/л
3) 0,15 моль/л
4) 0,35 моль/л
5) 0,45 моль/л
6) 0,65 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Вычислите объём (л) оксида азота(II), образовавшегося в результате окисления 22,4 л азота избытком кислорода, если объемный выход реакции 75%. Объемы газов измерены при одинаковых нормальных условиях. (Запишите число с точностью до десятых.)
В реакторе постоянного объёма смешали оксид азота(II) и кислород. Быстро установилось равновесие:
(Другие процессы в системе не протекают.)
При этом исходная концентрация кислорода составила 0,24 моль/л, а равновесные концентрации оксида азота(II) и оксида азота(IV) — 0,54 моль/л и 0,18 моль/л соответственно.
Определите исходную концентрацию и равновесную концентрацию
Выберите из списка номера правильных ответов.
1) 0,06 моль/л
2) 0,12 моль/л
3) 0,15 моль/л
4) 0,45 моль/л
5) 0,63 моль/л
6) 0,72 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами
В реактор постоянного объёма ввели азотный ангидрид и повысили температуру. В реакторе установилось равновесие:
При этом равновесные концентрации оксида азота(V) и оксида азота(IV) составили 0,02 моль/л и 0,16 моль/л соответственно.
Определите исходную концентрацию и равновесную концентрацию
Выберите из списка номера правильных ответов.
1) 0,01 моль/л
2) 0,02 моль/л
3) 0,04 моль/л
4) 0,08 моль/л
5) 0,1 моль/л
6) 0,16 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами
Органическое вещество X представляет собой бесцветные кристаллы. При сжигании 6,15 г этого вещества было получено 6,72 л углекислого газа, 0,56 л азота (объёмы газов измерены при н. у.) и 2,25 г воды. Вещество получают окислением соединения, содержащего шестичленный гетероцикл, подкисленным раствором перманганата калия, при этом газ не выделяется. На основании данных условия задачи:
1) Проведите необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин) и установите молекулярную формулу вещества
2) Составьте возможную структурную формулу вещества которая однозначно отражает порядок связи атомов в его молекуле;
3) Напишите уравнение получения реакцией окисления (в уравнении используйте структурные формулы органических веществ).
Органическое вещество представляет собой бесцветную жидкость с запахом аммиака. При сжигании 3,55 г этого вещества было получено 4,48 л углекислого газа, 0,56 л азота (объёмы газов измерены при н. у.) и 4,05 г воды. Известно, что молекула содержит только один атом азота и не имеет кратных связей, а при взаимодействии
с азотистой кислотой спирт не образуется. На основании данных условия задачи:
1) Проведите необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин) и установите молекулярную формулу вещества
2) Составьте возможную структурную формулу вещества которая однозначно отражает порядок связи атомов в его молекуле;
3) Напишите уравнение дегидрирования которое приводит к образованию ароматического соединения (в уравнении используйте структурные формулы органических веществ).
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210201.
Задания Д6 № 969
Верны ли следующие суждения о химических свойствах азота?
А. Азот реагирует с кислородом только при высокой температуре.
Б. Азот при нагревании реагирует с активными металлами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Установите соответствие между названием вещества и степенью окисления азота в нём: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) гидросульфид аммония
Б) нитрат железа (II)
В) нитрит натрия
Г) азотистая кислота
СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
1) −3
2) −2
3) +1
4) +2
5) +3
6) +5
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СВОЙСТВО АЗОТА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2014 по химии
Установите соответствие между формулой вещества и степенью окисления азота в нем: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
1) –3
2) –2
3) +2
4) +3
5) +4
6) +5
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
При разложении оксида азота образовалось 25 л азота и 12,5 л кислорода. Вычислите объём вступившего в реакцию оксида азота. Объёмы газов измерены при одинаковых условиях. Ответ дайте в литрах с точностью до целых.
Установите соответствие между уравнением реакции и свойством, которое проявляет элемент азот в этой реакции.
СВОЙСТВО АЗОТА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не изменяет степень окисления
Запишите в таблицу выбранные цифры под соответствующими буквами.
В реактор постоянного объёма поместили некоторое количество оксида азота(IV) и нагрели. В результате протекания обратимой реакции
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации оксида азота(IV)и кислорода составили 0,6 моль/л и 0,4 моль/л соответственно.
Определите исходную концентрацию и равновесную концентрацию
Выберите из списка номера правильных ответов.
1) 0,4 моль/л
2) 0,8 моль/л
3) 1,0 моль/л
4) 1,4 моль/л
5) 1,6 моль/л
6) 2,2 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Всего: 769 1–20 | 21–40 | 41–60 | 61–80 …
Азотная кислота в овр
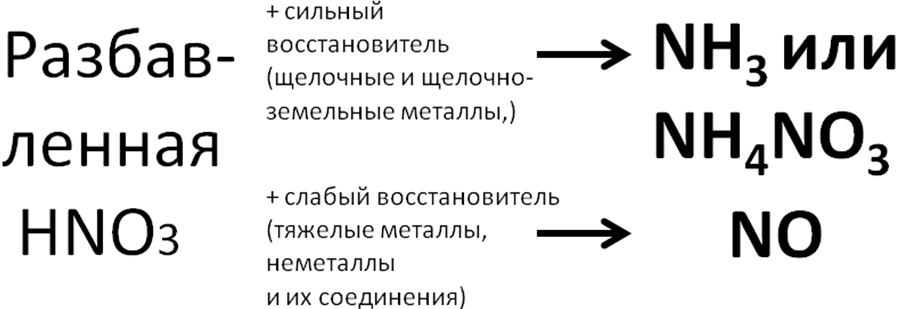
Азотная
кислота может окислять металлы, неметаллы,
сложные вещества. При окислении неметаллов
и сложных веществ концентрированная
азотная кислота, как правило
восстанавливается до оксида азота (IV),
разбавленная – до оксида азота (II)
Схема
4. Поведение концентрированной азотной
кислоты в ОВР

Cхема
5. Поведение разбавленной азотной кислоты
в ОВР
Особенно
часто в ЕГЭ встречаются уравнения
реакций окисления сульфидов азотной
кислотой. Концентрированная азотная
кислота окисляет соединения серы до
сульфатов, разбавленная – окисляет
сульфиды до свободной серы.
Рассмотрим
примеры:
CuS
+ 8HNO3
(конц.)
=
CuSO4
+ 8NO2
+ 4H2O
3H2S
+ 2HNO3
(разб.)
=
3S
+ 2NO
+ 4H2O
Серная кислота
Схема
6. Поведение концентрированной серной
кислоты в ОВР
Приведем
примеры:
H2SO4
+
2HBr
= Br2
+ SO2
+
2H2O
(бромоводород – слабый восстановитель)
H2SO4
+
8HI
= 4I2
+ H2
S+
4H2O
(йододород – сильный восстановитель)
Галогены
и
их кислородные соединения восстанавливаются
до галогенид-анионов:
KClO3
+3KNO2
= KCl
+ 3KNO3
Ферраты
восстанавливаются до солей железа
(III):
2K2FeO4
+
16HCl = 3Cl2
+ 2FeCl3
+
4KCl + 8H2O
Наиболее
часто встречающиеся в ЕГЭ восстановители:
сероводород, сульфиды, сульфиты, нитриты,
галогениды, аммиак, невысшие оксиды
(марганца, фосфора, серы), соли железа
(II),
марганца (II),
хрома (II)
и (III),
металлы.
Наибольшее
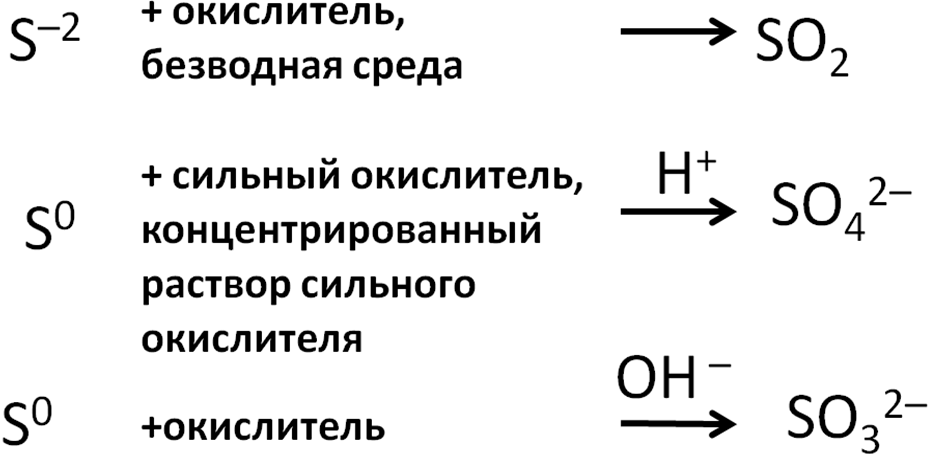
разнообразие продуктов дают соединения
серы:
С
хема
7. Окисление соединений серы

С
остальными восстановителями всё
достаточно однозначно:
Нитриты
окисляются до нитратов, галогениды
окисляются до свободных галогенов (в
случае очень сильных окислителей – до
галогенат-анионов ГалО3
–
).
Аммиак
окисляется, как правило, до азота.
Невысшие
оксиды фосфора и серы в безводной среде
– до высших оксидов, в нейтральной и
кислой среде – до высших кислот, в
щелочной среде – до солей высших кислот.
Оксид
марганца (IV)
– до манганата в щелочной среде,
перманганата – в кислой среде.
Соли
железа (II)
– до солей железа (III)
в кислой среде, до гидроксида железа
(III)
– в нейтральной и щелочной среде, очень
сильные окислители в щелочной среде
приводят к окислению до феррата.
Соли
марганца (II)
– в нейтральной среде до оксид марганца
(IV),
в щелочной среде – до манганата, в кислой
в присутствии очень сильного окислителя
– до перманганата.
Соли
хрома (II)
окисляются до солей хрома (III),
соли хрома (III)
— в щелочной среде до хроматов, в кислой
– до дихроматов.
Задание
Предположите
продукты реакций, расставьте коэффициенты.
Выбранные Вами продукты реакций
обоснуйте.
Пример выполнения домашнего задания:
Задание:
дихромат калия с водным раствором
сероводорода.
Решение:
Дихромат калия – окислитель, сероводород
– восстановитель, среда будет близка
к нейтральной, так как сероводород –
очень слабая кислота, а растворимость
сероводорода незначительная.
В
нейтральной среде дихромат восстанавливается
до гидроксида хрома (III)
(схема 3), а сероводород окисляется до
серы (схема 7)
K2Cr2O7
+ 3H2S
+ H2O
= 3S + 2Cr(OH)3
+ 2KOH
1)
перманганат калия с нитритом натрия в
растворе гидроксида калия;
2)
сероводород с водным раствором хромата
калия;
3)
алюминий с очень разбавленной азотной
кислотой (см. таблицу 1);
4)
фосфор с концентрированной серной
кислотой;
5)
сульфит калия с концентрированной
азотной кислотой;
6)
бромат калия с йодидом калия в сернокислом
растворе;
7)
сульфат железа (II)с
концентрированной серной кислотой;

сульфат хрома (III)
с бромом в растворе гидроксида калия;
9)
нитрат натрия с раствором гидроксида
натрия в присутствии алюминия;
10)
феррат калия с водным раствором аммиака.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
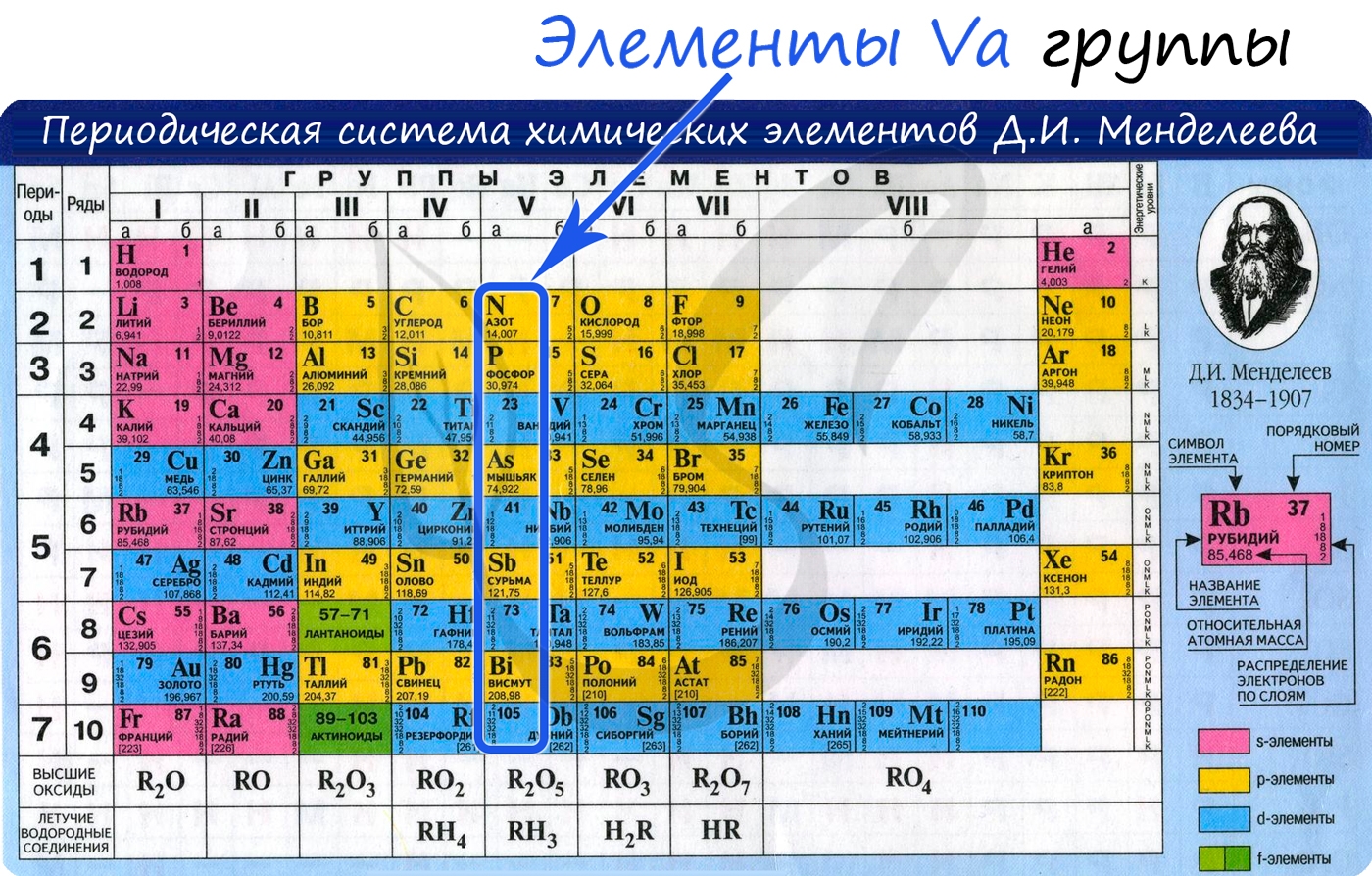
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
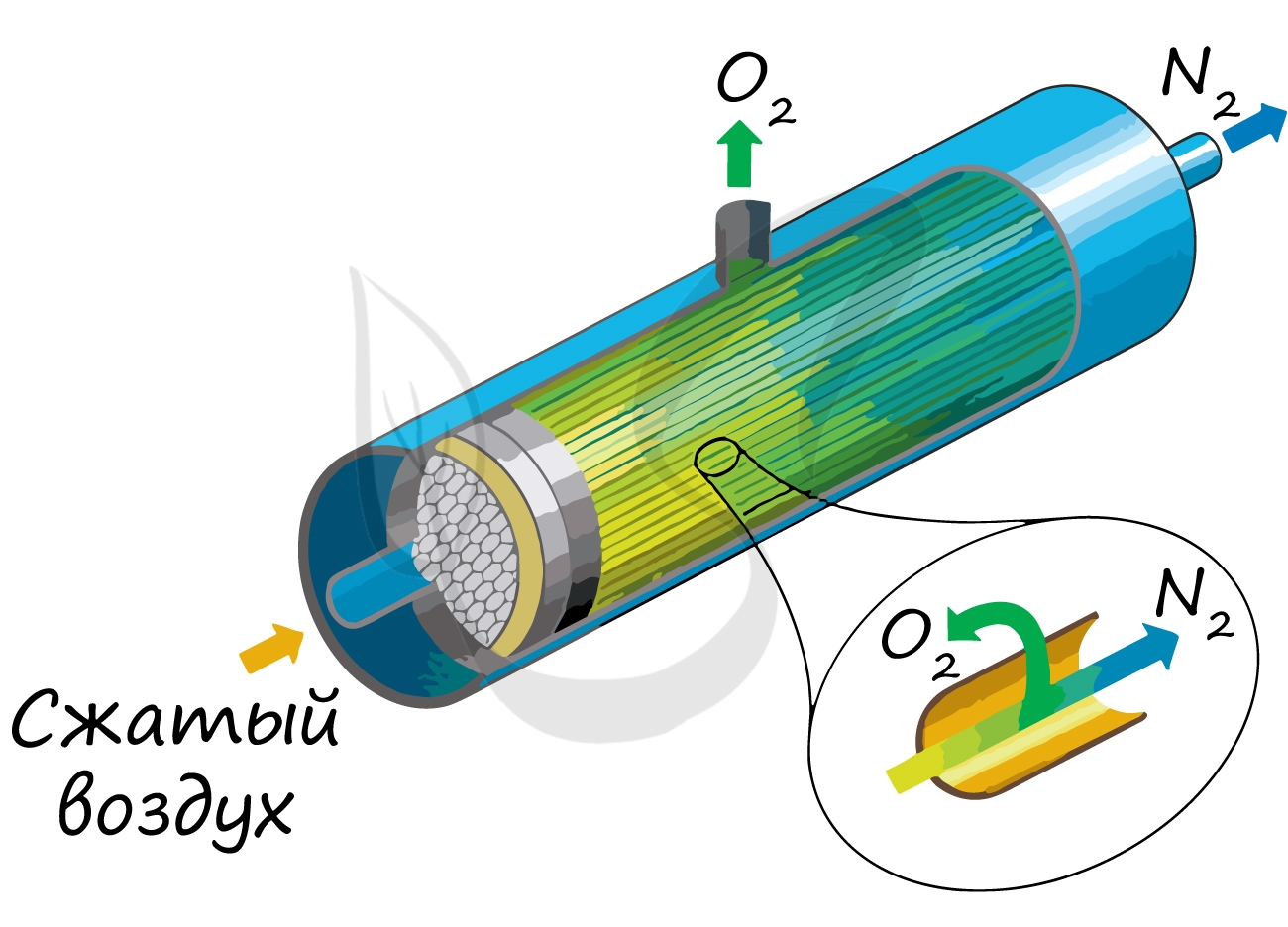
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.
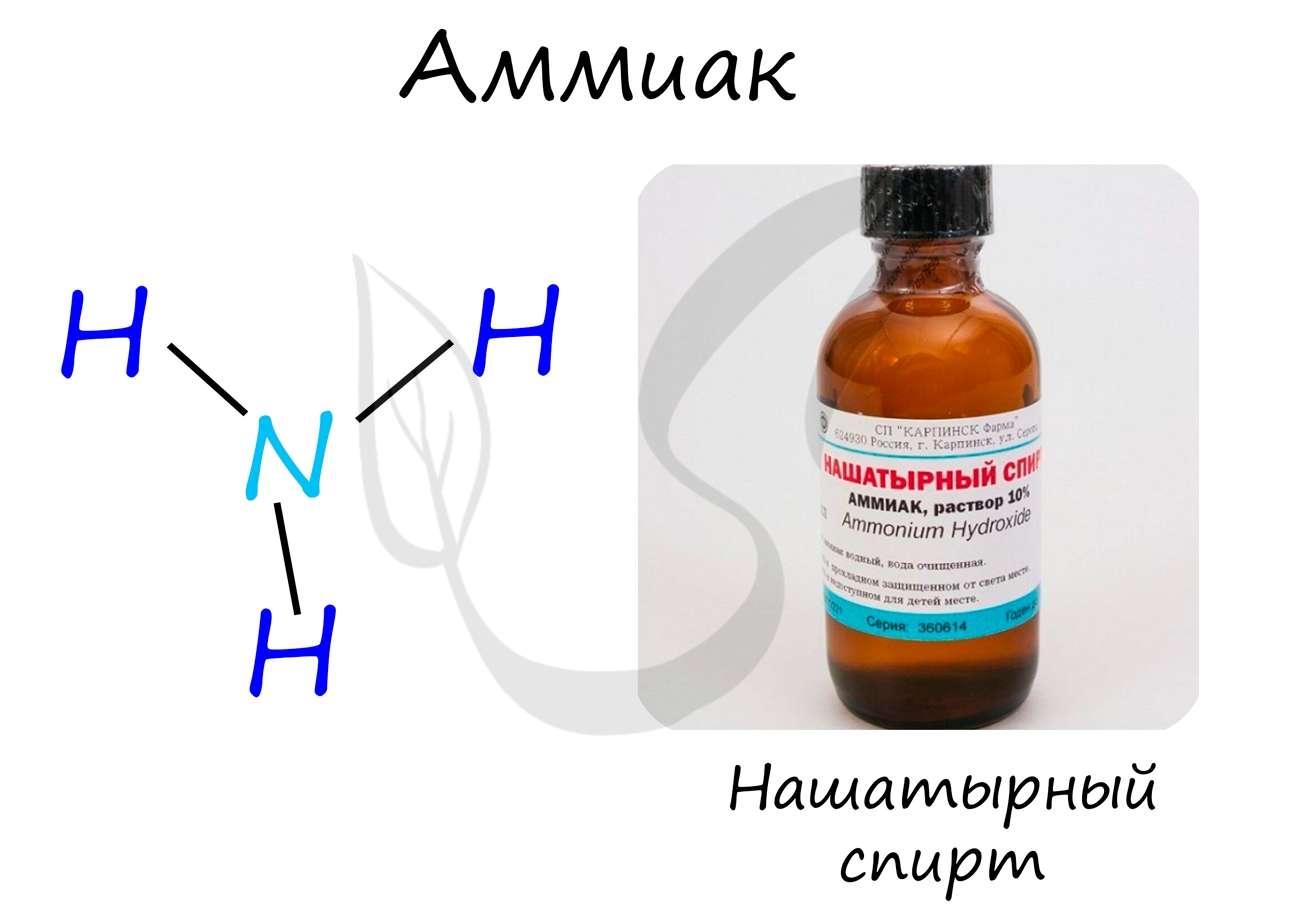
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 + H2O → H3AsO4 + NO↑
As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2—).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.