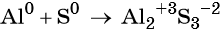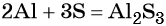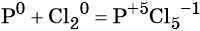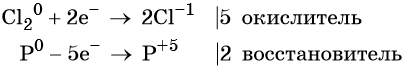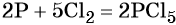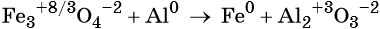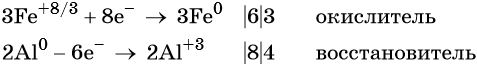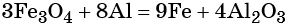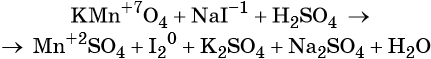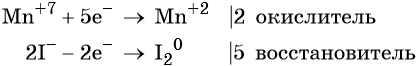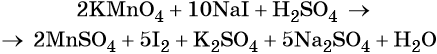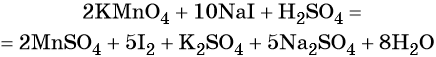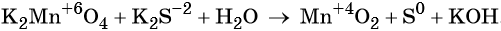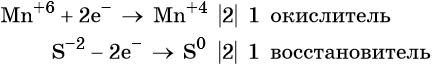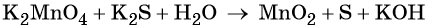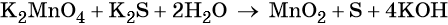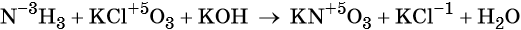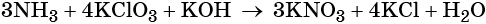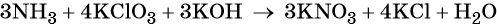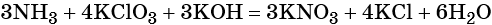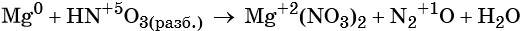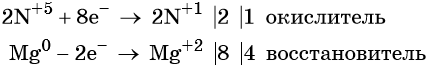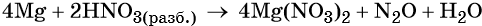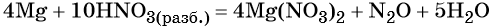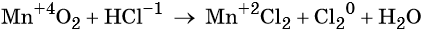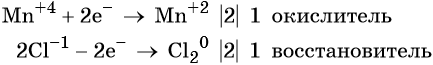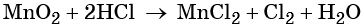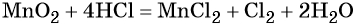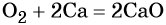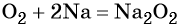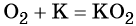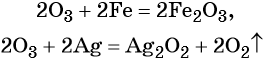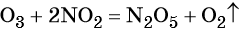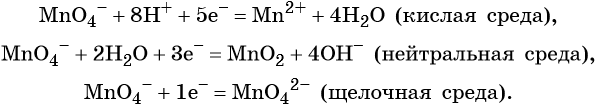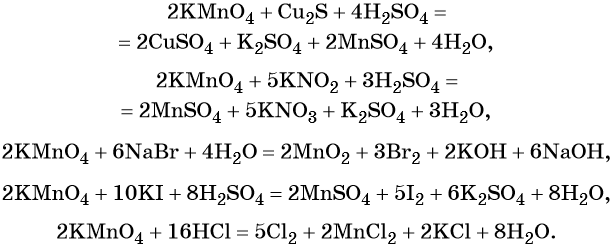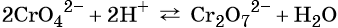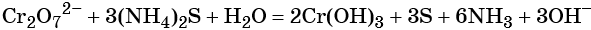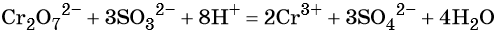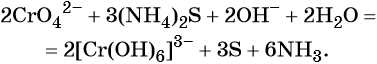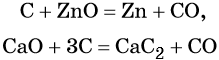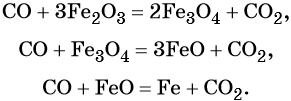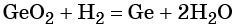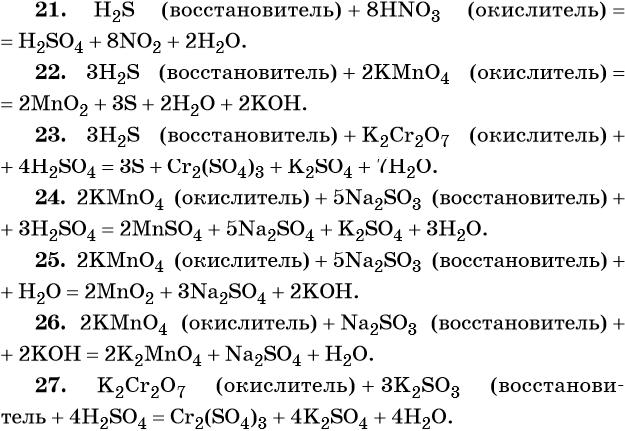1. Химические свойства галогенов и их соединений с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 1.1. Простые вещества
Водный раствор Cl2 окисляет соединения S–2 (H2S и сульфиды) до S+6, восстанавливаясь до степени окисления -1 (так как, находясь в седьмой группе периодической таблицы элементов, принять они могут только один электрон):
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
4Cl2 + Na2S + 4H2O → Na2SO4 + 8HCl
Br2 и I2 являются более слабыми окислителями и поэтому окисляют сероводород преимущественно до S:
Br2 + H2S → S
Водные растворы Cl2 и Br2 окисляют соединения S+4 до S+6:
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
Br2 + SO2 + 2H2O → H2SO4 + 2HBr
Cl2 и Br2 окисляют аммиак с образованием хлорида и бромида аммония:
3Cl2 + 8NH3 → N2 + 6NH4Cl
3Br2 + 8NH3 → N2 + 6NH4Br
F2, Cl2 и Br2 окисляют пероксид водорода с образованием кислорода:
F2 + H2O2 → O2
Cl2 + H2O2 → O2
Br2 + H2O2 → O2
F2, Cl2 и Br2 окисляют соединения железа, хрома, марганца и др. в промежуточных степенях окисления, преимущественно в щелочной среде:
3F2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KF + 8H2O
3Cl2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KCl + 8H2O
3Br2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KBr + 8H2O
2Br2 + 2CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
3Br2 + 2NaCrO2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
3Cl2 + 2CrCl3 + 16KOH → 2K2CrO4 + 12KCl + 8H2O
3Br2 + Cr2(SO4)3 + 16NaOH → 2Na2CrO4 + 3Na2SO4 + 6NaBr + 8H2O
3Cl2 + 2K3[Cr(OH)6] + 4KOH → 2K2CrO4 + 6KCl + 8H2O
2Br2 + Mn(NO3)2 + 8NaOH → Na2MnO4 + 4NaBr + 2NaNO3 + 4H2O
F2 + NaBrO3 + 2NaOH → NaBrO4 + 2NaF + H2O
I2 + K2SO3 + 2KOH → K2SO4 + 2KI + H2O
Br2 + 2K2MnO4 → 2KMnO4 + 2KBr
Галогены также окисляют кислоты и кислотные оксиды, в которых неметалл имеет промежуточную степень окисления:
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2I2 + As2O3 + 5H2O → 2H3AsO4 + 4HI
F2 + KClO3 + 2NaOH → KClO4 + 2NaF + H2O.
Правило 1.2. Кислородсодержащие кислоты и соли хлора являются сильными окислителями.
При восстановлении любых соединений с положительными степенями окисления галогенов последние восстанавливается по максимуму, до Г– .
Восстановление кислот:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
2HClO3 + 3P2O3 + 9H2O → 2HCl + 6H3PO4
4HClO + PH3 → 4HCl + H3PO4
HClO3 + 6HBr → 3Br2 + HCl + 3H2O
HClO3 + 6HI → 3I2 + HCl + 3H2O.
Восстановление солей:
KClO4 + 8HI → KCl + 4I2 + 4H2O
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
2KClO3 + 3P2O3 → 2KCl + 3P2O5
KClO3 + 3H2O2 → KCl + 3O2 + 3H2O
NaClO3 + 3MnO2 + 6NaOH → 3Na2MnO4 + NaCl + 3H2O.
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
В щелочной среде соединения Fe, Cr и Mn окисляются до ферратов (FeO42–), хроматов (CrO42–) и манганатов (MnO42–), соответственно:
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
KClO3 + 2CrCl3 + 10KOH → 7KCl + 2K2CrO4 + 5H2O
KClO3 + 2Cr(OH)3 + 4NaOH → KCl + 2Na2CrO4 + 5H2O
2KClO3 + 3MnO + 6KOH → 2KCl + 3K2MnO4 + 3H2O
KClO3 + 3MnO2 + 6KOH → KCl + 3K2MnO4 + 3H2O
NaClO3 + Cr2O3 + 2K2CO3 → NaCl + 2K2CrO4 + 2CO2
NaClO3 + Cr2O3 + 4NaOH → NaCl + 2Na2CrO4 + 2H2O.
Правило 1.3. При окислении галогенидов Г– как правило образуются простые вещества (Cl2, Br2 и I2).
Примеры реакций с Cl–, Br–, I– :
16HCl + 2KMnO4 → 5Cl2 + 2KCl + 8H2O + 2MnCl2
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
6HCl + KClO3 → 3Cl2 + KCl + 3H2O
2HCl + KClO → Cl2 + KCl + H2O
HCl + HClO → Cl2 + H2O
4HCl + PbO2 → Cl2 + PbCl2 + 2H2O
4HCl + Ca(ClO)2 → 2Cl2 + CaCl2 + 2H2O
14HI + K2Cr2O7 → 3I2 + 2CrI3 + 2KI + 7H2O
8HI + KClO4 → 4I2 + KCl + 4H2O
6KI + KClO3 + 3H2SO4 → 3I2 + 3K2SO4 + KCl + 3H2O
10KI + 2KMnO4 + 8H2SO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
2KI + MnO2 + 2H2SO4 → I2 + MnSO4 + K2SO4 + 2H2O
10KBr + 2KMnO4 + 8H2SO4 → 5Br2 + 2MnSO4 + 6K2SO4 + 8H2O
Правило 1.4. Только I– окисляется соединениями Fe+3 и Cu+2 :
6HI + 2Fe(OH)3 → I2 + 2FeI2 + 6H2O
6HI + Fe2O3 → I2 + 2FeI2 + 3H2O
6KI + 2FeBr3 → I2 + 2FeI2 + 6KBr
4HI + 2CuCl2 → I2 + 2CuI + 4HCl
4KI + 2CuSO4 → I2 + 2CuI + 2K2SO4
4KI + 2Cu(NO3)2 → I2 + 2CuI + 4KNO3
При взаимодействии HI с соединениями Fe+2 и Cu+1, а также других галогеноводородов с Fe+3 и Cu+2, идут обычные реакции ионного обмена:
HI + Fe(OH)2 → FeI2 + H2O
3HCl + Fe(OH)3 → FeCl3 + 3H2O
Правило 1.5. Ионы I– и Br– могут окисляться кислотами-окислителями:
8HI + H2SO4(к) → 4I2 + H2S
2HBr + H2SO4(к) → Br2 + SO2
8KI + 5H2SO4(к) → 4I2 + H2S
2KBr + 2H2SO4(к) → Br2 + SO2
2KI + 4HNO3(к) → I2 + 2NO2
2KBr + 4HNO3(к) → Br2 + 2NO2
Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr3+:
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.
Ответы
Окислительно-восстановительные реакции
I. ОВР в неорганической химии.
Перекись водорода.
|
4H2O2 + PbS → PbSO4 + 4H2O 5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + K2SO4 +2MnSO4 + 8H2O 5H2O2 + 2HIO3 → 5 O2 + I2 + 6H2O 3H2O2 + 2AuCl3 → 3 O2 + 6HCl + 2Au H2O2 + H2S → S + 2H2O H2O2 + KI + H2SO4 → I2 + K2SO4 + 2H2O 3H2O2 + 2CrCl3 + 10 KOH → 2K2CrO4 + 8H2O + 6KCl H2O2 + 2NaOH → Na2O2 + 2H2O H2O2 + Ba(OH)2 → BaO2 + 2H2O MnO2 2H2O2 → 2H2O + O2 H2O2 + Cl2 → 2HCl + O2 H2O2 + 2FeSO4 + H2SO4 → Fe2(SO3)3 + 2H2O K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 8H2O + 2KOH H2O2 + SO2 → H2SO4 |
Na2O2 + 2CO2 → 2Na2CO3 + O2 Na2O2 + 2H2O → H2O2 + 2NaOH Na2O2 + 2Na → 2Na2O Na2O2 + H2SO4 → H2O2 + Na2SO4 Na2O2 + H2SO4 + 2KI → I2 + Na2SO4 +K2SO4 + 2H2O KO2+ H2SO4→H2O2+K2SO4+O2 надперекись калия 2KO2 + 2H2O → 2KOH +H2O2+ O2 BaO2 + H2SO4 → BaSO4 + H2O2 BaO2 + CO2 + H2O → H2O2 + BaCO3 800oC 2BaO2 → 2BaO + O2 SnO2 + 2H2SO4 →Sn(SO4)2 + 2H2O |
Железо.
|
to сильное 2Fe + 6H2SO4 (к) → Fe2(SO4)3 + 3SO2 + 6H2O to Fe + 6HNO3(к) → Fe(NO3)3 + 3NO2 + 3H2O |
10Fe + 6HNO3(сильно разб.) → Fe(NO3)3 + 3N2 + 18H2O С растворами щелочей в присутствии сильных окислителей to Fe + KClO3 + 2KOH → KCl + H2O + K2FeO4 феррат калия |
Соединения Fe2+.
|
to 2FeO + 4H2SO4 (к) → Fe2(SO4)3 + SO2 + 4H2O to FeO + 4HNO3(к) → Fe(NO3)3 + NO2 + 2H2O to 3FeO + 10HNO3(р) → 3Fe(NO3)3 + NO + 5H2O to Fe(OH)2 + 4HNO3(к) → Fe(NO3)3 + NO2 + 3H2O to 2Fe(OH)2 + 4H2SO4 (к) → Fe2(SO4)3 + SO2 + 6H2O 10FeS + 6KMnO4 + 24H2SO4 → 5Fe2(SO4)3 + 6MnSO4 + + 3K2SO4 + 24H2O 2FeI2 + 6H2SO4 (к) → Fe2(SO4)3 + 2I2 +3SO2 + 6H2O |
to 4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2 4FeCl2 + O2 + 8NaOH + 2H2O → Fe(OH)3 + 8NaCl to 4FeSO4 → 2Fe2O3 + 4SO2 + O2 2FeSO4 + H2O2 + H2SO4 → Fe2(SO3)3 + 2H2O 10 FeSO4 + 2KIO3 + 6H2SO4 → I2 + 5Fe2(SO4)3 + K2SO4 + + 6H2O 6FeSO4 + KClO3 + 3H2SO4 → 3Fe2(SO4)3 + KCl + 3H2O 10 FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + + K2SO4 + 8H2O to 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 |
Соединения Fe3+.
|
to Fe2O3 + 3NaH → 3NaOH + 2Fe В присутствии сильных окислителей со щелочами Fe2O3 + 4KOH + 3KNO3 → 2K2FeO4 + 3 KNO2 +2H2O to Fe2O3 + 4KOH + KClO3 → 2K2FeO4 + KCl + 2H2O Fe2O3 + 6Hl → 2FeI2 + I2 + 3H2O NaFeO2+2H2O→ Fe(OH)3+NaOH 2Fe(OH)3 + 6HI → FeI2 +I2+ 6H2O |
to 2Fe(OH)3 +10NaOH+3Br2 → 2Na2FeO4 + 6NaBr +8H2O 2FeCl3 + 2KI → FeCI2 + I2 + 2KCl 2FeCl3 + H2S → FeCI2 + S + 2HCl 2FeCl3 + FeCl2 + 4(NH4)2S → 3FeS + S + 8NH4Cl to 2FeCl3 +3Br2+16NaOH →2Na2FeO4 + 6NaBr ++6NaCl+8H2Oферрат натрия |
Fe3O4.
|
Fe3O4 + 8HCl → FeCI2 + 2FeCl3 + 4H2O (не ОВР) Fe3O4+8Hl→3FeI2+I2+4H2O Fe3O4+10HNO3(к) →3Fe(NO3)3+ NO2 + 5H2O 3Fe3O4 + 28 HNO3 (р) → 9Fe(NO3)3 + NO+14H2O |
2Fe3O4+10H2SO4(к)→3Fe2(SO4)3 +SO2+10H2O Fe3O4 + 4H2SO4 (р) → Fe2(SO4)3 + FeSO4 + 8H2O to Fe3O4 + Fe → 4FeO |
Соединения марганца.
Оксиды:
MnO Mn2O3 Mn3O4 Mn2O7 MnO3 MnO2
основные кислотные амфотерный
|
Mn(NO3)2 + 5PbO2 + 6HNO3 → 5Pb(NO3)2 + 2HMnO4 +2H2O to Mn(NO3)2 → MnO2 + 2NO2 |
to Mn(NO3)2 +PbO2 →MnO2+ Pb(NO3)2 2KMnO4 + 3MnSO4 + 2H2O → 5MnO2 + K2SO4 +2H2SO4 |
MnO2
↙OH— ↘ H+
-2 +2
MnO4 Mn
манганат
|
2MnO2 +2H2SO4 (к) → 2MnSO4 + 2H2O+ O2 MnO2 + 4HCl → MnCl2 + Cl2+ 2H2O |
2MnO2 + 4HNO3 (к) → 2Mn(NO3)2 + 2H2O +O2 |
MnO2 проявляет кислотные свойства при сплавлении со щелочами или оксидами активных металлов без доступа воздуха.
|
MnO2 + 2KOH → K2MnO3 + H2O (не ОВР) |
Mn(OH)4 + BaO → BaMnO3 + 2H2O (не ОВР) |
В зависимости от условий реакции MnO2 проявляет либо окислительные, либо восстановительные свойства.
В кислой среде:
|
MnO2 +2FeSO4 +2H2SO4 → MnSO4 + Fe2(SO4)3 + 2H2O |
2MnO2+3PbO2+6HNO3→ 2HMnO4 +3Pb(NO3)2 + 2H2O |
В щелочной среде:
to
3MnO2 + KClO3 + 6NaOH → 3Na2MnO4 +KCl + 3H2O
твёрдые сплавление
MnO2 + KNO3 + 2KOH → K2MnO4 + KNO2 + H2O
_
MnO4
↙H+ ↓H2O ↘OH—
+2 2-
Mn +4 MnO4
MnO2 ↓ манганат
оксид марганца (IV)
В кислой среде:
|
2KMnO4+5K2SO3 +3H2SO4→2MnSO4+6K2SO4+3H2O 2KMnO4+5Na2SO3+3H2SO4→2MnSO4+5Na2SO4+ K2SO4 +3H2O 2KMnO4 + 5H2S + 3H2SO4 → 5S + MnSO4 + K2SO4 + 8H2O 2KMnO4 + 5H3PO3 + 3H2SO4 → 5H3PO4 +2MnSO4 + K2SO4 + 3H2O 2KMnO4 + 5N2O + 3H2SO4 → 2MnSO4 + K2SO4 + 10NO + 3H2O 2KMnO4 + 5NaNO2 + 3H2SO4 → 5NaNO3 +2MnSO4 + K2SO4 + 3H2O 2KMnO4 + 10KBr + 8H2SO4 → 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O 8KMnO4 + 5PH3 + 24HCl → 5H3PO4 + 8MnCl2 + 8KCl + 12H2O 2KMnO4 + 16HCl → 5Cl2 + MnCl2 + 2KCl + 8H2O 10 FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O В нейтральной среде: 2KMnO4+5SO2+ 2H2O → 2MnSO4 + K2SO4 + 2H2SO4 |
2KMnO4 + 3K2SO3 + H2O → 2MnO2 + 3K2SO4 + 2KOH
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 3Na2SO4 + 2KOH
2KMnO4 + (NH4)2SO4 → 2MnO2 + N2 + K2SO4 + 4H2O
2KMnO4 + 3MnSO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4
В щелочной среде:
2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O
2KMnO4 + Na2SO3 + 2KOH → Na2SO4 + 2K2MnO4 + H2O
Другие реакции:
to
2KMnO4 → K2MnO4 + MnO2 + O2↑
2HMnO4 + 3H2S → 3S + 2MnO2 + 4H2O
8HMnO4 + 3PH3 → 3H3PO4 + 8MnO2 + 4H2O
K2MnO4 + K2S + 2H2O → S + MnO2 + 4KOH
K2MnO4 + Cl2 → 2KCl + 2KMnO4
MnSO4 + NaClO + 2NaOH → MnO2 + NaCl + Na2SO4 + H2O
Соединения хрома.
Соединения хрома (III).
Cr2O3 – оксид хрома (III), порошок тёмно-зелёного цвета, по твёрдости близок к корунду. Поэтому его вводят в состав полирующих средств. Он нерастворим в воде, имеет аморфный характер, однако в кислотах и щелочах плохо растворим.
Химические свойства.
1. Сплавление со щелочами:
t0 t0
Cr2O3 + 2KOH → 2KCrO2 + H2O Cr2O3 + Ba(OH)2 → Ba(CrO2)2 + H2O
хромит калия хромит бария
2. Сплавление с карбонатами щелочных металлов:
t0
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
хромит натрия
3. Сплавление с оксидами щелочных и щелочно-земельных металлов:
t0
Cr2O3 + Na2O → 2NaCrO2
4. С концентрированными растворами кислот и щелочей реагирует с трудом:
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
t0
Cr2O3 + 6NaOH + 3H2O → 2Na3[Cr(OH)6]
гексагидроксохромит натрия
5. Взаимодействует со щелочными расплавами окислителей:
t0 +6
Cr2O3 + 3KNO3 + 4KOH → 2K2CrO4 + 3KNO2 + 2H2O
хромат калия
Получение Cr2O3.
1. В лаборатории. 2. В промышленности.
t0 t0
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O 2K2Cr2O7+3С→2Cr2O3+
2K2СO3 + СO2
t0
K2Cr2O7 + S → Cr2O3 + K2SO4
Cr(OH)3 – гидроксид хрома (III), серо-зелёного цвета, нерастворим в воде, амфотерный.
Получение Cr(OH)3.
CrCl3 + 3NaOH → Cr(OH)3 + 3NaCl
студенистый серо-зелёный осадок
Химические свойства.
Cr(OH)3 легко взаимодействует с кислотами и со щелочами.
1. Взаимодействие с кислотами:
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
2. Взаимодействие со щелочами:
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
гексагидроксохромат (III) натрия
(изумрудно-зелёный раствор)
3. Разложение при нагревании.
t0
2Cr(OH)3 → Cr2O3 + 3H2O
Соли – хромиты и другие — (III).
Химические свойства.
1. С кислотами легко реагируют:
а) недостаток кислоты:
NaCrO2 + HCl + H2O → Cr(OH)3 + NaCl
б) избыток кислоты:
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
2. С кислотными оксидами:
Na3[Cr(OH)6] + 3CO2 → Cr(OH)3 + 3NaHCO3
3. В растворе подвергаются гидролизу:
NaCrO2 + 2H2O → Cr(OH)3↓ + NaOH
Cr2S3 + 6H2O → 2Cr(OH)3↓ + 3H2S↑
4. Окислительные свойства соединений хрома (III):
+3 0 +2 +1
Cr2(SO4)3 + H2 (Zn + H2SO4) → 2CrSO4 + H2SO4
5. Восстановительные свойства соединений хрома (III):
+3 0 +6 -1
2К3[Cr(OH)6] + 3Br2 + 4KOH → 2K2CrO4 + 6KBr + 8H2O
+3 -1 +6 -2
3CrCl3 + 3H2O2 + 10KOH → 2K2CrO4 + 6KCL + 8H2O
-3e—↗ Cr+6 (окисление)
Cr+3
+1e—↘ Cr+2 (восстановление)
Соединения хрома (III):
а) при окислении в щелочной среде образуют хроматы:
to
Cr2O3 + KClO3 + 4KOH → 2K2CrO4 + KCl + 2H2O
спекание хромат калия
б) при окислении в кислой среде образуют дихроматы:
Cr2(SO4)3 + 2K2FeO4 + H2SO4 → K2Cr2O7 + Fe2(SO4)3 + K2SO4 + H2O
дихромат калия
Соединения хрома (VI).
CrO3 – оксид хрома (VI) – кристаллы тёмно-красного цвета, хорошо растворимые в воде, сильно ядовит (действует на почки; 0,6 г – смертельная доза). Кислотный оксид, которому соответствуют кислоты Н2CrO4 и Н2Cr2O7.
Получение CrO3.
K2Cr2O7 + 2H2SO4 → K2SO4 + 2CrO3 + H2O
Химические свойства.
1. Взаимодействие с водой.
OH— H+
CrO3 + H2O → Н2CrO4 2CrO3 + H2O → H2Cr2O7
Формула получающейся кислоты зависит от среды.
CrO3 – сильнейший окислитель.
2. Взаимодействие с углеродом:
4CrO3 + 3C → 3CO2↑ + 2Cr2O3
3. Взаимодействие с серой:
4CrO3 + 3S → 3SO2 + 2Cr2O3
4. Взаимодействие с органическими веществами:
C2H5OH + 4CrO3 → 2CO2↑ + 2Cr2O3 + 3H2O
+6 +3 +4 H C2H5OH + 4CrO3 + 6H2SO4 → 2Cr2(SO4)3 + 2CO2↑ + 9H2O H ↘ ↓
Реакция сопровождается воспламенением. H→C-С→O←H
H↗ ↑
H
5. Соли хромовой и дихромовой кислот – сильнейшие окислители.
Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O (не ОВР)
Na2Cr2O7 + 2NaOH → 2Na2CrO4 + H2O (не ОВР)
6. Хроматы при нагревании устойчивы, дихроматы при нагревании неустойчивы:
t0
4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3 O2↑
7. Взаимодействие с солями:
а) в нейтральной среде
2K2CrO4 + 3(NH4)2S + 2H2O → 2Cr(OH)3↓ + 3S↓ + 6NH3↑ + 4KOH
б) в щелочной среде
2K2CrO4 + 3(NH4)2S + 2KOH + 2H2O → 2K3[Cr(OH)6] + 3S↓ + 6NH3↑
в) в кислой среде:
K2Cr2O7 + 14HCl → 3Cl2 + 2KCL + 2CrCl3 + 7H2O
Cr(OH)3 — серо—зелёный осадок
K2CrO4 (CrO4)2— H2O ↗
}—-OH—— → [Cr(OH)6]3- — р-р изумрудно-зелёного цвета
K2Cr2O7 (Cr2O7)2 ______H+__
↘
Cr3+ — р-р сине-фиолетового цвета
Окисление органических соединений бихроматом калия.
+6 -2 +2 +3
2K2Cr2O7 + 3CH3OH + 8H2SO4 → HCOOH + 2Cr2(SO4)3 +2K2SO4 + 11H2O
+3 +4
K2Cr2O7 + 3HOOC-COOH + 4H2SO4 → 6CO2 + Cr2(SO4)3 + K2SO4 + 7H2O
Соли в кислой среде:
K2Cr2O7 + 2H2SO4 → 2KHSO4 + 2CrO3 + H2O (не ОВР)
Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O (не ОВР)
K2Cr2O7 + 4H2SO4 + 3H2S → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 4H2SO4 + 2NO → 2HNO3 + Cr2(SO4)3 + K2SO4 + 3H2O
2K2Cr2O7 + 8H2SO4 + 3C → 3CO2 + 2Cr2(SO4)3 + 2K2SO4 + 8H2O
K2Cr2O7 + 7H2SO4 + 6KI → 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
K2Cr2O7 + 7H2SO4 + 2Al → Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 14HCl → 3Cl2 + 2KCL + 2CrCl3 + 7H2O
2K2CrO4 + 16HCl → 3Cl2 + 4KCL + 2CrCl3 + 8H2O
2K2CrO4 + 10HNO3 + 3H2S → 4KNO3 + 2Cr(NO3)3 + 3S + 8H2O
Соли в щелочной среде:
Na2Cr2O7 + 2CsOH → Na2CrO4 + Cs2CrO4 + H2O (не ОВР)
K2Cr2O7 + 2RbOH → Rb2CrO4 + K2CrO4 + H2O (не ОВР)
Cr2(SO4)3 + 3Br2 + 16NaOH → Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O
Соли в нейтральной (или слабокислой) среде:
2K2CrO4 + 3H2S + 2H2O → 2Cr(OH)3 + 3S + 4KOH
(гор.)
K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 8H2O + 2KOH
K3[Cr(OH)6] + 3SO2 → Cr(OH)3 + 3KHSO3 (не ОВР)
K3[Cr(OH)6] + FeCl3 → Cr(OH)3 + Fe(OH)3 + 3KCl (не ОВР)
2K2CrO4 + 3K2SO3 + 5H2O → 2Cr(OH)3↓ + 3K2SO4 + 4KOH
Разложение солей:
to
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O (вулкан)
Основания:
2Cr(OH)3 + 3Cl2 + 10NaOH → 2Na2CrO4 + 6NaCl + 8H2O
Оксиды:
2CrO3 + 2NH3 + H2O → (NH4)2Cr2O7 (не ОВР)
Cr2O3 + 3KNO3 + 4KOH → 2K2CrO4 + 3KNO2 + 2H2O
+3 +1 -1 +6
Cr2O3 + 3Ca(OCl)Cl + 4NaOH → 3CaCl2 + 2Na2CrO4 + 2H2O
+3 +5 t0 +6 +4
Cr2O3 + Na2CO3 + KClO3 → 2Na2CrO4 + KCl + 2CO2
+3 +1 -1 +6
Cr2O3 + 3Ca(OCl)Cl + 4NaOH → 3CaCl2 + 2Na2CrO4 + 2H2O
+3 +5 t0 +6 +4
Cr2O3 + Na2CO3 + KClO3 → 2Na2CrO4 + KCl + 2CO2
t0
2Cr2O3 +3O2 +4Na2CO3 → 4Na2CrO4 + 4CO2
t0
2Cr2O3 +3O2 +4Na2CO3 → 4Na2CrO4 + 4CO2
Написать уравнения 4-х возможных реакций:
1) р-ры CrSO4; NaOH; Na2CrO4; H2SO4:
3CrSO4 + Na2CrO4 + 16NaOH + 4H2O → 4Na3[Cr(OH)6] + 3Na2SO4
2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
CrSO4 + 2NaOH → Na2SO4 + Cr(OH)2
2) р-ры SO2; CsOH; K2Cr2O7; H2SO4:
K2Cr2O7 + 2CsOH → K2CrO4 + Cs2CrO4 + H2O
2CsOH + H2SO4 → Cs2SO4 + 2H2O
K2Cr2O7 + 3SO2 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O
2CsOH + SO2 → Cs2SO3 + H2O
3) Cr(NO3)3; Na2SO3; Cl2; NaOH:
Cr(NO3)3 + Na2SO3 + 3H2O → 2Cr(OH)3↓ + SO2 + 6NaNO3
6NaOH + 3Cl2 → 5NaCl + NaClO3 + 3H2O
Cr(NO3)3 + 3NaOH → Cr(OH)3 + 3NaNO3
Галогены.
t0
3Cl2 + 6KOH (гор.) → 5KCl + KClO3 + 3H2O
Cl2 + 2KOH (хол.) → KCl + KClO + H2O
3Cl2 + 8NH3 → 6NH4Cl + N2
Cl2 + NaHS → S + NaCl + HCl
t0
3Br2 + 6KOH (гор.) → 5KBr + KBrO3 + 3H2O
Br2 + 2KOH (хол.) → KBr + KBrO + H2O
6Br2 + 6Ba(OH)2 → Ba(BrO3)2 + 5BaBr2 + 6H2O
чистый горячий
Br2 + H2S → 2HI + S
I2 + SO2 + 2H2O → H2SO4 + HI
Соединения галогенов.
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
KClO + HI → Kl + l2 + H2O
Соединения серы.
Концентрированная H2SO4.
to
5H2SO4 + 8KIтв. → 4 I2 + 3H2S ↑+ 4K2SO4 + 4H2O
3H2SO4 + KIO3 + 5KI → 3I2 + 3K2SO4 + 3H2O
H2SO4 + Na2S2O3 → Na2SO4 + SO2↑ + S↓ + H2O
2H2SO4 + Hg → HgSO4 + SO2 + 2H2O
2H2SO4 + C → CO2 + 2SO2 + 2H2O
Оксид серы (IV).
SO2 + I2 + 2H2O → H2SO4 + 2HI
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
SO2 + 2H2S → 3S + 2H2O
SO2 + H2O2 → H2SO4
Сера.
S + 6HNO3 (к.) → H2SO4 + 6NO2 + 2H2O
S + 2H2SO4 (к.) → 3SO2 + 2H2O
S + 3H2SO4 (к.) → 4SO2 + 4H2O
Соединения фосфора.
Фосфор.
|
to |
|||
|
6P + 5HClO3 + 9H2O → 5HCl + 6H3PO4 |
2P + 5NaNO3 → 5NaNO2 + P2O5 |
||
|
P + KMnO4 + H2SO4 →KH2PO4 + MnSO4 |
|||
|
4P + 3KOH(k.) + 3H2O → 3KH2PO2 + PH3 |
P + 5HNO3 (к.) → H3PO4 + 5NO2 + 5H2O |
Фосфин.
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 8AgNO3 + 4H2O → 8Ag + H3PO4 + 8HNO3
5PH3 + 8HBrO3 → 5H3PO4 + 4Br2 + 4H2O
3PH3 + 4HClO3 → 3H3PO4 + 4HCl
3PH3 + 8HMnO4 → 3H3PO4 + 8MnO2 + 4H2O
Фосфаты.
Сa3(PO4)2 + 5C + 3SiO2 → 3CaSiO3 + 2P + 5CO
3Сa3(PO4)2 + 16Al → 3Сa3P2 + 8Al2O3
Соединения азота.
Оксид азота (IV).
2NO2 + 2KOH → KNO2 + KNO3 + H2O
to
2NO2 + 4Cu → N2 + 4CuO
Азотная кислота.
H2S + 8HNO3 (к.) → H2SO4 + 8NO2 + 4H2O
H2S + 2HNO3 (к., хол.) → S + 2NO2 + 2H2O
3As2S3 + 28HNO3 + 4H2O → 6H3AsO4 + 28NO + 9H2SO4
S + 6HNO3 (к.) → H2SO4 + 6NO2 + 2H2O
5HNO3 (к.) + P → H3PO4 + 5NO2 + 5H2O
3Si + 4HNO3 + 18HF → 3H2SiF6 + 4NO + 8H2O
8HNO3 (к.) + CuS → CuSO4 + 8NO2 + 4H2O
Нитраты.
4Zn + KNO3 + 7KOH → NH3 + 4K2ZnO2 + 2H2O
(тв.)
Аммиак.
NH3 + Ca(OCl)2 → N2 + H2O + CaCl2
Кремний.
3Si + 4HNO3 + 18HF → 3H2SiF6 + 4NO + 8H2O
Si + 4NaOH → Na4SiO4 + 2H2↑
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Кислород.
2PH3 + 4O2 → P2O5 + 3H2O
2NO2 + O2 + 2KOH → 2KNO3 + H2O
Кислоты, содержащие хлор
11-Янв-2015 | Нет комментариев | Лолита Окольнова
Кислоты, содержащие хлор
Кислоты-окислители и их соли.
В ЕГЭ по этой теме не очень много спрашивают. Названия кислот и солей надо знать. И некоторые реакции. Я постарался написать в этой статье как можно больше каноничных ЕГЭ-шных реакций. Но на экзамене может попасться и то, чего здесь нет. Поэтому важно для ЕГЭ развить «химическую интуицию», чтобы предсказывать продукты реакций. Если посмотреть на ОВР очень внимательно, то можно вывести основные закономерности. То есть не все сводится к зубрежке, главное понять принцип. А чтобы у себя в голове вывести принцип, нужно прорешать много реакций. Ну и читать наши статьи.
Автор Статьи — Саид Лутфуллин
Вы, наверное, уже знаете, что у хлора очень много кислот. Все кислородсодержащие кислоты хлора и их соли – сильные окислители, и все они нестабильны.
Сила кислот возрастает со степенью окисления:
|
Степень окисления хлора |
Формула кислоты |
Название кислоты |
Сила кислоты |
Название соли |
|
+1 |
HClO |
Хлоноватистая |
Слабая |
Гипохлорит |
|
+3 |
HClO2 |
Хлористая |
Средней силы |
Хлорит |
|
+5 |
HClO3 |
Хлорноватая |
Сильная |
Хлорат |
|
+7 |
HClO4 |
Хлорная |
Очень сильная |
Перхлорат |
Хлорноватистая кислота образуется при пропускании хлора через воду.
При этом происходит диспропорционирование: хлор и окисляется (до +1) и восстанавливается (до +1), образуются хлороводородная (соляная) и хлорноватистая кислоты:
Cl2 + H2O → HCl + HClO
Если хлор пропускать не через воду, а через водный раствор щелочи, то образуются соли этих кислот: хлорид и гипохлорит:
Cl2 + 2KOH → KCl + KClO + H2O
А если хлор пропускать через ГОРЯЧИЙ раствор щелочи, то вместо гипохлорита, будет образовываться хлорат:
3Cl2 + 6KOH (t˚)→ 5KCl + KClO3 + 3H2O
Если полученный раствор остудить, то выпадут в осадок белые кристаллы хлората калия KClO3.
Запомните тривиальное название этой соли: бертолетова соль, а так же этот исторический способ ее получения. Именно этим способом был впервые получен хлорат калия французским ученым Клодом Луи Бертолле (отсюда и название соли).
Бертолетова соль – очень сильный окислитель.
При нагревании бертолетова соль разлагается, опять таки с диспропорционированием хлора. Он восстанавливается (до -1) и окисляется (до +7, дальше ему некуда):
4KClO3 (t˚)→ KCl + 3KClO4
Полученный перхлорат калия тоже не очень стабильный, и тоже разлагается:
KClO4 (t˚)→ KCl + 2O2↑
Хлорноватистая кислота окисляет галогеноводороды (иодоводороды и бромоводороды) до свободных галогенов:
2HI + HClO → I2↓ + HCl + H2O
2HBr + HClO → Br2 + HCl + H2O
Кислоты-окислители хлора окисляют серу в сернистом газе до высшей степени окисления +6 (образуется серная кислота), при этом, в зависимости от условий, хлор восстанавливается до простого вещества (0) или до хлороводорода (-1):
HClO3 + 3SO2 + 3H2O → 3H2SO4 + HCl
И имейте в виду, что некоторые из этих свойств так же могут подойти и для аналогичных кислот брома.
Обсуждение: «Кислоты, содержащие хлор»
(Правила комментирования)
1. Положение галогенов в периодической системе химических элементов
2. Электронное строение галогенов
3. Физические свойства и нахождение в природе
4. Соединения галогенов
5. Способы получения галогенов
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с серой
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.1.6. Взаимодействие с галогенами
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с водой
6.2.2. Взаимодействие с щелочами
6.2.3. Взаимодействие с солями и галогеноводородами
6.2.4. Взаимодействие с восстановителями
Галогеноводороды
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Диссоциация
3.3. Взаимодействие с солями
3.4. Восстановительные свойства
3.5. Взаимодействие с оксидом кремния (IV)
Соли-галогениды
Способы получения галогенидов
Химические свойства галогенидов
Кислородсодержащие кислоты галогенов
1. Хлорноватистая кислота и ее соли
2. Хлористая кислота и ее соли
3. Хлорноватая кислота и ее соли
4. Хлорная кислота и ее соли
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns2np5.
Например, электронная конфигурация фтора:
Электронная концигурация хлора:
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s22p5 | … 3s23p5 | … 4s24p5 | … 5s25p5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220оС | –101оС | –7оС | 113,5оС |
| Т кипения | –188оС | –34оС | 58оС | 185оС |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4
Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3
Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO
Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются ионы натрия:
K(–): Na+ +1e → Na0
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза расплава хлорида натрия:
2Na+ + 2Cl− → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH−
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза раствора хлорида натрия:
2H2O + 2Cl− → H2°↑ + 2OH− + Cl2°↑
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например, взаимодействием соляной кислоты с оксидом марганца (IV)
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
2KHF2 → 2K + H2 + 2F2
3. Получение брома.
Бром можно получить окислением ионов Br– сильными окислителями.
Например, бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например, оксид марганца (IV):
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
4. Получение йода.
Йод получают окислением ионов I– сильными окислителями.
Например, хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например, оксид марганца (IV) в кислой среде окисляет йодид калия:
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей. Галогены реагируют с металлами и неметаллами.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
2F2 + O2 → 2OF2
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
2F2 + C → CF4
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например, железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
I2 + Fe → FeI2
Аналогичная ситуация с медью: фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
Cl2 + Cu → 2CuCl2
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример: алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
F2 + H2 → 2HF
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Cl2 + H2 → 2HCl
Бром также реагирует с водородом с образованием бромоводорода:
Br2 + H2 → 2HBr
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
I2 + H2 ↔ 2HI
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например, фтор окисляет хлор, бром и йод:
Cl2 + F2 → 2ClF
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например, хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлороватую кислоту:
Cl2 + 6H2O ↔ 5HCl + HClO3
Фтор реагирует с водой со взрывом:
2F2 + 2H2O → 4HF + O2
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например, хлор реагирует с холодным раствором гидроксидом натрия:
Сl2 + 2NaOH (хол.) → NaCl + NaClO + H2O
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
3Cl2 + 6NaOH (гор.) → 5NaCl + NaClO3 + 3H2O
Еще пример: хлор растворяется в холодном растворе гидроксида кальция:
2Сl2 + 2Са(OH)2(хол.) → СaCl2 + Сa(ClO)2 + 2H2O
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например, хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например, фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl+F–
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
Cl2 + I2 + H2O → HCl + HIO3
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например, хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Cl2 + H2O + Na2SO3 → 2HCl + Na2SO4
Также галогены окисляют пероксиды:
Cl2 + H2O2 → 2HCl + O2
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например, действием концентрированной серной кислоты на хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) → NaHSO4 + HCl↑
Галогеноводороды получают также прямым взаимодействием простых веществ:
Cl2 + H2 → 2HCl
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства. Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами. Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например, хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
6HCl + Al2O3 → 2AlCl3 + 3H2O
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
HCl + NH3 → NH4Cl
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами, расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
Например, соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют, образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H+ + F–
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H+ + Cl–
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например, соляная кислота реагирует с карбонатом кальция:
2HCl + CaCO3 → CaCl2 + 2H2O + CO2
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами. При этом более активные галогены вытесняют менее активные.
Например, бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например: концентрированная соляная кислота окисляется оксидом марганца (IV):
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например, бромоводород окисляется концентрированной серной кислотой:
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
14HBr + K2Cr2O7 → 2KBr + 2CrBr3 + 3Br2 + 7H2O
Или с оксидом марганца (IV):
4HBr + MnO2 → MnBr2 + Br2 + 2H2O
Пероксид водорода также окисляет бромоводород до молекулярного брома:
2HBr + H2O2 → Br2 + 2H2O
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например, йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
2HI + Fe2(SO4)3 → 2FeSO4 + I2 + H2SO4
Йодоводород легко окисляется соединениями азота, например, оксидом азота (IV):
2HI + NO2 → I2 + NO + H2O
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + 6HF(изб) → H2[SiF6] + H2O
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами. При этом галогены проявляют свойства окислителя.
Например, хлор взаимодействует с магнием и кальцием:
Cl2 + Mg → MgCl2
Cl2 + Ca → CaCl2
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например, соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например, при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример: взаимодействие оксида алюминия с соляной кислотой:
6HCl + Al2O3 → 2AlCl3 + 3H2O
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например, при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
2HCl + Cu(OH)2 → CuCl2 + 2H2O
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например, гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями, если образуется осадок, газ или вода.
Например, бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами. При этом более активные металлы вытесняют менее активные.
Например, магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например, натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например, при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
2KBr + 2H2O → H2↑ + 2KOH + Br2↑
4. Галогениды металлов проявляют восстановительные свойства. Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например, бромид калия окисляется концентрированной серной кислотой:
2KBr + 2H2SO4 (конц.) → 4K2SO4 + 4Br2 + SO2 + 2H2O
Еще пример: йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
8KI + 5H2SO4 (конц.) → 4K2SO4 + 4I2 + H2S + 4H2O или
8KI + 9H2SO4 (конц.) → 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 → I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 → I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O → 2CuI + 2K2SO4 + H2SO4
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака.
Например, хлорид серебра (I) растворяется под действием избытка раствора аммиака:
AgCl + NH3 → [Ag(NH3)2]Cl
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например, хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде:
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается:
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями.
Например, с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например, хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например, пероксид водорода:
HClO + H2O2 → HCl + H2O + O2
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например, соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Ca(ClO)2 + H2SO4 → CaSO4 + 2HCl + O2
Даже угольная кислота вытесняет гипохлориты:
Ca(ClO)2 + CO2 + H2O → CaCO3 + 2HClO
2. Гипохлориты вступают в обменные реакции с другими солями, если образуется слабый электролит.
Например, гипохлорит кальция реагирует с растворимыми карбонатами:
Ca(ClO)2 + Na2CO3 → CaCO3 + 2NaClO
3. При нагревании гипохлориты разлагаются:
Ca(ClO)2 → CaCl2 + O2
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
2ClO2 + H2O2 → 2HClO2 + O2
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
HClO2 + KOH → KClO2 + H2O
2. При длительном хранении разлагается:
4HClO2 → HCl + HClO3 + 2ClO2 + H2O
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например, из хлората бария под действием серной кислоты:
Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
HClO3 + KOH → KClO3 + H2O
2. Хлорноватая кислота – сильный окислитель.
Например, хлорноватая кислота окисляет фосфор:
6P + 5HClO3 → 3P2O5 + 5HCl
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например, хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример: хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
5KClO3 + 6P → 5KCl + 3P2O5
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например, из перхлората натрия под действием серной кислоты:
2NaClO4 + H2SO4 → 2HClO4 + Na2SO4
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
HClO4 + KOH → KClO4 + H2O
2. Хлорная кислота – сильный окислитель.
Например, хлорная кислота окисляет углерод:
8HClO4 + 14C → 14CO2 + 4Cl2 + 4H2O
3. При нагревании хлорная кислота разлагается:
4HClO4 → 4ClO2 + 3O2 + 2H2O
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Например, перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
KClO4 → KCl + 2O2↑
Еще пример: перхлорат калия окисляет алюминий:
3KClO4 + 8Al → 3KCl + 4Al2O3