7. Химические свойства соединений марганца с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 8.1. В кислой среде соединения марганца, как правило, восстанавливаются до Mn+2, образуя соли соответствующих кислот:
Примеры реакций соединений с Mn+7:
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 16HBr → 2MnBr2 + 5Br2 + 2KBr + 8H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + 10CO2 + K2SO4 + 8H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2HMnO4 + 5SO2 + 2H2O → 2MnSO4 + 3H2SO4
2KMnO4 + 5Na2O2 + 8H2SO4 → 2MnSO4 + O2 + 5Na2SO4 + K2SO4 + 8H2O
10KMnO4 + 10KHS + 11H2SO4 → 4MnSO4 + 10S + 7K2SO4 + 16H2O
2KMnO4 + 5K2S + 8H2SO4 → 2MnSO4 + 5S + 6K2SO4 + 8H2O
2KMnO4 + 5H2S + 3H2SO4 → 2MnSO4 + 5S + K2SO4 + 8H2O
2KMnO4 + 10KBr + 8H2SO4 → 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
8KMnO4 + 5PH3 + 12H2SO4 → 8MnSO4 + 5H3PO4 + 4K2SO4 + 12H2O
6KMnO4 + 10NH3 + 9H2SO4 → 6MnSO4 + 5N2 + 3K2SO4 + 12H2O
Примеры реакций соединений с Mn+4:
MnO2 + HCl → MnCl2 + Cl2 + H2O
MnO2 + 2KI + 2H2SO4 → MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + 2KBr + 2H2SO4 → MnSO4 + Br2 + K2SO4 + 2H2O
MnO2 + 2FeSO4 + 2H2SO4 → MnSO4 + Fe2(SO4)3 + 2H2O
Примеры реакций соединений с Mn+6:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
Правило 8.2. В щелочной среде, как правило, реакции протекают с образованием соединений Mn+6, т.е. манганат-иона:
Примеры реакций соединений с Mn+7:
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
2KMnO4 + NaNO2 + 2KOH → 2K2MnO4 + NaNO3 + H2O
KMnO4 + FeCl2 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
6KMnO4 + Cr2(SO4)3 + 16KOH → 6K2MnO4 + 2K2CrO4 + 3K2SO4 + 8H2O
4KMnO4 + 8KOH → 4K2MnO4 + 2O2 + 4H2O
6NaMnO4 + 2NH3 + 6NaOH → 6Na2MnO4 + N2 + 6H2O
8KMnO4 + PH3 + 11KOH → 8K2MnO4 + K3PO4 + 7H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2O3 + 12KOH → 3K2MnO4 + 3K2SO4 + 6H2O
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
3MnSO4 + 3KClO3 + 12KOH → 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
3MnO + 2KClO3 + 6KOH → 3K2MnO4 + 2KCl + 3H2O
Примеры реакций соединений с Mn+4 в щелочной среде:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
MnO2 + O2 + 4KOH → 2K2MnO4 + 2H2O
Правило 8.3. В нейтральной среде соединения Mn+7, как правило, восстанавливаются до Mn+4, образуя оксид марганца (IV):
Примеры реакций соединений с Mn+7:
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
2KMnO4 + 3KNO2 + H2O → 2MnO2 + 3KNO3 + 2KOH
2KMnO4 + 3K2S + 4H2O → 2MnO2 + 3S + 8KOH
Реакции с H2S и NH3 протекают аналогично нейтральной среде:
2HMnO4 + 3H2S → 2MnO2+ 3S + 4H2O
2NaMnO4 + 2NH3 → 2MnO2 + N2 + 2NaOH + 2H2O
2KMnO4 + 2NH3×H2O → 2MnO2 + N2 + 2KOH + 4H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4.
— это реакции, протекающие с изменением степеней окисления элементов. В ходе таких реакций происходит отдача (отрыв) электронов от одного элемента и присоединение их к другому.
Важно запомнить следующие термины: окислитель, восстановитель, окисление, восстановление
Итак:
Процесс отдачи электронов атомом называется окислением, при этом степень окисления этого элемента повышается (он — восстановитель)
Процесс присоединения электронов атомом называется восстановлением, при этом степень окисления этого элемента снижается (он — окислитель)
Восстановитель — это элемент, степень окисления которого повышается, т.е. он отдает электроны
Окислитель — это элемент, степень окисления которого снижается за счет присоединения электронов

Помним, что электрон заряжен отрицательно. Поэтому, когда атом отдает электроны, отрицательных частиц в нем становится меньше, чем положительных протонов, и его
степень окисления повышается (он — восстановитель). И наоборот, если атом присоединяет к себе электроны, отрицательных частиц становится больше, чем положительных, соответственно, степень
окисления снижается.

Восстановителями могут быть элементы в низших степенях окисления:
— простые вещества металлы,
— соединения неметаллов в низших степенях окисления (HCl, HBr, HI, H2S и их соли, NH3, PH3, соли аммония)
Окислителями могут быть элементы в высших степенях окисления:
— KMnO4, K2CrO4, K2Cr2O7,
— H2SO4 (конц), HNO3 в любой концентрации, ее соли (KNO3, NaNO3), CO2
— простые вещества F2, О3
И окислителями и восстановителями могут быть элементы с промежуточной степенью окисления:
— простые вещества неметаллы H2, Cl2, Br2, I2, S, P, N2, C
— CO, NO, N2O, SO2
— HNO2 и ее соли
— соединения металлов в промежуточной степени окисления (FeSO2, FeCl2, Cr2(SO4)3, MnO2, K2MnO4)
— H2O2, HClO3 и ее соли
Важно: нередко в реакциях один и тот же элемент может одновременно повысить и понизить степень окисления. Такие реакции называют реакциями
диспрапорционирования
В ОВР часто в реакцию вступает третье вещество, которое не является ни окислителем, ни восстановителем. Такие вещества создают среду раствора. Она может быть кислой (за счет H2SO4), нейтральной
(H2O), щелочной (KOH или NaOH). Среда раствора определяет по какому пути пойдет реакция

Марганец имеет несколько степеней окисления, наиболее характерными являются +2, +4, +6, +7.
В зависимости от с.о. соединения Mn будут проявлять различную окислительно-восстановительную способность:
Mn в с.о. 0 — это простое вещество, металл, степень окисления которого может только повышаться, значит Mn(0) — только восстановитель.
Mn в с.о. +6 — манганаты калия и натрия (K2MnO4, Na2MnO4) — так же
являются как окислителями, так и восстановителями, их растворы имеют зеленоватый оттенок
Mn в с.о. +2 — обычно представляются в виде солей (хлоридов, сульфатов) и имеют бледно-розовый оттенок раствора. Преимущественно является восстановителем, но в
некоторых реакциях может выступать как окислитель, например, при электролизе или реакциях замещения

Mn в с.о. +4 — только MnО2 — амфотерный оксид, может быть как окислителем, так и восстановителем в зависимости от условий
реакции (при наличии более сильного окислителя, он — восстановитель, при более сильном восстановителе, проявляется как окислитель)
Пример:
MnO2 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O (MnO2 — окислитель)
КBr не может быть окислителем, т.к. Br находится в низшей с.о. (-1)
MnO2 + NaClO3 +
NaOH = Na2MnO4 + NaCl + H2O (MnO2 —
восстановитель)
Хлорат натрия NaClO3 — сильный окислитель, а значит MnO2 — будет
восстановителем

Mn в с.о. +7 — перманганаты калия и
натрия (KMnO4, NaMnO4) — только окислители, т.к. марганец находится в высшей степени окисления, а значит повышать ее и быть
восстановителем уже не может. Растворы перманганатов имеют ярко малиновый окрас

KMnO4 — сильный окислитель, реагирует как с неорганическими веществами, так и с органическими (спиртами, альдегидами, непредельными углеводородами).
В зависимости от среды, в реакциях будут образовываться различные продукты восстановления Mn:
— в кислой среде образуются соли Mn (+2), например MnCl2, MnSO4
— в нейтральной среде выпадает осадок MnO2 бурого цвета
— в щелочной среде образуется манганат K2MnO4? где Mn (+6)
Примеры:
FeSO4 + KMnO4 + H2SO4 = Fe2(SO4) + MnSO4 + K2SO4 + H2O
KMnO4 + KNO2 + H2O = KNO3 + MnO2 + KOH
Cr2(SO4)3 + KMnO4 + KOH = K2CrO4 + K2MnO4 + K2SO4 + H2O

Хром имеет несколько степеней окисления, наиболее характерны из которых +3 и +6.
Соединения Cr (+2) не стабильны, легко окисляются до +3, являясь сильнейшими восстановителями
Cr в с.о. +3 представляются в виде солей (сульфата, нитрата или хлорида) и гидроксида. Т.к. хром в этих соединениях находится в промежуточной степени окисления, то он может выступать в роли и
окислителя и восстановителя, хотя ОВР, где Cr (+3) — окислитель в практике ЕГЭ редки.
Цвета растворимых солей располагаются в лилово-зеленой гамме в зависимости от формулы и температуры. Гидроксид хрома (III) имеет грязно-зеленый оттенок.
При взаимодействии Cr (+3) с сильными окислителями, он окисляется до Cr (+6), т.е. до хромата или бихромата (зависит от кислотности среды):
— в кислой среде образуется оранжевый бихромат (К2Cr2О7)
— в щелочной среде — желтый хромат (К2CrО4)

Cr в с.о. +6 представлен двумя группами веществ — хроматами и бихроматами (или дихроматами, разницы нет). Они являются сильными окислителями, восстанавливаясь
до Cr (+3).
Ядовиты. Редко вступают в реакции ионного обмена. Так, хроматы могут реагировать с солями бария и серебра образуя желтый осадок хромата бария и кроваво-красный
осадок хромата серебра.
К2Cr2О7 — бихромат калия — вещество оранжевого цвета, стабильно в нейтральной и кислой среде.
K2CrO4 — хромат калия — вещество желтого цвета, стабильно в нейтральной и щелочной среде.
При добавлении щелочи к раствору бихромата, он окрашивается в желтый цвет — бихромат превращается в хромат. И наоборот, при добавлении кислоты в желтый раствор
хромата, окраска изменятся на оранжевый.


ОВР
соединений марганца
Рассмотрим окислительно – восстановительные свойства
соединений марганца, проявляемые ими в разных условиях (в
кислотной, нейтральной или щелочной). При проведении ОВР для создания в
растворе кислотной среды обычно используют серную кислоту. Азотную
кислоту используют крайне редко, так как она сама является сильным окислителем;
соляную, бромоводородную и йодоводородную кислоты не используют из-за их
способности к окислению. Щелочная среда создается добавлением в раствор гидроксидов
натрия или калия.
Перманганат
калия КMnO4 всегда
является окислителем. Продукты восстановления зависят от характера среды:
Условия
протекания окислительно-восстановительных превращений для соединений марганца
можно представить в виде схемы, приведенной на рисунке 2.
Как
видно из приведенной на этом рисунке схемы, перманганат-ион, входящий в состав
самого популярного в лабораторной практике окислителя, KMnO4,
в различных средах восстанавливается по-разному. В наибольшей степени
окислительные свойства перманганат калия проявляет в кислотной среде, в
несколько меньшей – в нейтральной и в наименьшей степени – в щелочной.
Рассмотрим
эти случаи на конкретных примерах.
Пример 1. Составьте
уравнение реакции, протекающей при пропускании оксида серы (IV) через
подкисленный серной кислотой раствор перманганата калия.
Для составления уравнения
воспользуемся методом электронного баланса.
При составлении уравнений ОВР наличием в растворе гидросульфатных
ионов обычно пренебрегают. (Наличием ионов HSO4— нельзя
пренебрегать при составлении уравнений ОВР типа взаимодействия
концентрированной H2SO4 с NaBr (среди прочего образуется
NaHSO4), но уравнения этих реакций составляют, используя метод
электронного балланса.)
1.
|
2 |
MnO4— + 8H+ + 5e– = |
|
5 |
SO2 + 2H2O – 2e– = SO42- |
2.
После умножения каждого из уравнений полуреакций на
соответствующие множители, сложения уравнений и приведения подобных членов
получаем ионное уравнение.
2MnO4— +
16 Н+ + 5SO2 + 10H2O = 2Mn2+ + 5SO42-
+ 20 H+ + 8H2O
3.
Добавив в левой части уравнения необходимое количество противоионов и не
забывая о них при написании формул продуктов реакции, запишем молекулярное
уравнение:
2KMnO4
+ 5SO2 + 2H2O = 2MnSO4 + 2H2SO4
+ K2SO4
Из
уравнения видно, что серная кислота, которая по смыслу задания должна была
вступить в реакцию, в действительности в реакцию не вступает, а, наоборот, в
процессе реакции выделяется, то есть добавлена в раствор только как
средообразователь. Но это скорее исключение, чем правило. Убедимся в этом
на другом примере.
Пример 2. Составьте
уравнение реакции, протекающей при сливании раствора перманганата калия с
раствором аммиака.
1. Аммиак
– слабое основание, поэтому среда в его водном растворе слабощелочная. Перманганат-ион
в этих условиях при восстановлении превращается в диоксид марганца, выпадающий
из раствора в виде бурого осадка. В нейтральной и щелочной среде очень мало
ионов оксония, поэтому для связывания «лишних» атомов кислорода могут
быть использованы лишь молекулы воды. Каждая молекула воды, присоединяя один
атом кислорода, превращается в два гидроксид-иона. Аммиак в этих условиях
окисляется до азота (ближайшая устойчивая степень окисления – ноль).
|
2 |
6 |
MnO4— + 2H2O + 3e– = |
|
1 |
3 |
2NH3 + 6H2O – 6e– = N2 |
2. Ионное
уравнение:
2MnO4—
+ 10H2O + 2NH3 = 2MnO2 + 8OH— + N2 + 6H3O+
3. Так как в одной из полуреакций образуются гидроксид-ионы, а в
другой – ионы водорода, что вполне допустимо в нейтральной (или близкой к ней)
среде, перед приведением подобных членов в ионном уравнении необходимо учесть,
что эти ионы одновременно в водном растворе существовать не могут (пройдет
реакция нейтрализации).
2MnO4— + 4H2O + 2NH3 =
2MnO2 + 2OH— + N2 + 6H2O
После приведения подобных членов получаем ионное уравнение:
2MnO4— + 2NH3
= 2MnO2 + 2OH— + N2 + 2H2O
4. Запишем молекулярное уравнение:
2KMnO4
+ 2NH3
= 2MnO2
+ 2KOH + N2 +
2H2O
Пример 3. Составить уравнение реакции, протекающей
при сливании раствора перманганата калия с раствором сульфита калия в
присутствии гидроксида калия.
|
2 |
MnO4— + e– |
|
1 |
SO32— + |
2MnO4—
+ SO32- + 2OH— = 2MnO42-
+ SO42- + H2O
2KMnO4
+ K2SO3 + 2KOH = 2K2MnO4 + K2SO4
+ H2O
Пример 4. Составить
уравнение реакции, протекающей при сливании раствора перманганата калия с
раствором сульфита натрия в присутствии серной кислоты.
Пример 5. Составить
уравнение реакции, протекающей при сливании раствора перманганата калия с
раствором сульфита натрия.
В
нейтральной среде:
Оксиды
марганца
Оксид
марганца (IV) MnO2 в кислотной среде проявляет свойства
сильного окислителя. Он окисляет хлорид-ион до хлора, нитрит-ион до
нитрат-иона, йодид-ион до йода и т. д.
В
свою очередь сам оксид марганца (IV)
получается при взаимодействии перманганата калия с растворами солей марганца (II)
по реакции:
2MnO4—
+ 3Mn2+ + 6H2O = 5MnO2 + 4H3O+
Устойчивый
только в сильнощелочных растворах манганат калия K2MnO4
уже при незначительном подкислении и даже при разбавлении раствора водой
диспропорционирует:
3MnO42-
+ 2H2O = 2MnO4— + MnO2 + 4OH—
Очень
сильным окислителем является оксид марганца (VII). Это кислотный оксид
(при обычных условиях жидкость), активно реагирующий с водой:
Mn2O7
+ H2O = 2HMnO4
Он
легко окисляет аммиак до N2, сероводород — до SO2,
сульфиды – до сульфатов, монооксид углерода и органические вещества — до CO2.
При этом сам восстанавливается до MnO2.
Соединения марганца в овр
Перманганат-ион
выступает окислителем в любой среде,
от рН среды зависит продукт восстановления
перманганата-иона. Кислую
среду создают серная, азотная, соляная
и другие сильные кислоты, раствор
сернистого газа.
Азотная кислота помимо создания кислой
среды будет проявлять окислительные
свойства, а соляная (и другие
галогеноводородные кислоты, кроме HF)
– восстановительные свойства. Щелочная
среда создается растворами щелочей и
аммиака, сульфидов щелочных металлов.
Тот или иной продукт восстановления
объясняется его устойчивостью в данной
среде. В некоторых заданиях С1 в качестве
продукта восстановления KMnO4
в
щелочной
среде указывается оксид марганца (IV).
Это объясняется тем, что манганат
(K2MnO4)
в принципе неустойчивое вещество и в
растворе самопроизвольно диспропорционирует
на оксид марганца(IV)
и перманганат.
Схема
1. Поведение перманганат-иона в ОВР

|
KMnO4 |
||
|
в MnO4— |
в |
в MnO4— |
|
(соль |
MnO2↓ |
Манганат |
|
5K2SO3 |
2КМnО4+ |
K2SO3 |
Приведем
примеры, следуя выше указанной схеме:
KMnO4
+ К2SO3
+ H2SO4
Окислитель
восстановитель создает кислую
среду,
Следовательно
перманганат превратится в сульфат
марганца (II),
сульфит окислится до сульфата, ионы
калия свяжутся сульфат-ионами, ионы
водорода превратятся в воду.
2KMnO4
+ 5К2SO3
+ 3H2SO4
=
6К2SO4+
2MnSO4+
3H2O
KMnO4
+ К2SO3+
H2O
Окислитель
восстановитель среда близка к
нейтральной (слабо щелочная из-за
гидролиза сульфита) , следовательно
перманганат превратится в оксид марганца
(IV),
сульфит окислится до сульфата, ионы
калия свяжутся с гидроксид-ионами.
2KMnO4
+ 3К2SO3
+ H2O
= 3К2SO4+
2MnO2+2KOH
KMnO4
+ К2SO3
+ KOH
Окислитель
становитель создает щелочную
среду,
Следовательно
перманганат превратится в манганат
калия, сульфит окислится до сульфата,
побочный продукт — вода:
2KMnO4
+К2SO3
+ 2KOH = К2SO4+
2 K2MnO4+
H2O
2KMnO4
+ 5SO2
+ 2H2O
=
К2SO4+
2MnSO4+
2H2
SO4
Создает
кислую среду
Другие соединения марганца:
|
Cоли |
||
|
кислая |
нейтральная |
щелочная |
|
KMnO4 HMnO4 |
оксид |
K2MnO4 |
|
2Mn(NO3)2 2MnSO4+ 2Mn(NO3)2 |
MnCl2 MnO2 |
MnO2 Mn(OH)2 K2MnO4 |
Манганат-ион
также может выступать окислителем (в
нейтральной и кислой среде):
Схема
2. Поведение манганат-иона в ОВР

Оксид
марганца (IV)
выступает окислителем в кислой среде
с образованием солей манганца (II):
Cоли
марганца (II),
оксид
марганца (IV)
и манганаты могут выступать восстановителями,
при этом продукт их окисления также
зависит от среды: в нейтральной среде
получится оксид марганца (IV),
в щелочной – манганат, в кислой –
перманганат.
Примеры:
MnCl2
+ O3
+ H2O
= MnO2
+
O2+
2HCl
восстановитель
окислитель нейтральная
среда продукт окисления
Mn(OH)2
+ 2Cl2
+ 6KOH =
K2MnO4
+
4H2O
+
4KCl
восстановитель
окислитель щелочная
среда
продукт окисления
MnO2
+ KNO3
+ 2KOH =
K2MnO4
+
H2O
+
K NO2
восстановитель
окислитель щелочная
среда
продукт окисления
2MnSO4+
5NaBiO3
+16HNO3
= 2HMnO4
+ 2Na2SO4
+
7H2O
+ NaNO3+5Bi
(NO3)3
Восст-ель
окис-ль кислая
среда
продукт окисления
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Цели урока:
- повторить алгоритм по составлению ОВР методом
электронного баланса и раскрыть сущность метода
полу реакций МПР. - показать преимущества в формировании умений
прогнозирования направления протекания ОВР в
растворах на примере соединений марганца. - закрепить умения по составлению уравнений ОВР,
протекающих в различных средах. - научить применять полученные знания для
решения конкретных задач.
Задачи урока.
- Подготовить учащихся к выполнению задания 36 из
ЕГЭ по химии - Планируемый результат
Предметные:
- знать ОВР, правила составления
ОВР; - уметь Определять характер среды,
условия протекания ОВР, исходные и продукты
образования, окислителя и восстановителя,
составить электронный баланс и пользоваться
методом полу реакций, проводить эксперимент и на
основе эксперимента сделать вывод.
Метапредметные:
- уметь Организовывать свою
деятельность, определять ее цели и задачи,
выбирать средства реализации цели и применять их
на практике, оценивать результаты; устанавливать
причинно-следственные связи, строить логические
рассуждения, делать выводы; умение создавать
модели и схемы; умение организовывать учебное
сотрудничество и совместную деятельность с
учителем и сверстниками, работать индивидуально
и в группе.
Личностные: Формирование
ответственного отношения к учению, готовности и
способности обучающихся к саморазвитию и
самообразованию на основе мотивации к обучению и
познанию; формирование коммуникативной
компетентности в общении и сотрудничестве со
сверстниками в процессе учебной деятельности.
Оборудование и реактивы:
- персональный компьютер, проектор, презентация
- Раствор перманганата калия, кристаллический
перманганат калия, раствор серной кислоты,
раствор щелочи, раствор иодида калия, сульфит
натрия, 5—10%-ный раствор пероксида водорода - Большие пробирки, помещенных в
демонстрационный штатив с белым фоном, прибор
для получения газов, колба-приемник, железный
штатив, спиртовка, лучинка, спички, пробирки в
универсальном штативе на каждом столе,
стеклянная палочка - Приложение 1 “Соединения элемента
марганца: окислители и восстановители, расчет
степеней окисления” - Приложение 2 “Алгоритм составления
уравнений ОВР методом электронного баланса” - Приложение 3 “Алгоритм составления
уравнений ОВР ионно-электронным методом” - Приложение 4 “Окислительные и
восстановительные свойства пероксида водорода в
зависимости от характера среды. Инструкция по
выполнению лабораторного опыта”.
Тип урока: усвоение новых знаний с
применением имеющихся знаний и умений с
последующим обобщением и систематизацией.
Формы, применяемые на уроке
- Разъяснение (объяснительно-иллюстративный)
- рассуждение (частично-поисковый)
- общая характеристика (проблемный)
Методы, применяемые на уроке
- словесные (беседа, объяснение)
- наглядные (опыты, компьютерная презентация,
информационные приложения) - практические (демонстрация и самостоятельное
выполнение опытов).
План урока.
- Актуализация знаний.
- Повторение основных теоретических понятий
темы. - Определение, среды (кислой, нейтральной или
щелочной), в которой протекает реакция. - Электронный и ионно-электронный метод
составления уравнений ОВР - Закрепление полученных знаний
Ход урока
1. Актуализация знаний.
Подготовка к выполнению задания 36 состоит из
нескольких элементов:
Изучение теоретического материала,
индивидуальные консультации с преподавателем и
выполнение заданий, основываясь на данном
методическому материале.
Прежде чем приступить к выполнению работы
необходимо освоить основные термины,
определения, понятия и овладеть техникой
химических расчетов.
В задании предложена схема реакции, причем
формулы одного-двух веществ заменены
многоточиями.
Все задания 36 можно условно разделить на три
типа:
Учитель проецирует с помощью видеопроектора
схемы на экран Слайд 2
2. Повторение пройденного материала
В программе основной школы вы уже затрагивали
основные вопросы, необходимые для выполнения
задания 36.
Знаете, какие химические реакции относятся к
окислительно -восстановительным и что в ОВР один
из участников окисляется. Это восстановитель,
т.е. он отдает электроны и повышает свою степень
окисления. Другой – восстанавливается. Это
окислитель, т.е. он оттягивает на себя валентную
пару электронов, понижает свою степень
окисления.
Слайд 3 Учитель проецирует с помощью
видеопроектора схемы на экран
Выполняем задание. Учащиеся имеют приложение
на партах Приложение 1
Выполняем упражнение:
- определение степени окисления элементов по
формуле - строение атома марганца, определяют возможные
степени окисления элемента, его окислительную и
восстановительную способность. - заполняют таблицу по типам химических реакций
- формируют вывод
Учащиеся заполняют таблицу. Делают вывод: все
реакции замещения и реакции, в которых
присутствуют простые вещества относятся к ОВР.
Рассматривают строение атома марганца. Делают
вывод.
3. Определение, среды (кислой, нейтральной
или щелочной), в которой протекает реакция.
Приступая к выполнению данного задания, вы,
логически рассуждая, должны определить
пропущенные вещества. Для этого необходимо знать
основные окислители и восстановители, а также
продукты их восстановления или окисления.
Кроме того, для того, чтобы дописать
пропущенные вещества, следует учитывать, в какой
среде протекает окислительно —
восстановительная реакция.
Определить среду можно
А) по продуктам восстановления окислителя
(например, марганца)
Перманганаты – сильные окислители, при чём, в
зависимости от рН среды:
Учитель проецирует с помощью видеопроектора
схемы на экран, проводит опыт
Слайд 4, 5, 6 Демонстрационный опыт
“Химический хамелеон”
Восстановление перманганата калия сульфитом
натрия в различных средах.
4. Процедуры подбора коэффициентов в
уравнениях
Что касается собственно процедуры подбора
коэффициентов в уравнениях, то можно
использовать метод электронного баланса, а для
реакций в растворах удобен так называемый метод
полу реакций, или электронно-ионный.
Учитель проецирует с помощью видеопроектора
схемы на экран Слайд 7,8,9
Составление уравнений ОВР методом
электронного баланса
Метод электронного баланса основан на
сравнении степеней окисления в исходных и
конечных веществах, когда известны все исходные
вещества и продукты реакции. Этим методом вы уже
пользовались при работе на уроках в 8-9 классах.
Учитель проецирует с помощью видеопроектора
схемы на экран, учащиеся для удобства имеют схемы
на партах Приложение 2.
Работа у доски: Уровнять реакции,
используя метод электронного баланса,
определить окислитель и восстановитель. Слайд
7,8,9
Делают вывод: Методом электронного
баланса расставлять коэффициенты удобно, если
известны исходные вещества и продукты реакции,
т.е. даны полные схемы реакций.
Метод полу реакций, или электронно-ионный.
При использовании метода полу реакций
(электронно-ионный баланс) следует иметь в виду,
что в водных растворах связывание избыточного
кислорода и присоединение кислорода
восстановителем происходит по-разному в кислой,
нейтральной и щелочной средах.
Учитель проецирует с помощью видеопроектора
схемы на экран. Выполняет опыты.
Учащиеся имеют приложения на партах. Приложение 3. Слайд 10,11
Демонстрационный опыт. Восстановление
перманганата калия йодидом калия в различных
средах. “Химический хамелеон”
Учитель проецирует с помощью видеопроектора
схемы на экран, учащиеся для удобства имеют схемы
на партах
Работа у доски: Уровнять реакции,
используя МПР, определить окислитель и
восстановитель.
Одну реакцию выполняет учитель, две оставляет
на самостоятельную работу учащихся.
Слайд 12,13,14
Делаем вывод:
Рассмотрев метод электронно-ионного баланса
или метод полу реакций можно выделить следующие
достоинства данного метода:
- что в нем применяются не гипотетические ионы, а
реально существующие. - нет необходимости использовать степени
окисления, отчетливо видна роль среды и
учитывается реальное состояние частиц в
растворе. Однако данный метод применим для
составления уравнений
окислительно-восстановительных процессов,
происходящих лишь в растворах.
5. Закрепление полученных знаний
Реакции – диспропорционирования.
Учитель проецирует с помощью видеопроектора
схемы на экран. Выполняет опыт.
Демонстрационный опыт “Химический
хамелеон” Слайд 15, 16
Описание:
Для опыта нужна пробирка с газоотводной
трубкой. В пробирку насыпали кристаллический
перманганат калия (марганцовку). При нагревании
перманганат калия разлагается, выделяющийся
кислород поступает по газоотводной трубке в
колбу-приемник. Кислород тяжелее воздуха,
поэтому не покидает колбу и постепенно заполняет
ее. Если опустить тлеющую лучину в колбу с
собранным кислородом, то она ярко вспыхнет, т.к.
кислород поддерживает горение.
Уравнение проведенной реакции:
2KMnO4 = K2MnO4 + MnO2 + O2
После окончания опыта и охлаждения пробирки в
нее наливают несколько миллилитров воды,
тщательно взбалтывают содержимое и наблюдают
цвет образовавшихся веществ (К2МnO4 —
зеленого цвета и МnO2 темно-бурого).
K2Mn+6O4 + H2O —> KMn+7O4
+ Mn+4O2 + KOH
При сильном разбавлении водой происходит
реакция самоокисления-самовосстановления.
Окраска изменится с зеленой на красно-фиолетовую
и выпадет бурый осадок.
Самостоятельная работа в тетрадях: Уровнять
реакции, используя МПР, определить окислитель и
восстановитель. Слайд 15,16
Формируют вывод: Это реакции,
где окислитель и восстановитель – один и тот же
элемент, входящий в состав одной молекулы.
Самостоятельно проводим опыт и пишем
уравнение методом полуреакций
Учитель объясняет, что пероксид водорода может
проявлять окислительные и восстановительные
свойства, как в кислотной, так и в щелочной среде.
(перекиси могут быть как окислителями, так и
восстановителями, электроны перекисей могут
переходить от одной молекулы к другой:
Н2O2 + Н2O2 = O2 + 2Н2O.)
Учащиеся выполняют лабораторный опыт и делают
вывод о проявлении перекиси водорода
окислительных и восстановительных свойств в
зависимости от среды.
Примечание. Для эксперимента используют 3%-й
раствор перекиси водорода, который можно
приобрести в аптеке, как и раствор марганцовки.
Техника эксперимента проста и не требует
большой затраты времени.
Учитель проецирует с помощью видеопроектора
схемы на экран. Для удобства учащиеся имеют
приложение на партах. Приложение 4.
Слайд 17
Лабораторная работа: “Восстановление
перманганата пероксидом водорода” “Химический
хамелеон” — Превращение малинового раствора в
бесцветный”
Делают вывод: В этом случае пероксид
водорода проявляет восстановительные свойства,
а перманганат калия — окислительные.
6. Домашнее задание: Слайд 18
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 —
амфотерные, +6, +7 — кислотные.

Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO4
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2

При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3)2 + NO + H2O

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо
восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Mn(OH)2 + O2 = MnO2 + H2O
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие
соли.
Mn(OH)2 + HCl = MnCl2 + H2O

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если
выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Mn(NO3)2 = (t) MnO2 + NO2
Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.

В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
MnO2 + HCl = MnCl2 + Cl2 + H2O

Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами.
Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4 + H2O

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют
кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
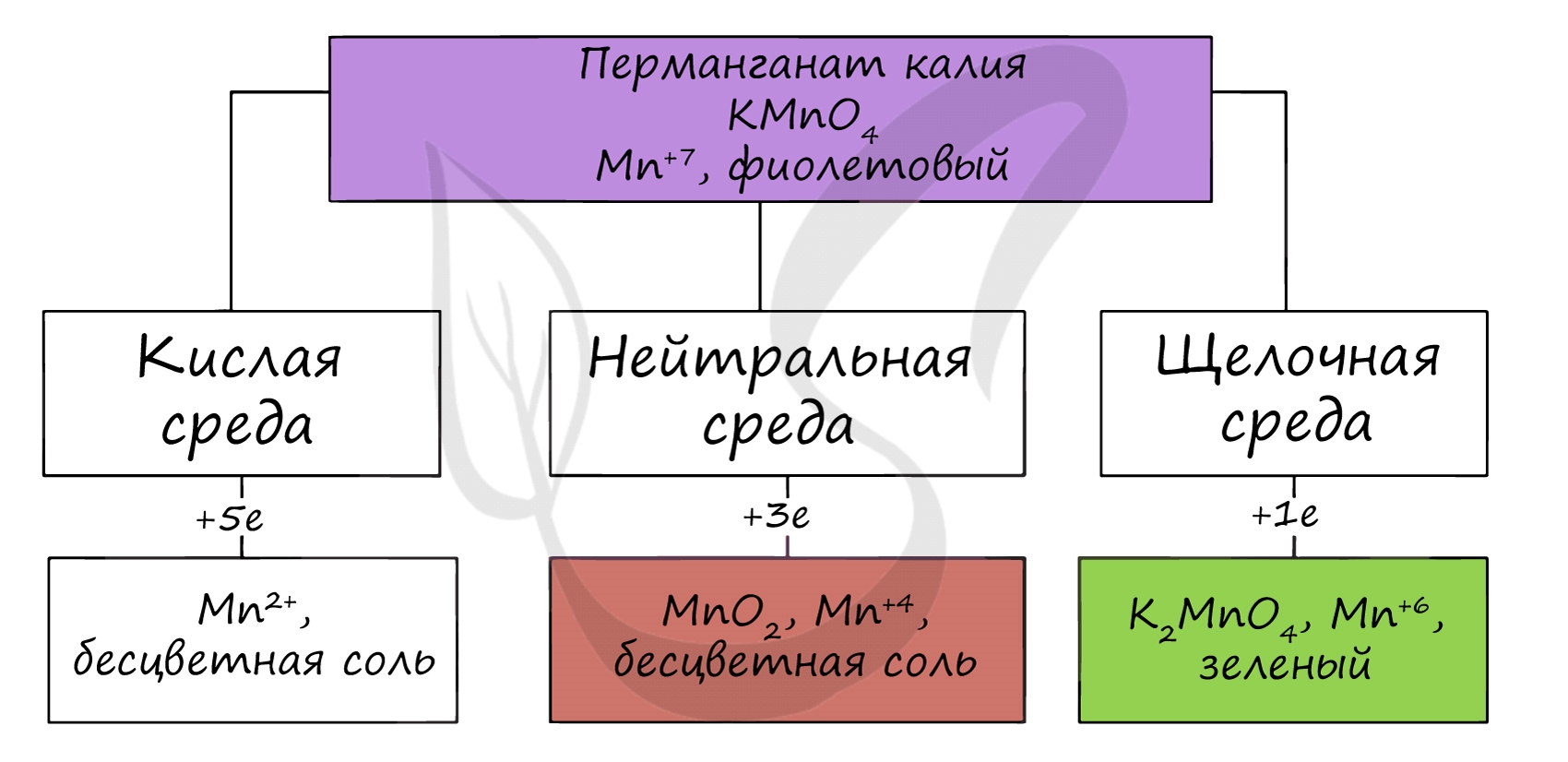
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑

При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn2+, в щелочной — Mn6+.
KMnO4 + H2O2 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав
меди с цинком — латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит

Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка
различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
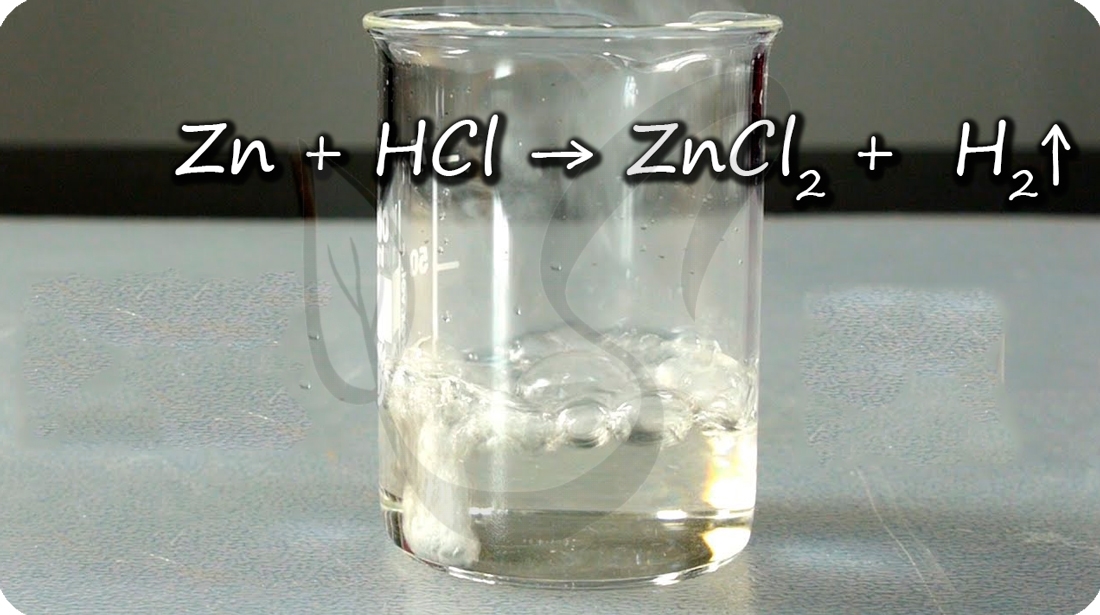
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями.
При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или
при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов.
При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O

Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.





