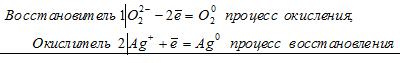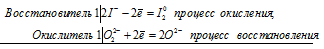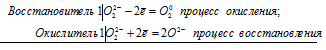Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут.
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr+3.
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2 → N2 + 6H2O
Соединения Cr+3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au+3, KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
ПЕРЕКИСЬ
ВОДОРОДА
Перекись
водорода представляет собой бесцветную сиропообразную жидкость с температурами
фазовых переходов -0,430С и 150,20С. Смешивается с водой
неограниченно.
В чистом
виде Н2О2 малоустойчива и может разлагаться со взрывом,
водные растворы довольно устойчивы.
Разложение
по уравнению: 2Н2О2 → О2 +2Н2О +
47 ккал в водном растворе идет интенсивно при нагревании, облучении или в
присутствии катализаторов ( чаще всего с MnO2).
В молекуле
перекиси два атома кислорода соединены друг с другом неполярной ковалентной
связью, образуя перекисную группу («мостик») -О-О-, поэтому степень
окисления кислорода в этом и подобных ему соединениях равна -1 ( аналогично
как и для серы в пирите).
Химические свойства.
1.
Кислотные
свойства
(перенос перекисной группы).
Н2О2
– очень слабая кислота двухосновная кислота; в воде частично диссоциирует:
Н2О2
→ Н+ + НО2- по первой стадии и по второй
НО2- →
Н+ + О2- в очень малой степени.
1. При
взаимодействии со щелочами (реакция нейтрализации) образуются соли – перекиси,
в которых сохраняется перекисный «мостик»:
Ва(ОН)2 нас.р-р
+ Н2О2 → ВаО2↓ + 2Н2О (выпадение
белых блестящих кристаллов)
2.При
взаимодействии с высшими кислотами: Н2O2+ 2H2SO4
→ H2S2O8 +H2O
образование пероксодисерной кислоты :
2.
Окислительно-восстановительные
свойства
Так как степень
окисления кислорода в перекиси -1, то это соединение может проявлять как
восстановительные так и окислительные свойства.
1) При
взаимодействии с восстановителями (качественная реакция на перекись
водорода) перекись проявляет окислительные свойства: перекисная
связь рвется и образуются два иона кислорода:
(О2)2- +2ẽ
→ 2О2-
2KI + H2SO4
+H2O2 → I2 +K2SO4 + 2H2O
Окислительные
свойства перекиси можно доказать взаимодействием со свежеполученным и
отфильтрованным сульфидом свинца (II) или бария:
PbS черный +4 H2O2 → PbSO4белый↓ + 4H2O –
изменение цвета осадка или
доокислением сернистой
кислоты в серную:
H2O2
+ H2SO3 → H2O + H2SO4
2) При
взаимодействии с более сильными окислителями перекись водорода проявляет
восстановительные свойства (количественное определение перекиси
водорода в растворе)
2KMnO4
+ 3H2SO4 + 5H2O2 → 2MnSO4
+K2SO4 +5O2 +8H2O
ОКИСЛИТЕЛЬНЫЕ
СВОЙСТВА Н2О2 ПРОЯВЛЯЕТ В БОЛЬШЕЙ СТЕПЕНИ, ЧЕМ
ВОССТАНОВИТЕЛЬНЫЕ.
3.
Образование
аддитивных соединений
Молекула перекиси
может присоединяться как целое к другой молекуле с образованием
пероксигидратов, аналогичных гидратам:
H2O2 + 2Na2CO3 → 2Na2CO3*3H2O2
Прописать
уравнения реакций по прописи эксперимента.
1. К нитрату
серебра приливают раствор аммиака, а затем по каплям добавляют 3% раствор
перекиси водорода. Выпадает темный осадок.
2. К
раствору ванадата натрия, подкисленного серной кислотой, добавляют по каплям
3% раствор перекиси водорода. Раствор окрашивается в розово-коричневый цвет
(образование пероксованадиевой кислоты HVO4)
3. В пробирку
с раствором сульфата титана (IV) внести по каплям растворы серной
кислоты и перекиси водорода. Появится желто-оранжевое окрашивание раствора
пероксотитановой кислоты (
H4TiO5).
Закончить
уравнения ОВР с участием перекиси водорода.
1. H2O2
+ KMnO4 + H2SO4 →
2. H2O2
+ KMnO4 + KOH →
3. H2O2
+ KMnO4→
4. H2O2
+ KI + H2SO4 →
5. H2O2
+ KI →
6. H2O2
+ Ca(ClO)2 →
7. H2O2
+ Ag2O →
8. H2O2
+ H2SO4 + FeSO4 →
Источник
информации
У.Шамб,
Ч.Сеттерфилд, Р.Вентворс, ПЕРЕКИСЬ ВОДОРОДА, пер с англ, изд. Иностранной
литературы, Москва, 1958
Окислительно-восстановительные реакции на примере перекиси водорода. Подготовка к ЕГЭ.
Выполнила: Власова Елена Валерьевна
МБОУСОШ№5 , п.г.т. Сафоново
2016 год
Теория и короткие научно-исследовательские работы с использованием перекиси водорода. Для опытов отобраны реакции, имеющие важное значение в химии, экологии, которые можно проводить для подготовки обучающихся к итоговой аттестации. Работать желательно малыми группами (по 2-3 человека). Это уменьшает время эксперимента, позволяет избежать ошибок и, самое главное, позволяет ученикам участвовать в научном общении, что развивает научную речь.
Краткая теория:
- Окислительно-восстановительные свойства пероксида водорода
Пероксид водорода – важнейший окислитель, который используется в быту, в технологии, при очистке воды от органических загрязнений. Пероксид водорода – экологически чистый окислитель, т. к. продукты его разложения – кислород и вода – не загрязняют окружающую среду. Известна роль пероксида водорода и пероксидных органических соединений в процессах биологического окисления-восстановления.
3 – 6 %-е растворы пероксида водорода для бытовых и учебных целей готовят обычно из 30 %-го раствора разбавлением водой. Пероксид водорода при хранении разлагается с выделением кислорода (нельзя хранить в плотно закрытых сосудах!). Чем меньше концентрация пероксида водорода, тем он устойчивее. Для замедления разложения пользуются добавками фосфорной, салициловой кислот и других веществ. Особенно сильно действуют на пероксид водорода соли железа, меди, марганца и фермент каталаза.
3 %-й раствор пероксида водорода в медицине используют для промывания рта и полоскания горла при стоматите и ангине.
30 %-й раствор пероксида водорода называют пергидролем. Пергидроль не взрывоопасен. Попадая на кожу, пергидроль вызывает ожоги, жжение, зуд и образование пузырей, кожа при этом белеет. Обожженное место следует быстро промыть водой. Пергидроль в медицине используют для лечения гнойных ран и для обработки десен при стоматите. В косметологии его используют для удаления пигментных пятен на коже лица. Пятна на одежде от пероксида водорода удалить невозможно. Пероксид водорода в текстильной отрасли промышленности используют для отбеливания шерсти и шелка, а также мехов.
Производство концентрированных (90 – 98%) растворов пероксида водорода постоянно растет. Хранят такие растворы в алюминиевых сосудах с добавкой пирофосфата натрия . Концентрированные растворы могут разлагаться со взрывом. Концентрированный раствор пероксида водорода на оксидном катализаторе при 700
распадается на пары воды и кислород, который служит окислителем для топлива в реактивных двигателях.
Перкосид водорода может проявлять как окислительные, так и восстановительные свойства.
Роль окислителя для пероксида водорода более характерна:
+ 2
+ 2e = 2
O
Например, в реакции:
2KI + +
=
+
+ 2
2.Пероксид водорода как восстановитель:
- В кислотной среде:
– 2e =
+ 2
- В основной (щелочной) среде:
+ 2
– 2e =
+ 2
Примеры реакций:
- В кислотной среде:
2 + 5
+ 3
=
+
+
+ 8
- В основной среде:
2 +
+ 2KOH = 2
+
+
Или
+
+
= 2
+
+
Окислительные свойства пероксида водорода проявляются более сильно в кислотной среде, а восстановительные – в щелочной.
Эксперимент
1а. Разложение пероксида водорода.
Налейте в пробирку 2 -3 мл раствора пероксида водорода и нагрейте раствор на водяной бане. Должно начаться выделение газа (какого?). Докажите экспериментально, что это именно тот газ, который вы ожидали получить.
В другую пробирку с раствором пероксида водорода бросьте крупинку диоксида марганца. Докажите, что выделяется тот же газ.
Напишите уравнение разложения пероксида водорода и отдельно уравнения приема и отдачи электронов. К какому типу относится эта окислительно-восстановительная реакция?
Рассчитайте ЭДС реакции, если:
|
|
E = 0,68 B |
|
|
E = 1,77 В |
Какая из этих двух реакций обладает большей способностью отдавать электроны и ее следует переписать в противоположном направлении? Из значения ЭДС реакции рассчитайте реакции и константу равновесия.
Сравните результаты с и константой равновесия, полученными из термодинамических данных:
|
𝛥 |
S, Дж/(K•моль) |
|
|
|
-187,8 |
109,5 |
|
|
-285,8 |
70,1 |
|
|
0 |
205, 0 |
Результаты ваших расчетов совпали? Если имеется некоторое расхождение в результатах, попытайтесь найти причины.
1б. Обнаружение пероксида водорода.
К разбавленному и подкисленному серной кислотой раствору (2-3 мл) йодида калия добавьте несколько капель раствора пероксида водорода. Раствор окрасился в желто-бурый цвет. При добавлении в него несколько капель раствора крахмала цвет смеси мгновенно становится синим. Напишите уравнение реакции (образующиеся вещества вы знаете!).
Рассчитайте ЭДС реакции, чтобы убедится, что реакция возможна (выберите нужную вам реакцию):
|
|
E = 0,54 B |
|
|
E = 0,68 В |
|
|
Е = 1,77 B |
1в. Черный сульфид свинца и пероксид водорода.
Старые мастера писали свои картины красками, приготовленными на основе свинцовых белил, в состав которых входил белый основный карбонат
2
. С течением времени свинцовые белила чернеют, а краски на их основе изменяют свою окраску из-за действия сероводорода, при этом образуется черный сульфид свинца PbS. Если картину осторожно потереть разбавленным раствором пероксида водорода, сульфид свинца переходит в белый сульфат свинца
и картине почти полностью возвращается ее первоначальный вид.
В пробирку налейте 1-2 мл 0.1 М раствора нитрата свинца или ацетата свинца
(продается в аптеке как свинцовая примочка). Прилейте немного раствора сероводорода или сульфида натрия, Слейте раствор с образовавшегося черного осадка и подействуйте на него раствором пероксида водорода. Напишите уравнения реакций
Все соединения свинца ядовиты!
1г. Приготовление раствора пероксида водорода из гидроперита.
Если вам не удалось достать раствор пероксида водорода, то для лабораторных работ можно пользоваться гидроперитом, таблетки которго можно купить в аптеке.
Гидроперит представляет собой комплексное соединение пероксида водорода с карбамидом (мочевиной)
. При растворении в воде получается раствор пероксида водорода и карбамида
. Раствор карбамида используют вместо раствора пероксида водорода как антисептическое средство и при покраске волос. Для полоскания рта и горла растворяют 1 таблетку в стакане воды (0.25 %-й раствор пероксида водорода). Одна таблетка гидроперита весит 1.5 г. и соответствует 15 мл. (1 столовой ложке) 3% -го раствора пероксида водорода.
Рассчитайте, сколько таблеток гидроперита следует растворить в 100 мл воды, чтобы получить приблизительно 1%-й раствор пероксида водорода. Какой объем кислорода (н.у.) можно получить из одной таблетки гидроперита?
Опытным путем определите, сколько миллилитров кислорода можно получить из одной таблетки гидроперита. Предложите конструкцию прибора и соберите его. Объем выделившегося кислорода приведите к нормальным условиям. Для получения более точных результатов расчета вы можете учесть добавление пара воды над раствором, которое при комнатной температуре (20 ) приблизительно равно 2300 Па
Уравнения с пероксидом водорода овр
18.5. ОВР пероксида водорода
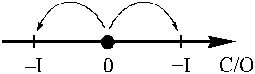
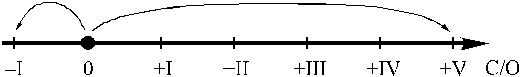
В молекулах пероксида водорода H2O2 атомы кислорода находятся в степени окисления –I. Это промежуточная и не самая устойчивая степень окисления атомов этого элемента, поэтому пероксид водорода проявляет и окислительные, и восстановительные свойства.
Окислительно-восстановительная активность этого вещества зависит от концентрации. В обычно используемых растворах с массовой долей 20 % пероксид водорода довольно сильный окислитель, в разбавленных растворах его окислительная активность снижается. Восстановительные свойства для пероксида водорода менее характерны, чем окислительные, и также зависят от концентрации.
Пероксид водорода – очень слабая кислота (см. приложение 13), поэтому в сильнощелочных растворах его молекулы превращаются гидропероксид-ионы.
В зависимости от реакции среды и от того, окислителем или восстановителем является пероксид водорода в данной реакции, продукты окислительно-восстановительного взаимодействия будут разными. Уравнения полуреакций для всех этих случаев приведены в таблице 1.
Уравнения окислительно-восстановительных полуреакций H2O2 в растворах
Реакция среды
H2O2 окислитель
H2O2 восстановительКислотнаяH2O2 + 2H3O 







Рассмотрим примеры ОВР с участием пероксида водорода.
Пример 1. Составьте уравнение реакции, протекающей при добавлении раствора йодида калия к раствору пероксида водорода, подкисленному серной кислотой.
H2O2 + 2H3O 

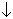
H2O2 + H2SO4 + 2KI = 2H2O + I2 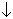
Пример 2. Составьте уравнение реакции между перманганатом калия и пероксидом водорода в водном растворе, подкисленном серной кислотой.
2MnO4 


2KMnO4 + 3H2SO4 + 5H2O2 = 2MnSO4 + 8H2O + 5O2 
Пример 3. Составьте уравнение реакции пероксида водорода с йодидом натрия в растворе в присутствии гидроксида натрия.
3HO2 



3NaHO2 + NaI = 3NaOH + NaIO3
Без учета реакции нейтрализации между гидроксидом натрия и пероксидом водорода это уравнение часто записывают так:
Это же уравнение получится, если сразу (на стадии составления баланса) не принимать во внимание образование гидропероксид-ионов.
Пример 4. Составьте уравнение реакции, протекающей при добавлении диоксида свинца к раствору пероксида водорода в присутствии гидроксида калия.
Диоксид свинца PbO2 – очень сильный окислитель, особенно в кислотной среде. Восстанавливаясь в этих условиях, он образует ионы Pb 2 

PbO2 + H2O + HO2 

Без учета образования гидропероксид-ионов уравнение записывается так:
PbO2 + H2O2 + OH 


Если по условию задания добавляемый раствор пероксида водорода был щелочным, то молекулярное уравнение следует записывать так:
PbO2 + H2O + KHO2 = K[Pb(OH)3] + O2
Если же в реакционную смесь, содержащую щелочь, добавляется нейтральный раствор пероксида водорода, то молекулярное уравнение может быть записано и без учета образования гидропероксида калия:
PbO2 + KOH + H2O2 = K[Pb(OH)3] + O2
Среди окислительно-восстановительных реакций выделяют реакции дисмутации (диспропорционирования, самоокисления-самовосстановления).
Реакции дисмутации – ОВР, в которых часть атомов одного и того же элемента в одной и той же степени окисления восстанавливается, а часть – окисляется.
Примером известной вам реакции дисмутации является реакция хлора с водой:
Cl2 + H2O 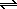
В этой реакции половина атомов хлора(0) окисляется до степени окисления +I, а вторая половина восстанавливается до степени окисления –I:
Составим методом электронно-ионного баланса уравнение аналогичной реакции, протекающей при пропускании хлора через холодный раствор щелочи, например KOH:
2Cl2 + 4OH 


Все коэффициенты в этом уравнении имеют общий делитель, следовательно:
Cl2 + 2OH 


Cl2 + 2KOH = KCl + KClO + H2O
Дисмутация хлора в горячем растворе протекает несколько иначе:
10Cl2 + 2e – = 2Cl 
2Cl2 + 12OH 

3Cl2 + 6OH 


3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Большое практическое значение имеет дисмутация диоксида азота при его реакции c водой (а) и с растворами щелочей (б):
1NO2 + 3H2O – e – = NO3 
1NO2 + 2OH 

1NO2 + H2O + e – = HNO2 + OH
1NO2 + e – = NO2
2NO2 + 2H2O = NO3 

2NO2 + 2OH 


2NO2 + H2O = HNO3 + HNO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Реакции дисмутации протекают не только в растворах, но и при нагревании твердых веществ, например, хлората калия:
2Cl +V + 6e – = Cl –I3
6Cl +V – 2e – = Cl +VII
Еще один тип реакций, протекающих при нагревании твердых веществ – внутримолекулярные ОВР.
Внутримолекулярные ОВР – ОВР, в которых атомы-окислители и атомы-восстановители входят в состав одного и того же вещества.
Характерным и очень эффектным примером внутримолекулярной ОВР является реакция термического разложения дихромата аммония (NH4)2Cr2O7. В этом веществе атомы азота находятся в своей низшей степени окисления (–III), а атомы хрома – в высшей (+VI). При комнатной температуре это соединение вполне устойчиво, но при нагревании интенсивно разлагается. При этом хром(VI) переходит в хром(III) – наиболее устойчивое состояние хрома, а азот(–III) – в азот(0) – также наиболее устойчивое состояние. С учетом числа атомов в формульной единице уравнения электронного баланса:
12Cr +VI + 6e – = 2Cr +III
12N –III – 6e – = N2,
а само уравнение реакции:
(NH4)2Cr2O7 = Cr2O3 + N2 

Другой важный пример внутримолекулярной ОВР – термическое разложение перхлората калия KClO4. В этой реакции хлор(VII), как и всегда, когда он выступает в роли окислителя, переходит в хлор(–I), окисляя кислород(–II) до простого вещества:
4Cl +VII + 8e – = Cl –I2
82O –II – 4e – = O2
и, следовательно, уравнение реакции
KClO4 = KCl + 2O2
Аналогично разлагается при нагревании и хлорат калия KClO3, если разложение проводить в присутствии катализатора (MnO2): 2KClO3 = 2KCl + 3O2
В отсутствие катализатора протекает реакция дисмутации.
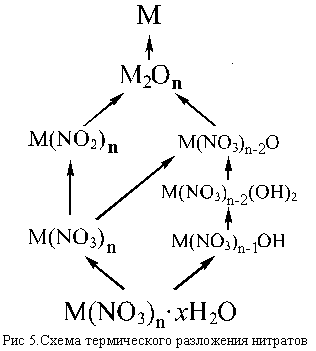
К группе внутримолекулярных ОВР относятся и реакции термического разложения нитратов.
Обычно процессы, протекающие при нагревании нитратов довольно сложны, особенно в случае кристаллогидратов. Если в кристаллогидрате молекулы воды удерживаются слабо, то при слабом нагревании происходит обезвоживание нитрата [например, LiNO3 . 3H2O и Ca(NO3)2 4H2O обезвоживаются до LiNO3 и Ca(NO3)2], если же вода связана прочнее [как, например, в Mg(NO3)2 . 6H2O и Bi(NO3)3 . 5H2O], то происходят своего рода реакции » внутримолекулярного гидролиза» с образованием основных солей – гидроксид-нитратов [Mg(NO3)OH и Bi(NO3)2OH], которые при дальнейшем нагревании могут переходить в оксид-нитраты <[Be4(NO3)6O] и [Bi6O6](NO3)6>, последние при более высокой температуре разлагаются до оксидов.
Безводные нитраты при нагревании могут разлагаться до нитритов (если они существуют и при этой температуре еще устойчивы), а нитриты – до оксидов. Если нагревание проводится до достаточно высокой температуры, или соответствующий оксид малоустойчив (Ag2O, HgO), то продуктом термического разложения может быть и металл (Cu, Cd, Ag, Hg).
Несколько упрощенная схема термического разложения нитратов показана на рис. 5.
Примеры последовательных превращений, протекающих при нагревании некоторых нитратов (температуры приведены в градусах Цельсия):
KNO3 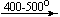
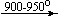
Ca(NO3)2 . 4H2O 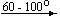
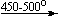
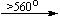
Mg(NO3)2 . 6H2O 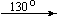
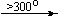
Cu(NO3)2 . 6H2O 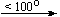

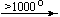
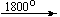
Bi(NO3)3 . 5H2O 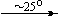
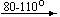
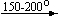
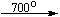
Несмотря на сложность происходящих процессов, при ответе на вопрос, что получится при » прокаливании» (то есть при температуре 400 – 500 o С) соответствующего безводного нитрата, обычно руководствуются следующими предельно упрощенными правилами:
1) нитраты наиболее активных металлов (в ряду напряжений – левее магния) разлагаются до нитритов;
2) нитраты менее активных металлов (в ряду напряжений – от магния до меди) разлагаются до оксидов;
3) нитраты наименее активных металлов (в ряду напряжений – правее меди) разлагаются до металла.
Используя эти правила, следует помнить, что в таких условиях
LiNO3 разлагается до оксида,
Be(NO3)2 разлагается до оксида при более высокой температуре,
из Ni(NO3)2 помимо NiO может получиться и Ni(NO2)2,
Mn(NO3)2 разлагается до Mn2O3,
Fe(NO3)2 разлагается до Fe2O3;
из Hg(NO3)2 кроме ртути может получиться и ее оксид.
Рассмотрим типичные примеры реакций, относящихся к этим трем типам:
KNO3 KNO2 + O2
| 2 | N +V +2e– = N +III |
| 1 | 2O– II – 4e– = O2 |
2KNO3 = 2KNO2 + O2
Zn(NO3)2 ZnO + NO2 
| 4Ѕ | N +V + e– = N +IV |
| 1Ѕ | 2O– II – 4e– = O2 |
2Zn(NO3)2 = 2ZnO + 4NO2 
AgNO3 Ag + NO2 
N +5 + e– = N +42e–12O -2 – 4e– = O2
2AgNO3 = 2Ag + 2NO2 + O2
ОВР конмутации – ОВР, в которых происходит выравнивание степени окисления атомов одного и того же элемента, находившихся до реакции в разных степенях окисления.
Эти реакции могут быть как межмолекулярными, так и внутримолекулярными. Например, внутримолекулярные ОВР, протекающие при термическом разложении нитрата и нитрита аммония, относятся к реакциям конмутации, так как здесь происходит выравнивание степени окисления атомов азота:
NH4NO3 = N2O 

NH4NO2 = N2 

При более высокой температуре (250 – 300 o С) нитрат аммония разлагается до N2 и NO, а при еще более высокой (выше 300 o С) – до азота и кислорода, и в том и в другом случае образуется вода.
Примером межмолекулярной реакции конмутации является реакция, протекающая при сливании горячих растворов нитрита калия и хлорида аммония:
NH4 

Если проводить аналогичную реакцию, нагревая смесь кристаллических сульфата аммония и нитрата кальция, то, в зависимости от условий, реакция может протекать по-разному:
Первая и третья из этих реакций – реакции конмутации, вторая – более сложная реакция, включающая как конмутацию атомов азота, так и окисление атомов кислорода. Какая из реакций будет протекать при температуре выше 250 o С, зависит от соотношения реагентов.
Реакции конмутации, приводящие к образованию хлора, протекают при обработке соляной кислотой солей кислородсодержащих кислот хлора, например:
Также по реакции конмутации образуется сера из газообразных сероводорода и диоксида серы:
ОВР конмутации довольно многочисленны и разнообразны – к ним относятся даже некоторые кислотно-основные реакции, например:
Для составления уравнений ОВР конмутации используется как электронно-ионный, так и электронный баланс, в зависимости от того, в растворе протекает данная реакция или нет.
Изучая главу IX, вы познакомились с электролизом расплавов различных веществ. Так как подвижные ионы присутствуют и в растворах, электролизу могут быть подвергнуты также растворы различных электролитов.
Как при электролизе расплавов, так и при электролизе растворов, обычно используют электроды, изготовленные из материала, не вступающего в реакцию (графита, платины и т. п.), но иногда электролиз проводят и с » растворимым» анодом. » Растворимый» анод используют в тех случаях, когда необходимо получить электрохимическим способом соединение элемента, из которого изготовлен анод. При электролизе имеет большое значение разделены анодное и катодное пространство, или электролит в процессе реакции перемешивается – продукты реакции в этих случаях могут оказаться разными.
Рассмотрим важнейшие случаи электролиза.
1. Электролиз расплава NaCl. Электроды инертные (графитовые), анодное и катодное пространства разделены. Как вы уже знаете, в этом случае на катоде и на аноде протекают реакции:
K: Na 
A: 2Cl 
Записав таким образом уравнения реакций , протекающих на электродах, мы получаем полуреакции, с которыми можем поступать точно так же, как в случае использования метода электронно-ионного баланса:
K:Na 
A:2Cl 
Сложив эти уравнения полуреакций, получаем ионное уравнение электролиза
2Na 

а затем и молекулярное
2NaCl 
В этом случае катодное и анодное пространства должны быть разделены для того, чтобы продукты реакции не реагировали между собой. В промышленности эта реакция используется для получения металлического натрия.
2. Электролиз расплава K2CO3. Электроды инертные (платиновые). Катодное и анодное пространства разделены.
K:K 
A:2CO3 2 

4K+ + 2CO3 2 


2K2CO3 

3. Электролиз воды (H2O). Электроды инертные.
K:2H3O 
A:4OH 
4H3O 



2H2O 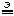

Вода – очень слабый электролит, в ней содержится очень мало ионов, поэтому электролиз чистой воды протекает крайне медленно.
4. Электролиз раствора CuCl2. Электроды графитовые. В системе присутствуют катионы Cu 2 





При электролизе растворов простые (одноатомные) анионы разряжаются (окисляются) раньше, чем сложные (многоатомные) ионы.
Следовательно в нашем случае на анода будут разряжаться хлоридные ионы.
K:Cu 2 
A:2Cl 
Cu 2 

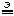
CuCl2 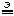
5. Электролиз раствора CuSO4. Электроды графитовые.
В водных растворах за счет автопротолиза воды (2H2O 







K:Cu 2 
K:Cu 2 
A:6H2O – 4e – = O2 + 4H3O
A:2H2O – 4e – = O2 + 4H 








На катоде выделяется медь, на аноде – кислород, а в растворе накапливается серная кислота.
Ионы металлов, стоящих в ряду напряжений правее водорода, при электролизе растворов солей разряжаются.
В принципе ионы металлов, стоящих в ряду напряжений левее водорода, при электролизе водных растворов не должны разряжаться. В этих случаях должен был бы выделяться водород. Практически, из-за специфических особенностей разряда ионов водорода, при электролизе выделяются и более активные металлы.
Ионы металлов, стоящих в ряду напряжений между алюминием и водородом при электролизе растворов солей разряжаются вместе с водородом.
При этом, чем активнее металл, тем больше водорода выделяется, и тем большая часть электрической энергии расходуется бесполезно.
6. Электролиз раствора NiBr2. Электроды графитовые. Катодное и анодное пространства разделены.
K:Ni 2 
A:2Br 
Ni 2 

NiBr2 
Одновременно с этим на катоде выделяется водород, в растворе накапливаются гидроксид-ионы, и, как следствие, протекает побочная реакция образования нерастворимого гидроксида никеля.
Ионы металлов, стоящие в ряду напряжений до алюминия при электролизе не разряжаются.
7. Электролиз раствора Na2SO4. Электроды платиновые. Раствор перемешивается.
В этом случае на катоде разряжаются не ионы натрия, а ионы оксония (2H3O 

K:2H2O + 2e – = H2 + 2OH 
A:6H2O – 4e – = O2 + 4H3O
10H2O 



Так как раствор перемешивается, происходит реакция нейтрализации. В итоге получаем
2H2O 

то есть, реакцию электролиза воды. При электролизе воды для повышения ее электропроводности в нее специально добавляют соли с неразряжающимися катионами и анионами, что значительно ускоряет процесс электролиза.
8. Электролиз раствора CuSO4. Анод медный.
K:Cu 2 
A:Cu – 2e – = Cu 2
В результате сложения уравнений полуреакций мы можем прийти к ошибочному выводу, что ничего не происходит. На самом деле эти полуреакции описывают реальный технологический процесс электролитического рафинирования (очистки) меди: с катода, содержащего примеси на анод переходят только ионы меди.

Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Пероксид водорода в окислительно-восстановительных реакциях
Решение задач по химии на составление уравнений реакций окисления-восстановления на примере пероксида водорода
Задание 325.
Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? На основании электронных уравнений напишите уравнения реакций Н2О2: а) с Аg2O;б) с КI.
Решение:
В пероксиде водорода Н2О2 кислород находится в своей промежуточной степени окисления -1, поэтому в зависимости от условий он может быть как восстановителем (когда увеличивает свою степень окисления атом кислорода), так и окислителем (когда атом кисло-рода уменьшает свою степень окисления). Например:
Здесь в пероксиде атом кислорода увеличивает свою степень окисления от -1 до 0, т.е. Н2О2 – восстановитель.
Здесь в пероксиде атом кислорода уменьшает свою степень окисления от -1 до -2, т.е. Н2О2 – окислитель.
Задание 326
Почему пероксид водорода способен диспропорционировать (самоокисляться-самовосстанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения Н2О2.
Решение:
Реакции самоокисления-самовосстановления (реакции диспропорционирования, дисмутации) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента в соединении. Поэтому эти реакции принципиально осуществимы лишь для тех соединений, в молекулах которых есть атомы со степенью окисления промежуточной между минимально и максимально возможной. Например, реакция самоокисления-самовосстановления:
В пероксиде водорода Н2О2 атом кислорода находится в своей степени окисления -1, про-межуточной между максимальной (0) и минимальной (-2).
Правила составления окислительно-восстановительных реакций
Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут .
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr +3 .
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2  → N2 + 6H2O
Соединения Cr +3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au +3 , KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
источники:
http://buzani.ru/zadachi/khimiya-shimanovich/973-peroksid-vodoroda-zadachi-327
http://chemrise.ru/theory/inorganic_11/rules_hydrogen_peroxide_11
Всего: 121 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
При разложении пероксида водорода выделилось 6,72 л (н. у.) кислорода.
Масса пероксида водорода, вступившего в реакцию, равна
1) 5,1 г
2) 10,2 г
3) 15,3 г
4) 20,4 г
Смесь пероксида бария (взятого в избытке) и алюминия общей массой 20,21 г подожгли. К полученному после бурной реакции твёрдому остатку добавили разбавленную серную кислоту, осадок отделили. Из оставшегося раствора при добавлении катализатора – оксида марганца (IV) выделяется 224 мл кислорода (н. у.). Рассчитайте массовые доли веществ в исходной смеси.
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) амфотерного оксида; Б) кислотного оксида; В) пероксида.
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
Ответ:
Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щелочи полностью нейтрализовали 10%-ным раствором серной кислоты объёмом 300 мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объём собранного газа.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щёлочи полностью нейтрализовали 10%-ным раствором серной кислоты объемом 300 мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объём собранного газа.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Смесь оксида и пероксида бария обработали избытком серной кислоты. Осадок отфильтровали, высушили и взвесили, его масса составила 46,6 г. К полученному раствору добавили избыток раствора перманганата калия, в результате выделилось 3,36 л газа (н. у.). Рассчитайте массовые доли веществ в исходной смеси.
Установите соответствие между формулой вещества и классом (группой) неорганических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
ФОРМУЛА НЕОРГАНИЧЕСКОГО ВЕЩЕСТВА
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) основный оксид
2) амфотерный оксид
3) кислотный оксид
4) пероксид
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества с ионной кристаллической решёткой, в которых присутствует ковалентная неполярная связь
1) пероксид натрия
2) ацетиленид натрия
3) азотная кислота
4) гидроксид кальция
5) сульфат аммония
Запишите номера выбранных веществ.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 1
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС/ГРУППА
1) пероксиды
2) кислые соли
3) средние соли
4) осно́вные оксиды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
Укажите все факторы, от которых зависит скорость разложения пероксида водорода в водном растворе.
1) температура
2) объём раствора
3) давление кислорода над раствором
4) концентрация пероксида водорода
5) действие света на раствор
Запишите номера выбранных ответов в порядке возрастания.
Вычислите объём (при н. у.) кислорода, который образуется при разложении 4 моль пероксида водорода. Ответ дайте в литрах с точностью до десятых.
Источник: ЕГЭ по химии 02.04.2016. Досрочная волна
Нитрат натрия прокалили. Твердый продукт реакции нагрели с иодидом аммония, выделился газ, входящий в состав воздуха. Соль обработали раствором пероксида водорода, подкисленным серной кислотой. Образовавшееся простое вещество прореагировало при нагревании с раствором гидроксида натрия.
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Пероксид водорода прореагировал с оксидом серебра (I). Выделившийся газ пропустили через нагретую трубку, наполненную сульфидом цинка. Полученный в результате этой реакции остаток прореагировал с концентрированным раствором гидроксида натрия. Полученную соль прокалили.
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует натрий.
1) водород
2) сульфат калия
3) оксид алюминия
4) пероксид натрия
5) метан
Запишите номера выбранных веществ.
Для выполнения задания используйте следующий перечень веществ: фосфат кальция, пероксид водорода, хлороводород, хлорид калия, сульфид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: фосфат кальция, пероксид водорода, хлороводород, хлорид калия, сульфид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: гидроксид бария, пероксид водорода, иодид калия, нитрат калия, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: гидроксид бария, пероксид водорода, иодид калия, нитрат калия, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома(III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома(III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: ЕГЭ — 2018, основная волна. Задания 31 (С2).
Источник: ЕГЭ — 2018, основная волна. Задания 30 (С1).
Гидрокарбонат натрия смешали с раствором гидроксида натрия. К полученному раствору добавили раствор бромида хрома(III), наблюдали выпадение осадка и выделение газа. Осадок отделили и поместили в раствор, содержащий пероксид водорода и гидроксид калия, и нагрели. Полученную соль поместили в раствор серной кислоты и наблюдали изменение окраски раствора. Напишите уравнения описанных реакций.
Источник: ЕГЭ — 2018, основная волна. Задания 32 (С3).
Нитрат калия прокалили. Твёрдый продукт реакции нагрели с иодидом аммония, при этом выделился газ, входящий в состав воздуха, а также образовалась соль. Соль обработали раствором, содержащим пероксид водорода и серную кислоту. Образовавшееся простое вещество прореагировало с раствором гидроксида натрия при нагревании. Напишите уравнения описанных реакций.
Источник: ЕГЭ — 2018, основная волна. Задания 32 (С3).
При взаимодействии пероксида водорода и оксида серебра выделился газ, который прореагировал с сульфидом цинка при нагревании. Образовавшееся твёрдое вещество добавили в концентрированный раствор гидроксида натрия. Полученную соль выделили и нагрели. Напишите уравнения описанных реакций.
Источник: ЕГЭ — 2018, основная волна. Задания 32 (С3).
Всего: 121 1–20 | 21–40 | 41–60 | 61–80 …