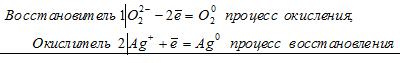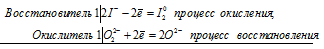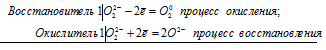Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут.
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr+3.
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2 → N2 + 6H2O
Соединения Cr+3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au+3, KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
ПЕРЕКИСЬ
ВОДОРОДА
Перекись
водорода представляет собой бесцветную сиропообразную жидкость с температурами
фазовых переходов -0,430С и 150,20С. Смешивается с водой
неограниченно.
В чистом
виде Н2О2 малоустойчива и может разлагаться со взрывом,
водные растворы довольно устойчивы.
Разложение
по уравнению: 2Н2О2 → О2 +2Н2О +
47 ккал в водном растворе идет интенсивно при нагревании, облучении или в
присутствии катализаторов ( чаще всего с MnO2).
В молекуле
перекиси два атома кислорода соединены друг с другом неполярной ковалентной
связью, образуя перекисную группу («мостик») -О-О-, поэтому степень
окисления кислорода в этом и подобных ему соединениях равна -1 ( аналогично
как и для серы в пирите).
Химические свойства.
1.
Кислотные
свойства
(перенос перекисной группы).
Н2О2
– очень слабая кислота двухосновная кислота; в воде частично диссоциирует:
Н2О2
→ Н+ + НО2- по первой стадии и по второй
НО2- →
Н+ + О2- в очень малой степени.
1. При
взаимодействии со щелочами (реакция нейтрализации) образуются соли – перекиси,
в которых сохраняется перекисный «мостик»:
Ва(ОН)2 нас.р-р
+ Н2О2 → ВаО2↓ + 2Н2О (выпадение
белых блестящих кристаллов)
2.При
взаимодействии с высшими кислотами: Н2O2+ 2H2SO4
→ H2S2O8 +H2O
образование пероксодисерной кислоты :
2.
Окислительно-восстановительные
свойства
Так как степень
окисления кислорода в перекиси -1, то это соединение может проявлять как
восстановительные так и окислительные свойства.
1) При
взаимодействии с восстановителями (качественная реакция на перекись
водорода) перекись проявляет окислительные свойства: перекисная
связь рвется и образуются два иона кислорода:
(О2)2- +2ẽ
→ 2О2-
2KI + H2SO4
+H2O2 → I2 +K2SO4 + 2H2O
Окислительные
свойства перекиси можно доказать взаимодействием со свежеполученным и
отфильтрованным сульфидом свинца (II) или бария:
PbS черный +4 H2O2 → PbSO4белый↓ + 4H2O –
изменение цвета осадка или
доокислением сернистой
кислоты в серную:
H2O2
+ H2SO3 → H2O + H2SO4
2) При
взаимодействии с более сильными окислителями перекись водорода проявляет
восстановительные свойства (количественное определение перекиси
водорода в растворе)
2KMnO4
+ 3H2SO4 + 5H2O2 → 2MnSO4
+K2SO4 +5O2 +8H2O
ОКИСЛИТЕЛЬНЫЕ
СВОЙСТВА Н2О2 ПРОЯВЛЯЕТ В БОЛЬШЕЙ СТЕПЕНИ, ЧЕМ
ВОССТАНОВИТЕЛЬНЫЕ.
3.
Образование
аддитивных соединений
Молекула перекиси
может присоединяться как целое к другой молекуле с образованием
пероксигидратов, аналогичных гидратам:
H2O2 + 2Na2CO3 → 2Na2CO3*3H2O2
Прописать
уравнения реакций по прописи эксперимента.
1. К нитрату
серебра приливают раствор аммиака, а затем по каплям добавляют 3% раствор
перекиси водорода. Выпадает темный осадок.
2. К
раствору ванадата натрия, подкисленного серной кислотой, добавляют по каплям
3% раствор перекиси водорода. Раствор окрашивается в розово-коричневый цвет
(образование пероксованадиевой кислоты HVO4)
3. В пробирку
с раствором сульфата титана (IV) внести по каплям растворы серной
кислоты и перекиси водорода. Появится желто-оранжевое окрашивание раствора
пероксотитановой кислоты (
H4TiO5).
Закончить
уравнения ОВР с участием перекиси водорода.
1. H2O2
+ KMnO4 + H2SO4 →
2. H2O2
+ KMnO4 + KOH →
3. H2O2
+ KMnO4→
4. H2O2
+ KI + H2SO4 →
5. H2O2
+ KI →
6. H2O2
+ Ca(ClO)2 →
7. H2O2
+ Ag2O →
8. H2O2
+ H2SO4 + FeSO4 →
Источник
информации
У.Шамб,
Ч.Сеттерфилд, Р.Вентворс, ПЕРЕКИСЬ ВОДОРОДА, пер с англ, изд. Иностранной
литературы, Москва, 1958
Окислительно-восстановительные реакции на примере перекиси водорода. Подготовка к ЕГЭ.
Выполнила: Власова Елена Валерьевна
МБОУСОШ№5 , п.г.т. Сафоново
2016 год
Теория и короткие научно-исследовательские работы с использованием перекиси водорода. Для опытов отобраны реакции, имеющие важное значение в химии, экологии, которые можно проводить для подготовки обучающихся к итоговой аттестации. Работать желательно малыми группами (по 2-3 человека). Это уменьшает время эксперимента, позволяет избежать ошибок и, самое главное, позволяет ученикам участвовать в научном общении, что развивает научную речь.
Краткая теория:
- Окислительно-восстановительные свойства пероксида водорода
Пероксид водорода – важнейший окислитель, который используется в быту, в технологии, при очистке воды от органических загрязнений. Пероксид водорода – экологически чистый окислитель, т. к. продукты его разложения – кислород и вода – не загрязняют окружающую среду. Известна роль пероксида водорода и пероксидных органических соединений в процессах биологического окисления-восстановления.
3 – 6 %-е растворы пероксида водорода для бытовых и учебных целей готовят обычно из 30 %-го раствора разбавлением водой. Пероксид водорода при хранении разлагается с выделением кислорода (нельзя хранить в плотно закрытых сосудах!). Чем меньше концентрация пероксида водорода, тем он устойчивее. Для замедления разложения пользуются добавками фосфорной, салициловой кислот и других веществ. Особенно сильно действуют на пероксид водорода соли железа, меди, марганца и фермент каталаза.
3 %-й раствор пероксида водорода в медицине используют для промывания рта и полоскания горла при стоматите и ангине.
30 %-й раствор пероксида водорода называют пергидролем. Пергидроль не взрывоопасен. Попадая на кожу, пергидроль вызывает ожоги, жжение, зуд и образование пузырей, кожа при этом белеет. Обожженное место следует быстро промыть водой. Пергидроль в медицине используют для лечения гнойных ран и для обработки десен при стоматите. В косметологии его используют для удаления пигментных пятен на коже лица. Пятна на одежде от пероксида водорода удалить невозможно. Пероксид водорода в текстильной отрасли промышленности используют для отбеливания шерсти и шелка, а также мехов.
Производство концентрированных (90 – 98%) растворов пероксида водорода постоянно растет. Хранят такие растворы в алюминиевых сосудах с добавкой пирофосфата натрия . Концентрированные растворы могут разлагаться со взрывом. Концентрированный раствор пероксида водорода на оксидном катализаторе при 700
распадается на пары воды и кислород, который служит окислителем для топлива в реактивных двигателях.
Перкосид водорода может проявлять как окислительные, так и восстановительные свойства.
Роль окислителя для пероксида водорода более характерна:
+ 2
+ 2e = 2
O
Например, в реакции:
2KI + +
=
+
+ 2
2.Пероксид водорода как восстановитель:
- В кислотной среде:
– 2e =
+ 2
- В основной (щелочной) среде:
+ 2
– 2e =
+ 2
Примеры реакций:
- В кислотной среде:
2 + 5
+ 3
=
+
+
+ 8
- В основной среде:
2 +
+ 2KOH = 2
+
+
Или
+
+
= 2
+
+
Окислительные свойства пероксида водорода проявляются более сильно в кислотной среде, а восстановительные – в щелочной.
Эксперимент
1а. Разложение пероксида водорода.
Налейте в пробирку 2 -3 мл раствора пероксида водорода и нагрейте раствор на водяной бане. Должно начаться выделение газа (какого?). Докажите экспериментально, что это именно тот газ, который вы ожидали получить.
В другую пробирку с раствором пероксида водорода бросьте крупинку диоксида марганца. Докажите, что выделяется тот же газ.
Напишите уравнение разложения пероксида водорода и отдельно уравнения приема и отдачи электронов. К какому типу относится эта окислительно-восстановительная реакция?
Рассчитайте ЭДС реакции, если:
|
|
E = 0,68 B |
|
|
E = 1,77 В |
Какая из этих двух реакций обладает большей способностью отдавать электроны и ее следует переписать в противоположном направлении? Из значения ЭДС реакции рассчитайте реакции и константу равновесия.
Сравните результаты с и константой равновесия, полученными из термодинамических данных:
|
𝛥 |
S, Дж/(K•моль) |
|
|
|
-187,8 |
109,5 |
|
|
-285,8 |
70,1 |
|
|
0 |
205, 0 |
Результаты ваших расчетов совпали? Если имеется некоторое расхождение в результатах, попытайтесь найти причины.
1б. Обнаружение пероксида водорода.
К разбавленному и подкисленному серной кислотой раствору (2-3 мл) йодида калия добавьте несколько капель раствора пероксида водорода. Раствор окрасился в желто-бурый цвет. При добавлении в него несколько капель раствора крахмала цвет смеси мгновенно становится синим. Напишите уравнение реакции (образующиеся вещества вы знаете!).
Рассчитайте ЭДС реакции, чтобы убедится, что реакция возможна (выберите нужную вам реакцию):
|
|
E = 0,54 B |
|
|
E = 0,68 В |
|
|
Е = 1,77 B |
1в. Черный сульфид свинца и пероксид водорода.
Старые мастера писали свои картины красками, приготовленными на основе свинцовых белил, в состав которых входил белый основный карбонат
2
. С течением времени свинцовые белила чернеют, а краски на их основе изменяют свою окраску из-за действия сероводорода, при этом образуется черный сульфид свинца PbS. Если картину осторожно потереть разбавленным раствором пероксида водорода, сульфид свинца переходит в белый сульфат свинца
и картине почти полностью возвращается ее первоначальный вид.
В пробирку налейте 1-2 мл 0.1 М раствора нитрата свинца или ацетата свинца
(продается в аптеке как свинцовая примочка). Прилейте немного раствора сероводорода или сульфида натрия, Слейте раствор с образовавшегося черного осадка и подействуйте на него раствором пероксида водорода. Напишите уравнения реакций
Все соединения свинца ядовиты!
1г. Приготовление раствора пероксида водорода из гидроперита.
Если вам не удалось достать раствор пероксида водорода, то для лабораторных работ можно пользоваться гидроперитом, таблетки которго можно купить в аптеке.
Гидроперит представляет собой комплексное соединение пероксида водорода с карбамидом (мочевиной)
. При растворении в воде получается раствор пероксида водорода и карбамида
. Раствор карбамида используют вместо раствора пероксида водорода как антисептическое средство и при покраске волос. Для полоскания рта и горла растворяют 1 таблетку в стакане воды (0.25 %-й раствор пероксида водорода). Одна таблетка гидроперита весит 1.5 г. и соответствует 15 мл. (1 столовой ложке) 3% -го раствора пероксида водорода.
Рассчитайте, сколько таблеток гидроперита следует растворить в 100 мл воды, чтобы получить приблизительно 1%-й раствор пероксида водорода. Какой объем кислорода (н.у.) можно получить из одной таблетки гидроперита?
Опытным путем определите, сколько миллилитров кислорода можно получить из одной таблетки гидроперита. Предложите конструкцию прибора и соберите его. Объем выделившегося кислорода приведите к нормальным условиям. Для получения более точных результатов расчета вы можете учесть добавление пара воды над раствором, которое при комнатной температуре (20 ) приблизительно равно 2300 Па
1. Окислители и восстановители
2. Классификация окислительно–восстановительных реакций
3. Основные правила составления ОВР
4. Общие закономерности протекания ОВР
5. Основные схемы ОВР
5.1. Схема восстановления перманганатов
5.2. Схема восстановления хроматов/бихроматов
5.3. Разложение нитратов
5.4. Окислительные свойства азотной кислоты
5.5. Взаимодействие металлов с серной кислотой
5.6. Пероксид водорода
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
-
перманганат калия (KMnO4);
-
дихромат калия (K2Cr2O7);
-
азотная кислота (HNO3);
-
концентрированная серная кислота (H2SO4);
-
пероксид водорода (H2O2);
-
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
-
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2Al0 + Fe+32O3 → Al+32O3 + 2Fe0,
C0 + 4HN+5O3(конц) = C+4O2 ↑ + 4N+4O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
(N-3H4)2Cr+62O7 → N20 ↑+ Cr+32O3 + 4 H2O,
2 NaN+5O-23 → 2 NaN+3O2 + O02↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2S-2 + S+4O2 = 3S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается, а восстановитель окисляется.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K+2S-2 + 2K+Mn+7O-24 = 2K+2Mn+6O-24 + S0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S-2 -2e = S0
Mn+7 + 1e = Mn+6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn+7 в кислой среде восстанавливается до Mn+2, а в щелочной — до Mn+6);
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N+5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3);
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N+5.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2+. Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны. В нейтральном растворе марганец восстанавливается до степени окисления +4, с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6. Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S + 2 KMnO4 + 8 H2SO4 = 5 S + 2 MnSO4 + 6 K2SO4 + 8 H2O,
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
K2S + 2 KMnO4 –(KOH)= 2 K2MnO4 + S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P-3, As-3= P+5, As+5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III). Соединения хрома Cr+3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6].
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As+5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 + O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО + 4NO2 + O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N+5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I) («веселящий газ») и вода:
NH4NO3 → N2O + 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N+3 и восстановителя N-3
NH4NO2 → N2 + 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 + 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO3)2 → 2FeO + 4NO2 + O2 при 60°C
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N+4); оксид азота (II) NO (N+2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3. Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV) NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu+ 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота (I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na+ 10HNO3 = 8NaNO3 + N2O + 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H+, которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например:
Fe + H2SO4(разб) = FeSO4 + H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S+4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 + 2H2S+6O4(конц) = Cu+2SO4 + S+4O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 + 5H2S+6O4(конц) → 4Na2+SO4 + H2S—2 + 4H2O
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
S+4O2 + H2O2-1 → H2S+6O4-2
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например:
2KMn+7O4 + 5H2O2-1 + 3H2SO4 → 5O20 + 2Mn+2SO4 + K2SO4 + 8H2O
Уравнения с пероксидом водорода овр
18.5. ОВР пероксида водорода
В молекулах пероксида водорода H2O2 атомы кислорода находятся в степени окисления –I. Это промежуточная и не самая устойчивая степень окисления атомов этого элемента, поэтому пероксид водорода проявляет и окислительные, и восстановительные свойства.
Окислительно-восстановительная активность этого вещества зависит от концентрации. В обычно используемых растворах с массовой долей 20 % пероксид водорода довольно сильный окислитель, в разбавленных растворах его окислительная активность снижается. Восстановительные свойства для пероксида водорода менее характерны, чем окислительные, и также зависят от концентрации.
Пероксид водорода – очень слабая кислота (см. приложение 13), поэтому в сильнощелочных растворах его молекулы превращаются гидропероксид-ионы.
В зависимости от реакции среды и от того, окислителем или восстановителем является пероксид водорода в данной реакции, продукты окислительно-восстановительного взаимодействия будут разными. Уравнения полуреакций для всех этих случаев приведены в таблице 1.
Уравнения окислительно-восстановительных полуреакций H2O2 в растворах
Реакция среды
H2O2 окислитель
H2O2 восстановительКислотнаяH2O2 + 2H3O 







Рассмотрим примеры ОВР с участием пероксида водорода.
Пример 1. Составьте уравнение реакции, протекающей при добавлении раствора йодида калия к раствору пероксида водорода, подкисленному серной кислотой.
H2O2 + 2H3O 

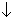
H2O2 + H2SO4 + 2KI = 2H2O + I2 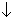
Пример 2. Составьте уравнение реакции между перманганатом калия и пероксидом водорода в водном растворе, подкисленном серной кислотой.
2MnO4 


2KMnO4 + 3H2SO4 + 5H2O2 = 2MnSO4 + 8H2O + 5O2 
Пример 3. Составьте уравнение реакции пероксида водорода с йодидом натрия в растворе в присутствии гидроксида натрия.
3HO2 



3NaHO2 + NaI = 3NaOH + NaIO3
Без учета реакции нейтрализации между гидроксидом натрия и пероксидом водорода это уравнение часто записывают так:
Это же уравнение получится, если сразу (на стадии составления баланса) не принимать во внимание образование гидропероксид-ионов.
Пример 4. Составьте уравнение реакции, протекающей при добавлении диоксида свинца к раствору пероксида водорода в присутствии гидроксида калия.
Диоксид свинца PbO2 – очень сильный окислитель, особенно в кислотной среде. Восстанавливаясь в этих условиях, он образует ионы Pb 2 

PbO2 + H2O + HO2 

Без учета образования гидропероксид-ионов уравнение записывается так:
PbO2 + H2O2 + OH 


Если по условию задания добавляемый раствор пероксида водорода был щелочным, то молекулярное уравнение следует записывать так:
PbO2 + H2O + KHO2 = K[Pb(OH)3] + O2
Если же в реакционную смесь, содержащую щелочь, добавляется нейтральный раствор пероксида водорода, то молекулярное уравнение может быть записано и без учета образования гидропероксида калия:
PbO2 + KOH + H2O2 = K[Pb(OH)3] + O2
Среди окислительно-восстановительных реакций выделяют реакции дисмутации (диспропорционирования, самоокисления-самовосстановления).
Реакции дисмутации – ОВР, в которых часть атомов одного и того же элемента в одной и той же степени окисления восстанавливается, а часть – окисляется.
Примером известной вам реакции дисмутации является реакция хлора с водой:
Cl2 + H2O 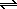
В этой реакции половина атомов хлора(0) окисляется до степени окисления +I, а вторая половина восстанавливается до степени окисления –I:
Составим методом электронно-ионного баланса уравнение аналогичной реакции, протекающей при пропускании хлора через холодный раствор щелочи, например KOH:
2Cl2 + 4OH 


Все коэффициенты в этом уравнении имеют общий делитель, следовательно:
Cl2 + 2OH 


Cl2 + 2KOH = KCl + KClO + H2O
Дисмутация хлора в горячем растворе протекает несколько иначе:
10Cl2 + 2e – = 2Cl 
2Cl2 + 12OH 

3Cl2 + 6OH 


3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Большое практическое значение имеет дисмутация диоксида азота при его реакции c водой (а) и с растворами щелочей (б):
1NO2 + 3H2O – e – = NO3 
1NO2 + 2OH 

1NO2 + H2O + e – = HNO2 + OH
1NO2 + e – = NO2
2NO2 + 2H2O = NO3 

2NO2 + 2OH 


2NO2 + H2O = HNO3 + HNO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Реакции дисмутации протекают не только в растворах, но и при нагревании твердых веществ, например, хлората калия:
2Cl +V + 6e – = Cl –I3
6Cl +V – 2e – = Cl +VII
Еще один тип реакций, протекающих при нагревании твердых веществ – внутримолекулярные ОВР.
Внутримолекулярные ОВР – ОВР, в которых атомы-окислители и атомы-восстановители входят в состав одного и того же вещества.
Характерным и очень эффектным примером внутримолекулярной ОВР является реакция термического разложения дихромата аммония (NH4)2Cr2O7. В этом веществе атомы азота находятся в своей низшей степени окисления (–III), а атомы хрома – в высшей (+VI). При комнатной температуре это соединение вполне устойчиво, но при нагревании интенсивно разлагается. При этом хром(VI) переходит в хром(III) – наиболее устойчивое состояние хрома, а азот(–III) – в азот(0) – также наиболее устойчивое состояние. С учетом числа атомов в формульной единице уравнения электронного баланса:
12Cr +VI + 6e – = 2Cr +III
12N –III – 6e – = N2,
а само уравнение реакции:
(NH4)2Cr2O7 = Cr2O3 + N2 

Другой важный пример внутримолекулярной ОВР – термическое разложение перхлората калия KClO4. В этой реакции хлор(VII), как и всегда, когда он выступает в роли окислителя, переходит в хлор(–I), окисляя кислород(–II) до простого вещества:
4Cl +VII + 8e – = Cl –I2
82O –II – 4e – = O2
и, следовательно, уравнение реакции
KClO4 = KCl + 2O2
Аналогично разлагается при нагревании и хлорат калия KClO3, если разложение проводить в присутствии катализатора (MnO2): 2KClO3 = 2KCl + 3O2
В отсутствие катализатора протекает реакция дисмутации.
К группе внутримолекулярных ОВР относятся и реакции термического разложения нитратов.
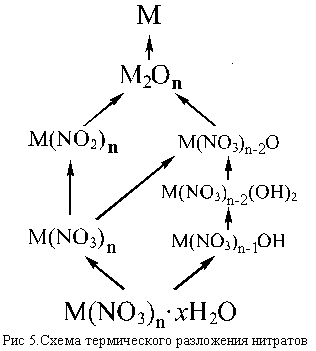
Обычно процессы, протекающие при нагревании нитратов довольно сложны, особенно в случае кристаллогидратов. Если в кристаллогидрате молекулы воды удерживаются слабо, то при слабом нагревании происходит обезвоживание нитрата [например, LiNO3 . 3H2O и Ca(NO3)2 4H2O обезвоживаются до LiNO3 и Ca(NO3)2], если же вода связана прочнее [как, например, в Mg(NO3)2 . 6H2O и Bi(NO3)3 . 5H2O], то происходят своего рода реакции » внутримолекулярного гидролиза» с образованием основных солей – гидроксид-нитратов [Mg(NO3)OH и Bi(NO3)2OH], которые при дальнейшем нагревании могут переходить в оксид-нитраты <[Be4(NO3)6O] и [Bi6O6](NO3)6>, последние при более высокой температуре разлагаются до оксидов.
Безводные нитраты при нагревании могут разлагаться до нитритов (если они существуют и при этой температуре еще устойчивы), а нитриты – до оксидов. Если нагревание проводится до достаточно высокой температуры, или соответствующий оксид малоустойчив (Ag2O, HgO), то продуктом термического разложения может быть и металл (Cu, Cd, Ag, Hg).
Несколько упрощенная схема термического разложения нитратов показана на рис. 5.
Примеры последовательных превращений, протекающих при нагревании некоторых нитратов (температуры приведены в градусах Цельсия):
KNO3 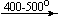
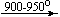
Ca(NO3)2 . 4H2O 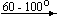
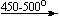
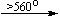
Mg(NO3)2 . 6H2O 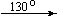
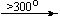
Cu(NO3)2 . 6H2O 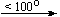

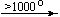
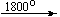
Bi(NO3)3 . 5H2O 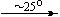
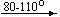
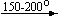
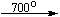
Несмотря на сложность происходящих процессов, при ответе на вопрос, что получится при » прокаливании» (то есть при температуре 400 – 500 o С) соответствующего безводного нитрата, обычно руководствуются следующими предельно упрощенными правилами:
1) нитраты наиболее активных металлов (в ряду напряжений – левее магния) разлагаются до нитритов;
2) нитраты менее активных металлов (в ряду напряжений – от магния до меди) разлагаются до оксидов;
3) нитраты наименее активных металлов (в ряду напряжений – правее меди) разлагаются до металла.
Используя эти правила, следует помнить, что в таких условиях
LiNO3 разлагается до оксида,
Be(NO3)2 разлагается до оксида при более высокой температуре,
из Ni(NO3)2 помимо NiO может получиться и Ni(NO2)2,
Mn(NO3)2 разлагается до Mn2O3,
Fe(NO3)2 разлагается до Fe2O3;
из Hg(NO3)2 кроме ртути может получиться и ее оксид.
Рассмотрим типичные примеры реакций, относящихся к этим трем типам:
KNO3 KNO2 + O2
| 2 | N +V +2e– = N +III |
| 1 | 2O– II – 4e– = O2 |
2KNO3 = 2KNO2 + O2
Zn(NO3)2 ZnO + NO2 
| 4Ѕ | N +V + e– = N +IV |
| 1Ѕ | 2O– II – 4e– = O2 |
2Zn(NO3)2 = 2ZnO + 4NO2 
AgNO3 Ag + NO2 
N +5 + e– = N +42e–12O -2 – 4e– = O2
2AgNO3 = 2Ag + 2NO2 + O2
ОВР конмутации – ОВР, в которых происходит выравнивание степени окисления атомов одного и того же элемента, находившихся до реакции в разных степенях окисления.
Эти реакции могут быть как межмолекулярными, так и внутримолекулярными. Например, внутримолекулярные ОВР, протекающие при термическом разложении нитрата и нитрита аммония, относятся к реакциям конмутации, так как здесь происходит выравнивание степени окисления атомов азота:
NH4NO3 = N2O 

NH4NO2 = N2 

При более высокой температуре (250 – 300 o С) нитрат аммония разлагается до N2 и NO, а при еще более высокой (выше 300 o С) – до азота и кислорода, и в том и в другом случае образуется вода.
Примером межмолекулярной реакции конмутации является реакция, протекающая при сливании горячих растворов нитрита калия и хлорида аммония:
NH4 

Если проводить аналогичную реакцию, нагревая смесь кристаллических сульфата аммония и нитрата кальция, то, в зависимости от условий, реакция может протекать по-разному:
Первая и третья из этих реакций – реакции конмутации, вторая – более сложная реакция, включающая как конмутацию атомов азота, так и окисление атомов кислорода. Какая из реакций будет протекать при температуре выше 250 o С, зависит от соотношения реагентов.
Реакции конмутации, приводящие к образованию хлора, протекают при обработке соляной кислотой солей кислородсодержащих кислот хлора, например:
Также по реакции конмутации образуется сера из газообразных сероводорода и диоксида серы:
ОВР конмутации довольно многочисленны и разнообразны – к ним относятся даже некоторые кислотно-основные реакции, например:
Для составления уравнений ОВР конмутации используется как электронно-ионный, так и электронный баланс, в зависимости от того, в растворе протекает данная реакция или нет.
Изучая главу IX, вы познакомились с электролизом расплавов различных веществ. Так как подвижные ионы присутствуют и в растворах, электролизу могут быть подвергнуты также растворы различных электролитов.
Как при электролизе расплавов, так и при электролизе растворов, обычно используют электроды, изготовленные из материала, не вступающего в реакцию (графита, платины и т. п.), но иногда электролиз проводят и с » растворимым» анодом. » Растворимый» анод используют в тех случаях, когда необходимо получить электрохимическим способом соединение элемента, из которого изготовлен анод. При электролизе имеет большое значение разделены анодное и катодное пространство, или электролит в процессе реакции перемешивается – продукты реакции в этих случаях могут оказаться разными.
Рассмотрим важнейшие случаи электролиза.
1. Электролиз расплава NaCl. Электроды инертные (графитовые), анодное и катодное пространства разделены. Как вы уже знаете, в этом случае на катоде и на аноде протекают реакции:
K: Na 
A: 2Cl 
Записав таким образом уравнения реакций , протекающих на электродах, мы получаем полуреакции, с которыми можем поступать точно так же, как в случае использования метода электронно-ионного баланса:
K:Na 
A:2Cl 
Сложив эти уравнения полуреакций, получаем ионное уравнение электролиза
2Na 

а затем и молекулярное
2NaCl 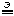
В этом случае катодное и анодное пространства должны быть разделены для того, чтобы продукты реакции не реагировали между собой. В промышленности эта реакция используется для получения металлического натрия.
2. Электролиз расплава K2CO3. Электроды инертные (платиновые). Катодное и анодное пространства разделены.
K:K 
A:2CO3 2 

4K+ + 2CO3 2 
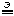


2K2CO3 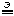

3. Электролиз воды (H2O). Электроды инертные.
K:2H3O 
A:4OH 
4H3O 

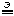


2H2O 

Вода – очень слабый электролит, в ней содержится очень мало ионов, поэтому электролиз чистой воды протекает крайне медленно.
4. Электролиз раствора CuCl2. Электроды графитовые. В системе присутствуют катионы Cu 2 





При электролизе растворов простые (одноатомные) анионы разряжаются (окисляются) раньше, чем сложные (многоатомные) ионы.
Следовательно в нашем случае на анода будут разряжаться хлоридные ионы.
K:Cu 2 
A:2Cl 
Cu 2 

CuCl2 
5. Электролиз раствора CuSO4. Электроды графитовые.
В водных растворах за счет автопротолиза воды (2H2O 







K:Cu 2 
K:Cu 2 
A:6H2O – 4e – = O2 + 4H3O
A:2H2O – 4e – = O2 + 4H 








На катоде выделяется медь, на аноде – кислород, а в растворе накапливается серная кислота.
Ионы металлов, стоящих в ряду напряжений правее водорода, при электролизе растворов солей разряжаются.
В принципе ионы металлов, стоящих в ряду напряжений левее водорода, при электролизе водных растворов не должны разряжаться. В этих случаях должен был бы выделяться водород. Практически, из-за специфических особенностей разряда ионов водорода, при электролизе выделяются и более активные металлы.
Ионы металлов, стоящих в ряду напряжений между алюминием и водородом при электролизе растворов солей разряжаются вместе с водородом.
При этом, чем активнее металл, тем больше водорода выделяется, и тем большая часть электрической энергии расходуется бесполезно.
6. Электролиз раствора NiBr2. Электроды графитовые. Катодное и анодное пространства разделены.
K:Ni 2 
A:2Br 
Ni 2 

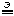
NiBr2 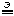
Одновременно с этим на катоде выделяется водород, в растворе накапливаются гидроксид-ионы, и, как следствие, протекает побочная реакция образования нерастворимого гидроксида никеля.
Ионы металлов, стоящие в ряду напряжений до алюминия при электролизе не разряжаются.
7. Электролиз раствора Na2SO4. Электроды платиновые. Раствор перемешивается.
В этом случае на катоде разряжаются не ионы натрия, а ионы оксония (2H3O 

K:2H2O + 2e – = H2 + 2OH 
A:6H2O – 4e – = O2 + 4H3O
10H2O 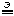



Так как раствор перемешивается, происходит реакция нейтрализации. В итоге получаем
2H2O 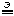

то есть, реакцию электролиза воды. При электролизе воды для повышения ее электропроводности в нее специально добавляют соли с неразряжающимися катионами и анионами, что значительно ускоряет процесс электролиза.
8. Электролиз раствора CuSO4. Анод медный.
K:Cu 2 
A:Cu – 2e – = Cu 2
В результате сложения уравнений полуреакций мы можем прийти к ошибочному выводу, что ничего не происходит. На самом деле эти полуреакции описывают реальный технологический процесс электролитического рафинирования (очистки) меди: с катода, содержащего примеси на анод переходят только ионы меди.

Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Пероксид водорода в окислительно-восстановительных реакциях
Решение задач по химии на составление уравнений реакций окисления-восстановления на примере пероксида водорода
Задание 325.
Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? На основании электронных уравнений напишите уравнения реакций Н2О2: а) с Аg2O;б) с КI.
Решение:
В пероксиде водорода Н2О2 кислород находится в своей промежуточной степени окисления -1, поэтому в зависимости от условий он может быть как восстановителем (когда увеличивает свою степень окисления атом кислорода), так и окислителем (когда атом кисло-рода уменьшает свою степень окисления). Например:
Здесь в пероксиде атом кислорода увеличивает свою степень окисления от -1 до 0, т.е. Н2О2 – восстановитель.
Здесь в пероксиде атом кислорода уменьшает свою степень окисления от -1 до -2, т.е. Н2О2 – окислитель.
Задание 326
Почему пероксид водорода способен диспропорционировать (самоокисляться-самовосстанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения Н2О2.
Решение:
Реакции самоокисления-самовосстановления (реакции диспропорционирования, дисмутации) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента в соединении. Поэтому эти реакции принципиально осуществимы лишь для тех соединений, в молекулах которых есть атомы со степенью окисления промежуточной между минимально и максимально возможной. Например, реакция самоокисления-самовосстановления:
В пероксиде водорода Н2О2 атом кислорода находится в своей степени окисления -1, про-межуточной между максимальной (0) и минимальной (-2).
Правила составления окислительно-восстановительных реакций
Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут .
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr +3 .
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2  → N2 + 6H2O
Соединения Cr +3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au +3 , KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
источники:
http://buzani.ru/zadachi/khimiya-shimanovich/973-peroksid-vodoroda-zadachi-327
http://chemrise.ru/theory/inorganic_11/rules_hydrogen_peroxide_11