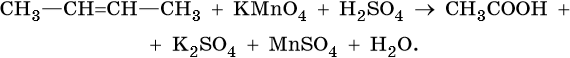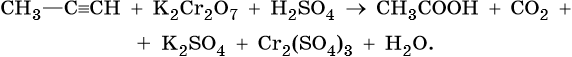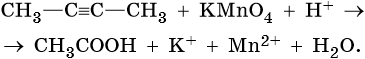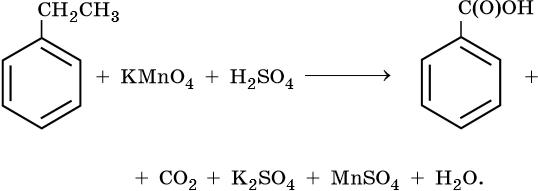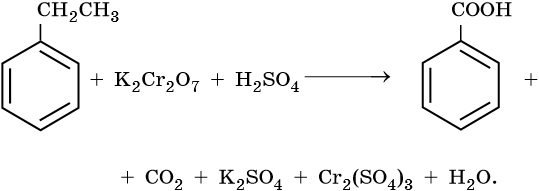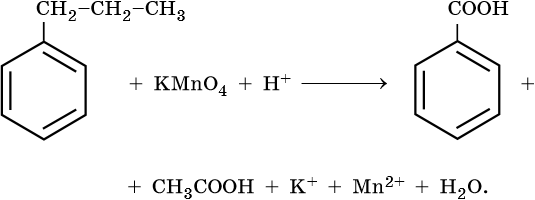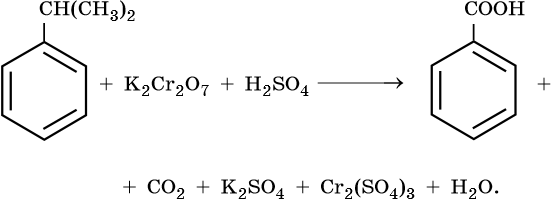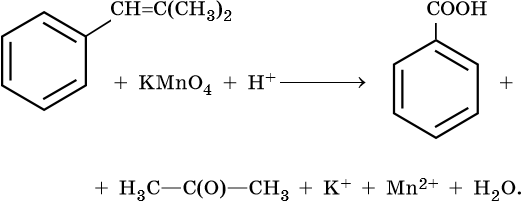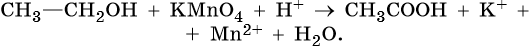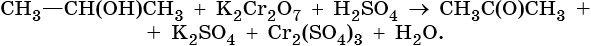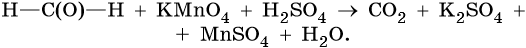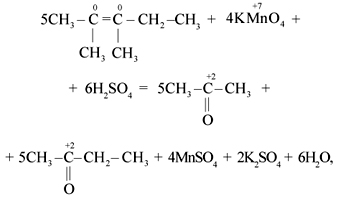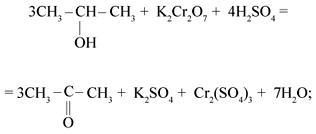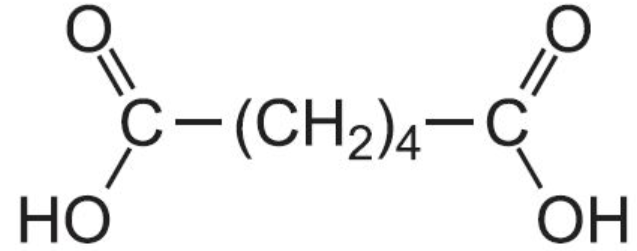Скачать материал

Скачать материал


- Сейчас обучается 30 человек из 23 регионов


- Сейчас обучается 113 человек из 49 регионов


- Курс добавлен 13.12.2022


Описание презентации по отдельным слайдам:
-
1 слайд
Организация подготовки к ЕГЭ по химии задание №33: окислительно-восстановительные реакции
с участием органических веществ
Минакова А.П., учитель химии
МБОУ «Гимназия №44» г. Курска -
2 слайд
В цепочках превращений органических веществ в подавляющем большинстве заданий встречаются ОВР. Эксперт имеет право начислить балл только в том случае, если записано уравнение, а не схема реакции, т.е. верно расставлены коэффициенты. В реакциях с участием неорганических окислителей (перманганат калия, соединения хрома (VI), пероксид водорода и др.) сделать это бывает непросто, без электронного баланса.
-
3 слайд
.
Изменение степени окисления атомов углерода в молекулах органических соединений -
4 слайд
Степени окисления атома углерода
-
5 слайд
КMnO4
K2Cr2O7
Основные окислители
MnSO4
MnO2
K2MnO4
Cr2(SO4)3
Cr(OH)3
K3[Cr(OH)6]
O3 и H2O2
Сине-зеленый -
-
7 слайд
Алканы
При обычных условиях алканы устойчивы к действию таких окислителей, как растворы KMnO4, K2Cr2O7.
В результате контролируемого каталитического окисления алканов кислородом в определенных условиях, т.е. при различных температурах и давлении, можно получить спирты, альдегиды, кетоны и карбоновые кислоты, например:Обратите внимание на то, что реакция каталитического окисления бутана используется в промышленности для получения уксусной кислоты
-
8 слайд
Алкены
При мягком окислении алкены превращаются в гликоли (двухатомные спирты), среда нейтральная или слабощелочная. Реакция Вагнера.
3CH2=CH2 + 2 KMnO4 + 4 H2O ——> 3 CH2OH-CH2OH + 2 KOH + 2MnO2
Слабощелочная среда (в общем виде):
R-CH=CH-R+ 2KMnO4+2KOH→R-CH(OH)-CH(OH)-R+2K2MnO4
WO3
Окисление алкенов концентрированным раствором перманганата калия KMnO4 или бихромата калия K2Cr2O7 в кислой среде сопровождается разрывом не только π-, но σ-связи. В зависимости от строения алкена в результате этой реакции образуются карбоновые кислоты, CO2 и кетоны. -
9 слайд
По продуктам окисления алкена можно определить положение двойной связи в его молекуле:
-
10 слайд
Алкены разветвленного строения, содержащие углеводородный радикал у атома углерода, соединенного двойной связью, при окислении образуют смесь карбоновой кислоты и кетона:
Алкены разветвленного строения, содержащие углеводородные радикалы у обоих атомов углерода, соединенных двойной связью, при окислении образуют смесь кетонов:
-
11 слайд
Алкены
CH3-CH=CH-CH3+O3+H2O= +H2O2CH3-CH=CH-CH3+O3+H2O= 2 +H2O2
CH3-CH(CH3)=CH-CH3+O3+H2O= +CH3-COH+H2O2 -
12 слайд
Пример:
3CH3 — CH = CH — CH = CH2+4KMnO4+8 H2O= 4KOH+4MnO2+3CH3 — CH — CH — CH — CH2
│ │ │ │
OH OH OH OH
пентадиен — 1,4 пентантетраол — 1,2,3,4Алкадиены
С5H8+4KMnO4+6H2SO4=2CO2+C3H4O4+2K2SO4+4MnSO4+8H2O
Малоновая кислота
Уравнение окисления бутадиена-1,3 избытком раствора перманганата калия в кислой среде: 5CH2=CH-CH=CH2 + 22KMnO4 + 33H2SO4 =20CO2+ 11K2SO4 + 22MnSO4 + 48H2OCH2=C=CH2 +KMnO4=CH2OH-CO-CH2OH +K2MnO4+H2O
1,3-дигидроксиацетон -
13 слайд
Под действием сильных окислителей образуют двухосновные карбоновые кислоты с тем же числом атомов углерода.
В зависимости от условий каталитическим окислением воздухом
циклогексана получают циклогексанол, циклогексанон или
адипиновую кислоту
При действии сильных окислителей (KMnO4, K2Cr2O7 и др.)
циклоалканы образуют двухосновные карбоновые кислоты с тем
же числом атомов углерода:
Циклоалканы -
14 слайд
+2 KMnO4+3H2SO4=HOOC-(CH2)2-COOH+2MnSO4+K2SO4+2H2O
Янтарная к-та
+2 KMnO4+3H2SO4=HOOC-(CH2)3-COOH+2MnSO4+K2SO4+4H2O
глутаровая к-та
+2 KMnO4+3H2SO4=HOOC-(CH2)4-COOH+2MnSO4+K2SO4+4H2O
Циклогексан окисляется до адипиновой кислоты, используемой в производстве полиамидных волокон – капрона и нейлона
+O2→
+H2O
kat -
15 слайд
5 + 8KMnO 4 + 12H 2 SO 4 = 5HOOC(CH 2 ) 3 COOH + 4K 2 SO 4 + 8MnSO 4+
+ 12H 2 OГлутаровая к-та
CH 3
+ 2KMnO 4 + 4H 2 O=
3
CH 3
OH
OH
3
+ 2MnO 2 + 2KOH -
16 слайд
Ацетилен окисляется водным раствором KMnO4 до оксалата калия K2C2O4:
АЛКИНЫ
В мягких условиях алкины с неконцевой тройной связью окисляются до
α-кетонов:
В жестких условиях алкины с неконцевой тройной связью окисляются до карбоновых кислот:
Алкины, содержащие тройную связь у крайнего атома углерода,
окисляются в жестких условиях с образованием карбоновой кислоты и
СО2: -
17 слайд
+H2O2=
Можно окислить озоном с образованием диальдегида:
Бензол
Устойчив к окислителям при комнатной температуре
Не реагирует с водными растворами KMnO4, K2Cr2O7 и других окислителей
2 -
18 слайд
Более сильные окислители – KMnO4 в кислой среде или хромовая смесь при нагревании окисляют метильную группу до карбоксильной:
В нейтральной или слабощелочной среде образуется не сама бензойная кислота, а ее соль — бензоат калия:
Окисляются относительно легко
Окислению подвергается боковая цепь
Мягкие окислители (MnO2) окисляют метильную группу
до альдегидной группы:
бензальдегид
Гомологи бензола
С6Н5СН3 + MnO2 →C6H5− CОН -
19 слайд
Под действием сильных окислителей (KMnO4 в кислой среде или
хромовой смеси) окисление идет по α-углеродному атому с образованием бензойной кислоты
Гомологи бензола
Окисление гомологов бензола с одной боковой цепью под действием
KMnO4 в кислой среде или хромовой смеси приводит к образованию
бензойной кислоты -
20 слайд
Реакция анилина с хромовой смесью. Получается чёрный анилин.
3 C6H5NH2 + 2 K2Cr2O7 + 11 H2SO4 → 3 C6H4O2 + 2 K2SO4 + 2 Cr2(SO4)3+ 3 NH4HSO4+
8 H2O
Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты: -
21 слайд
В нейтральной или слабощелочной среде при окислении перманганатом калия KMnO4 образуются соль карбоновой кислоты и карбонат калия:
-
22 слайд
Окисление первичных спиртов
до альдегидов до карбоновых кислотМетанол окисляется до СО2:
-
23 слайд
Окисление предельных одноатомных спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. -
24 слайд
Для окисления вторичных спиртов наиболее часто используют бихромат калия в кислой среде при комнатной температуре или небольшом нагревании. Применяют также KMnO4 и MnO2.
Для окисления первичных спиртов до альдегидов обычно используют реактив Джонсона или комплекс CrO3 c пиридином. Перманганат калия не применяют для окисления спиртов в альдегиды, т.к. реакция не останавливается на стадии образования альдегида, и окисление идет дальше до кислоты. Однако широкое применение нашел MnO2. Этот реагент не затрагивает кратные связи, поэтому может быть использован для получения и непредельных альдегидов и кетонов:Третичные спирты устойчивы к действию окислителей: они не окисляются ни в нейтральной, ни в щелочной среде. Но если в третичном спирте у атома углерода, соседнего с С-ОН-группой, есть атом водорода, то такие спирты окисляются в кислой среде, с отщеплением воды, образованием в качестве промежуточного продукта алкена и разрывом С-С -связи:
-
25 слайд
Например, окисление этанола дихроматом калия на холоде заканчивается получением уксусной кислоты, а при нагревании – ацетальдегида:
3CH3–CH2OH + 2K2Cr2O7 + 8H2SO4 = 3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O,
3CH3–CH2OH + K2Cr2O7 + 4H2SO4 = 3CH3–CHO + K2SO4 + Cr2(SO4)3 + 7H2O.
ṯ
Окисление хромовой смесью вторичного спирта -
26 слайд
5CH3-CH2-OH+4KMnO4+6H2SO4=5CH3COOH+2K2SO4+4MnSO4+11H2O
CH3-CH2-OH+4KMnO4+5KOH= CH3COOK+4K2MnO4+4H2O
3CH3-CH2-OH+4KMnO4=3 CH3COOK+4MnO2+KOH+4H2O
Окислителем одноатомных спиртов может быть перекись водорода
CH3-CH2-OH+2H2O2= CH3–COOH+3H2OОкисление предельных одноатомных спиртов
+ 4K2Cr2O7 + 16H2SO4 = 3HOOC-(CH2)4-COOH + 4Cr2(SO4)3 + 4K2SO4 +19H2OОкисление циклогексанола до адипиновой кислоты
-
27 слайд
Вторичные спирты окисляются до кетонов:
Третичные спирты устойчивы к окислению!
Окисление трет-бутанола в «жёстких» условиях: -
28 слайд
Окисление гликолей
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.5СН2(ОН) – СН2(ОН) + 8КMnO4+12H2SO4→5HOOC – COOH +8MnSO4 +4К2SO4 + +22Н2О
3СН2(ОН) – СН2(ОН) + 8КMnO4→3KOOC – COOK +8MnO2 +2КОН +8Н2О
Глицерин, такими сильными окислителями как КMnO4 и K2Cr2O7, может окисляться до CO2 и H2O:
14 КMnO4+ 3C3H5(OH)3→7K2CO3+14MnO2+12H2O+2CO2
3C3H5(OH)3+7 K2Cr2O7-+28H2SO4→9 CO2+40 H2O+7K2SO4+7Cr2(SO4)3
-
29 слайд
6КMnO4+9H2SO4→
5
5H
H
+6MnSO4 +3К2SO4 + 24Н2О
Окисление многоатомных спиртов происходит ступенчато, при этом первичные спиртовые группы превращаются в альдегидные, а вторичные – в кетонные. Первичные спиртовые группы могут окисляться до карбоксильных
2КMnO4+3H2SO4→
+2MnSO4 +К2SO4 + 6Н2О -
30 слайд
КMnO4
H2SO4
+ CO2 ↑+ -
31 слайд
+H2O2→
+H2O
Окисление фенола
пирокатехин
3
+2K2Cr2O7-+8H2SO4→3
+ 2K2SO4 + 2Cr2(SO4)3 + 11H2O
бензохинон -
32 слайд
C6H5-CH(OH)-CH3+H2O2→C6H5-CO-CH3+2H2O
C6H5CH(OH)CH3 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + C6H5COOH +СО2 +5H2O
3C6H5CH(OH)CH3 + K2Cr2O7 + 4H2SO4 = 3C6H5COCH3 + Cr2(SO4)3 + K2SO4 + 7H2O
Окисление ароматических спиртов -
33 слайд
Альдегиды легко окисляются до карбоновых кислот
Ароматические альдегиды
легко окисляются даже кислородом воздуха
Метаналь окисляется до CО2
Окисление альдегидов и кетонов -
34 слайд
Качественные реакции на альдегиды
Окисление гидроксидом меди(II)
Реакция «серебряного зеркала»
Соль, а не кислота! -
35 слайд
Кетоны окисляются с трудом, слабые окислители на них не действуют
Под действием сильных окислителей происходит разрыв С—С связей по обе стороны карбонильной группы с образованием кислот
Кетоны несимметричного строения преимущественно окисляются со стороны менее гидрированного
атома углерода при карбонильной
группе (правило Попова – Вагнера):Окисление циклических кетонов
-
36 слайд
Окисление альдегидов
5CH3–CH=O + 2KMnO4 + 3H2SO4 = 5CH3–COOH + 2MnSO4 + K2SO4 + 3H2O,
3CH3CH=O + 2KMnO4 = CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CH=O + KMnO4+2KOH= CH3COOK+ K2MnO4+ H2O
5H–CH=O + 4KMnO4 + 6H2SO4 = 5CO2+ 4MnSO4 + 2K2SO4 + 11H2O
3H–CH=O + 4KMnO4 + 2KOH= 3K2CO3 +4MnO2 + 4H2O
3CH3–CH=O + K2Cr2O7 + 4H2SO4 = 3CH3–COOH + Cr2(SO4)3 + K2SO4 + 4H2O,
CH3–CH=O + 2[Ag(NH3)2]OH = CH3–COONH4 + 2Ag + 3NH3 + H2O
HCOH+ 2[Ag(NH3)2]OH =(NH4)2CO3+ 2Ag+ 2NH3 + H2OCH3–CH=O + 2Cu(OH)2 = CH3COOH + Cu2O + 2H2O
CH3CH=O + Br2 + 3NaOH → CH3COONa + 2NaBr + 2H2O
-
37 слайд
Окисление карбоновых кислот
Непредельные карбоновые кислотыокисляются водным раствором KMnO4 в слабощелочной среде с образованием дигидрооксикислот и их солей:
В кислой среде происходит разрыв углеродного скелета по месту двойной связи С=С с образованием смеси кислот:
Среди одноосновных карбоновых кислот легко окисляется только
муравьиная кислота
НСООН+2Ag[(NH3)2]ОН → (NH4)2CO3 + H2O+2Ag+ 2NH3 -
38 слайд
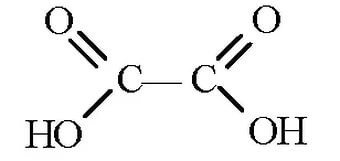
Особые свойства щавелевой кислоты
Легко окисляется под действием KMnO4 в кислой среде при нагревании до CО2 (метод перманганатометрии):
При нагревании подвергается декарбоксилированию
Под действием концентрированной H2SO4 при нагревании
щавелевая кислота и ее соли (оксалаты) разлагаются до СО и СО2 -
39 слайд
Окисление карбоновых кислот
Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
5НСООН + 2KMnO4 + 3H2SO4= 5CO2+ 2MnSO4 + K2SO4 + 8H2O
3НСООН + 2KMnO4 + 4KOH= 3K2CO3 +2MnO2 + 5H2O
5НOOC-СООН + 2KMnO4 + 3H2SO4= 10CO2+ 2MnSO4 + K2SO4 + 8H2O
НСООН + HgCl2 = CO2 + Hg + 2HClHCOOH+ Cl2 = CO2 +2HCl
HOOC-COOH+ Cl2 =2CO2 +2HCl
НСООН + 2[Ag(NH3)2]OH → NH4HCО3 +3NH3↑+ Н2O +2Ag↓
НСООН + 2Cu(OH)2 → CO2 + Cu2O↓ + 3H2O
-
40 слайд
Окисление глюкозы до глюконовой кислоты реактивом Толленса
гидроксидом меди Cu(OH)2 в щелочной среде
бромной водой
Окисление моносахаридов -
41 слайд
Окисление глюкозы до глюкаровой (сахарной) кислоты
разбавленной азотной кислотой HNO3
Окисление глюкозы до муравьиной кислоты
под действием иодной кислоты HIO4 (периодатное окисление)
Окисление моносахаридов -
42 слайд
Реакции, вызывающие трудности
C6H5-NH2+HCl=[C6H5-NH3]Cl
C6H5-NH2+CH3Br=[C6H5-NH2CH3]Cl
C6H5-NH2+CH3-COCl=C6H5-NH-CO-CH3+HCl
C6H5-NH2+C2H5-COOH=C6H5-NH-CO-C2H5+H2O
C6H5-NH2+HNO2=C6H5-OH+N2+H2O
C6H5-NH2+3Br2=C6H2Br3NH2+HBr
C6H5-NH2+NaNO2+2HCl=C6H5-NNCl+2H2O+NaCl
Гидролизуется при t до N2 фенола и HCl -
43 слайд
Реакции, вызывающие трудности
R-NO2+9Fe+4H2O→4R-NH2+3Fe3O4
R-NO2+3Zn+7HCl→R-NH3Cl+3ZnCl2+2H2O
R-NO2+3Fe+7HCl→R-NH3Cl+3FeCl2+2H2O
R-NO2+2Al+2NaOH+4H2O→R-NH2+2Na[Al(OH)4]CH3CH2OH + PCl5 = C2H5Cl + POCl3+HCl
CH3CH2OH + PCl3 = 3C2H5Cl + H3РO3 -
44 слайд
Реакции, вызывающие трудности
-
45 слайд
В составлении презентации были использованы материалы:
1. О.В. Архангельская, И.А. Тюльков. Задачи по теме «Уравнения окислительно-восстановительных реакций»
2. Л.И. Асановой, материалы вебинара по теме: «Организация подготовки к ЕГЭ по химии: окислительно-восстановительные реакции с участием органических веществ»
3. Л.И. Асанова, Е.Н. Стрельникова Окислительно-восстановительные реакции. Практикум по химии, Москва «ВАКО», 2018 г
4. И.И. Новошинский, Н.С. Новошинская Готовимся к ЕГЭ. Органическая химия. Пособие для учащихся, «Русское слово», 2013 г
5. О.Э. Сикорская Классы органических соединений. Пособие для подготовки к экзамену, «Веста», Владикавказ 2015 г
6. О.Э. Сикорская ХИМИЯ ОВР с участием органических соединений. Учебное пособие для подготовки к ЕГЭ, «Веста», Владикавказ 2014 г
7. Н.Е. Дерябина органическая химия. Книга 1. Углеводороды и их монофункциональные производные. Учебник-тетрадь. М.: ИПО «У Никитских ворот», 2012 г
8. ФИПИ школе. ЕГЭ Химия. Типовые экзаменационные варианты под редакцией А.А. Кавериной 2014-2018 гг
9. В.Н. Доронькин и др. ЕГЭ – 2018 Химия. Новые задания высокого уровня сложности, ЛЕГИОН, Ростов – на – Дону 2017 г
10. Сайт https://ege.sdamgia.ru/ и др
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 154 748 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы


«Биотопливо- взгляд в будущее»
- Учебник: «Химия (углублённый уровень)», Еремин В.В., Кузьменко Н.Е., Дроздов А.А. и др./ Под ред. Лунина В.В.
- Тема: § 65. Особенности современной нау
- 12.03.2018
- 1013
- 5

Амин 11 класс Химия
- Учебник: «Химия (углублённый уровень)», Еремин В.В., Кузьменко Н.Е., Дроздов А.А. и др./ Под ред. Лунина В.В.
- Тема: § 13. Амин
- 11.03.2018
- 1282
- 1

Рейтинг:
4 из 5
- 05.03.2018
- 4412
- 89



- 05.02.2018
- 1371
- 27

Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Экономика: инструменты контроллинга»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Страхование и актуарные расчеты»
-
Курс повышения квалификации «Источники финансов»
-
Курс профессиональной переподготовки «Организация деятельности помощника-референта руководителя со знанием иностранных языков»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Корпоративная культура как фактор эффективности современной организации»
-
Курс профессиональной переподготовки «Организация деятельности специалиста оценщика-эксперта по оценке имущества»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
II. ОВР в органической химии.
Степени окисления атомов в органических соединениях.
|
Углеводороды |
Спирты |
Альдегиды, кетоны |
Карбоновые кислоты |
|
-2 +1 -2 +1 CH2=CH2 |
-2 +1 -2 +1 CH3-OH |
0 ⸗O-2 0 -2 H-C-H (HCHO) |
+2 -2-2 HCOOH |
|
-2 -1 -3 CH2=CH-CH3 |
-3 -1 -2 CH3-CH2-OH |
-3 +1 ⸗O-2 CH3-C- H -3 +1 -2 (CH3CHO) |
-3 +3-2- 2 CH3COOH |
|
-3 -1 -1 -3 CH3-CH=CH-CH3 |
-1 -1 CH2-CH2 І І OH OH |
-3 +2 -3 CH3-C- CH3 ǁ O-2 |
+3 -2 -2 C OOH І+3-2-2 C OOH |
|
-3 0 -1 -3 CH3-C=CH-CH3 І -3 CH3 |
-1 0 -3 CH2-CH-CH3 І І OH OH |
||
|
-3 0 0 -3 CH3-CH2-CH-CH3 І І OH OH |
Углеводороды.
В кислой среде:
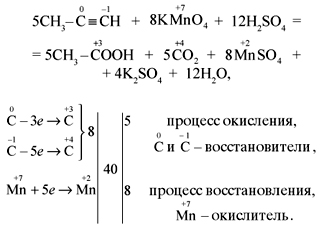
1) CH2=CH2 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + H2O + CO2
-2 -2 +7 +2 +4
5CH2=CH2 + 12KMnO4 + 18H2SO4 → 6K2SO4 + 12MnSO4 + 10CO2 + 28H2O
2C-2 – 12e— → 2C+4 | 12 | 5 – окисляется, восстановитель;
Mn+7 + 5e— → Mn+2 | 5 |12 — восстанавливается, окислитель
2) C2H2 – окисляется окислителями в кислой среде до щавелевой кислоты.
-1 -1 k. H2SO4, KMnO4 (K2Cr2O7) COOH
CHΞCH ―――――――→ І (HOOC-COOH)
COOH
-2 -1 -3 +7 +4 -3 +3
3)CH2=CH-CH3 + 2KMnO4 + 3H2SO4 → CO2 + CH3-COOH + K2SO4 +
+2
2MnSO4 + 4H2O
Mn+7 + 5e— → Mn+2 | 5e— | 2 — восст-тся, окислитель;
C-1 — 4e— → C+3 |} 10e—| 1 — окисляется, восстановитель
-3 -1 -1 -3 +7 -3 +3
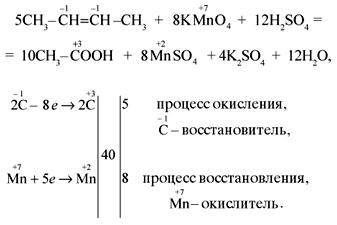
4) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3-COOH + 4K2SO4 +
+2
8MnSO4 + 12H2O
Mn+7 + 5e— → Mn+2 |4| | 8Mn+7 +40e— →8Mn+2 — восстанавливается, окислитель;
| |× 2 |
C-1 — 4e— → C+3 |5| | 10C-1 — 40e— → 10C+3 — окисляется, восстановитель
-3 0 -1 -3 -3 +3 -2 -2 -3 +2 -3
5) CH3-C‡ CH-CH3 + 6KMnO4 + 9H2SO4 → 5CH3-COOH + 5CH3-C-CH3
+ 3K2SO4 + 6MnSO4 +9H2O
| ǁ
-3 O-2
CH3
Mn+7 + 5e— → Mn+2 |× 6| 6Mn+7+30e—→ 6Mn+2
C-1 — 4e— → C+3 | | 5C-1— 20e— → 5C+3
C0 — 2e— → C+2 | | 5C0 10e— → 5C+2
↙͞ ͞͞͞ ͞ ͞͞ ͞ ͞ ͞ ͞ ͞ ͞͞ ͞ ͞↘
-1 -1 +7 C+3OOH +2
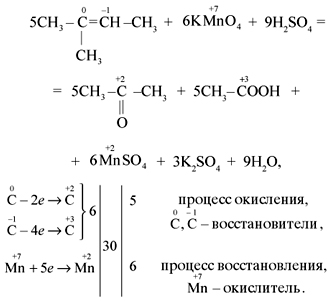
6) 5CHΞCH + 8KMnO4 + 12H2SO4 → 5 І +4K2SO4 +8MnSO4+ 12H2O C+3OOH
только ацетилен!
2C-1 — 8e— → 2C+3 |× 5
Mn+7 + 5e— → Mn+2 |× 8
Гомологи ацетилена окисляются до одноосновных карбоновых кислот.
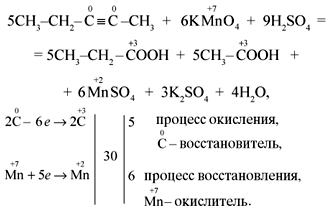
-1 0 -3 +7 -3 +3 +4 +2
7)5CHΞC-CH3 +8KMnO4 +12H2SO4 → 5CH3-COOH +5CO2 +4K2SO4+ 8MnSO4 + 12H2O
—3 0 0 -3 +7 -3 +3 +2

Ароматические углеводороды.
-1 -3 +7 -1 +3 +2
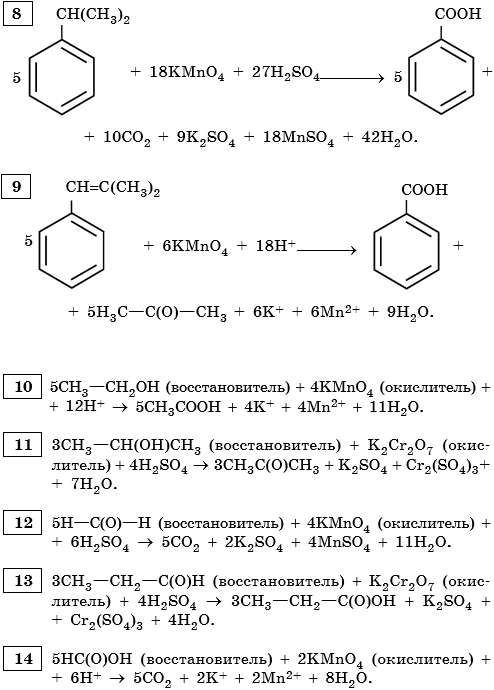
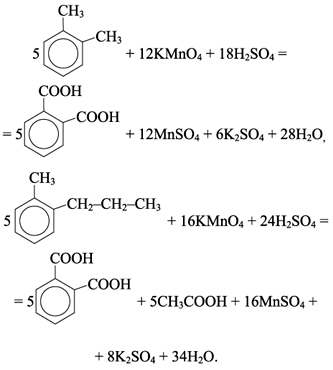
9) 5C6H5 -CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Mn+7 + 5e— → Mn+2 |× 6
C-3 — 6e— → C+3 |× 5
—1 -2 -3 +7 -1 +3 +4 +2
10) 5C6H5 -CH2CH3 + 12KMnO4 + 18H2SO4 → 5C6H5-COOH + 5CO2 + 6K2SO4 + 12MnSO4 + 28H2O
Mn+7 + 5e— → Mn+2 | 5e—|× 12
C-2 — 6e— → C+4 | |
|}12e—|× 5
C-3 — 6e— → C+3 | |
-1 -3 +7 -1 +3 +2
11) 5 C6H4(CH3)2 + 12KMnO4 + 18H2SO4 → 5 C6H4(COOH)2 + 6K2SO4 + 12MnSO4 + 28H2O
1,2-диметилбензол орто-фталевая кислота
2C-3 — 12e— → 2C+3 |12e—|× 5
Mn+7 + 5e— → Mn+2 | 5e— |× 12
-1 -1 -2 +7 -1 +3 +4 +2
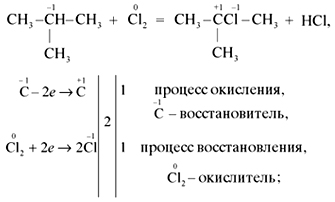
12) C6H5—CH=CH2 + 2KMnO4 + 3H2SO4 → C6H5COOH + CO2 + K2SO4 + 2MnSO4 + 4H2O
Mn+7 + 5e— → Mn+2 | 5e—|× 2
C-1 — 4e— → C+3 | |
|} 10e—|× 1
C-2 — 6e— → C+4 | |
В нейтральной среде:
-2 -2 +7 -1 -1 +4
1) 3CH2=CH2 + 2KMnO4 + 4H2O → CH2-CH2 + 2MnO2 + 2KOH 2C-2 — 2e— → 2C-1 |× 3
І І Mn+7 + 3e— → Mn+4 |× 1
OH OH
2) 3CH3–CH=CH– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– CH3 + 2MnO2 + 2KOH
І І
OH OH
3) C6H5—CH=CH2 + 2KMnO4 + 4H2O → C6H5—CH– CH2 + 2MnO2 + 2KOH
І І
OH OH
00C
4) 3CH3–CH=CH2 + 2KMnO4 + 4H2O —→ 3CH3–CH–CH + 2MnO2 + 2KOH
І І
OH OH
C+3OOK
5) 3CHΞCH + 8KMnO4 → 5 І + 8MnO2 + 2KOH + 2H2O
C+3OOK
только ацетилен!
6) 3CH3–CH=CH–СH2– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– СH2– CH3 + 2MnO2 + 2KOH
І І
OH OH
7) CH3–CH=C– CH3 + 2KMnO4 → CH3-C- CH3 + CH3-COOH + 2MnO2 + 2KOH
І ǁ
CH3 O
Реакция присоединения против правила Марковникова:
+ — H2O2
CH3—CH=CH2 + HBr ——→ CH3—CH2—CH2 — 1-бромпропан
|
Br
При наличии атома хлора в молекуле реакция также идёт против правила, т.к. меняется поляризация молекулы:
— + + —
CH2—CH=CH2 + HBr ——→ CH2—CH2—CH2 — 1-бром-3-хлорпропан
| | |
Cl Cl Br
Спирты.
-3 -1 -2 +7 -3 +3 +2
1) CH3-CH2-OH + 4KMnO4 + 6H2SO4 → 5CH3-COOH + 2K2SO4 + 4MnSO4 + 11H2O
-3 -1 -2 +6 -3 +3 +3
2) CH3-CH2-OH + 2K2Cr2O7 + 8H2SO4 → 3CH3-COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
+6 -2 +2 +3
3) 2K2Cr2O7 + 3CH3OH + 8H2SO4 → HCOOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
-3 +1 -2 -3 +7 -3 +2 -2 -3 +4
4) 5CH3-CH-CH2-CH3 + 2KMnO4 → 5CH3-C-CH2-CH3 + 2MnO2 + 2KOH + 4H2O
І ǁ
OH O
-1 -1 -2 +7 -1 +3 +2
5) 5C6H5 -CH2OH + 4KMnO4 + 6H2SO4 → 5C6H5-COOH + 2K2SO4 + 4MnSO4 + 11H2O
-2 +7 +4 +2
6) 5CH3-OH + 6KMnO4 + 9H2SO4 → 5CO2 + 3K2SO4 + 6MnSO4 + 19H2O
-3 -1 -2 +7 +4 -3 +3
7) 3CH3-CH2-OH + 4KMnO4 → 4MnO2 + KOH + 4H2O + 3CH3-COOK
Альдегиды.
0 +7 +4 +2
1) 5HCHO + 4KMnO4 + 6H2SO4 → 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O
-3 +1 +6 -3 +3 +3
2) 3CH3CHO + K2Cr2O7 + 4H2SO4 → 3CH3-COOH + Cr2(SO4)3 + K2SO4 + 4H2O
-3 +1 +7 -3 +3 +2
3) 5CH3CHO + 2KMnO4 + 3H2SO4 → 5CH3-COOH + K2SO4 + 2MnSO4 + 3H2O
-3 +1 +7 -3 +3 +4
4) 3CH3CHO + 2KMnO4 + KOH → 3CH3-COOK + 2MnO2 + 2H2O
OH
|
5) HC-(CH2)7 -CH3 HC-(CH2)7 -CH3
3 ǁ + 2KMnO4 + 4H2O → 3 | + 2KOH + 2MnO2
HC-(CH2)7 –COOH HC-(CH2)7 -COOH
стеариновая кислота |
OH
9,10 — диоксистеариновая кислота
Другие реакции органических соединений.
Углеводороды.
t0, кат.
1) 2C4H10 + 5 O2 ——→ 4CH3-COOH + 2H2O
2) 3CH3–CH=CH– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– CH3 + 2MnO2 + 2KOH
І І
OH OH
Pd+2
3) 2CH2=CH2 + O2 —→ 2CH3CHO
Ароматические углеводороды.
1) 5С6H4ClC2H5 +12KMnO4 +18H2SO4 → 5C6H4СlCOOH+ 5CO2 +6K2SO4 +12MnSO4+ 28H2O
(орто-,пара- изомеры) (орто-, пара- изомеры)
t0
2) 5 O2N-С6H4-CH3 + 6KMnO4 + 9H2SO4 → 5 O2N-С6H4-COOH + 3K2SO4 + 6MnSO4 + 14H2O
(пара- изомер) (пара- изомер)
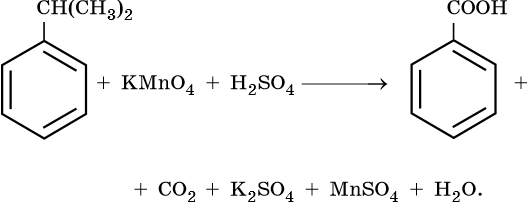
3) 5С6H5CH(CH3)2 +18KMnO4 + 27H2SO4 →5C6H5COOH +10CO2+9K2SO4 +18MnSO4+48H2O
KMnO4
4) CHΞC-С6H4-CH3 ——→ С6H4-(COOH)2
(орто — изомер) орто – фталевая кислота
5) 3С6H5-CH2 -CH=CH2 + 2KMnO4 + 4H2O → 3С6H5-CH2 –CH–CH2 + 2KOH + 2H2O
| |
OH OH
6) 5C6H5—CH2 — CH=CH2 + 16KMnO4 + 24H2SO4 → 5C6H5COOH + 10CO2 + 8K2SO4 + 16MnSO4 + 34H2O
+ —
7) O2N-С6H4-COOH + 3Fe + 7HCl → С6H4(COOH)NH3Cl + 3FeCl3 + 2H2O
Получение.
1) Al4C3 + 12H2O → 4Al(OH)4 + 3CH4
2) Al4C3 + 12HCl → 4AlCl3 + 3CH4
3) CaC2 + 2H2O → Ca(OH)2 + C2H2
Спирты.
1) 3CH2–CH=CH–CH2 + 2KMnO4 + 4H2O → 3CH2–CH–CH–CH2 + 2KOH + 2MnO2
| | | | | |
OH OH OH OH OH OH
2) 3CH3-CH2-OH + K2Cr2O7 + 4H2SO4 → 3CH3-CHO + 2Cr2(SO4)3 + K2SO4 + 7H2O
ацеталь
Альдегиды.
1) CH3CHO + 2NaMnO4 + 3NaOH → CH3-COONa + 2Na2MnO4 + 2H2O
Карбоновые кислоты.
+6 +3 +4 +3
1)K2Cr2O7 +3HOOC-COOH +4H2SO4 → 6CO2 + Cr2(SO4)3 + K2SO4 +7H2O
Соли карбоновых кислот.
электролиз
1) 2CH3-COONa ———→ H2 + C2H6 + 2NaOH + 2CO2
Тренировочные задания. Окислительно-восстановительные реакции с участием органических веществ
1. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
2. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
3. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
4. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
5. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
6. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
7. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
8. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
9. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
10. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
11. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
12. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
13. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
14. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
Ответы
Вы завершили курс по самостоятельной подготовке к ЕГЭ по химии. Если остались пробелы — закройте их с онлайн репетитором. Выбрать репетитора можно на сайте — http://profi-teacher.ru/school-predmety/repetitors-ximii/
ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Составление уравнений
окислительно-восстановительных реакций с
участием органических веществ
В связи с введением в
качестве единственной формы итоговой аттестации
выпускников средней школы единого
государственного экзамена (ЕГЭ) и переходом
старшей школы на профильное обучение все большую
актуальность приобретает подготовка
старшеклассников к выполнению наиболее
“дорогих” в балльном отношении заданий части
“С” теста ЕГЭ по химии. Несмотря на то, что пять
заданий части “С” считаются разными: химические
свойства неорганических веществ, цепочки
превращений органических соединений, расчетные
задачи, – все они в той или иной мере связаны
именно с окислительно-восстановительными
реакциями (ОВР). Если усвоены основные знания
теории ОВР, то можно правильно выполнить первое и
второе задания полностью, а третье – частично.
На наш взгляд, значительная часть успеха при
выполнении части “С” заключается именно в этом.
Опыт показывает, что если, изучая неорганическую
химию, ученики достаточно хорошо справляются с
заданиями по написанию уравнений ОВР, то
аналогичные задания по органической химии
вызывают у них большие трудности. Поэтому на
протяжении изучения всего курса органической
химии в профильных классах мы стараемся
сформировать у старшеклассников навыки
составления уравнений ОВР.
При изучении сравнительной характеристики
неорганических и органических соединений мы
знакомим учащихся с использованием степени
окисления (с.о.) (в органической химии прежде
всего углерода) и способами ее определения:
1) вычисление средней с.о. углерода в молекуле
органического вещества;
2) определение с.о. каждого атома углерода.
Уточняем, в каких случаях лучше использовать
тот или иной способ.
Статья опубликована при поддержке компании «ГЕО-Инжиниринг», представляющей на рынке продукцию под брендом «ProfKresla». Сфера деятельности компании — производство, продажа и установка кресел и стульев для различных залов. Высокий профессионализм сотрудников и собственные производственные мощности позволяют быстро и качественно реализовывать проекты любой степени сложности. Всю продукцию под брендом «ProfKresla», будь тоТеатральные кресла, сидения для залов ожидания или стулья для учебных заведений, отличают современный и эргономичный дизайн, а также высокая износостойкость, прочность и комфорт. Из огромного ассортимента продукции, представленного в каталоге на сайте profkresla.ru, Вы всегда сможете подобрать модели, наилучшим образом соответствующие корпоративному стилю, принятому в Вашей компании. Если же у Вас все-таки возникнут трудности с выбором, то специалисты компании всегда готовы дать консультацию, помочь определиться с моделью, после чего подготовить проект, на месте произвести все необходимые замеры и установку.
При изучении темы
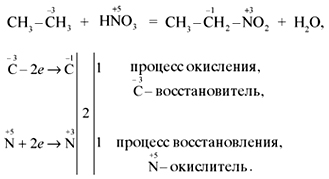
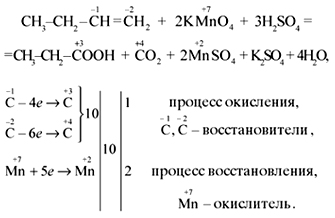
“Алканы” показываем, что процессы окисления,
горения, галогенирования, нитрования,
дегидрирования, разложения относятся к
окислительно-восстановительным процессам. При
написании уравнений реакций горения и
разложения органических веществ лучше
использовать среднее значение с.о. углерода.
Например:
Обращаем внимание на первую половину
электронного баланса: у атома углерода в дробном
значении с.о. знаменатель равен 4, поэтому расчет
передачи электронов ведем по этому коэффициенту.
В остальных случаях при изучении темы
“Алканы” определяем значения с.о. каждого атома
углерода в соединении, обращая при этом внимание
учащихся на последовательность замещения атомов
водорода у первичных, вторичных, третичных
атомов углерода:
Таким образом мы подводим учащихся к выводу,
что в начале протекает процесс замещения у
третичных, затем – у вторичных, и, в последнюю
очередь – у первичных атомов углерода.
При изучении темы
“Алкены” рассматриваем процессы окисления в
зависимости от строения алкена и среды
протекания реакции.
При окислении алкенов концентрированным
раствором перманганата калия KMnO4 в кислой
среде (жесткое окисление) происходит разрыв — и
-связей с образованием
карбоновых кислот, кетонов и оксида углерода(IV).
Эта реакция используется для определения
положения двойной связи.
Если двойная связь находится на конце молекулы
(например, у бутена-1), то одним из продуктов
окисления является муравьиная кислота, легко
окисляющаяся до углекислого газа и воды:
Подчеркиваем, что если в молекуле алкена атом
углерода при двойной связи содержит два
углеродных заместителя (например, в молекуле
2-метилбутена-2), то при его окислении происходит
образование кетона, т. к. превращение такого
атома в атом карбоксильной группы невозможно без
разрыва C–C-связи, относительно устойчивой в этих
условиях:
Уточняем, что если молекула алкена симметрична
и двойная связь содержится в середине молекулы,
то при окислении образуется только одна кислота:
Сообщаем, что особенностью окисления алкенов, в
которых атомы углерода при двойной связи
содержат по два углеродных радикала, является
образование двух кетонов:
Рассматривая окисление алкенов в нейтральной
или слабощелочной средах, акцентируем внимание
старшеклассников на том, что в таких условиях
окисление сопровождается образованием диолов
(двухатомных спиртов), причем гидроксильные
группы присоединяются к тем атомам углерода,
между которыми существовала двойная связь:
В аналогичном плане
рассматриваем окисление ацетилена и его
гомологов в зависимости от того, в какой среде
протекает процесс. Так, уточняем, что в кислой
среде процесс окисления сопровождается
образованием карбоновых кислот:
Реакция используется для определения строения
алкинов по продуктам окисления:
В нейтральной и слабощелочной средах окисление
ацетилена сопровождается образованием
соответствующих оксалатов (солей щавелевой
кислоты), а окисление гомологов – разрывом
тройной связи и образованием солей карбоновых
кислот:
Все правила
отрабатываются с учащимися на конкретных
примерах, что приводит к лучшему усвоению ими
теоретического материала. Поэтому при изучении
окисления аренов в различных средах ученики
могут самостоятельно высказать предположения,
что в кислой среде следует ожидать образования
кислот, а в щелочной – солей. Учителю
останется только уточнить, какие продукты
реакции образуются в зависимости от строения
соответствующего арена.
Показываем на примерах, что гомологи бензола с
одной боковой цепью (независимо от ее длины)
окисляются сильным окислителем до бензойной
кислоты по -углеродному
атому. Гомологи бензола при нагревании
окисляются перманганатом калия в нейтральной
среде с образованием калиевых солей
ароматических кислот.
5C6H5–CH3 + 6KMnO4 + 9H2SO4
= 5C6H5COOH + 6MnSO4 + 3K2SO4 +
14H2O,
5C6H5–C2H5 + 12KMnO4 +
18H2SO4 = 5C6H5COOH + 5CO2 + 12MnSO4
+ 6K2SO4 + 28H2O,
C6H5–CH3 + 2KMnO4 = C6H5COOK
+ 2MnO2 + KOH + H2O.
Подчеркиваем, что если в молекуле арена
несколько боковых цепей, то в кислой среде каждая
из них окисляется по a-углеродному атому до
карбоксильной группы, в результате чего
образуются многоосновные ароматические кислоты:
Полученные навыки
составления уравнений ОВР для углеводородов
позволяют использовать их при изучении раздела
“Кислородсодержащие соединения”.
Так, при изучении темы “Спирты” учащиеся
самостоятельно составляют уравнения окисления
спиртов, используя следующие правила:
1) первичные спирты окисляются до альдегидов
3CH3–CH2OH + K2Cr2O7 +
4H2SO4 = 3CH3–CHO + K2SO4 +
Cr2(SO4)3 + 7H2O;
2) вторичные спирты окисляются до кетонов
3) для третичных спиртов реакция окисления не
характерна.
В целях подготовки к ЕГЭ учителю целесообразно
дать дополнительные сведения к указанным
свойствам, что, несомненно, будет полезным для
учащихся.
При окислении метанола подкисленным раствором
перманганата калия или дихромата калия
образуется CO2, первичные спирты при
окислении в зависимости от условий протекания
реакции могут образовать не только альдегиды, но
и кислоты. Например, окисление этанола
дихроматом калия на холоду заканчивается
oбразованием уксусной кислоты, а при
нагревании – ацетальдегида:
3CH3–CH2OH + 2K2Cr2O7
+ 8H2SO4 = 3CH3–COOH + 2K2SO4 +
2Cr2(SO4)3 + 11H2O,
3CH3–CH2OH + K2Cr2O7 +
4H2SO4 3CH3–CHO
+ K2SO4 + Cr2(SO4)3 + 7H2O.
Вновь напомним учащимся о влиянии среды на
продукты реакций окисления спиртов, а именно:
горячий нейтральный раствор KMnO4 окисляет
метанол до карбоната калия, а остальные
спирты – до солей соответствующих карбоновых
кислот:
При изучении темы “Альдегиды и кетоны”
акцентируем внимание учащихся на том, что
альдегиды легче, чем спирты, окисляются в
соответствующие карбоновые кислоты не только
под действием сильных окислителей (кислород
воздуха, подкисленные растворы KMnO4 и K2Cr2O7),
но и под действием слабых (аммиачный раствор
оксида серебра или гидроксида меди(II)):
5CH3–CHO + 2KMnO4 + 3H2SO4 =
5CH3–COOH + 2MnSO4 + K2SO4 + 3H2O,
3CH3–CHO + K2Cr2O7 + 4H2SO4
= 3CH3–COOH + Cr2(SO4)3 + K2SO4
+ 4H2O,
CH3–CHO + 2[Ag(NH3)2]OH CH3–COONH4 + 2Ag + 3NH3
+ H2O.
Особое внимание уделяем окислению метаналя
аммиачным раствором оксида серебра, т.к. в этом
случае образуется карбонат аммония, а не
муравьиная кислота:
HCHО + 4[Ag(NH3)2]OH = (NH4)2CO3
+ 4Ag + 6NH3 + 2H2O.
Как показывает наш многолетний опыт,
предложенная методика обучения
старшеклассников составлению уравнений ОВР с
участием органических веществ повышает их
итоговый результат ЕГЭ по химии на несколько
баллов.
Л.К.ПИЛИПЕНКО,
учитель химии средней школы № 5
(г. Анапа, Краснодарский край)
Подготовка к ЕГЭ по химии
Окислительно-восстановительные реакции
с участием органических веществ.
Алкены. Алкины. Арены.
Кислородсодержащие вещества
(для педагогов и учащихся)
Составила: Борисова Снежана Петровна, учитель химии МАОУ СОШ №4
г.Новый Уренгой
2020
Окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении — понижается.
Первоначально окислением называли только реакции веществ с кислородом, восстановлением — отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует.
В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя), например:
При этом окислитель восстанавливается, а восстановитель — окисляется. При протекании реакций в гальваническом элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса ΔG в данной реакции может быть превращено в полезную работу. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно.
При окислительно-восстановительных реакциях атомы в высшей степени окисления являются только окислителями, в низшей — только восстановителями; атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановителями. Многие окислительно-восстановительные реакции (ОВР) – каталитические.
По формальным признакам окислительно-восстановительные реакции (ОВР) разделяют на межмолекулярные (например, 2SO2 + O2 → 2SO3) и внутримолекулярные, например:
Последняя реакция представляет собой самоокисление-самовосстановление.
В случае окислительно-восстановительных реакций в органической химии использование обобщенной концепции окисления-восстановления и понятия о степени окисления часто малопродуктивно, особенно при незначительно полярности связей между атомами, участвующими в реакции. В органической химии окисление рассматривают обычно как процесс, при котором в результате перехода электронов от органического соединения к окислителю возрастает число (или кратность) кислородсодержащих связей (С-О, N — О, S — О и т.п.) либо уменьшается число водородсодержащих связей (С — Н, N — Н, S — Н и т.п.), например: RCHO → RCOOH; R2CHCHR2 → R2C=CR2. При восстановлении органических соединений в результате приобретения электронов происходят обратные процессы, например: R2CO → R2CH2; RSO2Cl → RSO2H.
Используют также подход, при котором атомам С в молекуле приписывают различные степени окисления в зависимости от числа связей, образованных с элементом более электроотрицательным, чем водород. В этом случае функциональные производные можно расположить в порядке возрастания их степени окисления. Так, насыщенные углеводороды относят к нулевой группе (приблизительная степень окисления — 4), R2C=CR2, ROH, RCl и RNH2 — к первой (- 2), RCCR, R2CO и R2CCl2 — ко второй (0), RCOOH, RC
CCl, RCONH2 и RССl3 — к третьей (+2), RCN, CCl4 и СО2 — к четвертой (+4). Тогда окисление — процесс, при котором соединение переходит в более высокую категорию, а восстановление — обратный процесс.
В органической химии используют широкий ряд восстановителей и окислителей, что позволяет выбрать реагент, обладающий селективностью (т.е. способностью действовать избирательно на определенные функциональные группы), а также получать продукты в требуемой степени окисления. Например, борогид Na восстанавливает кетоны или альдегиды до спиртов, не реагируя с амидами и сложными эфирами; LiAlH4 восстанавливает все эти соединения до спиртов. Среди окислителей высокой селективностью обладают, например, комплекс CrО3 с пиридином, с высоким выходом окисляющий спирты в кетоны, не затрагивая кратные связи С-С, а также SeO2, окисляющий кетоны и альдегиды до α-дикарбонильных соединений.
Селективность окислительно-восстановительных реакций может быть обеспечена и в каталитических процессах; например, в зависимости от катализатора и условий реакций ацетиленовые углеводороды можно селективно гидрировать до этиленовых или насыщенных углеводородов.
Каталитические окислительно-восстановительные реакции (ОВР) играют важную роль в промышленности, например:
Окислительно-восстановительные реакции (ОВР) широко распространены в природе и используются в технике.
Органическая химия – это химия соединений углерода, поэтому важно уметь вычислять степени окисления атомов углерода в них.
Для определения степени окисления (СО) атомов в молекулах органических веществ существуют разные приёмы, вот один из способов. Он означает, что более электроотрицательный атом, смещая к себе одну электронную пару, приобретает заряд -1, две электронных пары — заряд -2. Связь между одинаковыми атомами не дает вклада в степень окисления. Таким образом, связь между атомами С-С соответствует нулевой степени их окисления. В связи C-H углероду как более электроотрицательному атому соответствует заряд -1, а в связи C-O заряд углерода (менее электроотрицательного) равен +1. Степень окисления атома в молекуле подсчитывается как алгебраическая сумма зарядов, которые дают все связи данного атома.
Пример №1.
Так, в молекуле CH3Cl три связи C-H дают суммарный заряд на атоме C, равный -3, а связь C-Cl — заряд +1. Следовательно, степень окисления атома углерода в этом соединении равна:
— 3+1=-2.
Пример №2.
Определим степени окисления (СО) атомов углерода в молекуле этанола:
C-3H3 – C-1H2 – OH
Три связи C−H дают суммарный заряд на атоме C, равный (С0+3е—→С-3) -3.
Две связи С−Н дают заряд на атоме С, равный -2,а связь С→О заряд +1, следовательно, суммарный заряд на атоме С, равен (-2+1=-1) -1.
Пример №3.
Определим СО атомов углерода в молекуле уксусной кислоты:
С-3Н3 – С+3О – ОН
Три связи C−H дают суммарный заряд на атоме C, равный (С0+3е—→С-3) -3.
Двойная связь С=О (кислород как более электроотрицательный, забирает электроны у атома углерода) даёт заряд на атоме С, равный +2 (С0-2е—→С+2),а связь С→О заряд +1, следовательно, суммарный заряд на атоме С, равен (+2+1=+3) +3.
Пример №4.
Определим СО атомов углерода в молекуле уксусного альдегида:
С-3Н3 – С+1О – Н
Три связи C−H дают суммарный заряд на атоме C, равный (С0+3е—→С-3) -3.
Двойная связь С=О (кислород как более электроотрицательный, забирает электроны у атома углерода) даёт заряд на атоме С, равный +2 (С0-2е—→С+2),а связь С−H заряд -1, следовательно, суммарный заряд на атоме С, равен (+2-1=+1) +1.
К окислителям органических соединений относятся в первую очередь вещества неорганической природы. По агрегатному состоянию их можно разделить на:
— газообразные (О2 воздуха без нагревания и при нагревании, О3);
— жидкие ( [Ag (NH3)2]OH (водные растворы), Cu(OH)2, H2O2, KMnO4/ H2O, KMnO4/ H2SO4, K2Cr2O7/ H2SO4)/
У ряда веществ окислительная активность изменятся в зависимости от условий проведения процесса окисления.
Перманганат калия является очень сильным окислителем, в зависимости от рН среды разные продукты его восстановления.
|
Среда |
Полуреакция |
Пример |
|
Сильно щелочная |
Мn+7 +1е → Мn+6 |
МnО42- (например К2МnО4) (раствор зеленого цвета) |
|
Нейтральная |
Мn+7+3е → Мn+4 |
МnО2 (бурый осадок) |
|
Сильно кислая |
Мn+7+5е → Мn+2 |
Мn2+ (например МnSО4 или МnСl2) (бесцветный раствор) |
Сильными окислителями являются дихроматы в кислой среде.
|
Среда |
Полуреакция |
Пример |
|
Сильно щелочная |
2Cr+6 +6е → 2Cr+3 |
[Cr(OH)6]3- (например К3[Cr(OH)6]) (светло-зеленый раствор) |
|
Нейтральная |
2Cr+6 +6е → 2Cr+3 |
Cr(OH)3 (серо-зеленый осадок) |
|
Сильно кислая |
2Cr+6 +6е → 2Cr+3 |
Cr+3 (например Cr2(SО4)3 или CrСl3) (сине-зелёный раствор) |
Подобрать и расставить коэффициенты в уравнениях окислительно-восстановительных реакций, протекающих с участием органических веществ, можно осуществить тремя способами.
1.Метод электронного баланса
Уравнения электронного баланса описывают процессы окисления и восстановления атомов. Кроме этого, специальные множители указывают на коэффициенты перед формулами веществ, содержащих атомы, которые участвовали в процессах окисления и восстановления. Это, в свою очередь, позволяет находить остальные коэффициенты.
Пример. Окисление толуола перманганатом калия в кислой среде.
C6H5-CH3 + KMnO4 + H2SO4 → …
Известно, что боковые метильные радикалы аренов обычно окисляются до карбоксила, поэтому в данном случае образуется бензойная кислота. Перманганат калия в кислой среде восстанавливается до двузарядных катионов марганца. Учитывая наличие сернокислотной среды, продуктами будут сульфат марганца (II) и сульфат калия. Кроме того, при окислении в кислой среде образуется вода. Теперь схема реакции выглядит так:
C6H5-CH3 + KMnO4 + H2SO4 → C6H5COOH + MnSO4 + K2SO4 + H2O
Из схемы видно, что изменяется состояние атома углерода в метильном радикале, а также атома марганца. Степени окисления марганца определяются по общим правилам подсчета: в перманганате калия +7, в сульфате марганца +2. Степени окисления атома углерода можно легко определить исходя из структурных формул метильного радикала и карбоксила. Для этого нужно рассмотреть смещение электронной плотности исходя из того, что по электроотрицательности углерод занимает промежуточное положение между водородом и кислородом, а связь С-С формально считается неполярной. В метильном радикале атом углерода притягивает три электрона от трех атомов водорода, поэтому его степень окисления равна -3. В карбоксиле атом углерода отдает два электрона карбонильному атому кислорода и один электрон атому кислорода гидроксильной группы, поэтому степень окисления атома углерода +3.
C6H5-C-3H3 + KMn+7O4 + H2SO4 → C6H5C+3OOH + Mn+2SO4 + K2SO4 + H2O
Уравнение электронного баланса:
|
Mn+7 + 5e → Mn+2 |
30 |
6 |
|
C-3 – 6e → C+3 |
5 |
Перед формулами веществ, содержащих марганец необходим коэффициент 6, а перед формулами толуола и бензойной кислоты – 5.
5C6H5-CH3 +6 KMnO4 + H2SO4 → 5C6H5COOH + 6MnSO4 + K2SO4 + H2O
Далее уравниваем число атомов калия:
5C6H5-CH3 +6 KMnO4 + H2SO4 → 5C6H5COOH + 6MnSO4 + 3K2SO4 + H2O
И число атомов серы:
5C6H5-CH3 +6 KMnO4 +9H2SO4→5C6H5COOH + 6MnSO4 +3K2SO4 + H2O
На заключительном этапе необходим коэффициент перед формулой воды, который можно вывести подбором по числу атомов водорода или кислорода:
5C6H5-CH3 +6 KMnO4 +9H2SO4 → 5C6H5COOH + 6MnSO4 +3K2SO4 + 14H2O
2.Метод полуреакций
Пример. Окисление толуола перманганатом калия в кислой среде.
C6H5 CH3 + KMnO4 + H2SO4 → C6H5COOH + MnSO4 + K2SO4 + H2O
Выписываем молекулы органических веществ:
C7H8 → C7H6O2
Выравниваем атомы O молекулой H2O:
(Добавляем слева 2 молекулы воды, т.к. справа 2 атома кислорода)
C7H8 + 2H2O → C7H6O2.
Уравниваем атомы H катионами H+ :
(Cлева 12 атомов водорода, поэтому справа нужно добавить 6 катионов водорода)
C7H8 + 2H2O → C7H6O2 + 6H+
Определяем заряды и переход электронов:
C7H8 + 2H2O — 6 e → C7H6O2 + 6H+
Выписываем ионы марганца
MnO4 — → Mn2+
Выравниваем атомы O молекулой H2O:
(Добавляем справа 4 молекулы воды, т.к. слева 4 атома кислорода)
MnO4 — → Mn2+ + 4 H2O
Уравниваем атомы H катионами H+ :
(Добавляем слева 8 катионов водорода, т.к справа 8 атомов водорода)
MnO4 — + 8Н+ → Mn2+ + 4 H2O
Определяем заряды и переход электронов:
MnO4 — + 8Н+ +5 e → Mn2+ + 4 H2O
Записываем электронно-ионный баланс
|
C7H8 + 2H2O — 6 e → C7H6O2 + 6H+ |
30 |
5 |
|
MnO4 — + 8Н+ +5 е → Mn2+ + 4 H2O |
6 |
Вносим числа в уравнение, расставляя коэффициенты
5C6H5CH3 + 6KMnO4 + H2SO4 → 5C6H5COOH + 6MnSO4 + K2SO4 + H2O
Уравниваем калий, серу, водород и проверяем количество кислорода.
5C6H5CH3 + 6KMnO4 + 9H2SO4 → C6H5COOH + 6MnSO4 + 3K2SO4 +18 H2O
3.Метод электронного баланса и полуреакций
Пример. Окисление толуола перманганатом калия в кислой среде.
C6H5 CH3 + KMnO4 + H2SO4 → C6H5COOH + MnSO4 + K2SO4 + H2O
Определяем степени окисления марганца по общим правилам подсчета: в перманганате калия +7, в сульфате марганца +2.
C6H5-CH3 + KMn+7O4 + H2SO4 = C6H5COOH + Mn+2SO4 + K2SO4 + H2O
Для неорганических веществ используем метод электронного баланса:
Mn+7 + 5e → Mn+2
Для органических веществ используем метод полуреакций (см. метод полуреакций).
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
30 |
6 |
|
C7H8 + 2H2O — 6 e → C7H6O2 + 6H+ |
5 |
Вносим числа в уравнение, расставляя коэффициенты
5C6H5CH3 + 6KMnO4 + H2SO4 → 5C6H5COOH + 6MnSO4 + K2SO4 + H2O
Уравниваем калий, серу, водород и проверяем количество кислорода.
5C6H5CH3 + 6KMnO4 + 9H2SO4 → C6H5COOH + 6MnSO4 + 3K2SO4 +18 H2O
Реакции окисления алкенов
Реакции окисления алкенов дают возможность превращать их в многоатомные спирты, альдегиды, кетоны, карбоновые кислоты, оксиды. Глубину определяют условия протекания реакций.
Окисление алкенов водным раствором KMnO4
(реакция Вагнера)
При мягком окислении алкены превращаются в гликоли (многоатомные спирты).
Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью. Разрывается только π связь, при этом ơ связь сохраняется. По месту разрыва π связи присоединяются гидроксильные группы, т.е. к тем атомам углерода, между которыми до окисления существовала двойная связь, вне зависимости от места расположения двойной связи (на краю или в центре молекулы).
Реакция с раствором перманганата калия протекает в нейтральной или слабо-щелочной среде следующим образом:
R-CH=CH-R’ + KMnO4 + H2O → R—CH2OH-CH2OH-R’ + MnO2 + KOH
(охлаждение)
Пример 1.
CH2=CH2 + KMnO4 + H2O → CH2OH-CH2OH + MnO2 + KOH
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
6 |
2 |
|
C2H4+ 2H2O — 2 e → C2H6O2 + 2H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3CH2=CH2 + 2KMnO4 + H2O → 3CH2OH-CH2OH + 2MnO2 + KOH
Уравниваем калий, водород и проверяем количество кислорода.
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2MnO2 + 2KOH
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены.
При наличии в молекуле 2-х двойных связей образуются тетраолы:
R-CH=CH-CH=CH-R’ + KMnO4 + H2O → R—CHOH-CHOH-CHOH-CHOH -R’ + MnO2 + KOH
Пример 2.
СН3-CH=CH-CH=CH-СН2-СН3 + KMnO4 + H2O → MnO2 + KOH +
СН3—CHOH-CHOH-CHOH-CHOH — СН2-СН3
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
12 |
4 |
|
C7H12+ 4H2O — 4 e → C7H16O4 + 4H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3СН3-CH=CH-CH=CH-СН2-СН3 + 4KMnO4 + H2O → 4MnO2 + KOH + С3Н3—CHOH-CHOH-CHOH-CHOH — СН2-СН3
Уравниваем калий, водород и проверяем количество кислорода.
3СН3-CH=CH-CH=CH-СН2-СН3 + 4KMnO4 + 8H2O → 4MnO2 + 4KOH + 3СН3—CHOH-CHOH-CHOH-CHOH — СН2-СН3
Окисление алкенов раствором KMnO4 и дихроматом калия
в кислой среде
В кислой среде (подкисленный серной кислотой раствор) при нагревании происходит полное разрушение двойной связи и превращение атомов углерода, между которыми существовала двойная связь, в атомы углерода карбоксильной группы.
1. Если двойная связь находится не на краю, то образуется смесь кислот.
а) если радикалы одинаковые:
R-CH=CH-R + KMnO4 + H2SO4 → 2R-CООН + MnSO4 + K2SO4 + H2O
R-CH=CH-R + K2Cr2O7 + H2SO4 → 2R-CООН + Cr2(SО4)3 + K2SO4 + H2O
Пример 3.
СН3-CH=CH- СН3 + KMnO4 + H2SO4 → 2СН3-CООН + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
40 |
8 |
|
C4H8+ 4H2O — 8 e → C4H8O4 + 8H+ |
5 |
Вносим числа в уравнение, расставляя коэффициенты
5СН3-CH=CH- СН3 + 8KMnO4 + H2SO4 → 10СН3-CООН + 8MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
5СН3-CH=CH- СН3 + 8KMnO4 + 12H2SO4 → 10СН3-CООН + 8MnSO4 + 4K2SO4 + 12H2O
Пример 4.
СН3-CH=CH- СН3 + K2Cr2O7 + H2SO4 → 2СН3-CООН + Cr2(SО4)3 + K2SO4 + H2O
Записываем электронно-ионный баланс
|
2Cr+6 + 6e → 2Cr+3 |
24 |
4 |
|
C4H8+ 4H2O — 8e → C4H8O4 + 8H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3СН3-CH=CH- СН3 + 4 K2Cr2O7+ H2SO4 → 6СН3-CООН + 4 Cr2(SО4)3 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
3СН3-CH=CH- СН3 + 4 K2Cr2O7 + 16H2SO4 → 6СН3-CООН + 4Cr2(SО4)3 + 4K2SO4 + 16H2O
б) если радикалы разные:
R-CH=CH-R’ + KMnO4 + H2SO4 → R-CООН + R’-CООН + MnSO4 + K2SO4 + H2O
R-CH=CH-R’ + K2Cr2O7+ H2SO4 → R-CООН + R’-CООН + Cr2(SО4)3 + K2SO4 + H2O
Пример 5.
СН3-CH=CH- СН2-СН3 + KMnO4 + H2SO4 → MnSO4 + K2SO4 + H2O + СН3-CООН + СН3-СН2 -CООН
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
40 |
8 |
|
C5H10 + 4H2O — 8 e → C2H4O2 + C3H6O2 + 8H+ |
5 |
Вносим числа в уравнение, расставляя коэффициенты
5СН3-CH=CH- СН2-СН3 + 8KMnO4 + H2SO4 → 8MnSO4 + K2SO4 + H2O + 5СН3-CООН + 5СН3-СН2 -CООН
Уравниваем калий, водород и проверяем количество кислорода.
5СН3-CH=CH- СН2-СН3 + 8KMnO4 + 16H2SO4 → 8MnSO4 + 4K2SO4 + 16H2O + 5СН3-CООН + 5СН3-СН2 -CООН
Пример 6.
СН3-CH=CH- СН2-СН3 + K2Cr2O7 + H2SO4 → + Cr2(SО4)3 + K2SO4 + H2O + СН3-CООН + СН3-СН2 -CООН
Записываем электронно-ионный баланс
|
2Cr+6 + 6e → 2Cr+3 |
24 |
4 |
|
C5H10 + 4H2O — 8 e → C2H4O2 + C3H6O2 + 8H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3СН3-CH=CH- СН2-СН3 + 4K2Cr2O7 + H2SO4 → 4Cr2(SО4)3 + K2SO4 + H2O + 3СН3-CООН + 3СН3-СН2 -CООН
Уравниваем калий, водород и проверяем количество кислорода.
3СН3-CH=CH- СН2-СН3 + 4K2Cr2O4 + 16H2SO4 → 4Cr2(SО4)3 + 4K2SO4 + 16H2O + 3СН3-CООН + 3СН3-СН2 -CООН
2. Если двойная связь находится у конца молекулы (например, в случае бутена-1), то одним из продуктов должна оказаться муравьиная кислота – вещество, которое легко окисляется до углекислого газа:
R-CH=CH2 + KMnO4 + H2SO4 → R-CООН + СО2 + MnSO4 + K2SO4 + H2O
R-CH=CH2 + K2Cr2O7 + H2SO4 → R-CООН + СО2 + Cr2(SО4)3 + K2SO4 + H2O
Пример 7.
СН3-CH=CH2 + KMnO4 + H2SO4 → СН3-CООН + СО2 + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
10 |
2 |
|
C3H6 + 4H2O — 10 e → C2H4O2 + CO2 + 10H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
СН3-CH=CH2 + 2KMnO4 + H2SO4 → СН3-CООН + СО2 + 2MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
СН3-CH=CH2 + 2KMnO4 + 3H2SO4 → СН3-CООН + СО2 + 2MnSO4 + K2SO4 + 4H2O
Пример 7.
СН3-CH2 -CH=CH2 + K2Cr2O7 + H2SO4 → СН3-CH2 -CООН + СО2 + Cr2(SО4)3 + K2SO4 + H2O
Записываем электронно-ионный баланс
|
2Cr+6 + 6e → 2Cr+3 |
30 |
5 |
|
C4H8+ 4H2O — 10 e → C3H6O2 + CO2 + 10H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3СН3-CH2 -CH=CH2 + 5K2Cr2O4 + H2SO4 → 3СН3-CH2 -CООН + 3СО2 + 5Cr2(SО4)3 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
3СН3-CH2 -CH=CH2 + 5K2Cr2O7 +20H2SO4 → 3СН3-CH2 -CООН + 3СО2 + 5Cr2(SО4)3 + 5K2SO4 + 23H2O
3. Если в молекуле алкена атом углерода при двойной связи содержит два углеводородных заместителя (например, 2-метилбутен-2), то при его окислении происходит образование кетона:
Пример 8.
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
30 |
6 |
|
C5H10 + 3H2O — 6 e → C3H6O + C2H4O2 + 6H+ |
5 |
Вносим числа в уравнение, расставляя коэффициенты
5(СН3)2С-CH=CH2 + 6KMnO4 + H2SO4 → 6MnSO4 + K2SO4 + H2O + 5СН3-СО- СН3 + 5СН3-CООН
Уравниваем калий, водород и проверяем количество кислорода.
4. Если в молекуле атом углерода при двойной связи содержит два углеводородных заместителя и 2 двойных связи, то при равных условиях они обе будут подвержены разрыву с образованием смеси веществ одно- и двухосновной кислот, углекислого газа или кетона:
Окисление алкенов раствором KMnO4
в сильнощелочной среде
1. В молекуле двойная связь располагается с краю: связь полностью разрушается, крайний атом превращается в среднюю соль (карбонат), оставшаяся часть — также в соответствующую соль.
R -CH=CH2 + KMnO4 + KOH → R-COOK + K2CO3 + H2O + K2MnO4 (нагревание)
Пример 9.
CH3 -CH=CH2 + KMnO4 + KOH → CH3COOK + K2CO3 + H2O + K2MnO4
Записываем электронно-ионный баланс
|
Mn+7 + 1e → Mn+6 |
10 |
10 |
|
C3H6 + 5H2O — 10e → CH3 COO— + CO32- + 13H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
СН3-CH=CH2 + 10KMnO4 + КОН → СН3-CООК + K2CO3 + H2O + 10K2MnO4
Уравниваем калий, водород и проверяем количество кислорода.
СН3-CH=CH2 + 10KMnO4 + 13КОН → СН3-CООК + K2CO3 + 8H2O + 10K2MnO4
2. В молекуле двойная связь располагается в середине молекулы: связь полностью разрушается, образуются 2 соли карбоновых кислот.
R -CH=CH-R’ + KMnO4 + KOH → R-COOK + R’-COOK + H2O + K2MnO4 (нагревание)
Пример 10.
CH3 -CH=CH-CH2 -CH3 + KMnO4 + KOH → CH3COOK + C2H5COOK + H2O + K2MnO4
Записываем электронно-ионный баланс
|
Mn+7 + 1e → Mn+6 |
8 |
8 |
|
C5H10 + 4H2O — 8e → CH3 COO— + C2H5CОO— + 10H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
CH3-CH=CH-CH2 -CH3 + 8KMnO4 + КОН → CH3COOK + C2H5COOK + H2O + 8K2MnO4
Уравниваем калий, водород и проверяем количество кислорода.
CH3-CH=CH-CH2-CH3+8KMnO4 +10КОН → CH3COOK + C2H5COOK + 6H2O + 8K2MnO4
Задания для самостоятельной работы
- Составьте уравнение окисления пентена-1 раствором перманганата калия в нейтральной среде.
- Составьте уравнение окисления пентена-1 раствором перманганата калия в кислой среде.
- Составьте уравнение окисления пентена-1 раствором перманганата калия в сильнощелочной среде.
- Составьте уравнение окисления пентена-2 раствором дихромата калия в кислой среде.
- Составьте уравнение окисления пентена-2 раствором перманганата калия в сильнощелочной среде.
- Составьте уравнение окисления 3-метилпентен-2 раствором перманганата калия в кислой среде.
- Составьте уравнение окисления 2,3-диметилпентен-2 раствором перманганата калия в кислой среде.
- Составьте уравнение окисления 2-метилпропена раствором перманганата калия в кислой среде.
- Составьте уравнение окисления гексена-3 раствором дихромата калия в кислой среде.
- Составить и уравнять методом электронно-ионного баланса схемы реакций взаимодействия алкена с водным и сернокислым (при t°C) раствором перманганата калия:
|
Вариант |
Название алкена (исходного вещества) |
|
I |
2-метилбутен-1 |
|
II |
2-метилпентен-1 |
|
III |
бутен-1 |
|
IV |
пентен-1 |
|
V |
3-метилпентен-1 |
|
VI |
3-метилпентен-2 |
Реакции окисления алкинов
Алкины окисляются значительно труднее алкенов. Сильные окислители окисляют алкины с разрывом тройной связи до карбоновых кислот. Эта реакция используется как качественная на наличие тройной связи (как и двойной) в органических соединениях
Окисление алкинов водным раствором KMnO4
Окисление алкинов перманганатом калия в нейтральной среде на холоду (00С) приводит к образованию 1,2-дикетона.
R-C C-R’ + KMnO4 + H2O → R—CO-CO-R’ + MnO2 + KOH
(охлаждение)
Пример 1.
СН3-CC- СН3 + KMnO4 + H2O →
Записываем электронно-ионный баланс
Пример 2.
+ KMnO4
КООС-СООК +
Записываем электронно-ионный баланс
Пример 3.
СН3-CCН + KMnO4 + H2O
СН3-СООК + КНСО3 +
Записываем электронно-ионный баланс
Окисление алкинов в кислой среде
Окисление ацетилена подкисленным раствором перманганата калия на холоду приводит к образованию щавелевой кислоты:
+ KMnO4 + H2SO4 → КООС-СООК +
При нагревании в присутствии перманганата калия в кислотной среде происходит расщепление кратной связи.
1.Если тройная связь находится у конца молекулы (например, в случае бутина-1), то одним из продуктов должна оказаться муравьиная кислота – вещество, которое легко окисляется до углекислого газа:
R-C CН + KMnO4 + H2SO4 → R-CООН + СО2 +
Пример 4.
СН3-CCН + KMnO4 + H2SO4 → СН3-СООН + СО2 +
Записываем электронно-ионный баланс
2. Если тройная связь находится не на краю, то образуется смесь кислот.
Пример 5.
СН3-CC- СН3 + K2Cr2O7 + H2SO4 → 2СН3-CООН +
Записываем электронно-ионный баланс
СН3-CC- СН2-СН3 + KMnO4 + H2SO4 →
Записываем электронно-ионный баланс
Пример 6.
СН3-CC- СН2-СН3 + K2Cr2O7 + H2SO4 →
Записываем электронно-ионный баланс
Пример 7.
СН3-CH2 -CC- СН2-CH2-СН3 + K2Cr2O7 + H2SO4 →
Записываем электронно-ионный баланс
Реакции окисления аренов
1.Бензол не окисляется даже под действием сильных окислителей
(KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко.
Окисление аренов раствором KMnO4
в щелочной среде
1. В молекуле тройная связь располагается с краю: связь полностью разрушается, крайний атом превращается в среднюю соль (карбонат), оставшаяся часть — также в соответствующую соль.
R -CCH + KMnO4 + KOH → R-COOK + K2CO3 + H2O + K2MnO4 (нагревание)
Пример 9.
CH3 -CCH + KMnO4 + KOH →
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
2. В молекуле тройная связь располагается в середине молекулы: связь полностью разрушается, образуются 2 соли карбоновых кислот.
R -CC-R’ + KMnO4 + KOH → R-COOK + R’-COOK + H2O + K2MnO4 (нагревание)
Пример 10.
CH3 -CC-CH2 -CH3 + KMnO4 + KOH →
Записываем электронно-ионный баланс
Пример 11.
CH3 -CCН + K2Cr2O7 + H2SO4 →
Записываем электронно-ионный баланс
Пример 12.
CH3 -CCН + KMnO4 + H2O →
Записываем электронно-ионный баланс
Пример 13.
CH3 -CC-СН2-СН2-СН3 + KMnO4 + H2O →
Записываем электронно-ионный баланс
Окисление аренов в кислой среде
При действии раствора KMnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи:
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
Пример 1.
С6Н5-CH2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены.
С6Н5-CH2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Пример 2.
С6Н5-CH2-СН2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СН3-CООН + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH2-СН2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СН3-CООН + MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH2-СН2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СН3-CООН + MnSO4 + K2SO4 + H2O
Пример 3.
С6Н5-CH2-(CH3)2 + K2Cr2O7 + H2SO4 → СН3-CООН + 2СО2 + Cr2(SО4)3 + K2SO4 + H2O
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH2-(CH3)2 + K2Cr2O7 + H2SO4 → СН3-CООН + 2СО2 + Cr2(SО4)3 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH2-(CH3)2 + K2Cr2O7 + H2SO4 → СН3-CООН + 2СО2 + Cr2(SО4)3 + K2SO4 + H2O
2.Если в молекуле арена несколько боковых цепей, то в кислой среде каждая из них окисляется по a-углеродному атому до карбоксильной группы, в результате чего образуются многоосновные ароматические кислоты:
Пример 5.
С6Н5-CH=CH2 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH=CH2 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH=CH2 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Окисление аренов в щелочной и нейтральной средах
1. Гомологи бензола при нагревании окисляются перманганатом калия в нейтральной среде с образованием калиевых солей ароматических кислот.
Пример 6.
С6Н5-CH3 + KMnO4 → C6H5COOК + MnO2 + KOН + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
6 |
2 |
|
C7H8 + 2H2O — 6 e → C7H5O2— + 7H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH3 + 2KMnO4 → C6H5COOК + 2MnO2 + KOН + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH3 + 2KMnO4 → C6H5COOК + 2MnO2 + KOН + H2O
Пример 6.
С6Н5— CH2-CH3 + KMnO4 → C6H5COOК + К2СО3 + MnO2 + KOН + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
12 |
4 |
|
C8H10 + 5H2O — 12 e → C7H5O2— + СО32- + 15H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
С6Н5— CH2-CH3 + 4KMnO4 → C6H5COOК + К2СО3 + 4MnO2 + KOН + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5— CH2-CH3 + 4KMnO4 → C6H5COOК + К2СО3 + 4MnO2 + KOН + 2H2O
Пример 6.
С6Н5— CH2-CH2-CH3 + KMnO4 → C6H5COOК + CH3COOК + MnO2 + KOН + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
30 |
10 |
|
C9H12 + 4H2O — 10 e → C7H5O2— + CH3COО— + 12H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3С6Н5-CH2-CH2-CH3 + 10KMnO4 → 3C6H5COOК + 3CH3COOК + 10MnO2 + KOН + H2O
Уравниваем калий, водород и проверяем количество кислорода.
3С6Н5— CH2-CH2-CH3 + 10KMnO4 → 3C6H5COOК + 3CH3COOК + 10MnO2 + 4KOН + 4H2O
2.Следует обратить внимание на то, что при мягком окислении стирола перманганатом калия КMnO4 в нейтральной или слабощелочной среде происходит разрыв π -связи ,образуется гликоль (двухатомный спирт). В результате реакции окрашенный раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV).
Пример 7.
С6Н5-CH=CH2 + KMnO4 + H2O → С6Н5-CH(ОН)-CH2(ОН) + MnO2 + KOН + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
6 |
2 |
|
C8H8 + 2H2O — 2 e → C8H10O2 + 2H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3С6Н5-CH=CH2 + 2KMnO4 + H2O → 3С6Н5-CH(ОН)-CH2(ОН) + 2MnO2 + KOН + H2O
Уравниваем калий, водород и проверяем количество кислорода.
3С6Н5-CH=CH2 + 2KMnO4 + 4H2O → 3С6Н5-CH(ОН)-CH2(ОН) + 2MnO2 + 2KOН
Задания для самостоятельной работы
- Составьте уравнение окисления изопропилбензола раствором перманганата калия в кислой среде.
- Составьте уравнение окисления толуола раствором перманганата калия в нейтральной среде.
- Составьте уравнение окисления бутилбензола раствором дихромата калия в кислой среде.
- Составьте уравнение окисления пентина-2 раствором дихромата калия в кислой среде.
- Составьте уравнение окисления пентина-1 раствором перманганата калия в кислой среде.
- Составьте уравнение пропина раствором перманганата калия в кислой среде.
- Составьте уравнение окисления гексина-3 раствором дихромата калия в кислой среде.
Окисление кислородсодержащих органических соединений
1. (CH3)2C6H3C(H)O + KMnO4 + H2SO4 → (HOOC)2C6H3COOH + MnSO4 + K2SO4 + H2O
2. CH3OH + K2Cr2O7 + HCI → HCOOH + CrCI3 + KCI + H2O
3. CH3OH + KMnO4 + H2SO4 → HCOOH + MnSO4 + K2SO4 + H2O
4. C2H5OH + KMnO4 → CH3COOK + MnO2↓ + KOH + H2O
5. C2H5OH + KMnO4 + H2SO4 → CH3COOH + K2SO4 + MnSO4 + H2O
6. C2H5OH + KMnO4 → MnO2↓ + CH3C(H)O + KOH + H2O
7. C2H5OH + K2FeO4 → Fe2O3↓ + CH3C(H)O + KOH + H2O
8. C2H5OH + K2MnO4 → CH3C(H)O + MnO2↓ + KOH
9. C2H5OH + CrO3 + H2SO4 → CH3COOH + Cr2(SO4)3 + H2O
10. C2H5OH + CrO3 → CO2↑ + Cr2O3↓ + H2O
11. C2H5OH + CI2 + NaOH → CH3COONa + NaCI + H2O
12. C2H5OH + K2Cr2O7 + H2SO4 → CH3C(H)O + Cr2(SO4)3 + K2SO4 + H2O
13. CH3CH(OH)CH2─CH3 + KMnO4 → CH3C(O) ─CH2CH3 + MnO2↓ + KOH + H2O
14. HOOC─CH(CH3)CH2OH + KMnO4 + H2SO4 →
→ HOOC─CH(CH3)COOH + K2SO4 + MnSO4 + H2O
15. HOCH2CH2OH + KMnO4 → K2C2O4 + MnO2↓ + KOH + H2O
16. HC(H)O + KMnO4 + H2SO4 → HCOOH + MnSO4 + K2SO4 + H2O
17. CH3C(H)O + Cu(OH)2 + NaOH CH3COONa + Cu2O↓ + H2O
18. CH3C(H)O + KMnO4 + H2SO4 → CH3COOH + K2SO4 + MnSO4 + H2O
19. RCOCH3 + I2 + KOH → RCOOK + CH3I + KI + H2O
20. CH3COOH + KMnO4 → K2CO3 + MnO2↓ + H2O + CO2↑
21. H2C2O4 + K2Cr2O7 + H2SO4 → Cr2(SO4)3 + CO2↑ + K2SO4 + H2O
22. C6H12O6 + KMnO4 + H2SO4 → CO2↑ + MnSO4 + K2SO4 + H2O
23. C12H22O11 + KMnO4 + H2SO4 → CO2↑ + K2SO4 + MnSO4 + H2O
Окислительно-восстановительные реакции в органической химии
-
Реакции горения
Углеводороды и кислородсодержащие ― CO2 и H2O
Галогенсодержащие ― H-Hal, CO2 и H2O
Азотсодержащие ― N2, CO2 и H2O
-
Окисление углеводородов с кратной связью сильными окислителями (KMnO4 или K2Cr2O7)
Нейтральная среда:
В нейтральной среде на месте кратной связи происходит разрыв пи-связи с присоединением гидроксо-групп. За счет чего образуется многоатомный спирт.
CH3-CH=CH2 + [O] → CH3-CH(OH)-CH2(OH)
Кислая среда:
В кислой среде происходит полный разрыв кратной связи: рвется и сигма-связь, и пи-связь.
Ацетилен и этилен образуют разные продукты.
CH2=CH2 + [O] → 2CO2
CH≡CH + [O] →
Из фрагмента с одним атомом углерода всегда образуется CO2, а из двух и более атомов углерода (линейного строения) ― карбоновая кислота.
CH3-CH=CH2 + [O] → 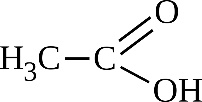

Если при кратной связи есть заместитель, то образуется кетон.
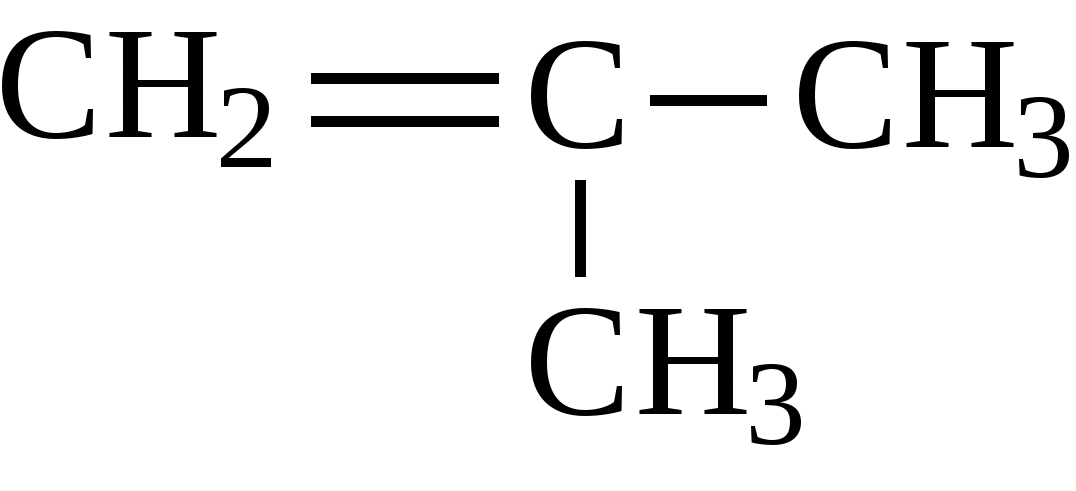
Гомологи бензола и стирол разрываются по альфа атом углерода. Оставшиеся фрагменты углерода из заместителей превращаются либо в углекислый газ, либо в карбоновую кислоту, а часть с бензолом ― всегда в бензойную кислоту.
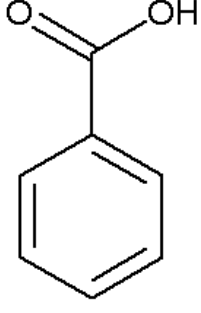
Щелочная среда:
Все то же самое, что и в кислой среде, только из-за присутствия катионов металла образуется соль карбоновой кислоты (вместо карбоновой кислоты), либо карбонат (вместо углекислого газа).
Ряд окислительно-восстановительных превращений.
первичные спирты ― альдегиды ― карбоновые кислоты ― углекислый газ
вторичные спирты ― кетоны ― углекислый газ
В окислительно-восстановительных реакциях органические вещества
чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических соединений зависит от доступности электронов при взаимодействии с окислителем. Все известные факторы, вызывающие увеличение электронной плотности в молекулах органических соединений (например, положительные индуктивный и мезомерные эффекты), будут повышать их способность к окислению и наоборот.
Склонность органических соединений к окислению возрастает с ростом их
нуклеофильности
, что соответствует следующим рядам:

Рост нуклеофильности в ряду
Рассмотрим
окислительно-восстановительные реакции
представителей важнейших классов
органических веществ
с некоторыми неорганическими окислителями.
Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
3C
2
H
4
+ 2KMnO
4
+ 4H
2
O → 3CH
2
OH–CH
2
OH + 2MnO
2
+ 2KOH
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH
3
CH=CHCH
2
CH
3
+ 8KMnO
4
+ 12H
2
SO
4
→ 5CH
3
COOH + 5C
2
H
5
COOH + 8MnSO
4
+ 4K
2
SO
4
+ 17H
2
O
2) 5CH
3
CH=CH
2
+ 10KMnO
4
+ 15H
2
SO
4
→ 5CH
3
COOH + 5CO
2
+ 10MnSO
4
+ 5K
2
SO
4
+ 20H
2
O
3) CH
3
CH=CHCH
2
CH
3
+ 8KMnO
4
+ 10KOH → CH
3
COOK + C
2
H
5
COOK + 6H
2
O + 8K
2
MnO
4
4) CH
3
CH=CH
2
+ 10KMnO
4
+ 13KOH → CH
3
COOK + K
2
CO
3
+ 8H
2
O + 10K
2
MnO
4
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:
Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH
3
C≡CH + 8KMnO
4
+ 12H
2
SO
4
→ 5CH
3
COOH + 5CO
2
+ 8MnSO
4
+ 4K
2
SO
4
+ 12H
2
O
Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO
4
→ 3KOOC –COOK +8MnO
2
+2КОН +2Н
2
О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
5CH≡CH +8KMnO
4
+12H
2
SO
4
→ 5HOOC –COOH +8MnSO
4
+4К
2
SO
4
+12Н
2
О
CH≡CH + 2KMnO
4
+3H
2
SO
4
→ 2CO
2
+ 2MnSO
4
+ 4H
2
O + K
2
SO
4
Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C
6
H
5
CH
3
+2KMnO
4
→ C
6
H
5
COOK + 2MnO
2
+ KOH + H
2
O
C
6
H
5
CH
2
CH
3
+ 4KMnO
4
→ C
6
H
5
COOK + K
2
CO
3
+ 2H
2
O + 4MnO
2
+ KOH
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
5С
6
Н
5
СН
3
+6КMnO
4
+9 H
2
SO
4
→ 5С
6
Н
5
СООН+6MnSO
4
+3K
2
SO
4
+ 14H
2
O
5C
6
H
5
–C
2
H
5
+ 12KMnO
4
+ 18H
2
SO
4
→ 5C
6
H
5
COOH + 5CO
2
+ 12MnSO
4
+ 6K
2
SO
4
+ 28H
2
O
Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C
2
H
5
OH + K
2
Cr
2
O
7
+ 4H
2
SO
4
→ 3CH
3
CHO + K
2
SO
4
+ Cr
2
(SO
4
)
3
+ 7H
2
O
С избытком окислителя (KMnO
4
, K
2
Cr
2
O
7
) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
5C
2
H
5
OH + 4KMnO
4
+ 6H
2
SO
4
→ 5CH
3
COOH + 4MnSO
4
+ 2K
2
SO
4
+ 11H
2
O
3CH
3
–CH
2
OH + 2K
2
Cr
2
O
7
+ 8H
2
SO
4
→ 3CH
3
–COOH + 2K
2
SO
4
+ 2Cr
2
(SO
4
)
3
+ 11H
2
O
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
Двухатомный спирт, этиленгликоль HOCH
2
–CH
2
OH, при нагревании в кислой среде с раствором KMnO
4
или K
2
Cr
2
O
7
легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН
2
(ОН) – СН
2
(ОН) + 8КMnO
4
+12H
2
SO
4
→ 5HOOC –COOH +8MnSO
4
+4К
2
SO
4
+22Н
2
О
3СН
2
(ОН) – СН
2
(ОН) + 8КMnO
4
→ 3KOOC –COOK +8MnO
2
+2КОН +8Н
2
О
Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO
4
, K
2
Cr
2
O
7
, [Ag(NH
3
)
2
]OH, Cu(OH)
2
. Все реакции идут при нагревании:
3CH
3
CHO + 2KMnO
4
→ CH
3
COOH + 2CH
3
COOK + 2MnO
2
+ H
2
O
3CH
3
CHO + K
2
Cr
2
O
7
+ 4H
2
SO
4
→ 3CH
3
COOH + Cr
2
(SO
4
)
3
+ 7H
2
O
CH
3
CHO + 2KMnO
4
+ 3KOH → CH
3
COOK + 2K
2
MnO
4
+ 2H
2
O
5CH
3
CHO + 2KMnO
4
+ 3H
2
SO
4
→ 5CH
3
COOH + 2MnSO
4
+ K
2
SO
4
+ 3H
2
O
CH
3
CHO + Br
2
+ 3NaOH → CH
3
COONa + 2NaBr + 2H
2
O

реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
CH
3
CH=O + 2[Ag(NH
3
)
2
]OH → CH
3
COONH
4
+ 2Ag + H
2
O + 3NH
3
CH
3
–CH=O + 2Cu(OH)
2
→ CH
3
COOH + Cu
2
O + 2H
2
O
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
5HCOH + 4KMnO
4
(
изб
)
+ 6H
2
SO
4
→ 4MnSO
4
+ 2K
2
SO
4
+ 5CO
2
+ 11H
2
O
3СН
2
О + 2K
2
Cr
2
O
7
+ 8H
2
SO
4
→ 3CO
2
+2K
2
SO
4
+ 2Cr
2
(SO
4
)
3
+ 11H
2
O
HCHO + 4[Ag(NH
3
)
2
]OH → (NH
4
)
2
CO
3
+ 4Ag↓ + 2H
2
O + 6NH
3
HCOH + 4Cu(OH)
2
→ CO
2
+ 2Cu
2
O↓+ 5H
2
O
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:
Карбоновые кислоты.
Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl
2
=CO
2
+ Hg + 2HCl
HCOOH+ Cl
2
= CO
2
+2HCl
HOOC-COOH+ Cl
2
=2CO
2
+2HCl
Муравьиная кислота
, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2↑ + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается:
HCOOH →(t) CO↑ + H2O
Каталитическое окисление алканов:
Каталитическое окисление алкенов:
Окисление фенолов:




![КMnO4K2Cr2O7Основные окислителиMnSO4MnO2K2MnO4Cr2(SO4)3Cr(OH)3K3[Cr(OH)6]O3 и... КMnO4K2Cr2O7Основные окислителиMnSO4MnO2K2MnO4Cr2(SO4)3Cr(OH)3K3[Cr(OH)6]O3 и...](https://documents.infourok.ru/8509b6c1-c05a-4b74-b1c8-29c15f3150e5/0/slide_05.jpg)




































![Реакции, вызывающие трудностиC6H5-NH2+HCl=[C6H5-NH3]ClC6H5-NH2+CH3Br=[C6H5-N... Реакции, вызывающие трудностиC6H5-NH2+HCl=[C6H5-NH3]ClC6H5-NH2+CH3Br=[C6H5-N...](https://documents.infourok.ru/8509b6c1-c05a-4b74-b1c8-29c15f3150e5/0/slide_42.jpg)