Описание презентации по отдельным слайдам:
-
1 слайд
Окислительно-восстановительные реакции в органической химии (подготовка к ЕГЭ, часть С)
-
2 слайд
Окисление этилена водным раствором перманганата калия до этиленгликоля на холоде (реакция Е.Е.Вагнера)
С-2Н2 = С-2Н2 + КMn+7O4 +Н2О → С-1Н2━С-1Н2 + Mn+4O2 + КОН
│ │
ОН ОН
2С-2 -2е →2С-1 3 окисление восстановитель
Mn+7 +3е →Мn+4 2 восстановление окислитель3СН2 = СН2 + 2КMnO4 +4Н2О → 3СН2-СН2 + 2MnO2 + 2КОН
│ │
ОН ОНЧасто в заданиях ЕГЭ части С ученикам при выполнении цепочки превращений органических веществ нужно уравнивать уравнения ОВР методом электронного баланса
-
3 слайд
С2Н4 этилен
2х+4(+1)=0
х = -2
С2Н6О2 этиленгликоль
2х+6(+1)+2(-2)=0
2х+2=0
х=-1Соединения элемента марганца
МnSО4 (кислотная среда H2SO4(р-р))
КМnO4 МnО2 ↓ (нейтральная среда Н2О)
К2МnО4 (щелочная среда КОН) -
4 слайд
Н-С-1≡С-1-Н + КMn+7O4 +Н2О →НООС+3-С+3ООН + Mn+4O2 + КОН
Окисление ацетилена водным раствором перманганата калия в щавелевую кислоту
2С-1 -8е →2С+3 3 окисление восстановитель
Mn+7 +3е →Мn+4 8 восстановление окислитель3Н-С≡С-Н + 8КMnO4 +4Н2О →3НООС-СООН + 8MnO2 + 8КОН
-
5 слайд
С2Н2 ацетилен
2х+2(+1)=0
Х=-1
С2Н2О4 щавелевая кислота
2х+2(+1)+4(-2)=0
2х=6
Х=+3 -
6 слайд
С6Н5С-2Н = С-2Н2 + КMn+7O4 +Н2О →С6Н5 С-1Н-С-1Н2 + Mn+4O2 + КОН
│ │
ОН ОН
2С-2 -2е →2С-1 3 окисление восстановитель
Mn+7 +3е →Мn+4 2 восстановление окислитель3С6Н5СН = СН2 + 2КMnO4 +4Н2О →3С6Н5 СН-СН2 + 2MnO2 + 2КОН
│ │
ОН ОН
Окисление стирола водным раствором перманганата калия до двухатомного ароматического спирта -
7 слайд
С6Н5СН = СН2 стирол можно рассматривать как производное этилена, в котором атом углерода замещен радикалом фенилом, на основании этого:
2х+4(+1)=0
Х=-2
С6Н5СН-СН2
І І
ОН ОН
двухатомный ароматический спирт можно рассматривать как производное этиленгликоля, в котором атом водорода замещен радикалом фенилом на основании этого:
2х+6(+1)+2(-2)=0
2х+2=0
Х=-1 -
8 слайд
С6Н5С-3Н3 + КMn+7O4 +Н2SO4 →С6Н5 С+3ООН + Mn+2SO4 + К2SO4 + Н2О
С-3 — 6е →С+3 5 окисление восстановитель
Mn+7 +5е →Мn+2 6 восстановление окислитель5С6Н5СН3 + 6 КMnO4 +9Н2SO4 →5С6Н5 СООН + 6MnSO4 + 3К2SO4 +14Н2О
Окисление толуола перманганатом калия в кислой среде до бензойной кислоты
-
9 слайд
Напишем структурную формулу толуола С6Н5СН3
Н
Н С НОпределим направление смещения электронных плотностей между атомами элементов вещества, исходя из предположения, что связь между атомами углерода не поляризуется:
Н
Н С НСтепень окисления углерода -3
-
10 слайд
Напишем структурную формулу бензойной кислоты С6Н5СООН
НО С = О
Определим направление смещения электронных плотностей между атомами элементов вещества, исходя из предположения, что связь между атомами углерода не поляризуется:
→
НО С = ОСтепень окисления углерода +3
-
11 слайд
С6Н5С2-3Н5+ КMn+7O4 +Н2SO4 →С6Н5 С+3ООН + Mn+2SO4 + К2SO4 + Н2О + СО2
Этилбензол можно рассматривать как производное этана С2Н6:
2х+6(+1)=0
Х=-32С-3 — 12е →2С+3 5 окисление восстановитель
Mn+7 +5е →Мn+2 12 восстановление окислитель5С6Н5С2-3Н5+12КMnO4 +18Н2SO4 →5С6Н5 С+ООН + 12MnSO4 + 6К2SO4 + +28Н2О +5СО2
Окисление этилбензола перманганатом калия в кислой среде до бензойной кислоты
-
12 слайд
СН3-С-1Н=С-1Н-СН3 + КMn+7O4 +Н2SO4 →СН3С+3ООН + Mn+2SO4 + К2SO4 + Н2О
2С-1 — 8е → 2С+3 5 окисление восстановление
Mn+7 +5е →Мn+2 8 восстановление окислитель5СН3-СН=СН-СН3 + 8КMnO4 +12Н2SO4 →10СН3СООН + 8MnSO4 + 4К2SO4 + +12Н2О
Окисление бутена -2 перманганатом калия в кислой среде до уксусной кислоты
-
13 слайд
Напишем структурную формулу бутена-2
СН3-СН=СН-СН3Определим направление смещения электронных плотностей между атомами элементов вещества, исходя из предположения, что связь между атомами углерода не поляризуется:
Н Н
СН3-С= С-СН3
Степень окисления углерода -1 -
14 слайд
СН3СН2-1ОН + КMn+7O4 → СН3С+1ОН + Mn+4O2 + КОН + Н2О
С-1 — 2е → С+1 3 окисление восстановление
Mn+7 +3е →Мn+4 2 восстановление окислитель3СН3СН2ОН + 2КMnO4 → 3СН3СОН + 2MnO2 + 2КОН + 2Н2О
Окисление этанола перманганатом калия в нейтральной среде
-
15 слайд
Напишем структурную формулу этанола
Н НН С – С – О -Н
Н Н
Определим направление смещения электронных плотностей между атомами элементов вещества, исходя из предположения, что связь между атомами углерода не поляризуется:
Н НН С-3 С-1 О Н
Н Н
Степень окисления углерода второго -1
Контрольные вопросы
? -
16 слайд
Напишем структурную формулу уксусного альдегида
НН С С = О
Н Н
Определим направление смещения электронных плотностей между атомами элементов вещества, исходя из предположения, что связь между атомами углерода не поляризуется:
Н
→
Н С-3 С+1 = ОН Н
Степень окисления углерода альдегидной группы +1
Слайд 1
Х + KMnO 4 + H 2 0 = …. + MnO 2 + KOH + KOH = …. + K 2 MnO 4 + H 2 0 + H 2 S0 4 = …. + MnS0 4 + K 2 S0 4 + H 2 0
Слайд 2
ЕН – 1 + KMnO 4 + H 2 0 = ДИОЛ + ЩЕЛОЧНАЯ СРЕДА = СОЛЬ КАРБОНОВЫХ КИСЛОТ + КАРБОНАТ + КИСЛАЯ = КАРБОНОВАЯ КИСЛОТА + СО 2
Слайд 3
ЕН – 2 + KMnO 4 + H 2 0 = ДИОЛ + ЩЕЛОЧНАЯ СРЕДА = 2 СОЛИ КАРБОНОВЫХ КИСЛОТ + КИСЛАЯ = 2 КАРБОНОВОЙ КИСЛОТЫ
Слайд 4
ЭТИЛЕН + KMnO 4 + H 2 0 = ДИОЛ + ЩЕЛОЧНАЯ СРЕДА = КАРБОНАТ КАЛИЯ + КИСЛАЯ = СО 2
Слайд 5
И Н – 1 + KMnO 4 + ЩЕЛОЧНАЯ СРЕДА = СОЛЬ КАРБОНОВЫХ КИСЛОТ + КАРБОНАТ + КИСЛАЯ = КАРБОНОВАЯ КИСЛОТА + СО 2
Слайд 6
И Н – 2 + KMnO 4 + ЩЕЛОЧНАЯ СРЕДА = 2 СОЛИ КАРБОНОВЫХ КИСЛОТ + КИСЛАЯ = 2 КАРБОНОВОЙ КИСЛОТЫ
Слайд 7
АЦЕТИЛЕН + KMnO 4 + H 2 0 = ЩАВЕЛЕВАЯ КИСЛОТА + ЩЕЛОЧНАЯ СРЕДА = ОКСОЛАТ + КИСЛАЯ = СО 2
Слайд 8
ТОЛУОЛ + KMnO 4 + H 2 0 = БЕНЗОАТ + ЩЕЛОЧНАЯ СРЕДА = БЕНЗОАТ + КИСЛАЯ = БЕНЗОЙНАЯ КИСЛОТА
Слайд 9
Э ТИЛБЕНЗОЛ + KMnO 4 + H 2 0 = БЕНЗОАТ + КАРБОНОВАЯ КИСЛОТА + ЩЕЛОЧНАЯ СРЕДА = БЕНЗОАТ + КАРБОНАТ + КИСЛАЯ = БЕНЗОЙНАЯ КИСЛОТА + СО 2
Слайд 10
ПРОПИЛБЕНЗОЛ + KMnO 4 + H 2 0 = БЕНЗОАТ + АЦЕТАТ + ЩЕЛОЧНАЯ СРЕДА = БЕНЗОАТ + АЦЕТАТ + КИСЛАЯ = БЕНЗОЙНАЯ КИСЛОТА + УКСУСНАЯ КИСЛОТА
Слайд 11
ОЛ – 1 + KMnO 4 + H 2 0 = + ЩЕЛОЧНАЯ СРЕДА = АЛЬДЕГИДЫ + КИСЛАЯ =
Слайд 12
ОЛ – 2 + KMnO 4 + H 2 0 = + ЩЕЛОЧНАЯ СРЕДА = КЕТОНЫ + КИСЛАЯ =
Слайд 13
ОЛ – 1 + KMnO 4 (ИЗБЫТОК) + H 2 0 = СОЛЬ КАРБОНОВЫХ КИСЛОТ + ЩЕЛОЧНАЯ СРЕДА = СОЛЬ КАРБОНОВЫХ КИСЛОТ + КИСЛАЯ = КАРБОНОВАЯ КИСЛОТА
Слайд 14
МЕТАНОЛ + KMnO 4 + H 2 0 = КАРБОНАТ КАЛИЯ + ЩЕЛОЧНАЯ СРЕДА = + КИСЛАЯ = СО 2
Слайд 15
АЛЬ + KMnO 4 + H 2 0 = КАРБОНОВАЯ КИСЛОТА + СОЛЬ КАРБОНОВЫХ КИСЛОТ + ЩЕЛОЧНАЯ СРЕДА = СОЛЬ КАРБОНОВЫХ КИСЛОТ + КИСЛАЯ = КАРБОНОВАЯ КИСЛОТА
Слайд 16
МЕТАНАЛЬ + KMnO 4 + H 2 0 = КАРБОНАТ КАЛИЯ + СО 2 + ЩЕЛОЧНАЯ СРЕДА = КАРБОНАТ КАЛИЯ + КИСЛАЯ = СО 2
1
Готовимся к ЕГЭ Окислительно- восстановительные реакции Из опыта работы учителя химии «МОУ СОШ 73» г. Оренбурга Кочулевой Л. Р.
2
Окислительно- восстановительные реакции (ОВР) — – химические реакции, в которых происходит изменение степеней окисления атомов, входящих в состав реагирующих веществ.
3
Степень окисления Степень окисления атомов элементов простых веществ равна нулю Степень окисления атомов элементов простых веществ равна нулю Степень окисления водорода в соединениях +1, кроме гидридов Степень окисления водорода в соединениях +1, кроме гидридов Степень окисления кислорода в соединениях -2, кроме пероксидов и соединений с фтором Степень окисления кислорода в соединениях -2, кроме пероксидов и соединений с фтором Сумма всех степеней окисления атомов в соединении равна нулю Сумма всех степеней окисления атомов в соединении равна нулю Сумма всех степеней окисления атомов в ионе равна значению заряда иона Сумма всех степеней окисления атомов в ионе равна значению заряда иона Mgº, Cl 2 º, O 2 º HCl, H 2 O, NaH H 2 O, Н 2 О 2, OF H 2 SO 4 2(+1)+6+4(-2)= SO 4 6+4(-2)=-2
4
Распознавание уравнений ОВР Запишите значения степеней окисления атомов всех элементов в уравнении реакции Запишите значения степеней окисления атомов всех элементов в уравнении реакции Определите изменяется ли степень окисления атомов элементов. Определите изменяется ли степень окисления атомов элементов PbO + 2HCl PbCl 2 + H 2 O PbO + 2HCl PbCl 2 + H 2 O Степень окисления не изменяется => реакция не окислительно- восстановительная PbO 2 + 2HCl PbCl 2 + Cl 2 + 2H 2 O PbO 2 + 2HCl PbCl 2 + Cl 2 + 2H 2 O Степень окисления изменяется => реакция окислительно-восстановительная
5
Распознавание окислителя и восстановителя SO 2 + 2H 2 S 3S + 2H 2 O SO 2 + 2H 2 S 3S + 2H 2 O SO 2 4 SO 2 4 окислитель 3 окислитель H 2 S -2 H 2 S восстановитель восстановитель
6
Метод электронного баланса SO 2 + 2H 2 S 3S + 2H 2 O SO 2 + 2H 2 S 3S + 2H 2 O _ _ 0 S S S +4 e S 1 S S S +4 e S 1 _ _ +4 0 взял e – восстановление +4 0 взял e – восстановление +4 +(-4)=0 +4 +(-4)= _ _ 0 S S S – 2 e S 2 S S S – 2 e S 2 _ _ -2 0 отдал e – окисление -2 0 отдал e – окисление -2 — (-2)= (-2)=0
7
Влияние среды на характер протекания реакции +7 Mn _ (MnO 4 ) + H H 2 O — OH 2+ Mn +6 Mn 2- (MnO 4 ) +4 MnO 2
8
Используя метод электронного баланса, составьте уравнение реакции: FeSO 4 +KMnO 4 +… …+K 2 SO 4 +K 2 MnO 4 Степень окисления Mn изменяется от +7 до +6 в щелочной среде! Степень окисления Mn изменяется от +7 до +6 в щелочной среде! FeSO 4 окисляется в щелочной среде до Fe(OH) 3 FeSO 4 окисляется в щелочной среде до Fe(OH) 3 FeSO 4 +KMnO 4 +3KOH Fe(OH) 3 +K 2 SO 4 +K 2 MnO 4 FeSO 4 +KMnO 4 +3KOH Fe(OH) 3 +K 2 SO 4 +K 2 MnO 4 FeSO 4 – восстановитель, KMnO 4 – окислитель FeSO 4 – восстановитель, KMnO 4 – окислитель
9
Используя метод электронного баланса, составьте уравнение pеакции: Zn+KMnO 4 +… …+K 2 SO 4 +MnSO 4 +Н 2 О Степень окисления Mn изменяется от +7 до +2 в кислой среде! Степень окисления Mn изменяется от +7 до +2 в кислой среде! Электронный баланс: Электронный баланс: Mn e — Mn +2 2 Mn e — Mn +2 2 Zn 0 – 2e — Zn +2 5 Zn 0 – 2e — Zn Zn+2KMnO 4 +8H 2 SO 4 5ZnSO 4 + 5Zn+2KMnO 4 +8H 2 SO 4 5ZnSO 4 + +K 2 SO 4 +2MnSO 4 +8Н 2 О
10
Используя метод электронного баланса, составьте уравнение реакции: K 2 SO 3 +KMnO 4 +… …+MnO 2 +… Степень окисления Mn изменяется от +7 до +4 в нейтральной среде! Степень окисления Mn изменяется от +7 до +4 в нейтральной среде! Электронный баланс: Электронный баланс: Mn e — Mn +4 2 Mn e — Mn +4 2 S +4 – 2e — S +6 3 S +4 – 2e — S K 2 SO 3 +2KMnO 4 +H 2 O 3K 2 SO 4 +2MnO 2 +2KОH
11
Влияние среды на характер протекания реакции +6 Cr 2- (Cr 2 O 7 ) 2- (CrO 4 ) + H H 2 O — OH 3+ Cr [Cr(OH) 6 ] 3- Cr(OH) 3
12
Используя метод электронного баланса, составьте уравнение pеакции: H 2 S+K 2 Cr 2 O 7 +… …+Cr 2 (SO 4 ) 3 +…+H 2 O Соли Cr(III) образуются в кислой среде! Соли Cr(III) образуются в кислой среде! Электронный баланс: Электронный баланс: 2Cr e — 2Cr Cr e — 2Cr +3 1 S -2 – 2e — S 0 3 S -2 – 2e — S 0 3 3H 2 S+K 2 Cr 2 O 7 +4H 2 SO 4 3H 2 S+K 2 Cr 2 O 7 +4H 2 SO 4 3S +Cr 2 (SO 4 ) 3 +K 2 SO 4 +7H 2 O
13
Используя метод электронного баланса, составьте уравнение pеакции: H 2 S+K 2 CrO 4 +… …+Cr(OH) 3 +KOH Гидроксид хрома(III) образуется в нейтральной среде. Гидроксид хрома(III) образуется в нейтральной среде. Электронный баланс: Электронный баланс: Cr +6 +3e — Cr +3 2 Cr +6 +3e — Cr +3 2 S -2 – 2e — S 0 3 S -2 – 2e — S 0 3 3H 2 S+2K 2 CrO 4 +2H 2 O 3S +2Cr(OH) 3 +4KOH
14
Используя метод электронного баланса, составьте уравнение pеакции: K 2 CrO 4 +H 2 O 2 +… K 3 [Cr(OH) 6 ]+O 2 +… Комплексный анион [Cr(OH) 6 ]3- образуется в щелочной среде. Комплексный анион [Cr(OH) 6 ]3- образуется в щелочной среде. Электронный баланс: Электронный баланс: Cr +6 +3e — Cr +3 2 Cr +6 +3e — Cr O -1 – 2e — O 2 3 2O -1 – 2e — O 2 3 2K 2 CrO 4 +3H 2 O 2 +2KOH+2H 2 O 2K 3 [Cr(OH) 6 ]+3O 2 2K 2 CrO 4 +3H 2 O 2 +2KOH+2H 2 O 2K 3 [Cr(OH) 6 ]+3O 2 Т.к. в правой части уравнения в составе гидроксокомплекса содержится уже 6 атомов водорода, вода переносится в левую часть уравнения.
15
Используя метод электронного баланса, составьте уравнение pеакции: NaCrO 2 +…+NaOH …+NaBr +H 2 O Соединения хрома(III) при окислении в щелочной среде образуют хроматы (CrO 4 2- ). Степень окисления хрома увеличивается от +3 до +6, следовательно NaCrO 2 является восстановителем, а окислителем будет служить Br 2, степень окисления которого снижается от 0 до -1. Соединения хрома(III) при окислении в щелочной среде образуют хроматы (CrO 4 2- ). Степень окисления хрома увеличивается от +3 до +6, следовательно NaCrO 2 является восстановителем, а окислителем будет служить Br 2, степень окисления которого снижается от 0 до -1. Электронный баланс: Электронный баланс: Cr +3 -3e — Cr +6 2 Cr +3 -3e — Cr +6 2 Br 2 +2e — 2Br — 3 Br 2 +2e — 2Br — 3 2NaCrO 2 +3Br 2 +8NaOH 2 Na 2 CrO 4 +6NaBr +4H 2 O 2NaCrO 2 +3Br 2 +8NaOH 2 Na 2 CrO 4 +6NaBr +4H 2 O
16
ОВР азотной кислоты
17
ОВР азотной кислоты ОВР азотной кислоты Ca + 10HNO 3 (конц.) 4Ca(NO 3 ) 2 + N 2 O + 5H 2 O 0 _ +2 0 _ +2 Ca – 2 e Ca 4 +5 _ _ +1 2N + 8 e 2N 1 Ca – восстановитель HNO 3 – окислитель Cu + 4HNO 3 (конц.) Cu(NO 3 ) 2 +2NO 2 + 2H 2 O
18
ОВР азотной кислоты S 0 + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O S 0 + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O B 0 + 3HNO 3 (конц)= H 3 B +3 O 3 + 3NO 2 B 0 + 3HNO 3 (конц)= H 3 B +3 O 3 + 3NO 2 3P 0 + 5HNO 3 + 2H 2 O = 5NO + 3H 3 P +5 O 4 3P 0 + 5HNO 3 + 2H 2 O = 5NO + 3H 3 P +5 O 4 P 0 + 5HNO 3 (конц) = 5NO 2 + H 3 P +5 O 4 +H 2 O P 0 + 5HNO 3 (конц) = 5NO 2 + H 3 P +5 O 4 +H 2 O
19
ОВР азотной кислоты ОВР азотной кислоты FeS HNO 3 (конц.) Fe(NO 3 ) 3 +2H 2 SO 4 +15NO 2 +7H 2 O +2 _ _ +3 Fe – 1 e Fe _ – 15 e 1 – 15 e 1 -1 _ _ +6 2S – 14 e 2S +5 _ _ +4 N + e N 15 N + e N 15 FeS 2 – восстановитель HNO 3 – окислитель
20
ОВР с участием органических соединений Окисление алкенов в нейтральной среде: C 2 H 4 + 2KMnO 4 + 2H 2 O CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH C 2 H 4 + 2KMnO 4 + 2H 2 O CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH Окисление алкенов в кислой среде: CH 3 CH=CH 2 +2KMnO 4 +3H 2 SO 4 CH 3 COOH +CO 2 +2MnSO 4 +K 2 SO 4 +4H 2 O CH 3 CH=CH 2 +2KMnO 4 +3H 2 SO 4 CH 3 COOH +CO 2 +2MnSO 4 +K 2 SO 4 +4H 2 O Окисление алкенов в щелочной среде: CH 3 CH=CH KMnO KOH CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4
21
Окисление алкинов в нейтральной среде: в нейтральной среде: 3CH CH +8KMnO 4 3KOOC – COOK +8MnO 2 +2КОН +2Н 2 О 2C -1 – 8e — 2C C -1 – 8e — 2C +3 3 Mn +7 +3e — Mn +4 8 Mn +7 +3e — Mn +4 8 в кислой среде: в кислой среде: 5CH CH +8KMnO 4 +12H 2 SO 4 5HOOC– COOH +8MnSO 4 +4К 2 SO 4 +12Н 2 О CH CH + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
22
Окисление гомологов бензола H O H O H C H C | | O – H | | O – H KMnO 4 + 9H 2 SO MnSO 4 + 3K 2 SO 4 +4H 2 O восстано- окисли- среда восстано- окисли- среда витель тель витель тель -3 _ _ +3 С – 6 e C 5 +7 _ _ +2 Mn + 5 e Mn 6
23
Окисление гомологов бензола Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до карбоксильных групп, остальные атомы углерода – до углекислого газа. Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до карбоксильных групп, остальные атомы углерода – до углекислого газа. 5C 6 H 5 -CH 2 CH KMnO 4 +18H 2 SO 4 5C 6 H 5 -CH 2 CH KMnO 4 +18H 2 SO 4 5С 6 Н 5 СООН+CO 2 +12MnSO 4 +6K 2 SO 4 +28H 2 O 5С 6 Н 5 СООН+CO 2 +12MnSO 4 +6K 2 SO 4 +28H 2 O C -2 -5e — C +3 5 C -2 -5e — C +3 5 C -3 -7e — C +4 C -3 -7e — C +4 Mn +7 +5e — Mn Mn +7 +5e — Mn +2 12
24
Окисление стирола В нейтральной среде: 3C 6 H 5 -CH =CH 2 +2 KMnO 4 + H 2 O 3C 6 H 5 -CH =CH 2 +2 KMnO 4 + H 2 O 3C 6 H 5 -CH(OH) -CH 2 (OH)+2MnO 2 +2KOH В кислой среде: C 6 H 5 -CH=CH 2 +2KMnO 4 +3H 2 SO 4 C 6 H 5 -CH=CH 2 +2KMnO 4 +3H 2 SO 4 С 6 Н 5 СООН+CO 2 +2MnSO 4 +K 2 SO 4 +H 2 O
25
Окисление спиртов 3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4 ) 3 + 7H 2 O 3СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 3СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 3KOOC – COOK +8MnO 2 +2КОН +8Н 2 О 5СН 2 (ОН) – СН 2 (ОН) + 8КMnO H 2 SO 4 5СН 2 (ОН) – СН 2 (ОН) + 8КMnO H 2 SO 4 5HOOC – COOH +8MnSO 4 +4К 2 SO 4 +22Н 2 О 5HOOC – COOH +8MnSO 4 +4К 2 SO 4 +22Н 2 О
26
Окисление альдегидов 3CH 3 CH=O + 2KMnO 4 = CH 3 COOH + 3CH 3 CH=O + 2KMnO 4 = CH 3 COOH + + 2CH 3 COOK + 2MnO 2 + H 2 O 3CH 3 CH=O + K 2 Cr 2 O 7 + 4H 2 SO 4 = = 3CH 3 COOH + Cr 2 (SO 4 ) 3 + 7H 2 O 3СН 2 О + 2K 2 Cr 2 O 7 + 8H 2 SO 4 = = 3CO 2 +2K 2 SO 4 + 2Cr 2 (SO 4 ) H 2 O
27
Окисление карбоновых кислот НСООН + HgCl 2 =CO 2 + Hg + 2HCl НСООН + HgCl 2 =CO 2 + Hg + 2HCl HCOOH+ Cl 2 = CO 2 +2HCl HCOOH+ Cl 2 = CO 2 +2HCl HOOC-COOH+ Cl 2 =2CO 2 +2HCl HOOC-COOH+ Cl 2 =2CO 2 +2HCl
28
Список источников и литературы Список источников и литературы 1. Ахлебинин А.К., Нифантьев Э.Е., Анфилов К.Л. Органическая химия. Решение качественных задач. – М.: Айрис-пресс, Ахлебинин А.К., Нифантьев Э.Е., Анфилов К.Л. Органическая химия. Решение качественных задач. – М.: Айрис-пресс, Габриелян О.С. Химия: пособие для школьников старших классов и поступающих в вузы. – М.: Дрофа, Габриелян О.С. Химия: пособие для школьников старших классов и поступающих в вузы. – М.: Дрофа, Слета Л.А. Химия: Справочник. – Харьков: Фолио; М.: ООО «Издательство АСТ», Слета Л.А. Химия: Справочник. – Харьков: Фолио; М.: ООО «Издательство АСТ», Новошинский И.И., Новошинская Н.С. Переходные металлы. – Краснодар: «Советская Кубань», Новошинский И.И., Новошинская Н.С. Переходные металлы. – Краснодар: «Советская Кубань», (сообщества «Химоза» и «Подготовка к ЕГЭ по химии») 5. (сообщества «Химоза» и «Подготовка к ЕГЭ по химии»)
Презентация «ОВР в органической химии» содержит информацию о способах определении степени окисления элементов в органических соединениях, видах окисления разных классов органических веществ в мягких и жестких условиях. Слайды сопровождаются заданиями для самостоятельной работы. Презентация может быть использована педагогами и учащимися 10-11 классов, в том числе и для подготовки к ЕГЭ по химии.
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Презентация по химии «ОВР в органической химии» (10 класс, химия)
ОВР в органической
химии
Коновалова Ирина Павловна,
учитель химии
муниципального бюджетного образовательного учреждения
«Средняя общеобразовательная школа №12»
Г. Урай
ХМАО – Югра
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Установите соответствие
А) HCOOH 1) 0
Б) С 2) 1; 1
В) CH2 = CH2 3) 0
Г) HCOH 4) +2
Д) CH
Е) KMnO4 6) +7
≡ CH 5) 2; 2
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Установите соответствие
А) HCOOH 1) 0
Б) С 2) 1; 1
В) CH2 = CH2 3) 0
Г) HCOH 4) +2
Д) CH
Е) KMnO4 6) +7
≡ CH 5) 2; 2
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Реакции окисления
алкенов
Продукт реакции
Двухатомные спирты
Примечание
Среда
раствора
Нейтральная, или
слабощелочная
(мягкие условия)
Кислая
2 карбоновые кислоты,
или 1 карбоновая кислота +
CO2↑
если C – C = C – C
|
C , то
→ кетон + карбоновая кислота
Cильнощелочная
2 соли,
или 1 соль + карбонат
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Этилен
2 2 +7
1 1 +4
3CH2=CH2 + 2KMnO4 + 4H2O →
→ 3CH2CH2 + 2MnO2 + 2KOH
OH OH
2C – 2e
2 1
│ │
│
3
→
2C
→
Mn
│
2
ýòèëåí +ïåðìàíãàíàò êàëèÿ.wmv
+7 +4
Mn + 3e
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Ацетилен
1 1 +7
+3 +3 +2
5CH ≡ CH + 8KMnO4 + 12H2SO4 →
→ 5HOOC COOH + 8MnSO4 +
+ 4K2SO4 + 12H2O
1 +3
+7 +2
2C
→
Mn
│
5
│
8
2C – 8e
→
Mn + 5e
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Реакции окисления
гомологов бензола
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Этилбензол
2 3 +7
+3 +4 +4
C6H5 CH2CH3 + 4KMnO4 →
→ C6H5COOK + K2CO3 + 4MnO2 +
+ KOH + 2H2O
C
C – 5e
2 +3
→
3 +4
→
C – 7e
+7 +4
Mn + 3e
C
→
Mn 12
│
│
│
3
1
│
4
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Реакции окисления
спиртов
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Этиленгликоль
1 1 +7
+3 +3 +2
5CH 2 (OH) CH2(OH) + 8KMnO4 +
+ 12H2SO4 →
→ 5HOOC COOH + 8MnSO4 +
+ 4K2SO4 + 22H2O
1 +3
+7 +2
2C
→
Mn
│
5
│
8
2C – 8e
→
Mn + 5e
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Реакции окисления
альдегидов
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Этаналь
CH3СH=O + 2Cu(OH)2 →
→ CH3COOH + Cu2O + 2H2O
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Реакции окисления
карбоновых кислот
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Муравьиная и щавелевая
кислоты
1
+3 +3 0 +4
HCOOH + Cl2
+2 0 +4 1
+ 2HCl
+ ↑
CO→
HOOC – COOH + Cl2
+ 2HCl
2
↑
2CO→
2
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Вставьте пропущенные
слова в предложения
1. При мягком окислении алкены
превращаются в …
гликоли
2. Продуктом окисления
первичных спиртов являются …
альдегиды
Презентация по химии «ОВР в органической химии» (10 класс, химия)
Вставьте пропущенные
слова в предложения
3. Альдегиды являются сильными
восстановителями
4. Приведите пример ОВРс
образованием CO2
HCOOH + Cl2
CO→ 2
↑
+ 2HCl
Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
Введите ваш emailВаш email
1.
ПОДГОТОВКА К ЕГЭ по химии
Учитель: Новикова Е.В.
МБОУ «Билютуйская СОШ»
2.
Расширить, углубить, обобщить знания
учащихся в области окислительновосстановительных реакций в органической
химии.
3.
C2H4 + KMnO4 + H2O= CH2ОН― CH2ОН + …. +KOH
2C-2 — 2ē = 2C-1 | 3 окисление
Mn+7+ 3ē = Mn+4 | 2 восстановление
3C2H4 + 2KMnO4 + 4H2O= 3CH2ОН― CH2ОН +
2MnO2 +2KOH
4.
CH3-CH=CH2 + KMnO4+H2 SO4→
CH3C OOH +CO2+K2SO4+…+H2O
C-3
-10ē →C+7
1
Mn+7 + 5ē → Mn+2 2
CH3-C-1H=C-2H2 +2 KMn +7O4+3H2 SO4→
CH3C +3OOH +C +4O2+K2SO4+
2Mn+2SO4+4H2O
Если, двойная связь находится между 1,2
атомами углерода образуется карбоновая
кислота.
5.
C2H5OH +KMnO4 + H2SO4 = CO2 +K2SO4 +
… + H2O
C-3 — 7ē = C+4
|
C-1 — 5ē = C+4
| 5 окисление
Mn+7+ 5ē = Mn+2 | 12 восстанов-е
5C2H5OH + 12KMnO4 + 18H2SO4 =
10CO2 + 6K2SO4 + 12MnSO4 + 33H2O
6.
СН3ОН+KMnO4+H2 SO4 →
НСОН+MnSO4+K2SO4+H2O
C-2
-2ē →C0
Mn+7 + 5ē → Mn+2
5
2
5С-2Н3ОН+2KMn+7O4+3H2 SO4 →
5НС0ОН+2Mn+2SO4+K2SO4+8H2O
7.
СН3-СОН +KMnO4+H2 SO4→
СН 3СООН+…..+K2SO4+H2O
C+1
-2ē →C+3 5
Mn+7 + 5ē → Mn+2 2
5СН3-С+1ОН +2KMn+7O4+3H2 SO4→
СН 3С +3 ООН+2Mn+2SO4+K2SO4+3H2O
8.
C6H5-CH3 + KMnO4 + H2SO4 = C6H5COOH + MnSO4 +
K2SO4 + H2O
В метильном радикале атом углерода притягивает
три электрона от трех атомов водорода, поэтому
его степень окисления равна -3. В карбоксиле атом
углерода отдает два электрона карбонильному
атому кислорода и один электрон атому кислорода
гидроксильной группы, поэтому степень окисления
атома углерода +3.
Mn+7 + 5e = Mn+2
C-3 – 6e = C+3
6
5
5C6H5-CH3 +6 KMnO4 + H2SO4 = 5C6H5COOH +
6MnSO4 + K2SO4 + 14H2O
9.
CH3CHO + Ag(NH3)2OH = CH3COONH4 + Ag + …
C+1 – 2e = C+3
Ag+1 + 1e = Ag0
1
2
CH3CHO + 2Ag(NH3)2OH = CH3COONH4 + 2Ag +
H2O
10.
С6Н12О6+ КМnO4 + H2SO4 = CO2 +…+…+….
Презентацию на тему «ОВР в органической химии»
можно скачать абсолютно бесплатно на нашем сайте. Предмет
проекта: Химия. Красочные слайды и иллюстрации помогут вам
заинтересовать своих одноклассников или аудиторию.
Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад — нажмите на
соответствующий текст под плеером. Презентация
содержит 16 слайд(ов).
Слайд 1
ОВР в органической химии
Слайд 2
Цель работы:
изучить и показать применение окислительно-восстановительных реакций в органической химии.
Слайд 3
Содержание
Степень окисления в органической химии Метод электронного баланса Метод полуреакций Вывод Список используемой литературы
Слайд 4
Степень окисления в органической химии
В неорганической химии степень окисления – одно из основных понятий, в органической химии – нет.
Слайд 5
Для органической химии важна не степень окисления атома, а смещение электронной плотности, в результате которого на атомах появляются частичные заряды, никак не согласующиеся со значениями степеней окисления.
Слайд 6
Метод электронного баланса
При составлении уравнений ОВР, протекающих с участием органических веществ, в простейших случаях можно применить степень окисления.
Слайд 7
CH3-CH2OH+ KMnO4 = CH3 — COOK + MnO2 + KOH + H2O Определяем степени окисления элементов C -3 H+13 — C-1H+12O-2H+1+ K+1Mn+7O-24 = C-3H+13 – C+3O-2O-2K+1 +Mn+4O-22 + K+1O-2H+1 + H+12O-2 Составляем электронные уравнения, выражающие процессы отдачи и присоединения электронов, и найдем коэффициенты при восстановителе и окислителе:
Слайд 8
C-1 — 4ē = C+3 (процесс окисления) 3 Mn+7 + 3ē =Mn+4(процесс восстановления)4 Числа 3 и 4 в электронных уравнениях справа от вертикальной черты и являются коэффициентами в уравнении реакции.
Слайд 9
В левой части уравнения пишем исходные вещества с найденными коэффициентами, а в правой – формулы образующихся веществ с соответствующими коэффициентами. 3CH3-CH2OH+ 4KMnO4 = 3CH3 — COOK + 4MnO2 + KOH + 4H2O
Слайд 10
Метод полуреакций
C6H12O6+KMnO4+H2SO4=CO2+MnSO4+K2SO4+H2O Расписываем все растворимые вещества на ионы. C6H12O6+K++MnO4-+2H++SO42-= =CO2+Mn2++SO42-+2K++SO42-+H2O 2. Выпишем отдельно ионы, которые в результате реакции претерпели изменения, и ионы, определяющие среду C6H12O6 +MnO4-+2H+= CO2+Mn2++H2O
Слайд 11
3. Надо разобраться в процессах, происшедших с ионами. Кислород, очевидно, отщепился от воды. C6H12O6 +6H2O=6CO2+24H+ Посчитать заряды левой и правой частей схемы: C6H12O6 +6H2O=6CO2+24H+ 0 +24 Они различны. Это связано с переходом электронов. C6H12O6 +6H2O-24e=6CO2+24H+
Слайд 12
Рассмотрим, что произошло с ионом MnO4-. Он превратился в Mn2+, т.е. полностью потерял 4 атома кислорода. Они будут связаны ионами водорода, которых в кислой среде избыток: MnO4-+H+=Mn2++H2O Для того чтобы связать четыре атома кислорода в молекулах воды, требуется 8 ионов H+: MnO4-+8H+=Mn2++4H2O Посчитаем заряды левой и правой частей схемы: MnO4-+8H+=Mn2++4H2O +7 +2
Слайд 13
MnO4-+8H++5e=Mn2++4H2O Изменение заряда системы от +7 до +2 связано с принятием 5 электронов (восстановление). Электроны принял ион MnO4-. Этот ион является окислителем. 5. Итак, мы получили два электронно-ионных уравнения. Запишем их вместе: MnO4-+8H++5e=Mn2++4H2O 24 C6H12O6 +6H2O-24e=6CO2+24H+ 5 Уравниваем число отданных и принятых электронов, найдя доп. множители. Теперь Умножаем каждое уравнение на свой множите и одновременно складываем их. Получаем:
Слайд 14
5C6H12O6+24MnO4-+30H2O+192 H+ = =30CO2+24Mn2++120H+ +96H2O Найдя коэффициенты перед ионами, ставим их в молекулярное уравнение: 5C6H12O6+24MnO4-+72 H+ = =30CO2+24Mn2++66H2O Найденные коэффициенты подставляем в исходное уравнение: 5C6H12O6+24KMnO4+36H2SO4= =30CO2+24MnSO4+12K2SO4+66H2O
Слайд 15
Преимущества метода полуреакций
1.Рассматриваются реально существующие ионы: MnO4-; Mn2+, и вещества C6H12O6; CO2; 2.Не нужно знать все получающиеся вещества, они появляются при его выводе. 3.При использовании этого метода нет необходимости определять степени окисления атомов отдельных элементов, что особенно важно в случае ОВР, протекающих с участием органических соединений, для которых подчас очень сложно сделать это. 4.Этот метод дает не только сведения о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда. 5. Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Слайд 16
Список использованной литературы.
Н.Б. Сухоржевская. Применение метода полуреакций в органической химии..//Приложение к газете «Первое сентября», Химия.№20,1996г. Г.М. Чернобельская, И.Н. Чертков Химия, «Учебная литература для медицинских училищ». М.: Медицина, 1986г.
Презентация — Окислительно-восстановительные реакции в органической химии
3,574
просмотра
Презентации / Химия / Окислительно-восстановительные реакции в органической химии
Текст этой презентации
Слайд 1
Окислительно-восстановительные реакции (ОВР) с участием органических веществ
Слайд 2
Горение органических веществ(полное окисление)
Реакция горения приводит к полному окислению органических веществ, в результате чего образуются СО2 и Н2О: 2С4Н10 + 13О2 = 8СО2 + 10Н2О бутан
С2Н4 + 3О2 = 2СО2 + 2Н2О этен
2С2Н2 + 5О2 = 4СО2 + 2Н2О этин
С2Н5ОН + 3О2 = 2СО2 + 3Н2О этанол
При сгорании азотсодержащих веществ выделяется также N2:
4СН3NH2 + 9O2 = 4CO2 + 10H2O + 2N2 метиламин
Горение хлорпроизводных углеводородов сопровождается выделением HСl:
2C2H5Cl + 6O2 = 4CO2 + 4H2O + 2HCl хлорэтан
Слайд 3
Алканы
При обычных условиях устойчивы к действию окислителей (растворы KMnO4, K2Cr2O7). В результате контролируемого каталитического окисления кислородом можно получить спирты, альдегиды, кетоны, карбоновые кислоты:
Слайд 4
Алкены
В зависимости от природы окислителя и условий реакции образуются различные продукты: двухатомные спирты, альдегиды, кетоны, карбоновые кислоты При окислении водным растворoм KMnO4 при комнатной температуре происходит разрыв π-связи и образуются двухатомные спирты (реакция Вагнера): Обесцвечивание раствора перманганата калия — качественная реакция на кратную связь
Слайд 5
Алкены
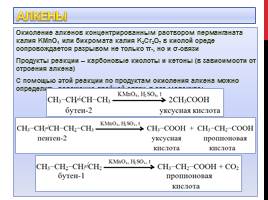
Окисление алкенов концентрированным раствором перманганата калия KMnO4 или бихромата калия K2Cr2O7 в кислой среде сопровождается разрывом не только π-, но и σ-связи
Продукты реакции – карбоновые кислоты и кетоны (в зависимости от строения алкена)
С помощью этой реакции по продуктам окисления алкена можно определить положение двойной связи в его молекуле:
Слайд 6
Алкены
Алкены разветвленного строения, содержащие углеводородный радикал у атома углерода, соединенного двойной связью, при окислении образуют смесь карбоновой кислоты и кетона:
Слайд 7
Алкены
Алкены разветвленного строения, содержащие углеводородные радикалы у обоих атомов углерода, соединенных двойной связью, при окислении образуют смесь кетонов:
Слайд 8
Алкены
В результате каталитического окисления алкенов кислородом воздуха получают эпоксиды:
В жестких условиях при сжигании на воздухе алкены, как и другие углеводороды, сгорают с образованием углекислого газа и воды:
С2Н4 + 3О2 → 2СО2 + 2Н2О
Слайд 9
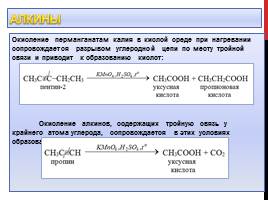
Алкины
Алкины легко окисляются перманганатом калия и бихроматом калия по месту кратной связи
При действии на алкины водным раствором KMnO4 происходит его обесцвечивание (качественная реакция на кратную связь)
При взаимодействии ацетилена с водным раствором перманганата калия образуется соль щавелевой кислоты (оксалат калия):
Слайд 10
Алкины
Окисление перманганатам калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной связи и приводит к образованию кислот: Окисление алкинов, содержащих тройную связь у крайнего атома углерода, сопровождается в этих условиях образованием карбоновой кислоты и СО2:
Слайд 11
Циклоалканы
При действии сильных окислителей (KMnO4, K2Cr2O7 и др.) циклоалканы образуют двухосновные карбоновые кислоты с тем же числом атомов углерода: Адипиновая кислота используется для производства полиамидных волокон – капрона и найлона
Слайд 12
Арены
Бензол Устойчив к окислителям при комнатной температуре
Не реагирует с водными растворами перманганата калия, бихромата калия и других окислителей
Можно окислить озоном с образованием диальдегида:
Слайд 13
Арены
Гомологи бензола
Окисляются относительно легко. Окислению подвергается боковая цепь, у толуола – метильная группа. Мягкие окислители (MnO2) окисляют метильную группу до альдегидной группы:
О //
С6Н5СН3 + MnO2 → C6H5− C Н бензальдегид
Слайд 14
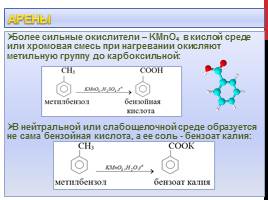
Арены
Более сильные окислители – KMnO4 в кислой среде или хромовая смесь при нагревании окисляют метильную группу до карбоксильной: В нейтральной или слабощелочной среде образуется не сама бензойная кислота, а ее соль — бензоат калия:
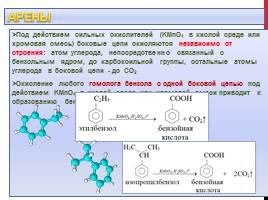
Слайд 15
Арены
Под действием сильных окислителей (KMnO4 в кислой среде или хромовая смесь) боковые цепи окисляются независимо от строения: атом углерода, непосредственно связанный с бензольным ядром, до карбоксильной группы, остальные атомы углерода в боковой цепи — до СО2 Окисление любого гомолога бензола с одной боковой цепью под действием KMnO4 в кислой среде или хромовой смеси приводит к образованию бензойной кислоты:
Слайд 16
Арены
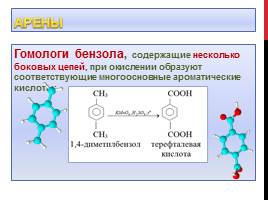
Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты:
Слайд 17
Арены
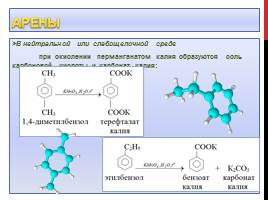
В нейтральной или слабощелочной среде при окислении перманганатом калия образуются соль карбоновой кислоты и карбонат калия:
Слайд 18
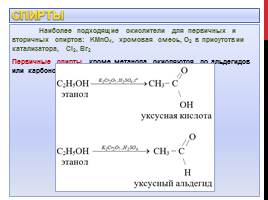
Спирты
Наиболее подходящие окислители для первичных и вторичных спиртов: KMnO4, хромовая смесь, О2 в присутствии катализатора, Cl2, Br2 Первичные спирты, кроме метанола, окисляются до альдегидов или карбоновых кислот:
Слайд 19
Спирты
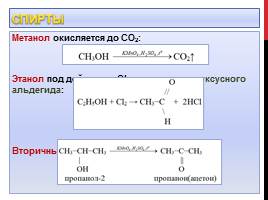
Метанол окисляется до СО2: Этанол под действием Cl2 окисляется до уксусного альдегида: Вторичные спирты окисляются до кетонов:
Слайд 20
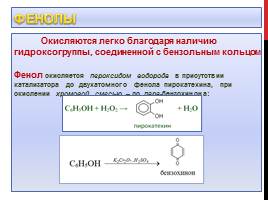
Фенолы
Окисляются легко благодаря наличию гидроксогруппы, соединенной с бензольным кольцом Фенол окисляется пероксидом водорода в присутствии катализатора до двухатомного фенола пирокатехина, при окислении хромовой смесью – до пара-бензохинона:
Слайд 21
Альдегиды и кетоны
Альдегиды окисляются легко, при этом альдегидная группа окисляется до карбоксильной: Метаналь окисляется до CО2:
Слайд 22
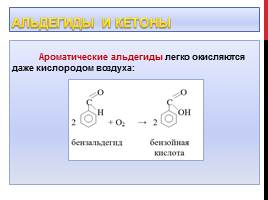
Альдегиды и кетоны
Ароматические альдегиды легко окисляются даже кислородом воздуха:
Слайд 23
Альдегиды и кетоны
Качественные реакции на альдегиды: окисление гидроксидом меди(II) реакция «серебряного зеркала»
Соль, а не кислота!
Слайд 24
Альдегиды и кетоны
Кетоны окисляются с трудом, слабые окислители на них не действуют Под действием сильных окислителей происходит разрыв С — С связей по обе стороны карбонильной группы с образованием смеси кислот (или кетонов) с меньшим числом атомов углерода, чем в исходном соединении:
Слайд 25
Альдегиды и кетоны
В случае несимметричного строения кетона окисление преимущественно осуществляется со стороны менее гидрированного атома углерода при карбонильной группе (правило Попова – Вагнера) По продуктам окисления кетона можно установить его строение:
Слайд 26
Непредельные карбоновые кислоты
Легко окисляются водным раствором KMnO4 в слабощелочной среде с образованием дигидрооксикислот и их солей: В кислой среде происходит разрыв углеродного скелета по месту двойной связи С=С с образованием смеси кислот:
Слайд 27
Щавелевая кислота
Легко окисляется под действием KMnO4 в кислой среде при нагревании до CО2 (метод перманганатометрии): При нагревании подвергается декарбоксилированию (реакция диспропорционирования): В присутствии концентрированной H2SO4 при нагревании щавелевая кислота и ее соли (оксалаты) диспропорционируют: