Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
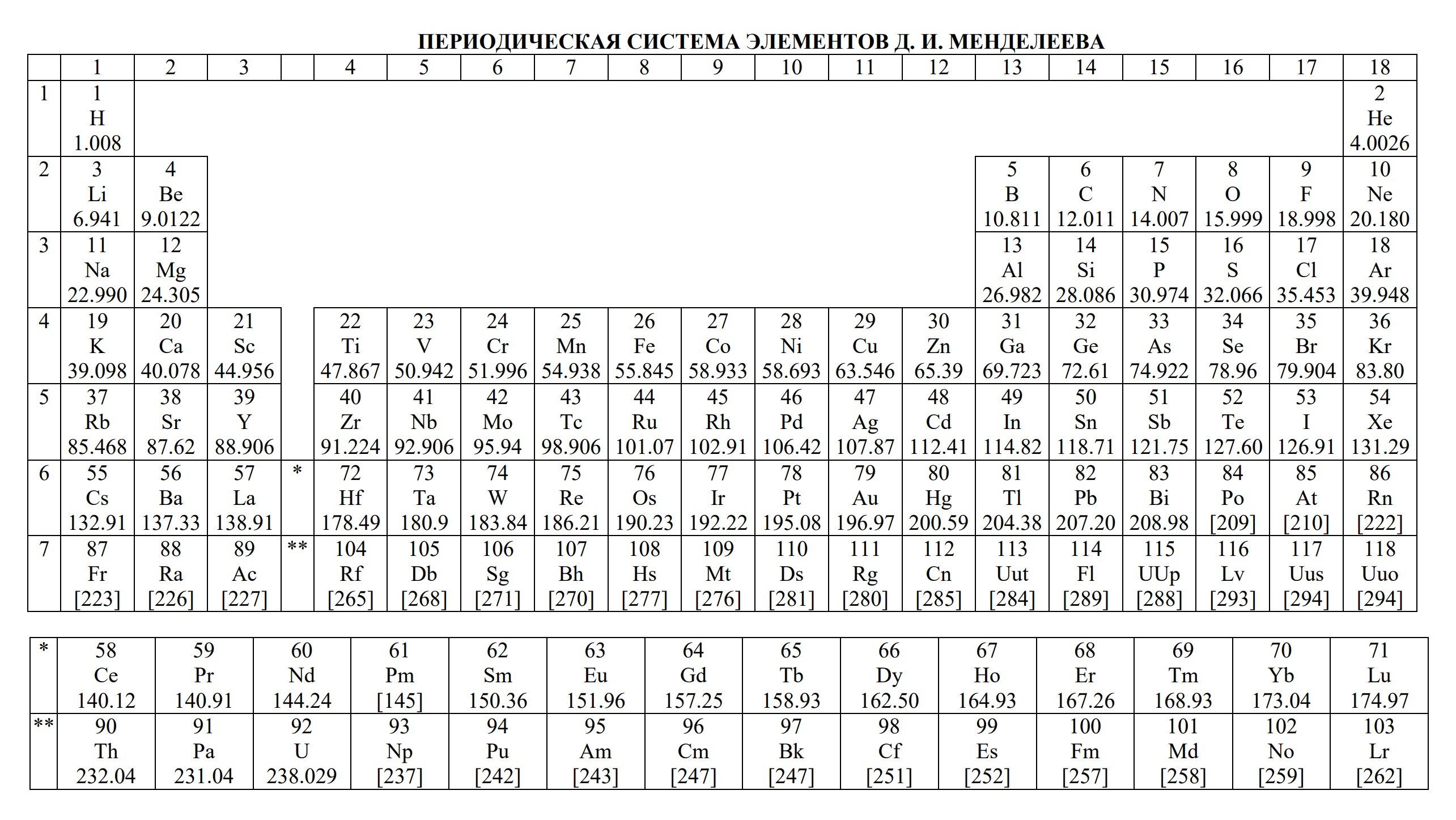
- периодическая система химических элементов Д.И. Менделеева
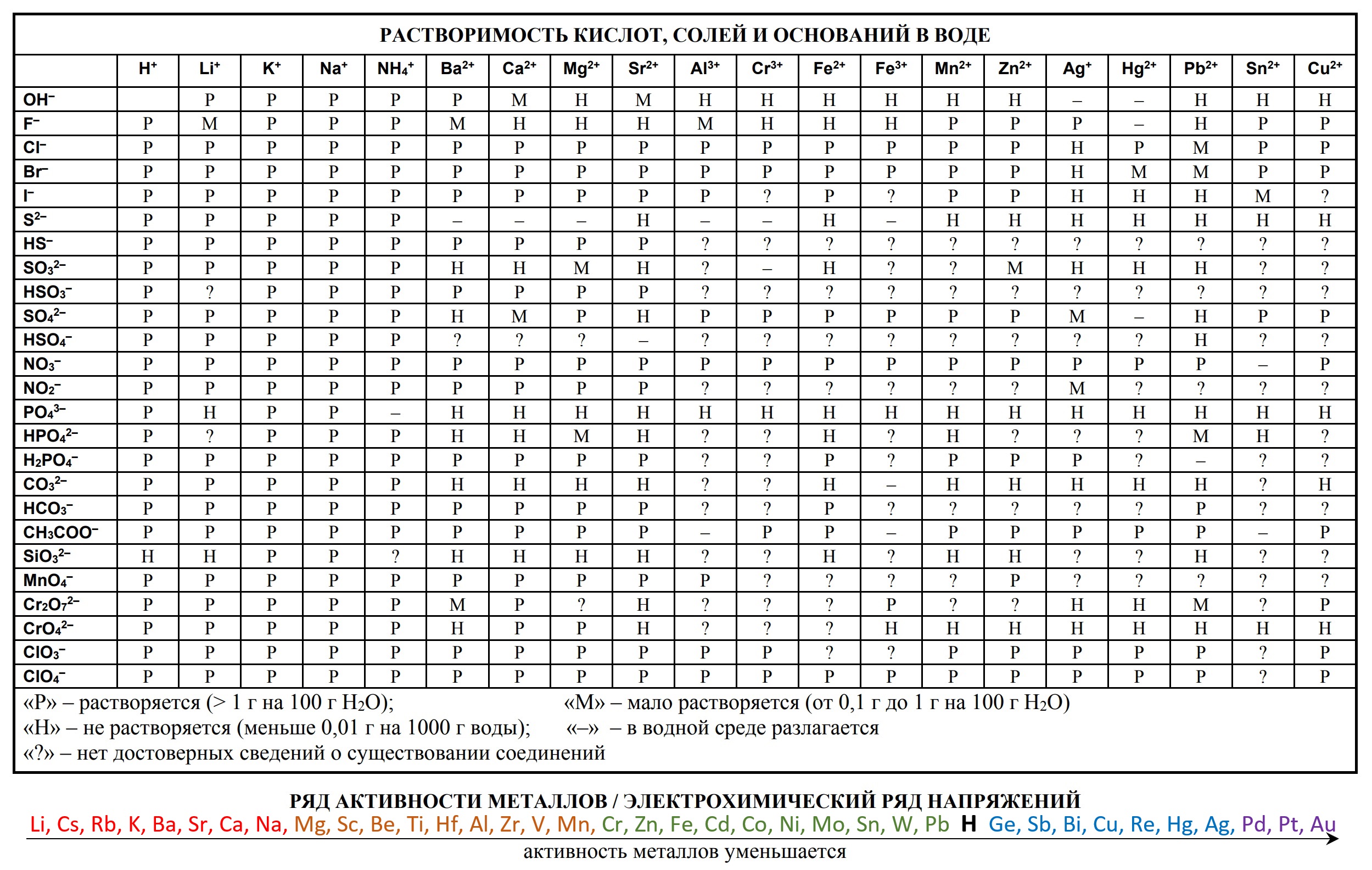
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
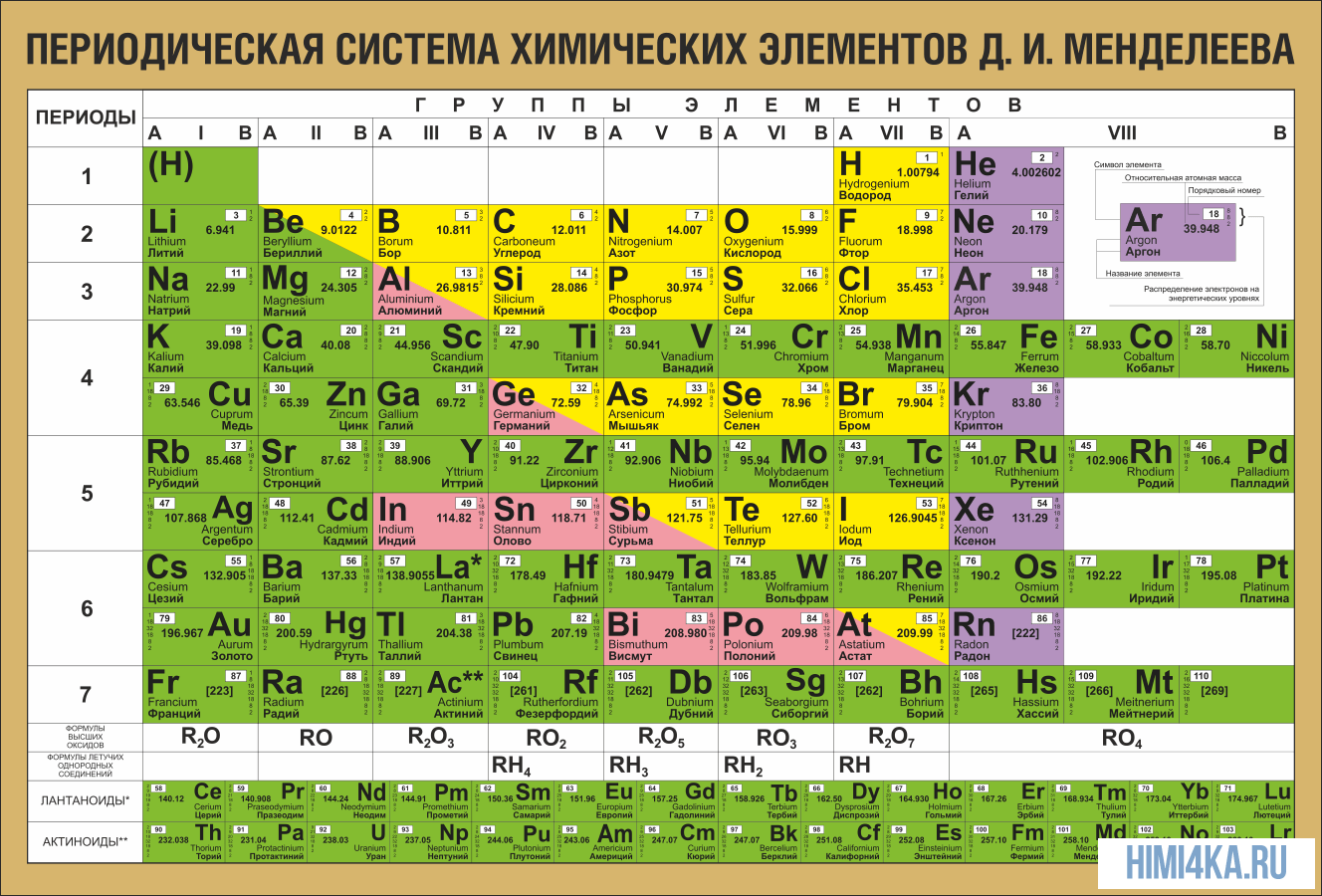
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
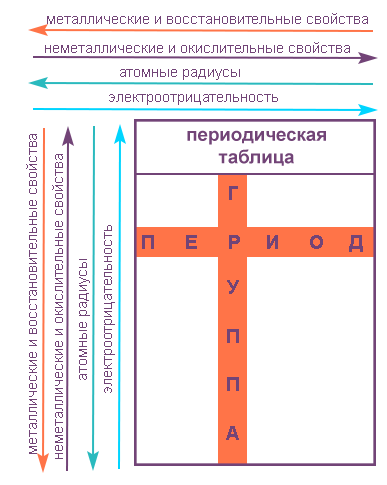
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Периодическая таблица химических элементов менделеева для печати как на егэ
Таблица Менделеева в хорошем качестве
Периодическая таблица химических элементов Д. И. Менделеева в высоком разрешении для качественной печати. Таблицу можно распечатать на листе бумаги формата А4, а так же в большого размера для оформления кабинета Химии.
Чтобы скачать и распечатать картинку — выберите нужный вариант таблицы и нажмите на изображение.
Второй вариант оформления таблицы Менделеева. Картинка в высоком разрешении для печати большого формата:
© 2016-2022 PrintFiles. ru — Файлы для распечатки
Все графические и текстовые материалы сайта PrintFiles. ru защищены российскими и международными законами и соглашениями об охране авторских прав и интеллектуальной собственности (статьи 1259 и 1260 главы 70 «Авторское право» Гражданского Кодекса Российской Федерации от 18 декабря 2006 года N 230-ФЗ).
Посетителям сайта разрешается использовать материалы сайта в некоммерческих целях.
Размещение материалов этого сайта на других ресурсах в интернете без разрешения владельцев запрещено!
Посетителям сайта разрешается использовать материалы сайта в некоммерческих целях.
Printfiles. ru
19.08.2017 12:59:07
2020-12-07 14:24:52
Источники:
Https://printfiles. ru/raspechatat/tablitsa-mendeleeva/
Периодическая таблица Менделеева — ЕГЭ-апрель 2021 » /> » /> .keyword { color: red; } Периодическая таблица химических элементов менделеева для печати как на егэ
Периодическая таблица Менделеева
Периодическая таблица Менделеева
Таблица Менделеева является фундаментом нашего современного знания о химии.
Содержание:
- Сколько элементов в таблице Менделеева? Классический вид периодической таблицы Менделеева Таблица Менделеева для ЕГЭ по химии Периодический закон Менделеева
Сколько элементов в таблице Менделеева?
Ответ: 118 или 126 элементов в зависимости от вида таблицы.
Почему такая разница?
В природе люди обнаружили 94 элемента. Другие 24 элемента были созданы в лабораториях. Всего получается 118 штук. Еще 8 элементов являются лишь гипотетическими вариантами.
Классический вид периодической таблицы Менделеева
Таблица Менделеева для ЕГЭ по химии
Ниже приведена таблица, которую можно использовать на ЕГЭ по химии, входит в пакет разрешенных документов.
Периодический закон Менделеева
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д. И. Менделеева:
«Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов».
Современная:
«Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)».
Ниже приведена таблица, которую можно использовать на ЕГЭ по химии, входит в пакет разрешенных документов.
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д. И. Менделеева:
«Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов».
Современная:
«Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)».
Содержание:
Классический вид периодической таблицы Менделеева
Всего получается 118 штук.
Bingoschool. ru
Черно-белая таблица менделеева для егэ по химии
Таблица Менделеева на ЕГЭ 2020 год и таблица растворимости кислот – версия для печати по всем стандартам для экзамена.
На государственный экзамен по химии можно будет взять следующие вещи:
- Калькулятор (простой или инженерный без функции текстовой памяти и кнопки PRG, PR илиProgram);Таблицу Менделеева, таблицу растворимости кислот и ряд активности металлов ( ВСЕ для печати в формате World (.doc ) : Скачать файл: tablica-mendeleeva-ege-standart. zip [434,35 Kb] (cкачиваний: 189)
Согласно стандартам, на самом экзамене таблицы должна выдавать школа, где проводится ЕГЭ. Они идут с печатями, как и черновики. Либо ламинированные, чтобы ничего нельзя было написать, передать другому и так далее.
Зачем нужно иметь под рукой свои таблицы? Прежде всего, для подготовки. Если начать сразу пользоваться черно-белым вариантом, приучать себя к стандартизированной информации, то никакого дискомфорта во время сдачи не будет.
По поводу калькулятора на ЕГЭ по химии – Министерство образования опубликовало список рекомендуемых моделей
Однако, главное – отсутствие функций программирования. Если проверяющий начинает высказывать претензии, требуйте письменное обоснование.
Можно ли брать свою таблицу и наносить не нее шпаргалки?
На всякий случай взять стоит. Вдруг организаторам ЕГЭ придет в голову повесить в классе общую таблицу Менделеева, а у вас будет плохое зрение. Тогда по договоренности могут разрешить использовать обычный бумажный вариант, поставив на него штамп.
А вот шпаргалки писать нельзя – сразу выведут с экзамена. Вообще, учитывая строгость правил, лучше полностью соблюдать дисциплину. Мелкий почерк, нацарапанные иголкой формулы – все это давно не прокатывает.
Чтобы подготовиться к экзамену по химии и сдать его отлично, необходимо приобрести или взять в библиотеке 2-3 сборника типовых тестов ЕГЭ. И прорешать их полностью, за месяц это сделать вполне реально!
Наша таблица Менделеева будет вовремя обновляться по мере обновления информации и поступления сведений ФИПИ.
Согласно стандартам, на самом экзамене таблицы должна выдавать школа, где проводится ЕГЭ. Они идут с печатями, как и черновики. Либо ламинированные, чтобы ничего нельзя было написать, передать другому и так далее.
Можно ли брать свою таблицу и наносить не нее шпаргалки?
На всякий случай взять стоит. Вдруг организаторам ЕГЭ придет в голову повесить в классе общую таблицу Менделеева, а у вас будет плохое зрение. Тогда по договоренности могут разрешить использовать обычный бумажный вариант, поставив на него штамп.
А вот шпаргалки писать нельзя – сразу выведут с экзамена. Вообще, учитывая строгость правил, лучше полностью соблюдать дисциплину. Мелкий почерк, нацарапанные иголкой формулы – все это давно не прокатывает.
Чтобы подготовиться к экзамену по химии и сдать его отлично, необходимо приобрести или взять в библиотеке 2-3 сборника типовых тестов ЕГЭ. И прорешать их полностью, за месяц это сделать вполне реально!
Наша таблица Менделеева будет вовремя обновляться по мере обновления информации и поступления сведений ФИПИ.
По поводу калькулятора на ЕГЭ по химии – Министерство образования опубликовало список рекомендуемых моделей
Можно ли брать свою таблицу и наносить не нее шпаргалки?
Либо ламинированные, чтобы ничего нельзя было написать, передать другому и так далее.
Novosti-online. info
Новости
Таблицы для ЕГЭ по химии
Различные таблицы и справочные материалы занимают важную роль при подготовке к ЕГЭ по химии. В них собрана вся самая важная и нужная информация в сжатом формате, что помогает быстро найти ответ, не заучивая целые параграфы из учебников.
Таблицы, необходимые на ЕГЭ по химии 2019
На сдаче ЕГЭ по химии разрешено использование трёх таблиц: периодической системы химических элементов Д. И. Менделеева, таблицы растворимости и ряда активности металлов. Они содержат в себе 80% информации, необходимой для решения большинства заданий.
1. Периодическая система химических элементов Д. И. Менделеева верный друг каждого химика. В ней содержатся основные сведения обо всех известных химических элементах.
Но нужно понимать, что эта таблица поможет только тому, кто разбирается в основных свойствах элементов и знает, что в ней искать. Для этого нужно быть знакомым с такими понятиями, как электроотрицательность, валентность, степень окисления, строение атома.
2. Таблица растворимости солей, кислот и оснований в воде. Одно из условий протекания реакции – выпадение осадка. Именно таблица растворимости даёт возможность узнать образует то или иное вещество осадок, а, следовательно, протекает реакция или нет. Для того, чтобы установить факт растворимости вещества в воде по таблице, необходимо выбрать необходимые катион и анион, а затем прочитать символ, находящийся в месте их пересечения.
3. Электрохимический ряд напряжений металлов – последовательность, которая представляет сравнительную активность металлов в окислительно-восстановительных реакциях в водной среде. Активность металла характеризует его реакционную способность: чем легче атом отдаёт электроны, тем активнее его восстановительная способность. Элементы, находящиеся в таблице до водорода, являются активными, после водорода – неактивными. Измерение электрохимического потенциала металлов на практике производится с помощью стандартного водородного электрода, поэтому водород присутствует в ряду напряжений.
Эта таблица используется для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот, а также для оценки катодно-анодных процессов при электролизе и оценки возможности протекания ОВР с участием металлов.
Справочные материалы для ЕГЭ по химии в таблицах
Для качественной и продуктивной подготовки к экзамену по химии школьники используют различные справочные материалы. Самый удобный способ запоминания важных аспектов – использование справочных материалов в формате таблиц. Они содержат в себе максимальное количество полезной, заранее структурированной информации.
Формулы и названия наиболее распространённых кислот и солей
Тривиальные названия неорганических веществ
Еще по этой теме:
Серная кислота
Основные сведения о серной кислоте: свойства, получение, применение.
Теперь «ХиШник» стал полностью бесплатным
Как развивалось приложение все эти годы, и почему мы им так гордимся.
Азотная кислота
Статья содержит основную информацию об азотной кислоте: её свойства, получение и применение.
Диены
Основные сведения о диеновых углеводородах: номенклатура и изомерия, классификация, химические свойства, получение.
Правило Марковникова
Правило Марковникова: формулировка, механизм протекания реакций, исключения из правила.
Внеклассное мероприятие по химии
Идеи интересных внеклассных мероприятий по химии.
Формулы для решения задач по химии
Перечень основных формул, которые используются при решении школьных задач по химии.
Химические профессии
Обзор необычных профессий, связанных с химией.
ЕГЭ по химии 2019
Основная информация о ЕГЭ по химии 2019: структура экзамена, баллы, даты проведения.
Критерии оценивания ОГЭ по химии, баллы 2019
Подробно расскажем о баллах ОГЭ по химии 2019, методах и критериях оценивания заданий и переводе первичных баллов в школьную оценку.
Изменения ОГЭ по химии в 2019 году
Расскажем об изменениях, которые ждут школьников при сдаче ОГЭ по химии в 2019 году.
Подготовка к ОГЭ по химии
Несколько советов и рекомендаций, следуя которым подготовка к ОГЭ по химии будет проходить результативно.
Онлайн тесты по химии
Немного информации о проверке знаний с помощью тестов по химии в режиме онлайн.
Все об ОГЭ по химии в 2019
Основные сведения об ОГЭ по химии 2019: даты, время, баллы, материалы для подготовки.
Тест по химии 11 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 11 классе.
Тест по химии 10 класс
Общие сведения о тестах по химии в 10 классе.
Тест по химии 9 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 9 классе.
Тест по химии 8 класс
Рассказываем в общих чертах о тестах по химии в 8 классе
Ионная связь
Статья, содержащая в себе базовые понятие об ионном виде химической связи.
Водородная связь
Статья о водородном типе химической связи и его особенностях.
Подготовка к ЕГЭ по химии с нуля
В статье дано несколько действенных советов по подготовке к ЕГЭ по химии «с нуля».
Металлическая связь
Продолжаем серию статей про виды химической связи.
Ковалентная связь
Начинаем серию статей про виды химической связи.
Шкала перевода баллов ЕГЭ по химии 2018
Отвечаем на вопросы о системе оценивания и переводе первичных баллов в тестовые.
Учимся на летних каникулах
Размышляем о том, как полезно провести время во время летнего отдыха на каникулах. (в статье есть подарок внимательным читателям)
«ХиШник» приехал на Сахалин!
Этим летом открывается очередная летняя сессия областной профильной школы для одаренных детей «Эврика».
Мой сын увлёкся химией, что делать?
Собрали ТОП-5 полезных материалов для старшеклассника.
Двенадцать сервисов для изучения химии, с которыми ты точно сдашь
Великолепная подборка полезных сайтов для самостоятельного изучения химии.
О правах и обязанностях в школе: почему необходимо сотрудничество учеников и учителей
Что такое право само по себе и откуда оно берется. Как не заработать славу скандалистов, «вечно качающих права», и при этом не переносить безропотно нарушение своих личных границ…
Современный задачник по химии
Материал о том, какие виды задачников по химии существуют и как среди них ориентироваться.
Выбираем репетитора по химии: инструкция
Или не выбираем
Научиться решать задачи по химии легко: следуем инструкции
Учимся решать задачи по химии к ОГЭ, ЕГЭ, инструкция от ХиШника
Изменения в ЕГЭ по химии 2018 года, новая демоверсия, спецификация, кодификаторы ЕГЭ
ФИПИ снова решил усложнить нам жизнь новыми требованиями к ЕГЭ. О том, почему изменения не всегда плохи, и как встретить их с достоинством.
Обновление в демонстрационной версии «ХиШника»
Мы расширили приветственное окно, чтобы при входе в приложение всем новым пользователям были понятны основные принципы работы «ХиШника».
Активация лицензионного ключа и первые шаги в «ХиШнике».
Что такое лицензионный ключ и как происходит его активация в приложении
Современный урок химии по ФГОС
Для чего нужны стандарты, по которым происходит обучение химии в российских школах, и как приложение “ХиШник” поможет соответствовать этим стандартам?
ХиШник в школе: ИКТ на уроках химии
Как наше приложение поможет внедрить ИКТ в уроки
Ура! Новые планы ХиШника и подарочки
Подводим итоги 2017, планируем 2018 и, конечно же, дарим подарки!
Родина приложения «ХиШник» – Новосибирский Академгородок
Почему же родиной «ХиШника» стал Новосибирский Академгородок?
Совпадение не случайное.
Можно ли просматривать историю решения задач учениками в онлайн-режиме?
Итак, «ХиШник» это приложение, в котором могут работать и ученики, и преподаватели. После того, как преподаватель создает в приложении учебную группу
Можно ли заниматься в «ХиШнике» со смартфона/планшета?
Сегодня у нас вопрос, которого мы давно ждали: можно ли заниматься в «ХиШнике» со смартфона/планшета?
Семинар от «ХиШника» на КПК для учителей химии
На прошлой неделе мы провели семинар в рамках масштабных ежегодных курсов повышения квалификации на базе СУНЦ НГУ (Новосибирск, Академгородок).
Команда «ХиШника» провела мастер-класс для преподавателей химии и методистов
Вчера команда «ХиШника» провела мастер-класс для преподавателей химии и методистов программ повышения квалификации из разных регионов России.
Как купить полный доступ к приложению?
Сегодня новый вопрос: что делать, если решать задачи в демо-версии приложения понравилось, как получить полный доступ? Отвечаем!
«ХиШник» представляет два кейса на ярмарке кейсов «Школа реальных дел»
Ярмарка кейсов «Школы реальных дел» – уже в эту пятницу! В этом году «ХиШник» представляет два кейса.
Служба поддержки:
Support@hishnik-school. ru
Для СМИ:
Onp@alekta. ru
Спасибо!
От 01.01.2017 года
Настоящее пользовательское (лицензионное) соглашение (далее – «Соглашение») заключается между Обществом с ограниченной ответственностью «АЛЕКТА» (далее – «Лицензиар»), и Пользователем (физическим лицом, выступающем в роли конечного потребителя Продукта) совместно именуемые «Стороны».
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а также соответствующими условиями лицензионного соглашения, изложенными ниже.
Расскажем об изменениях, которые ждут школьников при сдаче ОГЭ по химии в 2019 году.
Спасибо!
От 01.01.2017 года
Настоящее пользовательское (лицензионное) соглашение (далее – «Соглашение») заключается между Обществом с ограниченной ответственностью «АЛЕКТА» (далее – «Лицензиар»), и Пользователем (физическим лицом, выступающем в роли конечного потребителя Продукта) совместно именуемые «Стороны».
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а также соответствующими условиями лицензионного соглашения, изложенными ниже.
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Изменения ОГЭ по химии в 2019 году
Формулы для решения задач по химии.
Hishnik-school. ru
Novosti-online. info
Новости
Различные таблицы и справочные материалы занимают важную роль при подготовке к ЕГЭ по химии. В них собрана вся самая важная и нужная информация в сжатом формате, что помогает быстро найти ответ, не заучивая целые параграфы из учебников.
Таблицы, необходимые на ЕГЭ по химии 2019
На сдаче ЕГЭ по химии разрешено использование трёх таблиц: периодической системы химических элементов Д. И. Менделеева, таблицы растворимости и ряда активности металлов. Они содержат в себе 80% информации, необходимой для решения большинства заданий.
1. Периодическая система химических элементов Д. И. Менделеева верный друг каждого химика. В ней содержатся основные сведения обо всех известных химических элементах.
Но нужно понимать, что эта таблица поможет только тому, кто разбирается в основных свойствах элементов и знает, что в ней искать. Для этого нужно быть знакомым с такими понятиями, как электроотрицательность, валентность, степень окисления, строение атома.
2. Таблица растворимости солей, кислот и оснований в воде. Одно из условий протекания реакции – выпадение осадка. Именно таблица растворимости даёт возможность узнать образует то или иное вещество осадок, а, следовательно, протекает реакция или нет. Для того, чтобы установить факт растворимости вещества в воде по таблице, необходимо выбрать необходимые катион и анион, а затем прочитать символ, находящийся в месте их пересечения.
3. Электрохимический ряд напряжений металлов – последовательность, которая представляет сравнительную активность металлов в окислительно-восстановительных реакциях в водной среде. Активность металла характеризует его реакционную способность: чем легче атом отдаёт электроны, тем активнее его восстановительная способность. Элементы, находящиеся в таблице до водорода, являются активными, после водорода – неактивными. Измерение электрохимического потенциала металлов на практике производится с помощью стандартного водородного электрода, поэтому водород присутствует в ряду напряжений.
Эта таблица используется для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот, а также для оценки катодно-анодных процессов при электролизе и оценки возможности протекания ОВР с участием металлов.
Справочные материалы для ЕГЭ по химии в таблицах
Для качественной и продуктивной подготовки к экзамену по химии школьники используют различные справочные материалы. Самый удобный способ запоминания важных аспектов – использование справочных материалов в формате таблиц. Они содержат в себе максимальное количество полезной, заранее структурированной информации.
Формулы и названия наиболее распространённых кислот и солей
Тривиальные названия неорганических веществ
Bingoschool. ru
Современный задачник по химии.
Dankonoy. com
11.08.2018 11:16:46
2018-08-11 11:16:46
Источники:
Https://dankonoy. com/ege/ege2/archives/27077
Таблица Менделеева, химические элементы » /> » /> .keyword { color: red; } Периодическая таблица химических элементов менделеева для печати как на егэ
Таблица Менделеева
Таблица Менделеева
Таблица Менделеева — общепринятое графическое выражение Периодического закона, открытого Д. И. Менделеевым в 1869 г. Первоначальный вариант таблицы был разработан Менделеевым в 1869—1871 годах. За время существования было предложено более сотни вариантов её изображения, однако наиболее общепринятый вариант представляет собой двумерную таблицу в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Мы постарались описать основные химические элементы Таблицы Менделеева, для подробной информации о них переходите по соответствующей ссылке в таблице. Обращаем ваше внимание, что целью нашего сайта Занимательная химия не является описание химических элементов с научной точки зрения, мы больше сконцентрировались на интересных фактах, которые будут интересны даже детям, не углубляясь в непонятные термины и цифры. Однако, для каждого элемента приводится краткое описание химических свойств в простой и доступной форме.
| ГРУППЫ ЭЛЕМЕНТОВ | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||
| 1 H Водород |
2 He Гелий |
||||||||
| 3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 С Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||
| 11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||
| 19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
| 29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
||
| 37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
43 Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
| 47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
||
| 55 Cs Цезий |
56 Ba Барий |
57 La Лантан × |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
| 79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
84 Po Полоний |
85 At Астат |
86 Rn Радон |
||
| 87 Fr Франций |
88 Ra Радий |
89 Ac Актиний ×× |
104 Rf Резерфордий |
105 Db Дубний |
106 Sg Сиборгий |
107 Bh Борий |
108 Hs Хассий |
109 Mt Мейтнерий |
110 Ds Дармштадтий |
| 111 Rg Рентгений |
112 Сn Коперниций |
113 Nh Нихоний |
114 Fl Флеровий |
115 Mc Московий |
116 Lv Ливерморий |
117 Tn Теннесин |
118 Og Оганессон |
| 57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
61 Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмий |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
| 89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
93 Np Нептуний |
94 Pu Плутоний |
95 Am Америций |
96 Cm Кюрий |
97 Bk Берклий |
98 Cf Калифорний |
99 Es Эйнштейний |
100 Fm Фермий |
101 Md Менделевий |
102 No Нобелий |
103 Lr Лоуренсий |
Таблица Менделеева и её значение
Открытие Периодического закона стало важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях была создана стройная таблица Менделеева, на основе которой стало возможным обобщать, делать выводы и предвидеть открытие новых химических элементов.
Список химических элементов Таблицы Менделеева
Список химических элементов упорядочен в порядке возрастания атомных номеров, приводятся обозначения элемента в Таблице Менделеева, латинское и русское названия.
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперници й |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннесин |
| 118 | Og | Oganesson | Оганессон |
Таблица Менделеева в хорошем качестве
Предлагаем вам скачать несколько вариантов таблицы Менделеева в хорошем качестве, которые можно распечатать на принтере большого формата, как в черно-белом так и в цветном вариантах.
Таблица Менделеева в хорошем качестве.
Www. alto-lab. ru
05.09.2018 15:57:45
2018-01-12 17:23:30
Источники:
Https://www. alto-lab. ru/tablica-mendeleeva/
Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе, что значительно облегчит решение задач. Более того, периодическую систему можно использовать на ЕГЭ, и это может стать серьезным подспорьем. Главное — уметь грамотно ей пользоваться. Как это делать — читайте в нашей статье.
Таблица Менделеева — краткое описание
Таблица Менделеева — это графическое выражение периодического закона, который открыл русский ученый Д.И. Менделеев в 1869 году. Периодическая система представляет собой классификацию химических элементов, которая основана на зависимости свойств химических элементов от заряда их атомного числа. Первоначальный вариант предполагал зависимость свойств веществ от их атомной массы.
Существуют три формата таблицы Менделеева:
- короткий (короткопериодный);
- длинный (длиннопериодный);
- сверхдлинный.
Международным союзом теоретической и прикладной химии (ИЮПАК) в качестве основного утвержден длинный вариант таблицы Менделеева, а короткий вариант официально отменен в 1989 году.
Пустые ячейки в таблице
Создав периодическую таблицу в 1869 году на базе уже известных миру 63-х химических элементов, Менделеев предсказал открытие новых и оставил для них пустые ячейки в таблице. Русский ученый оказался прав. Гипотеза Менделеева в скором времени была подтверждена открытиями других ученых: в 1875 году был открыт галлий, в 1879 — скандий, в 1886 — германий. На 2023 год в таблицу собраны 118 известных элементов. Последние из них открыты в 2016 году: ученые обнаружили нихоний, московий, теннессин и оганесон.
Структура таблицы
В таблице Менделеева химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы. Таблица состоит из семи периодов и восьми групп.
Периоды — это горизонтальные ряды в таблице.
Элементы, которые относятся к одному периоду, показывают следующие закономерности с увеличением их порядкового номера:
- Возрастает электроотрицательность.
- Металлические свойства убывают, неметаллические возрастают.
- Атомный радиус падает.
Периоды в таблице делятся на:
- малые;
- большие.
Малыми называются периоды, которые содержат небольшое количество элементов. Это первый, второй и третий периоды, первый состоит из 2-х, второй и третий из 8 элементов.
Все остальные периоды — это большие периоды. Четвертый и пятый состоят из 18 элементов, шестой — из 32-х, седьмой — из 24-х.
В нижней части таблицы Менделеева расположены химические вещества, которые называются лантаноидами и актиноидами.
Таблица периодической системы содержит десять рядов. Малые периоды состоят из одного ряда, большие периоды содержат по два ряда. В седьмом периоде находится один ряд.
Каждый большой период состоит из четного и нечетного рядов. В четных рядах содержатся металлы, в нечетных рядах — неметаллы.
Периодическая система начинается водородом — первым химическим элементом, а заканчивается на сегодняшний день 118-м — оганесоном. Ученые утверждают, что таблица не закончена, идет активный поиск 119-го элемента.
Группы элементов с похожими свойствами
Группа — это вертикальная колонка в периодической таблице, определяющая основные физико-химические свойства элементов. Вещества, принадлежащие к одной и той же группе, обладают похожими химическими особенностями и демонстрируют одинаковую закономерность в изменении своих свойств по мере увеличения атомного числа.
Всем группам (колонкам таблицы) присваиваются номера от 1 до 18 — слева направо (от щелочных металлов к благородным газам). Такая система вступила в силу в 1988 году по инициативе ИЮПАК. Все прежние названия групп, которые использовали в разных странах, больше не употребляются.
Элементы, которые относятся к одной группе, показывают следующие закономерности по направлению сверху вниз:
- Возрастает радиус атома элементов в рамках одной группы.
- Усиливаются металлические свойства элементов и ослабевают неметаллические.
- Падает электроотрицательность.
Цветовое определение групп
Вещества в каждой группе делятся на те, которые находятся в главной подгруппе и те, которые входят в побочную подгруппу. В таблице составляющие побочной группы выделяются синим цветом, к ней относятся элементы только больших периодов (начинаются с четвертого периода). В главную подгруппу могут входить элементы и малых, и больших периодов (начинаются с первого или второго периодов).
Различение металлов, металлоидов и неметаллов
Все химические элементы в зависимости от их химических и физических свойств можно разделить на 3 типа:
- металлы;
- металлоиды;
- неметаллы.
Характеристика металлов (например, медь, алюминий, золото):
- Хорошая электро- и теплопроводность.
- Способность отражать свет (яркий внешний вид).
- Высокая температура плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Пластичность и податливость.
Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Их характеризуют:
- Неспособность проводить тепло и электричество.
- Разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Значительно более низкая температура плавления в сравнении с металлами.
- Хрупкость и ломкость.
Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Их основные черты:
- Средняя тепло- и электропроводность.
- Внешний вид может быть схож с металлами или неметаллами.
- Различаются между собой по температуре плавления, плотности, цвету и форме.
Обозначение элементов
Каждый элемент в периодической системе Менделеева имеет несколько обозначений:
- название;
- буквенное выражение;
- атомный номер;
- массовое число.
Буквенное, название
В таблице может быть указано полное название вещества (например, Carbon), в таких случаях его располагают под химическим символом.
Символ — это сокращенное название элемента (например, гелий — He).
Иногда в таблице не указываются названия вещества и приводится лишь его химический символ. Обозначения, как правило, состоят из одной или двух латинских букв. Символ элемента расположен в центре соответствующей ячейки в таблице.
Атомный номер
Атомный номер элемента обычно располагается вверху соответствующей ячейки, посередине или в углу. Все элементы имеют атомные номера от 1 до 118. Атомный номер — это всегда целое число.
Массовое число
Массовое число — это общее количество протонов и нейтронов в ядре. Его легко определить по атомной массе элемента, округляя ее до ближайшего целого числа.
Атомная масса указывается внизу ячейки, под символом элемента. Атомная масса — это сумма масс частиц, которые составляют ядро атома (протоны и нейтроны), представляет собой среднюю величину, для большинства элементов записывается в виде десятичной дроби.
Например, фосфор (P) имеет атомную массу равную 30,97376, следовательно, массовое число (количество протонов и нейтронов в ядре) составит 31.
Валентность
Валентность — это свойство элементов образовывать химические связи.
Валентность бывает:
- постоянная;
- переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность по таблице Менделеева несложно:
- Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
- Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 (всего 8 групп в таблице) вычесть № группы, в которой находится вещество.
Например, вещества, находящиеся в первой группе главной подгруппы (Li, К) имеют валентность, равную I; элементы, которые располагаются во второй группе главной подгруппы (Mg, Ca) обладают II валентностью. Мышьяк (As) находится в V группе главной подгруппы, следовательно, значение его валентности также будет равняться V. Помимо этого, у вещества есть еще одно значение валентности. Определяется оно по приведенной выше формуле и равняется III.
Если у вас возникнут сложности в усвоении знаний не только по химии, но и по любому другому предмету, обращайтесь за помощью к образовательному ресурсу Феникс.Хелп. Для нас не существует нелюбимых дисциплин и сложных тем!
Периодическая система химических элементов Д. И. Менделеева
| Период | Ряд | Группа | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||
| 1 | 1 | 1HВодород1,0079 | (H) | 2HeГелий4,0026 | |||||||
| 2 | 2 | 3LiЛитий6,941 | 4BeБериллий9,012 | 5BБор10,811 | 6CУглерод12,011 | 7NАзот14,007 | 8OКислород15,999 | 9FФтор18,998 | 10NeНеон20,18 | ||
| 3 | 3 | 11NaНатрий22,99 | 12MgМагний24,305 | 13AlАлюминий26,982 | 14SiКремний28,086 | 15PФосфор30,974 | 16SСера32,065 | 17ClХлор35,453 | 18ArАргон39,948 | ||
| 4 | 4 | 19KКалий39,098 | 20CaКальций40,078 | 21ScСкандий44,956 | 22TiТитан47,867 | 23VВанадий50,942 | 24CrХром51,996 | 25MnМарганец54,938 | 26FeЖелезо55,845 | 27CoКобальт58,933 | 28NiНикель58,693 |
| 5 | 29CuМедь63,546 | 30ZnЦинк65,409 | 31GaГаллий69,723 | 32GeГерманий72,64 | 33AsМышьяк74,992 | 34SeСелен78,96 | 35BrБром79,904 | 36KrКриптон83,798 | |||
| 5 | 6 | 37RbРубидий85,468 | 38SrСтронций87,62 | 39YИттрий88,906 | 40ZrЦирконий91,224 | 41NbНиобий92,906 | 42MoМолибден95,94 | 43TcТехнеций[98,906] | 44RuРутений101,07 | 45RhРодий102,906 | 46PdПалладий106,42 |
| 7 | 47AgСеребро107,868 | 48CdКадмий112,411 | 49InИндий114,818 | 50SnОлово118,71 | 51SbСурьма121,76 | 52TeТеллур127,60 | 53IИод126,904 | 54XeКсенон131,293 | |||
| 6 | 8 | 55CsЦезий132,905 | 56BaБарий137,327 | 57La*Лантан138,905 | 72HfГафний178,49 | 73TaТантал180,948 | 74WВольфрам183,84 | 75ReРений186,207 | 76OsОсмий190,23 | 77IrИридий192,217 | 78PtПлатина195,084 |
| 9 | 79AuЗолото196,967 | 80HgРтуть200,59 | 81TlТаллий204,383 | 82PbСвинец207,2 | 83BiВисмут208,98 | 84PoПолоний[208,98] | 85AtАстат[209,98] | 86RnРадон[222,02] | |||
| 7 | 10 | 87FrФранций[223,02] | 88RaРадий[226,03] | 89Ac**Актиний[227,03] | 104RfРезерфордий[261,1087] | 105DbДубний[262,1138] | 106SgСиборгий[263,1182] | 107BhБорий[262,1229] | 108HsХассий[265] | 109MtМейтнерий[266] | 110DsДармштадтий[269] |
| 11 | 111RgРентгений[272] | 112CnКоперниций[285] | 113UutУнунтрий[284] | 114FlФлеровий[289] | 115UupУнунпентий[288] | 116LvЛиверморий[293] | 117UusУнунсептий[295] | 118UuoУнуноктий[294] | |||
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие соединения с водородом | RH4 | RH3 | H2R | HR |
*Лантаноиды
| 58CeЦерий140,12 | 59PrПразеодим140,91 | 60NdНеодим144,24 | 61PmПрометий[146,9] | 62SmСамарий[150,36] | 63EuЕвропий151,96 | 64GdГадолиний157,25 | 65TbТербий158,93 | 66DyДиспрозий162,50 | 67HoГольмий164,93 | 68ErЭрбий167,26 | 69TmТулий168,93 | 70YbИттербий173,04 | 71LuЛютеций174,97 |
**Актиноиды
| 90ThТорий232,04 | 91PaПротактиний231,04 | 92UУран238,03 | 93NpНептуний[237,05] | 94PuПлутоний[244,06] | 95AmАмериций[243,06] | 96CmКюрий[247,07] | 97BkБерклий[247,07] | 98CfКалифорний[251,08] | 99EsЭйнштейний[252,08] | 100FmФермий[257,1] | 101MdМенделевий[258,1] | 102NoНобелий[259,1] | 103LrЛоуренсий[260,11] |
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году.
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Выше приведена «короткая» форма таблицы.
Периодическая система химических элементов Д.И.Менделеева. Таблица Менделеева.
| периоды | ряды | группы элементов | ||||||||||||||||||||||||||||
| I | II | III | IV | V | VI | VII | VIII | |||||||||||||||||||||||
| I | 1 |
1 H |
химические элементы |
2 He |
||||||||||||||||||||||||||
| II | 2 |
3 Li |
4 Be |
5 B |
6 С |
7 N |
8 O |
9 F |
10 Ne |
|||||||||||||||||||||
| III | 3 |
11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
|||||||||||||||||||||
| IV | 4 |
19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
|||||||||||||||||||
|
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
|||||||||||||||||||||||
| V | 5 |
37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
|||||||||||||||||||
|
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
|||||||||||||||||||||||
| VI | 6 |
55 Cs |
56 Ba |
57 La |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
|||||||||||||||||||
|
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
|||||||||||||||||||||||
| VII | 7 |
87 Fr |
88 Ra |
89 Ac |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
|||||||||||||||||||
|
111 Rg |
112 285 |
113 |
114 289 |
115 |
116 |
117 |
118 |
|||||||||||||||||||||||
|