Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
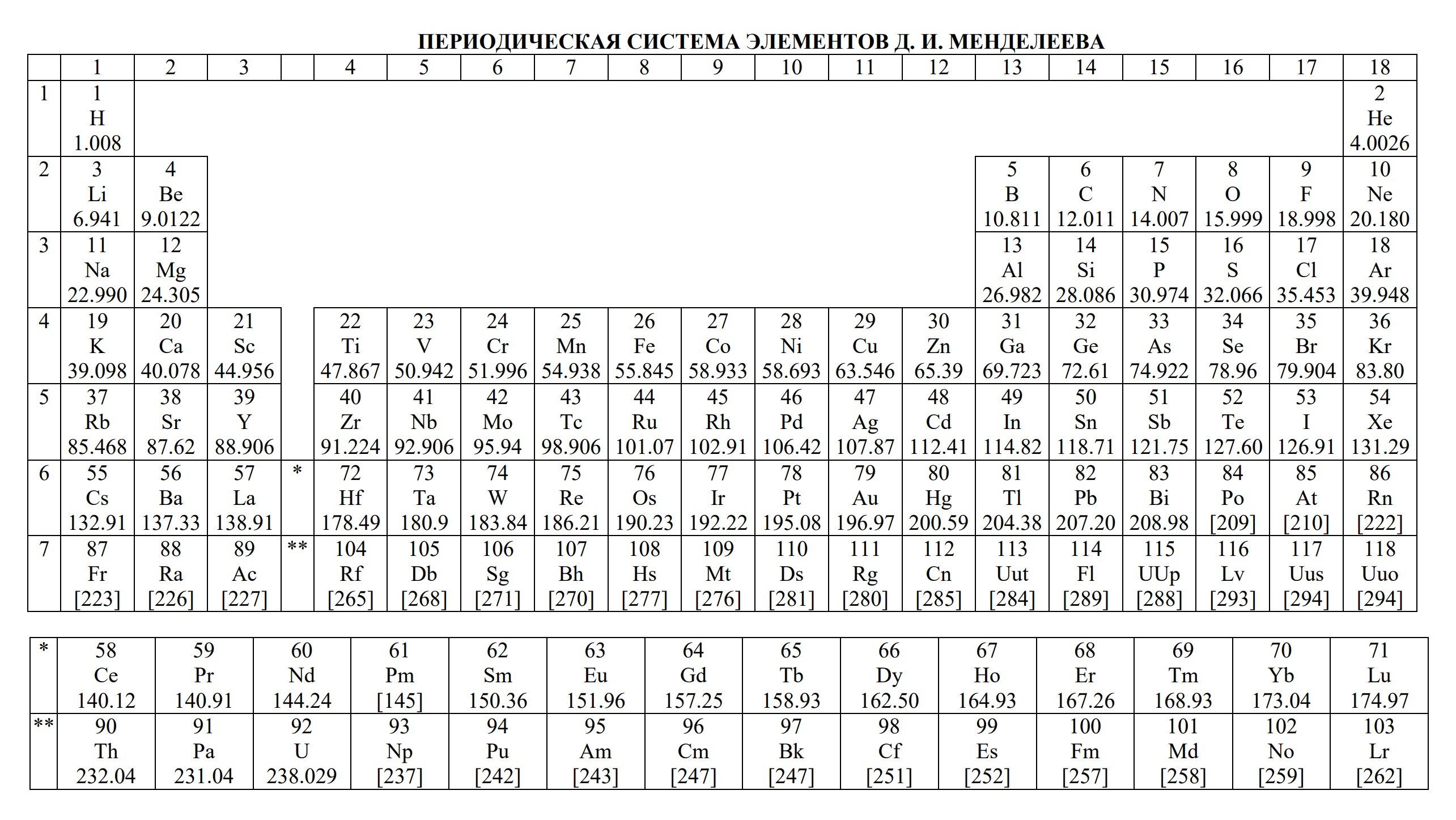
- периодическая система химических элементов Д.И. Менделеева
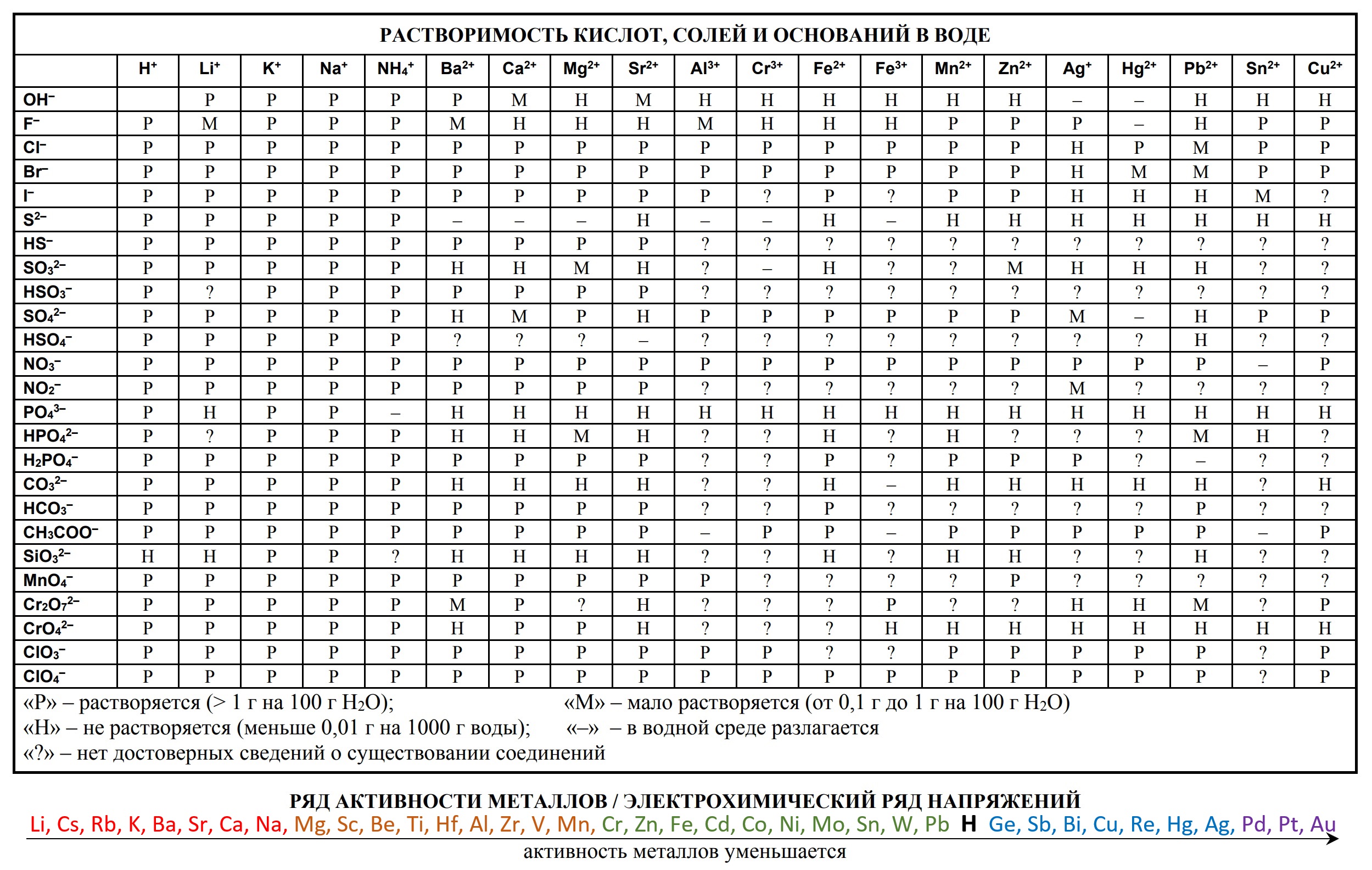
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Ниже приведены таблицы, идентичные используемым на ЕГЭ по химии: «Периодическая система химических элементов Д.И.Менделеева»
«Растворимость солей, кислот и оснований в воде» и «Электрохимический ряд напряжений металлов»:
Опубликовано
admin
в 14:10
Периодическая таблица химических элементов Д. И. Менделеева в высоком разрешении для качественной печати. Таблицу можно распечатать на листе бумаги формата А4, а так же в большого размера для оформления кабинета Химии.
Чтобы скачать и распечатать картинку — выберите нужный вариант таблицы и нажмите на изображение.
Второй вариант оформления таблицы Менделеева. Картинка в высоком разрешении для печати большого формата:
© 2016-2022 PrintFiles.ru — Файлы для распечатки
Все графические и текстовые материалы сайта PrintFiles.ru защищены российскими и международными законами и соглашениями об охране авторских прав и интеллектуальной собственности (статьи 1259 и 1260 главы 70 «Авторское право» Гражданского Кодекса Российской Федерации от 18 декабря 2006 года N 230-ФЗ).
Посетителям сайта разрешается использовать материалы сайта в некоммерческих целях.
Размещение материалов этого сайта на других ресурсах в интернете без разрешения владельцев запрещено!
Понедельник, 20 Январь 2014 15:49
-
Печать
Периодическая таблица химических элементов Д.И. Менделеева и таблица растворимости кислот, оснований и солей, используемые на итоговой аттестации обучающихся по химии (скачать)
На днях очень понадобилась наглядная и удобная версия таблицы Менделеева, распечатанная на формате А4. Удобно, наглядно.
Зачем? А затем, что в современных учебниках химии величайшее творение русского учёного Менделеева представлено в таком убогом и урезанном виде, что учиться по ней вообще невозможно. Вернее информацию оттуда черпать невозможно. А надо бы.
Кто помнит — у меня скан с высоким разрешением из учебника Фельдман, Рудзитис, самого начала 90-х годов. Таблица там представлена в САМОМ полном виде. Но стоит помнить, что эта таблица школьного уровняэ
Я подкрутил ещё резкость, маленько подсветил. Распечатал на струйном принтере — качество достойное. Этот вариант таблицы отлично подойдёт как версия для печати. Ну а теперь не пропадать же добру Вот я и выкладываю этот скан на всеобщую пользу. Заархивировал рисунок, чтобы удобнее было скачивать.
Пользуйтесь на здоровье!
СКАЧАТЬ tablica_mendeleeva.zip
Цитата дня
Учитесь так, словно вы постоянно ощущаете нехватку своих знаний, и так, словно вы постоянно боитесь растерять свои знания.
Конфуций
Таблицы ЕГЭ по химии
Ниже приведены таблицы, идентичные используемым на ЕГЭ по химии: «Периодическая система химических элементов Д.И.Менделеева»
«Растворимость солей, кислот и оснований в воде» и «Электрохимический ряд напряжений металлов»:
-
Главная
-
Теория ЕГЭ
-
Химия — теория ЕГЭ
-
Таблица Менделеева ЕГЭ по химии
Таблица Менделеева ЕГЭ по химии
- 01.11.2020
Подробная таблица растворимости, которой можно пользоваться на ЕГЭ по химии.
- Кстати, тренировочные варианты этого года ЕГЭ по химии
Смотрите Таблицу растворимости для ЕГЭ (ей тоже можно пользоваться).
- Другая теория по химии
Таблица Менделеева в картинке JPG
Таблица Менделеева в PDF
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Сохранить ссылку:
Комментарии (0)
Добавить комментарий
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Имя (обязательное)
E-Mail
Подписаться на уведомления о новых комментариях
Отправить
ТАБЛИЦА МЕНДЕЛЕЕВА — периодическая система химических элементов
Таблица Менделеева (периодическая система химических элементов) — это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 — 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец — это группа, определяющая основные физико-химические свойства, а строки — это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА

Порядковый номер элемента — это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
| П. |
Группы химических элементов |
|||||||||
|
VIII |
||||||||||
| 1 |
1,00794 Водород |
4,0026 Гелий |
||||||||
| 2 |
6,941 Литий |
9,0122 Берилий |
10,811 Бор |
12,01115 Углерод |
14,0067 Азот |
15,9994 Кислород |
18,9984 Фтор |
20,179 Неон |
||
| 3 |
22,9898 Натрий |
24,305 Магний |
26,9815 Алюминий |
28,086 Кремний |
30,9738 Фосфор |
32,064 Сера |
35,454 Хлор |
39,948 Аргон |
||
| 4 |
39,0983 Калий |
40,08 Кальций |
44,956 Скандий |
47,88 Титан |
50,942 Ванадий |
51,996 Хром |
54,938 Марганец |
55,847 Железо |
58,9332 Кобальт |
58,69 Никель |
|
63,546 Медь |
65,39 Цинк |
69,72 Галлий |
72,61 Германий |
74,9216 Мышьяк |
78,96 Селен |
79,904 Бром |
83,80 Криптон |
|||
| 5 |
85,47 Рубидий |
87,62 Стронций |
88,906 Иттрий |
91,224 Цирконий |
92,906 Ниобий |
95,94 Молибден |
98,906 Технеций |
101,07 Рутений |
102,905 Родий |
106,42 Палладий |
|
107,868 Серебро |
112,41 Кадмий |
114,82 Индий |
118,71 Олово |
121,75 Сурьма |
127,60 Теллур |
126,9045 Йод |
131,30 Ксенон |
|||
| 6 |
132,905 Цезий |
137,327 Барий |
138,91 Лантан |
178,49 Гафний |
180,948 Тантал |
183,85 Вольфрам |
186,207 Рений |
190,2 Осмий |
192,22 Иридий |
195,09 Платина |
|
196,967 Золото |
200,59 Ртуть |
204,383 Таллий |
207,19 Свинец |
208,98 Висмут |
[209] Полоний |
[210] Астат |
[222] Радон |
|||
| 7 |
[223] Франций |
226,025 Радий |
[227] Актиний |
[261] Резерфордий |
[262] Дубний |
[263] Сиборгий |
[264] Борий |
[265] Хассий |
[266] Мейтнерий |
[281] Дармштадтий |
|
[281] Рентгений |
[285] Коперниций |
[284] Нихоний |
[289] Флеровий |
[288] Московий |
[293] Ливерморий |
[294] Теннесин |
[294] Оганесон |
|||
| 8 |
[316] Унуненний |
[320] Унбинилий |
||||||||
|
Высшие оксиды |
||||||||||
|
R2O |
RO |
R2O3 |
RO2 |
R2O5 |
RO3 |
R2O7 |
RO4 |
|||
|
Летучие водородные соединения |
||||||||||
|
RH4 |
RH3 |
H2R |
RH |
|
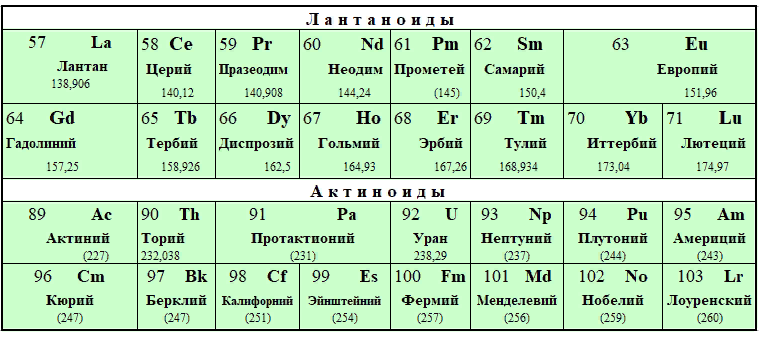
* ЛАНТАНОИДЫ |
|||||||||
|
114,16 Церий |
140,907 Празеодим |
144,24 Неодим |
[145] Прометий |
150,36 Самарий |
151,96 Европий |
157,25 Гадолиний |
158,924 Тербий |
162,5 Диспрозий |
164,93 Гольмий |
|
167,26 Эрбий |
168,94 Тулий |
173,04 Иттербий |
174,97 Лютеций |
||||||
|
** АКТИНОИДЫ |
|||||||||
|
232,038 Торий |
231,04 Протактиний |
238,03 Уран |
237,05 Нептуний |
[244] Плутоний |
[243] Америций |
[247] Кюрий |
[247] Берклий |
[251] Калифорний |
[254] Эйнштейний |
|
[257] Фермий |
[258] Менделевий |
[259] Нобелий |
260 Лоуренсий |
||||||
|
*** СУПЕРАКТИНОИДЫ |
|||||||||
|
320 Унбиуний |
* Унбибий |
* Унбитрий |
332 Унбиквадий |
* Унбипентий |
* Унбигексий |
||||
|
s – элементы |
p – элементы |
d – элементы |
f – элементы |
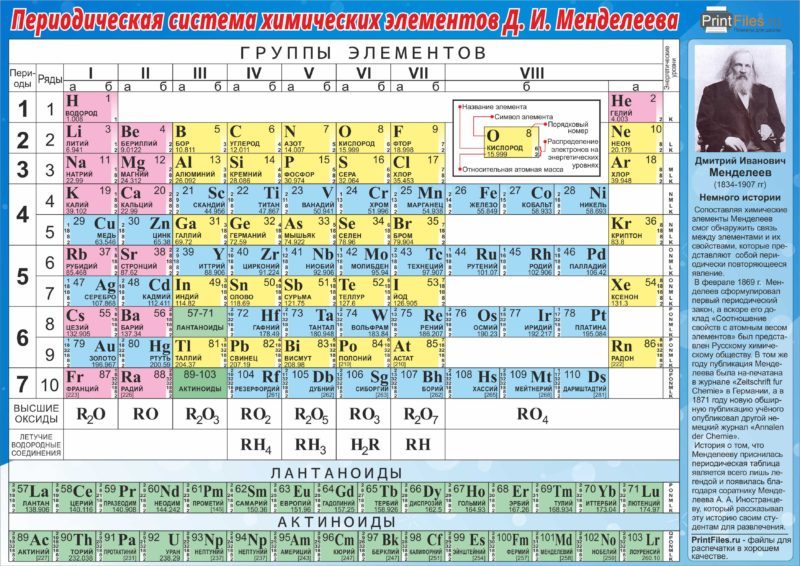
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А — главные (s- и р-элементы) и В — побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
|
1 период |
2 элемента (1s2) |
5 период |
18 элементов (5s24d105p6) |
|
2 период |
8 элементов (2s22p6) |
6 период |
32 элемента (6s24f145d106p6) |
|
3 период |
8 элементов (3s23p6) |
7 период |
32 элемента (6s24f145d106p6) |
|
4 период |
18 элементов (4s23d104p6) |
8 период |
не завершен |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
|
Название семейства |
Тип конфигурации |
Застраиваемые подуровни |
|
s — элементы |
ns1–2 |
внешний (n) s-подуровень |
|
p -элементы |
ns2 np1–6 |
внешний (n) р-подуровень |
|
d — элементы |
(n-1)d1–10 ns1–2 |
предвнешний (n–1 ) d-подуровень |
|
f — элементы |
(n-2)f1–14 (n-1)d1–10 ns1–2 |
третий снаружи (n–2) f-подуровень |
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s2p6, для гелия s2.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
— металлические свойства усиливаются и неметаллические свойства ослабевают;
— атомный радиус увеличивается;
— возрастает сила образованных элементом оснований и бескислородных кислот;
— уменьшается электроотрицательность.
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
— увеличивается электроотрицательность;
— металлические свойства ослабевают, неметаллические усиливаются;
— уменьшается атомный радиус.
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R — обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).
В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
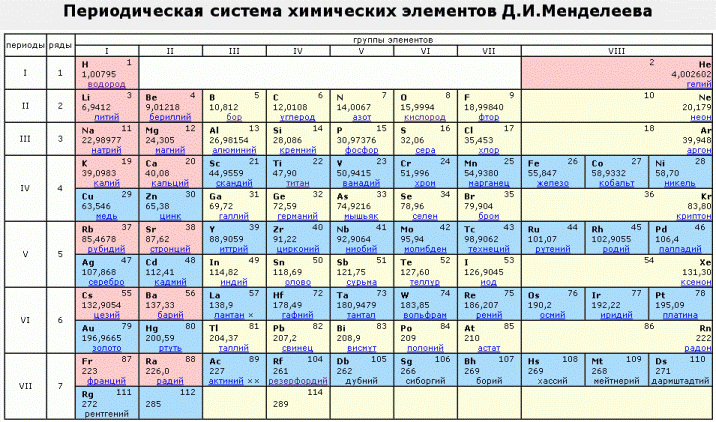
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.
Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
1) Таблица Менделеева для печати в хорошем качестве цветная (короткая форма)
2) Таблица Менделеева для печати в хорошем качестве черно-белая (короткая форма)
3) Таблица Менделеева для печати в хорошем качестве цветная (длинная форма)
4) Таблица Менделеева для печати в хорошем качестве черно-белая (длинная форма)
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
3. По материалам сайта ru.wikipedia.org
В этой статье вы найдете таблицу Менделеева и таблицу растворимости веществ.
Содержание
- Таблица Менделеева: распечатать для ЕГЭ
- Таблица растворимости по химии: распечатать для ЕГЭ
- Видео: Периодическая таблица Д.И.Менделеева — лучшая шпаргалка по химии
В школе, в каждом кабинете химии есть таблица Менделеева. Это великие научные труды знаменитого ученого, которые являются основой знаний наших современников о химии. В этой статье вы найдете и сможете распечатать таблицу с химическими элементами для ЕГЭ и таблицу растворимости солей и других веществ.
Таблица Менделеева: распечатать для ЕГЭ
Первая таблица появилась в 1869 году и в ней было всего 60 элементов. Затем ее расширили и разместили в ней 118 элементов, которые известны нам на сегодняшний день. Вся таблица систематизирована и состоит из периодов (ряды) и групп (столбцы). Поэтому сейчас такая табличка называется «Периодическая система Менделеева».
Кажется, что идея самой таблицы Менделеева обманчива, ведь упорядочить элементы по увеличению веса их атомов — это просто. Кроме этого, химические и физические свойства многих рядов атомов схожи с предшествующими в этой же таблице.
- Такая закономерная схожесть проявляется у всех рядов атомов с одинаковым зарядом ядра, кроме первых, так как они не имеют перед собой других рядов.
- Благодаря данному открытию и появилась возможность последовательного расположения в таблице, которая внешне напоминает обычный настенный календарь.
- Это открытие великого ученого помогло объединить большое количество элементов в одной таблице.
Важно запомнить: Система, придуманная Менделеевым не только синхронизирует элементы, но и их свойства. Все химики пользуются такой таблицей, чтобы найти правильные ответы на многие научные вопросы.
Ниже находится таблица Менделеева. Распечатайте ее, чтобы подготовиться к ЕГЭ и найти для себя все ответы.
Таблица растворимости по химии: распечатать для ЕГЭ
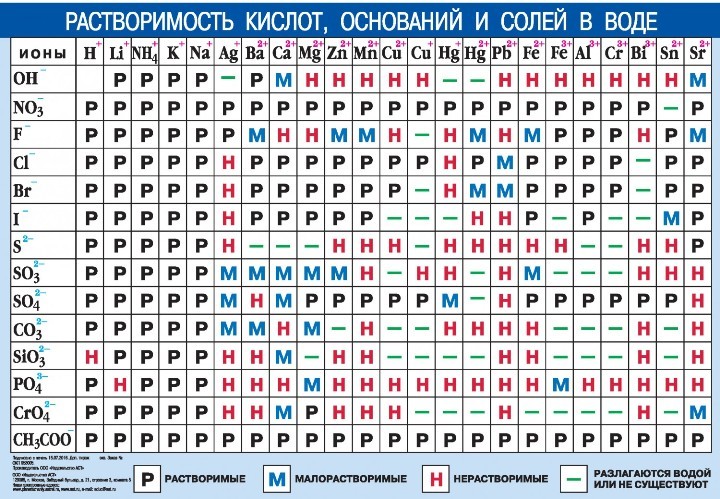
Таблица растворимости позволяет определить, как будет вести себя вещество в солях или кислоте, и будет ли осадок в результате этой реакции. Чтобы проверить показатели растворов, ищите место взаимопересечения столбца и строчки, и вы увидите, какой знак там изображен.
Запомните: Растворимость — это показатель способности конкретного компонента создавать с другими составляющими однородность, а именно раствор, в котором эти компоненты находятся в виде атомов, молекул или частичек.
Выражение показателей растворов можно описать в виде концентрации растворенного компонента в его растворе или в процентах. Также растворимость может выражаться в виде веса или объема, отнесенного к 100 граммам или 100 сантиметрам кубическим растворителя — грамм/100 грамм или см³/100 см³.
Выражение растворимости:
- Газообразных веществ напрямую связано с температурой или давлением.
- Жидких и твердых веществ связано только с температурой.
Ниже размещена таблица растворимости кислот, оснований и солей в воде. Распечатывайте для использования на ЕГЭ, используйте и готовьтесь к экзамену.
Благодаря таблицам, которые находятся выше по тексту, вы сможете без проблем решать задачи по химии. Вы не сможете предугадать, какие задачи у вас будут в экзаменационных бланках. Но, порешав множество разных задач, вы сможете хорошо потренироваться и уже на экзамене вы легко выполните любую работу без проблем. Удачи!
Видео: Периодическая таблица Д.И.Менделеева — лучшая шпаргалка по химии