Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) нитрит натрия
2) гидроксид рубидия
3) дихромат калия
4) нитрат хрома(III)
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
2
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) нитрит натрия
2) гидроксид рубидия
3) дихромат калия
4) нитрат хрома(III)
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
3
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) нитрат бария
2) карбонат натрия
3) серная кислота
4) сульфат железа(III)
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
4
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) сульфат калия
2) сульфат алюминия
3) гидроксид лития
4) гидроксид аммония
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
5
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) иодид бария
2) нитрат железа(III)
3) карбонат калия
4) уксусная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Пройти тестирование по этим заданиям
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет
реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз
(вода) разрушает «слабое» — это правило вам очень пригодится.

Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются
слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести
нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем
интеллектуальном составляющем 

По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr,
CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4,
FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз
разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти
по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2
не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4,
NaNO2, Ca(OCl)2, Ba(CH3COO)2, K2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2,
Al2S3, Cr2(SO3)3, CH3COONH4.

Самостоятельно определите тип гидролиза для CaI2, Li2SiO3, Ba(NO2)2, CuBr2, Zn(H2PO4)2.
Ниже вы найдете решение.

Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль,
вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда
раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда
раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры:
NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.

Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили.
Ниже будет располагаться решение.

С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH < 7. В нейтральной pH = 7. В щелочной pH > 7.

Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH < 7).
Индикаторы (лат. indicator — указатель)
Индикатор — вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен
менять его цвет, что наглядно отражает характер среды в определенный момент времени.
Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды
раствора их окраска меняется, что отражает приведенная ниже таблица.

Для тех, кто обладает хорошей зрительной памятью, будет несложно запомнить эту схему. Но что делать аудиалам и кинестетикам? 
От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую
запомнить индикаторы по стихам.
Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет
настроение 
Лакмус
Индикатор лакмус красный
Кислоту укажет ясно.
Индикатор лакмус синий —
Щелочь здесь, не будь разиней!
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеин
Фенолфталеиновый
В щелочах малиновый
Несмотря на это —
В кислотах он без цвета.
Метиловый оранжевый
От щелочи я желт как в лихорадке
Я розовею от кислот, как от стыда
И я бросаюсь в воду без оглядки —
Здесь я оранжевый практически всегда!

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Среда водных растворов
Вода и водные растворы окружают нас повсюду. В воде и в водных растворах присутствуют ионы Н+ и ОН—. Избыток или недостаток этих ионов определяет среду раствора.
В нейтральном растворе количество ионов водорода Н+ равно количеству гидроксид-ионов ОН–.
[Н+] = [ОН–]
Если количество ионов водорода Н+ больше количества гидроксид-ионов ОН–, то среда раствора кислая:
[Н+] > [ОН–]
Если количество ионов водорода Н+ меньше количества гидроксид-ионов ОН–, то среда раствора щелочная:
[Н+] < [ОН–]
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н+] > [ОН–] | [Н+] = [ОН–] | [Н+] < [ОН–] |
| pH < 7 | pH = 7 | pH > 7 |
Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H+ и анионы кислотных остатков:
HA = H+ + A–
При этом в растворе возникает избыток катионов водорода Н+, поэтому среда водных растворов кислот — кислая (что вполне логично).
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН–:
МеОH = Ме+ + ОН–
При этом в растворе возникает избыток катионов гидроксид-анионов ОН–, поэтому среда водных растворов оснований — щелочная. Сильные основания (щелочи) хорошо растворимы в воде, поэтому среда их водных растворов — сильно щелочная. Нерастворимые основания в воде практически не растворяются, поэтому в водном растворе оказывается лишь небольшое количество ионов ОН–. Среда водного раствора аммиака слабо щелочная.
Растворы солей
Среда водных растворов солей определяется не только диссоциацией, но и особенностями взаимодействия катионов металлов и анионов кислотных остатков с водой — гидролизом солей.
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4+) и анионы кислотных остатков.
Катионы металлов, которым соответствуют слабые основания, притягивают из воды ионы ОН–, при этом в воде образуются избыточные катионы водорода Н+. Протекает гидролиз по катиону. Катионы металлов, которым соответствуют сильные основания, с водой таким образом не взаимодействуют.
Например, катионы Fe3+ подвергаются гидролизу:
Fe3+ + HOH ↔ FeOH2+ + H+
Анионы кислотных остатков, которым соответствуют слабые кислоты, притягивают из воды катионы Н+, при этом в воде остаются гидроксид-анионы ОН–. Протекает гидролиз по аниону. Анионы кислотных остатков сильных кислот таким образом с водой не взаимодействуют.
Например, ацетат-ионы (остаток уксусной кислоты CH3COOH) подвергаются гидролизу:
CH3COO— + HOH ↔ CH3COOH + OH—
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катион/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катион/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочная | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катион/анион | Na+ | NH4+ |
| Cl– | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO32– | Na2CO3, гидролиз по аниону, среда щелочная | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катион/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катион/анион | Na+ | NH4+ |
| Cl– | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO32– | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Содержание
- 1 Понятие о водородном показателе
- 2 Шкала pH
- 3 Методы определения величины pH
- 3.1 Использование индикаторов
- 3.2 Ионометрический метод
- 3.3 Аналитический объемный метод
- 4 Влияние температуры на значение pH
- 5 Значения pH некоторых растворов
- 5.1 pH растворов кислот
- 5.2 pH растворов оснований
- 5.3 Значения pH некоторых бытовых веществ и пищевых продуктов
- 6 Роль показателя кислотности
Важной характеристикой водных растворов является уровень концентрации в них положительно заряженных ионов водорода и отрицательно заряженных гидроксид-ионов относительно друг друга. При одинаковых концентрациях и раствор считается нейтральным, при избытке катионов – кислотным и при избытке анионов – основным (щелочным). Величина, называемая водородным показателем, или pH раствора, – это количественное выражение кислотности.
Понятие о водородном показателе
Определение pH-фактора базируется на кислотно-основных свойствах воды. Ее молекулы способны к самопроизвольной диссоциации, благодаря чему в воде всегда присутствует некоторое количество ионов и . Их концентрация мала вследствие обратимости процесса диссоциации, который выражается формулой
⇄
+
Из формулы видно, что ионы водорода и гидроксила содержатся в воде в равной концентрации: []=[
]. В стандартных условиях (при температуре 22–25° C) она составляет
моль⁄л.
Величина =[
]∙[
] называется ионным произведением воды. При заданной температуре она является постоянной (при 22–25° C
=
моль
/л
) не только для воды, но и для разбавленных растворов. При добавлении кислоты к воде повышается концентрация [
] и понижается [
] (кислотность возрастает), при добавлении щелочи падает [
] и растет [
] (кислотность понижается).
В качестве показателя кислотности удобно использовать десятичный логарифм величины [] с обратным знаком:
pH = -lg []
Для воды и любой нейтральной среды водородный показатель составит: pH = — lg = -(-7) = 7
Шкала pH
На основе постоянства значения ионного произведения воды построена шкала величин pH различных растворов. Отметка «7» в ней соответствует нейтральной среде, числа слева от 7 – кислотной, и справа – основной (щелочной).
Важно помнить, что, поскольку для определения показателя кислотности для избавления от знака «минус» в показателе степени используется отрицательный логарифм, понижение pH означает повышение концентрации , то есть кислотных свойств, и наоборот. Так, значение
5 соответствует концентрации [
] =
моль⁄л и большей кислотности, чем
9, означающее, что в растворе содержится
моль⁄л катионов водорода.
Методы определения величины pH
В зависимости от целей и условий значение водородного показателя устанавливается различными методами. Качественно оценить кислотность среды позволяет применение индикаторов. Точные количественные результаты получают с помощью измерительных методов.
Использование индикаторов
Метод основан на способности ряда органических веществ к изменению окраски в зависимости от кислотности среды. Распространенные индикаторы – лакмус, метилоранж, фенолфталеин. Каждый из них проявляет свои свойства в ограниченном диапазоне значений pH.
| Индикатор | Интервал шкалы pH | Характер изменения цвета
по мере уменьшения кислотности |
| Лакмус | 5,0–8,0 | красный → фиолетовый → синий |
| Метилоранж | 3,1–4,4 | красный → оранжевый → желтый |
| Фенолфталеин | 8,2–10,0 | бесцветный → малиновый |
Индикаторный метод отличает простота наглядность и быстрота, но он недостаточно точен и зависит от субъективного восприятия цвета.
Достичь большей точности позволяет применение универсального индикатора. Он представляет собой смесь веществ и охватывает широкий диапазон pH от 0 до 14. Цвет, приобретенный нанесенным на бумажную полосу индикатором в той или иной среде, сравнивают с эталонной шкалой. Универсальный индикатор дает возможность определять pH с точностью до десятых долей.
Индикаторные методы неэффективны в случаях, когда раствор слишком слабый, имеет собственную яркую окраску или замутнен.
Ионометрический метод
Водородный показатель можно определить с точностью до 0,01 в широком диапазоне, применяя pH-метр. Прибор представляет собой электронный милливольтметр, определяющий разность потенциалов на электродах, один из которых (измерительный pH-электрод) помещен в исследуемый раствор. Другой (электрод сравнения) погружен в электролит с определенным pH. На нем создается стабильный потенциал, относительно которого измеряют pH анализируемой среды. Разность потенциалов пропорциональна величине показателя кислотности.
pH-метр требует тщательной калибровки. Для нее используются специально приготовленные буферные растворы с эталонными значениями pH, устойчивыми при разбавлении или добавкам небольших количеств сильных кислот или оснований. В приготовлении буферных растворов для pH-метрии применяются стандарт-титры – наборы чистых реактивов с точно известной массой, которые разводят дистиллированной водой до необходимой концентрации.
Конструкция современных pH-метров предусматривает вместо двух электродов один комбинированный, что значительно упрощает их использование.
Аналитический объемный метод
В данном способе определения водородного показателя применяется процедура кислотно-основного титрования, ведущую роль в которой играет реакция нейтрализации исследуемого образца титрантом – стандартным раствором с определенным pH. Если титруется раствор кислоты, в качестве титранта используют щелочь (гидроксид натрия или калия), если основание – титрантом является раствор сильной кислоты (соляной или серной).
Титрант медленно добавляют к образцу до достижения точки эквивалентности – момента, когда происходит полная нейтрализация титруемого раствора. Фиксация конечной точки титрования может производиться несколькими способами: с помощью индикатора, потенциометрии, спектрофотометрии или измерения электропроводности. Определив необходимый для нейтрализации объем титранта и зная его концентрацию, вычисляют pH препарата.
Влияние температуры на значение pH
Повышение температуры приводит к росту диссоциации слабых электролитов, в том числе и воды. Повышается равновесная концентрация ионов и и возрастает величина ионного произведения. Соответственно меняется и водородный показатель для нейтральной среды:
| Температура
T, 0° C |
0 | 20 | 25 | 40 | 60 | 80 | 100 |
| Ионное произведение воды, |
|||||||
| Нейтральный pH = — lg(√(K_W ))=-lg K_W/2 | 7,5 | 7,1 | 7 | 6,8 | 6,5 | 6,3 | 6,1 |
Температурные изменения оказывают сложное и неоднозначное влияние на измерения pH. В целом органические и щелочные пробы более зависимы от них, чем неорганические и кислотные. При pH-метрии и титровании температура строго контролируется, а полученные результаты пересчитываются с целью приведения к значению, характерному при 25° C.
Значения pH некоторых растворов
При определении величины pH для растворов кислот и оснований принято выражать концентрацию раствора в единицах нормальности. Нормальная концентрация – это количество моль-эквивалентов вещества в 1 л раствора: .
Эквивалентом называется частица (реальная либо условная), которая в химических реакциях равноценна одному катиону или одному электрону. Моль-эквивалент содержит эквивалентов, а его масса в единицах называется молярной массой эквивалента .
Многоосновные кислоты могут отдавать один или более ионов водорода, поэтому число моль-эквивалентов в растворе и, соответственно, нормальность будет в разных случаях неодинакова. Она имеет обозначение «н.» с указанием доли нормальной концентрации. Например, серная кислота, молекула которой при диссоциации отдает два протона , при молярной концентрации имеет нормальность 1н.
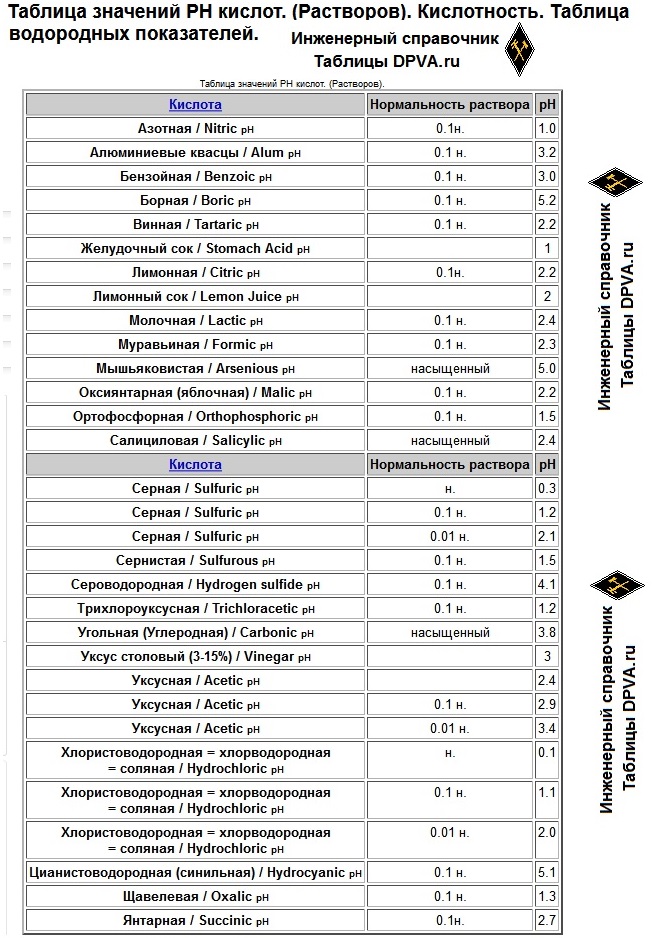
pH растворов кислот
| Кислота | Концентрация | pH |
| Азотная | 0,1 н. | 1,0 |
| Борная | 0,1 н. | 5,2 |
| Муравьиная | 0,1 н. | 2,3 |
| Серная | н. | 0,3 |
| 0,1 н. | 1,2 | |
| 0,01 н. | 2,1 | |
| Сернистая | 0,1 н. | 1,5 |
| Сероводородная | 0,1 н. | 4,1 |
| Уксусная | н. | 2,4 |
| 0,1 н. | 2,9 | |
| 0,01 н. | 3,4 | |
| Соляная | н. | 0,1 |
| 0,1 н. | 1,1 | |
| 0,01 н. | 2,0 | |
| Щавелевая | 0,1 н. | 1,3 |
pH растворов оснований
Нормальность щелочей определяется аналогично нормальности кислот, исходя из количества гидроксид-ионов, которые отщепляются при диссоциации.
| Основание | Концентрация | pH |
| Гидроксид калия | н. | 14,0 |
| 0,1 н. | 13,0 | |
| 0,01 н. | 12,0 | |
| Гидроксид кальция | насыщенный | 12,4 |
| Гидроксид натрия | н. | 14,0 |
| 0,1 н. | 13,0 | |
| 0,01 н. | 12,0 |
Значения pH некоторых бытовых веществ и пищевых продуктов
| Вещество | pH | Продукт | pH |
| электролит аккумуляторный на основе | <1 | сок лимонный | 2,0–2,6 |
| шампуни | 4,5–7,0 | уксус пищевой | 2,4–3,1 |
| мыла жидкие на основе синтетических ПАВ | 5,5–7,0 | кетчуп | 3,9 |
| средства для мытья стекол | 6,2–7,3 | томаты | 4,3–4,9 |
| средства для мытья пола | 6,9–8,6 | сыр | 4,8–6,4 |
| вода морская | 8,0 | кофе | 5,0 |
| мыло натуральное | 9,0–11,0 | чай | 5,5 |
| нашатырный спирт | 11,5 | вода питьевая | 6,5–8,5 |
| хлорная известь (отбеливатель) | 12,5 | молоко | 6,5–6,9 |
| раствор соды | 13,5 | яйцо куриное свежее | 7,6–8,0 |
Роль показателя кислотности
Знание и использование водородного показателя играет значительную роль во многих областях жизни людей, особенно в здравоохранении и медицине, в водоснабжении, в производстве и грамотном потреблении продуктов питания и средств бытовой химии. Оно также важно в организации сельского хозяйства, в производстве кормов и удобрений. Показатель pH имеет большое значение при проведении научно-исследовательских работ в химии и биологии, а также при мониторинге многих технологических процессов в нефтехимической, топливной, атомной и других отраслях промышленности.
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греч. hydro — вода, lysis — распад, разложение).
Гидролиз — это реакция обменного разложения вещества водой.
Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Водные растворы солей имеют разные значения рН и различные типы сред — кислотную ($рН < 7$), щелочную ($рН > 7$), нейтральную ($рН = 7$). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов $Н^{+}$ или $ОН^{-}$, и раствор соли становится кислотным или щелочным соответственно.
Классификация солей
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль $KClO$ образована сильным основанием $KOH$ и слабой кислотой $HClO$.
В зависимости от силы основания и кислоты можно выделить четыре типа солей.
Рассмотрим поведение солей различных типов в растворе.
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия $KCN$ образована сильным основанием $KOH$ и слабой кислотой $HCN$:
${KOH}↙{text»сильное однокислотное основание»}←KCN→{HCN}↙{text»слабая однокислотная кислота»}$
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения
$H_2O{⇄}↖{←}H^{+}+OH^{-};$
2) полная диссоциация соли (сильного электролита):
$KCN=K^{+}+CN^{-}$
Образующиеся при этих процессах ионы $Н^{+}$ и $CN^{-}$ взаимодействуют между собой, связываясь в молекулы слабого электролита — цианистоводородной кислоты $HCN$, тогда как гидроксид — ион $ОН^{-}$ остается в растворе, обусловливая тем самым его щелочную среду. Происходит гидролиз по аниону $CN^{-}$.
Запишем полное ионное уравнение происходящего процесса (гидролиза):
$K^{+}+CN^{-}+H_2O{⇄}↖{←}HCN+K^{+}+OH^{-}.$
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), т.к. вода — значительно более слабый электролит, чем цианистоводородная кислота $HCN$.
$CN^{-}+H_2O⇄HCN+OH^{-}.$
Уравнение показывает, что:
а) в растворе есть свободные гидроксид-ионы $ОН^{-}$, и концентрация их больше, чем в чистой воде, поэтому раствор соли $KCN$ имеет щелочную среду ($рН > 7$);
б) в реакции с водой участвуют ионы $CN^{-}$, в таком случае говорят, что идет гидролиз по аниону. Другие примеры анионов, которые участвуют в реакции с водой:
| $HCOO^{–}, CH_3COO^{–}, NO_2^{–}$ | от слабых кислот — муравьиной $HCOOH$, уксусной $CH_3COOH$, азотистой $HNO_2$ |
| $S^{2-}, CO_3^{2-}, SO_3^{2-}, PO_4^{3-}$ | от слабых кислот — сероводородной $H_2S$, угольной $H_2CO_3$, сернистой $H_2SO_3$, ортофосфорной $H_3PO_4$ |
Рассмотрим гидролиз карбоната натрия $Na_2CO_3$.
${NaOH}↙{text»сильное однокислотное основание»}←Na_2CO_3→{H_2CO_3}↙{text»слабая двухосновная кислота»}$
Происходит гидролиз соли по аниону $CO_3^{2-}$.
Полное ионное уравнение гидролиза:
$2Na^{+}+CO_3^{2-}+H_2O{⇄}↖{←}HCO_3^{-}+2Na^{+}+OH^{-}.$
Сокращенное ионное уравнение гидролиза:
$CO_2^{2-}+H_2O⇄HCO_3^{-}+OH^{-}.$
Продукты гидролиза — кислая соль $NaHCO_3$ и гидроксид натрия $NaOH$.
Среда водного раствора карбоната натрия — щелочная ($рН > 7$), потому что в растворе увеличивается концентрация ионов $ОН^{-}$. Кислая соль $NaHCO_3$ тоже может подвергаться гидролизу, который протекает в очень незначительной степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по аниону:
а) по аниону соли, как правило, гидролизуются обратимо;
б) химическое равновесие в таких реакциях сильно смещено влево;
в) реакция среды в растворах подобных солей щелочная ($рН > 7$);
г) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония $NH_4Cl$.
${NH_3·H_2O}↙{text»слабое однокислотное основание»}←NH_4Cl→{HCl}↙{text»сильная одноосновная кислота»}$
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
$H_2O{⇄}↖{←}H^{+}+OH^{-}$
2) полная диссоциация соли (сильного электролита):
$NH_4Cl=NH_4^{+}+Cl^{-}$
Образующиеся при этом ионы $OH^{-}$ и $NH_4^{+}$ взаимодействуют между собой с получением $NH_3·H_2O$ (слабый электролит), тогда как ионы $Н^{+}$ остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
$NH_4^{+}+Cl^{-}+H_2O{⇄}↖{←}H^{+}+Cl^{-}NH_3·H_2O$
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т.к. вода $Н_2О$ — значительно более слабый электролит, чем гидрат аммиака $NH_3·H_2O$.
Сокращенное ионное уравнение гидролиза:
$NH_4^{+}+H_2O⇄H^{+}+NH_3·H_2O.$
Уравнение показывает, что:
а) в растворе есть свободные ионы водорода $Н^{+}$, и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду ($рН < 7$);
б) в реакции с водой участвуют катионы аммония $NH_4^{+}$; в таком случае говорят, что идет гидролиз по катиону.
В реакции с водой могут участвовать и многозарядные катионы: двухзарядные $М^{2+}$ (например, $Ni^{2+}, Cu^{2+}, Zn^{2+}…$), кроме катионов щелочноземельных металлов, трехзарядные $М^{3+}$ (например, $Fe^{3+}, Al^{3+}, Cr^{3+}…$).
Рассмотрим гидролиз нитрата никеля $Ni(NO_3)_2$.
${Ni(OH)_2}↙{text»слабое двухкислотное основание»}←Ni(NO_3)_2→{HNO_3}↙{text»сильная одноосновная кислота»}$
Происходит гидролиз соли по катиону $Ni^{2+}$.
Полное ионное уравнение гидролиза:
$Ni^{2+}+2NO_3^{-}+H_2O{⇄}↖{←}NiOH^{+}+2NO_3^{-}+H^{+}$
Сокращенное ионное уравнение гидролиза:
$Ni^{2+}+H_2O⇄NiOH^{+}+H^{+}.$
Продукты гидролиза — основная соль $NiOHNO_3$ и азотная кислота $HNO_3$.
Среда водного раствора нитрата никеля кислотная ($рН < 7$), потому что в растворе увеличивается концентрация ионов $Н^{+}$.
Гидролиз соли $NiOHNO_3$ протекает в значительно меньшей степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по катиону:
а) по катиону соли, как правило, гидролизуются обратимо;
б) химическое равновесие реакций сильно смещено влево;
в) реакция среды в растворах таких солей кислотная ($рН < 7$);
г) при гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
3. Соли, образованные слабым основанием и слабой кислотой.
Вам, очевидно, уже ясно, что такие соли подвергаются гидролизу и по катиону, и по аниону.
Катион слабого основания связывает ионы $ОН^{-}$ из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы $Н^{+}$ из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов — кислоты и основания, которые образуются в результате гидролиза.
Например, рассмотрим гидролиз двух солей: ацетата аммония $NH_4(CH_3COO)$ и формиата аммония $NH_4(HCОO)$:
1) ${NH_3·H_2O}↙{text»слабое однокислотное основание»}←NH_4(CH_3COO)→{CH_3COOH}↙{text»сильная одноосновная кислота»};$
2) ${NH_3·H_2O}↙{text»слабое однокислотное основание»}←NH_4(HCOO)→{HCOOH}↙{text»слабая одноосновная кислота»}.$
В водных растворах этих солей катионы слабого основания $NH_4^{+}$ взаимодействуют с гидроксидионами $ОН^{-}$ (напомним, что вода диссоциирует $H_2O⇄H^{+}+OH^{-}$), а анионы слабых кислот $CH_3COO^{-}$ и $HCOO^{-}$ взаимодействуют с катионами $Н^{+}$ с образованием молекул слабых кислот — уксусной $CH_3COOH$ и муравьиной $HCOOH$.
Запишем ионные уравнения гидролиза:
1) $CH_3COO^{-}+NH_4^{+}+H_2O⇄CH_3COOH+NH_3·H_2O;$
2) $HCOO^{-}+NH_4^{+}+H_2O⇄NH_3·H_2O+HCOOH.$
В этих случаях гидролиз тоже обратимый, но равновесие смещено в сторону образования продуктов гидролиза — двух слабых электролитов.
В первом случае среда раствора нейтральная ($рН = 7$), т.к. $К_Д(СН_3COOH)=К+Д(NH_3·H_2O)=1.8·10^{-5}$. Во втором случае среда раствора слабокислотная ($pH < 7$), т.к. $К_Д(HCOOH)=2.1·10^{-4}$ и $К_Д(NH_3·H_2O) < К_Д(HCOOH)$ ($К_Д$ — константа диссоциации).
Как вы уже заметили, гидролиз большинства солей является обратимым процессом. В состоянии химического равновесия гидролизована лишь часть соли. Однако некоторые соли полностью разлагаются водой, т.е. их гидролиз является необратимым процессом.
В таблице «Растворимость кислот, оснований и солей в воде» вы найдете примечание: «в водной среде разлагаются» — это значит, что такие соли подвергаются необратимому гидролизу. Например, сульфид алюминия $Al_2S_3$ в воде подвергается необратимому гидролизу, т. к. появляющиеся при гидролизе по катиону ионы $Н^{+}$ связываются образующимися при гидролизе по аниону ионами $ОН^{-}$. Это усиливает гидролиз и приводит к образованию нерастворимого гидроксида алюминия и газообразного сероводорода:
$Al_2S_3+6H_2O=2Al(OH)_3↓+3H_2S↑$
Поэтому сульфид алюминия $Al_2S_3$ нельзя получить реакцией обмена между водными растворами двух солей, например хлорида алюминия $AlCl_3$ и сульфида натрия $Na_2S$.
Возможны и другие случаи необратимого гидролиза, их нетрудно предсказать, ведь для необратимости процесса необходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции.
Подведем итог тому, что вы узнали о гидролизе и по катиону, и по аниону:
а) если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо;
б) реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующихся основания и кислоты;
в) соли могут гидролизоваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
4. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу.
К этому выводу, очевидно, вы пришли сами.
Рассмотрим поведение в растворе хлорида калия $KCl$.
${KOH}↙{text»сильное однокислотное основание»}←KCl→{HCl}↙{text»сильная одноосновная кислота»}.$
Соль в водном растворе диссоциирует на ионы ($KCl=K^{+}+Cl^{–}$), но при взаимодействии с водой слабый электролит образоваться не может. Среда раствора нейтральная ($рН=7$), т.к. концентрации ионов $Н^{+}$ и $ОН^{-}$ в растворе равны, как в чистой воде.
Другими примерами подобных солей могут быть галогениды, нитраты, перхлораты, сульфаты, хроматы и дихроматы щелочных металлов, галогениды (кроме фторидов), нитраты и перхлораты щелочноземельных металлов.
Следует также отметить, что реакция обратимого гидролиза полностью подчиняется принципу Ле Шателье. По этому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
а) добавить воды (уменьшить концентрацию);
б) нагреть раствор, при этом усиливается эндотермическая диссоциация воды:
$H_2O⇄H^{+}+OH^{-}-57$ кДж,
а значит, увеличивается количество $Н^{+}$ и $ОН^{–}$, которые необходимы для осуществления гидролиза соли;
в) связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианида аммония $NH_4CN$ будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака $NH_3$ и воды $Н_2О$:
$NH_4^{+}+CN^{-}+H_2O⇄NH_3·H_2O+HCN.$
$NH_3{↑}↖{⇄}H_2$
Гидролиз солей
| Соли, не подвергающиеся гидролизу | Соли, подвергающиеся гидролизу | ||
| обратимо со смещением равновесия | необратимо | ||
| влево | вправо | ||
| $←$ | ${⇄}↖{←}$ | ${⇄}↖{→}$ | ${↑,↓}↖{→}$ |
| $C+C$ | $C+Cл$ | $Cл+C$ | $Cл+Cл$ |
| гидролиз по аниону — среда раствора щелочная (рН > 7) | гидролиз по катиону — среда раствора кислотная (рН < 7) | гидролиз по катиону и аниону — среда раствора зависит от констант диссоциации образующихся при гидролизе основания и кислоты (нейтральная, слабощелочная, слабокислотная) |
Условные обозначения:
| $C$ | катион | сильных | оснований | $↓$ нерастворимое соединение |
| анион | кислот | |||
| $Cл$ | катион | слабых | оснований | $↑$ летучее соединение |
| анион | кислот |
Гидролиз можно подавить (значительно уменьшить количество подвергающейся гидролизу соли), действуя следующим образом:
а) увеличить концентрацию растворенного вещества;
б) охладить раствор (для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
в) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислотная, или подщелачивать, если щелочная.
Значение гидролиза
Гидролиз солей имеет и практическое, и биологическое значение. Еще в древности в качестве моющего средства использовали золу. В золе содержится карбонат калия $K_2CO_3$, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов $ОН^{-}$.
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые и калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются.
Гидролиз стеарата натрия $С_{17}Н_{35}COONa$ выражается следующим ионным уравнением:
$C_{17}H_{35}COO^{-}+H_2O⇄C_{17}H_{35}COOH+OH^{-}$,
т.е. раствор имеет слабощелочную среду.
В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения рН среды.
Соли, создающие необходимую щелочную среду раствора, содержатся в фотографическом проявителе. Это карбонат натрия $Na_2CO_3$, карбонат калия $K_2CO_3$, бура $Na_2B_4O_7$ и другие соли, гидролизующиеся по аниону.
Если кислотность почвы недостаточна, у растений появляется болезнь — хлороз. Ее признаки — пожелтение или побеление листьев, отставание в росте и развитии. Если $рН_{почвы} > 7.5$, то в нее вносят удобрение сульфат аммония $(NH_4)_2SO_4$, которое способствует повышению кислотности благодаря гидролизу по катиону, проходящему в почве:
$NH_4^{+}+H_2O⇄NH_3·H_2O$
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма. Например, в состав крови входят соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Это происходит за счет смещения равновесия процессов гидролиза:
$HCO_3^{-}+H_2O⇄H_2CO_3+OH^{-}$
$HPO_4^{2-}+H_2O⇄H_2PO_4^{-}+OH^{-}$
Если в крови избыток ионов $Н^{+}$, они связываются с гидроксид-ионами $ОН^{-}$, и равновесие смещается вправо. При избытке гидроксид-ионов $ОН^{-}$ равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно.
Другой пример: в составе слюны человека есть ионы $HPO_4^{2-}$. Благодаря им в полости рта поддерживается определенная среда ($рН=7-7.5$).

Таблицы DPVA.ru — Инженерный Справочник
Адрес этой страницы (вложенность) в справочнике dpva.ru: 
Таблица значений PH кислот. (Растворов). Кислотность. Таблица водородных показателей
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Поиск в инженерном справочнике DPVA. Введите свой запрос: |
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н+), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН−).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н+ говорят, что раствор имеет кислую реакцию среды, если ОН− — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Na2S = 2Na+ + S2-
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO3)2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.
примечание: сернистую (H2SO3) и фосфорную (H3PO4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H+. Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом:
S2- + H2O ↔ HS− + OH−
HS−+ H2O ↔ H2S + OH−
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону.
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn2+, которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы:
Zn2+ + H2O ↔ Zn(OH) + + H+
Zn(OH) + + H2O ↔ Zn(OH)+ + H+
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону.
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na+ соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу.
Примеры: Ba(NO3)2, KCl, Li2SO4 и т.д.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K2CO3, Li2S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону, среда кислая.
Примеры: Zn(NO3)2, Fe2(SO4)3, CuSO4 и т.д.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону. Нередко такие соли подвергаются необратимому гидролизу.
Что же значит то, что они необратимо гидролизуются?
Поскольку в данном случае с водой реагируют и катионы металла (или NH4+) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H+, и ионы OH− , которые образуют крайне малодиссоциирующее вещество – воду (H2O).
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
2Al(NO3)3 + 3Na2S = Al2S3 + 6NaNO3 ( − так реакция не протекает!)
Наблюдается следующая реакция:
2Al(NO3)3 + 3Na2S + 6H2O= 2Al(OH)3↓+ 3H2S↑ + 6NaNO3
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
2Al + 3S = Al2S3
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑