Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
- Способы получения
- Химические свойства
Оксид меди (I)
- Химические свойства
Гидроксид меди (II)
- Химические свойства
Соли меди
Медь
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии:
+29Cu 1s22s22p63s23p63d104s1 1s 2s
2p
3s 3p
4s
3d
У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4оС, температура кипения 2567оС, плотность меди 8,92 г/см3.
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: растворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например, вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
Видеоопыт взаимодействия сульфата меди (II) с железом можно посмотреть здесь.
- Пирометаллургический метод: получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами. При этом образуется голубой осадок гидроксида меди(II).
Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 → 2Cu2О
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
Видеоопыт взаимодействия меди с серой можно посмотреть здесь.
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Но, обратите внимание:
2Cu + I2 = 2CuI
Видеоопыт взаимодействия меди с хлором можно посмотреть здесь.
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
Cu + H2 ≠
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2Cu + H2O + CO2 + O2 = (CuOH)2CO3
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H2SO4 (разб.) ≠
Видеоопыт взаимодействия меди с соляной кислотой можно посмотреть здесь.
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
2.4. Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
С разбавленной азотной кислотой:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами:
1. Термическим разложением гидроксида меди (II) при 200°С:
Cu(OH)2 → CuO + H2O
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
(CuOH)2CO3 2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства). При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
Видеоопыт взаимодействия оксида меди (II) с серной кислотой можно посмотреть здесь.
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например, оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
CuO + SO3 → CuSO4
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Видеоопыт взаимодействия оксида меди (II) с водородом можно посмотреть здесь.
Более активные металлы вытесняют медь из оксида.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
CH3CHO + 2Cu(OH)2 → CH3COOH + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СНО + 2Cu(OH)2 → CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например, соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2]+. Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuCl + 2NH3 = [Cu(NH3)2]Cl
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом:
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl + 2NH3
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например, при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя:
Cu2O + CO = 2Cu + CO2
Cu2O + H2 = 2Cu + H2O
3Cu2O + 2Al = 6Cu + Al2O3
А под действием окислителей, например, кислорода — свойства восстановителя:
2Cu2O + O2 = 4CuO
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например, хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH)2 → CuO + H2O
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
Также хлорид меди (I) реагирует с хлором:
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
Иодид меди (I) реагирует с концентрированной серной кислотой:
4CuI + 5H2SO4(конц.гор.) = 4CuSO4 + 2I2 + H2S + 4H2O
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.гор.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например, соли меди (II) окисляют иодиды и сульфиты:
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
Бромиды и иодиды меди (II) можно окислить перманганатом калия:
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
Соли меди (II) также окисляют сульфиты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
Более активные металлы вытесняют медь из солей.
Например, сульфат меди (II) реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой. При нагревании возможно образование сульфата меди (II):
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2 + 4H2O
Еще одна форма этой реакции:
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например, растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Электролиз раствора нитрата меди (II):
2Cu(NO3)2 + 2Н2О → 2Cu + O2 + 4HNO3
Некоторые соли меди при нагревании разлагаются, например, нитрат меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
(CuOH)2CO3 → 2CuO + CO2 + H2O
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.

9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Ответы и решения
1.
CuCl2 Cu + Сl2
на катоде на аноде
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
6NaOH(гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
2.
CuCl2 = Cu + Сl2
на катоде на аноде
Cu + S = CuS
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2↑ + 4H2O
или CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3.
NaNO3(тв.) + H2SO4(конц.) = HNO3 + NaHSO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
2NaNO3 = 2NaNO2 + O2↑
4.
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
5. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
Cu(OH)2 = CuO + H2O
CuO + C Cu + CO
6. Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
7. Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
8. (CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
9.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + CO2 = 2Na2CO3 + O2
10.
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
3CuO + 2NH3 = 3Cu + N2 + 3H2O
11.
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + H2 = Cu + H2O
12.
Cu + Cl2 = CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
13.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
CuO + H2 = Cu + H2O
14.
2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + NaOH = Cu(OH)2↓ + Na2SO4
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
15.
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
16.
2Cu + I2 = 2CuI
2CuI + 4H2SO4 = 2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
17.
2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
18.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
19) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
20.
Fe + 2HCl = FeCl2 + H2
CuO + H2 = Cu + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
21.
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
22.
Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
3CuO + 2NH3 = 3Cu + N2 + 3H2O
23.
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24.
CuO + CO = Cu + CO2
Cu + Cl2 = CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
.
25.
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
26.
H2C2O4 = CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
CuO + CO = Cu + CO2
27.
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Медь и соединения меди.
- Mедь – простое вещество.
Химически малоактивный металл, в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II) – малахит.
2Cu+ H2O + CO2 = (CuOH)2CO3
При нагревании медь реагирует с достаточно сильными окислителями,
- с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 2Cu2О 2Cu + О2
2CuО
- С галогенами , серой:Cu + Cl2 = CuCl2Сu + Br2 = CuBr2Cu + S
CuS
- С кислотами-окислителями:
при нагревании в концентрированной серной кислоте:
Cu + 2H2SO4(конц.)CuSO4 + SO2 + 2H2O
без нагревания в азотной кислоте:
Cu + 4HNO3(конц.)= Cu(NO3)2 + 2NO2 + 2H2O
3Cu +8HNO3(разб..)= 3Cu(NO3)2 + 2NO2 + 4H2O
3Cu + 2HNO3 + 6HCl = 3CuCl2 + 2NO + 4H2O
- Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO2FeCl3 + Cu = 2FeCl2 + CuCl2!!!!!!!!!!!!!!
- Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
- Соединения меди.
- Оксиды.
Оксид меди (II) проявляет слабо выраженные амфотерные свойства (с преобладанием основных). СuO взаимодействует с кислотами: СuO + 2HBr = CuBr2 + H2O
- В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
3CuO + 2NH33Cu + N2 + 3H2O СuO + C = Cu + CO 3CuO + 2Al = 3Cu + Al2O3
- В лаборатории оксид меди (II) получают окислением меди при нагревании, или прокаливанием (CuOH)2CO3, Cu(NO3)2:
2Cu + O2 2CuO (CuOH)2CO3
2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Оксид меди (I) обладает основными свойствами.
- При действии на оксид меди (I) галогеноводородной кислотой получают галогениды меди (I) и воду: Cu2O + 2HCl = 2CuCl↓ + H2O
- При растворении Cu2O в кислородсодержащих кислотах, например, в растворе серной, образуются соли меди (II) и медь: Cu2O + H2SO4(разб.) = CuSO4 + Cu + H2O
- В концентрированной серной, азотной кислотах образуются только соли (II).
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
Cu2O + 6HNO3(конц.)= 2Cu(NO3)2 + 2NO2 + 3H2O
5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
- Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2]+. Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH CuCl+ 2NH3 = [Cu(NH3)2]Cl
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом:
СH ≡ CH+ 2[Cu(NH3)2]Cl→Сu–C ≡ C–Cu + 2NH4Cl
- В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность
Cu2O + CO = 2Cu + CO2 3Cu2O + 2Al = 6Cu + Al2O3 2Cu2O +O2 = 4CuO
В лаборатории его получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
CH3CHO + 2Cu(OH)2 CH3COOH + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СНО + 2Cu(OH)2CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
- Гидроксиды.
Гидроксид меди (II) проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
- Сu(OН)2 взаимодействует с кислотами: Сu(OН)2 + 2HBr = CuBr2 + 2H2O
- Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
- При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH )2 + 2NaOH(конц.)= Na2[Cu(OH)4]
- При нагревании гидроксид меди (II) разлагается: Сu(OH)2
CuO + H2O
- Соли.
Соли меди (I). В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность.
- Как восстановители они реагируют с окислителями:
CuCl + 3HNO3(конц.)= Cu(NO3)2 + HCl + NO2 + H2O
2CuCl+ Cl2 = 2CuCl2
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
2CuI + 4H2SO4 + 2MnO2= 2CuSO4 + 2MnSO4+ I2 + 4H2O
4CuI + 5H2SO4(конц.гор.)= 4CuSO4 + I2 + H2S + 4H2O
Cu2S + 8HNO3(конц.хол.)= 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S +12HNO3(конц.хол.)=Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
- Для соединений меди (I) возможна реакция диспропорционирования:2CuCl =Cu + CuCl2
- Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака: CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II). В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
2CuCl2 + 4KI = 2CuI + I2 + 4HCl
2CuCl2 + Na2SO3 + 2NaOH =2CuCl + Na2SO4 + 2NaCl + H2O
5CuBr2 + 2KMnO4 + 8H2SO4=5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4+ 2H2SO4
CuSO4 + Fe = FeSO4 + Cu
CuS +8HNO3(конц.гор..)=CuSO4 + 8NO2+ 4H2O
CuS+ 2FeCl3= CuCl2 + 2FeCl2 + S
2CuS + 3O2 2CuO + 2SO2↑
CuS + 10HNO3(конц.)= Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
2CuCl2+ 4KI = 2CuI + I2↓ + 4KCl
CuBr2 + Na2S = CuS↓ + 2NaBr
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
CuSO4 +Cu + 2NaCl = 2CuCl↓ + Na2SO4
2Cu(NO3)2+ 2Н2О2Cu + O2 + 4HNO3
2Cu(NO3)2 2CuO + 4NO2 + O2
CuCl2 +4NH3 = [Cu(NH3)4]Cl2
Медь и соединения меди.
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6)В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.

9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17)Крастворухлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18)Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19)Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20)Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21)Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22)Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Поученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка.Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа.Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты.Напишите уравнения описанных реакций.
Медь. Соединения меди.
1. CuCl2Cu+ Сl2
на катоде на аноде
Cu + 4HNO3(конц.)= Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
6NaOH(гор.)+ 3Cl2 = NaClO3 + 5NaCl + 3H2O
2. CuCl2Cu+ Сl2
на катоде на аноде
Cu + SCuS
CuS + 8HNO3(конц.гор.)= CuSO4 + 8NO2↑ + 4H2O
илиCuS + 10HNO3(конц.)= Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3. NaNO3(тв.)+ H2SO4(конц.)= HNO3 + NaHSO4
Cu + 4HNO3(конц.)= Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
2NaNO32NaNO2 +O2↑
4. Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
5. 3Cu + 8HNO3(разб.)= 3Cu(NO3)2 + 2NO↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
CuO +CCu + CO
6. Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
7. Cu2O +6HNO3(конц.)= 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
8. (CuOH)2CO3 2CuO + CO2 + H2O
CuO +H2Cu + H2O
Cu + 2H2SO4(конц.)= CuSO4 + SO2 + 2H2O
CuSO4 +Cu + 2NaCl = 2CuCl↓ + Na2SO4
9.3Cu + 8HNO3(разб.)= 3Cu(NO3)2 + 2NO2↑ + 4H2O
2Cu(NO3)2+ 2H2O 2Cu+ O2+ 4HNO3
накатоденааноде
2Na +O2 = Na2O2
2Na2O2 +CO2 = 2Na2CO3 + O2
10. (CuOH)2CO3 2CuO + CO2 + H2O
CuO + 2HNO3 Cu(NO3)2 + H2O
2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
3CuO + 2NH3 3Cu + N2 + 3H2O
11. CuO + H2SO4 CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 CuO + H2O
CuO + H2 Cu + H2O
12. Cu + Cl2 CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2 CuO + H2O
CuO + C Cu + CO
13.Cu + 4HNO3(конц.)= Cu(NO3)2 + 2NO2↑ + 2H2O
4NO2 + O2 + 2H2O = 4HNO3
2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
CuO +H2Cu + H2O
14. 2Cu + O2= 2CuO
CuO+ H2SO4= CuSO4 + H2O
CuSO4+ NaOH= Cu(OH)2↓ + Na2SO4
Сu(OH)2+ 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
15. СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 CuO + H2O
CuO + C Cu + CO
Cu + 2H2SO4(конц.)= CuSO4 + SO2 + 2H2O
16) 2Cu + I2 = 2CuI
2CuI + 4H2SO4 2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 CuO + H2O
17) 2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3 2CuO + CO2 + H2O
CuO +H2Cu + H2O
3Cu + 8HNO3(разб.)= 3Cu(NO3)2 + 2NO2↑ + 4H2O
18)3Cu + 8HNO3(разб.)= 3Cu(NO3)2 + 2NO2↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4= CuSO4 + 2(NH4)2SO4 + 2H2O
19) Cu + 4HNO3(конц.)= Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl= CuCl2 + 4NH4Cl+ 2H2O
20) Fe + 2HCl = FeCl2 + H2
CuO+ H2 = Cu + H2O
Cu + 4HNO3(конц.)= Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2+ 2H2O 2Cu + O2 + 4HNO3
21) I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3Cu(NO3)2 + 2H2O
2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
22) Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 CuO + H2O
3CuO + 2NH3 3Cu + N2 + 3H2O
23) CuO+ H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O2Cu + O2 + 2H2SO4
4NO2+ O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24) CuO + CO Cu + CO2
Cu + Cl2= CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
25) 2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
CuO+ H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц.)= Cu(NO3)2 + 2NO2↑ + 2H2O
26) H2C2O4 CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2 2CuO + 4NO2↑+ O2↑
CuO + CO Cu + CO2
27) Cu + 2H2SO4(конц.)= CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl CuCl2 + 2H2O
Медь – d
элемент, расположенный в 1B
подгруппе – 3 d10
4 S1
Степень окисления + 1, + 2
v Химически
малоактивный Ме
1. 2 Cu
+ O2
=t
2CuO
(или Cu2O в зависимости от условий)
2. Cu +
Cl2 =t CuCl2
c CuS или Cu2S
3. Cu +
Br =t CuBr2 2Cu + O2 + CO2 + H2O
=t Cu (OH)2 . CuCO3
v Не
реагирует с H2O,
растворами щелочей, с разбавленной H2SO4
и HCl.
v Медленно
окисляется в солянокислом растворе:
2Cu +
4HCl + O2 = 2CuCl2 + 2H2O
v 2H2SO4(концентрированная)
+
Cu
=t CuSO4 + SO2 + 2H2O
8HNO3(разбавленная) + 3Cu
= Cu(NO3)2 + 2NO + 2H2O
4HNO3(концентрированная)+
Cu
= Cu(NO3)2
+ 2NO2
+ 2H2O
v Окисляет
некоторые оксиды НеМе
4Cu + SO2 =t Cu2S + 2CuO;
CuS + 2O2 = 2CuO + SO2!
4Cu + 2NO2 =t 4CuO +
N2; CuO + Cu2S =t 4Cu +
SO2
Ø Cu2O
– основной характеристикой является окраска красного цвета, нерастворим в воде(H2O).
Cu2O
+ 2HJ
= 2CuJ(осадок)
+ H2O,
существуют только Cu2S
и галогениды, соли Cu(I)
кислородосодержащие не получены, устойчивы комплексные соли.
§ Восстановление: Cu2O
+ CO = 2Cu + CO2
§ Окисление: CuCl
+ HNO3 = Cu(NO3)2 + HCl + NO2 + H2O
§ Диспропорционирование: Cu2SO4
=H2O Cu+ CuSO4
Ионы Cu+
в водном растворе не существуют
Ø CuO
– основный оксид, слабоамфотерные свойства.
CuO +
Na2O = Na2CuO2; Cu(OH)2 =t
CuO + H2O.
§ Восстановление:
2CuSO4
+ 4KJ
= 2CuJ
+ J2
+ K2SO4;
CuCl2
+ Cu = CuCl;
CuCl2
+ SO2 + 4NaOH = 2CuCl + Na2SO4 + 2NaCl + 2H2O;
2CuS +
H2 = Cu2S + H2S;
CuO +
H2 =t Cu + H2O; Fe + CuSO4
= FeSO4 + Cu;
2.2.4. Химические свойства переходных металлов (меди, цинка, хрома, железа).
Химические свойства меди
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s22s22p63s23p63d104s1 вместо предполагаемой формулы 1s22s22p63s23p63d94s2. Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(NH3)2]Cl и [Cu(NH3)2]OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400оС образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
Cu + Br2 = CuBr2
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 оС может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4
Cu + 2FeCl3 = CuCl2 + 2FeCl2
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
2Cu + H2O + СО2 + О2 = (CuOН)2СO3
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + H2O + O2 + CO2 → Zn2(OH)2CO3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Zn + H2SO4 (20%) → ZnSO4 + H2↑
Zn + 2HCl → ZnCl2 + H2↑
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Zn + H2O = ZnO + H2↑
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Zn + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2H2O
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO↑ + 4H2O
4Zn +10HNO3(20%) = 4Zn(NO3)2 + N2O↑ + 5H2O
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2↑ + 6H2O
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + NH4NO3 + 3H2O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + Ba(OH)2 + 2H2O = Ba[Zn(OH)4] + H2↑
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
4Zn + NaNO3 + 7NaOH + 6H2O → 4Na2[Zn(OH)4] + NH3↑
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Zn + 4NH3·H2O → [Zn(NH3)4](OH)2 + H2↑ + 2H2O
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl2 = Cu + ZnCl2
Zn + FeSO4 = Fe + ZnSO4
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O2 = ot=> 2Cr2O3
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 oC соответственно):
2Cr + 3F2 = ot=> 2CrF3
2Cr + 3Cl2 = ot=> 2CrCl3
С бромом же хром реагирует при температуре красного каления (850-900 oC):
2Cr + 3Br2 = ot=> 2CrBr3
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 oС:
2Cr + N2 =ot=> 2CrN
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
Cr + S =ot=> CrS
2Cr + 3S =ot=> Cr2S3
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
2Cr + 3H2O =ot=> Cr2O3 + 3H2↑
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
Cr + 6HNO3(конц.) =to=> Cr(NO3)3 + 3NO2↑ + 3H2O
2Cr + 6H2SO4(конц) =to=> Cr2(SO4)3 + 3SO2↑ + 6H2O
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
10Cr + 36HNO3(разб) = 10Cr(NO3)3 + 3N2↑ + 18H2O
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
Cr + 2HCl = CrCl2 + H2↑
Cr + H2SO4(разб.) = CrSO4 + H2↑
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» H2FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
3Fe + 2O2 =to=> Fe3O4
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Fe + S =to=> FeS
Либо же при избытке серы дисульфид железа:
Fe + 2S =to=> FeS2
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =to=> 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =to=> 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =to=> 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Fe + I2 =to=> FeI2 – йодид железа (ll)
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Взаимодействие со сложными веществами
Взаимодействие с кислотами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Fe + H2SO4 (разб.) = FeSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Взаимодействие с кислотами-окислителями
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
2Fe + 6H2SO4 = ot=> Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3 =ot=> Fe(NO3)3 + 3NO2 + 3H2O
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
Коррозия (ржавление) железа
На влажном воздухе железо весьма быстро подвергается ржавлению:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 оС). т.е.:
Чтобы поделиться, нажимайте
Медь расположена в IB группе Периодической системы химических элементов Д.И. Менделеева. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d94s2, однако вследствие устойчивости d10-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d104s1. В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
Физические свойства меди
Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см3.
На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 оС металл покрывается темно-красной пленкой оксида меди (I):
4Cu + O2 = 2Cu2O
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Cu + S = CuS
4Cu + SO2= Cu2S + 2CuO
4Cu + 2NO2 = 4CuO + N2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
С концентрированной горячей соляной кислотой:
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:
Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:
Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод
Электролиз раствора сульфата меди:
медь
I . Исторические сведения
II . Медь – химический элемент:
1) Положение меди в периодической системе
химических элементов Д.И.Менделеева
2) Строение атома.
3) Нахождение в природе
III. Медь – простое вещество
1. Состав. Строение. Свойства .
2 . Получение.
3. Химические свойства
4 . Применение
5. Биологическое значение меди.
IV. Соединения меди
VI . Качественная реакция на медь
I . Исторические сведения
Медь (англ. Copper, франц. Cuivre, нем. Kupfer) — один из первых металлов, которые человек стал применять для технических целей. В древности медь применялась в основном в виде сплава с оловом — бронзы для изготовления оружия. Периоды использования меди и бронзы ознаменовали целые эпохи культурного развития человечества под названием медный век и бронзовый век.
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III в. до н. э. существовали медные рудники и производилась выплавка меди.
Положение меди в ПСХЭ Д.И. Менделеева. Строение атома.
порядковый номер
группа
период
I B
Cu
4
4
29
+29
металл
4 s 1
2 s 2 2 p 6
1 s 2
3 s 2 3 p 6
3 d 1 0
1 8
1
8
2
валентные электроны
Cu 0 ─ 2e → Cu +2
Cu 0 ─ 1 e → Cu +1
Нахождение меди
в природе
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS 2 , также известный как медный колчедан, халькозин Cu 2 S и борнит Cu 5 FeS 4 . Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu 2 O , азурит Cu 3 (CO 3 ) 2 (OH) 2 , малахит Cu 2 CO 3 (OH) 2 . Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн .
Медь занимает по распространению в природе 23-е место среди всех элементов: ее массовая доля в земной коре равна 0,01%.
Физические свойства
Медь тяжелый розово-красный металл, мягкий и ковкий, плавится при температуре 1084,5°С, очень хорошо проводит электрический ток и теплоту: электрическая проводимость меди в 1,7 раза выше, чем алюминия, в 6 раз выше, чем железа, и лишь немного уступает электрической проводимости серебра
Кристаллическая решётка меди .
Получение меди
Исходным сырьем для промышленного получения меди
являются сульфидные руды. Процесс получения меди из
сульфидных руд относят к пирометаллургическим
(протекающим при повышенной температуре)
Вначале сульфид меди (например, Cu 2 S) подвергают окислительному обжигу:
Cu 2 S + 20 2 = 2CuO + S0 2
К образовавшемуся оксиду, меди (II) добавляют новую порцию сульфида. При высокой температуре протекает реакция: 2CuO + Cu 2 S = 4Сu + S0 2
Очищают медь от примесей электролитическим рафинированием.
Для этой цели в качестве анода используют медные листы , подлежащие
рафинированию, в качестве катода – пластинки чистой меди , электролита –
раствор сульфата меди ( II ). При прохождении электрического тока через
электролит медь анода растворяется, а на катоде выделяется чистая медь,
т.е. протекает электролиз с растворимым анодом.
Анод, нерафинированная
медь.
Содержащиеся в меди примеси остаются в растворе часть из них – анодный шлам – оседает на дне электролитической ванны.
Анодный шлам служит важным
источником благородных металлов
е
е
+
CuSO 4 = Cu 2+ + SO 4 2–
Cu 2+
Cu 2+ + 2e →Cu 0
На катоде :
Cu 0 − 2e → Cu 2+
На аноде :
Cu 2+
Катод,
рафинированная
медь.
примеси
Получение меди гидрометаллургическим способом.
Медную руду обрабатывают растворами серной кислоты или
или аммиака:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuO + 4NH 3 + H 2 O = [Cu(NH 3 ) 4 ](OH) 2
Медь, перешедшую в раствор, восстанавливают более активным металлом:
CuSO 4 + Fe = FeSO 4 + Cu
[Cu(NH 3 ) 4 ](OH) 2 + Zn = Cu + [Zn(NH 3 ) 4 ](OH) 2
Химические свойства
Cu
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn,Cr Fe Co,Sn,Pb, H 2, Hg,Ag,Au
О 2
+
+
Cu
неметаллы
H 2 SO 4 (конц.)
HNO 3
+
растворы солей
+
При комнатной температуре медь устойчива на воздухе.
При нагревании на воздухе металл покрывается черной
пленкой оксида меди ( II) . Составьте уравнение реакции.
2Cu + O 2 = 2CuO
При длительном хранении медные изделия покрываются
зеленым налетом .
2Cu + CO 2 + H 2 O + O 2 = (CuOH) 2 CO 3
Взаимодействие с неметаллами:
Медь вступает в реакции с галогенами, серой, селеном.
С водородом, углеродом, азотом медь не взаимодействует
даже при высокой температуре.
Составьте уравнение реакции меди с хлором, бромом, серой. Рассмотрите эти реакции как окислительно-восстановительные. Назовите окислитель и восстановитель.
Cu 0 + Br 2 0 = Cu +2 Br 2 –
Cu 0 ─ 2e → Cu +2 1
Br 2 0 + 2e → 2Br –1 1
Cu 0 ─ восстановитель, процесс окисления
Br 2 – окислитель, процесс восстановления
Взаимодействие хлора с медью
Даже малоактивные металлы энергично взаимодействуют с хлором. Пучок медной проволоки, нагретый в пламени горелки помещают в цилиндр, наполненный хлором. Медь раскаляется, взаимодействует с хлором, с кончика проволоки на дно цилиндра начинает капать расплавленный хлорид меди ( II ).
Cu 0 + Cl 2 0 = Cu +2 Cl 2 –
опыт
Cu 0 ─ 2e → Cu +2 1
Cl 2 0 + 2e → 2Cl –1 1
Cu 0 ─ восстановитель, процесс окисления
Cl 2 – окислитель, процесс восстановления
Взаимодействие серы с медью
Медь — неактивный металл. Но при повышенных температурах она активно взаимодействует с серой. Сера плавится и постепенно закипает. Пробирка наполняется бурыми парами серы. В парах серы медь загорается. Продукт взаимодействия – черный сульфид меди.
Cu + S = CuS
опыт
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь
расположена правее водорода. Кислоты не обладающие
окислительными свойствами, на нее не действуют, но медь
легко растворяется в кислотах-окислителях – концентрирован-
ной серной и азотной. Рассмотрите эти реакции как
окислительно-восстановительные. Назовите окислитель и
восстановитель.
0
+6
+2
+4
Cu + H 2 S O 4 → Cu SO 4 + S O 2 + H 2 O
опыт
Cu 0 ─ 2e → Cu +2 2
S +6 + 4e → S +4` 1
Cu + 2 H 2 SO 4 = CuSO 4 + SO 2 + 2 H 2 O
Cu 0 ─ восстановитель, процесс окисления
H 2 SO 4 (за счет S +6 ) – окислитель, процесс восстановления
0
+5
+2
Cu + HN O 3 → Cu (NO 3 ) 2 + N O 2 + H 2 O
+4
Cu 0 ─ 2e → Cu +2 1
N + 5 + 1e → N +4` 2
Cu + 4 HNO 3 = Cu(NO 3 ) 2 + 2 NO 2 + 2 H 2 O
Cu 0 ─ восстановитель, процесс окисление
HNO 3 – окислитель, процесс восстановление
опыт
+2
+2
0
+5
0
Cu + HN O 3 → Cu (NO 3 ) 2 + N O + H 2 O
Cu 0 ─ 2e → Cu +2 3
N + 5 + 3 e → N +4 2 2
3 Cu + 8 HNO 3 = 3 Cu(NO 3 ) 2 + 2 NO 2 + 4 H 2 O
Cu 0 ─ восстановитель, процесс окисление
HNO 3 – окислитель, процесс восстановление
Разбавленные серная и соляная кислоты на медь не
действуют. Однако в присутствии кислорода воздуха медь
растворяется в этих кислотах с образованием солей меди (II):
2Cu + O 2 + 2H 2 SO 4 = 2CuSO 4 + 2H 2 O
2Cu + O 2 + 4HCl = 2CuCl 2 + 2H 2 O
Взаимодействие с растворами солей
+ 2
+2
0
0
Cu + Hg(NO 3 ) 2 → Cu(NO 3 ) 2 + Hg
опыт
Рассмотрите эту реакцию как окислительно-восстановительную и
расставьте коэффициенты.
Cu 0 ─ 2e → Cu +2 1
Hg +1 + 2e → Hg 0 1
Cu + Hg(NO 3 ) 2 = Cu(NO 3 ) 2 + Hg
Cu 0 ─ восстановитель, процесс окисления
Hg(NO 3 ) 2 (за счет Hg +2 ) – окислитель, пр . восстановления
Применение меди
в электротехнике
1
теплоотводные устройства
2
производство труб
3
сплавы на основе меди
4
ювелирные сплавы
5
в архитектуре
6
другие сферы применения
7
Из-за низкого удельного сопротивления медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов. Для этих целей металл должен быть очень чистый
1
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся радиаторы охлаждения, кондиционирования и отопления.
2
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов, во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
3
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых бронза и латунь, дюралюминий ( w ( Cu) = 4 ,4%)
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880°С .
4
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к этим механическим воздействиям.
Медь применяют для изготовления украшений
5
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди служат безаварийно по 100—150 лет.
6
Другие сферы применени я
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
7
Биологическая роль
Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития. В растениях и животных содержание меди варьируется от 10 -15 до 10 -3 %. Всего в организме человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных — участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов. Так как медь токсична, в животном организме она находится в связанном состоянии. Медь необходима для осуществления различных функций организма — дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.
Соединения меди
оксиды
гидроксиды
соли
Соединения меди ( I )
Оксид меди ( I) красного цвета, в
природе встречается в виде минерала
куприта.
Соединения меди ( I )
Cu 2 O
Составьте формулу оксида меди ( I).
В лаборатории его получают восстановлением свежеосажденного гидроксида меди ( II) альдегидами или глюкозой.
опыт
O O
Н – С + 2 Cu(OH) 2 → H – C + Cu 2 O ↓+ 2 H 2 O
H OH
t°
O O
CH 2 ОН – ( C НОН) 4 – С + 2 Cu(OH) 2 → CH 2 ОН – ( C НОН) 4 – С +
H OH
+ Cu 2 O + 2H 2 O
t°
опыт
Получают оксид меди(I) прокаливанием металлической
меди при недостатке кислорода
4Cu + O 2 = 2 Cu 2 O
Химические свойства Cu 2 O
При нагревании без доступа воздуха разлагается на металлическую медь и оксид меди (II):
Cu 2 O = CuO + Cu
Водородом, оксидом углерода (II), алюминием оксид меди ( II) восстанавливается до металлической меди:
Cu 2 O + H 2 = 2Cu + H 2 O
Cu 2 O + CO = 2Cu + CO 2
3 Cu 2 O + 2 Al = 6 Cu + Al 2 O 3
1) В разбавленной серной и соляной кислотах растворяется только в присутствии кислорода.
2Cu 2 O + 8HCl (разб.) + O 2 = 4CuCl 2 + 4H 2 O
2) В концентрированной серной кислоте растворяется с выделением диоксида серы SO 2 .
С u 2 O + H 2 SO 4 (конц.) → CuSO 4 + SO 2 + H 2 O
3) В концентрированной азотной кислоте растворяется с выделением диоксида азота N O 2
Cu 2 O + HNO 3 → Cu(NO 3 ) 2 + NO 2 + H 2 O
Рассмотрите реакции 2,3 как окислительно-восстановительные. Расставьте коэффициенты. Определите окислитель, восстановитель
С u +1 2 O + H 2 S +6 O 4( конц.) → Cu +2 SO 4 + S +4 O 2 + H 2 O
С u +1 – 1е → Cu +2 2
S +6 + 2е → S +4 1
С u 2 O + 3 H 2 SO 4 = 2 CuSO 4 + SO 2 + 3 H 2 O
С u 2 O (за счёт С u +1 ) — восстановитель, процесс окисления
H 2 SO 4 (за счёт S +6 ) – окислитель, процесс восстановления
Cu 2 +1 O + HN + 5 O 3( конц.) = Cu +2 (NO 3 ) 2 + N +4 O 2 + H 2 O
С u +1 – 1е → Cu +2 1
N + 5 + 1 е → N +4 1
Cu 2 O + 6HNO 3( конц.) = 2Cu(NO 3 ) 2 + 2NO 2 + 3H 2 O
С u 2 O (за счёт С u +1 ) — восстановитель, процесс окисления
HNO 3 (за счёт N +5 ) – окислитель, процесс восстановления
Устойчивыми соединениями меди ( I) являются
нерастворимые соединения ( CuCl, Cu 2 S ) или комплексные соединения [Cu(NH 3 ) 2 ]OH, [Cu(NH 3 ) 2 ]Cl,
которые получают растворением в концентрированном растворе аммиака оксида меди ( I), хлорида меди (I)
Cu 2 O + 4 (NH 3 · H 2 O) = 2[Cu(NH 3 ) 2 ]OH + 3Н 2 О
CuCl + 2NH 3 = [Cu(NH 3 ) 2 ]Cl
Аммиачные растворы солей меди взаимодействуют с
алкинами, например, с ацетиленом:
CH ≡ CH + 2[Cu(NH 3 ) 2 ]Cl → Cu–C≡C–Cu + 2NH 3 + 2NH 4 Cl
В окислительно-восстановительных реакциях соединения
меди ( I) проявляют окислительно-восстановительную
двойственность.
С u 2 O + H 2 → Cu + H 2 O
С u 2 O + H 2 SO 4 + KMnO 4 → CuSO 4 + MnSO 4 + K 2 SO 4 + H 2 O
С uCl + HNO 3 → Cu(NO 3 ) 2 + HCl + NO 2 + H 2 O
Рассмотрите реакции как окислительно-восстановительные.
Определите окислитель, восстановитель
С u 2 +1 O + H 2 0 → Cu 0 + H 2 +1 O
С u +1 + 1е → Cu 0 2
Н 2 0 – 2е → 2Н +1 1
С u 2 O + H 2 = 2 Cu + H 2 O
С u 2 O (за счет С u +1 ) – окислитель, процесс восстановления
Н 2 – восстановитель, процесс окисления
С u 2 +1 O + H 2 SO 4 + KMn +7 O 4 →Cu +2 SO 4 + Mn +2 SO 4 + K 2 SO 4 + H 2 O
2С u +1 – 2е → 2 Cu +2 5
Mn + 7 + 5 е → Mn + 2 2
5 С u 2 O + 13H 2 SO 4 + 2KMnO 4 = 10CuSO 4 + 2MnSO 4 + K 2 SO 4 +
+ 13H 2 O
С u 2 O (за счет С u +1 ) – восстановитель, процесс окисления
KMnO 4 ( за счет Mn + 7 ) – окислитель, процесс восстановления
С u +1 Cl + HN +5 O 3 → Cu +2 (NO 3 ) 2 + HCl + N +4 O 2 + H 2 O
С u +1 – 1е → Cu +2 5
N + 5 + 1 е → N + 4 1
С uCl + 3 HNO 3( конц.) = Cu(NO 3 ) 2 + HCl + NO 2 + H 2 O
С uCl (за счет С u +1 ) – восстановитель, процесс окисления
HNO 3 ( за счет N + 5 ) – окислитель, процесс восстановления
оксид меди ( II )
Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита
(мелаконита) чёрного цвета.
CuO
Составьте формулу оксида меди ( II).
Получение оксида меди (II)
Оксид меди ( II ) получают как при взаимодействии меди с
кислородом, так и при разложении гидроксида меди ( II ),
нитрата меди ( II ) и малахита ( CuOH ) 2 CO 3 .
Составьте уравнения реакций получения оксида меди ( II)
t°
2Cu + O 2 = 2CuO
t°
Cu(OH) 2 = CuO + H 2 O
опыт
t°
2Cu(NO 3 ) 2 = 2CuO + 4NO 2 + O 2
t°
опыт
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O
Химические свойства CuO
Оксид меди ( II ) обладает слабыми амфотерными
свойствами, т.е. взаимодействуют как с кислотами так и
со щелочами.
Составьте уравнения реакции взаимодействия CuO
c соляной, серной кислотами.
CuO + 2HCl = CuCl 2 + H 2 O
CuO + 2H + + Cl – = Cu 2+ + 2Cl – + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
опыт
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuO + 2H + + SO 4 2– = Cu 2+ + SO 4 2– + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
При сплавлении со щелочами CuO образует куприты:
CuO + 2KOH = K 2 CuO 2 + H 2 O
Взаимодействие уксусной кислоты с оксидом меди ( II)
Как и неорганические кислоты, уксусная кислота реагирует с оксидами металлов. При обычных условиях реакция идет очень медленно. При нагревании наблюдается растворение
Н оксида меди ( II ) и появление голубой окраски раствора. В пробирке образовался ацетат меди ( II ).
2 СН 3 СООН + CuO → (CH 3 COO) 2 Cu + H 2 O
опыт
Оксид меди ( II ) при нагревании взаимодействует с аминоуксусной кислотой. Раствор приобретает голубую окраску. Альфа-аминокислоты дают с медью окрашенные, очень устойчивые комплексные соли. Эти комплексные соединения очень прочны и не разрушаются под действием раствора щелочи.
опыт
Такие восстановители, как водород, аммиак, оксид
углерода (II), кокс, алюминий и другие восстанавливают
CuO до свободной меди.
Составьте уравнения реакций.
опыт
CuO + H 2 = Cu + H 2 O
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O
CuO + C О = Cu + CO 2
CuO + C ( кокс) = Cu + CO
3CuO + 2Al = 3Cu + Al 2 O 3
CuO обладает слабыми амфотерными свойствами.
При сплавлении со щелочами оксид меди ( II ) образует
купраты.
CuO + 2 KOH = K 2 CuO 2 + H 2 O
Оксид меди ( II ) растворяется в водном растворе аммиака
CuO + 4(NH 3 · H 2 O) = [Cu(NH 3 ) 4 ](OH) 2 + 3H 2 O
Оксид меди ( II )
восстанавливается
спиртами, превращая их в
альдегиды
O
CuO + C 2 H 5 OH → CH 3 ─ C + Cu + H 2 O
H
опыт
Гидрооксид меди ( II )
Гидроксид меди(II) — голубое аморфное или кристаллическое вещество.
Составьте формулу гидроксида меди ( II).
Cu(OH) 2
Получение гидроксида
меди (II)
Лабораторный опыт.
К раствору сульфата меди ( II ) добавляйте по каплям раствор гидроксида натрия. Образующийся в начале голубой осадок
основной соли в избытке щелочи переходит в синий гидроксид меди ( II ).
Составьте уравнения реакций получения гидроксида
меди( II ), используя сульфат меди ( II ), хлорид меди ( II ) и гидроксид натрия. Рассмотрите реакции с т.зр. ТЭД.
опыт
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
Cu 2+ + SO 4 2– + 2Na + + 2OH – = Cu(OH) 2 ↓ + 2Na + + SO 4 2–
Cu 2+ + 2OH – = Cu(OH) 2 ↓
CuCl 2 + 2NaOH = Cu(OH) 2 + 2NaCl
Cu 2+ + 2Cl – + 2Na + + 2OH – = Cu(OH) 2 ↓ + 2Na + + 2Cl –
Cu 2+ + 2OH – = Cu(OH) 2 ↓
Химические свойства Cu ( O H) 2
Перечислите свойства нерастворимых оснований.
Составьте уравнения реакций гидроксида меди ( II ) с
растворами кислот (соляной и серной). Рассмотрите
реакции с точки зрения теории электролитической
диссоциации.
Cu(OH) 2 + Н 2 SO 4 = CuSO 4 + 2 H 2 O
опыт
Cu(OH) 2 + 2 Н + + SO 4 2– = Cu 2+ + SO 4 2– + 2 H 2 O
Cu(OH) 2 + 2 Н + = Cu 2+ + 2 H 2 O
Cu(OH) 2 + 2HCl = CuCl 2 + 2 H 2 O
Cu(OH) 2 + 2 Н + + 2Cl – = Cu 2+ + 2Cl – + 2 H 2 O
Cu(OH) 2 + 2 Н + = Cu 2+ + 2 H 2 O
Лабораторный опыт.
Нагрейте пробирку с гидроксидом меди ( II ).
Чем вызвано изменение окраски?
Составьте уравнение реакции.
нагревание
голубая суспезия
Cu(OH) 2
черный осадок
CuO
опыт
t°
С u(OH) 2 CuO + H 2 O
Гидроксид меди ( II ) очень легко растворяется в избытке аммиака с образованием аммиаката меди. Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов меди(II) в растворе.
Cu(OH) 2 + 4NH 4 OH = [Cu(NH 3 ) 4 ](OH) 2 + 4H 2 O
или
Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2
Гидроксид меди ( II ) при нагревании окисляет альдегиды до карбоновых кислот. При этом интенсивная окраска реактива исчезает и образуется кирпично-красный осадок оксида меди ( I ).
опыт
t°
Н-СОН + 2 Cu ( OH ) 2 HCOOH + Cu 2 О + 2 H 2 O
При добавлении к глицерину , осадок гидроксида меди (II) растворяется и образуется темно-синий раствор глицерата меди (II). При добавлении гидроксида меди (II) к раствору этиленгликоля также образуется темно-синий раствор. Реакция с гидроксидом меди (II) является качественной реакцией на многоатомные спирты.
опыт
H
СН 2 – ОН СН 2 – О O– СН 2
Cu
2 СН – ОН + Cu(OH) 2 СН 2 – О O– СН 2
– 2H 2 O H
СН 2 – ОН СН 2 –О H СН 2 – OH
Соли
Сульфат меди(II) (CuSO 4 ) — белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO 4 · 5H 2 O — медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения
опыт
Малахит (основной карбонат меди) – Cu 2 (OH) 2 CO 3
При нагревании до 200°С разлагается с выделением
углекислого газа и воды, превращаясь в черный оксид
меди ( II )
t°
Cu 2 (OH) 2 CO 3 2CuO + H 2 O + CO 2
опыт
Для малахита характерна растворимость в кислотах с выделением углекислого газа, а также в аммиаке, который окрашивается при этом в голубой цвет.
(CuOH) 2 CO 3 + 4 HCl = 2CuCl 2 + CO 2 + 3 H 2 O
(CuOH) 2 CO 3 + 8(NH 3 ·H 2 O) = [Cu(NH 3 ) 4 ]CO 3 + +[Cu(NH 3 ) 4 ](OH) 2 + 8H 2 O
С глубокой древности известен способ получения из малахита свободной меди. В условиях неполного сгорания угля, при котором образуется угарный газ, происходит реакция:
2CO+(CuOH) 2 CO 3 =3CO 2 +2Cu+ H 2 O
Медь можно обнаружить по зелёно-голубой окраске пламени .







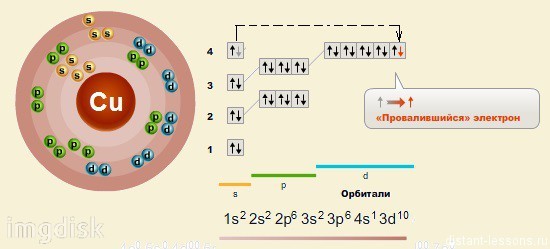

![{displaystyle {mathsf {2Cu+4HCllongrightarrow 2H[CuCl_{2}]+H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc80bfb324a1e02cf0b53b9c94e705f56502ee4d)













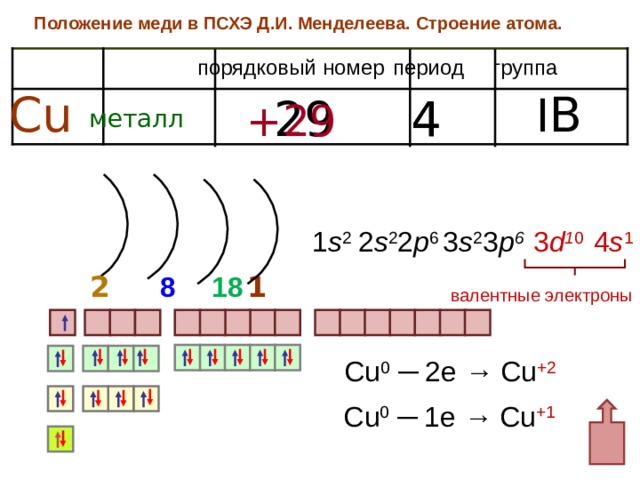





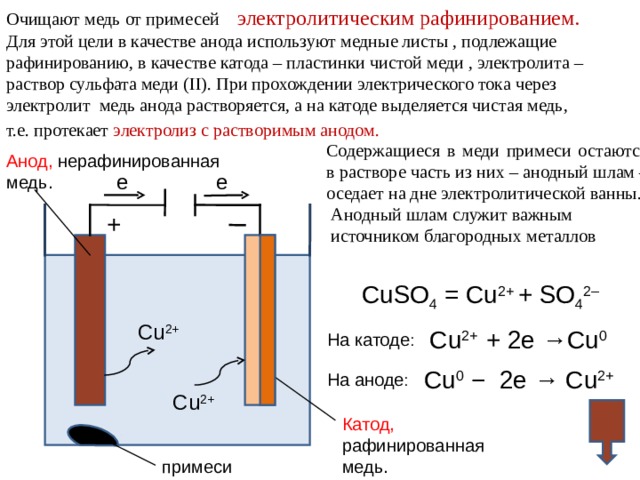
 2 Медь, перешедшую в раствор, восстанавливают более активным металлом: CuSO 4 + Fe = FeSO 4 + Cu [Cu(NH 3 ) 4 ](OH) 2 + Zn = Cu + [Zn(NH 3 ) 4 ](OH) 2](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img10.jpg)
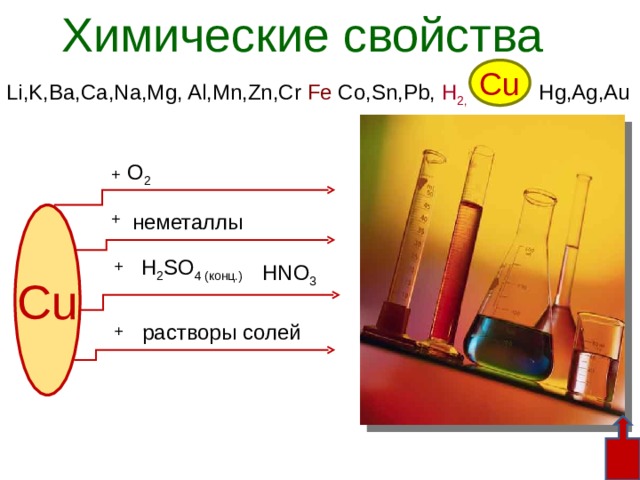





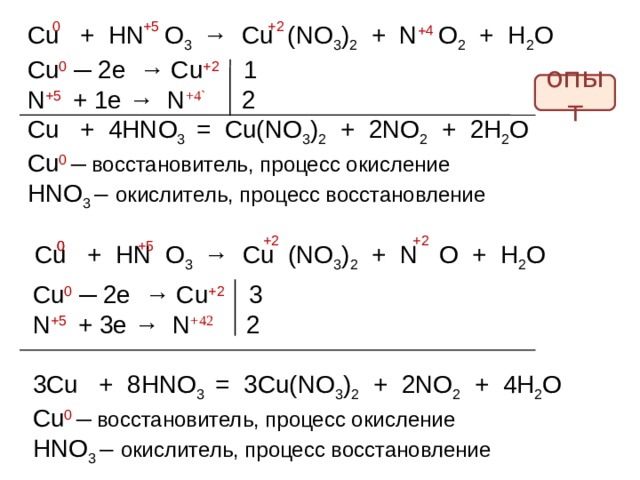














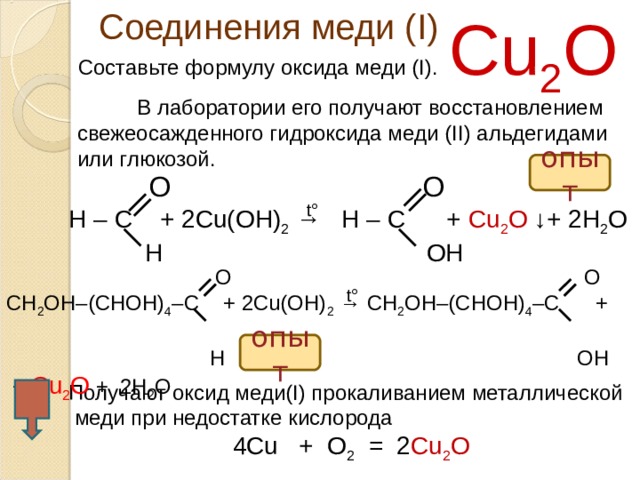





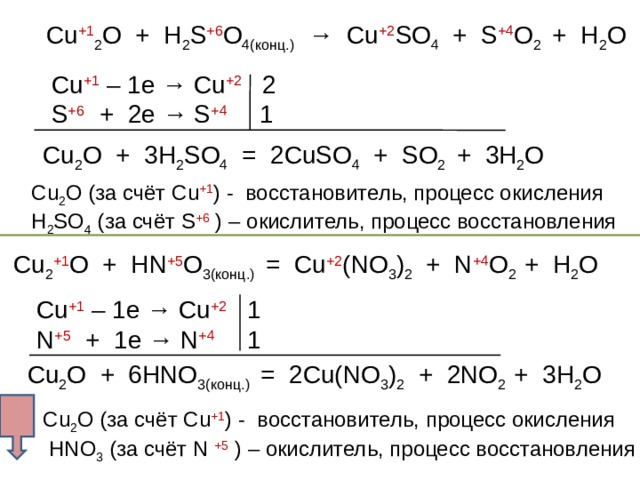
![Устойчивыми соединениями меди ( I) являются нерастворимые соединения ( CuCl, Cu 2 S ) или комплексные соединения [Cu(NH 3 ) 2 ]OH, [Cu(NH 3 ) 2 ]Cl, которые получают растворением в концентрированном растворе аммиака оксида меди ( I), хлорида меди (I) Cu 2 O + 4 (NH 3 · H 2 O) = 2[Cu(NH 3 ) 2 ]OH + 3Н 2 О CuCl + 2NH 3 = [Cu(NH 3 ) 2 ]Cl Аммиачные растворы солей меди взаимодействуют с алкинами, например, с ацетиленом: CH ≡ CH + 2[Cu(NH 3 ) 2 ]Cl → Cu–C≡C–Cu + 2NH 3 + 2NH 4 Cl](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img39.jpg)
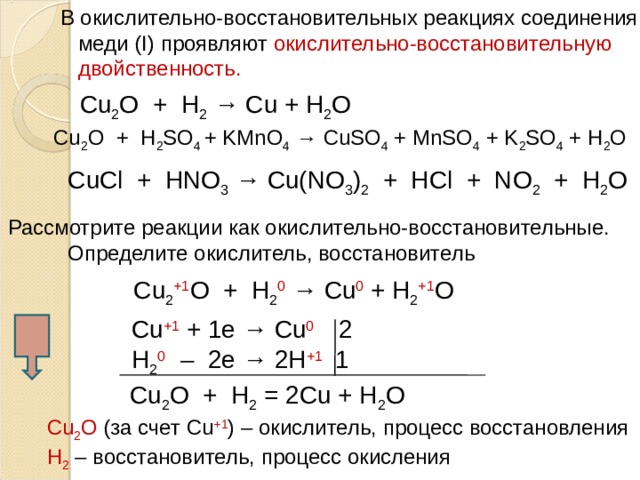









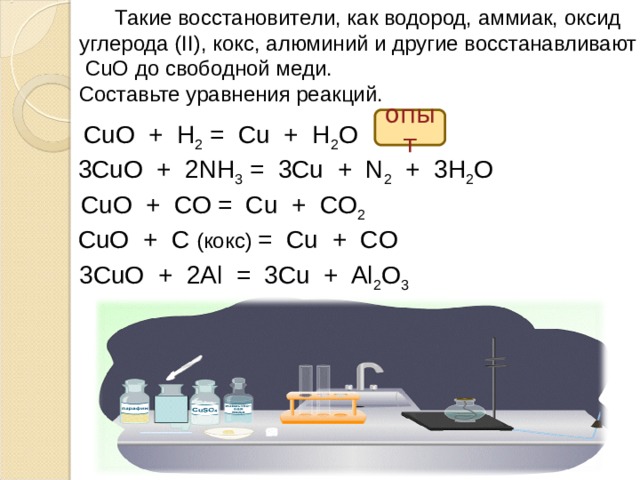

 2 + 3H 2 O](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img52.jpg)
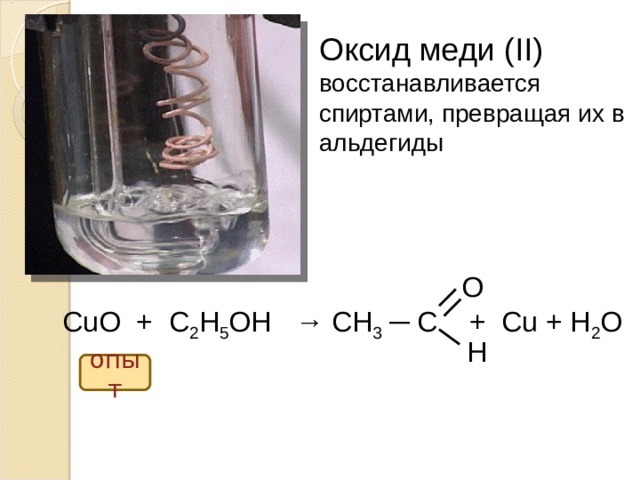



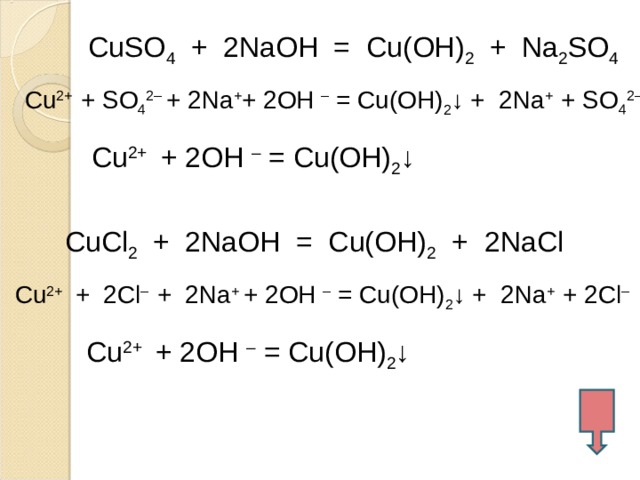


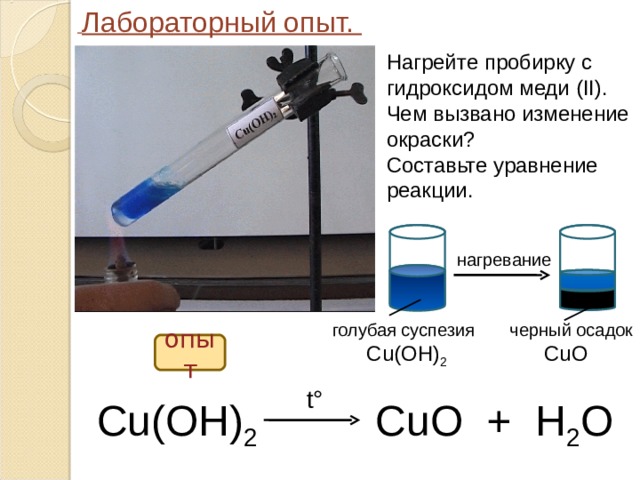
 2 + 4H 2 O или Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img61.jpg)

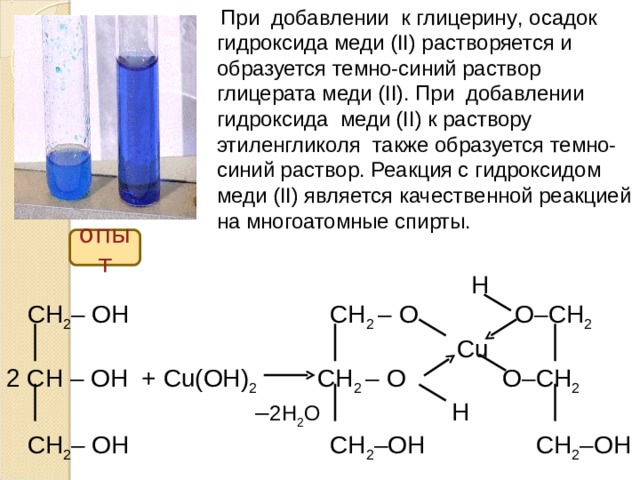



![Для малахита характерна растворимость в кислотах с выделением углекислого газа, а также в аммиаке, который окрашивается при этом в голубой цвет. (CuOH) 2 CO 3 + 4 HCl = 2CuCl 2 + CO 2 + 3 H 2 O (CuOH) 2 CO 3 + 8(NH 3 ·H 2 O) = [Cu(NH 3 ) 4 ]CO 3 + +[Cu(NH 3 ) 4 ](OH) 2 + 8H 2 O С глубокой древности известен способ получения из малахита свободной меди. В условиях неполного сгорания угля, при котором образуется угарный газ, происходит реакция: 2CO+(CuOH) 2 CO 3 =3CO 2 +2Cu+ H 2 O](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img67.jpg)

