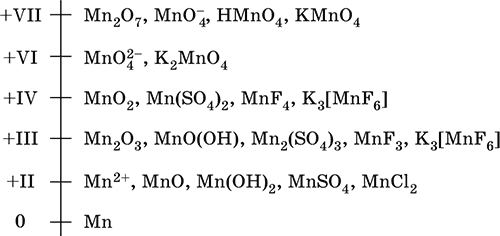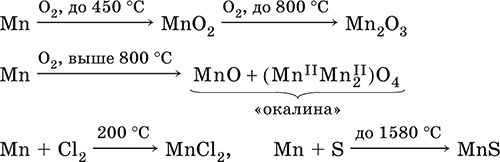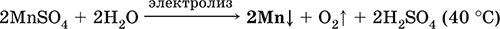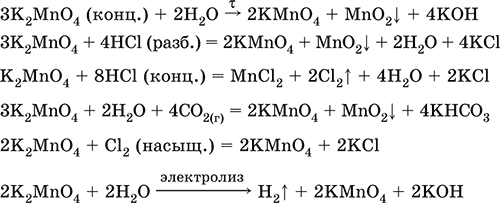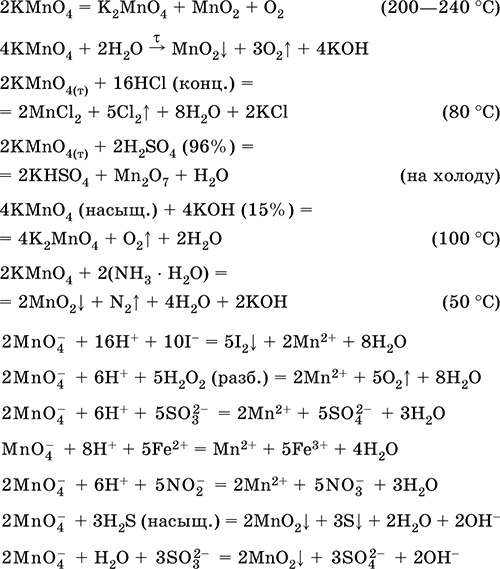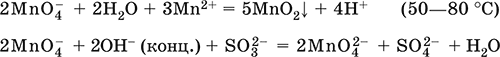Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 —
амфотерные, +6, +7 — кислотные.

Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO4
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2

При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3)2 + NO + H2O

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо
восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Mn(OH)2 + O2 = MnO2 + H2O
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие
соли.
Mn(OH)2 + HCl = MnCl2 + H2O

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если
выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Mn(NO3)2 = (t) MnO2 + NO2
Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.

В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
MnO2 + HCl = MnCl2 + Cl2 + H2O

Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами.
Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4 + H2O

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют
кислотные свойства. Соли марганцовой кислоты — перманганаты.
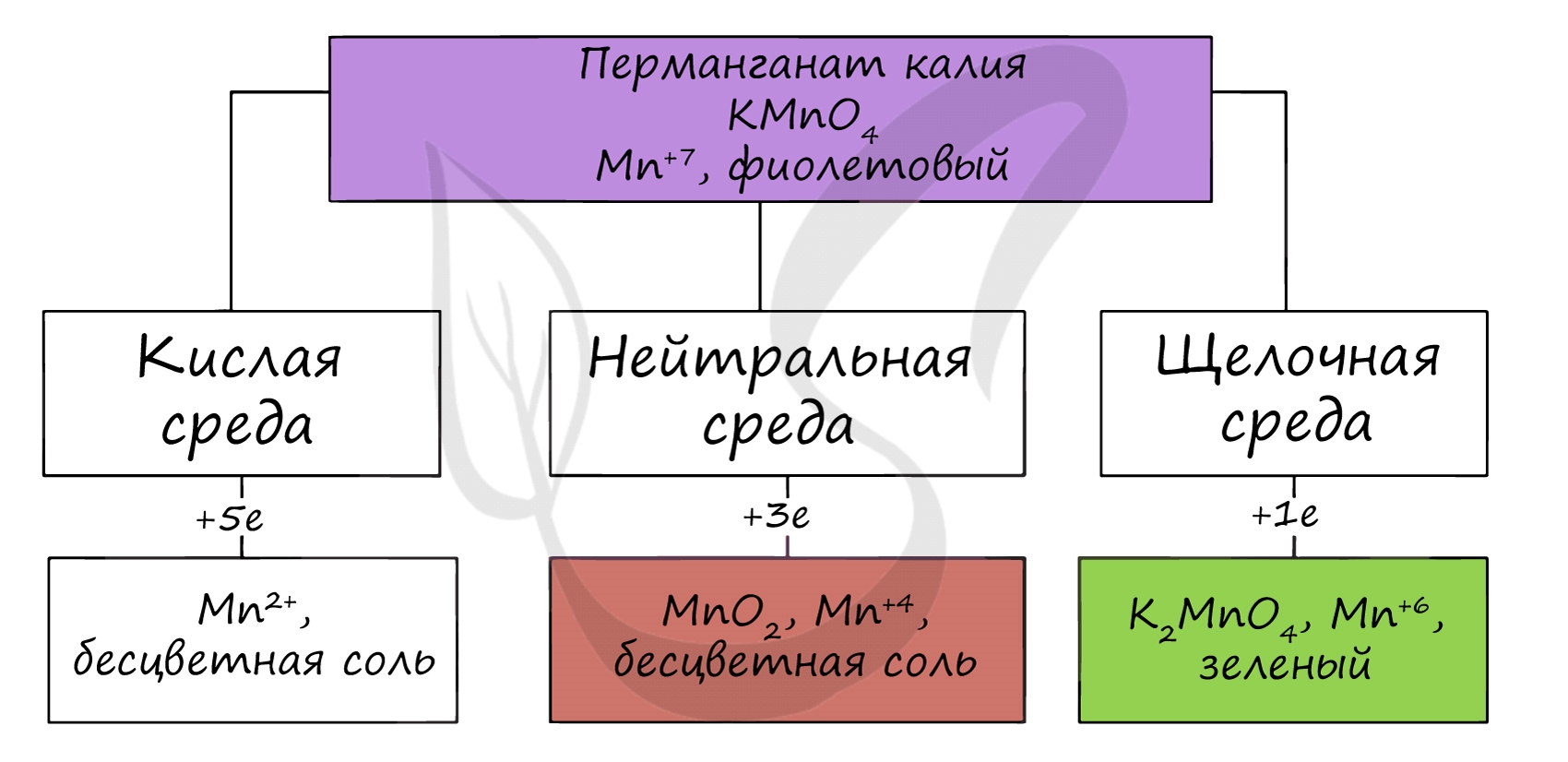
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑

При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn2+, в щелочной — Mn6+.
KMnO4 + H2O2 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав
меди с цинком — латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит

Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка
различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
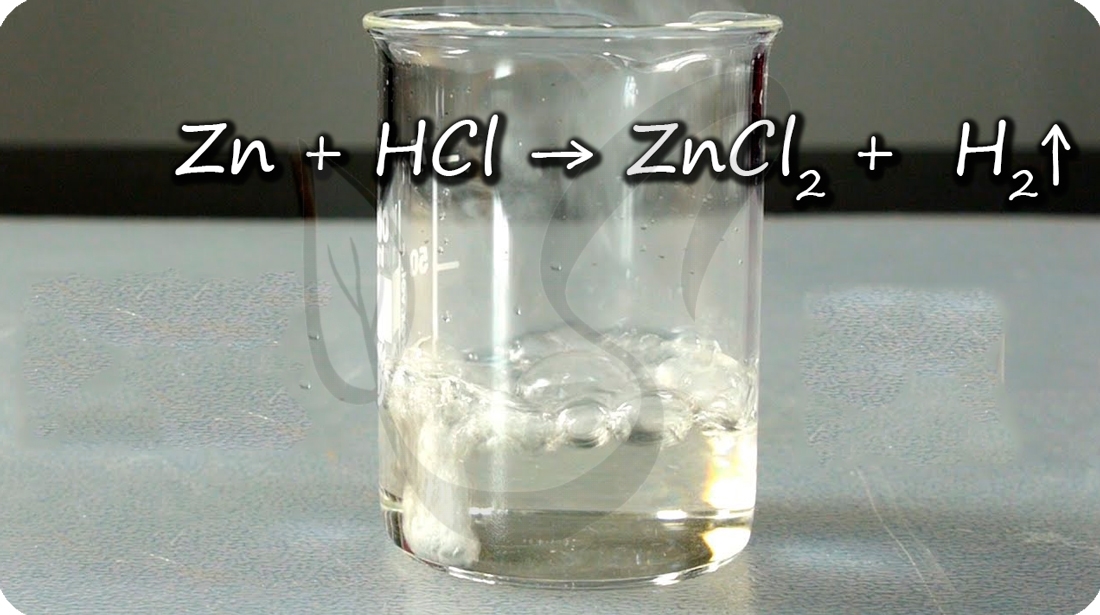
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями.
При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или
при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов.
При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O

Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Тренажер задания 31 из ЕГЭ по химии марганца, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии марганца с текстовыми решениями и ответами.
- Нитрат марганца (II) прокалили, к полученному твердому бурому веществу прилили концентрированную хлороводородную кислоту. Выделившийся газ пропустили через сероводородную кислоту. Образовавшийся раствор образует осадок с хлоридом бария. Напишите уравнения описанных реакций.
Mn(NO3)2 → MnO2 + 2NO2
MnO2 + 4HCl = MnCl2 + Cl2 ↑ + 2H2O
4Cl2 + H2S + 4H2O = 8HCl + H2SO4
H2SO4 + BaCl2 = BaSO4 + 2HCl
- Бурый осадок, полученный при взаимодействии сульфита натрия с водным раствором перманганата калия, отфильтровали и обработали концентрированной серной кислотой. Выделяющийся газ при нагревании реагирует с алюминием, а образующееся вещество – с раствором соляной кислоты. Напишите уравнения описанных реакций.
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
2MnO2 + 2H2SO4(конц.) = 2MnSO4 + O2↑ + 2H2O
3O2 + 4Al = 2Al2O3
2Al2O3 + 6HCl = 2AlCl3 + 3H2O
- Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
2P + 3PCl5 = 5PCl3
PCl3 + 3H2O = H3PO3 + 3HCl↑
5H3PO3 + 2KMnO4 + 3H2SO4 = 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
1) 2KMnO4 → K2MnO4 + MnO2 + O2
2) MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
3) MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl
4) Mn(OH)2 + 4KMnO4 + 6KOH = 5K2MnO4 + 4H2O
5) 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
6) 2KMnO4 + 3KNO2 + H2O = 2MnO2 + 3KNO3 + 2KOH
7) 3MnO2 + 4Al → 3Mn + 2Al2O3
- K2MnO4 + 4HNO2 = 2KNO2 + Mn(NO3)2 + 2H2O
- 4KMnO4 + Mn(OH)2 + 6KOH = 5K2MnO4 + 4H2O
- MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
- MnCl2 + AgNO3 = Mn(NO3)2 + 2AgCl↓
- 2KMnO4 + 3CH2 = CH2 + 4H2O → 3CH2(OH) − CH2(OH) + 2MnO2↓ + 2H2O
- 2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2↑ + 8H2O
- Mn + H2SO4((разб.) = MnSO4 + H2↑
- 3MnO2 + 4Al → 3Mn + 2Al2O3
- 2MnO2 + 4HNO2 = Mn(NO3)2 + Mn(NO2)2 + 2H2O
- 2KMnO4 + H2O2 + 2KOH = 2K2MnO4 + O2↑ + 2H2O
- MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4
- 3MnCl2 + 2Al → 3Mn + 2AlCl2
- MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
- MnCl2 + 2CH3COOAg = (CH3COO)2Mn + 2AgCl↓
- (CH3COO)2Mn + 2NaOH = Mn(OH)2↓ + 2CH3COONa
- Mn(OH)2 + 2HBr = MnBr2 + 2H2O
- MnBr2 + 2AgNO3 = Mn(NO3)2 + 2AgBr↓
- Mn(NO3)2 → MnO2 + 2NO2
- 2KMnO4 → K2MnO4 + MnO2 + O2
- K2MnO4 + 8HCl = MnCl2 + 2KCl + 2Cl2 + 4H2O
- MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
- 2Mn(OH)2 + O2 + 2H2O = 2Mn(OH)4
- MnO2 + SO2 = MnSO4
- 2MnSO4 + 8HNO3 + 5PbO = 2HMnO4 + 4Pb(NO3)2 + 2H2O + Pb(HSO4)2
- CH2Br – СHBr − CH3 + Mg → MgBr2 + CH2=CH−CH3
- 3CH2=CH−CH3 + 2KMnO4 + 4H2O → 3CH2OH – CHOH − CH3 + 2KOH + 2MnO2
- CH2Br – СHBr − CH3 + 2KOH(спиртовой) → CH≡C –CH3 + 2KBr + 2H2O
- 5CH ≡ C – CH3 + 8KMnO4 + 12H2SO4 → 5CO2 + 5CH3COOH + 8MnSO4 + 4K2SO4 + 12H2O
Чтобы поделиться, нажимайте
Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn (лат. Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре). Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
Минералы марганца
- пиролюзит MnO2·xH2O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
- гаусманит (MnIIMn2III)O4;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
- псиломелан mMnO • MnO2 • nH2O (45-60 % марганца);
- пурпурит Mn3+[PO4], (36,65 % марганца).
Химические свойства:
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при нагревании разлагает воду, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
Эта реакция используется для качественного определения Mn2+
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:

7. Химические свойства соединений марганца с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 8.1. В кислой среде соединения марганца, как правило, восстанавливаются до Mn+2, образуя соли соответствующих кислот:
Примеры реакций соединений с Mn+7:
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 16HBr → 2MnBr2 + 5Br2 + 2KBr + 8H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + 10CO2 + K2SO4 + 8H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2HMnO4 + 5SO2 + 2H2O → 2MnSO4 + 3H2SO4
2KMnO4 + 5Na2O2 + 8H2SO4 → 2MnSO4 + O2 + 5Na2SO4 + K2SO4 + 8H2O
10KMnO4 + 10KHS + 11H2SO4 → 4MnSO4 + 10S + 7K2SO4 + 16H2O
2KMnO4 + 5K2S + 8H2SO4 → 2MnSO4 + 5S + 6K2SO4 + 8H2O
2KMnO4 + 5H2S + 3H2SO4 → 2MnSO4 + 5S + K2SO4 + 8H2O
2KMnO4 + 10KBr + 8H2SO4 → 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
8KMnO4 + 5PH3 + 12H2SO4 → 8MnSO4 + 5H3PO4 + 4K2SO4 + 12H2O
6KMnO4 + 10NH3 + 9H2SO4 → 6MnSO4 + 5N2 + 3K2SO4 + 12H2O
Примеры реакций соединений с Mn+4:
MnO2 + HCl → MnCl2 + Cl2 + H2O
MnO2 + 2KI + 2H2SO4 → MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + 2KBr + 2H2SO4 → MnSO4 + Br2 + K2SO4 + 2H2O
MnO2 + 2FeSO4 + 2H2SO4 → MnSO4 + Fe2(SO4)3 + 2H2O
Примеры реакций соединений с Mn+6:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
Правило 8.2. В щелочной среде, как правило, реакции протекают с образованием соединений Mn+6, т.е. манганат-иона:
Примеры реакций соединений с Mn+7:
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
2KMnO4 + NaNO2 + 2KOH → 2K2MnO4 + NaNO3 + H2O
KMnO4 + FeCl2 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
6KMnO4 + Cr2(SO4)3 + 16KOH → 6K2MnO4 + 2K2CrO4 + 3K2SO4 + 8H2O
4KMnO4 + 8KOH → 4K2MnO4 + 2O2 + 4H2O
6NaMnO4 + 2NH3 + 6NaOH → 6Na2MnO4 + N2 + 6H2O
8KMnO4 + PH3 + 11KOH → 8K2MnO4 + K3PO4 + 7H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2O3 + 12KOH → 3K2MnO4 + 3K2SO4 + 6H2O
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
3MnSO4 + 3KClO3 + 12KOH → 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
3MnO + 2KClO3 + 6KOH → 3K2MnO4 + 2KCl + 3H2O
Примеры реакций соединений с Mn+4 в щелочной среде:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
MnO2 + O2 + 4KOH → 2K2MnO4 + 2H2O
Правило 8.3. В нейтральной среде соединения Mn+7, как правило, восстанавливаются до Mn+4, образуя оксид марганца (IV):
Примеры реакций соединений с Mn+7:
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
2KMnO4 + 3KNO2 + H2O → 2MnO2 + 3KNO3 + 2KOH
2KMnO4 + 3K2S + 4H2O → 2MnO2 + 3S + 8KOH
Реакции с H2S и NH3 протекают аналогично нейтральной среде:
2HMnO4 + 3H2S → 2MnO2+ 3S + 4H2O
2NaMnO4 + 2NH3 → 2MnO2 + N2 + 2NaOH + 2H2O
2KMnO4 + 2NH3×H2O → 2MnO2 + N2 + 2KOH + 4H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4.
Марганец – элемент 4-го периода и VIIB-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Ar]3d54s2; характерные степени окисления +VII, +VI, +IV, +II и 0.
Шкала степеней окисления марганца:
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Mg) и неметаллами (F, О, N, Cl). Соединения MnII – оксид и гидроксид – проявляют основные свойства, соединения MnIII и MnIV – амфотерные свойства, для соединений MnVI и MnVII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе – четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Mn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород:
Mn (порошок) + 2H+ = Mn2+ + Н2?
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Mn + 2H2SO4 (конц.) = MnSO4 + SO2? + 2Н2O
ЗMn + 8HNO3 (разб.) = 3Mn(NO3)2 + 2NO? + 4Н2O
Получение марганца в промышленности – восстановление пиролюзита MnO2 или гаусманита (MnIIMn2III)O4 коксом или алюминием:
MnO2 + С (кокс) = Mn + СO2 (600 °C)
3(MnIIMn2III)O4 + 8Al = 9Mn + 4Al2O3 (700–900 °C)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца(II), например:
Промышленно важен сплав с железом — ферромарганец (> 70 % Mn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) MnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата MnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и H2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
4MnO2 = 2Mn2O3 + O2 (530–585 °C)
2MnO2 + 2H2SO4 (конц.) = MnSO4 + O2? + 2Н2O (кипячение)
MnO2 + 4HCl (конц.) = MnCl2 + Cl2? + 2H2O
MnO2 + H2SO4 (гор.) + KNO2 = MnSO4 + KNO3 + H2O
MnO2 + 2H2SO4 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
MnO2 + 2KOH + KNO3 = K2MnO4 + KNO2 + H2O (350–450 °C)
3MnO2 + 3K2CO3 + KClO3 = 3K2MnO4 + KCl + 3CO2 (400 °C)
В природе самое распространенное соединение марганца – минерал пиролюзит.
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением O2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону MnO42-. Медленно разлагается при разбавлении раствора водой, быстро – при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция – появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
Получение: сплавление MnO2 с сильными окислителями (KNO3, КСlO3).
Пермапгапат калия КMnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону MnO4—), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до MnII, в нейтральной среде – до MnIV, в сильнощелочной среде – до MnVI.
Качественная реакция на ион MnO4— – исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике.
Уравнения важнейших реакций:
Получение – электролиз раствора K2MnO4 (см.).
Цели урока:
- повторить алгоритм по составлению ОВР методом
электронного баланса и раскрыть сущность метода
полу реакций МПР. - показать преимущества в формировании умений
прогнозирования направления протекания ОВР в
растворах на примере соединений марганца. - закрепить умения по составлению уравнений ОВР,
протекающих в различных средах. - научить применять полученные знания для
решения конкретных задач.
Задачи урока.
- Подготовить учащихся к выполнению задания 36 из
ЕГЭ по химии - Планируемый результат
Предметные:
- знать ОВР, правила составления
ОВР; - уметь Определять характер среды,
условия протекания ОВР, исходные и продукты
образования, окислителя и восстановителя,
составить электронный баланс и пользоваться
методом полу реакций, проводить эксперимент и на
основе эксперимента сделать вывод.
Метапредметные:
- уметь Организовывать свою
деятельность, определять ее цели и задачи,
выбирать средства реализации цели и применять их
на практике, оценивать результаты; устанавливать
причинно-следственные связи, строить логические
рассуждения, делать выводы; умение создавать
модели и схемы; умение организовывать учебное
сотрудничество и совместную деятельность с
учителем и сверстниками, работать индивидуально
и в группе.
Личностные: Формирование
ответственного отношения к учению, готовности и
способности обучающихся к саморазвитию и
самообразованию на основе мотивации к обучению и
познанию; формирование коммуникативной
компетентности в общении и сотрудничестве со
сверстниками в процессе учебной деятельности.
Оборудование и реактивы:
- персональный компьютер, проектор, презентация
- Раствор перманганата калия, кристаллический
перманганат калия, раствор серной кислоты,
раствор щелочи, раствор иодида калия, сульфит
натрия, 5—10%-ный раствор пероксида водорода - Большие пробирки, помещенных в
демонстрационный штатив с белым фоном, прибор
для получения газов, колба-приемник, железный
штатив, спиртовка, лучинка, спички, пробирки в
универсальном штативе на каждом столе,
стеклянная палочка - Приложение 1 “Соединения элемента
марганца: окислители и восстановители, расчет
степеней окисления” - Приложение 2 “Алгоритм составления
уравнений ОВР методом электронного баланса” - Приложение 3 “Алгоритм составления
уравнений ОВР ионно-электронным методом” - Приложение 4 “Окислительные и
восстановительные свойства пероксида водорода в
зависимости от характера среды. Инструкция по
выполнению лабораторного опыта”.
Тип урока: усвоение новых знаний с
применением имеющихся знаний и умений с
последующим обобщением и систематизацией.
Формы, применяемые на уроке
- Разъяснение (объяснительно-иллюстративный)
- рассуждение (частично-поисковый)
- общая характеристика (проблемный)
Методы, применяемые на уроке
- словесные (беседа, объяснение)
- наглядные (опыты, компьютерная презентация,
информационные приложения) - практические (демонстрация и самостоятельное
выполнение опытов).
План урока.
- Актуализация знаний.
- Повторение основных теоретических понятий
темы. - Определение, среды (кислой, нейтральной или
щелочной), в которой протекает реакция. - Электронный и ионно-электронный метод
составления уравнений ОВР - Закрепление полученных знаний
Ход урока
1. Актуализация знаний.
Подготовка к выполнению задания 36 состоит из
нескольких элементов:
Изучение теоретического материала,
индивидуальные консультации с преподавателем и
выполнение заданий, основываясь на данном
методическому материале.
Прежде чем приступить к выполнению работы
необходимо освоить основные термины,
определения, понятия и овладеть техникой
химических расчетов.
В задании предложена схема реакции, причем
формулы одного-двух веществ заменены
многоточиями.
Все задания 36 можно условно разделить на три
типа:
Учитель проецирует с помощью видеопроектора
схемы на экран Слайд 2
2. Повторение пройденного материала
В программе основной школы вы уже затрагивали
основные вопросы, необходимые для выполнения
задания 36.
Знаете, какие химические реакции относятся к
окислительно -восстановительным и что в ОВР один
из участников окисляется. Это восстановитель,
т.е. он отдает электроны и повышает свою степень
окисления. Другой – восстанавливается. Это
окислитель, т.е. он оттягивает на себя валентную
пару электронов, понижает свою степень
окисления.
Слайд 3 Учитель проецирует с помощью
видеопроектора схемы на экран
Выполняем задание. Учащиеся имеют приложение
на партах Приложение 1
Выполняем упражнение:
- определение степени окисления элементов по
формуле - строение атома марганца, определяют возможные
степени окисления элемента, его окислительную и
восстановительную способность. - заполняют таблицу по типам химических реакций
- формируют вывод
Учащиеся заполняют таблицу. Делают вывод: все
реакции замещения и реакции, в которых
присутствуют простые вещества относятся к ОВР.
Рассматривают строение атома марганца. Делают
вывод.
3. Определение, среды (кислой, нейтральной
или щелочной), в которой протекает реакция.
Приступая к выполнению данного задания, вы,
логически рассуждая, должны определить
пропущенные вещества. Для этого необходимо знать
основные окислители и восстановители, а также
продукты их восстановления или окисления.
Кроме того, для того, чтобы дописать
пропущенные вещества, следует учитывать, в какой
среде протекает окислительно —
восстановительная реакция.
Определить среду можно
А) по продуктам восстановления окислителя
(например, марганца)
Перманганаты – сильные окислители, при чём, в
зависимости от рН среды:
Учитель проецирует с помощью видеопроектора
схемы на экран, проводит опыт
Слайд 4, 5, 6 Демонстрационный опыт
“Химический хамелеон”
Восстановление перманганата калия сульфитом
натрия в различных средах.
4. Процедуры подбора коэффициентов в
уравнениях
Что касается собственно процедуры подбора
коэффициентов в уравнениях, то можно
использовать метод электронного баланса, а для
реакций в растворах удобен так называемый метод
полу реакций, или электронно-ионный.
Учитель проецирует с помощью видеопроектора
схемы на экран Слайд 7,8,9
Составление уравнений ОВР методом
электронного баланса
Метод электронного баланса основан на
сравнении степеней окисления в исходных и
конечных веществах, когда известны все исходные
вещества и продукты реакции. Этим методом вы уже
пользовались при работе на уроках в 8-9 классах.
Учитель проецирует с помощью видеопроектора
схемы на экран, учащиеся для удобства имеют схемы
на партах Приложение 2.
Работа у доски: Уровнять реакции,
используя метод электронного баланса,
определить окислитель и восстановитель. Слайд
7,8,9
Делают вывод: Методом электронного
баланса расставлять коэффициенты удобно, если
известны исходные вещества и продукты реакции,
т.е. даны полные схемы реакций.
Метод полу реакций, или электронно-ионный.
При использовании метода полу реакций
(электронно-ионный баланс) следует иметь в виду,
что в водных растворах связывание избыточного
кислорода и присоединение кислорода
восстановителем происходит по-разному в кислой,
нейтральной и щелочной средах.
Учитель проецирует с помощью видеопроектора
схемы на экран. Выполняет опыты.
Учащиеся имеют приложения на партах. Приложение 3. Слайд 10,11
Демонстрационный опыт. Восстановление
перманганата калия йодидом калия в различных
средах. “Химический хамелеон”
Учитель проецирует с помощью видеопроектора
схемы на экран, учащиеся для удобства имеют схемы
на партах
Работа у доски: Уровнять реакции,
используя МПР, определить окислитель и
восстановитель.
Одну реакцию выполняет учитель, две оставляет
на самостоятельную работу учащихся.
Слайд 12,13,14
Делаем вывод:
Рассмотрев метод электронно-ионного баланса
или метод полу реакций можно выделить следующие
достоинства данного метода:
- что в нем применяются не гипотетические ионы, а
реально существующие. - нет необходимости использовать степени
окисления, отчетливо видна роль среды и
учитывается реальное состояние частиц в
растворе. Однако данный метод применим для
составления уравнений
окислительно-восстановительных процессов,
происходящих лишь в растворах.
5. Закрепление полученных знаний
Реакции – диспропорционирования.
Учитель проецирует с помощью видеопроектора
схемы на экран. Выполняет опыт.
Демонстрационный опыт “Химический
хамелеон” Слайд 15, 16
Описание:
Для опыта нужна пробирка с газоотводной
трубкой. В пробирку насыпали кристаллический
перманганат калия (марганцовку). При нагревании
перманганат калия разлагается, выделяющийся
кислород поступает по газоотводной трубке в
колбу-приемник. Кислород тяжелее воздуха,
поэтому не покидает колбу и постепенно заполняет
ее. Если опустить тлеющую лучину в колбу с
собранным кислородом, то она ярко вспыхнет, т.к.
кислород поддерживает горение.
Уравнение проведенной реакции:
2KMnO4 = K2MnO4 + MnO2 + O2
После окончания опыта и охлаждения пробирки в
нее наливают несколько миллилитров воды,
тщательно взбалтывают содержимое и наблюдают
цвет образовавшихся веществ (К2МnO4 —
зеленого цвета и МnO2 темно-бурого).
K2Mn+6O4 + H2O —> KMn+7O4
+ Mn+4O2 + KOH
При сильном разбавлении водой происходит
реакция самоокисления-самовосстановления.
Окраска изменится с зеленой на красно-фиолетовую
и выпадет бурый осадок.
Самостоятельная работа в тетрадях: Уровнять
реакции, используя МПР, определить окислитель и
восстановитель. Слайд 15,16
Формируют вывод: Это реакции,
где окислитель и восстановитель – один и тот же
элемент, входящий в состав одной молекулы.
Самостоятельно проводим опыт и пишем
уравнение методом полуреакций
Учитель объясняет, что пероксид водорода может
проявлять окислительные и восстановительные
свойства, как в кислотной, так и в щелочной среде.
(перекиси могут быть как окислителями, так и
восстановителями, электроны перекисей могут
переходить от одной молекулы к другой:
Н2O2 + Н2O2 = O2 + 2Н2O.)
Учащиеся выполняют лабораторный опыт и делают
вывод о проявлении перекиси водорода
окислительных и восстановительных свойств в
зависимости от среды.
Примечание. Для эксперимента используют 3%-й
раствор перекиси водорода, который можно
приобрести в аптеке, как и раствор марганцовки.
Техника эксперимента проста и не требует
большой затраты времени.
Учитель проецирует с помощью видеопроектора
схемы на экран. Для удобства учащиеся имеют
приложение на партах. Приложение 4.
Слайд 17
Лабораторная работа: “Восстановление
перманганата пероксидом водорода” “Химический
хамелеон” — Превращение малинового раствора в
бесцветный”
Делают вывод: В этом случае пероксид
водорода проявляет восстановительные свойства,
а перманганат калия — окислительные.
6. Домашнее задание: Слайд 18









![{displaystyle {mathsf {Mn+2H_{2}O{xrightarrow[{}]{^{o}t}}Mn(OH)_{2}+H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f2f2542fc314355759f96f5ed931bcdea913c47b)





![{mathsf {2KMnO_{4}{xrightarrow[ {}]{^{0}t}}K_{2}MnO_{4}+MnO_{2}+O_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f264f2b70681b5830fab86dfa201c3f70b15ba9a)