Загрузить PDF
Загрузить PDF
У органической химии не самая хорошая репутация — многие не раз слышали от студентов жуткие истории об этом предмете задолго до того, как сами начали знакомиться с ним. Действительно, предмет непростой, но и назвать его ужасным нельзя. В органической химии нужно больше разбираться в материале, чем просто запоминать его, а это — ключ к успешной сдаче экзамена.
-
1
Познакомьтесь с термином «органическая химия». Органическая химия изучает химические соединения на основе углерода.[1]
Углерод — шестой элемент периодической системы и один из важнейших «кирпичиков», из которых состоит все живое на земле. Живые организмы состоят из молекул, которые содержат углерод. Это означает, что органическая химия изучает и химические процессы, которые изо дня в день происходят в вашем организме. Кроме того, она включает в себя и химические процессы в организмах животных, в растениях и в природных экосистемах.- Однако органическая химия не ограничивается только живыми существами. К примеру, химические реакции, происходящие при горении природного топлива, также относятся к органической химии, поскольку при этих реакциях взаимодействуют органические вещества в топливе.
-
2
Научитесь изображать молекулы. В органической химии визуальное восприятие гораздо важнее, чем в общей химии. Вы будете рисовать молекулы и соединения чаще, чем на занятиях по общей химии, поэтому важно научиться расшифровывать и понимать эти рисунки.
- Вы уже знакомы со структурой Льюиса — этому учат на занятиях по общей химии. В структуре Льюиса атомы в молекуле обозначаются их химическим символом (то есть буквой в периодической таблице). Линии — это связи между атомами, а точки — валентные электроны. На WikiHow есть статьи, посвященные этой теме.
- Скорее всего, о скелетной формуле вы еще не слышали. В скелетной формуле атомы углерода не изображаются — есть только линия, которая используется для обозначения связи. Поскольку в органической химии очень много атомов углерода, так рисовать молекулы гораздо быстрее. Атомы прочих элементов изображаются их химическими символами. На этом сайте можно найти подробную информацию о скелетной формуле.[2]
-
3
Научитесь изображать связи. Чаще всего вы будете иметь дело с ковалентными связями, хотя вам также надо будет узнать, что такое ионная связь.[3]
При ковалентной связи два атома обмениваются непарными электронами. Если есть лишние непарные электроны, появляются двойные и тройные соединения.- Как в структуре Льюиса, так и в скелетной формуле единичные связи изображаются одной линией, двойные — двойной, тройные — тройной.
- В скелетной формуле связи между углеродом (С) и водородом (Н) не рисуются, поскольку они встречаются очень часто.
- За исключением особых случаев, у атомов может быть 8 валентных электронов (то есть электронов внешней оболочки). Таким образом, чаще всего атом может соединиться максимум с четырьмя другими атомами.
-
4
Ознакомьтесь с основами трехмерной молекулярной структуры. В органической химии вам нужно будет представлять молекулы в таком виде, в котором они существуют в действительности, а не только как на рисунке. Молекулы — это трехмерные образования. Форму молекулы определяет тип связей в ней, хотя и другие факторы могут оказывать на это влияние. Важно помнить о следующем:
- Углерод, связанный с другими атомами единичными связями, будет иметь форму тетраэдра (четырехгранной пирамиды). Примером может служить молекула метана (CH4).
- Углерод, связанный с другим атомом двойной связью и с двумя атомами единичными связями, имеет форму плоского треугольника. В качестве примера можно привести ион CO3-2.
- Углерод, соединенный с двумя атомами двойными связями или с одним атомом тройной связью, представляет собой прямую линию. Примером служит двуокись углерода — CO2.
-
5
Научитесь узнавать гибридизацию орбиталей. Звучит страшно, но все не так сложно, как кажется. Гибридные орбитали — это способ отображения валентных электронов атома на основе поведения атома (а не схемы). Если у атома есть несколько непарных электронов, но он предпочитает образовывать другое количество связей, считается, что у него есть гибридные орбитали.
- Углерод служит примером такого поведения. У атомов углерода четыре валентных электрона: два на орбитали 2s и два непарных на орбитали 2p. Поскольку у атома есть два непарных электрона, можно предположить, что он образует две связи. Однако в результате экспериментов было установлено, что связи формируют парные электроны на орбитали 2s. Таким образом, у углерода появляется 4 непарных электрона на гибридной орбитали sp.
-
6
Ознакомьтесь с основами электроотрицательности. Есть множество факторов, которые могут влиять на то, как молекулы будут взаимодействовать, но одним из важнейших факторов считается электроотрицательность. Электроотрицательность — это способ измерения того, с какой силой атом удерживает свои электроны. Атомы с высокой электроотрицательностью сильнее удерживают электроны, с низкой — слабее. На WikiHow есть статьи на эту тему.
- По мере продвижения вверх и направо в периодической системе элементов электроотрицательность атомов возрастает (исключение составляют водород и гелий). У фтора, крайнего элемента в верхнем правом углу, максимальная электроотрицательность.
- Поскольку электроотрицательные атомы стремятся получить больше электронов, они стараются схватиться за все доступные электроны других молекул. Например, атомы хлора и фтора часто становятся негативными ионами, потому что забирают электроны у других атомов.[4]
Реклама
-
1
Не бойтесь. В органической химии будет много новых понятий, и вы будете рассматривать некоторые явления с другой стороны. Вам нужно будет заучить много новых слов. Не переживайте — все в вашей группе пройдут через это. Учитесь прилежно и обращайтесь за помощью, если она вам потребуется, и все будет хорошо.
- Не позволяйте «страшилкам» студентов, которые сдавали экзамен по органической химии, запугать вас. Студенты часто гордятся тем, как им было сложно. Если на первой контрольной вы будете считать, что перед вами невыполнимая задача, вам будет еще сложнее.[5]
Лучше много занимайтесь и хорошо выспитесь накануне контрольной работы.
- Не позволяйте «страшилкам» студентов, которые сдавали экзамен по органической химии, запугать вас. Студенты часто гордятся тем, как им было сложно. Если на первой контрольной вы будете считать, что перед вами невыполнимая задача, вам будет еще сложнее.[5]
-
2
Старайтесь понимать, а не заучивать. Вы будете наблюдать за сотнями разных реакций. Запомнить их все практически нереально, поэтому не пытайтесь заучить их. Лучше сосредоточьтесь на основных принципах самых частых реакций. Многие реакции идут по одному и тому же сценарию, поэтому разберитесь в нем и знайте, как его применять, и это позволит вам решать уравнения без проблем.
- Если у вас хорошая память, используйте ее. Напишите основные механизмы реакций на карточках и заучивайте их. Конечно, вам придется изменить подход к уравнению, если вы увидите реакцию, которой раньше не видели, но знание основных принципов реакций поможет вам решить и такое уравнение.
-
3
Знайте необходимые функциональные группы. В органической химии используется один и тот же набор структур практически во всех молекулах. Эти структуры называются функциональными группами. Если вы научитесь узнавать их и будете знать, как они ведут себя при реакциях, вы сможете справиться с задачами по химии. Поскольку функциональные группы обычно всегда реагируют одинаково, знание их свойств поможет вам в самых разных упражнениях.
- В органической химии очень много функциональных групп, и перечислить все в этой статье невозможно. Найти учебные материалы по этой теме нетрудно. К примеру, можно почитать об этом здесь.
-
4
Если сомневаетесь, следите за движением электронов. На базовом уровне реакции в органической химии, как правило, подразумевают обмен электронами между двумя и более молекулами. Если вы не знаете, с чего начать в реакции, подумайте, куда переместились бы электроны. Иными словами, ищите атомы, которые могут принять электроны, и атомы, которые могут их отдать. Совершите обмен электронами и подумайте, что нужно сделать, чтобы привести молекулы к стабильному состоянию.
- Например, кислород (О) обладает большей электроотрицательностью, чем углерод, поэтому кислород с двойной связью с углеродом в кетонной группе будет стараться притянуть электроны ближе к себе. Из-за этого у углерода появится частично положительный заряд, и он сможет принимать электроны. Если в реакции участвует элемент, который готов отдавать электроны, он может напасть на кислород и образовать новую связь, в результате чего произойдет химическая реакция.
-
5
Готовьтесь к контрольным работам и делайте домашнее задание в группах. Не думайте, что вы обязаны заниматься в одиночестве, — попробуйте объединиться с одногруппниками. Они помогут вам разобраться в том, что вам сложно дается, а если вы сами будете объяснять что-то другим, вы лучше запомните материал.
Реклама
-
1
Познакомьтесь с преподавателем. Больше всего об этом предмете знает тот, кто его преподает, поэтому воспользуйтесь этим источником информации. Попросите преподавателя пояснить вам то, что вы не понимаете. Задавайте точные и четкие вопросы и объясняйте, что вам дается особенно тяжело. Будьте готовы пояснить ход своих мыслей, если дадите неверный ответ.
- Не стоит беспокоить преподавателя, если у вас нет четкого вопроса. Если вы просто скажете, что не понимаете задание на дом, это вам ничем не поможет.
- Важно не только получить ответы на вопросы, но и познакомиться с преподавателем. Помните, что хорошие оценки вам еще пригодятся. Преподаватели гораздо более благосклонны к тем, кто обращается к ним за помощью.
-
2
Используйте вспомогательные материалы для визуализации задач. В органической химии форма молекул влияет на то, как они реагируют. Поскольку изобразить трехмерные молекулы на плоскости сложно, можно использовать объемные фигуры при работе со сложными структурами.
- Наборы для построения молекул позволяют создавать трехмерные модели из пластиковых фигур. Стоят они недешево, но обычно они есть в кабинете химии, и ими можно пользоваться.
- Если у вас нет возможности воспользоваться специальным набором, попробуйте строить модели из мячиков, маркеров и деревянных палочек.
- Существуют специальные компьютерные программы (например, эта), которые позволяют строить трехмерные модели.[6]
-
3
Поищите ответы на свои вопросы на форумах. К счастью, в интернете многие ищут нужную им информацию по органической химии, и там есть люди, у которых есть ответы. Существуют форумы, посвященные органической химии, где обсуждаются сложные темы. Попробуйте разместить задачу, которую вы не можете решить, и пообщайтесь с людьми, которые вызовутся вам помочь.
- Если вы владеете английским языком, вам подойдет chemicalforums.com.[7]
- Если вы владеете английским языком, вам подойдет chemicalforums.com.[7]
-
4
Воспользуйтесь информацией интернет-ресурсов об органической химии. Есть много сайтов, посвященных этой теме. Ниже мы приводим список таких ресурсов (на английском языке):
-
Khan Academy: Здесь собраны видеозаписи лекций на самые разные темы.[8]
-
Chem Helper: Здесь есть тесты для тренировки, форумы, описания реакций и другая информация. Тут вы также найдете информацию о работе в лаборатории.[9]
- University of South Carolina Aiken: Здесь приводится список полезных ссылок на многие темы в рамках органической химии.
Реклама
-
Khan Academy: Здесь собраны видеозаписи лекций на самые разные темы.[8]
Советы
- Чем больше времени вы будете уделять органической химии, тем лучше вы будете знать предмет. Старайтесь выделять минмум час на изучение химии ежедневно, потому что регулярность важна не меньше, чем количество потраченного времени.
- Для понимания многих тем в органической химии будут полезны базовые знания физики. Старайтесь уделять достаточно времени этому предмету.
- На WikiHow есть статьи, которые помогут вам решать задачи по химии.
Реклама
Об этой статье
Эту страницу просматривали 28 644 раза.
Была ли эта статья полезной?
1. Структурная формула отражает:
-
пространственное расположение атомов
-
порядок связи атомов в молекуле
-
только качественный состав молекулы
-
только количественный состав молекулы
2. Изомерия — это явление существования нескольких веществ, имеющих:
-
одинаковый качественный и разный количественный состав
-
одинаковый качественный и количественный состав
-
одинаковое строение и разный состав
-
разное строение и разный состав
3. Закончите формулировку положения теории А.М. Бутлерова: «Атомы и группы атомов в молекулах вещества:
-
взаимно влияют друг на друга
-
соединяются по алфавиту
-
взаимодействуют друг с другом
-
взаимозависят друг от друга
4. Ковалентная слабополярная связь возникает между атомами:
-
углерода и водорода
-
углерода и углерода
-
углерода и кислорода
-
углерода и фтора
5. -связь возникает при перекрывании:
-
р-орбиталей атомов углерода вдоль линии, соединяющей центры атомов
-
гибридных орбиталей атомов углерода вдоль линии, соединяющей центры атомов
-
s-орбиталей атомов водорода и р-орбиталей атомов углерода
-
р-орбиталей атомов углерода перпендикулярно линии, соединяющей центры атомов
6. Порядок связи атомов в молекуле отражает:
-
эмпирическая формула
-
молекулярная формула
-
структурная формула
-
брутто-формула
7. Атомы в молекулах органических веществ соединяются в определенной последовательности согласно их:
-
электроотрицательности
-
алфавитному порядку
-
валентности
-
атомным массам
8. -связь возникает в каждом случае перекрывания, кроме перекрывания:
-
р-орбиталей атомов углерода вдоль линии, соединяющей центры атомов
-
гибридных атомов углерода вдоль линии, соединяющей центры атомов
-
s-орбиталей атомов водорода и р-орбиталей атомов углерода вдоль линии, соединяющей центры атомов
-
р-орбиталей атомов углерода перпендикулярно линии, соединяющей центры атомов
9. Соединения, в состав которых входит функциональная группа —NH2, относятся к классу:
-
аминов
-
нитросоединений
-
карбоновых кислот
-
альдегидов
10. По систематической номенклатуре названия веществ, формулы которых:
-
2,2-диметилбутан и 1,2-диметилциклобутан
-
3,3-диметилбутан и диметилциклобутан
-
2-метил-2-этилпропан и 2,3-диметилциклобутан
-
н-гексан и циклогексан
11. К соединениям, имеющим общую формулу С п Н2п + 2 относится:
-
бензол
-
циклогексан
-
гексан
-
глюкоза
12. Алкен, в составе которого пять атомов углерода, имеет формулу:
-
С5Н10
-
С5Н8
-
С5Н12
-
С5Н12О
13. Соединения, в состав которых входит функциональная группа —СООН, относятся к классу:
-
аминов
-
нитросоединений
-
карбоновых кислот
-
альдегидов
14. По систематической номенклатуре названия веществ, формулы которых:
это соответственно:
-
2,3-диметилбутен и пропанол
-
2,3-метилбутен и пропанол
-
2,3-диметилбутен-1 и пропанол-1
-
2,3-диметилбутен-3 и пропанол-3
15. К соединениям, имеющим общую формулу СnН2n, относится:
-
метан
-
этилен
-
ацетилен
-
этанол
16. Функциональной группой кетонов является:
-
1
-
2
-
3
-
4
17. Алкен, в составе которого 4 атома углерода, имеет формулу:
-
С4Н10
-
С4Н10О
-
С4Н8
-
С4Н8О
18. Разные функциональные группы содержит молекула:
-
глюкозы
-
многоатомного спирта
-
углеводорода
-
кетона
19. Соединения, в состав которых входит функциональная группа —СН=О, относятся к классу:
-
аминов
-
нитросоединений
-
карбоновых кислот
-
альдегидов
20. По систематической номенклатуре названия веществ, формулы которых:
-
2,3-диметилпентен и уксусная кислота
-
2,3-метилпентен и бутановая кислота
-
2,3-диметилпентен-1 и 3-метилбутановая кислота
-
2,3-метилпентен-1 и 2-метилбутановая кислота
21. К соединениям, имеющим общую формулу СnН2n—2, относится:
-
бензол
-
ацетилен
-
этилен
-
бутан
22. Функциональной группой спиртов является:
-
1
-
2
-
3
-
4
23. Алкан, в составе которого 4 атома углерода, имеет формулу:
-
С4Н10
-
С4Н10О
-
С4Н8
-
С4Н8О
24. Аминокислоты содержат функциональные группы:
-
аминогруппу и карбонильную
-
аминогруппу и карбоксильную
-
несколько аминогрупп
-
нитрогруппу и карбоксильную
25. Соединения, в состав которых входит функциональная группа —ОН, относятся к классу:
-
аминов
-
спиртов
-
карбоновых кислот
-
альдегидов
26. По систематической номенклатуре названия веществ, формулы которых:
это соответственно
-
3,4-диметилпентин-1 и бутанол-2
-
3,4-диметилпентин и бутанол
-
2,3-диметилпентин и бутанол-2
-
2,3-диметилпентин-4 и бутанол
27. Соединения, сходные по свойствам, своему химическому строению и отличающиеся по составу на одну или несколько групп —СН2, называют:
-
изомерами
-
гомологами
-
аналогами
-
аллотропными модификациями
28. Гомологом пентана является:
-
пентин
-
гексан
-
пентен
-
гексен
29. Гомологами является следующая пара веществ:
-
этан и толуол
-
этилен и ацетилен
-
метан и декан
-
этан и этен
30. Изомеры — это вещества, имеющие:
-
одинаковый качественный состав, но разный количественный состав и разное строение
-
одинаковый количественный состав, но разный качественный состав и разное строение
-
одинаковый качественный и количественный состав, но разное строение
-
разный качественный и количественный состав и разное строение
31. Цыс-бутен-2 и транс-бутен-2 являются:
-
гомологами
-
структурными изомерами
-
геометрическими изомерами
-
одним и тем же веществом
32. Гомологом 2-метилпентана является:
-
3-метилпентан
-
гексан
-
2-метилгексан
-
пентан
33. Гомологами является следующая пара веществ:
-
бензол и толуол
-
бензол и бензойная кислота
-
бензол’и хлорбензол
-
бензол и стирол
34. Вещества одинакового состава, но разного строения и имеющие разные свойства называют:
-
изомерами
-
гомологами
-
аналогами
-
аллотропными модификациями
35. Гомологом 2,2-диметилпентана является:
-
2-метилгексан
-
2,2-диметилгексан
-
гептан
-
гексан
36. Этановая кислота и уксусная кислота являются:
-
гомологами
-
структурными изомерами
-
геометрическими изомерами
-
одним и тем же веществом
37. К алканам относятся оба вещества пары:
-
С3Н8; С3Н6
-
С3Н8; С4Н10
-
С3Н6; С4Н8
-
С2Н2; С2Н4
38. Вещество, структурная формула которого:
называется
-
н-бутан
-
2-метил-2-этилбутан
-
3-диметилпентан
-
3,3-диметилпентан
39. Метан при соответствующих условиях получают из:
-
карбоната кальция
-
пропианата натрия
-
карбоната натрия
-
карбида алюминия
40. Этан в соответствии с реакцией Вюрца получают из:
-
хлорметана
-
хлорэтана
-
этилена
-
ацетилена
41. Пропан можно получить сплавлением:
-
ацетата натрия со щелочью
-
пропионата натрия со щелочью
-
бутирата натрия со щелочью
-
карбоната натрия со щелочью
42. Вещество, структурная формула которого
Называется:
-
н-бутан
-
2,3-диметил-3-этилбутан
-
2,3-диметил-2-этилбутан
-
2,3,3-триметилпентан
43. Метан при соответствующих условиях получают из
-
ацетата натрия
-
пропианата натрия
-
карбоната натрия
-
карбида кальция
44. Бутан в соответствии с реакцией Вюрца получают из:
-
хлорметана
-
хлорэтана
-
этилена
-
ацетилена
45. Этан можно получить сплавлением
-
ацетата натрия со щелочью
-
пропионата натрия со щелочью
-
бутирата натрия со щелочью
-
карбоната натрия со щелочью
46. Соединения 1,2-дибромпропан и 1,2-дибромбутан:
-
гомологи
-
структурные изомеры
-
одно и то же вещество
-
геометрические изомеры
49. К алканам относятся оба вещества пары
-
С5Н10; С6Н6
-
С3Н8; С3Н6
-
С3Н8; С4Н8
-
С6Н14; С4Н10
50. Гексан в соответствии с реакцией Вюрца получают из:
-
хлорметана
-
хлорэтана
-
1-хлорпропана
-
2-хлорпропана
51. Вещество, структурная формула которого
называется:
-
н-бутан
-
2,3-диметил-2,3-диэтилбутан
-
2,2,3,3-тетраметилгексан
-
2,3-тетрамеитлгексан
52. Метан при соответствующих условиях не получают из:
-
карбида алюминия
-
ацетата натрия
-
карбоната натрия
-
углерода и водорода
53. При сплавлении ацетата и гидроксида натрия образуется:
-
бутан
-
метан
-
этан
-
пропан
54. Для метана характерна реакция:
-
нитрования
-
присоединения бромной воды
-
окисления раствором перманганата калия
-
полимеризации
55. Этан:
-
взаимодействует и с хлором, и с водородом
-
взаимодействует с хлором, но не реагирует с водородом
-
не взаимодействует ни с хлором, ни с водородом
-
не взаимодействует с хлором, но реагирует с водородом
56. Укажите реагенты А и В в схеме:
-
А — СI2; В — Na
-
А — Na; В — СI2
-
А — НСI; В — NaOH
-
А —О2; В — NaOH
57. В отличие от пропана бутан вступает в реакцию:
-
окисления кислородом
-
окисления раствором перманганата калия
-
дегидрирования
-
изомеризации
58. Метан при определенных условиях реагирует с:
-
азотной кислотой
-
раствором серной кислоты
-
фосфорной кислотой
-
соляной кислотой
59. Для метана характерны реакции:
-
хлорирования на свету
-
присоединения водорода
-
окисления раствором перманганата калия
-
присоединения бромной воды
60. Пропан:
-
взаимодействует и с хлором, и с водородом
-
не взаимодействует ни с хлором, ни с водородом
-
взаимодействует с хлором, но не реагирует с водородом
-
не взаимодействует с хлором, но реагирует с водородом
61. Установите истинность суждений о свойствах алканов.
А. Этан подвергается дегидрированию при повышенной температуре в присутствии катализатора.
Б. Этан горит на воздухе.
-
верно только А
-
верно только Б
-
оба утверждения верны
-
оба утверждения неверны
62. Этан при определенных условиях реагирует с:
-
азотной кислотой
-
угольной кислотой
-
фосфорной кислотой
-
соляной кислотой
63. Установите истинность суждений о свойствах алканов.
А. Метан вступает в реакцию с азотной кислотой, в результате образуется нитрометан.
Б. Метан участвует в реакциях присоединения.
-
верно только А
-
оба утверждения верны
-
верно только Б
-
оба утверждения неверны
64. Из приведенных пар названий классов соединений выберите ту, в которой оба имеют общую формулу СnН2n:
-
алканы и алкены
-
алкены и циклоалканы
-
алкены и алкины
-
алкены и алкадиены
65. Изомером метилциклобутана является:
-
1,1-диметил циклобутан
-
1,2-диметилциклобутан
-
этилциклобутан
-
циклопентан
66. Вещество, формула которого:
называется:
-
1,2,4-триметилциклогексан
-
1,3,4-триметилциклогексан
-
1,3,6-триметилциклогексан
-
1,4,6-триметилциклогексан
67. В молекуле циклогексана каждый атом углерода находится в состоянии гибридизации:
-
sp
-
sp3d2
-
sp3
-
sp2
68. Установите истинность суждений о циклоалканах:
А. Циклобутан имеет только один изомер — метилциклопропан.
Б. Циклоалканы можно получить из нефти.
-
верно только А
-
верно только Б
-
оба высказывания верны
-
оба высказывания неверны
69. Из приведенных пар названий соединений выберите ту, в которой оба вещества относятся к гомологическому ряду, имеющему общую формулу СnН2n:
-
метан и декан
-
бутан и циклобутан
-
пропен и пропан
-
бутен и циклобутан
70. Изомерами в приведенном перечне веществ являются все, кроме:
-
1,1-диметилциклобутана
-
1,2-диметилциклобутана
-
этилциклобутана
-
циклопентана
71. Вещество, формула которого
называется:
-
1-этил-З-метилциклопентан
-
1-метил-З-этилциклопентан
-
метилэтилциклопентан
-
этилметилциклопентан
72. В молекуле циклопропана каждый атом углерода нахо дится в состоянии гибридизации:
-
sp
-
sp3
-
sp3d2
-
sp2
73. При действии натрием на 1,5-дихлоргексан получают:
-
гексан
-
циклопентан
-
метилциклопентан
-
циклогексан
74. Изомером циклогексана является:
-
метилциклопентан
-
циклопентан
-
метилциклогексан
-
1,2-диметилциклопетан
75. При действии натрием на 2,5-дихлоргексан получают:
-
1,2-диметилциклобутан
-
циклопентан
-
1,2-диметилциклопентан
-
Циклогексан
76. В отличие от пропана циклопропан вступает в реакции:
-
дегидрирования
-
гидрирования
-
горения в кислороде
-
хлорирования
77. Циклогексан и гексан вступают в реакцию:
-
присоединения с хлором
-
гидрирования
-
дегидрирования
-
гидратации
78. При дегидрировании циклогексана может образоваться:
-
бензол
-
гексан
-
метилциклопентан
-
пропан
79. Взаимодействует ли циклопропан с водородом? Что образуется при этом?
-
Взаимодействует. Образуется пропан
-
Взаимодействует. Образуется пропен
-
Взаимодействует. Образуется циклобутан
-
Не взаимодействует
80. В отличие от пропана циклопропан вступает в реакции:
-
присоединения брома
-
горения в кислороде
-
дегидрирования
-
хлорирования на свету
81. При взаимодействии с хлором циклогексана на свету образуется:
-
хлоргексан
-
2-хлоргексан
-
хлорциклогексан
-
1-хлоргексан
82. В схеме:
А и В обозначены
-
НСI и NaCI
-
СI2 и Na
-
НСI и Na
-
Na и НСI
83. Число -связей в молекуле этилена равно:
-
2
-
4
-
5
-
6
83. В молекуле 2-метилбутена-1 тип гибридизации атомных орбиталей атомов углерода:
-
только sp3
-
sp3 и sp2
-
только sp2
-
sp3, sp2 и sp
84. Вещество, формула которого:
называется:
-
3,4,4-триметилпентен-1
-
2,2,3-триметилпентен-4
-
3-метил-4,4-диметилпентен-1
-
триметилпентен-1
85. Изомером 2-метилбутена-1 является:
-
2-метилбутан
-
2-метилбутен-2
-
пентан
-
2,3-диметилбутан
86. Бутен-2 можно получить непосредственно в одну стадию из любого предложенного вещества, кроме:
-
бутанола-2
-
бутана
-
2-хлорбутана
-
бутанона-2
87. Число -связей в молекуле этилена равно:
-
1
-
2
-
3
-
4
88. Вещество, формула которого
называется:
-
триметилгексен
-
2-метил-4,4-диметилгексен-2
-
3,3,5-триметилгексен-4
-
2,4,4-триметилгексен-2
89. Бутен-1 можно получить непосредственно в одну стадию из любого предложенного вещества, кроме:
-
бутанола-1
-
бутана
-
1-хлорбутана
-
Этанола
90. Вещество, формула которого
называется:
-
3,5-диметил-4-этилгексен-1
-
диметилэтилгексен
-
2,4-диметил-3-этилгексен-5
-
3-метил-4-пропилгексен-1
91. Этилен можно получить непосредственно в одну стадию из любого предложенного вещества, кроме:
-
1,1-дихлорэтана
-
хлорэтана
-
этана
-
этанола
92. Этилен взаимодействует с каждым веществом пары:
-
бром, натрий
-
бромоводород, вода
-
гидроксид натрия, кислород
-
перманганат калия (раствор), железо
93. При реакции бутена-1 с хлороводородом образуется:
-
2-хлорбутан
-
1-хлорбутан
-
1,2-дихлорбутан
-
2,2-дихлорбутан
94. Для доказательства непредельности бутена-1 следует провести реакцию:
-
обесцвечивания раствора перманганата калия
-
с раствором хлорида железа(Ш)
-
с гидроксидом меди(П)
-
серебряного зеркала
95. Установите истинность суждений о свойствах алкенов.
А. Этилен — бесцветный газ, немного легче воздуха, плохо растворим в воде.
Б. Реакции присоединения к алкенам происходят по механизму электрофильного присоединения.
-
верно только А
-
верно только Б
-
оба высказывания верны
-
оба высказывания неверны
96. Для проведения реакции СnН2n+1Br → СnН2n :
-
КМnO4 (водный р-р)
-
КОН (водный р-р)
-
H2SO4 (t > 140°С)
-
КОН (спиртовой р-р)
97. В схеме превращений: пропанол-1 → Х → 2-хлорпропан, веществом X является:
-
пропан
-
пропен
-
1,2-дихлорпропан
-
Этен
98. Этилен взаимодействует с каждым веществом пары:
-
хлор, гидроксид натрия
-
хлороводород, вода
-
соляная кислота (1%), азот
-
перманганат калия (раствор), медь
99. Установите истинность суждений о свойствах алкенов.
А. П.Э. Бертло в 1854 г. гидратацией этилена в присутствии кислоты синтезировал этиловый спирт, который до этого получали только брожением углеводов.
Б. Температура кипения углеводорода тем выше, чем более разветвлена углеводородная цепь в молекуле.
-
верно только А
-
верно только Б
-
оба высказывания верны
-
оба высказывания неверны
100. Для проведения реакции CnH2n-1OH → CnH2n используют реактив:
-
КМпO4 (водный р-р)
-
КОН (спиртовой р-р)
-
КОН (водный р-р)
-
H2SO4 (t > 140°С)
101. Для доказательства непредельности пропена следует провести реакцию:
-
с раствором перманганата калия
-
с гидроксидом меди(II)
-
серебряного зеркала
-
с раствором хлорида железа(III)
102. Для проведения реакции С2Н4 → С2Н4(ОН)2 используют реактив:
-
КМnO4 (водный раствор)
-
КОН (водный раствор)
-
КОН (спиртовой раствор)
-
H2SO4 (t > 140°С)
103. При реакции бутена-1 с хлороводородом образуется:
-
1-хлорбутан
-
1,2-дихлорбутан
-
2-хлорбутан
-
2,2-дихлорбутан
104. Вещество, формула которого
называется:
-
3,5-диметил-4-этилгексадиен-1,5
-
2,4-диметил-3-этилгексадиен-1,5
-
диметилэтилгексадиен-1,5
-
2,3-метил-4-этил-гексен-1,5
105. Изомерами являются:
-
этен и бутен-1
-
бутен-1 и бутадиен-1,3
-
бутадиен-1,3 и бутадиен-1,2
-
изопрен и пентен-1
106. Вещество, формула которого
называется:
-
2,3,3-триметилпентадиен-1,4
-
2,3,3-метилпентадиен
-
3,3,4-триметилпентадиен-1,4
-
2-метил-3,3-диметилпентадиен-1,4
107. Бутадиен-1,3 при н.у. — это:
-
газ, который легко сжижается
-
газ, который трудно сжижается
-
летучая жидкость
-
тяжелая маслянистая жидкость
108. В реакцию полимеризации вступает:
-
метан
-
бутан
-
дивинил
-
изобутан
109. 2-метилбутадиен-1,3 при н.у. — это:
-
газ, который легко сжижается
-
газ, который трудно сжижается
-
летучая жидкость
-
тяжелая маслянистая жидкость
110. Реакции присоединения характерны для:
-
2,3-диметилпентана
-
изобутана
-
2-метилбутадиена-1,3
-
бутанола-1
111. Бромную воду обесцвечивают оба вещества:
-
изопрен и 2-метилпентан
-
дивинил и этилен
-
метан и 2,3-диметилбутан
-
ацетилен и этан
112. В реакцию полимеризации вступает:
-
пропан
-
пентан
-
изобутан
-
изопрен
113. Установите истинность суждений о натуральном каучуке.
А. Макромолекулы натурального каучука состоят из остатков молекул бутадиена-1,3.
Б. В макромолекуле натурального каучука группы —СН2 — находятся по одну сторону двойных связей (цис— форма).
-
верно только А
-
верно только Б
-
оба высказывания верны
-
оба высказывания неверны
114. Раствор перманганата калия обесцвечивают оба вещества:
-
изопрен и 2-метилпентан
-
дивинил и этилен
-
метан и 2,3-диметилбутан
-
ацетилен и этан
115. Установите истинность суждений о натуральном каучуке.
А. Натуральный каучук содержится в млечном соке некоторых растений.
Б. Натуральный каучук в бензине сначала набухает, а затем растворяется.
-
верно только А
-
верно только Б
-
оба высказывания верны
-
оба высказывания неверны
116. К классу алкинов относится:
-
С2Н4
-
СН4
-
С2Н6
-
С2Н2
117. Вещество, формула которого
называется:
-
2,3,4-триметилгексин-1
-
2,4-диметил-4-этилгексин-1
-
3,5-диметил-4-этилгексин-1
-
диметилэтилгексин
118. В молекулах какого вещества отсутствую -связи?
-
этина
-
изопрена
-
этена
-
циклопентана
119. В одну стадию ацетилен можно получить из каждого вещества, кроме:
-
метана
-
карбида кальция
-
этилена
-
карбида алюминия
120. Пропин можно получить реакцией:
-
1,2-дихлорпропана со спиртовым раствором щелочи
-
1,1-дихлорпропана с водным раствором щелочи
-
2-хлорпропана со спиртовым раствором щелочи
-
1-хлорпропана с водным раствором щелочи
121. К классу алкинов относится:
-
С3Н4
-
СН4
-
С4Н8
-
С5Н12
122. В молекуле ацетилена имеются:
-
две — и две -связи
-
две — и три -связи
-
три — и одна -связь
-
три — и две -связи
123. Вещество, формула которого
называется:
-
3,3,4-триметилгексин-1
-
3,3,5-триметилгексин-1
-
3,3-диметил-5-метилгексин-1
-
2,4,4-триметилгексин-5
124. Бутин-2 можно получить реакцией
-
1,2-дихлорбутана со спиртовым раствором щелочи
-
1,1-дихлорбутана с водным раствором щелочи
-
2,2-дихлорбутана со спиртовым раствором щелочи
-
1,4-дихлорбутана с водным раствором щелочи
125. Число — и -связей в молекуле пропина равно соответствено:
-
1 и 2
-
3 и 1
-
6 и 2
-
8 и 1
126. Ацетилен взаимодействует с:
-
водой
-
азотом
-
метаном
-
медью
127. Реакцией Кучерова получают:
-
из этанола бутадиен-1,3
-
из ацетилена винилацетилен
-
из ацетилена уксусный альдегид
-
дихлорэтана ацетилен
128. При присоединении избытка бромоводорода к пропину преимущественно образуется:
-
1-бром пропан
-
2-бромпропан
-
1,1 -дибромпропан
-
2,2-дибромпропан
129. Как бутен, так и бутин:
-
при гидратации дают спирты
-
обесцвечивают бромную воду
-
не реагируют с раствором КМnО4
-
не подвергаются гидрированию
130. Ацетилен взаимодействует с:
-
серебром
-
аммиачным раствором оксида серебра
-
метаном
-
азотом
131. При присоединении избытка бромоводорода к бутину-1 преимущественно образуется:
-
1-бромбутан
-
2-бромбутан
-
1,1-дибромбутан
-
2,2-дибромбутан
132. Как этен, так и этин:
-
при гидратации дают спирты
-
не обесцвечивают бромную воду
-
реагируют с раствором КМnO4
-
не подвергаются гидрированию
133. Ацетилен взаимодействует с:
-
бромом
-
азотом
-
пропаном
-
железом
134. Общая формула аренов:
-
СnН2n+2
-
СnН2n
-
СnН2n-2
-
СnН2n-6
135. Гомологами являются:
-
этилбензол и 1,4-диметилбензол
-
этилен и ацетилен
-
бутен-1 и бутен-2
-
метилбензол и этилбензол
136. По тривиальной номенклатуре 1,2-диметилбензол называют:
-
о-ксилол
-
м-ксилол
-
п-ксилол
-
стирол
137. Установите истинность суждений об аренах.
А. Факт присоединения к молекуле бензола трех молекул водорода можно понять только в том случае, если признать, что исходное вещество имеет циклическое строение.
Б. Впервые формулу бензола предложил немецкий химик Ф.А. Кекуле.
-
верно только А
-
верно только Б
-
оба высказывания верны
-
оба высказывания неверны
138. Толуол (метилбензол) относится к гомологическому ряду с общей формулой:
-
СnН2n+2
-
СnН2n
-
СnН2n-2
-
СnН2n-6
139. Установите истинность суждений об аренах.
А. Делокализация электронов в сопряженной системе приводит к понижению устойчивости системы.
Б. Тип гибридизации атомных орбиталей атомов углерода в бензоле sp2.
-
верно только А
-
верно только Б
-
оба высказывания верны
-
оба высказывания неверны
140. Выберите вещество, которое на свету взаимодействует с бензолом:
-
водород
-
бромная вода
-
раствор перманганата калия
-
раствор гидроксида натрия
141. Толуол при определенных условиях реагирует со всеми перечисленными веществами, кроме:
-
хлороводород
-
водорода
-
бромной водой
-
раствора перманганата калия
142. Влияние метильного радикала на свойства толуола проявляется в том, что:
-
реакция толуола с бромом по бензольному кольцу может происходить легче, чем с бензолом
-
реакция нитрования толуола происходит труднее, чем бензола
-
в отличие от бензола реакция присоединения водорода к толуолу происходит в присутствии катализатора
-
у толуола, в отличие от бензола, возможна реакция с водой
143. С сохранением -системы бензола протекают все реакции, кроме:
-
хлорирования на свету
-
нитрования
-
алкилирования
-
хлорирования в присутствии хлорида железа(Ш)
144. Выберите вещество, которое при определенных условиях взаимодействует с бензолом.
-
соляная кислота
-
азотная кислота
-
раствор перманганата калия
-
раствор хлорида натрия
145. Влияние метильного радикала на бензольное кольцо в толуоле проявляется в том, что:
-
толуол легче, чем бензол, вступает в реакцию замещения в бензольном кольце
-
толуол труднее, чем бензол, вступает в реакцию замещения в бензольном кольце
-
толуол легче, чем бензол, вступает в реакцию замещения в метальном радикале
-
толуол легче, чем бензол, вступает в реакцию горения
146. Веществами /условиями реакций в схеме реакций:
1-хлорпропан → гексан -→ С6Н6 →С6Н5Вг соответственно обозначены:
-
натрий, температура и катализатор (Ni), бром, в присутствии катализатора (FeBr3)
-
натрий, температура и катализатор (Ni), бромная вода
-
температура и катализатор (Ni), бромная вода, натрий
-
спиртовой раствор щелочи, водород в присутствии катализатора, бром, в присутствии катализатора (FeBr3)
147. Влияние метильного радикала на свойства толуола проявляется в том, что:
-
электронная плотность в бензольном кольце повышается в положении 3, 5
-
электронная плотность в бензольном кольце повышается в положении 2, 4, 6
-
электронная плотность в бензольном кольце повышается в положении 2, 3, 4
-
электронная плотность в бензольном кольце повышается в положении 3, 4, 5
148. Природный газ состоит в основном из углеводородов:
-
разветвленных, высших предельных
-
неразветвленных, высших предельных
-
низших предельных
-
низших непредельных
149. Ректификация — это процесс:
-
разделения нефтяных фракций
-
расщепления углеводородов с длинной цепью на углеводороды с меньшей относительной молекулярной массой
-
получения ароматических углеводородов
-
получения углеводородов с разветвленными цепями
150. Природный газ содержит в основном:
-
метан, этан, пропан, бутан
-
пентан, гептан, гексан
-
благородные газы, углекислый газ
-
гексан, октан, благородные газы
151. Риформинг проводят для:
-
разделения нефтяных фракций
-
расщепления углеводородов с длинной цепью на углеводороды с меньшей относительной молекулярной массой
-
получения ароматических углеводородов
-
получения углеводородов с разветвленными цепями
152. Даны вещества: а) метан, б) пропен, в) бензол, г) 2-метил- бутадиен-1,3 д) бутин-1. Какие из этих веществ способны обесцвечивать бромную воду?
-
а, в и г
-
б, в и г
-
б, г и д
-
в, г и д
153. Отличить бензол от толуола можно по реакции с:
-
бромной водой
-
перманганатом калия
-
кислородом
-
бромом в присутствии катализатора
154. И с раствором перманганата калия, и с бромной водой реагируют вещества, формулы которых:
-
С2Н2 и С2Н4
-
С3Н6 и С3Н8
-
С6Нб и С2Н2
-
С4Н6 и С4Н10
155. Атом углерода в бензольном кольце находится в состоянии гибридизации:
-
d2sp3
-
sp
-
sp2
-
sp3
156. Углы между гибридными орбиталями атома углерода в молекуле бензола равны:
-
90°
-
109°28’
-
180°
-
120°
157. Число -связей в молекуле бензола равно:
-
6
-
12
-
9
-
15
158. Является ароматическим углеводородом:
-
фенол
-
ксилол
-
этанол
-
пропанол
159. Не является ароматическим углеводородом:
-
бензол
-
толуол
-
фенол
-
ксилол
160. Относится по составу к аренам:
-
С6Н10
-
С8Н10
-
С7Н10
-
С5Н4
161. Этилбензол и толуол — это
-
структурные изомеры
-
гомологи
-
одно и то же вещество
-
геометрические изомеры
162. Бензол образуется в результате циклизации и дегидрирования:
-
н-гексана
-
циклогексана
-
н-гептана
-
метилциклогексана
163. Толуол образуется в результате дегидрирования:
-
н-гексана
-
циклогексана
-
бензола
-
метилциклогексана
164. Мономером полистирола является
-
этилбензол
-
хлорбензол
-
винилбензол
-
толуол
165. Укажите вещество X в схеме превращений: метан → X → бензол:
-
гексан
-
ацетилен
-
циклогексан
-
хлорметан
166. Для бензола и его гомологов характерны реакции:
-
замещения
-
присоединения
-
окисления
-
всех перечисленных типов
167. Для получения хлорбензола из бензола в качестве реактива используется:
-
СI2 (катализатор АIСI3)
-
СI2 (при нагревании)
-
хлорная вода
-
СI2 (на свету)
168. Для получения гексахлорциклогексана из бензола в качестве реактива используется:
-
СI2 (катализатор АIСI3)
-
СI2 (при охлаждении)
-
хлорная вода
-
СI2 (на свету)
169. При наличии в бензольном кольце электронодонорного заместителя замещение идет в положения:
-
мета и пара
-
орто и пара
-
орто и мета
-
орто, мета и пара
170. Не обесцвечивает раствор перманганата калия при нагревании или при подкислении:
-
бензол
-
о-ксилол
-
толуол
-
стирол
171. Обесцвечивает раствор брома:
-
бензол
-
этилбензол
-
метилбензол
-
винилбензол
172. При действии на бензол водорода (катализатор Pt, нагревание) образуется:
-
циклогексен
-
циклогексан
-
толуол
-
гексан
173. При действии на толуол водорода (катализатор Pt, нагревание) образуется:
-
бензойная кислота
-
гептан
-
метилциклогексан
-
циклогептан
174. При действии хлора (в присутствии хлорида алюминия) на толуол могут образоваться:
-
2-хлортолуол и 3-хлортолуол
-
3-хлортолуол и хлорметилбензол
-
2-хлортолуол и 4-хлортолуол
-
4-хлортолуол и хлорметилбензол
175. При нагревании толуола с раствором перманганата калия образуется кислота:
-
бензойная
-
угольная
-
уксусная
-
соляная
176. В схеме: бензол →X → 4-нитротолуол соединением X может быть
-
метилбензол
-
нитробензол
-
4-аминотолуол
-
Хлорбензол
177. Общая формула предельных одноатомных спиртов:
-
СnН2n+2ОН
-
CnH2nOH
-
CnH2n + 1OH
-
CnH2n-1OH
178. Формула пропанола-2:
-
CH3—CH2OH
-
СН3—СН2—СН2ОН
-
СН3—СН(СН3)—СН2ОН
-
СН3—СНОН—СН3
179. Напишите структурную формулу изооктана — 2,2,4- триметилпентана. Укажите число первичных атомов углерода в молекуле изооктана:
-
3
-
5
-
4
-
6
180. Укажите спирт, который является изомером строения углеродного скелета для бутанола-1:
-
mpem-бутиловый спирт
-
изопропиловый спирт
-
вmop-бутиловый спирт
-
бутанол-2
181. Гомологом бутанола-1 является:
-
вmop-бутиловый спирт
-
2-метилпропанол-2
-
2-метилпропанол-1
-
пропанол-1
182. Одним и тем же веществом являются:
-
этиловый спирт и пропанол-1
-
пропанол-1 и изопропиловый спирт
-
этанол и этиловый спирт
-
пропиловый спирт и пропанол-2
183. Согласно правилу Марковникова при гидратации пропена образуется:
-
пропанол-1
-
этанол
-
пропанол-2
-
метанол
184. Этанол образуется при взаимодействии бромэтана:
-
с водным раствором NaOH
-
с металлическим Na
-
со спиртовым раствором NaOH
-
с этилатом натрия
185. Этиловый спирт получают в ходе процесса брожения:
-
глицерина
-
глюкозы
-
целлюлозы
-
этиленгликоля
186. Этанол получают при гидратации:
-
этиленгликоля
-
ацетилена
-
этана
-
этилена
187. Укажите соединения с наибольшей температурой кипения:
-
этанол
-
пропан
-
этан
-
бутан
188. Между молекулами спиртов существуют связи:
-
ковалентные полярные
-
ковалентные неполярные
-
водородные
-
металлические
189. Наименее растворимый в воде спирт:
-
СН3ОН
-
С8Н17ОН
-
С4Н9ОН
-
С11Н23ОН
190. В ходе взаимодействия этанола с концентрированной серной кислотой при температуре 100 °С образуется преимущественно:
-
моноэтилсульфат
-
диэтилсульфат
-
этилен
-
диэтиловый эфир
191. Альдегиды образуются при окислении:
-
первичных спиртов
-
вторичных спиртов
-
третичных спиртов
-
карбоновых кислот
192. В ходе взаимодействия карбоновой кислоты со спиртом образуется:
-
простой эфир
-
альдегид
-
сложный эфир
-
кетон
193. Определите вещество X в схеме: глюкоза →X → уксусный альдегид.
-
метанол
-
этиленгликоль
-
глицерин
-
этанол
194. Укажите формулу пропандиола-1,3:
-
СН2ОН—СНОН—СН2ОН
-
СН2ОН—СН2—СН2ОН
-
СН2ОН—СНОН—СН3
-
СН2ОН—СН2—СНОН—СН3
195. По систематической номенклатуре глицерин называется:
-
бутантриол-1,2,3
-
пропандиол-1,3
-
пропантриол-1,2,3
-
пропанол-2
196. Глицерин образуется при действии водного раствора щелочи на:
-
2-хлорпропан
-
1,2,3-трихлорпропан
-
пропилен
-
1,1,1-трихлорпропан
197. При реакции этиленгликоля с водным раствором гидроксида натрия образуется:
-
этилат натрия
-
фенолят натрия
-
гликолят натрия
-
реакция не идет
198. Реактив, с помощью которого можно обнаружить многоатомные спирты, это:
-
раствор КМnO4
-
Сu(ОН)2
-
Ag2O (в растворе NH3)
-
бромная вода
199. Вещество, образующее с Си(ОН)2 ярко-синий раствор, это:
-
этанол
-
ксилол
-
глицерин
-
толуол
200. Этиленгликоль, взаимодействуя со свежеприготовленным раствором гидроксида меди (II), образует:
-
белый осадок
-
ярко-красный раствор
-
синий осадок
-
ярко-синий раствор
201. Нитроглицерин, образующийся при взаимодействии глицерина с азотной кислотой, относится к классу:
-
сложных эфиров
-
нитроалканов
-
простых эфиров
-
солей
202. Нитроглицерин используется в медицине как :
-
обезболивающее средство
-
успокаивающее средство
-
сосудорасширяющее средство
-
противоаллергенное средство
203. Для смягчения кожи используют:
-
этиленгликоль
-
глицерин
-
метанол
-
этанол
204. Укажите общую формулу гомологического ряда одноатомных фенолов:
-
СnН2n —5(ОН)2
-
СnН2n—7ОН
-
СnН2n— 6ОН
-
СnН2n—8(ОН)2
205. Г омологом фенола является:
-
о-крезол
-
пирогаллол
-
пирокатехин
-
бензиловый спирт
206. Относится к ароматическим спиртам:
-
фенол
-
о-крезол
-
пирокатехин
-
бензиловый спирт
207. Изомером бензилового спирта является:
-
фенол
-
1,2-дигидроксибензол
-
толуол
-
о-крезол
208. Кислотные свойства в наибольшей степени имеются у:
-
фенола
-
воды
-
этанола
-
бензилового спирта
209. В одну стадию можно получить фенол из:
-
бензола
-
хлорбензола
-
метилбензола
-
ацетона
210. Бесцветное кристаллическое вещество, с характерным запахом, малорастворимое в воде, но хорошо растворимое в щелочах:
-
этиленгликоль
-
этанол
-
фенол
-
глицерин
211. Карболовой кислотой называют раствор:
-
этанола
-
фенола
-
глицерина
-
оксида углерода(IV)
212. В молекуле фенола наиболее подвижны атомы водорода в положениях:
-
2 и З
-
З и 5
-
3 и 4
-
2, 4 и 6
213. Характерное фиолетовое окрашивание фенол образует в ходе реакции с:
-
гидроксидом меди(II)
-
хлоридом железа(III)
-
гидроксидом натрия
-
соляной кислотой
214. Взаимодействует и с натрием, и с раствором гидроксида натрия:
-
пропанол-2
-
бензиловый спирт
-
фенол
-
этанол
215. Если в водный раствор фенолята натрия пропускать углекислый газ, то образуется:
-
бензойная кислота
-
пикриновая кислота
-
карболовая кислота
-
гидроксид натрия
216. Обесцвечивает бромную воду:
-
толуол
-
фенол
-
бензол
-
этанол
217. При обработке фенола избытком бромной воды образуется:
-
2,4,6-трибромфенол
-
2-бромфенол
-
3,5-дибромфенол
-
4-бромфенол
218. Предельный альдегид может иметь формулу:
-
С3Н6О
-
С2Н6О
-
С3Н6О2
-
С3Н5О3
219. Ближайшим гомологом пропаналя является:
-
ацетон
-
пропанол-1
-
метаналь
-
ацетальдегид
220. Изомером пропаналя является:
-
этана ль
-
бутанон
-
пропанон
-
пропанол-1
221. Укажите число изомерных альдегидов, имеющих формулу С5Н10О.
-
5
-
4
-
3
-
6
222. Укажите название следующего соединения:
СН3—С(СН3)2—СН2—СНО
-
2-метилпентаналь
-
2,2-диметилбутаналь
-
3-метилбутаналь
-
3,3-диметилбутаналь
223. Альдегиды образуются при действии СиО на:
-
первичные спирты
-
вторичные спирты
-
третичные спирты
-
простые эфиры
224. При пропускании смеси этилена с воздухом через водный раствор солей палладия, меди и железа образуется:
-
этанол
-
пропаналь
-
этана ль
-
пропанон
225. Является газом при обычных условиях:
-
метанол
-
этанол
-
ацетон
-
метаналь
226. Укажите верное суждение: А) между молекулами альдегидов существуют водородные связи; Б) температуры кипения альдегидов выше, чем температуры кипения соответствующих спиртов.
-
верно только А
-
верно только Б
-
верны оба суждения
-
оба суждения неверны
227. Реакция «серебряного зеркала» является характерной реакцией для:
-
альдегидов
-
алкенов
-
спиртов
-
кислот
228. Для проведения реакции «серебряного зеркала» используют:
-
Ag
-
аммиачный раствор Ag2О
-
раствор AgNО3
-
Ag2О
229. При нагревании альдегида в присутствии гидроксида меди (II) цвет осадка меняется в следующей последовательности:
-
голубой —> желтый —> красный
-
голубой —> красный —> желтый
-
желтый —> голубой —> красный
-
красный —> желтый —> зеленый
230. При окислением альдегидов гидроксидом меди (II) образуется красный осадок следующего вещества:
-
СuОН
-
СuО
-
Cu
-
Cu2O
231. Уксусную кислоту получают из:
-
ацетона
-
этаналя
-
пропаналя
-
метаналя
232. Укажите вещество X в схеме превращений: С3Н7ОН → X → С2Н5СООН :
-
метаналь
-
этаналь
-
пропаналь
-
ацетон
233. При восстановлении водородом из ацетона образуется:
-
метанол
-
пропанол-1
-
этанол
-
пропанол-2
234. Функциональная группа —СООН — это группа:
-
карбонильная
-
карбоксильная
-
гидроксильная
-
альдегидная
235. Укажите формулу карбоновой кислоты:
-
H2SO3
-
С2Н5ОН
-
НСООН
-
СН3СООС2Н5
236. Общая формула одноосновных предельных карбоновых кислот:
-
СnH2nO2
-
СnH2n+2O2
-
СnH2n-2O2
-
СnH2nO
237. Гомолог уксусной кислоты:
-
С2Н5ОН
-
СН3СНО
-
НСООСН3
-
С2Н5СООН
238. Изомер бутановой кислоты:
-
2-метилпропановая кислота
-
2-метилбутановая кислота
-
2-хлорбутановая кислота
-
2,2-диметилпропановая кислота
239. Непредельная кислота:
-
С6Н5СООН
-
С2Н3СООН
-
С2Н5СООН
-
С17Н35СООН
240. Ароматическая кислота:
-
С15Н31СООН
-
С3Н7СООН
-
НСООН
-
С6Н5СООН
241. При скисании вина образуется кислота:
-
бутановая
-
этановая
-
пропановая
-
метановая
242. В выделениях муравьев, в крапиве содержится кислота:
-
метановая
-
пропановая
-
этановая
-
бутановая
243. В корнях валерианы содержится кислота:
-
бутановая
-
гексановая
-
пентановая
-
гептановая
244. Наиболее сильным электролитом является кислота:
-
бутановая
-
пропановая
-
этановая
-
метановая
245. Этановую кислоту нельзя получить в одну стадию из:
-
этанола
-
этаналя
-
бутана
-
этана
246. Пропановую кислоту можно получить при каталитическом окислении:
-
пропанола-1
-
пропанона
-
пропанола-2
-
пропена
247. С каким соединением не реагирует муравьиная кислота:
-
С2Н5ОН
-
Сu
-
СаО
-
NaHCO3
248. С аммиачным раствором оксида серебра реагирует кислота:
-
метановая
-
пропановая
-
этановая
-
бутановая
249. Сложный эфир образуется при взаимодействии кислоты:
-
с кетоном
-
со спиртом
-
с альдегидом
-
с алканом
250. Уксусная кислота может реагировать с каждым из двух веществ:
-
СО2 и Mg
-
MgO и Сu
-
C2H5OH и NH3
-
СI2 и СН3СНО
251. Муравьиная кислота может реагировать с каждым из двух веществ:
-
[Ag(NH3)2]OH и Ag
-
NH3 и НСНО
-
SО2 и KОH
-
СаО и [Ag(NH3)2]OH
252. Вещество X в схеме превращений: уксусная кислота → X → метан:
-
ацетат натрия
-
этаналь
-
этилацетат
-
этанол
253. Вещества X и Y в схеме превращений: этин → X → Y → ацетат натрия соответственно:
-
этановая кислота и этаналь
-
этанол и этановая кислота
-
этаналь и этановая кислота
-
этаналь и этилацетат
254. Непредельной кислотой является:
-
С3Н7СООН
-
С15Н31СООН
-
С17Н35СООН
-
С17Н31СООН
255. Кислота СН2=СН—СН2—СООН по систематической номенклатуре называется:
-
бутен-1-овая
-
бутен-3-овая
-
бутен-2-овая
-
бутен-4-овая
256. Реакция присоединения характерна для кислоты:
-
акриловой
-
валериановой
-
пропановой
-
уксусной
257. Обесцвечивает бромную воду кислота:
-
масляная
-
пальмитиновая
-
олеиновая
-
стеариновая
258. Для того, чтобы отличить олеиновую кислоту от стеариновой, используют:
-
КОН
-
Ag2O в (NH3)
-
Вr2 (водн.)
-
С2Н5ОН
259. Акриловая кислота не реагирует с:
-
h2so4
-
С2Н5ОН
-
NaOH
-
Вr2
260. Определите вещество X в схеме превращений: олеат натрия → X → стеариновая кислота:
-
пальмитиновая кислота
-
линолевая кислота
-
олеиновая кислота
-
линоленовая кислота
261. Является сложным эфиром:
-
С2Н5СОСН3
-
НСООСН3
-
СН3ОС2Н5
-
СН3СН(ОН)СООН
262.Общая формула гомологического ряда сложных эфиров:
-
СnН2nO2
-
СnН2nО
-
СnН2n + 2O2
-
СnН2n —2O2
262. Сложные эфиры являются межклассовыми изомерами:
-
минеральных кислот
-
карбоновых кислот
-
альдегидов и кетонов
-
спиртов и простых эфиров
263. Изомером этилацетата является:
-
метилацетат
-
пропилацета
-
этилформиатт
-
изопропилформиат
264. Сложные эфиры с относительно небольшой молекулярной массой:
-
жидкости с запахом фруктов
-
газообразные вещества
-
твердые вещества
-
хорошо растворимые в воде жидкости
265. Реакция — обратная реакции этерификации является реакцией:
-
гидрирования
-
гидролиза
-
дегидратации
-
нейтрализации
266. Определите вещество X в схеме превращений: С2Н5ОН → Х → С2Н5СООН :
-
этилацетат
-
этилпропионат
-
пропилацетат
-
пропилпропионат
267. Определите вещество X в схеме превращений: СН3СООН → X → СН3ОН :
-
этилформиат
-
этилацетат
-
метилацетат
-
метилформиат
268. Укажите верное суждение: А) твердые жиры — это сложные эфиры глицерина и высших непредельных карбоновых кислот; Б) жидкие жиры — это сложные эфиры глицерина и высших предельных карбоновых кислот.
-
верно только А
-
верны оба суждения
-
верно только Б
-
оба суждения неверны
269. Спирт, образующийся при щелочном гидролизе жиров:
-
пропандиол-1,2
-
этиленгликоль
-
глицерин
-
этанол
270. В состав сливочного масла входит кислота:
-
метановая
-
пропановая
-
этановая
-
бутановая
271. Взаимодействие растворов щелочи с жирами называют реакцией:
-
разложения
-
омыления
-
окисления
-
этерификации
272. Вода, в которой наилучшим образом пенится мыло:
-
ключевая
-
жесткая
-
дождевая
-
морская
273. Маргарин — это продукт переработки растительных масел путем их:
-
кислотного гидролиза
-
каталитического гидрирования
-
щелочного гидролиза
-
частичного окисления
274. При полном гидрировании линоленовой кислоты образуется кислота:
-
стеариновая
-
пальмитинова
-
олеиноваяя
-
линолевая
275. Обесцвечивает бромную воду:
-
маргарин
-
масляная кислота
-
сливочное масло
-
пальмитиновая кислота
276. Количество вещества брома, которое может присоединить к 1 моль трилинолята глицерина:
-
1 моль
-
3 моль
-
2 модь
-
6 моль
277. Моносахаридом является:
-
целлюлоза
-
рибоза
-
сахароза
-
крахмал
278. Глюкоза и рибоза — это соответственно:
-
пентоза и гексоза
-
пентоза и пентоза
-
гексоза и пентоза
-
гексоза и гексоза
279. Альдегидоспиртом является:
-
крахмал
-
фруктоза
-
сахароза
-
глюкоза
280. Кетоноспиртом является:
-
глюкоза
-
рибоза
-
фруктоза
-
дезоксирибоза
281. Дает реакцию «серебряного зеркала»:
-
фруктоза
-
глюкоза
-
глицерин
-
уксусная кислота
282. Не образует при комнатной температуре ярко-синий раствор с Сu(ОН)2:
-
глюкоза
-
рибоза
-
фруктоза
-
этанол
283. В растворе глюкоза существует в виде:
-
линейной формы
-
смеси линейной и циклических форм
-
ɑ—D-глюкозы
-
смеси циклических форм
284. Продуктом восстановления глюкозы водородом на никелевом катализаторе является:
-
сорбит
-
молочная кислота
-
глюконовая кислота
-
фруктоза
285. Укажите вещество X в схеме превращений: крахмал → X → этанол:
-
сахароза
-
глюкоза
-
фруктоза
-
рибоза
286. Дисахаридом является:
-
глюкоза
-
сахароза
-
фруктоза
-
крахмал
287. Молекула сахарозы состоит из остатков:
-
двух молекул глюкозы
-
молекул глюкозы и фруктозы
-
двух молекул фруктозы
-
молекул рибозы и глюкозы
288. Формула сахарозы:
-
С12Н22О11
-
С11Н22О11
-
С12Н24О12
-
С6Н12О6
289. Свекловичный сахар — это:
-
фруктоза
-
рибоза
-
глюкоза
-
сахароза
290. Укажите вещество X в схеме превращений: сахароза → X → этанол.
-
фруктоза
-
этана ль
-
глюкоза
-
этилен
291. Реакция, характерная для дисахаридов, но не характерная для моносахаридов, — это реакция:
-
гидролиза
-
окисления
-
дегидратации
-
восстановления
292. При гидролизе сахарозы образуется:
-
рибоза
-
целлюлоза
-
мальтоза
-
фруктоза
293. Наиболее сладким вкусом обладает:
-
сахароза
-
фруктоза
-
глюкоза
-
крахмал
294. Молекула сахарозы вступает в реакцию со свежеосажденным гидроксидом меди (II) за счет функциональных групп:
-
—ОН
-
—СНО
-
—NH2
-
—СООН
295. При гидролизе крахмала не образуется:
-
глюкоза
-
фруктоза
-
мальтоза
-
декстрины
296. Структурное звено крахмала представляет собой остаток:
-
α-циклической формы глюкозы
-
линейной формы глюкозы
-
β-циклической формы глюкозы
-
линейной формы фруктозы
297. Дисахарид, который образуется при гидролизе крахмала:
-
глюкоза
-
рибоза
-
сахароза
-
мальтоза
298. Реактивом на крахмал является раствор:
-
хлороводорода
-
брома
-
иода
-
хлора
299. Белый аморфный порошок, который не растворяется в холодной воде, а в горячей набухает и образует клейстер:
-
целлюлоза
-
крахмал
-
сахароза
-
мальтоза
300. Раствор иода образует характерное синее окрашивание:
-
с глюкозой
-
с сахарозой
-
с крахмалом
-
с целлюлозой
301. Крахмал и гликоген выполняют функцию:
-
запаса питательных веществ
-
строительного материала
-
передачи наследственной информации
-
источника энергии
302. Наибольшее количество целлюлозы (до 98%) содержится в волокнах:
-
древесины
-
конопли
-
льна
-
хлопка
303. Твердое волокнистое вещество, нерастворимое в воде:
-
мальтоза
-
сахароза
-
крахмал
-
целлюлоза
304. В клетках растений целлюлоза выполняет функцию:
-
строительную и конструкционную
-
запаса питательных веществ
-
катализатора биологических процессов
-
передачи наследственной информации
305. Целлюлоза — макромолекула, структурным звеном которой являются остатки:
-
линейной формы глюкозы
-
α-циклической формы глюкозы
-
β-циклической формы глюкозы
-
линейной формы фруктозы
306. Взрывчатое вещество «пироксилин» — это:
-
тринитрат целлюлозы
-
ди- и триацетат целлюлозы
-
мононитрат целлюлозы
-
триацетат крахмала
307. При нагревании древесины без доступа воздуха получают древесный спирт, формула которого:
-
СН3ОН
-
С2Н5ОН
-
С3Н7ОН
-
С4Н9ОН
308. Укажите вещества X и Y, соответственно, в схеме превращений: целлюлоза → X → этанол → Y → полиэтилен:
-
этилен и глюкоза
-
глюкоза и хлорвинил
-
глюкоза и этаналь
-
глюкоза и этилен
309. Метилэтиламин является амином:
-
третичным
-
четвертичным
-
первичным
-
вторичным
310. В ряду аммиак → метиламин → диметиламин основные свойства:
-
увеличиваются
-
уменьшаются
-
увеличиваются, потом уменьшаются
-
уменьшаются, потом увеличиваются
311. Для аминов характерны реакции с:
-
кислотами
-
алканами
-
основаниями
-
спиртами
312. Этиламин реагирует с:
-
НСI
-
NaOH
-
Н2
-
СаСI2
313. Укажите вещество X в схеме превращений: С6Н6 → X → C6H5NH2 :
-
хлорбензол
-
толуол
-
нитробензол
-
фенол
314. При реакции анилина с бромом образуется:
-
3-броманилин
-
2,4,6-трибромбензол
-
3,5-диброманилин
-
2,4,6-триброманилин
315. Аминокислоты содержат функциональные группы:
-
—СООН и —NH2
-
—NH2 и —ОН
-
—СООН и —N02
-
— NО2 и — СНО
316. К аминокислотам относятся вещества с общей формулой:
-
R—СН2—CONH2
-
H2N—CH(R)—СООН
-
R—СН2—COONH4
-
NO2—CH(R)—COOH
317. Аминокислоты — это:
-
окрашенные твердые вещества
-
бесцветные кристаллические вещества
-
бесцветные жидкости
-
газообразные вещества
318. Аминоуксусная кислота в водном растворе находится преимущественно в следующей форме:
-
H2N+—СН2—СООН
-
H2N—СН2—СООН
-
H2N—СН2—СОО¯
-
H3N+—СН2—СОО¯
319. Аминокислоты имеют свойства:
-
только основные
-
только кислотные
-
амфотерные
-
не имеют подобных свойств
320. В водном растворе аминокислоты не взаимодействуют с:
-
НСI
-
NaOH
-
NaCI
-
С2Н5ОН
321. К биполярным соединениям — внутренним солям — относится:
-
глицин
-
аминоацетат натрия
-
солянокислый глицин
-
ацетат аммония
322. Амидной, а в белках пептидной, называют группу атомов:
-
—СО—NH—
-
—CONH2
-
—COONH4
-
NH2COO—
323. Белковые молекулы построены из остатков:
-
только α-аминокислот
-
только β-аминокислот
-
только ω-аминокислот
-
всех типов аминокислот
324. В синтезе белков в живых организмах принимают участие:
-
150 аминокислот
-
20 аминокислот
-
100 аминокислот
-
10 аминокислот
325. Первичная структура белка обусловлена образованием связей:
-
водородных
-
дисульфидных мостиков
-
ионных
-
пептидных
326. Вторичная структура белка обусловлена образованием связей:
-
водородных
-
дисульфидных мостиков
-
ионных
-
пептидных
327. Реакция образования макромолекул белка из большого числа аминокислот относится к реакциям:
-
полимеризации
-
присоединения
-
поликонденсации
-
замещения
328. Гидролиз белков — это:
-
разложение белков до аминокислот под действием кислот или щелочей
-
разрушение природной структуры белка при нагревании или изменении кислотности среды
-
процесс образования белков из аминокислот
-
проведение характерных цветных реакций на белки
329. Денатурация белков — это:
-
разложение белков до аминокислот под действием кислот или щелочей
-
проведение характерных цветных реакций на белки
-
процесс образования белков из аминокислот
-
разрушение природной структуры белка при нагревании или изменении кислотности среды
330. При действии на белок концентрированной азотной кислоты (ксантопротеиновая реакция) появляется окраска:
-
желтая
-
красная
-
фиолетовая
-
синяя
331. При действии на раствор белка сульфата меди (И) в щелочной среде (биуретовая реакция) образуется окраска:
-
красная
-
красно-фиолетовая
-
желтая
-
синяя
332. К пуриновым основаниям относится:
-
пиридин
-
цитозин
-
гуанин
-
аденин
333. К пиримидиновым основаниям относится:
-
тимин
-
гуанин
-
пиридин
-
аденин
Пятигорский медико-фармацевтический институт – филиал государственного бюджетного образовательного учреждения
высшего профессионального образования «Волгоградский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
О.А. Андреева
ГОТОВИМСЯ К ЭКЗАМЕНАМ
ОТ ПРОСТОГО К БОЛЕЕ СЛОЖНОМУ
Часть I
Учебное пособие по органической химии
для студентов заочного отделения
Пятигорск 2014
УДК 547 (075.4) ББК 35.66
А 65
Рецензенты: доктор фармац. наук, профессор кафедры органической химии ПМФИ – филиала ВолгГМУ Оганесян Э.Т.
доктор фармац. наук, доцент кафедры органической химии ПМФИ – филиала ВолгГМУ Кодониди И.П.
О.А.Андреева Под редакцией канд. хим. наук, доцента Смирновой Л.П.
А 65 Готовимся к экзаменам. От простого к более сложном: учебное пособие по органической химии для студентов заочного отделения / О.А. Андреева. – Пятигорск: ПМФИфилиал ВолгГМУ, 2014. – Ч. I. — 256 с.
Настоящий сборник включает перечень тестовых заданий по органической химии, входящих в экзаменационные вопросы студентам заочного отделения, обучающихся по специальности «Фармация», составлен в соответствии с программой по органической химии и учебным планом по специальности 060301 «Фармация». Содержание вопросов отражает основы строения органических соединений, а также свойства углеводородов и их функциональных производных.
Предназначено для внутривузовского использования студентами заочного отделения.
УДК 547 (075.4) ББК 35.66
Печатается по решению Центральной методической комиссии ПМФИфилиала ГБОУ ВПО ВолгГМУ.
© Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России, 2014
2
РАЗДЕЛ 1. (Определить класс соединений)
К алканам относятся вещества, имеющие общую формулу:
аCnH2n-2
бCnH2n+2
вCnH2n
гCnH2n-4
дCnH2n-6
Соединения, отвечающие общей формуле CnH2n, могут относиться к а алканам и алкадиенам
балкинам и алканам
в алкенам и циклоалканам г алкинам и алкадиенам
даренам и спиртам
Алкинами называются углеводороды, имеющие в молекуле: а одну тройную связь б одну двойную связь
вбензольное кольцо
г только одинарные углерод-углеродные связи
ддве двойные связи
Вещества, имеющие плоское циклическое строение и единую π-электронную систему, могут относиться к:
ациклоалканам
бциклоалкинам
валкенам
гаренам
ддиеновым углеводородам
Производные предельных ациклических углеводородов, содержащие два атома галогена у одного углеродного атома, называются:
авиц-дигалогеналканы
бгалогенарены
вгем-дигалогеналканы
г вторичные галогеналканы
дтретичные галогеналканы
Вещества с общей формулой R-OH называются:
аспиртами
3

бальдегидами
в карбоновыми кислотами г сложными эфирами
даренами
Вещества, у которых гидроксильная группа непосредственно связана с бензольным кольцом, называются:
аароматическими спиртами
бальдегидами
вкетонами
г карбоновыми кислотами
дфенолами
Альдегидами называются вещества, содержащие в молекуле:
акарбонильную группу, связанную с углеводородным радикалом и
водородом
бкарбоксильную группу
в карбонильную группу, связанную с двумя радикалами г гидроксильную группу
даминогруппу
Вещества, имеющие общую формулу,
акетонами
б простыми эфирами
всложными эфирами
гальдегидами
дкарбоновыми кислотами
R
C O
R называются:
Функциональная группа – СООН содержится в молекулах:
аспиртов
бкетонов
вфенолов
гкарбоновых кислот
дсульфоновых кислот
Кфункциональным производным карбоновых кислот относятся все три вещества в ряду:
аROH, RNH2, RCOOH
б RCONH2, RCOCI, RCOOR1 в RCOR1, RCHO, (RCO)2O
г ROH, ArOR, RSO3H
дROR1, RNO2, RSH
4

К амидам карбоновых кислот относится соединение имеющее формулу:
CH2 COOH
аNH2
бCH3 CH2 NH2
гCH3 CN
|
O |
||||||||
|
CH3 |
||||||||
|
C |
||||||||
|
д |
NH2 |
|||||||
Сложными эфирами называются функциональные производные карбоновых кислот, в молекулах которых ОН группа в карбоксиле замещена на:
а-OR
б-NH2
в-OCOR
г -NHNH2
дгалоген
Вещества, имеющие общую формулу RNH2, относятся к:
апростым эфирам
б первичным аминам в вторичным аминам
гтретичным аминам
дамидам
Кпростым эфирам относятся вещества, имеющие общую формулу:
аR 


RC
б

RC
вNH2

R C
г H
5
R

дO
Вещества с общей формулой Ar-N=N-Ar называются:
адиазосоединениями
базосоединеними
ваминами
г амидами
днитрилами
Вещество, имеющее формулу [C6H5–N 2]+CI—, относится к соединениям, которые называются:
аазосоединениями
б галогенопроизводными углеводородов в солями арилдиазония
гсолями сульфокислот
дгалогенангидридами кислот
Природные соединения, отвечающие общей формуле (С5Н8)n, где n ≥ 2 называются:
аалканами
балкенами
встероидами
г терпенами
дуглеводами
Природные соединения, основой которых является углеводород циклопентанпергидрофенантрен (стеран, гонан) называются:
атерпеноидами
балкалоидами
впептидами
г углеводами
дстероидами
Пептидами называются соединения, состоящие из остатков:
аβ-гидроксикислот
бα-гидроксикислот
вα-аминокислот
гаминов
дазотсодержащих гетероциклов
Природные соединения, большинство из которых отвечает общей формуле Cn(H2O)m, относятся к классу соединений, который называется:
6

ауглеводы
бстероиды
валкалоиды
гпептиды
днуклеиновые кислоты
По химическоми строению жиры можно отнести к:
атерпенам
бполипептидам
всложным эфирам
гуглеводам
дпростым эфирам
РАЗДЕЛ 2 (Вещества, применяемые в медицине)
Тривиальное название вещества, формула которого CHCI3:
ахлорметан
бхлоральгидрат
вметилхлорид
гхлороформ
дтрихлорметан
Йодоформом называется вещество, имеющее формулу:
аCH3I
бCH2I2
|
в |
CHI3 |
|
|
г |
CH3 |
– CH 2 – I |
|
д |
CH3 |
– CHI 2 |
Этиловым спиртом является вещество, формула которого:
аC2H5СНО
бC2H5COOH
вC2H5OH
г C2H5ОС2Н5
дC2H5СOC2H5
Вещество, имеющее структурную формулу
аглицерин
бфенол
врезорцин
г ацетон
дэтанол
CH2 CH CH2
OH OH OH , называется:
7

|
OH |
||||
|
Структурная формула |
принадлежит веществу, которое |
|||
|
называется: |
афенол
бпирокатехин
вгидрохинон
г резорцин
дглицерин
это вещество, структурная формула которого:

OH

HO

HO 
CH2 CH CH2
OH OH OH
Формалин это 40%-ный раствор вещества, которое имеет структурную формулу:
O
HC
аH
|
O |
|||||||||||||
|
б |
CH3 |
C |
OH |
||||||||||
|
CH |
O |
CH |
|||||||||||
|
в |
3 |
3 |
|||||||||||
|
O |
|||||||||||||
|
CH3 |
|||||||||||||
|
C |
|||||||||||||
|
г |
OCH3 |
||||||||||||
дC2H5OH
8
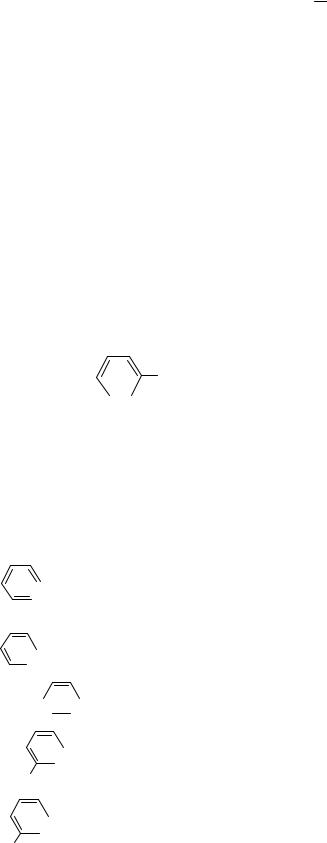
HCOOH
Вещество, имеющее структурную формулу названием:
ауксусная кислота
бформалин
вацетальдегид
гацетон
дэтилацетат
|
CH3 |
C |
CH3 |
|||
|
O |
, известно под |
Уксусная кислота – это вещество, формула которого:
аCH3COOH
бHCOOH
вCH3CH2COOH
гC2H5OH
дC2H5OC2H5
COOH
Структурную формулу 
буксусная кислота
всалициловая кислота
г аспирин
дфенол
Салициловая кислота имеет структурную формулу:



HOOC 

HOOC

HO
Щавелевой кислотой называют вещество, имеющее формулу:
а
бCH3COOH
9

вHOOC – COOH
|
г |
C6H5COOH |
|
д |
C6H5CH2OH |
|
Формула |
HOOC – CH 2 – CH 2 – COOH принадлежит веществу, которое |
|
называется: |
|
|
а |
янтарная кислота |
|
б |
молочная кислота |
вщавелевая кислота
г ацетилсалициловая кислота
дацетон
Молочной кислотой называют вещество, имеющее формулу:
H3C CH COOH
|
а |
OH |
|||||||||||||||
|
H3C |
CH |
COOH |
||||||||||||||
|
б |
NH2 |
|||||||||||||||
|
H3C |
COOH |
|||||||||||||||
|
C |
||||||||||||||||
|
в |
O |
|||||||||||||||
|
г |
H3C |
COOH |
||||||||||||||
|
д |
C6H5 |
COOH |
||||||||||||||
|
CH2 |
COOH |
|||||||||||||||
|
Вещество, имеющее |
структурную формулу |
NH2 |
известно под |
|||||||||||||
названием:
аглицерин
бглицин
вглюкоза
ггуанин
дглутаминовая кислота
Аланином называется вещество, формула которого:
H3C 

|
а |
O |
|||
|
H3C |
CH |
COOH |
||
|
б |
NH2 |
|||
|
CH2 |
COOH |
вNH2
10
Соседние файлы в папке Органическая химия
- #
- #
- #
- #
Вопросы к экзамену по общей и органической химии
Ниже опубликованы вопросы для подготовки к экзамену по общей и
органической химии для студентов 1 курса ФМБФ. Любителям читать с
листочка —
вариант для печати (zip/doc)
.
Химическая связь. Метод молекулярных орбиталей.
Порядок связи в ММО для двухатомных молекул и ионов.
Понятие о методе валентных связей. Гибридизация
атомных орбиталей и их симметрия. Примеры. Направленность и насыщаемость
ковалентной связи. Механизмы образования ковалентной связи.
Строение C2H6,
C2H4, С2H2,
C6H6. Гибридизация и кратность связи в этих
соединениях.
Постоянный диполь молекулы и факторы его
определяющие.
Метод резонанса. Основные принципы.
Локализованные и делокализованные связи в методе PC.
Предельные резонансные структуры.
Квантово-химическая сущность и методика построения.
Оценка предельных структур. Энергия резонанса. Качественная оценка энергии
резонанса.
Электронное строение бутадиена. Энергия сопряжения.
Электронные эффекты: индукционный и мезомерный
(сопряжения). Электронодонорные и электроноакцепторные группы.
Ароматические соединения и ароматичность. Условия
возникновения ароматичности. Ароматический секстет пи-электронов. Бензол,
пиридин, пиррол и т.п. Экспериментальное определение энергии резонанса.
Конденсированные ароматические системы. Неполное выравнивание порядков связей.
Другие ароматические соединения.
Водородная связь.
Современные теории кислот и оснований.
Кислоты и основания. Величины рКа и
рКb. Факторы,
определяющие кислотность и основность органических соединений.
Кислотно-основное равновесие для алфа-аминокислот.
Изоэлектрическая точка.
С-Н-Кислоты. Карбанионы. Таутомерия.
Основные функциональные группы. Классификация
органических соединений.
Уровни изомерии: структурная изомерия (изомерия
скелета, изомерия положения, функциональная изомерия, таутомерия),
пространственная изомерия (конфигурация и конформация).
Хиральность, энантиомерия, диастериомерия,
прохиральность. Относительная и абсолютная стереохимическая номенклатура.
Система Кана-Йнгольда-Прелога. R, S-номенклатура
хиральных молекул. Z, E-Номенклатура ахиральных молекул.
Молекулы с одним хиральным центром. Проекции по
Фишеру. Правила проектирования по Фишеру. Правила преобразования фишеровских
проекций.
Соединения, содержащие несколько хиральных центров.
Мезо-формы. Псевдохиральность.
Конформационный анализ. Конформация и конформеры.
Конформация ациклических молекул. Двугранные углы и ньюменовские проекции.
Энергетический профиль конформации. Конформационная номенклатура.
Скорость реакции. Понятие скоростьлимитирующей
стадии. Метод стационарных концентраций. Метод установившегося равновесия.
Теория переходного состояния. Термодинамическая
трактовка константы скорости реакции. Переходное состояние. Координата
реакции. Понятие Элементарной реакции.
Катализ (гомогенный, гетерогенный, ферментативный).
Моно- (SN1) и бимолекулярные (SN2) механизмы нуклеофильного
замещения. Основные кинетические особенности. Стереохимия. Влияние
заместителей в субстрате на реакционную способность. Влияние на скорость
реакции строения уходящей группы и нуклеофильного агента.
Нуклеофильное присоединение к кратной связи
углерод-гетероатом. Влияние строения субстрата на скорость реакции. Механизмы
некатализируемой, катализируемой кислотами и основаниями реакции.
Взаимодействие альдегидов и кетонов с кислород и азотсодержащими нуклеофилами.
Альдольная и кротоновая конденсация. Гидролиз производных карбоновых кислот.
Сложноэфирная конденсация (конденсация Кляйэена).
Электрофильное присоединение к кратной связи
углерод-углерод. Влияние строения субстрата, природы электрофильного агента,
растворителя. Присоединение по правилу Марковникова.
Электрофильное замещение в ароматическом ядре
(механизм, ориентирующее действие заместителей, примеры реакций).
Бета-элиминирование. Механизмы E1, Е2, E1cB. Правила
Зайцева и Гофмана.
Кислотно-основной катализ в органических реакциях
различного типа.
Элементы биоорганической химии по курсу лекций.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА:
В.Л. Флорентьев, Органическая химия (ч. 1), M, 1990
г.
Методические указания к практическим работам по
органической химии, МФТИ, М., 1989.
Дж. Робертс, М. Касерно. Основы органической химии,
т. 1, 2. Изд. Мир, 1978.
И.И. Гранберг. Органическая химия. М., Высш. школа,
1980, 1988.
П. Сайке. Механизмы реакций в органической химии. М.,
Изд. Химия, 1977.
А. Терней. Современная органическая химия, т. 1, 2.
Изд. Мир, М., 1981.
В.В. Зеленцов Курс лекций по биоорганической химии.
Понятие о функциональных группах. Основные классы органических соединений. Теория строения А.М. Бутлерова.
Электронная структура атома углерода и химические связи. Взаимное влияние атомов в молекулах органических соединений.
Гомологический ряд алканов. Номенклатура и изомерия. Радикалы алканов. Способы получения (из солей карбоновых кислот, реакция Вюрца). Отдельные представители (вазелин, вазелиновое масло, парафин) применение в медицине и фармации.
Тетраэдрическое строение атома углерода. Образование — связей. Реакции свободнорадикального замещения, окисление алканов.
Гомологический ряд, номенклатура алкенов. Строение на примере этилена. Образование p — связи. Структурная и пространственная изомерия. Способы получения – реакции элиминирования. Отдельные представители (этилен, полипропилен) применение в медицине и фармации.
Химические свойства алкенов (реакции присоединения, реакции окисления). Правила А.М. Зайцева и В.В. Марковникова.
Номенклатура алкадиенов. Строение бутадиена-1,3. Сопряжение и делокализация. Способы получения бутадиена-1,3 и изопрена. Химические свойства алкадиенов.
Понятие о полимерах и их применение. Каучуки.
Гомологический ряд алкинов, номенклатура, изомерия. Строение на примере ацетилена. Отдельные представители (ацетилен, винилацетилен) применение в медицине и фармации.
Образование и p — связей. Способы получения. Химические свойства алкинов (реакции присоединения, окисления, восстановления, кислотные свойства).
Номенклатура насыщенных и ненасыщенных карбоциклических соединений. Структурная и пространственная изомерия алициклов. Особенности строения циклоалканов.
Химические свойства алициклических соединений: взаимодействие с галогенами, галогеноводородами, водородом.
Классификация, номенклатура и изомерия аренов. Строение бензола, признаки ароматичности, правило Хюккеля. Реакции электрофильного замещения. Отдельные представители (бензол, толуол, фенантрен) применение в медицине и фармации.
Электронодонорные (I рода) и электроноакцепторные (II рода) заместители, их направляющее действие в реакциях SE , Реакции окисления, восстановления, боковой цепи.
Классификация галогенопроизводных углеводородов. Номенклатура: радикало – функциональная и заместительная. Зависимость свойств галогеналканов от строения радикала и галогена. Отдельные представители (хлорэтан, хлороформ, иодоформ) применение в медицине и фармации.
Реакции нуклеофильного замещения в галогенопроизводных углеводородах (гидролиз, аммонолиз, взаимодействие с солями циановодородной кислоты). Реакции элиминирования. Реакции ароматических галогенопроизводных.
Современные представления о кислотах и основаниях. Теория Бренстеда — Лоури. Основные типы органических кислот и оснований. Сопряженные кислоты и основания.
Классификация спиртов. Гомологический ряд предельных одноатомных спиртов. Радикало – функциональная и заместительная номенклатура спиртов. Способы получения одноатомных спиртов.
Межмолякулярная водородная связь в спиртах. Химические свойства спиртов: кислотно – основные свойства, реакции нуклеофильного замещения, дегидратации, окисления, восстановления.
Многоатомные спирты (этанол, глицерин). Сравнительная характеристика одноатомных и многоатомных спиртов.
Классификация, номенклатура, способы получения и химические свойства одноатомных фенолов в сопоставлении со спиртами.
Кислотные свойства фенолов. Реакции нуклеофильного замещения (взаимодействие с галогенопроизводными). Качественные реакции на фенолы. Отдельные представители (фенол, резорцин, пирокатехин, гидрохинон) применение в медицине и фармации.
Тиолы и их производные. Способы получения. Химические свойства. Тиоэфиры
Классификация, номенклатура, способы получения простых эфиров. Физические и химические свойства простых эфиров. Отдельные представители (этоксиэтан, бутилвиниловый эфир, винилин) применение в медицине и фармации.
Классификация аминов. Номенклатура. Способы получения. Физические свойства. Отдельные представители (сульфаниловая кислота, сульфаниламидные препараты) применение в медицине и фармации.
Взаимное влияние атомов в аминах. Основность. Анилин. Химические свойства алифатических аминов.
Реакции диазотирования первичных ароматических аминов. Строение солей диазония, их реакции азосочетания с фенолами.
Реакции замещения диазокатиона на другие функциональные группы в солях диазония.
Электронное строение оксо – группы. Номенклатура, способы получения альдегидов и кетонов. Отдельные представители (формальдегид, уротропин) применение в медицине и фармации.
Реакции нуклеофильного присоединения в оксосоединениях (взаимодействие с цианидами металлов, спиртами, производными аммиака; окисление, восстановление).
Классификация карбоновых кислот. Номенклатура. Способы получения монокарбоновых и дикарбоновых кислот. Строение карбоксильной группы. Отдельные представители (уксусная, щавелевая, малоновая, янтарная кислоты) применение в медицине и фармации.
Химические свойства карбоновых кислот. Кислотность, реакции этерификации, образование галогенангидридов, амидов по одной и двум карбоксильным группам. Специфические реакции дикарбоновых кислот.
Пространственное строение органических соединений. Энантиомеры. Диастереомеры. Рацематы. Мезоформы. Относительная и абсолютная конфигурация. Стереоизомерия и биологическая активность.
Классификация гидроксикислот. Номенклатура. Оптическая активность, изомерия. Химические свойства алифатических гидроксикислот как бифункциональных соединений. Отношение к нагреванию. Отдельные представители (пировиноградная, ацетоуксусная, салициловая кислоты, фенилсалицилат, сегнетова соль) применение в медицине и фармации.
Кислотность, химические свойства фенолокислот. Реакции карбоксильной группы, реакции фенольного гидроксила, декарбоксилирование. Качественные реакции фенолокислот.
Классификация аминокислот. Номенклатура. Строение. Химические свойства: реакции карбоксильной группы, реакции аминогруппы. Отношение к нагреванию. Пептидная связь. Отдельные представители (анестезин, новокаин) применение в медицине и фармации.
Аминоспирты и аминофенолы.
Классификация, номенклатура, строение и ароматичность гетероциклических соединений. Пиррольный и пиридиновый атомы азота — зависимость между их строением и свойствами соединений. Отдельные представители (фурацилин, анальгин, дибазол, теофиллин) применение в медицине и фармации.
Химические свойства гетероциклических соединений: кислотно – основные, реакции электрофильного замещения, восстановление. Фуран. Тиофен. Пиррол. Диазолы. Азины. Диазины.
Классификация, номенклатура и строение углеводов. Цикло – оксо – таутомерия.
Оптическая изомерия моносахаридов. Формулы Фишера и Хеуорса.
Химические свойства моносахаридов. Реакции полуацетального гидроксила, реакции спиртовых гидроксилов, окисления, восстановления. Дисахариды: сахароза, лактоза.
Строение, пептидная связь, пептидная цепь, первичная и вторичная структура белков. Денатурация белка. Качественные реакции на белки. Природные α-аминокислоты.
Классификация, номенклатура, общая характеристика строения жиров. Физические свойства жиров.
Химические свойства жиров. Кислотный и щелочной гидролиз, гидрогенизация жидких жиров. ПАВ.