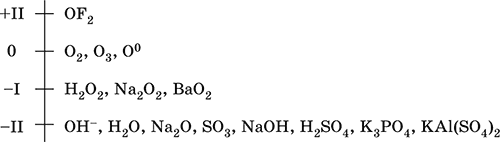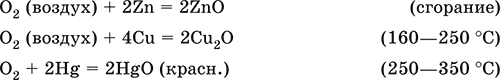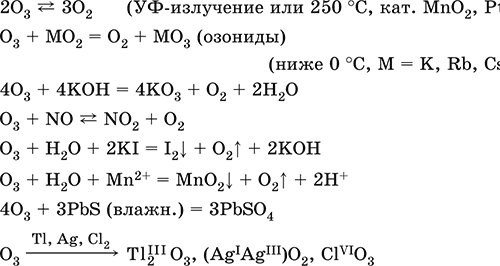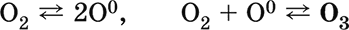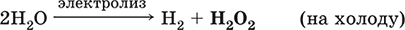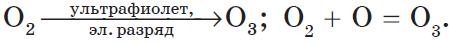1. Положение кислорода в периодической системе химических элементов
2. Электронное строение кислорода
3. Физические свойства кислорода и нахождение в природе
4. Способы получения кислорода
5. Химические свойства кислорода
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с металлами
5.1.6. Взаимодействие с углеродом
5.2. Взаимодействие со сложными веществами
Кислород
Положение в периодической системе химических элементов
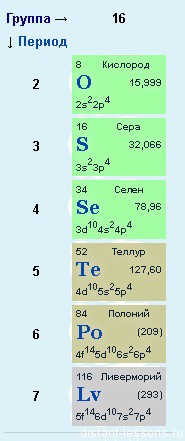
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии:
+8O 1s22s22p4 1s 2s
2p
Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183оС.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение бертолетовой соли в присутствии катализатора MnO2:
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода в присутствии оксида марганца (IV):
2H2O2 → 2H2O + O2
2HgO → 2Hg + O2
2KNO3 → 2KNO2 + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
Соединения кислорода:
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2
Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O
Оксиды металлов и неметаллов Na2O, SO2 и др. Кислородсодержащие кислоты Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 + 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
S + O2 → SO2
Si + O2 → SiO2
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P + 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P + 5O2 → 2P2O5
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Al4C3 + 6O2→ 2Al2O3 + 3CO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 + O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 + O2 → 2CH3-CH=O
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает
группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος —
рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O — 2s22p4
- S — 3s23p4
- Se — 4s24p4
- Te — 5s25p4
- Po — 6s26p4
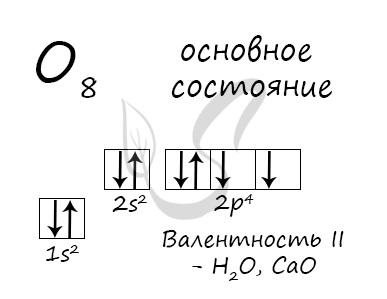
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более
высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых
устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция
каталитического разложения пероксида водорода.
KMnO4 → K2MnO4 + MnO2 + O2↑
KClO3 → KCl + O2↑
H2O2 → (кат. — MnO2) H2O + O2
На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции
с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Реакции с металлами
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
NO + O2 → (t) NO2
S + O2 → (t) SO2
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2

Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются
до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Подгруппа кислорода
22-Окт-2012 | комментария 2 | Лолита Окольнова
Подгруппа кислорода
Элементы 6-й группы главной подгруппы. Очень часто употребляемое название — ХАЛЬКОГЕНЫ — «руду рождающие». Думаю, этим названием они в большей степени обязаны сере, чем кислороду 🙂
В формате подготовки к ЕГЭ мы рассмотрим физические и химические свойства двух элементов — кислорода O и серы S.
Электронное строение
nS2 np4
Но тут не все так просто.
К кислороду претензий нет — у него электронное строение соответствует общей формуле, а вот у серы и остальных элементов есть и другие варианты… Если детально рассмотреть строение p-элементов по периодам, то нужно обратить внимание, что с 3-го периода у p- элементов появляется свободная d-орбиталь, на которую могут переходить электроны.
Именно поэтому степень окисления серы может быть не только -2.
Итак, выводы:
- Валентность элементов:
- валентность кислорода = 2,
- валентность серы — 2,4,6
- Степени окисления:
- степень окисления кислорода = -2 — типичный неметалл, сильный окислитель;
- степень окисления серы = -2(минимальная степень окисления), +2 (редко), +4, +6 (максимальная степень окисления) в минимальной с.о. S будет проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства

Сера — S — твердое вещество, хотя мы пишем формулу этого вещества как S , но обычно образуются кристаллы состава S4 и S8. Обычно сера — пластичное вещество коричневого или желтого цвета.
На воздухе сера горит: S + O2 = SO2 (бесцветный газ с резким запахом)
Химические свойства
Свойства кислорода
| Окислительные свойства |
Восстановительные свойства |
|
Кислород может проявлять восстановительные свойства только к элементу, у которого больше электроотрицательность, т.е., он должен стоять в периодической системе элементов правее кислорода. Это КОРОЛЬ НЕМЕТАЛЛОВ — F:
|
Свойства серы:
| Окислительные свойства |
Восстановительные свойства |
|
|
Cернистая кислота — H2SO3 (степень окисления серы= +4). Соли — сульфиты
Серная кислота — H2SO4 (cтепень окисления серы=+6). Соли — сульфаты
Их свойства мы рассмотрим отдельно.
[TESTME 32]
Категории:
|
Обсуждение: «Подгруппа кислорода»
(Правила комментирования)
2.3.2. Химические свойства кислорода и серы.
Химические свойства кислорода
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств. Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию. Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 oC и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Химические свойства озона:
Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах:
PbS + 4O3 = PbSO4 + 4O2
Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном:
2Ag + O3 = Ag2O + O2
Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода:
2KI + O3 + H2O = I2↓ + O2 + 2KOH
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:
Особенности химических свойств концентрированной и разбавленной серной кислоты
Оксиду серы(VI) – соответствует серная кислота H2SO4.
Серная кислота является сильной кислотой, она представляет собой тяжелую маслянистую жидкость плотностью 1,84 г/см3, нелетуча. С водой смешивается в любых соотношениях. Напомним: при приготовлении водных растворов H2SO4 следует добавлять небольшими порциями концентрированную серную кислоту к воде при перемешивании.
Серная кислота проявляет все свойства кислот: реагирует с основаниями, основными оксидами, солями более слабых и летучих кислот:
H2SO4 + 2NaOH = Na2SO4 + 2H2O;
H2SO4 + CuO = CuSO4 + H2O;
H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑;
H2SO4(конц.) + NaCl(тв.) 
Особенности взаимодействия серной кислоты с металлами
Разбавленная серная кислота взаимодействует с металлами, которые расположены в электрохимическом ряду напряжений до водорода, как обычная кислота, то есть с выделением водорода:
Zn + H2SO4 = ZnSO4 + H2.
разбавл.
Концентрированная серная кислота является сильным окислителем, она способна окислять металлы, стоящие в электрохимическом ряду напряжений правее водорода (Cu, Ag, Hg):
Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O.
конц.
При этом окислителем является сера в степени окисления +6. Чаще всего продуктом восстановления серы является SO2. При взаимодействии с активными металлами (Zn, Mg) могут образовываться сера и сероводород.
Некоторые металлы, такие как железо, алюминий, хром не реагируют с концентрированной H2SO4 без нагревания благодаря наличию защитной оксидной пленки. Свинец не реагирует с разбавленной серной кислотой вследствие образования защитной пленки из нерастворимого сульфата свинца PbSO4.
Золото и платину серная кислота не растворяет.
Серная кислота является важнейшим продуктом химической промышленности.
Основной метод промышленного получения серной кислоты – контактный. Сначала получают SO2 путем сжигания серы на воздухе, либо обжигом природных сульфидов металлов, в основном, пирита:
S + O2 = SO2;
4FeS2 +11O2 = 2Fe2O3 + 8SO2.
Далее, после тщательной очистки диоксид серы окисляют кислородом воздуха на катализаторе (V2O5):
2SO2 + O2 = 2SO3.
Окисление осуществляется в контактном аппарате, поэтому этот метод получения серной кислоты получил название контактный.
Заключительная стадия процесса получения серной кислоты – поглощение SO3 концентрированной серной кислотой. При этом образуется олеум – раствор SO3 в серной кислоте. Для получения серной кислоты олеум разбавляют раствором серной кислоты. Непосредственное поглощение триоксида серы водой использовать нельзя, так как при этом образуется туман из мельчайших капелек серной кислоты, что снижает эффективность процесса поглощения.
Серная кислота широко используется в промышленности для получения минеральных удобрений, очистки нефти, получения различных веществ. В нашей республике серная кислота производится на Гомельском химическом заводе и Гродненском производственном объединении “Азот”.
Сернистая и серная кислоты, будучи двухосновными, образуют два вида солей. Соли серной кислоты – сульфаты и гидросульфаты, сернистой кислоты – сульфиты и гидросульфиты. Сульфаты натрия Na2SO410H2О и магния MgSO47H2О используются в медицине; сульфат кальция СаSO42H2O (гипс) – в строительстве; сульфат алюминия Al2(SO4)3 – для очистки воды. Сульфит натрия Na2SO3 применяется в фотографии.
Качественной реакцией на сульфат-ионы SO42– является образование с ионами бария Ba2+ белого осадка BaSO4, нерастворимого в кислотах:
H2SO4 + Ba(NO3)2 = BaSO4 + 2HNO3;
SO42– + Ba2+ = BaSO4.
Кислород – элемент 2-го периода и VIA-группы Периодической системы, порядковый номер 8, относится к халькогенам (но чаще рассматривается отдельно). Электронная формула атома [2He]2s22p4, характерные степени окисления чаще 0 и – II, реже – I и +II, состояние ОII считается устойчивым.
Шкала степеней окисления кислорода:
Кислород обладает высокой электроотрицательностью (3,50, второй элемент после фтора), проявляет типичные неметаллические свойства. Образует соединения со всеми элементами, кроме Не, Ne и Ar, входит в состав многочисленных оксидов, гидроксидов, солей кислородсодержащих кислот.
Природный кислород содержит изотоп 16O с примесью изотопов 17O и 18O. В химии большинство соединений природного кислорода рассматривается как изотопно-чистые соединения кислорода-16.
Кислород – самый распространенный элемент в земной коре (55 %) и природных водах, встречается в свободном и связанном виде. Жизненно важный элемент для всех организмов.
Кислород O2. Простое вещество. Состоит из неполярных молекул О2 (дикислород) с ??-связью O=O, устойчивая аллотропная форма существования элемента в свободном виде. Бесцветный газ, в жидком состоянии – светло-голубой, в твердом – синий.
Составная часть воздуха: 20,94 % по объему, 23,13 % по массе. Из жидкого воздуха кислород выкипает после азота N2. Малорастворим в воде (31 мл/1 л Н2O при 20 °C), но несколько лучше, чем N2. При комнатной температуре обладает малой химической активностью из-за прочности двойной связи в молекулах.
Кислород поддерживает горение многих веществ. Сильный окислитель при высоких температурах, реагирует с большинством металлов и неметаллов:
Кислород вызывает ржавление (медленное окисление) железа, уравнения реакций см. в 11.3. Особенно активен атомарный кислород О0 (активность выше, чем у озона O3), обычно получаемый непосредственно в зоне реакции при термическом разложении многих веществ.
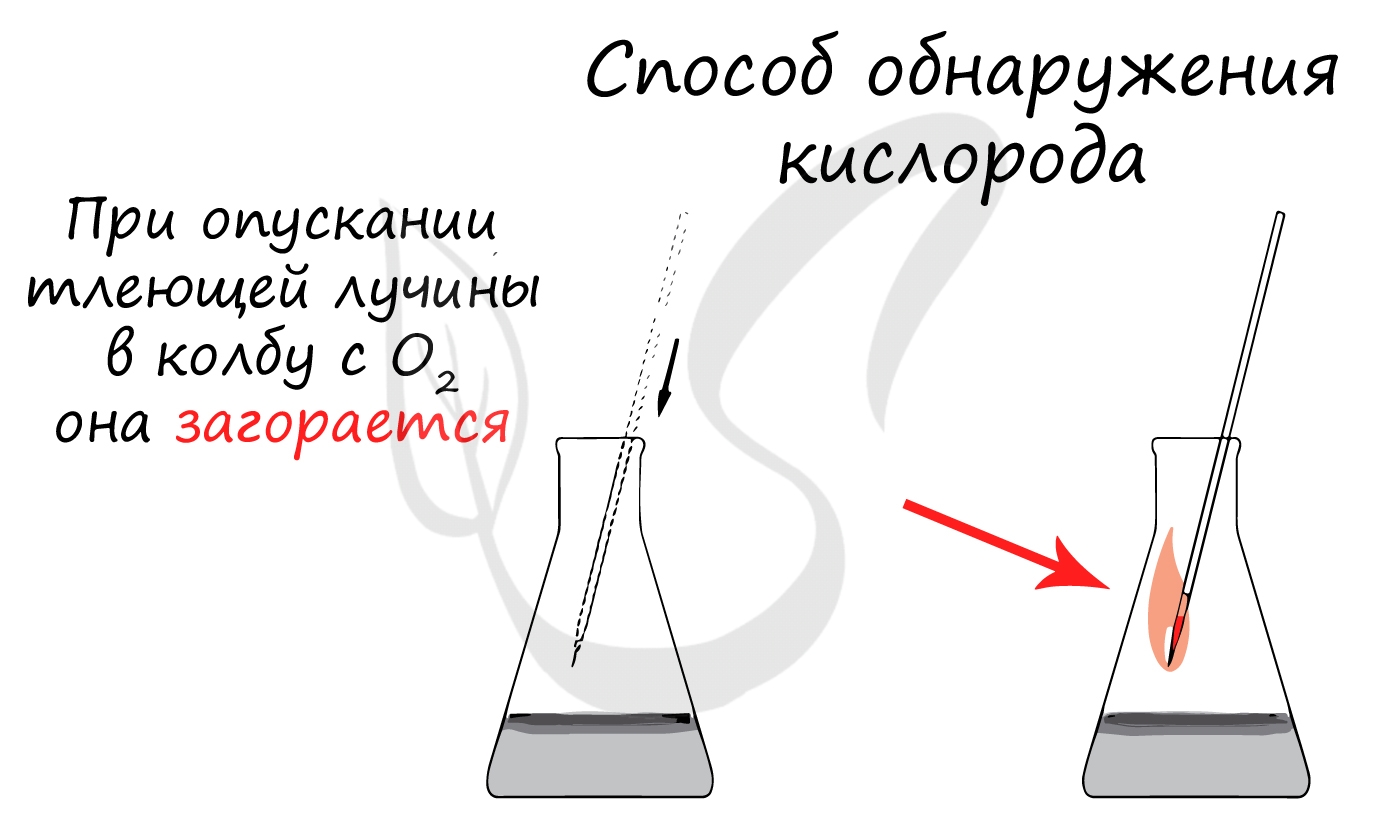
Простейшая качественная реакция – яркое загорание тлеющей древесной лучинки в атмосфере кислорода.
Получение кислорода:
а) в промышленности – фракционная дистилляция жидкого воздуха, электролиз воды (уравнения реакций см. в разд. 12);
б) в лаборатории – нагревание легко разлагающихся кислородсодержащих веществ:
2HgO = 2Hg + O2 (450–500 °C)
2КMnO4 = К2MnO4 + MnO2 + O2 (200–240 °C)
2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум)
2КClO3 = 2КCl + 3O2 (150–300 °C, кат. MnO2)
2KNO3 = 2KNO2 + O2 (400–520 °C)
Кислород является важнейшим продуктом основного химического производства. Применяется как реагент в химической технологии (обжиг сульфидных руд, синтез оксидов), металлургии (производство чугуна и стали) и газификации природного угля, при сварке и резке металлов; жидкий кислород – окислитель топлива в ракетной технике.
Убыль кислорода в атмосфере в результате процессов горения, гниения и дыхания возмещается растениями при фотосинтезе. При вдыхании человеком и животными воздуха в легкие кислород связывается с гемоглобином крови и переносится в клетки, где органические вещества (в первую очередь глюкоза) с его помощью окисляются и обеспечивают жизненную энергию организмов.
Озон O3. Простое вещество (трикислород), неустойчивая аллотропная форма существования элемента. Светло-синий газ с характерным («озоновым») запахом, тяжелее воздуха. Молекула имеет строение незавершенного треугольника [: O(O)2] (sр2-гибридизация, валентный угол 117°), содержит ковалентные ??-связи O=O. Разлагается под действием ультрафиолетового излучения, катализаторов и оксидов азота (разрушение озонового слоя атмосферы Земли). Устойчив в смеси с O2 (озонированный кислород). Малорастворим в воде (285 мл/1 л Н2O), но значительно лучше, чем O2. Сильный окислитель (более сильный, чем O2, но более слабый, чем атомарный кислород O0). Окисляет при комнатной температуре многие металлы и неметаллы до высоких степеней окисления. С надпероксидами щелочных металлов (К, Rb, Cs) образует оранжево-красные озониды. Не реагирует с Au, Cu, Ni, Pt, Sn. Генерируется из кислорода O2 в специальном приборе — озонаторе.
Качественная реакция – выделение иода из раствора KI при комнатной температуре (O2 в реакцию не вступает). Уравнения важнейших реакций:
Получение: под действием электрического разряда в озонаторе:
Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел, как реагент в
неорганическом и органическом синтезе. В атмосфере Земли озоновый слой (на высоте =25 км) защищает живой мир от воздействия космического ультрафиолетового излучения.
Атомарный кислород О0. Третья аллотропная форма кислорода. Более сильный окислитель по сравнению с O2 и O3. Образуется при распаде молекул O2 и O3 под действием ультрафиолетового излучения. Возникает при термическом разложении кислородсодержащих веществ (см. выше, получение O2); при отсутствии восстановителей тут же переходит снова в O2 и O3, в присутствии восстановителей окисляет их:
KNO3 = KNO2 + O0
О0 + С (графит) = СO2
Поэтому вещества, легко отщепляющие кислород при нагревании, проявляют сильные окислительные свойства.
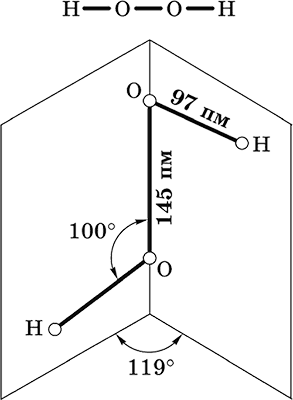
Пероксид водорода Н2O2. Бинарное соединение. Молекула Н2O2 неплоская, имеет строение с ?-связью О – О на ребре и связями Н – О на плоскостях двугранного угла. Степень окисления кислорода равна – I. Группа – О – О– называется пероксогруппой.
Бесцветная жидкость, вязкая, тяжелее воды, чувствительна к свету и примесям (стабилизатор Н3РO4). Разлагается со взрывом при слабом нагревании, на катализаторе – при комнатной температуре. Неограниченно смешивается с водой. Разбавленными щелочами нейтрализуется не полностью. Сильный окислитель, слабый восстановитель.
Пероксид водорода применяется как отбеливатель текстиля, бумаги, кож, жиров и минеральных масел, окислитель ракетного топлива, реагент в органическом синтезе, при осветлении картин старых мастеров (потемневший красочный слой из-за перехода белил – гидроксокарбонатов свинца – в черный PbS осветляют переводом в белый PbSO4). В промышленности обычно используют взрывобезопасный 30 %-ный раствор Н2O2 (пергидроль), в медицине – 3 %-ный раствор.
Уравнения важнейших реакций:
2Н2O2 = 2Н2O + O2 (выше 150 °C или на кат. MnO2)
Н2O2 (разб.) + NaOH (разб.) = NaHO2 + Н2O
Н2O2 (конц.) + 2NaOH(т) = Na2O2? + 2H2O (0 °C)
Н2O2 (3 %) + 2H+ + 2I— = I2? + 2Н2O
5Н2O2 (30 %) + I2(т) = 2НIO3 + 4Н2O
Н2O2 (10 %) + SO32- = SO32- + H2O
4Н2O2 (30 %) + PbS (черн.) = 4H2O + PbSO4 (бел.)?
3H2O2 + 2[Cr(OH)6]3- = 2CrO42- + 8H2O + 2OH—
2Н2O2 (конц.) + Са(ClO)2 = СаCl2 + 2Н2O + 2O2?
5H2O2 + 6H+ + 2MnO4— = 2Mn2+ + 5O2? + 8Н2O
Получение: в лаборатории вначале синтезируют пероксид бария ВаO2:
2ВаО + O2 (изб.) = 2ВаO2 (до 500 °C),
а затем его обрабатывают серной кислотой:
ВаO2 + H2SO4 = BaSO4? + Н2O2 (на холоду)
В промышленности (старый метод) – электролиз водного раствора H2SO4 или (NH4)2SO4 в специальных условиях; при этом кислота или соль не расходуются, а протекает электролиз воды с образованием на аноде Н2O2:
Современный промышленный способ (8O% мирового производства) – окисление сложного органического соединения 2-этилантрагидрохинон кислородом воздуха на холоду.
Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
— неметаллов:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
— металлов:
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
$2Cu+O_2=2CuO$;
б) горение сложных веществ:
$2{C_2H_2}↙{ацетилен}+5O_2→4CO_2+2H_2O$
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
${Ag+O_3=AgO+O_2↑}↙{text «(с кислородом серебро не реагирует)» }$
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6{e}↖{-}$, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления $+2,+4,+6$. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления $–2$.
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°{пл}=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°{пл}=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ |
1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°{пл}=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: — с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ — со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ — с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: — горение серы $S+O_2=SO_2$ — обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ |
1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична: 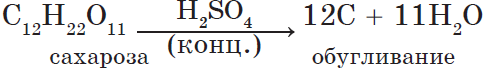 Получение в промышленности в соответствии со схемой: $FeS_2(или S){→}↖{O_2}SO_2{→}↖{O_2}SO_3{→}↖{H_2O}H_2SO_4$ |