Поджелудочная железа относится к железам смешанной секреции. Анатомически она состоит из головки, тела и хвоста.
Головка и тело составляют экзокринную часть, которая выделяет ферменты, участвующие в расщеплении веществ в
тонкой кишке.
Более всего нас с вами будет интересовать хвост поджелудочной железы — то самое место, где в кровь секретируются
гормоны инсулин и глюкагон. Именно в хвосте сосредоточены так называемые островки Лангерганса, объединяющие
клетки с эндокринной функцией.
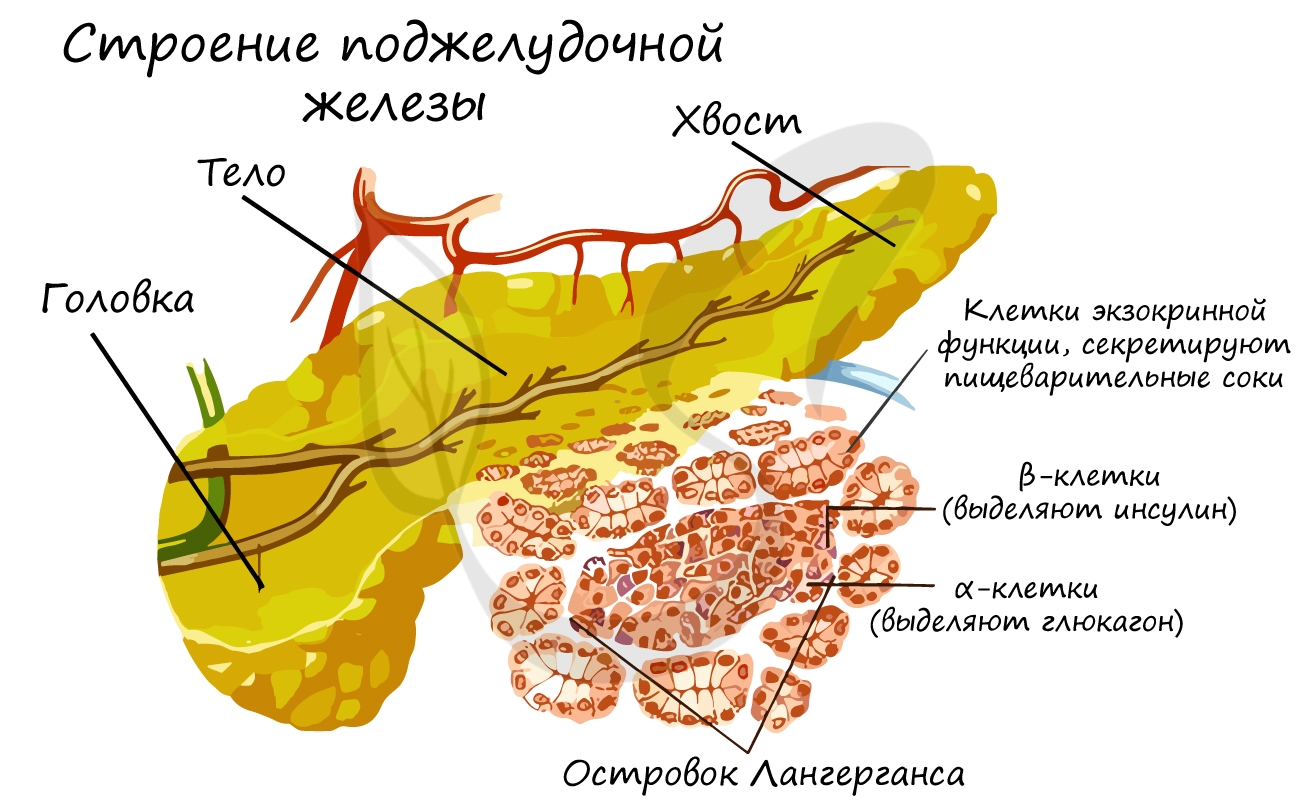
Островки Лангерганса
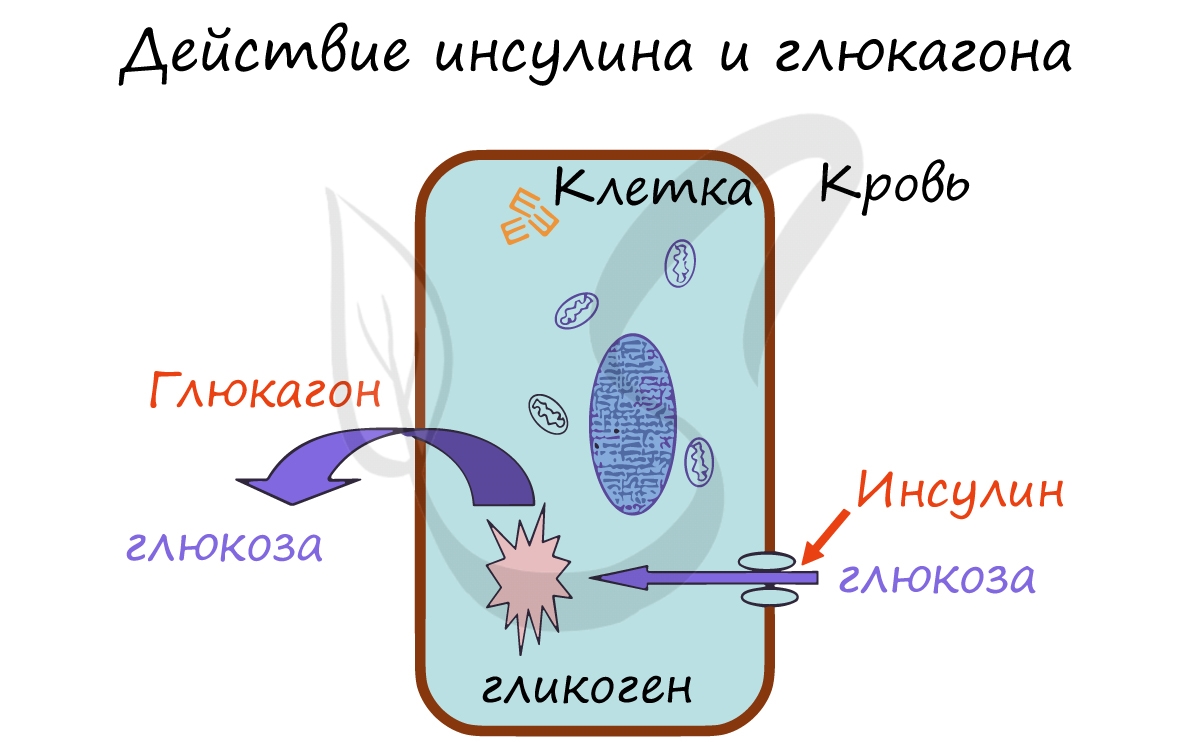
Островками Лангерганса называют скопления эндокринных клеток, продуцирующих гормоны. Состоят из α-клеток, выделяющих
глюкагон, и β-клеток, выделяющих инсулин. Оба эти гормона влияют на обмен углеводов, однако, действие у них противоположное.
Запомните, что инсулин активирует транспорт глюкозы, аминокислот, жирных кислот из крови в клетку. Его действие можно
сравнить с ключом к двери, где инсулин — ключ, который открывает вход в клетку для молекул глюкозы — основного
источника энергии. В клетке глюкоза запасается в виде гликогена, таким образом, в результате действия инсулина содержание глюкозы (сахара) в крови понижается.
Глюкагон, напротив, способствует расщеплению гликогена в клетках и выходу глюкозы в кровь. В результате действия глюкагона
сахар (глюкоза) в крови повышается. Запомните мнемоническое выражение: Глюкагон «Гонит» глюкозу в кровь.
Инсулин выделяется наиболее активно после приема пищи, когда в кровь всасываются моносахариды, аминокислоты, жирные кислоты.
Выделение глюкагона активируется при голодании, когда для поддержания работы организма необходимо повысить уровень глюкозы в крови.
В островках Лангерганса есть особые δ-клетки (дельта-клетки), которые секретируют гормон соматостатин. Соматостатин угнетает выработку
гормона роста (соматотропного гормона гипофиза), синтез ферментов в экзокринной части поджелудочной железы и синтез глюкагона и инсулина
α- и β-клетками.
Сахарный диабет
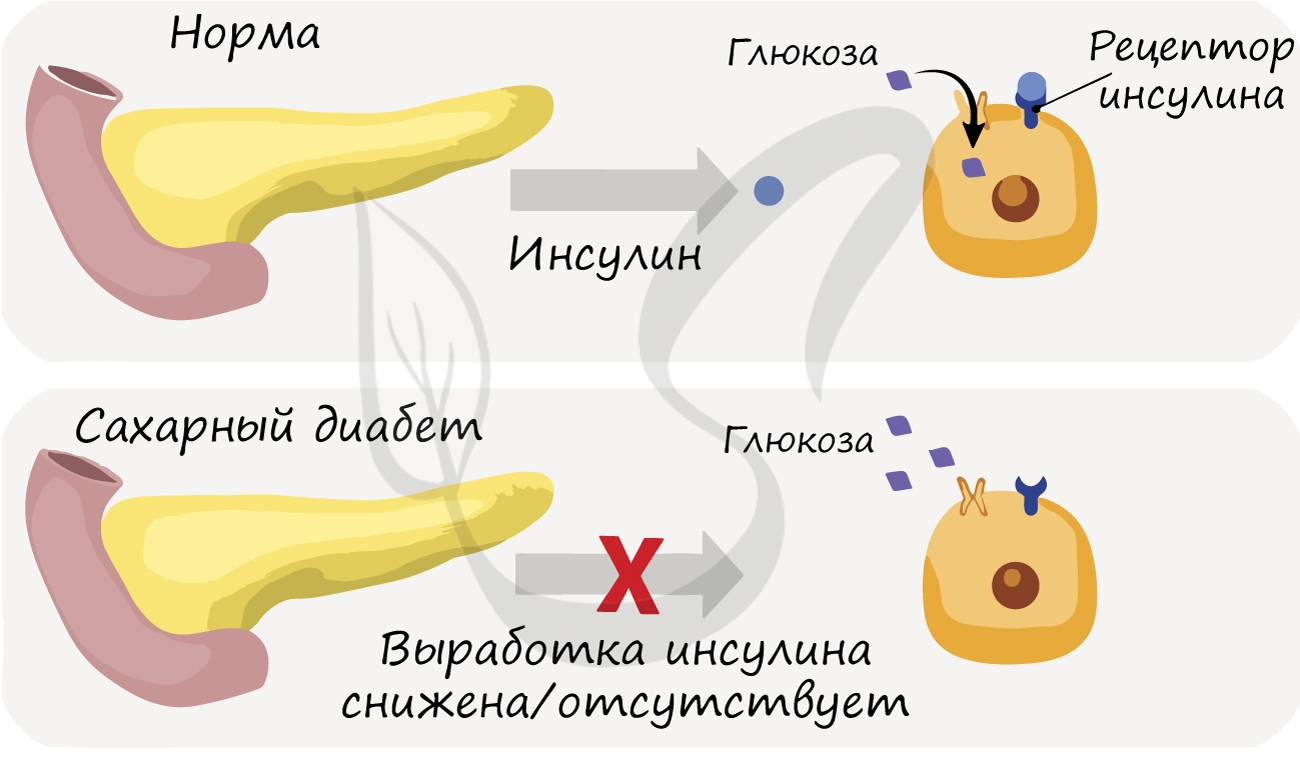
При недостаточной выработке (гипофункции) поджелудочной железой инсулина глюкоза перестает поступать в клетки, которые
в ней нуждаются, и уровень глюкозы в крови возрастает. Парадоксально, но высокий уровень глюкозы не способствует усвоению
ее тканями, так как «ключ к двери» — гормон инсулин — отсутствует в нужном количестве.
Такое состояние называется сахарный диабет. Оно сопровождается гипергликемией (греч. hypér — сверх, чрезмерно + glykýs
— сладкий + háima — кровь) — повышением глюкозы в крови, и глюкозурией (греч. uron — моча) — выделением глюкозы с мочой.
Нейроны особенно чувствительны к отсутствию поступления в них глюкозы, поэтому нередко сахарный диабет впервые проявляется внезапной потерей сознания. Гипергликемия оказывает разрушительное действие на почки, нервы, сосуды. Поэтому больным с сахарным диабетом
крайне важно контролировать уровень глюкозы в крови.

Норма содержания глюкозы в крови 3,5-5,5 ммоль/л. При такой концентрации сахар в моче не обнаруживается, глюкоза в моче
появляется только тогда, когда ее концентрация в крови в 2-2,5 раза больше нормальной.
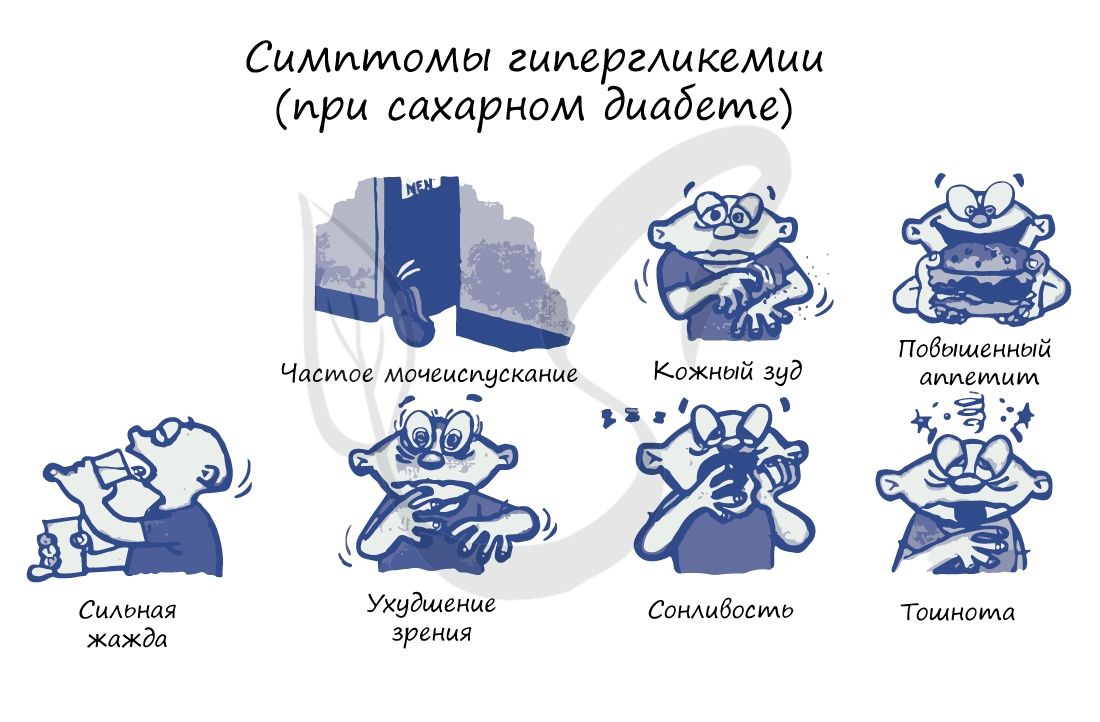
Типичные симптомы диабета: сильная жажда (может выпивать более 6 литров воды в сутки), сахарное мочеизнурение — увеличение
диуреза (объема отделяемой мочи) до 5-6 литров в сутки. Наблюдается повышенный аппетит, однако вес стремительно уменьшается,
присутствует сильная слабость.
Замечу, что сильная жажда и обильное мочеиспускание обусловлено тем, что организм «стремится разбавить» высокую концентрацию глюкозы в крови и
вывести с мочой ее избыток. На схеме ниже для вас собраны самые основные симптомы сахарного диабета.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Поджелудочная железа – орган пищеварительной системы. Она выполняет внешнесекреторную (экзокринную) и внутрисекреторную (эндокринную) функции. Внешнесекреторная функция поджелудочной железы реализуется выделением панкреатического сока, который содержит ферменты, участвующие в пищеварении. Внутрисекреторная функция поджелудочной железы состоит в выработке гормонов, участвующих в регуляции углеводного, жирового и белкового обмена.
Эндокринная часть поджелудочной железы представлена панкреатическими островками, или островками Лангерганса. Островки состоят из клеток, в которых синтезируются гормоны.
- b-клетки продуцируют инсулин
- a-клетки продуцируют глюкагон
- D-клетки продуцируют соматостатин и гастрин
- РР-клетки продуцируют панкреатический полипептид.
Проинсулин — белок, который синтезируется в b-клетках островков поджелудочной железы. Он практически полностью превращается в инсулин после отщепления от него молекулы С-пептида. Небольшая его доля, которая не превратилась в инсулин, поступает в кровоток в неизмененном виде. Биологическая активность проинсулина гораздо ниже, чем инсулина. Чаще всего определение уровня проинсулина применяется в диагностике инсулино́м. Инсулино́ма – это опухоль b-клеток островков Лангерганса, бесконтрольно секретирующая инсулин.
Инсулин необходим для транспорта глюкозы – основного источника энергии для клеток нашего организма, а также калия и аминокислот внутрь клеток. Сам инсулин проникать в клетки не может, поэтому свою функцию осуществляет посредством взаимодействия с рецепторами на поверхности клеток. Он также стимулирует гликолиз и синтез гликогена в печени и мышцах. Абсолютная недостаточность инсулина вследствие повреждения b-клеток — причина развития сахарного диабета 1 типа. Если нарушение возникает на этапе взаимодействия инсулина с клетками, развивается сахарный диабет 2 типа. При этом инсулина в крови достаточно, синтез его не нарушен, но клетки его «не чувствуют». В обоих случаях в крови повышается уровень глюкозы, так как её «некому» переправить в клетки. Это состояние называется гипергликемией. Бывает и обратная ситуация, когда инсулина в крови слишком много. Это ведет к снижению в крови уровня глюкозы – гипогликемии. Причиной избыточной секреции инсулина чаще всего становится инсулино́ма.
С-пептид образуется из проинсулина. Он является показателем секреции инсулина. Период полувыведения С-пептида из кровотока 30-40 минут, что на порядок дольше, чем у инсулина, а его концентрация примерно в 5 раз больше концентрации инсулина. С-пептид полезно определять у пациентов, которые наблюдаются после удаления поджелудочной железы, для диагностики гипогликемических состояний, при подозрении на инсулино́му. Также С-пептид позволяет оценить уровень эндогенного инсулина, при приеме препаратов инсулина, или при наличии в крови антител к инсулину.
Глюкагон синтезируется a-клетками поджелудочной железы и является антагонистом инсулина. Его повышение служит сигналом для организма о необходимости повысить в крови уровень глюкозы. Это достигается путем распада гликогена до молекул глюкозы, или образование глюкозы альтернативным путём (глюконеогенез).
Гастрин стимулирует желудочную секрецию. Его концентрация изменяется в течение суток. После приема пищи концентрация гастрина увеличивается в 1,5-2 раза. Синтез гастрина стимулируется при снижении уровня соляной кислоты в желудке. Определение уровня гастрина применяется в диагностике и контроле лечения синдрома Золлингера-Эллисона, или гастриномы, при котором у 2/3 больных отмечается 10-кратное увеличение уровня гастрина в сыворотке натощак (>1000 пг/мл).
Действие соматостатина в рамках пищеварительной системы заключается в подавлении секреции гастрина, инсулина, глюкагона, пищеварительных ферментов. Он также подавляет секреторную активность других органов желудочно-кишечного тракта.
Тесты для оценки функции поджелудочной железы:
- Инсулин (Insulin)
- С-пептид (Connecting peptide)
- Проинсулин (Proinsulin)
- Гастрин (Gastrin)
- Дифференциальная диагностика форм сахарного диабета
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Наумович Ю.И.
1
Тлехусеж М.А.
1
1 ФГБОУ ВО «Кубанский государственный технологический университет»
Все знают о пользе, а теперь уже и о вреде, углеводов. Но как происходит усвоение их организмом, какие процессы протекают при расщеплении углеводов в организме человека и как происходит выделение той самой энергии, которая так нужна для нашей жизни? Мы рассмотрим один из биохимических процессов – процесс выделения и поглощения энергии из углеводов. Исторически этот процесс получил название брожения. Актуальность биохимических исследований обусловлена выживанием и комфортом человека в природе: это лекарства, продукты питания, красители, и т д. Задачей настоящей работы являлось изучение литературных данных о природе углеводов, их роли в жизни человека, изучение химизма расщепления углеводов с целью понимания процессов энергетического обмена, происходящих в клетках живых организмов и человека.
расщепление углеводов
ферменты
гликолиз
1. Нострадамус. Биография. Карьера врача. [Электронный ресурс]. Режим доступа: https://ru.wikipedia.org/wiki/Нострадамус (дата обращения: 20.12.2018).
2. Углеводы. [Электронный ресурс]. Режим доступа: http://kak.znate.ru/docs/index-43767.html (дата обращения: 19.12.2018).
3. ХиМиК. Гликолиз. [Электронный ресурс]. Режим доступа: http://www.xumuk.ru/biologhim/145.html (дата обращения: 21.12.2018).
4. Химия. Раздел: Спирт из сахара и сахар из воздуха. [Электронный ресурс]. Режим доступа: http://djht.ru/19organichescaa/24.html (дата обращения: 09.12.2018).
5. Шеховцева Т.Н. Ферменты: их использование в химическом анализе // Соросовский образовательный журнал. 2000. Т. 6. № 1. С. 44–48.
6. Московченко Н.Я., Савина Г.А. Ходатайство о награждении Н.Н. Семенова орденом Ленина // Физики о себе. Л.: Наука, 1990. С. 89.
Все биологические процессы, происходящие в окружающем мире, по своей сути являются химическими реакциями. Первую химическую реакцию человек осуществил, когда разжег костер – это реакция горения. Первое антибактериальное применение продуктов брожения и величайшее открытие в области медицины совершил Нострадамус. Большинство из нас знает его как предсказателя, но его основная заслуга состоит в том, что он нашел способ борьбы с чумой с помощью уксусной кислоты. История свидетельствует, чума лишила Нострадамуса и первой семьи, и друзей. С тех пор он искал средство борьбы от страшной болезни. Найдя чудо-лекарство, исследователь переезжал из города в город, где появлялась чума, спасая множество жизней [1].
Первым биохимиком была клетка, которая научилась энергетическому обмену: научилась поглощать свет и выделять энергию, необходимую для жизнеобеспечения. Таким образом, первый биохимик – это и есть сама жизнь. Все процессы, которые протекают в клетках живого организма, – это биохимические реакции.
Углеводы
Название «углеводы» появилось из-за того, что многие представители данного класса имеют общую формулу: Сn(Н2О)m, где n и m >= 4. Известно множество углеводов, не соответствующих этой формуле, но несмотря на это термин «углеводы» употребляется и по сей день. Другое общепринятое название этого класса соединений – сахара.
Все углеводы можно разделить на четыре больших класса.
Моносахариды – это гетерофункциональные соединения, содержащие оксогруппу и несколько гидроксильных групп. Они не могут быть гидролизованы до более простых форм углеводов и являются структурной единицей любых углеводов, например, глюкоза, фруктоза, рибулоза, рамноза. Содержатся в различных продуктах: фрукты, мёд, некоторые виды вина, шоколад.
Олигосахариды – это соединения, построенные из нескольких остатков моносахаридов, связанных между собой гликозидной связью. Они делятся по числу моносахаридов в молекуле на дисахариды, трисахариды и т.д. К биологически активным производным олигосахаридов относятся некоторые антибиотики, сердечные гликозиды.
Дисахариды – это углеводы, которые при гидролизе дают две одинаковые или различные молекулы моносахарида и связаны между собой гликозидной связью, например, лактоза, сахароза, мальтоза. При гидролизе из дисахаридов образуется глюкоза.
Полисахариды – имеют общий принцип строения с олигосахаридами, за исключением моносахаридных остатков – полисахариды могут содержать их сотни и даже тысячи. Примеры: крахмал, гликоген, хитин, целлюлоза [2].
Для лучшего понимания реакций расщепления углеводов в организме, рассмотрим более подробно глюкозу, участвующую в этих процессах.
Глюкоза
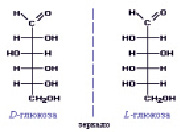
Глюкоза является одним из самых распространенных углеводов в природе, моносахарид, или гексоза С6Н12О6. Второе её название – виноградный сахар. Это растворимое в воде вещество белого цвета, сладкое на вкус. В молекуле глюкозы имеется четыре неравноценных асимметрических атома углерода (рис. 1):
Рис. 1. Строение молекулы глюкозы
Для такого соединения возможно 24 = 16 стереоизомеров, которые образуют 8 пар зеркальных оптических антиподов. Каждое из восьми соединений представляет собой диастереомер (диа – двойной) с присущими только ему физическими свойствами (растворимость, температура плавления и т.д.).
Глюкоза содержится в растительных и живых организмах. Велико ее содержание в виноградном соке, в меде, фруктах и ягодах, в семенах, листьях крапивы. Глюкоза повышает работоспособность мозга, благотворно влияет на нервную систему человека. Именно поэтому в стрессовых ситуациях люди иногда хотят чего-нибудь сладкого. Помимо этого, глюкоза применяется в медицине для приготовления лечебных препаратов, консервирования крови, внутривенного вливания и т.д. Она широко применяется в кондитерском производстве, производстве зеркал и игрушек (серебрение). Ее используют при окраске тканей и кож.
Биохимические реакции расщепления углеводов в организме человека
Для поддержания жизнедеятельности организма используется энергия, скрытая в химических связях продуктов питания. Во многих продуктах питания содержится значительное количество углеводов в виде полисахаридов (сахар, крахмал, клетчатка) и моноз (глюкоза, фруктоза, лактоза и др.). К примеру, в картофеле содержание крахмала составляет до 16 %, в рисе – 78 %, а в белом хлебе – 51 %.
Уже во рту человека начинается процесс расщепления углеводов. Происходит гидролиз крахмала под действием биологического катализатора – фермента амилазы, который содержится в слюне. Под действием амилазы молекула крахмала расщепляется на довольно короткие цепочки, которые состоят из глюкозных звеньев. После этого углеводы попадают в желудок. Далее под действием желудочного сока заканчивается кислотный гидролиз крахмала. Крахмал распадается до отдельных глюкозных звеньев. Глюкоза попадает в кишечник и через стенки кишок поступает в кровь, разносящую её по всему человеческому организму.
Содержание глюкозы в крови поддерживается на постоянном уровне при помощи гормона инсулина, который выделяется поджелудочной железой. Инсулин полимеризует избыточную глюкозу в животный крахмал – гликоген, который откладывается в печени. Часть гликогена в печени может гидролизоваться в глюкозу, далее поступающую обратно в кровь. Это происходит при понижении содержания глюкозы в крови. Если поджелудочная железа не может вырабатывать инсулин, содержание глюкозы в крови повышается, что приводит к диабету. Именно поэтому людям, болеющим сахарным диабетом, необходимо регулярно вводить в кровь инсулин.
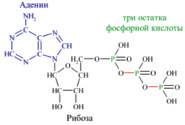
Молекула глюкозы, попадая в клетку организма, окисляется, «сгорает» с образованием воды и диоксида углерода. При этом выделяется энергия, необходимая организму для движения, согревания, осуществления различных физических нагрузок и т.д. Но биологическое окисление глюкозы похоже на обычное горение лишь по своим конечным результатам. Биологическое окисление – процесс медленный, многоступенчатый. Только малая часть высвобождаемой при окислении энергии превращается на каждой стадии данного процесса в тепло. Значительная доля энергии, заключенной в химических связях глюкозы, расходуется на образование других веществ, из которых важнейшее в биоэнергетике – аденозинтрифосфорная кислота C10H16N5O13P3 (АТФ). Это соединение состоит из трех частей – гетероцикла аденина, рибозы (сахара) и трех остатков фосфорной кислоты, образующей с рибозой сложный эфир (рис.2).
Рис. 2. Структура аденозинтрифосфорной кислоты
АТФ в клетках – универсальная энергетическая валюта. Множество ферментов умеют вести химические реакции, осуществляющиеся с затратой энергии, за счет гидролитического отщепления одного или двух остатков фосфорной кислоты от молекулы АТФ (этот процесс сопровождается выделением энергии), или наоборот, умеют использовать энергию, которая высвобождается в реакциях с выделением энергии для того, чтобы АТФ образовалась. Расщепляя АТФ, клетка использует высвобождаемую энергию на биосинтез различных соединений, а окисляя углеводы – синтезирует АТФ.
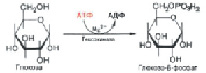
Первая стадия «сгорания» глюкозы в клетке – взаимодействие глюкозы с АТФ (рис. 3). При этом АТФ переходит в АДФ (аденозиндифосфат C10H15N5O10P2), а глюкоза – в 6-фосфат. Этот процесс фосфорилирования происходит под действием фермента гексокиназы за счет перенос остатка фосфорной кислоты (H3PO4) от фосфорилирующего агента – донора к субстрату:
Рис. 3. Взаимодействие глюкозы с АТФ
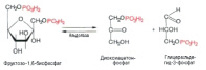
Следующий этап окисления – «рокировка» глюкозофосфата во фруктозофосфат, который происходит под действием фермента изомеразы (рис.4). Рокировка типа глюкоза–фруктоза делает доступным для фосфорилирования еще один гидроксил сахара (т.к. взаимодействовать с АТФ могут только краевые гидроксилы):
Рис. 4. Взаимодействие глюкозо-6-фосфата и фермента изомеразы
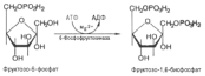
После второго фосфорилирования уже под действием другого фермента – фосфорфруктокиназы – получается в итоге фруктозо-1,6-дифосфат (C6H14O12P2 ) (рис.5):
Рис. 5. Взаимодействие фруктозо-6-фосфата и 6-фосфоруктокиназы
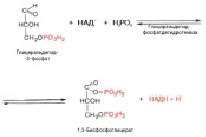
Фруктозо-1,6-дифосфат распадается на две части. Получается дигидроксиацетонфосфат ( C3H7O6P ) и глицеральдегид-3-фосфат ( C3H7O6P) (рис. 6).
Рис. 6. Распад Фруктозо-1,6-дифосфата
Клетке нужен только второй продукт, и она с помощью фермента изомеразы превращает первый фосфат во второй (чтобы не было отходов производства) (рис. 7).
Рис. 7. Превращение диоксиацетон-фосфата в глицеральдегид-3-фосфат
На данной стадии в реакцию вступают два соединения: глутатион – соединение, несущее меркаптогруппу SН и никотинамидаденинуклеотид (НАД). НАД легко присоединяет водород: НАД-Н2.
Далее развивается процесс, мало изученный в деталях, но описать его можно пока следующим образом. Под действием НАД и его восстановленной формы, фермента дегидрогеназы и фосфорной кислоты, глицеральдегид-3-фосфат превращается в смешанный ангидрид 3-фосфоглицериновой и фосфорной кислот (рис. 8).
Рис. 8. Превращение глицеральдегид-3-фосфата в смешанный ангидрид 3-фосфоглицериновой и фосфорной кислот
Всё это время энергия только поглощалась, так как АТФ переходил в АДФ. Теперь в реакции будет вступать АДФ, а в продуктах появится АТФ, и энергия будет выделяться. Так, под действием АДФ и фермента фосфоглицераткиназы образуется 3-фосфоглицериновая кислота (рис. 9).
Рис. 9. Образование 3-фосфоглицерата
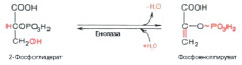
В ней фермент фосфоглицеромутаза вызывает «рокировку» фосфатной группы в положение 2 (рис. 10).
Рис. 10. Превращение 3-фосфоглицерата в 2-фосфоглицерат
На полученный продукт воздействует фермент енолаза и АДФ – получается пировиноградная кислота (рис. 11, 12).
Рис. 11. Дегидратация 2-фосфоглицерата
Рис. 12. Перенос фосфорильной группы с фосфоенолпирувата на АДФ. Образование пирувата
Процесс превращения глюкозы в пировиноградную кислоту в клетке называется гликолизом [3]. В результате гликолиза клетка получает из одной молекулы глюкозы восемь молекул АТФ и две молекулы пировиноградной кислоты. Превращение глюкозы в пировиноградную кислоту является первой стадией, общей для нескольких процессов. То же самое происходит под действием дрожжей на раствор сахара. Но реакция не закачивается получением пировиноградной кислоты. От этой кислоты отщепляется (под действием фермента декарбоксилазы) молекула диоксида углерода и образуется уксусный альдегид, который, в свою очередь, атакуется ферментом дегидрогеназой и НАД-Н2. В результате при отсутствии кислорода получается этиловый спирт.
На самом деле уравнение этого сложного процесса выглядит довольно просто:
С6Н12О6 à 2С2Н5ОН + 2СО2
Это и есть процесс брожения. В мышцах НАД-Н2 восстанавливает пировиноградную кислоту в молочную. Это происходит при большой нагрузке, когда кровь не успевает подводить кислород в нужном количестве. Поэтому у спортсменов, пробежавших дистанцию, резко увеличивается в крови количество молочной кислоты [4].
Ферменты
Ферменты – это биологические катализаторы, имеющие белковую природу, помогающие ускорить химические реакции как в живых организмах, так и вне их. Ферменты обладают высокой каталитической активностью. К примеру, чтобы расщепить молекулу полиуглевода (крахмал, целлюлозу) или какой – либо белок на составные части, их нужно несколько часов кипятить с крепкими растворами щелочей либо кислот. А ферменты пищеварительных соков (пепсин, протеаза, амилаза) способны гидролизовать эти вещества буквально за несколько секунд при температуре 37 °С. Помимо этого, ферменты обладают избирательностью своего действия в отношении структуры субстрата, условий проведения реакции и её типа (фермент превращает только данный тип субстратов в определенных реакциях и условиях). Ферменты катализируют огромное количество реакций, протекающих в живой клетке при размножении, дыхании, обмене веществ и т.д. [5].
Заключение
В современном понимании биохимическое расщепление углеводов – это метаболический процесс, при котором регенерируется АТФ, а продукты расщепления органического субстрата могут служить одновременно и донорами, и акцепторами водорода. Огромную роль в биохимических процессах играют микроорганизмы, ферменты и катализаторы. Считается, что анаэробный гликолиз (расщепление углеводов) был первым источником энергии для общих предков всех живых организмов до того, как концентрация кислорода в атмосфере стала достаточно высокой, и поэтому эта форма генерации энергии в клетках – более древняя. За очень редкими исключениями она существует и у всех ныне живущих клеток.
В настоящее время ученые считают, что все реакции биохимического расщепления углеводов на начальной стадии имеют общую схему вплоть до образования пировиноградной кислоты. Затем, в зависимости от условий и качества ферментов, из пировиноградной кислоты образуются конечные продукты реакции: спирты, кислоты (уксусная, лимонная, молочная, яблочная, масляная и т.д.), альдегиды, углекислый газ, водород, вода и пр.
Изучение биохимических реакций расщепления углеводов в организме человека и анализ использованных источников позволили сделать следующие выводы:
1. В общем виде схему механизма расщепления углеводов можно представить следующим образом: сложный углевод (дисахарид, полисахарид) à глюкоза à эфиры фосфорных кислот à глицериновый альдегид à глицериновая кислота à пировиноградная кислота à далее возможны любые упомянутые выше направления.
2. Биохимические реакции углеводов лежат в основе жизнедеятельности клеток живых организмов, в том числе и человека.
3. Биохимические процессы расщепления углеводов, которые изображаются простыми, на первый взгляд, уравнениями начальных и конечных продуктов, на самом деле представляют собой сложные и многоступенчатые процессы.
4. Для осуществления биохимических процессов необходимы ферменты и катализаторы, которые ускоряют реакции расщепления углеводов в тысячи раз.
Изучая сложнейшие процессы, происходящие в живой клетке, ученые задумываются: а нельзя ли, научившись у природы, провести в колбах и ретортах искусственные химические процессы, копирующие биохимические реакции? Начатые по инициативе академика Н.Н. Семенова, такие исследования в области «химической бионики» успешно ведутся в России и во всем мире [6].
Библиографическая ссылка
Наумович Ю.И., Тлехусеж М.А. БИОХИМИЧЕСКИЕ РЕАКЦИИ РАСЩЕПЛЕНИЯ УГЛЕВОДОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА // Научное обозрение. Педагогические науки. – 2019. – № 4-4.
– С. 80-85;
URL: https://science-pedagogy.ru/ru/article/view?id=2149 (дата обращения: 11.03.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Рассматривая обмен веществ в условиях нормального функционирования организма, следует остановиться на безусловно взаимосвязанных, но в то же время достаточно специфичных составляющих метаболизма, а именно на углеводном, белковом, липидном и водно-электролитном обмене.
Очевидно, что основная роль углеводов в метаболизме определяется их энергетической функцией. Именно глюкоза крови вследствие наличия простого и быстрого пути гликолитической диссимиляции и последующего окисления в цикле трикарбоновых кислот, а также возможности максимально быстрого извлечения ее из депо гликогена, обеспечивающей экстренную мобилизацию энергетических ресурсов, является наиболее востребованным источником энергии в организме. Использование циркулирующей в плазме глюкозы разными органами неодинаково: мозг задерживает 12% глюкозы, кишечник— 9%, мышцы — 7%, почки — 5%. При этом уровень глюкозы плазмы крови является одной из важнейших гомеостатических констант организма, составляя 3, 3—5, 5 ммоль/л. Как известно снижение уровня глюкозы ниже допустимого передела имеет своим незамедлительным следствием дискоординацию деятельности ЦНС, проявляющуюся соответствующей клинической симптоматикой: головной мозг содержит небольшие резервы углеводов и нуждается в постоянном поступлении глюкозы, поскольку энергетические расходы мозга покрываются исключительно за счет углеводов. Глюкоза в тканях мозга преимущественно окисляется, а небольшая часть ее превращается в молочную кислоту.
Единственной формой углеводов, которая может всасываться в кишечнике, являются моносахара. Они всасываются главным образом в тонкой кишке, током крови переносятся в печень и к тканям. Основная часть поступающей с пищей глюкозы (около 70%) окисляется в тканях до воды и углекислого газа, около 25—28% пищевой глюкозы превращается в жир и только 2—5% ее синтезируется в гликоген. Гликоген печени представляет собой основной резерв углеводов в организме, достигая по своей массе у взрослого человека 150—200 г. Синтез гликогена происходит достаточно быстро, что, наряду с быстрой мобилизацией гликогена и поступлением глюкозы в кровь в процессе гликогенолиза, является одним из механизмов поддержания гликемии в константных пределах. Помимо печени в качестве депо гликогена выступают также мышцы. Однако запас гликогена в мышечной массе по отношению к всему гликогену организма составляет всего 1 — 2%. В мышцах под влиянием фермента фосфорилазы, которая активируется в начале мышечного сокращения, происходит усиленное расщепление гликогена, являющегося одним из источников энергии мышечного сокращения. При распаде мышечного гликогена процесс идет до образования пировиноградной и молочной кислот. Этот процесс называют гликолизом. В фазе отдыха из молочной кислоты в мышечной ткани происходит ресинтез гликогена.
При полном отсутствии углеводов в пище они образуются в организме из продуктов трансформации жиров и белков. В печени возможно новообразование углеводов как из собственных продуктов их распада (пировиноградной или молочной кислоты), так и из продуктов диссимиляции жиров и белков (кетокислот и аминокислот), что обозначается как глюконеогенез. В результате трансформации аминокислот образуется пировиноградная кислота, при окислении жирных кислот — ацетилкоэнзим А, который может превращаться в пировиноградную кислоту — предшественник глюкозы. Это наиболее важный общий путь биосинтеза углеводов. Между двумя основными источниками энергии — углеводами и жирами — существует тесная физиологическая взаимосвязь. Повышение содержания глюкозы в крови увеличивает биосинтез триглицеридов и уменьшает распад жиров в жировой ткани. Поступление в кровь свободных жирных кислот уменьшается. В случае возникновения гипогликемии процесс синтеза триглицеридов тормозится, ускоряется распад жиров и в кровь в большом количестве поступают свободные жирные кислоты. Гликогенез, гликогенолиз и глюконеогенез являются тесно взаимосвязанными процессами, обеспечивающими оптимальный уровень глюкозы крови сообразно степени функционального напряжения организма.
Центральным звеном регуляции углеводного и других видов обмена и местом формирования сигналов, управляющих уровнем глюкозы, является гипоталамус. Отсюда регулирующие влияния реализуются вегетативными нервами и гуморальным путем, включающим эндокринные железы. Единственным гормоном, снижающим уровень гликемии, является инсулин — гормон, вырабатываемый β-клетками островков Ланхгерганса. Снижение гликемии происходит за счет усиления инсулином синтеза гликогена в печени и мышцах и повышения потребления глюкозы тканями организма. Увеличение уровня глюкозы в крови возникает при действии нескольких гормонов. Это глюкагон, продуцируемый α-клетками островков Ланхгерганса, адреналин — гормон мозгового слоя надпочечников, глюкокортикоиды — гормоны коркового слоя надпочечников, соматотропный гормон гипофиза, тироксин и трийодтиронин — гормоны щитовидной железы. Данные гормоны в связи с однонаправленностью их влияния на углеводный обмен и функциональным антагонизмом по отношению к эффектам инсулина часто объединяют понятием «контринсулярные гормоны».
Таким образом биологическая роль углеводов для организма человека определяется прежде всего их энергетической функцией. Обладая энергетической ценностью в 16, 7 кДж (4, 0 ккал) на 1 грамм вещества, углеводы являются основным источником энергии для всех клеток организма, при этом выполняя еще пластическую и опорную функции. Суточная потребность взрослого человека в углеводах составляет около 500 г.
Характерной особенностью белкового обмена является его чрезвычайная разветвленность. Достаточно указать, что в обмене 20 аминокислот, входящих в состав белковых молекул, в организме животных участвуют сотни промежуточных метаболитов, тесно связанных с обменом углеводов и липидов. Число ферментов, катализирующих химические реакции азотистого обмена, также исчисляется сотнями. Собственно белки (протеины и протеиды), высокомолекулярные соединения, построенные из мономеров — аминокислот, занимают ведущее место среди органических элементов организма, составляя более 50 % сухой массы клетки. Как известно, белки в организме выполняют ряд важнейших биологических функций, а именно:
— пластическая (структурная) функция заключается в том, что белки являются главной составной частью всех клеточных и межклеточных структур тканей;
— ферментная (каталитическая, энзимная) функция состоит в обеспечении всех химических реакций, протекающих в ходе обмена веществ в организме (дыхание, пищеварение, выделение), деятельностью ферментов, являющихся по своей структуре белками;
— транспортная функция белков заключается в их способности к соединению с целым рядом метаболитов и переносе последних в связанном состоянии в межтканевой жидкости и плазме крови к области их утилизации;
— защитная функция белков проявляется реализацией иммунного ответа образованием иммуноглобулинов (антител) и системы комплемента при поступлении в организм чужеродного белка, а также способностью к непосредственному связыванию экзогенных токсинов; белки системы гемостаза обеспечивают свертывание крови и остановку кровотечения при повреждении кровеносных сосудов;
— регуляторная функция, направленная на сохранение гомеостаза с поддержанием биологических констатнт организма, реализуется буферными свойствами молекулы протеинов, белковой структурой клеточных рецепторов, активируемых в свою очередь регуляторными полипептидами и гормонами, также имеющими белковую структуру;
— двигательная функция, обеспечивается взаимодействием сократительных белков мышечной ткани актина и миозина;
— энергетическая роль белков состоит в обеспечении организма энергией, образующейся при диссимиляции белковых молекул; при окислении 1 г белка в среднем освобождается энергия, равная 16, 7 кДж (4, 0 ккал).
В организме постоянно происходит распад и синтез белков. Единственным источником синтеза нового белка являются белки пищи. В пищеварительном тракте белки ферментативно расщепляются ферментами до аминокислот и абсорбируются в тонкой кишке. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30 — 50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) — активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь. Перенос через щеточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Na+-зависимых механизмов симпорта, подобно переносу глюкозы.
Из аминокислот и простейших пептидов клетки тканей синтезируют собственный белок, который характерен только для данного организма. Белки не могут быть заменены другими пищевыми веществами, так как их синтез в организме возможен только из аминокислот. Вместе с тем белок может замещать собой жиры и углеводы, то есть использоваться для синтеза этих соединений. В тканях постоянно протекают процессы распада белка с последующим выделением из организма неиспользованных продуктов белкового обмена и параллельно с этим — синтез белков. Катаболизм большинства аминокислот начинается с отщепления α-аминогруппы результате реакций трансаминирования и дезаминирования. Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных — глутамат, аланин, аспартат и соответствующие им кетокислоты — α—кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат. Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование — заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование — первая стадия дезаминирования большинства аминокислот, то есть начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется. В свою очередь дезаминирование аминокислот — реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение — мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования.
При катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются а-кетоглутарат и аммиак. При необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты. В случае использования белков в качестве источника энергии большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до углекислого газа и воды. Прежде, чем эти вещества вовлекаются в заключительный этап катаболизма, их углеродный скелет превращается в двухуглеродный фрагмент в форме ацетил-КоА. Именно в этой форме большая часть молекул аминокислот включается в цикл лимонной кислоты.
Белки организма находятся в динамическом состоянии: из-за непрерывного процесса их разрушения и образования происходит обновление белков, скорость которого неодинакова для различных тканей. С наибольшей скоростью обновляются белки печени, слизистой оболочки кишечника, а также других внутренних органов и плазмы крови. Медленнее обновляются белки, входящие в состав клеток мозга, сердца, половых желез и еще медленнее — белки мышц, кожи и особенно опорных тканей (сухожилий, костей и хрящей). Важнейшими азотистыми продуктами распада белков, которые выделяются с мочой и потом, являются мочевина, мочевая кислота и аммиак. Преобладание в организме в данный момент времени синтеза или распада белка отражается понятием азотистого баланса — разностью между количеством азота, содержащегося в пище человека, и его уровнем в выделениях. Азотистым равновесием называют состояние, при котором количество выведенного азота равно количеству поступившего в организм. Азотистое равновесие наблюдается у здорового взрослого человека, если минимальное количество белков в пище соответствует 30-50 г/сут. Оптимальное количество поступления белка с пищей при средней физической нагрузке составляет около 100-120 г/сут. При положительном азотистом балансе количество азота в выделениях организма значительно меньше, чем содержание его в пище, то есть наблюдается задержка азота в организме. Положительный азотистый баланс отмечается у детей в связи с усиленным ростом, у женщин во время беременности, при усиленной спортивной тренировке, приводящей к увеличению мышечной массы, при заживлении обширных ран и при разрешении патологического процесса, связанного с выраженными системными нарушениями. Отрицательный азотистый баланс отмечается тогда, когда количество выделяющегося азота больше содержания его в пище, поступающей в организм. Отрицательный азотистый баланс наблюдается при белковом голодании, лихорадочных состояниях, нарушениях нейроэндокринной регуляции белкового обмена.
Некоторые аминокислоты не могут синтезироваться в организме человека и должны обязательно поступать с пищей в готовом виде. Эти аминокислоты принято называть незаменимыми, или эссенциальными. Экспериментально установлено, что из 20 входящих в состав белков аминокислот 12 синтезируются в организме (заменимые аминокислоты), а 8 не синтезируются (незаменимые аминокислоты) . К незаменимым аминоксилотам относятся: валин, метионин, треонин, лейцин, изолейцин, фенилаланин, триптофан и лизин. Две аминокислоты — аргинин и гистидин — у взрослых образуются в достаточных количествах, однако детям для нормального роста организма необходимо дополнительное поступление этих аминокислот с пищей. Поэтому их называют частично заменимыми. Две другие аминокислоты — тирозин и цистеин — условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина. Белки, содержащие весь необходимый набор аминокислот, называют биологически полноценными (табл. 1. 1. ). Наиболее высока биологическая ценность белков молока, яиц, рыбы, мяса. Биологически неполноценными называют белки, в составе которых отсутствует хотя бы одна аминокислота, которая не может быть синтезирована в организме. Неполноценными белками являются белки кукурузы, пшеницы, ячменя.
Таблица 1. 1. Аминокислоты, входящие в состав белков человека.
|
1. Незаменимые Валин Лейцин Изолейцин Треонин Метионин Фенилаланин Триптофан Лизин |
2. Частично заменимые Гистидин Аргинин 3. Условно заменимые Цистеин Тирозин |
4. Заменимые Аланин Аспарагиновая кислота Аспарагин Глутаминовая кислота Глутамин Пролин Глицин Серин |
Жиры (липиды) по своей химической структуре представляют собой триглицериды — сложные эфиры глицерина и жирных кислот (табл. 1. 2). Изначально эти соединения были объединены в одну химическую группу по общему признаку растворимости: они не растворяются в воде, но растворяются в органических растворителях (эфир, спирт, бензол). Жиры делят на простые липиды (нейтральные жиры, воски), сложные липиды (фосфолипиды, гликолипиды, сульфолипиды) и стероиды (холестерин). Основная масса липидов представлена в организме человека нейтральными жирами — триглицеридами олеиновой, пальмитиновой, стеариновой, линолевой и линоленовой жирных кислот.
Таблица 1. 2. Классификация липидов организма человека.
|
1. Гликолипиды. |
Содержат углеводный компонент. |
|
2. Жиры. |
Эфиры глицерина и высших жирных кислот. Химическое название — ацилглицерины. Преобладают триацилглицерины. |
|
3. Минорные липиды. |
Свободные жирные кислоты, жирорастворимые витамины, биологически активные вещества липидной природы — простагландины и др. |
|
4. Стероиды. |
В основе строения — полициклическая структура циклопентанпергидрофенантрен-стеран. |
|
А. Стерины (спирты). |
Наиболее важен холестерин. |
|
В. Стериды. |
Эфиры стеринов и высших жирных кислот. Наиболее распространены эфиры холестерина. |
|
5. Фосфолипипы. |
Отличительная особенность — остаток фосфорной кислоты в составе молекулы. |
Жиры растительного и животного происхождения имеют различный состав жирных кислот, определяющий их физические свойства и физиолого-биохимические эффекты. Жирные кислоты подразделяются на два основных класса — насыщенные и ненасыщенные. Насыщенность жира определяется количеством атомов водорода, которое содержит каждая жирная кислота (или, иначе, количеством двойных связей С=С). Жирные кислоты со средней длиной цепи (С8-С14) способны усваиваться в пищеварительном тракте без участия желчных кислот и панкреатической липазы, не депонируются в печени и подвергаются β-окислению. Животные жиры могут содержать насыщенные жирные кислоты с длиной цепи до двадцати и более атомов углерода, они имеют твердую консистенцию и высокую температуру плавления. Как известно высокое потребление насыщенных жирных кислот является важнейшим фактором риска развития диабета, ожирения, атеросклероза. К мононенасыщенным жирным кислотам относятся миристолеиновая и пальмитолеиновая кислоты (жиры рыб и морских млекопитающих), олеиновая (оливковое, сафлоровое, кунжутное, рапсовое масла). Мононенасыщенные жирные кислоты помимо их поступления с пищей в организме синтезируются из насыщенных жирных кислот и частично из углеводов. Жирные кислоты с двумя и более двойными связями между углеродными атомами называются полиненасыщенными – ПНЖК. Особое значение для организма человека имеют такие ПНЖК как линолевая, линоленовая, являющиеся структурными элементами клеточных мембран и обеспечивающие нормальное развитие и адаптацию организма человека к неблагоприятным факторам окружающей среды. ПНЖК являются предшественниками образующихся из них биорегуляторов – эйкозаноидов. Двумя основными группами ПНЖК являются кислоты семейств ω-6 и ω-3. Жирные кислоты ω-6 содержатся практически во всех растительных маслах и орехах. ω-3 жирные кислоты также содержатся в ряде масел (льняном, из семян крестоцветных, соевом). Основным пищевым источником ω-3 жирных кислот являются жирные сорта рыб и некоторые морепродукты. Из ПНЖК ω — 6 особое место занимает линолевая кислота, которая является предшественником наиболее физиологически активной кислоты этого семейства — арахидоновой. Арахидоновая кислота является преобладающим представителем ПНЖК в организме человека и служит субстратом для синтеза простагландинов и лейкотриенов.
Источниками жира в организме являются экзогенный жир, поступающий с пищей, и эндогенный жир, синтезируемый в печени из углеводов. Жир, всасывающийся из кишечника, поступает преимущественно в лимфу и в меньшем количестве — непосредственно в кровь. Большая часть жиров в организме находится в жировой ткани, меньшая часть входит в состав клеточных структур. В жировой ткани жир, находящийся в клетке в виде включений, легко выявляется при микроскопическом и гистохимическом исследованиях. Жировые вакуоли в клетках — это резервный жир, используемый для обеспечения прежде всего энергетических потребностей клетки. Больше всего запасного жира содержится в жировой ткани, а также в некоторых органах, например в печени и мышцах. Количество запасного жира зависит от характера питания, количества пищи, конституциональных особенностей, а также от величины расхода энергии при мышечной деятельности; количество же протоплазматического жира является устойчивым и постоянным. В жировой ткани нейтральный жир депонируется виде триглицеридов. Сложные липиды — фосфолипиды и гликолипиды — входят в состав всех клеток, но в большей степени в состав клеток нервной ткани. Общее количество жира в организме человека колеблется в широких пределах и в среднем составляет 10—20% от массы тела, а в случае патологического ожирения может достигать 50%. Суточная потребность взрослого человека в нейтральном жире составляет 70—80 г. У человека состав и свойства жира относительно постоянны. При употреблении пищи, содержащей даже небольшое количество жира, в теле человека жир все же откладывается в депо. При этом эндогенный жир имеет некоторые видовые особенности, однако видовая специфичность жиров выражена несравнимо меньше, чем видовая специфичность белков.
Основная биологическая роль жиров — обеспечение пластического и энергетического обмена в организме. Пластическая роль липидов состоит в том, что они входят в состав клеточных мембран, в значительной мере определяя их свойства. Фосфатиды и стерины входят в состав клеточных структур, в частности клеточных мембран, а также ядерного вещества и цитоплазмы. Исключительно важное физиологическое значение имеют стерины, в частности холестерин. Это вещество входит в состав клеточных мембран, является источником образования желчных кислот, а также гормонов коры надпочечников и половых желез, витамина D. Печень является практически единственным органом, поддерживающим уровень фосфолипидов в крови и местом синтеза эндогенного холестерина. В плазме крови холестерин находится в составе липопротеидных комплексов, с помощью которых и осуществляется его транспорт. У взрослых людей 67—70% холестерина плазмы крови находится в составе липопротеидов низкой плотности (ЛПНП), 9—10% — в составе липопротеидов очень низкой плотности (ЛПОНП) и 20—24% — в составе липопротеидов высокой плотности (ЛПВП). Давно доказано, что именно липопротеиды определяют уровень холестерина и динамику его обмена.
Энергетическая роль жиров определяется их максимальной среди всех биологических молекул энергоемкостью, более чем в два раза превышающую таковую углеводов или белков. При окислении 1 г жира выделяется 37, 7 кДж (9, 0 ккал) энергии. В отличие от углеводов жиры составляют энергетический резерв организма. Преимущество жира в качестве энергетического резерва заключается в том, что жиры являются более восстановленными веществами по сравнению с углеводами (в молекулах углеводов при каждом углеродном атоме есть кислород — группы -CHOH-; у жира имеются длинные углеводородные радикалы, в которых преобладают группы -CH2- — в них нет кислорода). От жира можно отнять больше водорода, который затем проходит по цепи митохондриального окисления с образованием АТФ. Еще одним преимуществом жира как энергетического резерва, в отличие от углеводов, является гидрофобность — он не связан с водой. Это обеспечивает компактность жировых запасов — они хранятся в безводной форме, занимая малый объем. В среднем, у человека запас чистых триацилглицеринов составляет примерно 13 кг. Этих запасов могло бы хватить на 40 дней голодания в условиях умеренной физической нагрузки. Для сравнения: общие запасы гликогена в организме — примерно 400 г; при голодании этого количества не хватает даже на одни сутки.
Катаболизм жира включает в себя три этапа: 1) гидролиз жира до глицерина и жирных кислот (липолиз) ; 2) трансформация глицерина с последующим вступлением продуктов в гексозобифосфатный путь, а также окисление жирных кислот до ацетил-КоА; 3) вступление вышеуказанных продуктов в цикл трикарбоновых кислот. Кроме указанных этапов к катаболизму жиров относят также окисление кетоновых тел и перекисное окисление липидов. Обмен полученного в результате липолиза глицерина может осуществляться несколькими путями. Значительная часть образовавшегося при гидролизе липидов глицерина используется для ресинтеза триглицеридов. Второй путь обмена глицерина — включение продукта его окисления в гликолиз или в глюконеогенез. Окисление жирных кислот осуществляется различными путями, наиболее значимым из них является β-окисление. В ходе β-окисления последовательно происходит активация жирной кислоты на мембране митохондрии и ее связывание с молекулой карнитина, прохождение комплекса нв внутреннюю поверхность мембраны митохондрии, внутримитохондриальное окисление жирной кислоты с образованием ацетил-КоА и АТФ.
Одним из продуктов катаболизма жиров, имеющем важное значения для метаболизма в целом являются кетоновые тела. Кетоновые тела — группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. К кетоновым телам относят β-оксимасляную и ацетоуксусную кислоты и ацетон, имеющие сходное строение и способные к взаимопревращениям. Главным путем синтеза кетоновых тел, происходящего в основном в печени, считается реакция конденсации между двумя молекулами ацетил-КоА, образовавшегося при β-окислении жирных кислот или при окислительном декарбоксилировании пирувата (пировиноградной кислоты) в процессе обмена глюкозы и ряда аминокислот. Данный путь синтеза кетоновых тел более других зависит от характера питания и в большей степени страдает при патологических нарушениях обмена веществ. Из печени кетоновые тела поступают в кровь и с нею во все остальные органы и ткани, где они включаются в универсальный энергообразующий цикл — цикл трикарбоновых кислот, в котором окисляются до углекислоты и воды. Кетоновые тела используются также для синтеза холестерина, высших жирных кислот, фосфолипидов и заменимых аминокислот. При голодании, однообразном безуглеводистом питании и при недостаточной секреции инсулина использование ацетил-КоА в цикле трикарбоновых кислот подавляется, так как все метаболически доступные ресурсы организма превращаются в глюкозу крови. В этих условиях увеличивается синтез кетоновых тел. Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики «топлива» для мышц, почек и действуют, возможно, как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала.
Процесс образования, отложения и мобилизации из депо жира регулируется нервной и эндокринной системами, а также тканевыми механизмами и тесно связаны с углеводным обменом. Так, повышение концентрации глюкозы в крови уменьшает распад триглицеридов и активизирует их синтез. Понижение концентрации глюкозы в крови, наоборот, тормозит синтез триглицеридов и усиливает их расщепление. Таким образом, взаимосвязь жирового и углеводного обменов направлена на обеспечение энергетических потребностей организма. При избытке углеводов в пище триглицериды депонируются в жировой ткани, при нехватке углеводов происходит расщепление триглицеридов с образованием неэтерифицнрованных жирных кислот, служащих источником энергии. В обмене жиров одна из важнейших ролей принадлежит печени. Печень — основной орган, в котором происходит образование кетоновых тел (бета-оксимасляная, ацетоуксусная кислоты, ацетон), используемых как альтернативный глюкозе источник энергии.
При обильном углеводном питании и отсутствии жиров в пище синтез жира в организме может происходить из углеводов. Источником углерода для синтеза жирных кислот служит ацетил-КоА, образующийся при распаде глюкозы в абсорбтивном периоде. В норме у человека 25—30% углеводов пищи превращается в жиры. Превращение белка в жирные кислоты происходит, вероятнее всего, также через образование углеводов. С другой стороны и нейтральные жиры в энергетическом отношении могут быть заменены углеводами. Тем не менее жиры необходимы для нормальной жизнедеятельности. Известно, что длительное исключение жиров из пищевого рациона может явиться причиной возникновения целого ряда тяжелых метаболических нарушений. Отчасти это связано с отсутствием поступления в организм жирорастворимых витаминов (A, D, E, K). Но основная причина метаболических нарушений кроется в возникновении в организме дефицита незаменимых жирных кислот. Некоторые ненасыщенные жирные кислоты (с числом двойных связей более 1), например линолевая, линоленовая и арахидоновая, в организме человека и некоторых животных не образуются из других жирных кислот и поэтому являются незаменимыми. Особенно остро реагирует организм на дефицит незаменимой линолевой кислоты СН3- (СН2) 4 — СН = СН — СН2 — СН = СН — (СН2) 7 — СООН. Возможно это связано с тем, что эта ненасыщенная жирная кислота в организме человека служит предшественником арахидоновой кислоты, которая в свою очередь необходима для синтеза универсальных биорегуляторов — простагландинов. Основными пищевыми источниками полиненасыщенных жирных кислот, в том числе линолевой, являются растительные масла.
Как указывалось выше метаболизм жиров контролируется нервной и эндокринной системами. Мобилизация жиров из депо происходит под влиянием гормонов мозгового слоя надпочечников — адреналина и норадреналина. Соматотропный гормон гипофиза также обладает жиромобилизирующим действием. Аналогично действует тироксин — гормон щитовидной железы. Тормозят мобилизацию жира глюкокортикоиды — гормоны коркового слоя надпочечника, вероятно, вследствие того, что они несколько повышают уровень глюкозы в крови. Действие инсулина связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации. Имеются данные, свидетельствующие о возможности прямых нервных влияний на обмен жиров. Симпатические влияния тормозят синтез триглицеридов и усиливают их распад. Парасимпатические влияния, напротив, способствуют отложению жира в депо.
31 мая 2016 г.
«Поддержание гомеостаза глюкозы — жизненно важная функция организма» — эта фраза известна нам со студенческой скамьи, хотя вряд ли когда-нибудь мы задумывались, почему именно это жизненно важно. На самом деле это действительно так, поскольку головной мозг в качестве энергосубстрата может использовать только глюкозу, в отличие от других тканей организма, способных получать энергию как из жиров, так и из белков. Это объясняет жесткие рамки нормального уровня гликемии натощак (от 3,3 до 5,5 ммоль/л в капиллярной крови, но не выше 6,1 ммоль/л в плазме и не более 11,1 ммоль/л как в цельной, так и в венозной крови на пике всасывания после приема пищи). Действительно, при снижении гликемии ниже 3,0 ммоль/л мы видим развитие отека мозга, равно как и при повышении гликемии выше 15–20 ммоль/л. Именно этим, по-видимому, обусловлено то, что не менее 60% калорийности пищи составляют углеводы, поступающие в организм в виде полисахаридов, ди- и моносахаров. Поступившие в желудочно-кишечный тракт полисахариды расщепляются с помощью кишечных глюкозидаз до моносахаров и поглощаются ворсинками тонкого кишечника, после чего они должны попасть в кровь. Для этого моносахаридам необходимо преодолеть, как минимум, апикальную мембрану энтероцита и его базальную мембрану.
Из просвета кишечника глюкоза и галактоза всасываются по механизму вторичного активного транспорта, при котором энергия при переносе сахаров тратится не непосредственно на транспорт молекулы, а на создание градиента концентрации другого вещества. В случае моносахаридов таким веществом является Na+. Поглощение моносахаридов в основном опосредуется котранспортером Na+-D-глюкозы (натрий-глюкозный котранспортер 1 типа — SGLT-1 [1, 2]) и факультативными переносчиками глюкозы, глюкозными транспортерами (GLUT), — GLUT-2 и GLUT-5. SGLT-1 и GLUT-2 имеют отношение к абсорбции D-глюкозы и D-галактозы, в то время как GLUT-5 имеет отношение к абсорбции D-фруктозы [3, 4].
После выхода в кровь, оттекающую от кишечника, моносахариды движутся по сосудам воротной системы в печень, где частично задерживаются, или выходят в большой круг кровообращения, проникая затем в клетки органов. Из крови внутрь клеток глюкоза попадает посредством облегченной диффузии по градиенту концентрации с участием белков—переносчиков. Всего выделяют 12 типов транспортеров глюкозы, отличающихся локализацией, сродством к глюкозе и способностью к регулированию
Глюкозный транспортер GLUT-1 есть на мембранах всех клеток, он ответствен за базовый транспорт глюкозы в клетки для поддержания их жизнеспособности.
Особенностями GLUT-2 являются способность пропускать глюкозу в двух направлениях и низкое сродство к глюкозе. Переносчик представлен в первую очередь в гепатоцитах, которые после еды захватывают глюкозу, а в постабсорбтивный период и при голодании поставляют ее в кровь. Этот транспортер присутствует также на базолатеральной мембране эпителия кишечника и почечных канальцев. Находясь на мембранах β-клеток островков Лангерганса, GLUT-2 переносит глюкозу внутрь при увеличении ее концентрации свыше 5,5 ммоль/л и выпускает из клетки наружу при снижении концентрации. Благодаря этому осуществляется тонкая регуляция сигнала для увеличения секреции инсулина.
GLUT-3 представлен в нервной ткани и обладает высоким сродством к глюкозе, поэтому нейроны способны поглощать глюкозу даже при низких ее концентрациях в крови.
В скелетных мышцах, миокарде и жировой ткани находится GLUT-4, только этот транспортер чувствителен к влиянию инсулина. При действии инсулина на клетку он выходит на поверхность мембраны и переносит глюкозу внутрь. Указанные ткани получили название инсулинозависимых.
Некоторые ткани совершенно нечувствительны к действию инсулина, их называют инсулинонезависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты.
GLUТ-5 в первую очередь отвечает за облегченную диффузию фруктозы.
В печени задерживается до 60% поступивших в кровоток моносахаров, где они откладываются в виде печеночного гликогена благодаря активизации инсулином фермента гликогенсинтетазы либо используются для синтеза в печени энергии АТФ.
Поступившая внутрь клетки глюкоза окисляется там по гликолитическому пути — основному инсулинозависимому пути окисления глюкозы (рис. 1), поскольку активность ферментов, обеспечивающих гликолиз, зависит от наличия инсулина.
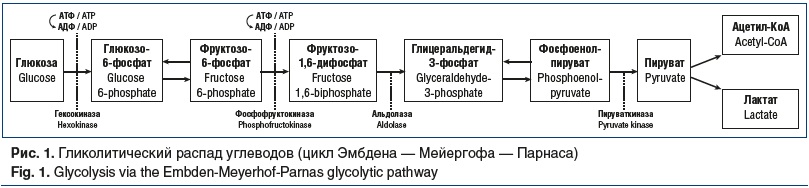
Большинство реакций гликолиза относятся к так называемым равновесным реакциям, т. е. могут протекать либо в направлении от глюкозы к пирувату, либо, наоборот, от пирувата к глюкозе. Различают анаэробный и аэробный гликолиз. Направление гликолиза по тому или иному пути зависит от степени дифференцировки клетки (имеет или не имеет она собственную «лабораторию» — митохондрии), а также от того, насколько в данный момент ткань обеспечена кислородом. Примером низкоорганизованных клеток являются эритроциты крови, примером активации анаэробного гликолиза в условиях гипоксии служит работающая мышца. В ходе анаэробного гликолиза пируват восстанавливается в молочную кислоту (лактат), что сопровождается образованием двух молекул АТФ. С точки зрения эффективности аэробный гликолиз, в ходе которого глюкоза расщепляется до конечных продуктов — воды (H2O) и углекислого газа (СО2), более выгоден, поскольку в этом случае клетка получает суммарно 36 молекул АТФ — энергию, необходимую для ее жизнеобеспечения. Вместе с тем аэробный гликолиз — более сложный процесс, протекающий в клеточной митохондрии, куда пируват поступает через стадию ацетил-КоА, образующегося из пирувата под действием специфического фермента — пируватдегидрогеназы, активность которой облигатно зависит от наличия инсулина. Ферментативный процесс, с помощью которого ткани утилизируют кислород и выделяют СО2 (т. е. осуществляют клеточное дыхание), называется циклом трикарбоновых кислот или циклом Кребса. Эта последовательность метаболических превращений представляет собой общий конечный путь аэробного окисления и образования СО2 из углеводов, жирных кислот и аминокислот в клеточной митохондрии [3, 4].
Высвобождающаяся в ходе окислительно-восстановительных реакций цикла Кребса энергия в виде Н+ улавливается никотинамид-дифосфонуклеотидом (НАДФ) и переносится на дыхательную цепь белков-цитохромов, обеспечивающих последовательный перенос энергии с НАДФ•Н на синтезируемую молекулу АТФ. Таким образом, благодаря действию инсулина, активизирующего ферменты гликолиза, любая клетка получает необходимую ей энергию АТФ при окислении глюкозы.
В то же время гликолиз не является единственным путем окисления глюкозы, зависящим от инсулина. Большое значение по сопряжению углеводного, липидного и белкового обмена имеет пентозный путь, в ходе которого образующийся глюкозо-6-фосфат может окисляться глюкозо-6-фосфатдегидрогеназой с образованием 6-фосфоглюконата. Последний может затем превращаться в пентозы: рибулезу, рибозу и ксилулозу, необходимые для синтеза ДНК и РНК. Таким образом, обеспечивая клетку субстратом, необходимым для синтеза ДНК и РНК, инсулин способствует синтезу белка даже в условиях белкового голодания. Другим, не менее важным эффектом пентозного цикла является генерация НАДФ•Н, необходимого в восстановительном синтезе жирных кислот и стеролов. Благодаря инсулину, активирующему оба пути окисления глюкозы, весь избыток поступающих в организм углеводов через стадию ацетил-КоА в печени превращается в молекулы жирной кислоты и покидает печень в виде триглицеридов в составе липопротеинов очень низкой плотности (рис. 2) [5].
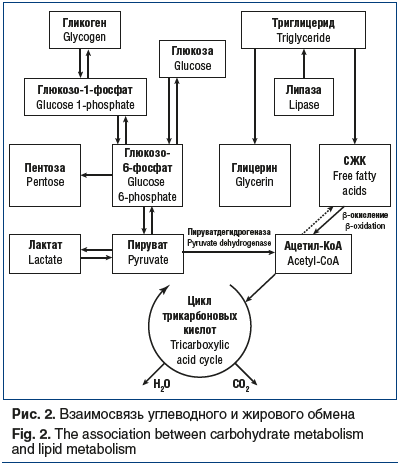
Следует отметить, что липотропный эффект действия инсулина в 10 раз превышает его глюкозотропный эффект, поэтому у людей, злоупотребляющих углеводами, всегда следует ожидать гиперинсулинемию, которая способствует избыточному отложению жира и прогрессированию ожирения. Само по себе накопление нейтральных жиров в жировой ткани, стимулируемое инсулином, является наиболее важной для организма формой сохранения эндогенной энергии, используемой при голодании. Это определяется большей энергетической емкостью жиров (9 ккал/г по сравнению с 4 ккал/г в углеводах и белках), а также их безводной природой, что обусловливает меньший удельный вес. Биохимиками было подсчитано, что если бы в организме человека калории откладывались только в виде углеводов (гликогена печени и мышц), то для накопления конкретного количества калорий ему потребовалась бы в 8 раз большая масса, чем в случае, когда это накопление происходит в виде жира. Таким образом, накапливать энергию в виде жира организму выгоднее всего, вот почему на долю жировой ткани приходится более 80% всей эндогенной энергии, и основная роль в этом процессе принадлежит инсулину, который не только стимулирует синтез жирных кислот и триглицеридов в печени и жировой ткани, но и препятствует липолизу, блокируя гормон-чувствительную липазу в жировой ткани [4].
Таким образом, оценивая роль инсулина в обмене веществ, можно заключить, что это 100% анаболический гормон, способствующий накоплению энергии как в виде молекул АТФ, так и в виде гликогена, нейтральных жиров и белков. Инсулин обеспечивает взаимосвязь углеводного, белкового и жирового обмена за счет регуляции основных путей окисления глюкозы.
Как поддерживается нормальный уровень гликемии в здоровом организме в условиях голодания? Рассмотрим поддержание гомеостаза глюкозы в условиях кратковременного голодания между приемами пищи. При снижении уровня гликемии происходит снижение уровня инсулина и стимулируется секреция глюкагона, обеспечивающего распад печеночного гликогена и высвобождение свободной глюкозы из печени за счет активации фосфорилазы, — этот процесс носит название гликогенолиза. Параллельно стимулируется секреция адреналина, также стимулирующего гликогенолиз в печени и процесс липолиза в абдоминальных адипоцитах, обеспечивающий высвобождение свободных жирных кислот (СЖК), которые используются мышечной тканью в качестве энергосубстрата. Вместе с тем адреналин как нейромедиатор мотивирует к приему пищи. В физиологических условиях период длительного голодания — это период ночного сна, когда перерыв между приемами пищи может достигать 10–12 ч. Как осуществляется энергообеспечение в этих условиях? Основную роль здесь играет гликогенолиз. Однако это не единственный механизм энергообеспечения при ночном голодании. При снижении уровня глюкозы в крови активизируются глюкорецепторы гипоталамуса, что стимулирует секрецию соматолиберина и кортиколиберина, активирующих, в свою очередь, выброс соматотропного гормона (СТГ) и адренокортикотропного гормона (АКТГ) аденогипофиза соответственно. Пик секреции СТГ, самого мощного жиромобилизующего фактора организма, приходится на середину ночи (между 2 и 3 часами). СТГ активизирует гормон-чувствительную липазу в жировой ткани, что способствует усилению липолиза и поступлению СЖК и глицерина в кровь. В условиях повышения концентрации СЖК в крови проницаемость клеточных мембран для глюкозы снижается, а для СЖК повышается, что приводит к переключению углеводного обмена на жировой. Процесс носит название цикла Рэндла и характеризуется активацией процесса β-окисления поступивших в ткани СЖК. Клетки начинают использовать в качестве энергосубстрата жирные кислоты, а образующаяся в ходе гликогенолиза глюкоза сберегается для энергообеспечения головного мозга. Процесс, при котором СЖК окисляются и обеспечивают продукцию АТФ, называется β-окислением жирных кислот, поскольку в нем происходит окисление углеродного атома, занимающего β-положение в углеродной цепочке молекулы жирной кислоты, с образованием β-кетокислоты, подвергающейся расщеплению с высвобождением ацетил-КоА, и укорочением молекулы на 2 углеродных атома. Жирноацильное производное КоА включается в цикл Кребса, а укороченная жирная кислота вновь подвергается β-окислению. Процесс повторяется до тех пор, пока вся молекула жирной кислоты полностью не окислится до ацетил-КоА с образованием H2O, СО2 и АТФ (см. рис. 2, 3).

Поскольку жирные кислоты содержат 12 углеродных атомов и больше, а молекула глюкозы — только 6, становится понятным, что при их окислении образуется тем больше энергии АТФ, чем длиннее углеродная цепочка молекулы жирной кислоты. Вот почему организму выгоднее, т. е. экономичнее, накапливать жиры, нежели гликоген.
Вместе с тем липолиз — не единственный дополнительный путь энергообеспечения организма в период ночного голодания. Как указывалось выше, снижение уровня глюкозы в крови сопровождается увеличением секреции другого гормона аденогипофиза — АКТГ, под действием которого к 5–6 часам утра, т. е. тогда, когда запасы печеночного гликогена истощаются, кора надпочечников начинает выделять глюкокортикоиды. Под действием глюкокортикоидов происходит мобилизация аминокислот из мышечного белка и их расщепление до стадии аланина, который при потере аминогруппы превращается в пируват с последующим его восстановлением до глюкозы в процессе глюконеогенеза. Другим субстратом для глюконеогенеза является лактат, накапливающийся в мышцах при мышечной работе. Под действием глюкокортикоидов он также поступает в печень, где окисляется до пирувата с последующим восстановлением до глюкозы. Высвобождающийся в процессе липолиза глицерин также включается в процесс глюконеогенеза при поступлении в печень (см. рис. 2). Подводя итог вышеизложенному, можно заключить, что поддержание нормогликемии натощак обусловлено печеночной продукцией глюкозы, образующейся за счет процессов гликогенолиза и глюконеогенеза.
Таким образом, гомеостаз глюкозы поддерживается действием инсулина, обеспечивающего поглощение глюкозы, ее окисление с образованием энергии АТФ и накопление энергосубстратов в виде печеночного и мышечного гликогена, нейтральных жиров в жировой ткани и тканевых белков, с одной стороны, и с другой — действием контринсулярных гормонов: глюкагона и катехоламинов, активизирующих распад гликогена в печени, СТГ и адреналина, стимулирующих липолиз и β-окисление жирных кислот, которые обеспечивают энергией ткани организма в условиях голодания, а также АКТГ и глюкокортикоидов, стимулирующих катаболизм белка и процесс глюконеогенеза.
Что происходит в организме при более длительном голодании и как долго может человек голодать? Ответ на этот далеко не праздный вопрос позволит нам приблизиться к пониманию механизмов развития основных клинических симптомов сахарного диабета.
Если продлить голодание хотя бы до суток, то уже через 24 ч, несмотря на то, что уровень гликемии натощак будет оставаться нормальным, соотношение вклада гликогенолиза и глюконеогенеза в уровень глюкозы натощак изменится диаметрально противоположно: если после ночного голодания в крови содержится 80% глюкозы, образовавшейся за счет гликогенолиза, и только 20% — за счет глюконеогенеза, то через 24 ч голодания, наоборот, 80% циркулирующей глюкозы будет образовано за счет глюконеогенеза, а 20% — за счет гликогенолиза, и запасы гликогена в печени будут стремительно падать, тогда как синтез его прекратится вследствие непоступления субстрата (глюкозы) [5, 6]. Роль основного энергосубстрата для синтеза АТФ будут выполнять СЖК, являющиеся продуктом активации липолиза. Чем дольше будет длиться голодание, тем больше СЖК будет поступать в печень, где далеко не все из них смогут подвергнуться β-окислению вследствие ограничения доступности КоА. Поскольку одновременно с СЖК в печень в эквимолярных соотношениях поступает и глицерин, создаются условия для синтеза в гепатоцитах de novo триглицеридов. Поэтому при длительном голодании часто увеличивается печень за счет жирового гепатоза. Вместе с тем при длительном голодании повышается потребность в карнитине, осуществляющем транспорт жирноацильного производного ацетил-КоА через митохондриальную мембрану в цикл Кребса. В результате повышения β-окисления СЖК скорость образования ацетил-КоА в печени может превышать скорость его окисления в цикле Кребса. В этих условиях ацетил-КоА используется для продукции ацетоуксусной, β-оксимасляной кислот и ацетона. Эти вещества носят название «кетоновых тел» и, выделяясь через слизистые кишечника, мочевыводящих путей и легких, обусловливают развитие «голодательного кетоза», проявляющегося в положительной реакции мочи на ацетон и появлении характерного фруктового запаха в выдыхаемом воздухе. Вместе с тем истинный метаболический ацидоз со сдвигом кислотно-щелочного равновесия при длительном голодании не развивается, поскольку кетоновые тела, в отличие от СЖК и аминокислот, легко проникают через гематоэнцефалический барьер и включаются в цикл Кребса в нервной ткани, обеспечивая мозг необходимым количеством АТФ. Это предохраняет организм от развития ацидоза и препятствует развитию отека мозга в условиях снижения уровня циркулирующей глюкозы, поскольку поступающие в мозг кетоновые тела позволяют поддерживать нормальное осмотическое давление в мозговой ткани.
Как долго может голодать здоровый человек? Это зависит от количества накопленных нейтральных жиров: чем их больше, тем длительнее ткани будут получать достаточное количество энергии. При полном расщеплении всех запасов триглицеридов функцию энергообеспечения возьмут на себя белки: при их катаболизме в кровь будут поступать аминокислоты, которые при потере аминогруппы начнут превращаться в жирные кислоты и использоваться в процессе β-окисления. Однако аминокислоты при этом используются также и в качестве субстрата для глюконеогенеза, и в качестве строительного материала для регенерации тканей, и для синтеза иммуноглобулинов. В результате нарастает кахексия и развивается синдром приобретенного иммунодефицита, ведущий к присоединению вторичной инфекции, развитию и прогрессированию сердечной недостаточности и в конечном итоге к летальному исходу [6, 7].
Таким образом, в условиях голодания организм переключается на использование эндогенных энергосубстратов — гликогена, нейтральных жиров и белков, за счет действия контринсулярных гормонов, обеспечивающих гликогенолиз, липолиз и глюконеогенез.
Рассмотрим теперь ситуацию, когда в организме имеется абсолютный или относительный дефицит инсулина. В первую очередь в условиях дефицита инсулина поступившая в кишечник и всосавшаяся глюкоза не сможет накапливаться в печени в виде гликогена, следовательно, уровень посталиментарной гликемии значительно превысит верхний предел нормы. Поскольку адекватной уровню гликемии секреции инсулина не будет, в основные инсулинозависимые ткани глюкоза не пойдет и использоваться в качестве энергосубстрата для синтеза АТФ не сможет. Даже проникая по градиенту концентрации в инсулинонезависимые ткани, глюкоза не будет окисляться там по гликолитическому пути до конечных продуктов — Н2О и СО2 с образованием АТФ. Развитие «энергетического голода» повлечет за собой активацию энергообеспечительных процессов, таких как гликогенолиз, липолиз и β-окисление жирных кислот, а также глюконеогенез. Результатом активации гликогенолиза и глюконеогенеза будет чрезмерное повышение печеночной продукции глюкозы в результате отсутствия ингибирующего эту активность действия инсулина, что приведет к повышению уровня гликемии натощак, а затем и к нарастанию постпрандиальной гликемии до уровня, превышающего почечный порог для глюкозы (>11 ммоль/л). В итоге глюкоза, поступившая в первичную мочу, не будет реабсорбироваться в дистальных канальцах почек, что повлечет за собой нарушение всасывания воды и приведет к глюкозурии и полиурии. В целом глюкозурия и вызванная ею для поддержания осмотического равновесия полиурия — не что иное, как компенсаторная реакция, направленная на выведение излишней глюкозы из организма. Однако результатом этой компенсаторной реакции являются обезвоживание тканей и появление жажды. Таким образом, основные клинические симптомы сахарного диабета — полидипсия и полиурия — это итог нарастающей в результате активации гликогенолиза и глюконеогенеза гипергликемии и следующей за ней глюкозурии.
Вместе с тем в ситуации дефицита инсулина глюкоза не может эффективно окисляться по гликолитическому пути с образованием энергии АТФ, поэтому активизируется липолиз, обеспечивающий энергосубстратом — СЖК — цикл трикарбоновых кислот (цикл Кребса). Избыточное поступление СЖК в печень, обедненную гликогеном, способствует формированию жирового гепатоза, что сопровождается увеличением размеров печени и даже появлением болевого синдрома вследствие растяжения капсулы Глиссона. Вследствие активации липолиза и катаболизма белка человек начинает терять в весе тем быстрее, чем больший дефицит инсулина развивается.
Следует отметить, что тип развивающегося диабета во многом определяет степень выраженности метаболических нарушений. Сахарный диабет 1 типа характеризуется абсолютным дефицитом инсулина, возникающим в результате аутоиммунной деструкции островков Лангерганса, тогда как при сахарном диабете 2 типа, напротив, отмечается гиперинсулинемия, обусловленная инсулинорезистентностью периферических тканей, в результате чего развивается относительная недостаточность инсулина.
Безусловно, при абсолютном дефиците инсулина активация липолиза более выражена, что приводит к накоплению кетоновых тел и, как следствие, к сдвигу кислотно-щелочного равновесия с развитием метаболического кетоацидоза. Напротив, при относительной инсулиновой недостаточности благодаря тому, что липотропный и антилиполитический эффект инсулина в 10 раз превышает его глюкозотропный эффект, столь выраженной стимуляции липолиза и, соответственно, кетогенеза с развитием метаболического ацидоза не отмечается. В этом и заключается основное отличие в клинической картине сахарного диабета 1 и 2 типа, позволяющее дифференцировать эти два столь разных по патогенезу, но очень схожих по метаболическим нарушениям типа заболевания.
Подводя итог обзора метаболических нарушений, развивающихся при сахарном диабете, следует отметить, что в условиях дефицита инсулина и развивающегося «энергетического голода» в организме пациента с сахарным диабетом активируются те же самые процессы энергообеспечения, что и при голодании у здорового человека. Однако из-за отсутствия контроля инсулина за уровнем печеночной продукции глюкозы и процессом липолиза эта активация становится чрезмерной, приводя к гипергликемии и обусловленной ею глюкозурии, что клинически проявляется симптомами полидипсии и полиурии, приводящей к потере массы тела на фоне усиления липолиза и катаболизма белка. Иными словами, можно сказать, что по сути своей сахарный диабет есть не что иное, как «грубая пародия на нормальную реакцию организма на голод» [8]. Риск нарушения толерантности к углеводам появляется при избыточной продукции любого контринсулярного гормона за счет повышения печеночной продукции глюкозы при активации гликогенолиза (глюкагон, катехоламины) и глюконеогенеза (АКТГ, глюкокортикоиды), при повышении продукции СТГ, стимулирующего липолиз и, опосредованно, глюконеогенез. Для поддержания нормогликемии в этих условиях стимулируется секреция инсулина и поддерживается гомеостаз глюкозы.
Сведения об авторе:
Недосугова Людмила Викторовна — д.м.н., доцент, профессор кафедры эндокринологии № 1 ИКМ им. Н.В. Склифосовского ФГАОУ Первый МГМУ им. И.М. Сеченова (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-6823-2487.
Контактная информация: Недосугова Людмила Викторовна, e-mail: profmila@mail.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 22.07.2021.
Поступила после рецензирования 16.08.2021.
Принята в печать 08.09.2021.
About the author:
Lyudmila V. Nedosugova — Dr. Sc. (Med.), Associate Professor, professor of the Department of Endocrinology of the N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-6823-2487.
Contact information: Lyudmila V. Nedosugova, e-mail: profmila@mail.ru.
Financial Disclosure: the author has no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 22.07.2021.
Revised 16.08.2021.
Accepted 08.09.2021.