-
Главная
-
Теория ЕГЭ
-
Химия — теория ЕГЭ
-
Таблица растворимости ЕГЭ 2023 по химии
Таблица растворимости ЕГЭ 2023 по химии
- 01.11.2020
Подробная таблица растворимости, которой можно пользоваться на ЕГЭ по химии в 2023 году.
- Кстати, тренировочные варианты этого года ЕГЭ по химии
Обновлено: 17.11.2022
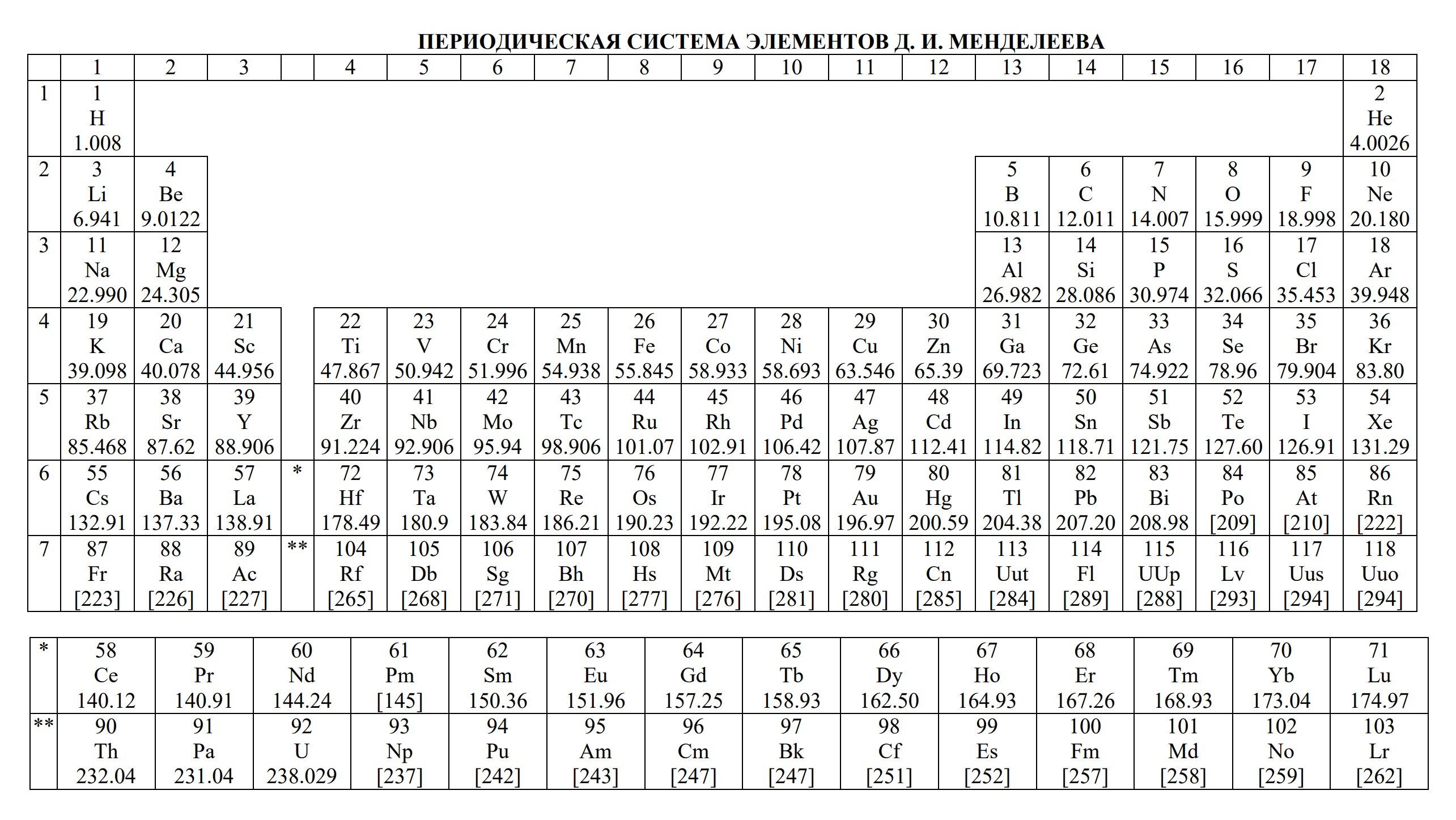
Смотрите Таблицу Менделеева для ЕГЭ (ей тоже можно пользоваться).
- Другая теория по химии
Таблица Растворимости в картинке JPG
Таблица Растворимости в PDF
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Сохранить ссылку:
Комментарии (0)
Добавить комментарий
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Имя (обязательное)
E-Mail
Подписаться на уведомления о новых комментариях
Отправить
Уважаемый посетитель!
Если у вас есть вопрос, предложение или жалоба, пожалуйста, заполните короткую форму и изложите суть обращения в текстовом поле ниже. Мы обязательно с ним ознакомимся и в 30-дневный срок ответим на указанный вами адрес электронной почты
Статус Абитуриент Студент Родитель Соискатель Сотрудник Другое
Филиал Абакан Актобе Алагир Алматы Алушта Анапа Ангарск Архангельск Армавир Асбест Астана Астрахань Атырау Баку Балхаш Барановичи Барнаул Белая Калитва Белгород Бельцы Берлин Бишкек Благовещенск Бобров Бобруйск Борисов Боровичи Бронницы Брянск Бузулук Чехов Челябинск Череповец Черкесск Дамаск Дербент Димитровград Дмитров Долгопрудный Домодедово Дубай Дубна Душанбе Екатеринбург Электросталь Елец Элиста Ереван Евпатория Гана Гомель Гродно Грозный Хабаровск Ханты-Мансийск Хива Худжанд Иркутск Истра Иваново Ижевск Калининград Карабулак Караганда Каракол Кашира Казань Кемерово Киев Кинешма Киров Кизляр Королев Кострома Красноармейск Краснодар Красногорск Красноярск Краснознаменск Курган Курск Кызыл Липецк Лобня Магадан Махачкала Майкоп Минеральные Воды Минск Могилев Москва Моздок Мозырь Мурманск Набережные Челны Нальчик Наро-Фоминск Нижневартовск Нижний Новгород Нижний Тагил Ногинск Норильск Новокузнецк Новосибирск Новоуральск Ноябрьск Обнинск Одинцово Омск Орехово-Зуево Орел Оренбург Ош Озёры Павлодар Пенза Пермь Петропавловск Подольск Полоцк Псков Пушкино Пятигорск Радужный Ростов-на-Дону Рязань Рыбинск Ржев Сальск Самара Самарканд Санкт-Петербург Саратов Сергиев Посад Серпухов Севастополь Северодвинск Щербинка Шымкент Слоним Смоленск Солигорск Солнечногорск Ставрополь Сургут Светлогорск Сыктывкар Сызрань Тамбов Ташкент Тбилиси Терек Тихорецк Тобольск Тольятти Томск Троицк Тула Тверь Тюмень Уфа Ухта Улан-Удэ Ульяновск Ургенч Усть-Каменогорск Вёшенская Видное Владимир Владивосток Волгодонск Волгоград Волжск Воркута Воронеж Якутск Ярославль Юдино Жлобин Жуковский Златоуст Зубова Поляна Звенигород
Тип обращения Вопрос Предложение Благодарность Жалоба
Тема обращения Поступление Трудоустройство Обучение Оплата Кадровый резерв Внеучебная деятельность Работа автоматических сервисов университета Другое
* Все поля обязательны для заполнения
Я даю согласие на обработку персональных данных, согласен на получение информационных рассылок от Университета «Синергия» и соглашаюсь c политикой конфиденциальности
Таблицы на ЕГЭ и ОГЭ по химии
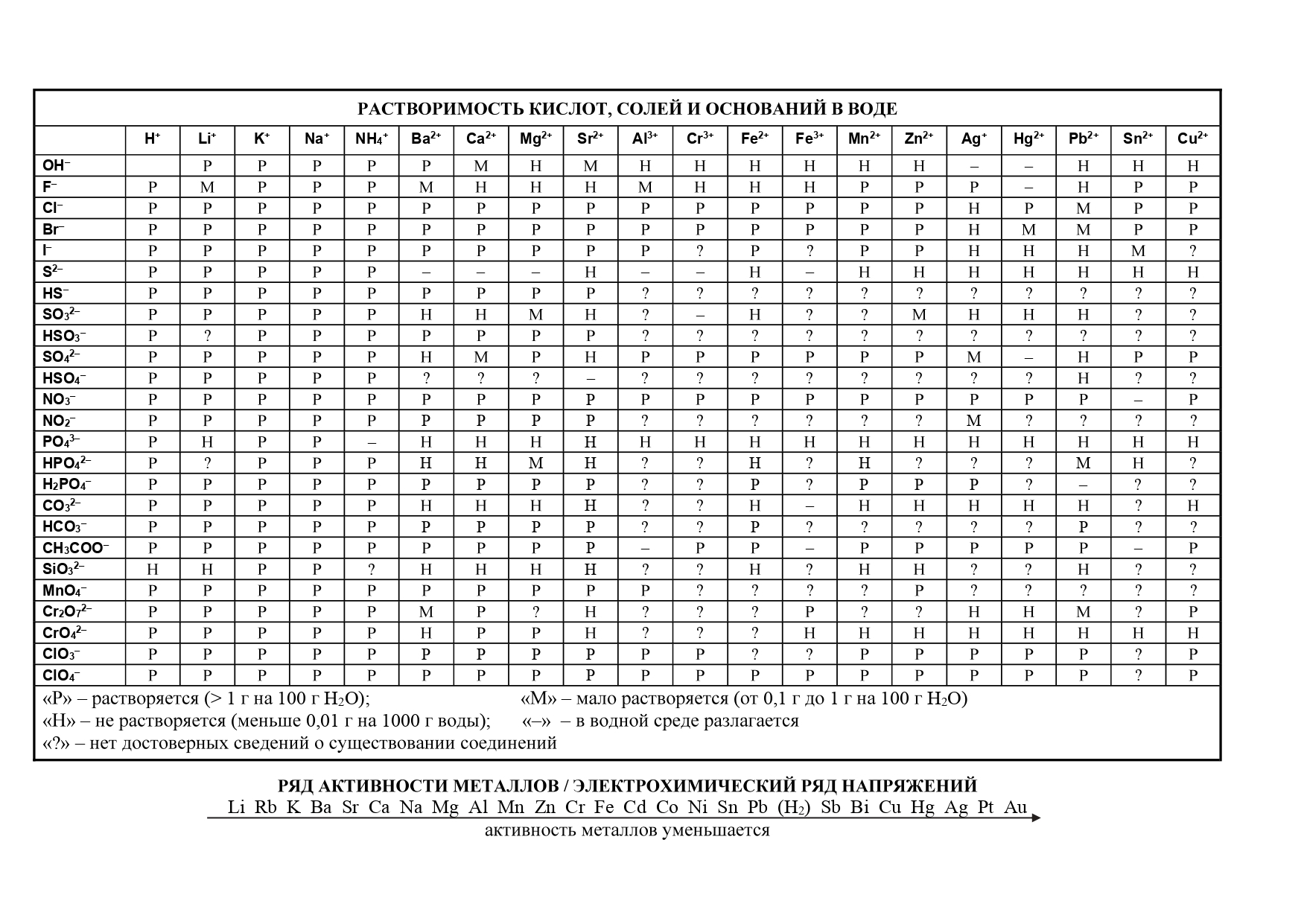
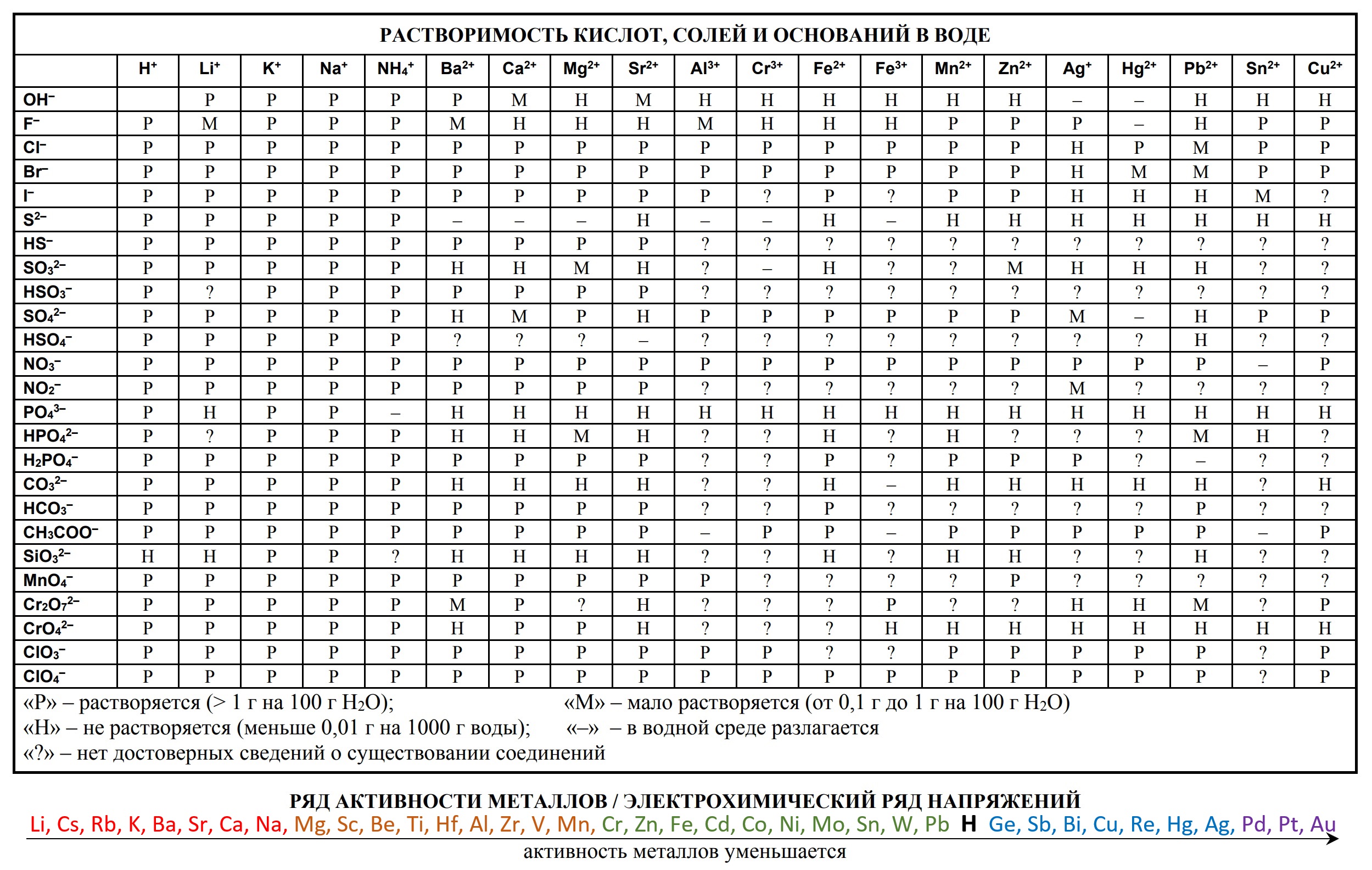
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Таблицы для ЕГЭ по химии
- 31.10.2020
Приводим таблицы, которые можно использовать на ЕГЭ по химии, эти таблицы можно использовать на ЕГЭ в любом году, входит в пакет разрешённых документов, т.е. то, чем можно пользоваться на ЕГЭ по химии.
Из года в год эти таблицы не меняются. В 2023 году поменялась только таблица растворимости — информацию обновили. Используйте ссылки ниже.
В состав документа входят:
- Таблица растворимости солей
- Таблица Менделеева
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
6 августа 2021
В закладки
Обсудить
Жалоба
ЕГЭ по химии: справочные материалы
Предложенный материал адресован абитуриентам, преподавателям химии и ученикам 8-11 классов.
Материал содержит справочные таблицы, тривиальные названия неорганических и органических соединений, краткие теоретические сведения о гидролизе, электролизе, тренажёр для повторения большого количества неорганических реакций.
spr-himiya.docx
spr-himiya.pdf
Автор: Аветисян Сатеник Вагеевна.
Таблицы ЕГЭ по химии
Ниже приведены таблицы, идентичные используемым на ЕГЭ по химии: «Периодическая система химических элементов Д.И.Менделеева»
«Растворимость солей, кислот и оснований в воде» и «Электрохимический ряд напряжений металлов»:
Таблица растворимости
Интерактивная таблица
Таблица растворимости — наглядная инфографика о растворимости солей. На пересечении катиона (по горизонтали) и аниона (по вертикали) отображается информация о соли, состоящей из данного катиона и данного аниона. Смотрите вкладки ниже, чтобы понять, какая информация там содержится.
Часто таблицу используют, чтобы предсказать возможность протекания реакции ионного обмена: если в процессе такой реакции образуется осадок (то есть нерастворимое вещество Н или малорастворимое М в этой таблице), то скорее всего реакция осуществима.
$$ce{BaCl2 + Na2SO4 ->[ce{H2O}] BaSO4 v + 2NaCl}$$
Однако, для совсем точного знания о ходе реакции обмена потребуется вычислить константу равновесия реакции, для которой необходимы знания произведений растворимости (ПР) малорастворимых и нерастворимых веществ. А чтобы узнать ПР, можно навести мышь на любое мало- или нерастворимое вещество: появится окошко со значением ПР вещества.
$$ce{BaSO4 <=> Ba^2+ + SO4^2-}, K_{s} = [ce{Ba^2+}][ce{SO4^2-}]$$
У таблицы растворимости есть следующие возможности:
- При наведении на пересечение катиона и аниона, если соединение нерастворимо (Н) или малорастворимо (М), отобразится значение произведения растворимости (ПР) этого соединения.
- При наведении на анион появится его название (гидроксид, фторид…);
- При наведении на любую клеточку отобразится подсказка о содержании данной ячейки.
Обозначения, используемые в таблице растворимости:
- Р: соединение растворимо (более 1 г на 100 г H2O);
- М: соединение малорастворимо (от 0,1 до 1 г на 100 г H2O);
- Н: соединение нерастворимо (менее 0,1 г на 100 г H2O);
- 🞩: нет данных о существовании соединения;
- —: соединение существует, но его невозможно получить обменом в водном растворе, то есть оно необратимо гидролизуется (Al2S3 + 6H2O = 2Al(OH)3 + 3H2S).
Все данные о растворимости приведены при стандартных условиях: 1 атм внешнего давления, температура 25°C.
Все данные о растворимости и о ПР веществ взяты из следующих источников:
- David R. Lide, ed., CRC Handbook of Chemistry and Physics, Internet Version 2005, <http://www.hbcpnetbase.com>, CRC Press, Boca Raton, FL, 2005
- «Неорганическая химия» в 3-х т. под ред. Ю. Д. Третьякова.
Если вы нашли ошибку, пожалуйста, сообщите об этом, выделив ошибку и нажав Ctrl+Enter, при необходимости добавив комментарий.
Спасибо за помощь, уважаемый читатель!
| Анион | H+ | NH4+ | Li+ | Na+ | K+ | Be2+ | Mg2+ | Ca2+ | Ba2+ | Al3+ | Zn2+ | Cr2+ | Cr3+ | Fe2+ | Fe3+ | Cu2+ | Pb2+ | Hg22+ | Hg2+ | Ag+ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
OH− Гидроксид |
Р | Р | Р | Р | Р | Н
ПР: 6,92 * 10-22 |
Н
ПР: 6,8 * 10-12 |
М
ПР: 6,3 * 10-6 |
Р | Н
ПР: 5,7 * 10-32 |
Н
ПР: 3,0 * 10-16 |
Н
ПР: 1,0 * 10-17 |
Н
ПР: 1,1 * 10-30 |
Н
ПР: 7,9 * 10-16 |
Н
ПР: 6,3 * 10-38 |
Н
ПР: 5,6 * 10-20 |
Н
ПР: 5,5 * 10-16 |
🞩 | 🞩 | 🞩 |
|
F− Фторид |
Р | Р | М
ПР: 1,5 * 10-3 |
Р | Р | Р | Н
ПР: 6,4 * 10-9 |
Н
ПР: 4,0 * 10-11 |
М
ПР: 1,7 * 10-6 |
М | М
ПР: 3,04 * 10-2 |
М
ПР: |
Р | Р | Р | Н | Н
ПР: 2,7 * 10-8 |
Н | — | Р |
|
Cl− Хлорид |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М
ПР: 1,7 * 10-5 |
Н
ПР: 1,5 * 10-18 |
Р | Н
ПР: 1,8 * 10-10 |
|
Br− Бромид |
Р | Р | Р | Р | Р | М
ПР: |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М
ПР: 5,0 * 10-5 |
Н
ПР: 7,9 * 10-23 |
М
ПР: |
Н
ПР: 5,3 * 10-13 |
|
I− Иодид |
Р | Р | Р | Р | Р | — | Р | Р | Р | Р | Р | Р | М
ПР: ? |
Р | 🞩 | 🞩 | Н
ПР: 8,7 * 10-9 |
Н
ПР: 5,4 * 10-29 |
Н | Н
ПР: 2,3 * 10-16 |
|
NO3− Нитрат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
|
SO42− Сульфат |
Р | Р | Р | Р | Р | Р | Р | М
ПР: 3,7 * 10-5 |
Н
ПР: 1,8 * 10-10 |
Р | Р | Р | Р | Р | Р | Р | Н
ПР: 1,7 * 10-8 |
— | — | М
ПР: 1,2 *10-3 |
|
SO32− Сульфит |
Р | Р | Р | Р | Р | 🞩 | М
ПР: 3,0 * 10-3 |
Н
ПР: 3,2 * 10 -7 |
Н
ПР: 8,0 * 10-7 |
🞩 | М | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н | Н | 🞩 | Н
ПР: 1,5 * 10-14 |
|
CH3COO− Ацетат |
Р | Р | Р | Р | Р | Н | Р | Р | Р | 🞩 | Р | М
ПР: |
Р | 🞩 | 🞩 | Р | Р | Р | Р | М
ПР: |
|
CO32− Карбонат |
Р | Р | М
ПР: 1,9 * 10-3 |
Р | Р | М | М
ПР: 4,9 * 10-11 |
Н
ПР: 4,4 * 10-9 |
Н
ПР: 4,9 * 10-9 |
🞩 | Н
ПР: 5,3 * 10-11 |
🞩 | 🞩 | Н
ПР: 2,9 * 10-11 |
🞩 | — | Н
ПР: 3,6 * 10-14 |
Н
ПР: ? |
🞩 | Н
ПР: 1,2 * 10-12 |
|
S2− Сульфид |
Р | Р | Р | Р | Р | — | — | М
ПР: — |
Р | — | Н
ПР: 1,2 * 10-25 |
Н | — | Н | Н | Н
ПР: 1,4 * 10-36 |
Н
ПР: 8,7 * 10-29 |
Н | Н
ПР: 1,4 * 10-45 |
Н
ПР: 7,2 * 10-50 |
|
SiO32− Силикат |
Н | 🞩 | Н | Р | Р | 🞩 | М
ПР: N |
М
ПР: N |
Н | 🞩 | Н | 🞩 | 🞩 | Н | 🞩 | 🞩 | Н | 🞩 | 🞩 | Н |
|
PO43− Фосфат |
Р | — | Н
ПР: 3,2 * 10-9 |
Р | Р | 🞩 | Н
ПР: 1,04 * 10-24 |
Н
ПР: 1,0 * 10-25 |
Н
ПР: 6,0 * 10-39 |
М
ПР: 9,84 * 10-21 |
Н
ПР: 9,1 * 10-33 |
🞩 | Н | Н | Н | Н | Н | Н | Н | Н
ПР: 1,8 * 10-18 |
|
HPO4− Гидрофосфат |
Р | Р | 🞩 | Р | Р | Н | М | Н | Н | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | — | 🞩 | 🞩 | 🞩 |
|
H2PO4− Дигидрофосфат |
Р | Р | Р | Р | Р | 🞩 | 🞩 | Р | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Р | 🞩 | 🞩 | 🞩 |
|
ClO4− Перхлорат |
Р | Р | Р | Р | М
ПР: 1,0 * 10-2 |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
|
ClO3− Хлорат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | 🞩 | 🞩 | Р | Р | Р | Р | 🞩 |
|
HCOO− Формиат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | — | Н |
|
C2O42− Оксалат |
Р | Р | Р | Р | Р | Р | Н
ПР: 8,6 * 10-3 |
Н
ПР: 2,3 * 10-9 |
Н
ПР: 1,1 * 10-9 |
Р | Н
ПР: 1,38 * 10-9 |
🞩 | Н | Н
ПР: 2,1 * 10-7 |
Н | Н | Н | Н | Н | Н
ПР: 3,5 * 10-11 |
|
MnO4− Перманганат |
Р | М | Н | М | М | 🞩 | 🞩 | 🞩 | Р | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | М |
|
CrO42− Хромат |
Р | Р | Р | Р | Р | Р | Р | Р | Н
ПР: 1,1 * 10-10 |
— | Н | 🞩 | Р | — | Р | Н | Н
ПР: 2,8 * 10-15 |
М | Н | Н
ПР: 1,1 * 10-12 |
|
Cr2O72− Дихромат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н
ПР: 1,1 * 10-10 |
|
ReO4− Перренат |
Р | Р | Р | Р | М | 🞩 | 🞩 | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | М |
|
MoO42− Метамолибдат |
Н | Р | Р | Р | Р | 🞩 | Р | Н
ПР: 1,46 * 10-8 |
Н
ПР: 3,54 * 10-8 |
Н | Н | 🞩 | 🞩 | Н | 🞩 | Н | Н | 🞩 | 🞩 | Н
ПР: 2,8 * 10-12 |
|
WO42− Метавольфрамат |
Н | Р | Р | Р | Р | 🞩 | 🞩 | Н | Н | 🞩 | Н | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н | 🞩 | 🞩 | Н
ПР: 5,5 * 10-12 |
|
[Fe(CN)6]4− Гексацианоферрат(II) |
Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | 🞩 | — | Н | Н | Н | Н | Н | — | Н |
|
S2O32− Тиосульфат |
— | Р | Р | Р | Р | 🞩 | Р | Р | М | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н | Н | — | Н |
|
N3− Азид |
Р | Р | Р | Р | Р | 🞩 | Р | Р | Р | — | 🞩 | 🞩 | 🞩 | 🞩 | Р | Н | Н
ПР: 2,6 * 10-9 |
Н | Н | Н |
|
SeO42− Селенат |
Р | Р | Р | Р | Р | Р | Р | Р | Н
ПР: |
🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | Р | Н
ПР: |
🞩 | 🞩 | 🞩 |
|
CN− Цианид |
Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Р | Н
ПР: 1,4 * 10-16 |
|
[Fe(CN)6]3− Гексацианоферрат(III) |
Р | Р | Р | Р | Р | 🞩 | Р | Р | Р | 🞩 | Н
ПР: |
🞩 | — | Н
ПР: |
Р | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
CNS− Тиоцианат |
Р | Р | Р | Р | Р | Н
ПР: |
Р | Р | Р | Р | Р | Р | 🞩 | Р | Р | Р | М
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
VO43− Ортованадат |
🞩 | 🞩 | Р | Р | Р | 🞩 | 🞩 | 🞩 | Н
ПР: |
🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н
ПР: |
|
BO2− Метаборат |
Р | Р | Р | Р | Р | 🞩 | М
ПР: |
М
ПР: |
М
ПР: |
Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
— | — | М
ПР: |
|
IO3− Иодат |
Р | Р | Р | Р | Р | Р | Р | М
ПР: |
Н
ПР: |
Н
ПР: |
М
ПР: |
🞩 | 🞩 | 🞩 | Н
ПР: |
М
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
|
SiF62− Гексафторосиликат |
Р | Р | Р | М
ПР: |
Н
ПР: |
🞩 | Р | Р | Н
ПР: |
🞩 | Р | 🞩 | 🞩 | Р | 🞩 | Р | Р | 🞩 | 🞩 | Р |
|
C17H35COO− Стеарат |
Н
ПР: |
Р | Н
ПР: |
Р | Р | 🞩 | Н
ПР: |
Н
ПР: |
Р | Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
C6H5COOH− Бензоат |
М
ПР: |
Р | Р | Р | Р | 🞩 | Р | Р | Р | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | Н
ПР: |
М
ПР: |
🞩 | М
ПР: |
М
ПР: |
|
[PtCl6]2− Гексахлороплатинат |
Р | М
ПР: |
Р | Р | М
ПР: |
🞩 | 🞩 | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 |
|
AsO33− Арсенит |
🞩 | Р | 🞩 | Р | Р | 🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
— | — | 🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
AsO43− Ортоарсенат |
Р | Р | Н
ПР: |
Р | Р | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Физическая химия
Степан Чичулин
20.02.2021