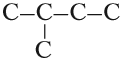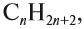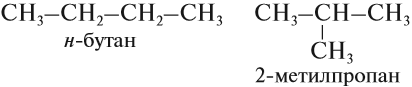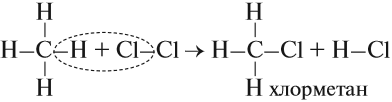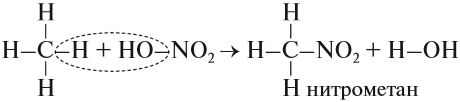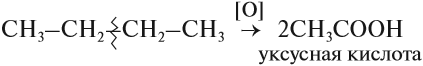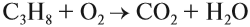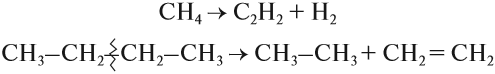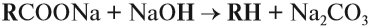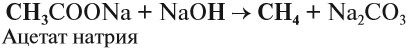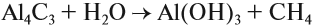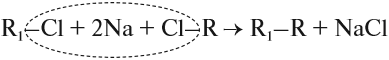Строение алканов
Гомологический ряд
Получение алканов
Химические свойства алканов
Получение алканов. Лабораторные и промышленные способы получения алканов
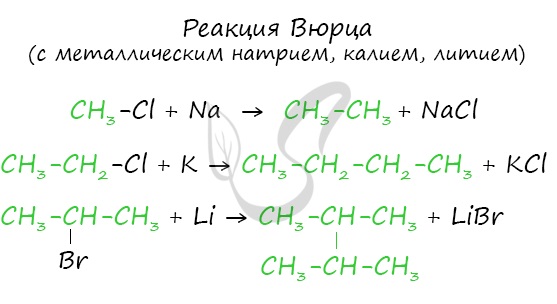
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Хлорэтан взаимодействует с натрием с образованием бутана:
Реакция больше подходит для получения симметричных алканов.
При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
2. Водный или кислотный гидролиз карбида алюминия
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Al4C3 + 12HCl = 4AlCl3 + 3CH4
Этот способ получения используется в лаборатории.
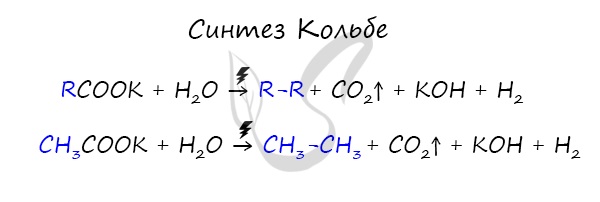
3. Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод (-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод (+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3
4. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
5. Гидрирование алкеноа, алкинов, циклоалканов, алкадиенов.
При гидрировании этилена образуется этан:
При полном гидрировании ацетилена также образуется этан:
При гидрировании циклопропана образуется пропан:
6. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (2n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
7. В промышленности алканы получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько
основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает
химическое строение. - Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его
свойствах. - Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда
— CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления
этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos —
соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить
читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они
связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи
и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д. - Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

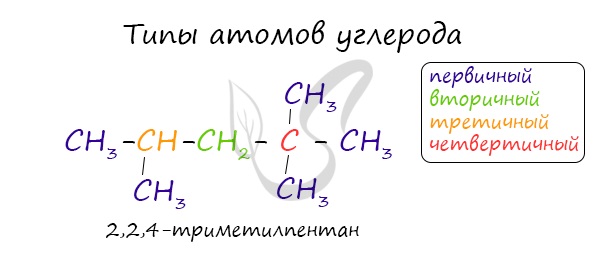
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный
атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по
строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной
(геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

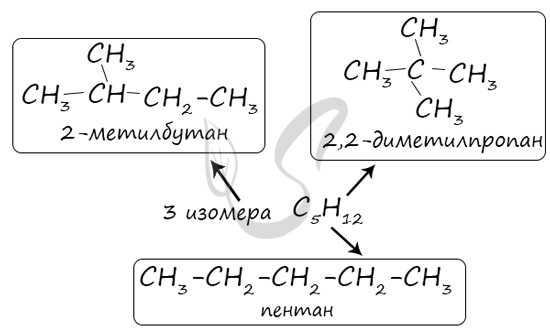
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.
Некоторые данные, касающиеся алканов, надо выучить:
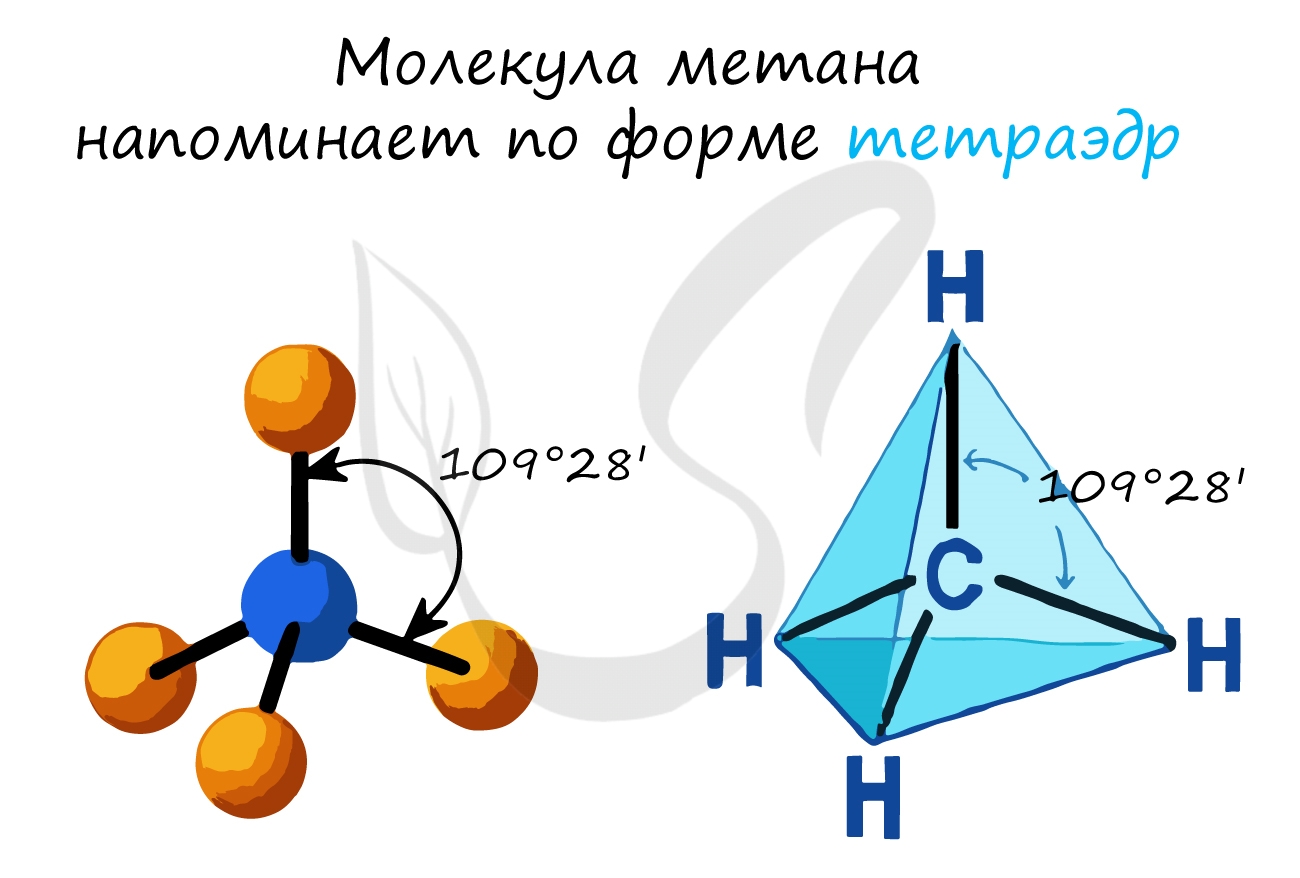
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28′
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить
одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Гриньяра
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного
радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).

На схеме выше мы сначала получили реактив Гриньяра, а потом
использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для
алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее — у вторичного и значительно труднее — у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы,
которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция
идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.

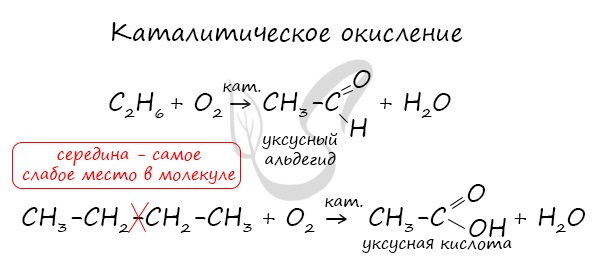
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное
отличие пиролиза от горения — в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат.) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
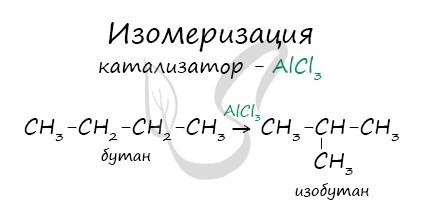
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их
химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
4.1.7. Основные способы получения углеводородов.
Углеводороды разных классов (алканы, алкены, алкины, алкадиены, арены) можно получать различными способами.
Получение алканов
Крекинг алканов с изначально большей длиной цепи
Процесс, используемый в промышленности, протекает в интервале температур 450-500oC в присутствии катализатора и при температуре 500-700oC в отсутствие катализатора:
Важность промышленного процесса крекинга заключается в том, что он позволяет повысить выход бензина из тяжелых фракций нефти, которые не представляют существенной ценности сами по себе.
Гидрирование непредельных углеводородов
- алкенов:
- алкинов и алкадиенов:
Газификация каменного угля
в присутствии никелевого катализатора при повышенных температуре и давлении может быть использована для получения метана:
Процесс Фишера-Тропша
С помощью данного метода могут быть получены предельные углеводороды нормального строения, т.е. алканы. Синтез алканов осуществляют, используя синтез-газ (смеси угарного газа CO и водорода H2), который пропускают через катализаторы при высоких температуре и давлении:
Реакция Вюрца
С помощью данной реакции могут быть получены углеводороды с большим числом атомов углерода в цепи, чем в исходных углеводородах. Реакция протекает при действии на галогеналканы металлического натрия:
Декарбоксилирование солей карбоновых кислот
Сплавление твердых солей карбоновых кислот со щелочами приводит к реакции декарбоксилирования, при этом образуются углеводород с меньшим числом атомов углерода и карбонат металла (реакция Дюма):
Гидролиз карбида алюминия
Взаимодействие карбида алюминия с водой, а также кислотами-неокислителями приводит к образованию метана:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Получение алкенов
Крекинг алканов
Реакция в общем виде уже была рассмотрена выше (получение алканов). Пример реакции крекинга:
Дегидрогалогенирование галогеналканов
Дегидрогалогенирование галогеналканов протекает при действии на них спиртового раствора щелочи:
Дегидратация спиртов
Данный процесс протекает в присутствии концентрированной серной кислоты и нагревании до температуры более 140оС:
Обратите внимание, что и в случае дегидратации, и в случае дегидрогалогенирования отщепление низкомолекулярного продукта (воды или галогеноводорода) происходит по правилу Зайцева: водород отщепляется от менее гидрированного атома углерода.
Дегалогенирование вицинальных дигалогеналканов
Вицинальными дигалогеналканами называют такие производные углеводородов, у которых атомы хлора прикреплены к соседним атомам углеродной цепи.
Дегидрогалогенирование вицинальных галогеналканов можно осуществить, используя цинк или магний:
Дегидрирование алканов
Пропускание алканов над катализатором (Ni, Pt, Pd, Al2O3 или Cr2O3) при высокой температуре (400-600оС) приводит к образованию соответствующих алкенов:
Получение алкадиенов
Дегидрирование бутана и бутена-1
В настоящий момент основным методом производства бутадиена-1,3 (дивинила) является каталитическое дегидрирование бутана, а также бутена-1, содержащихся в газах вторичной переработки нефти. Процесс проводят в присутствии катализатора на основе оксида хрома (III) при 500—650°С:
Действием высоких температур в присутствии катализаторов на изопентан (2-метилбутан) получают промышленно важный продукт – изопрен (исходное вещество для получения так называемого «натурального» каучука):
Метод Лебедева
Ранее (в Советском Союзе) бутадиен-1,3 получали по методу Лебедева из этанола:
Дегидрогалогенирование дигалогензамещенных алканов
Осуществляется действием на галогенпроизводные спиртового раствора щелочи:
Получение алкинов
Получение ацетилена
Пиролиз метана
При нагревании до температуры 1200-1500оС метан подвергается реакции дегидрирования с одновременным удваиванием углеродной цепи – образуются ацетилен и водород:
Гидролиз карбидов щелочных и щелочноземельных металлов
Действием на карбиды щелочных и щелочно-земельных металлов воды или кислот-неокислителей в лаборатории получают ацетилен. Наиболее дешев и, как следствие, наиболее доступен для использования карбид кальция:
Дегидрогалогенирование дигалогеналканов
Получение гомологов ацетилена
Дегидрогалогенирование дигалогеналканов:
Дегидрирование алканов и алкенов:
Получение ароматических углеводородов (аренов)
Декарбоксилирование солей ароматических карбоновых кислот
Сплавлением солей ароматических карбоновых кислот со щелочами удается получить ароматические углеводороды с меньшим числом атомов углерода в молекуле по сравнению с исходной солью:
Тримеризация ацетилена
При пропускании ацетилена при температуре 400°C над активированным углем с хорошим выходом образуется бензол:
Аналогичным способом можно получать симметричные триалкилзамещенные бензолы из гомологов ацетилена. Например:
Дегидрирование гомологов циклогексана
При действии на циклоалканы с 6-ю атомами углерода в цикле высокой температуры в присутствии платины происходит дегидрирование с образованием соответствующего ароматического углеводорода:
Дегидроциклизация
Также возможно получение ароматических углеводородов из углеводородов нециклического строения при наличии углеродной цепи с длиной в 6 или более атомов углерода (дегидроциклизация). Процесс осуществляют при высоких температурах в присутствии платины или любого другого катализатора гидрирования-дегидрирования (Pd, Ni):
Алкилирование
Получение гомологов бензола алкилированием ароматических углеводородов хлорпроизоводными алканов, алкенами или спиртами:
ПОЛУЧЕНИЕ АЛКАНОВ
(материал для ЕГЭ)
-
Реакция Фишера-Тропша :
190-250oC,Fe
2nCO + (n+1)H2 —> CnH2n+2 + nCO2
160-200oC,Ni,Co
nCO + (2n+1)H2 —> CnH2n+2 + nH2O
-
Каталитическая гидрогенизация угля:
460-470oC,Fe,р
nC + (n+1)H2 —> CnH2n+2
-
Крекинг алканов. Получают смесь алканов и алкенов с меньшим числом атомов углерода:
t
С8Н18 —> C4H10 + C4H8
-
Реакция Вюрца. Взаимодействие моногалогеналканов с металлическим натрием при нагревании:
2CH3Br + 2Na —> CH3-CH3 + 2NaBr
CH3Br + 2Na + C2H5Br —> CH3-CH2-CH3 + 2NaBr
По реакции Вюрца нельзя получить метан.
2CH3-CH-CH2-CH3 + 2Na —> CH3-CH2-CH — CH-CH2-CH3 +2NaBr
l l l
Br CH3 CH3
-
Взаимодействие галогеналканов с Zn в водных растворах минеральных кислот или уксусной кислоты:
СH3COOH,HBr
2CH3CH2Br + Zn —> 2CH3-CH3 + ZnBr2
-
Гидролиз карбида алюминия Al4C3 (или Be2C):
Be2C + 4H2O —> 2Be(OH)2 + CH4
Al4C3 + 12H2O —> 4Al(OH)3 + 3CH4
Al4C3 + 12HCl —> 4AlCl3 + 3CH4
-
Реакция Дюма. Сплавление щелочей с солями одноосновных и двухосновных карбоновых кислот:
CH3COONa + NaOH —> CH4 + Na2CO3
СOONa-CH2-CH2-COONa + 2NaOH —> CH3-CH3 + 2Na2CO3
-
Реакция Кольбе. Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O —> CH3-CH3 + 2CO2 + 2NaOH + H2
-
Гидрирование непредельных и циклических углеводородов:
t,kat
CH2=CH2 + H2 —> CH3-CH3
t,kat
CH≡CH + 2H2 —> CH3-CH3


-
Реакция Вюрца-Гриньяра:
CH3-Mg-Cl + Cl-CH3 —> CH3-CH3 + MgCl2
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ПОЛУЧЕНИЕ АЛКАНОВ:
1. Фракционная перегонка нефти
Нефть поступает в ректификационные колонны на атмосферную перегонку (перегонку при атмосферном давлении), где разделяется на несколько фракций: легкую и тяжёлую бензиновые фракции, керосиновую фракцию, дизельную фракцию и остаток атмосферной перегонки — мазут. Качество получаемых фракций не соответствует требованиям, предъявляемым к товарным нефтепродуктам, поэтому фракции подвергают дальнейшей (вторичной) переработке.
2. Пиролиз нефти -(от др.-греч. πῦρ — огонь, жар и λύσις — разложение, распад) — термическое разложение органических и многих неорганических соединений. В узком смысле, разложение органических природных соединений при недостатке кислорода (древесины, нефтепродуктови прочего). В более широком смысле — разложение любых соединений на составляющие менее тяжёлые молекулы, или элементы под действием повышения температуры.
3. Крекинг — (англ. cracking, расщепление) — высокотемпературная переработка нефти и её фракций с целью получения, как правило, продуктов меньшей молекулярной массы — моторного топлива, смазочных масел и т. п., а также сырья для химической и нефтехимической промышленности. Крекинг протекает с разрывом связей С—С и образованием свободных радикалов. Одновременно с разрывом связей С—С происходит дегидрирование, изомеризация, полимеризация и конденсация как промежуточных, так и исходных веществ.
В результате последних двух процессов образуются крекинг-остаток (фракция с температурой кипения более 350 °C) и нефтяной кокс.
ЛАБОРАТОРНЫЕ СПОСОБЫ
1. Реакция Вюрца –удлинение цепи:
действие металлического натрия на моногалогенопроизводные углеводородов:
Происходит удлинение углеродного скелета. Реакция подходит для получения симметричных алканов
5. Сплавление солей карбоновых кислот со щелочами (реакция Дюма).
Так получают метан при нагревании ацетата натрия с гидроксидом натрия.
3. Электролиз солей карбоновых кислот (реакция Кольбе)
4) Гидрирование (восстановление) непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля).
5) Гидрирование угля, оксида углерода при повышенной температуре
катализаторы (железо, кобальт, никель) :
ПОЛУЧЕНИЕ МЕТАНА
1) Гидролиз карбида алюминия
2) Взаимодействие карбида алюминия с кислотами
1. В промышленности из продуктов перегонки нефти
Лабораторные способы :
2. Реакция дигалогенпроизводных алканов с металлическим натрием или магнием (атомы галогенов на концах цепочки — в цепочке не менее 4 атомов углерода)
3. Каталитическое гидрирование ароматических углеводородов — образуется гексан и его производные.
ПРОМЫШЛЕННЫЕ
1. Крекинг алканов:
2. Дегидрирование алканов (450 — 500°С, катализатор)
(можно и в лабораторных условиях):
ЛАБОРАТОРНЫЕ СПОСОБЫ
1. Дегидратация одноатомных спиртов при повышенной температуре (выше 140°C), в присутствии водоотнимающих реагентов (Al2O3, H2SO4) – реакция элиминирования.
(подчиняется правилу Зайцева)
Правило Зайцева:
Отщепление атома водорода в реакциях элиминирования происходит преимущественно от наименее гидрогенизированного атома углерода.
2. Дегидрогалогенирование галогеналканов при действии спиртового раствора щелочи — реакция элиминирования
подчиняются правилу Зайцева
3. Взаимодействие дигалогенпроизводных (атомы галогенов у соседних атомов углерода) с активными металлами с валентностью II (Zn ИЛИ Mg)
4. Гидрирование ацетиленовых углеводородов над катализаторами пониженной активности (Fe)
ПРОМЫШЛЕННЫЙ
1. Каталитическое дегидрирование алканов через стадию образования алкенов.
В промышленности так получают дивинил из бутана.
Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:
2. Синтез Лебедева — дегидрирование и дегидратация этилового спирта (катализатор – смесь оксидов Al2O3,MgO,ZnO)
ЛАБОРАТОРНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ
3. Дегидратация двухатомных спиртов
4. Действие спиртового раствора щелочи на дигалогенпроизводные алканов (атомы галогенов у атомов галогенов 1-3)
ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ
1.Высокотемпературный крекинг метана (пиролиз метана)
Реакцию проводят электродуговым способом, пропуская метан между электродами.
Нагревания быстрое, так как ацетилен при такой температуре может разлагаться на углерод и водород.
2. Частичное окисление метана при высокой температуре (образуется ацетилен, окись углерода, водород)
ЛАБОРАТОРНЫЕ СПОСОБЫ
1. Гидролиз карбида кальция
Карбид
кальция образуется при нагревании угля с оксидом кальция до
2500ºС.
При гидролизе выделяется ацетилен.
2.Взаимодействие спиртового раствора щелочи с дигалогеналканами (2 атома галогенов должны находиться у одного атома углерода — щелочь и спирт в избытке) .
3. Взаимодействие ацетиленидов металлов с галогеналканами (удлинение цепи).
ПОЛУЧЕНИЕ АРЕНОВ
ПРОМЫШЛЕННЫЕ СПОСОБЫ
2. Выделение из нефти и продуктов коксования угля
ЛАБОРАТОРНЫЕ СПОСОБЫ
3. Сплавление солей ароматических кислот с щелочами или натронной известью
4. Дегидрирование циклоалканов (ароматизация)
катализаторы Ni, Pt, Pd, t = 300⁰C
5. Взаимодействие аренов с галогеналканами в присутствии безводного хлорида алюминия или алкенами (реакция Фриделя-Крафтса):
6.Взаимодествие ароматических галогенпроизводных с металлическим натрием (реакция Вюрца-Фиттига (открыта Вюрцем).
P. Фиттиг распространил на область жирно-ароматических углеводородов
ПОЛУЧЕНИЕ СТИРОЛА:
1. Дегидрирование этилбензола
2. Дегидрогалогенирование фенилбромэтана
Тесты ЕГЭ ФИПИ 2015 по теме Углеводороды
Содержание
- Понятие об алканах
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства алканов
- Физические свойства
- Химические свойства
- Получение и применение алканов
- Выводы
Понятие об алканах
Алканы — это углеводороды незамкнутого (нециклического) строения, в молекулах которых атомы углерода соединены только простыми связями. Например:
Задание 18.1. Допишите атомы водорода и попробуйте ответить на вопрос: существует ли углеводород, имеющий большее число атомов водорода в молекуле?
Поэтому-то алканы обычно называют предельными углеводородами, то есть содержащими максимально возможное (предельное) число атомов водорода в молекуле.
Гомологический ряд, номенклатура, изомерия
Алканы образуют гомологический ряд с общей формулой
где n — число атомов углерода в молекуле. Если
- n = 1 → СН4, это метан;
- n = 2 → С2Н6, это этан;
- n = 3 → С3Н8, или СН3–СН2–СН3, это пропан.
Начиная с n = 4 для алканов возможна изомерия, то есть для вещества состава C4H10 существуют два соединения различного строения, а значит, различные по свойствам:
Следующий гомолог с n = 5 имеет уже три изомера, один из них н-пентан, то есть пентан нормального (неразветвлённого) строения.
Задание 18.2. Составьте графические формулы всех изомеров пентана (их три). Назовите эти изомеры.
Строение молекул
Атомы углерода и водорода в молекулах алканов соединены только простыми связями. Это ковалентные, слабо полярные связи.
Все С–Н связи в молекуле метана равноценны и направлены в пространстве к вершинам тетраэдра. Это σ-связи (сигма-связи), очень прочные. Поэтому метан и другие алканы с трудом вступают в химические реакции (на разрыв σ-связей нужно затратить много энергии). Все химические реакции алканов идут в особых условиях (нагревание, присутствие катализатора, освещение и др.), то есть при обычных условиях реакции алканов невозможны.
Свойства алканов
Физические свойства
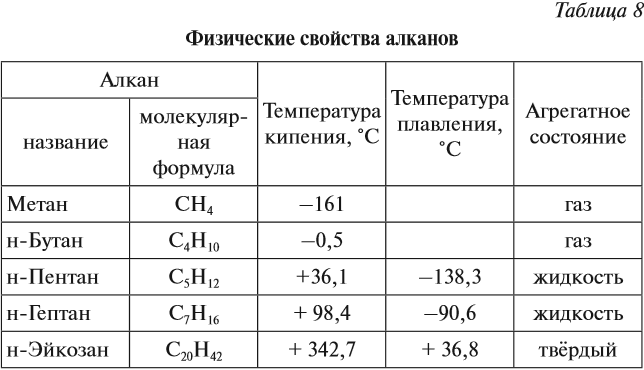
Поскольку все связи в молекулах алканов слабо полярны, то в молекулах отсутствуют какие-либо значительные заряды. Поэтому молекулы алканов слабо притягиваются друг к другу. В результате все алканы — это либо газы, либо летучие жидкости, либо твёрдые легкоплавкие вещества (табл. 8).
Смесь газообразных углеводородов образует природный газ. Начиная с n = 16, алканы являются твёрдыми веществами. Очищенные твёрдые предельные углеводороды называют парафином.
Неполярные углеводороды практически нерастворимы в полярном растворителе, например в воде, но прекрасно растворяются в неполярных растворителях. Таким растворителем является смесь жидких алканов (бензин, керосин). Природная смесь твёрдых, жидких и газообразных углеводородов называется нефтью. Нефть в основном состоит из алканов и циклоалканов. При переработке нефти получают: попутный нефтяной газ, смесь жидких алканов (бензин, керосин), твёрдых алканов (асфальт, парафин) и другие нефтепродукты. Такой способ переработки нефти называется нефтеперегонкой и осуществляется при её нагревании в специальных ректификационных колоннах.
Задание 18.3. Бензин представляет собой смесь алканов с числом атомов углерода от 5 до 9. Составьте их молекулярные формулы.
Химические свойства
Алканы, в принципе, не способны к реакциям присоединения, так как имеют максимально возможное число атомов водорода. Поэтому их называют насыщенными углеводородами.
Для алканов наиболее характерна реакция замещения. В результате такой реакции происходит замещение одного атома водорода алкана на новую группу или на атом (на каждой стадии). Характер химической связи при этом не изменяется.
К таким реакциям относятся:
- Реакция хлорирования, которая происходит под действием солнечного света:
- Реакция нитрования, которая происходит при нагревании:
Обратите внимание: молекулу азотной кислоты в органических реакциях рекомендуется записывать как НО–NO2, так как в результате реакций с ней в молекуле исходного вещества появляется нитрогруппа –NО2.
Для алканов возможны реакции окисления. В растворе они не происходят. Но в присутствии катализаторов алканы окисляются до кислот:
Обратите внимание! Знак [О] означает, что происходит неполное (мягкое) окисление. Окислителями могут быть разные вещества, не только кислород, например, перманганат калия KMnO4.
При полном окислении (горении) любой алкан (и любой углеводород!) превращается в углекислый газ и воду:
Газообразные алканы горят бесцветным пламенем, т. е. сгорают полностью! При этом выделяется много теплоты, поэтому алканы применяются в качестве топлива: природный газ, бензин, керосин, мазут и т. д.
Задание 18.4. Расставьте коэффициенты в уравнении реакции горения.
При нагревании до очень высоких температур в отсутствии кислорода происходит разрушение (крекинг) молекулы углеводорода:
При этом образуются и непредельные углеводороды.
Задание 18.5. Укажите формулы непредельных углеводородов.
Процессы крекинга используют при переработке нефти.
Задание 18.6. Напишите уравнения реакций:
- хлорирования этана;
- нитрования метана;
- горения пентана.
Получение и применение алканов
Алканы широко распространены в природе. Простейший алкан — метан — образуется в результате разложения без доступа воздуха остатков растительных и животных организмов, этот газ выделяется на болотах, поэтому он так и называется: «болотный газ». Метан накапливается в шахтах, где добывают каменный уголь, из-за этого на шахтах иногда бывают взрывы, так как смесь метана с воздухом взрывоопасна. Это следует учитывать и в быту, так как природный газ является источником тепла в газовых плитах. Метан составляет 95–97 % природного газа.
Алканы — ценное сырьё для получения смазочных масел, пластмасс, красок, стиральных порошков и т. д. Смеси алканов — бензин, керосин — топливо для автомобилей, тракторов, ракет, самолётов. Поэтому их получают в больших количествах в основном при переработке нефти и газа.
В лаборатории в небольших количествах алканы можно получить нагреванием соли карбоновой кислоты со щёлочью:
Внимание! Здесь и далее буквой R обозначается любой углеводородный радикал.
Так, метан получают нагреванием ацетата натрия в присутствии щёлочи:
Метан можно получить гидролизом карбида алюминия (см. урок 13.1):
Кроме того, в лаборатории алканы получают синтезом Вюрца из галогенпроизводных под действием натрия:
где R и R1 — предельные радикалы.
Выводы
Алканы — предельные, насыщенные углеводороды, в молекулах которых имеется максимально возможное (предельное) числа атомов углерода. Поэтому состав всех алканов СnH2n+2 и они не способны вступать в реакции присоединения. Все связи в молекулах алканов — неполярные, простые, очень прочные, поэтому алканы с трудом вступают в химические реакции. Это реакции замещения, крекинга, горения и каталитического окисления.




![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)