Тема кодификатора ЕГЭ по химии: Общие научные принципы химического производства на примере промышленного получения аммиака, серной кислоты, метанола.
В этой статье мы рассмотрим принципы химического производства на примере получения аммиака в объеме, достаточном для решения заданий по этой теме в ЕГЭ по химии.
В промышленности аммиак получают по методу Габера – прямым взаимодействием азота и водорода в реакционной колонне:
N2 + 3Н2 ⇄ 2NH3
Реакция азота с водородом обратимая, экзотермическая, гомогенная (газофазная). Для увеличения выхода аммиака необходимо смещать равновесие в сторону продукта. Согласно принципу Ле-Шателье, для смещения равновесия вправо в данной реакции необходимо повышать давление и понижать температуру. Однако низкая температура уменьшит скорость реакции.
Поэтому для повышения скорости реакции температура в процессе поддерживается все-таки высокой, 500-550оС и в присутствии катализатора.
А для смещения равновесия применяют очень высокие давления 15-30 МПа.
В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Рассмотрим процессы, протекающие на разных участках производства аммиака:
1 этап. Трубопровод. В трубопровод подается предварительно подготовленная азотно-водородная смесь (N2:Н2=1:3) в соотношении 1 к 3.
2 этап. Турбокомпрессор. Турбокомпрессор используется для сжатия исходной смеси газов с целью повышения давления. Синтез аммиака проводится при очень высоком давлении (15-30 МПа, или 150-300 атм).
3 этап. Колонна синтеза. В колонне синтеза (контактном аппарате) производится синтез аммиака. Азотно-водородная смесь продавливается через полки с катализатором. Процесс синтеза протекает обратимо (т.е. частично) и является сильно экзотермическим, протекает с большим выделением тепла. Часть выделяющегося тепла расходуется на нагревание поступающей азотоводородной смеси с помощью теплообменников. Смесь, выходящая из колонны синтеза в холодильник, состоит из аммиака (20-30%) и не прорегировавших азота и водорода.
4 этап. Холодильник. В холодильнике реакционная смесь, которая выходит из колонны синтеза, охлаждается и направляется на дальнейшее разделение в сепаратор.
5 этап. Сепаратор. После прохождения холодильника температура реакционной смеси значительно снижается, и аммиак переходит в жидкую фазу. В сепараторе происходит разделение реакционной смеси, жидкий аммиак отделяют от азота и водорода и отправляют на склад.
6 этап. Циркуляционный насос. Циркуляционный насос возвращает не прореагировавшую смесь азота и водорода в контактный аппарат. Благодаря циркуляции удаѐтся довести использование азотводородной смеси (конверсию) до 95%.
Получение одноатомных cпиртов
Гидратация алкенов
В присутствии сильных минеральных кислот, алкены вступают в реакцию гидратации с образованием спиртов:
В случае несимметричных алкенов присоединение происходит в соответствии с правилом Марковникова – атом водорода молекулы воды присоединяется к более гидрированному атому углерода, а гидрокси-группа к менее гидрированному при двойной связи:
Гидрирование (восстановление) альдегидов и кетонов
Гидрирование альдегидов на металлических катализаторах (Pt, Pd или Ni) при нагревании приводит к образованию первичных спиртов:
В аналогичных условиях из кетонов получаются вторичные спирты:
Гидролиз сложных эфиров
При действии на сложные эфиры сильных минеральных кислот они подвергаются гидролизу с образованием спирта и карбоновой кислоты:
Гидролиз сложных эфиров в присутствии щелочей называют омылением. Данный процесс является необратимым и приводит к образованию спирта и соли карбоновой кислоты:
Данный процесс протекает по действием на моногалогенпроизводные углеводородов водного раствора щелочи:
Другие способы получения отдельных представителей одноатомных спиртов
Спиртовое брожение глюкозы
В присутствии некоторых дрожжей, точнее под действием вырабатываемых ими ферментов, возможно образование этилового спирта из глюкозы. При этом в качестве побочного продукта образуется также углекислый газ:
Получение метанола из синтез-газа
Синтез-газом называют смесь угарного газа и водорода. Действием на данную смесь катализаторов, нагрева и повышенных давлений в промышленности получают метанол:
Получение многоатомных спиртов
Реакция Вагнера (мягкое окисление алкенов)
При действии на алкены нейтрального раствора перманганата калия на холоду (0oC) образуются вицинальные двухатомные спирты (диолы):
Схема, представленная выше, не является полноценным уравнением реакции. В таком виде ее проще запомнить, для того чтобы суметь ответить на отдельные вопросы тестовые вопросы ЕГЭ. Однако, если данная реакция попадется в заданиях высокой сложности, то ее уравнение обязательно нужно записывать в полном виде:
Хлорирование алкенов с последующим гидролизом
Данный метод является двустадийным и заключается в том, что на первой стадии алкен вступает в реакцию присоединения с галогеном (хлором или бромом). Например:
А на второй, полученный дигалогеналкан подвергается обработке водным раствором щелочи:
Получение глицерина
Основным промышленным способом получения глицерина является щелочной гидролиз жиров (омыление жиров):
Получение фенола
Трехстадийный метод через хлорбензол
Данный метод является трехстадийным. На первой стадии осуществляют бромирование или хлорирование бензола в присутствии катализаторов. В зависимости от используемого галогена (Br2 или Cl2) в качестве катализатора используется соответствующий галогенид алюминия или железа (III)
На второй стадии полученное выше галогенпроизводное обрабатывается водным раствором щелочи:
На третьем этапе фенолят натрия обрабатывается сильной минеральной кислотой. Фенол вытесняется поскольку является слабой кислотой, т.е. малодиссоциирующим веществом:
Окисление кумола
Получение альдегидов и кетонов
Дегидрирование спиртов
При дегидрировании первичных и вторичных спиртов на медном катализаторе при нагревании получаются альдегиды и кетоны соответственно
Окисление спиртов
При неполном окислении первичных спиртов получаются альдегиды, а вторичных – кетоны. В общем виде схемы такого окисления можно записать как:
и
Как можно заметить неполное окисление первичных и вторичных спиртов приводит к тем же продуктам, что и дегидрирование этих же спиртов.
В качестве окислителей можно использовать оксид меди при нагревании:
Или другие более сильные окислители, например раствор перманганата калия в кислой, нейтральной, или щелочной среде.
Гидратация алкинов
В присутствии солей ртути (часто вместе с сильными кислотами) алкины вступают в реакцию гидратации. В случае этина (ацетилена) образуется альдегид, в случае любого другого алкина — кетон:
Пиролиз солей карбоновых кислот двухвалентных металлов
При нагревании солей карбоновых кислот двухвалентных металлов, например, щелочно-земельных, образуется кетон и карбонат соответствующего металла:
Гидролиз геминальных дигалогенпроизводных
Щелочной гидролиз геминальных дигалогенпроизводных различных углеводородов приводит к альдегидам если атомы хлора были прикреплены к крайнему атому углерода и к кетонам,если не к крайнему:
Каталитическое окисление алкенов
Каталитическим окислением этилена получают ацетальдегид:
Получение карбоновых кислот
Каталитическое окисление алканов
Окисление алкенов и алкинов
Для этого чаще всего используют подкисленный раствор перманганата или дихромата калия. При этом происходит разрыв кратной углерод-углеродной связи:
Окисление альдегидов и первичных спиртов
В этом способе получения карбоновых кислот также наиболее распространенные используемые окислители это подкисленный раствор перманганата или дихромата калия:
С помощью гидролиза тригалогензамещенных углеводородов
На первой стадии тригалогеналкан подвергается обработке водным раствором щелочи. При этом образуется соль карбоновой кислоты:
На второй стадии следует обработка соли карбоновой кислоты сильной минеральной кислотой. Т.к. карбоновые кислоты являются слабыми они легко вытесняются сильными кислотами:
Гидролиз сложных эфиров
Из солей карбоновых кислот
Данная реакция уже была рассмотрена при получении карбоновых кислот посредством гидролиза тригалогенпроизодных (см. выше). Заключается в том, что карбоновые кислоты, являясь слабыми, легко вытесняются сильными неорганическими кислотами:
Специфические методы получения кислот
Получение муравьиной кислоты из угарного газа
Данный метод является промышленным и заключается в том, что на первой стадии угарный газ под давлением при высоких температурах реагирует с безводной щелочью:
а на второй полученный формиат обрабатывают сильной неорганической кислотой:
2HCOONa + H2SO4 > 2HCOOH + Na2SO4
Получение высших карбоновых кислот гидролизом жиров
Данный метод является основным для получения высших карбоновых кислот:
Получение бензойной кислоты окислением гомологов бензола
Автор: С.И. Широкопояс https://scienceforyou.ru/
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
АММИАК NH₃ — бесцветный газ с чрезвычайно острым, характерным, вызывающим слезы запахом
Схема производства аммиака включает следующие стадии:
Вспомогательный материал: катализатор (пористое железо)
1. Основной химический процесс: азотоводородную смесь получают парокислородной конверсией метана:
СН4 + Н2O(г) ↔ СО + ЗН2 — 207 кДж
2СН4+ O2 ↔ 2СО + 4Н2 + 70 кДж
СО + Н2O(г) ↔ СO2 + Н2 + 42 кДж
Газы реагируют при 450—500 °С в присутствии катализатора под давлением 15-106 Па с образованием 10—20% аммиака:
N2 + ЗН2 ↔ 2NН3 + 92 кДж
Данная реакция:
- обратимая
- экзотермическая
- каталитическая
- гетерогенная (катализатор – твердое вещество)
Оптимальные условия:
- температура 400-500 0С
- давление 15-30 МПа
- катализатор – порошкообразное железо с примесью оксидов алюминия и калия
ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ
H2SO4 -бесцветная маслянистая жидкость без запаха плотностью 1,83 г/см3
Пагубно действует на растительные и животные ткани, отнимая от них воду, вследствие чего они обугливаются.
С водой смешивается во всех соотношениях, причём при разбавлении соединения водой происходит сильное разогревание, сопровождающееся разбрызгивание жидкости.
Одна из самых сильных кислот. В водных растворах практически полностью диссоциирует на ионы:
H2SO4 = 2 Н+ + SO42-
Раствор оксида серы (+6) SO3 в серной кислоте называется олеумом H2SO4∙SO3
- S(самородная сера)
- H2S(сероводород)
- Cu2S, ZnS, PbS (цветные металлы)
- CaSO4*2H2O (гипс)
- FeS2 (пирит) – содержание серы 54,3%.
Вспомогательные материалы:
серная кислота (98%), катализатор — оксид ванадия (V).
ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВА
I СТАДИЯ
Обжиг сырья (пирита) и получение оксида серы SO2.
4FeS₂ + 11O₂ = 2Fe₂O₃ + 8SO₂ + Q
(минерал пирит)
Условия
1. Воздух, обогащенный кислородом.
2. t=8000 , теплота экзотермической реакции отводиться.
3. «Кипящий» слой (принцип противотока — увеличение площади соприкосновения).
4. Время обжига — несколько секунд, процесс непрерывный
ПОДГОТОВКА СЫРЬЯ ДЛЯ II СТАДИИ
Прежде чем приступить ко II стадии SO2 очищают от пыли:
Циклон – от крупных частиц пыли.
Электрофильтр – от мелких частиц пыли
Осушить в сушильной башне – поглощается газ концентрированной серной кислотой
Нагреть до t=4000 в теплообменнике
ПРИНЦИПЫ II СТАДИИ (контактный аппарат)
2 SO2 + O2 ↔ 2 SO3 + Q
1. Понижение температуры от 6000С до 4000С.
2. Повышение давления
3. Катализатор V2O5 на керамике.
4. Окисление в «кипящем слое» катализатора.
5. Противоточное движение.
6. Теплообмен.
III СТАДИЯ: ПОГЛОЩЕНИЕ СЕРНОГО ГАЗА (ПОГЛОТИТЕЛЬНАЯ БАШНЯ)
SO3+H2O=H2SO4+Q (t до 300оС)
1. Противоток газа и кислоты
2. Увеличивают площадь соприкосновения (керамические кольца Рашига)
3. Отводят продукты реакции
4. Орошают 98% серной кислотой, образуется олеум (раствор SO3 в H2SO4)
ТРАНСПОРТИРОВКА И ХРАНЕНИЕ СЕРНОЙ КИСЛОТЫ
Транспортируют в железнодорожных и автоцистернах из кислотостойкой стали
Хранят в герметически закрытых емкостях из полимера или нержавеющей стали, покрытой кислотоупорной плёнкой
ПОТРЕБЛЕНИЕ СЕРНОЙ КИСЛОТЫ
1. Производство минеральных удобрений.
2. Производство сульфатов (солей серной кислоты).
3. Производство синтетических волокон.
4. Черная и цветная металлургия.
5. Производство органических красителей.
6. Спирты, кислоты, эфиры(орг. вещества).
7. Пищевая промышленность(патока, глюкоза), эмульгатор (загуститель) Е513.
8. Нефтехимия(минеральные масла).
9. Производство взрывчатых веществ.
ЭКОЛОГИЧЕСКИЙ УЩЕРБ ПРОИЗВОДСТВА
При аварийных выбросах в атмосферу попадают соединения серы: SO2;SO3; H2S; H2SO4; Fe2O3(пыль)
ПОСЛЕДСТВИЯ: «закисление» почв и водоёмов, «металлизация» атмосферы
РЕШЕНИЕ ЭКОЛОГИЧЕСКИХ ПРОБЛЕМ:
1. Непрерывность технологического процесса;
2. Комплексное использование сырья;
3. Совершенствование технологического оборудования.
ПРОИЗВОДСТВО МЕТАНОЛА
Сегодня исходный синтез-газ (сингаз) для синтеза метанола получают в результате конверсии (превращения) углеводородного сырья:
природного газа, коксового газа, жидких углеводородов (нефти, мазута, легкого каталитического крекинга) и твердого топлива (угля, сланцев).
Исходный газ для синтеза метанола можно получить почти из всех видов сырья, которые используют при получении водорода, например в процессах синтеза аммиака. Поэтому производство метанола часто базируется на тех же сырьевых ресурсах, что и производство аммиака и поэтому является составной частью основного химического производства.
Примером такого смешанного производства являются ОАО «Невинномысский Азот», расположенное в г. Невинномысске (Ставропольский край) и НПО «Азот» в г. Новомосковске.
ПОЛУЧЕНИЕ МЕТАНОЛА ИЗ СИНТЕЗ-ГАЗА.
1 стадия:
Конверсия природного газа в синтез-газ:
СН4 +Н2О = СО + 3Н2
метан синтез-газ
2 стадия:
Каталитический синтез метанола из монооксида углерода и водорода
Сырьем для синтеза метанола служит синтез-газ (CO + H2), обогащенный водородом:
Процесс осуществляют на цинк-хромовых и медьсодержащих катализаторах.
На отечественных производствах метанола в основном используют активный цинк-хромовый катализатор (3ZnO-ZnCr2О4) при 380—4000C и давлении 20 – 30 МПа.
Выбирая оптимальный температурный режим и величину давления, необходимо учитывать возможность образования побочных соединений: метана, высших спиртов, кислот, альдегидов, кетонов и эфиров.
Эти реакции обусловливают бесполезный расход синтез-газа и удорожают очистку метанола.
Таким образом, промышленный синтез метилового спирта включает три основные стадии:
1. получение смеси окиси углерода и водорода (синтез-газ);
2. получение метилового спирта-сырца;
3. выделение и очистка метилового спирта (ректификация).
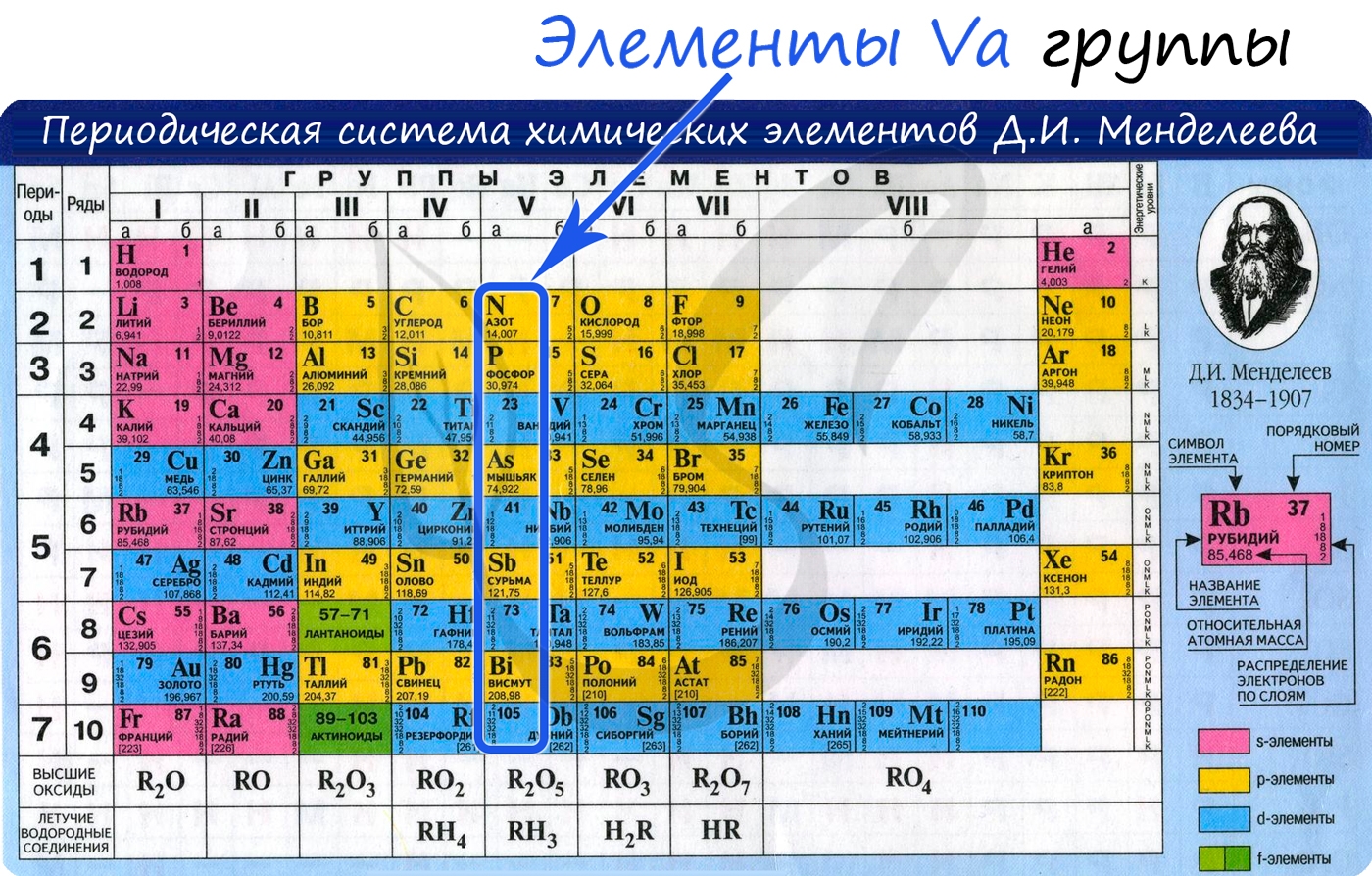
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
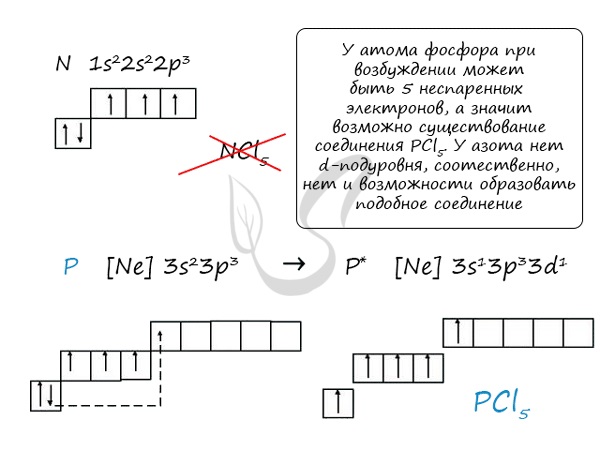
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
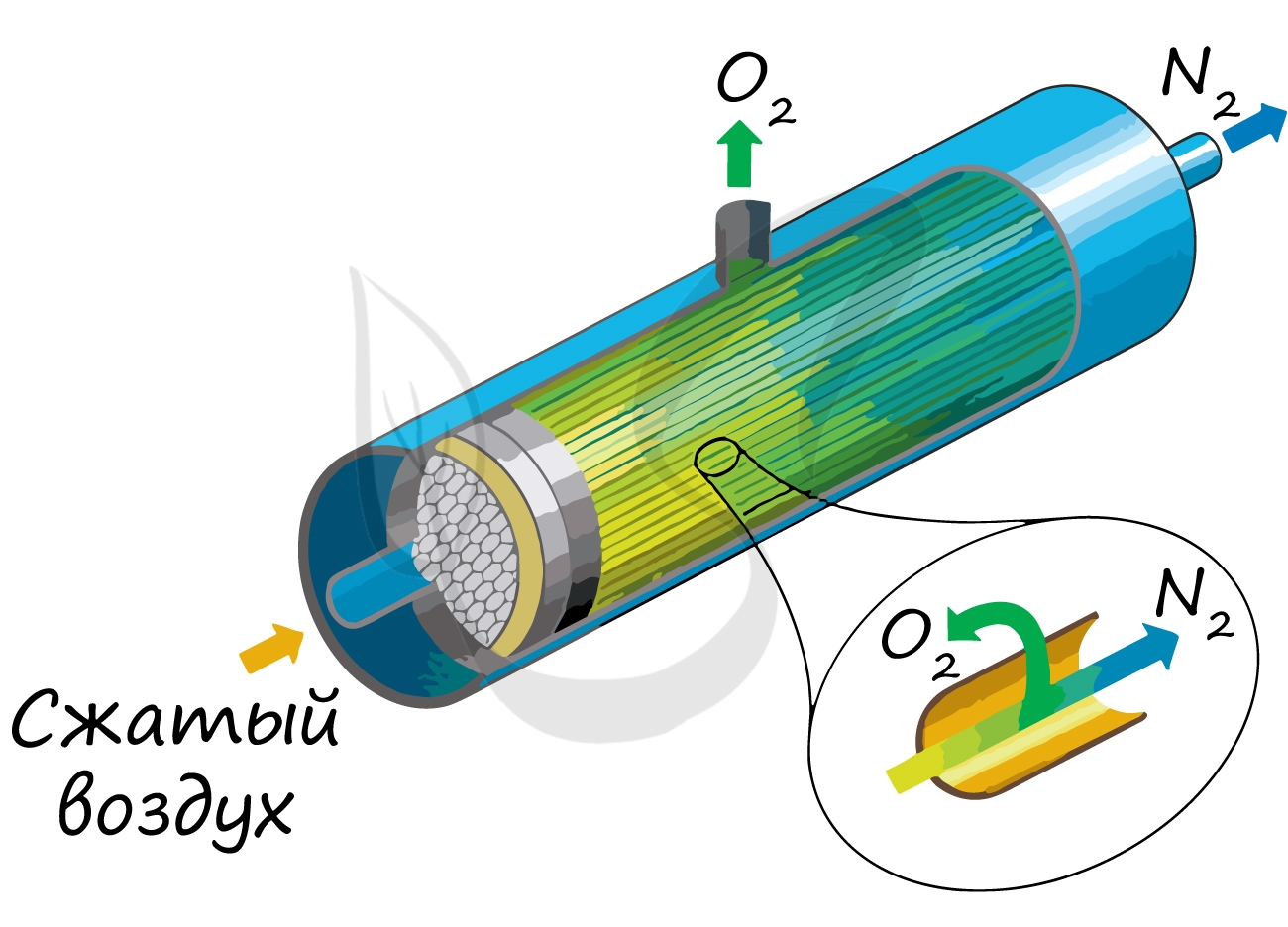
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
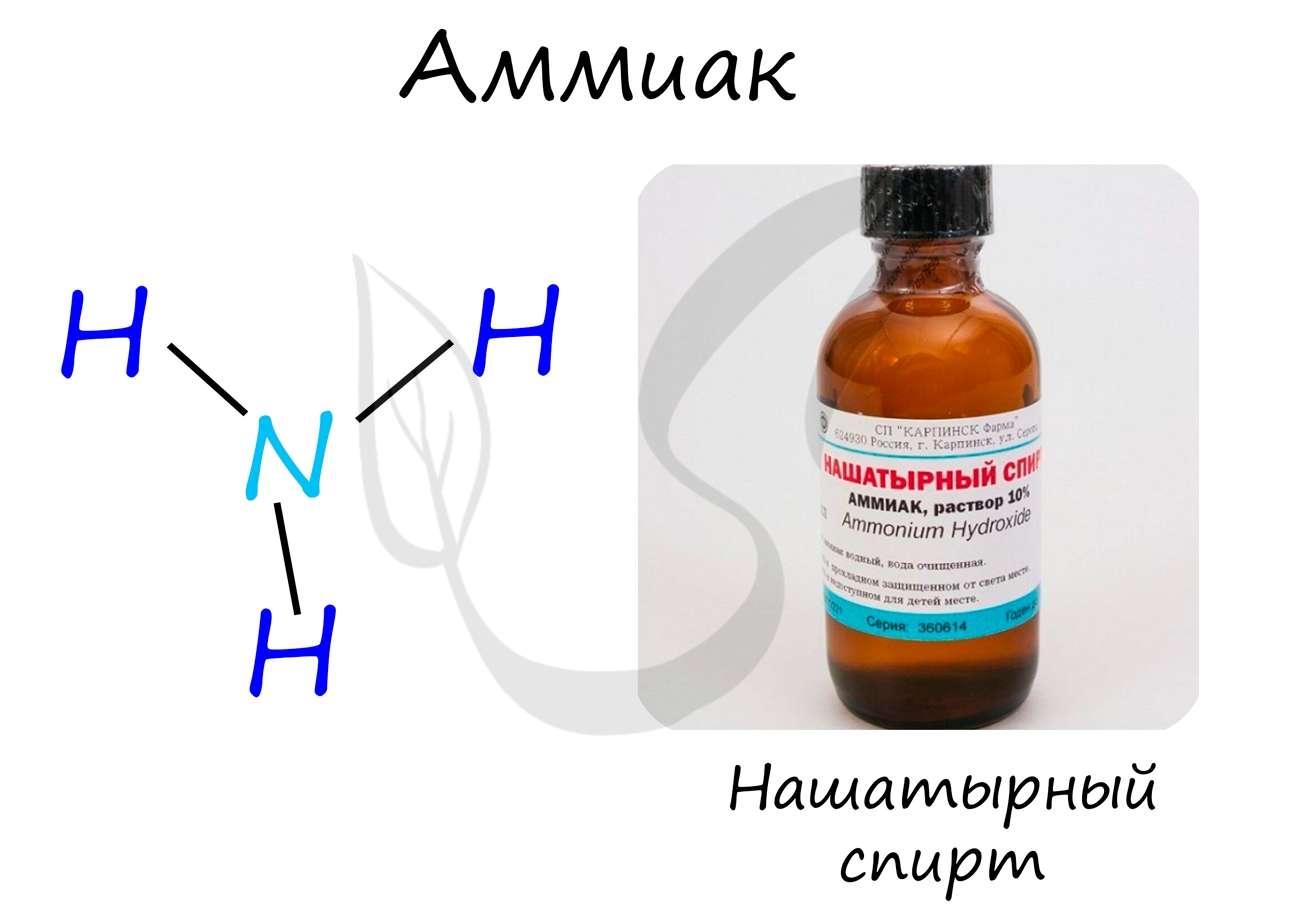
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 + H2O → H3AsO4 + NO↑
As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2—).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Промышленное получение серной кислоты
1) 4FeS
2
+ 11O
2
→ 2Fe
2
O
3
+ 8SO
2
2) 2SO
2
+ O
2
V
2
O
5
→ 2SO
3
3) nSO
3
+ H
2
SO
4
→ H
2
SO
4
·nSO
3 (
олеум
)
Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в «
кипящем слое
«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом.
Из печи выходит печной газ, состав которого: SO
2
, O
2
, пары воды (пирит был влажный) и мельчайшие частицы огарка (оксида железа). Газ очищают от примесей твёрдых частиц (в циклоне и электрофильтре) и паров воды (в сушильной башне).
В контактном аппарате происходит окисление сернистого газа с использованием катализатора
V
2
O
5
( пятиокись ванадия) для увеличения скорости реакции. Процесс окисления одного оксида в другой является обратимым. Поэтому подбирают оптимальные условия протекания прямой реакции — повышенное давление (т.к прямая реакция идет с уменьшением общего объема) и температура не выше 500 С ( т.к реакция экзотермическая).
В поглотительной башне происходит поглощение оксида серы (VI) концентрированной серной кислотой.
Поглощение водой не используют, т.к оксид серы растворяется в воде с выделением большого количества теплоты, поэтому образующаяся серная кислота закипает и превращается в пар. Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H
2
SO
4
·nSO
3
Промышленное получение аммиака
Предварительно получают азотоводородную смесь. Водород получают конверсией метана (из природного газа):
СН
4
+ Н
2
О(г) → СО + ЗН
2
— Q
2СН
4
+ О
2
→ 2СО + 4Н
2
+ Q
СО + Н
2
О(г) → СО
2
+ Н
2
+ Q
Азот получают из жидкого воздуха.
В турбокомпрессоре происходит сжатие смеси до необходимого давления 25·10
6
Па. В колонне синтеза газы реагируют при 450—500 °С в присутствии катализатора (пористое железо с примесями Al
2
O
3
и K
2
O) :
N
2
+ 3H
2
↔ 2NH
3
+ 92 кДж (выход 10—20% аммиака)
Образующийся аммиак отделяют от непрореагировавших азота и водорода сжижением в холодильнике, возвращая непрореагировавшую азотоводородную смесь в колонну синтеза.
Процесс непрерывный, циркуляционный.
Применение: производство азотных удобрений, взрывчатых веществ, пластических масс и др.
Производство метилового спирта
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Современный способ:
Сырье: синтез-газ — смесь оксида углерода (II) с водородом (1:2).
Вспомогательные материалы: катализаторы (ZnO и CuO).
Основной химический процесс: синтез-газ при температуре 250 °С и давлении 7 МПа превращается каталитически в метанол:
СО + 2Н
2
↔ СНзОН + Q
Особенности технологического процесса: при прохождении газовой смеси через слой катализатора образуется 10—15% метанола, который конденсируют, а непрореагировавшую смесь смешивают со свежей порцией синтез — газа и после нагревания снова направляют в слой катализатора (циркуляция). Общий выход — 85%.
Условия проведения синтеза метанола и аммиака при среднем давлении сходны, а сырье (природный газ) общее для обоих процессов. Поэтому чаще всего производства метанола и аммиака объединяют (азотно-туковые заводы).
Чтобы поделиться, нажимайте
Азот – элемент 2-го периода V А-группы Периодической системы, порядковый номер 7. Электронная формула атома [2He]2s22p3, характерные степени окисления 0,-3, +3 и +5, реже +2 и +4 и др.
Шкала степеней окисления у азота:
+5 — N2O5, NO3, NaNO3, AgNO3
+4 — NO2
+3 – N2O3, NO2, HNO2, NaNO2, NF3
+2 — NO
+1 – N2O
0 — N2
-3 — NH3, NH4, NH3 * H2O, NH2Cl, Li3N, Cl3N.
Азот обладает высокой электроотрицательностью (3,07), третий после F и O. Проявляет типичные неметаллические (кислотные) свойства, образуя при этом различные кислородсодержащие кислоты, соли и бинарные соединения, а так же катион аммония NH4 и его соли.
В природе – семнадцатый по химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов.
Азот N2. Простое вещество. Состоит из неполярных молекул с очень устойчивой ˚σππ-связью N≡N, этим объясняется химическая инертность элемента при обычных условиях.


Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2).
Главная составная часть воздуха 78,09% по объему, 75,52 по массе. Из жидкого воздуха азот выкипает раньше, чем кислород. Малорастворим в воде (15,4 мл/1 л H2O при 20 ˚C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N2, реагирует с фтором и в очень малой степени – с кислородом:
N2 + 3F2 = 2NF3, N2 + O2 ↔ 2NO
Обратимая реакция получения аммиака протекает при температуре 200˚C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe, F2O3, FeO, в лаборатории при Pt )
N2 + 3H2 ↔ 2NH3 + 92 кДж
В соответствии с принципом Ле-Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450-500 ˚C, достигая 15%-ного выхода аммиака. Непрориагировавшие N2 и H2 возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Получение в промышленности – фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2C(кокс) + O2 = 2CO при нагревании. В этих случаях получают азот, содержащий так же примеси благородных газов (главным образом аргон).
В лаборатории небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
N-3H4N+3O2(T) = N20 + 2H2O (60-70)
NH4Cl(p) + KNO2(p) = N20↑ + KCl +2H2O (100˚C)
Применяется для синтеза аммиака. Азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
Аммиак NH3. Бинарное соединение , степень окисления азота равна – 3. Бесцветный газ с резким характерным запахом. Молекула имеет строение незавершенного тетраэдра [: N(H)3] (sp3-гибридизация). Наличие у азота в молекуле NH3 донорской пары электронов на sp3-гибридной орбитали обуславливает характерную реакцию присоединения катиона водорода, при этом образуется катион аммония NH4.

Сжижается под избыточным давлением при комнатной температуре. В жидком состоянии ассоциирован за счет водородных связей. Термически неустойчив. Хорошо растворим в воде (более 700 л/1 л H2O при 20˚C); доля в насыщенном растворе равна 34% по массе и = 99% по объему, pH= 11,8.
Весьма реакционноспособный, склонен к реакциям присоединения. Сгорает в кислороде, реагирует с кислотами. Проявляет восстановительные (за счет N-3) и окислительные (за счет H+1) свойства. Осушается только оксидом кальция.
Качественные реакции – образование белого «дыма» при контакте с газообразным HCl, почернение бумажки, смоченной раствором Hg2(NO3)2.
Промежуточный продукт при синтезе HNO3 и солей аммония. Применяется в производстве соды, азотных удобрений, красителей, взрывчатых веществ; жидкий аммиак – хладагент. Ядовит.
Уравнения важнейших реакций:
2NH3(г) ↔ N2 + 3H2
NH3(г) + H2O ↔ NH3 * H2O (р)↔ NH4++ OH–
NH3(г) + HCl(г) ↔ NH4Cl(г) белый «дым»
4NH3 + 3O2 (воздух) = 2N2 + 6 H2O (сгорание)
4NH3 + 5O2 = 4NO+ 6 H2O (800˚C, кат. Pt/Rh)
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O (500˚C)
2 NH3 + 3Mg = Mg3N2 +3 H2 (600 ˚C )
NH3(г) + CO2(г) + H2O = NH4HCO3 (комнатная температура, давление)
Получение. В лаборатории – вытеснение аммиака из солей аммония при нагревании с натронной известью (NaOH + CaO):
NH4Cl NH3
Или кипячение водного раствора аммиака с последующим осушением газа.
В промышленности аммиак получают из азота (см.) с водородом. Выпускается промышленностью либо в сжиженном виде, либо в виде концентрированного водного раствора под техническим названием аммиачная вода.
Гидрат аммиака NH3 H2O. Межмолекулярное соединение. Белый, в кристаллической решетке – молекулы NH3 и H2O, связанные слабой водородной связью NH3N .. HOH. Присутствует в водном растворе аммиака, слабое основание (продукты диссоциации – катион NH4 и анион OH). Катион аммония имеет правильно-тетраэндрическое строение (sp3-гибридизация). Термически неустойчив, полностью разлагается при кипячении раствора. Нейтрализуется сильными кислотами. Проявляет восстановительные свойства (за счет N-3) в концентрированном растворе. Вступает в реакцию ионного обмена и комплексообразования.
Качественная реакция – образование белого «дыма» при контакте с газообразным HCl. Применяется для создания слабощелочной среды в растворе, при осаждении амфотерных гидроксидов.
в 1 М растворе аммиака содержится в основном гидрат NH3 H2O и лишь 0,4% ионов NH4 OH (за счет диссоциации гидрата); таким образом, ионный «гидроксид аммония NH4 OH» практически не содержится в растворе, нет такого соединения и в твердом гидрате.
Уравнения важнейших реакций:
NH3 H2O (конц.) = NH3↑ + H2O (кипячение с NaOH)
NH3 H2O + HCl (разб.) = NH4Cl + H2O
3(NH3 H2O) (конц.) + CrCl3 = Cr(OH)3↓ + 3 NH4Cl
8(NH3 H2O) (конц.) + 3Br2(p) = N2↑ + 6 NH4Br + 8H2O (40-50˚C)
2(NH3 H2O) (конц.) + 2KMnO4 = N2↑ + 2MnO2↓ + 4H2O + 2KOH
4(NH3 H2O) (конц.) + Ag2O = 2[Ag(NH3)2]OH + 3H2O
4(NH3 H2O) (конц.) + Cu(OH)2 + [Cu(NH3)4](OH)2 + 4H2O
6(NH3 H2O) (конц.) + NiCl2 = [Ni(NH3)6]Cl2 + 6H2O
Разбавленный раствор аммиака (3-10%-ный) часто называют нашатырным спиртом (название придумано алхимиками), а концентрированный раствор (18,5 – 25%-ный) – аммиачный раствор (выпускается промышленностью).
Задание:
изучите
материал, напишите уравнения реакций по схемам, расставьте коэффиценты.
Аммиак
—
NH3
1. Строение молекулы
— структура треугольной пирамиды;
— атом азота в sp3-гибридизации;
— одна неподеленная электронная пара на атоме азота;
— химическая связь ковалентная полярная, в жидком
состоянии между молекулами водородные связи;
— с.о. на атоме азота = -3.
2.
Физические свойства
Бесцветный
газ с резким запахом («нашатырного спирта»), в 14,5 раз легче воздуха, очень
хорошо растворимый в воде (в 1 V Н2О – 700 V NH3 при
комн. t)
Аммиачная вода — 18,5 – 25%-ный раствор
Нашатырный спирт – 3 – 10%-ный
3. Получение
В
промышленности – синтез из простых веществ (обратимая,
экзотермическая, каталитическая)
Азот +
водород ®
Сырье — азотоводородная
смесь
(азот – фракционная перегонка жидкого воздуха, водород – конверсия метана(из
природного газа)) подвергают тщательной очистке
Условия:р=25*106
Па (300 атм.), Т=450-500 0С, кат. – губчатое Fe, Pt.
Давление
азотоводородной смеси создается при помощи турбокомпрессора. Реакцию проводят в
колене синтеза. Теплоту, выделяющуюся при реакции используют для прогревания
смеси азота и водорода (принцип теплообмена).
Образующиеся NH3 и
непрореагировавшие газы поступают в холодильник (NH3 сжижается)
=> сепаратор
(отделяется от непрореагировавших газов) ==> склад готовой продукции.
Оставшаяся смесь с
помощью циркуляционного компрессора с новой порцией сырья в колонну синтеза (принцип
циркуляции) (h(NH3) = 95%).
В
лаборатории – нагревание солей аммония со щелочью
Хлорид аммония +
гидроксид кальция ®
Собирают методом
вытеснения воздуха в перевернутый сосуд, доказательство наличия (посинение
влажной индикаторной бумаги, по запаху, «дым без огня»)
4. Химические
свойства
1) с водой
NH3(г) + H2O ↔ NH3
* H2O (р)↔ NH4++ OH–
слабое
основание, среда
раствора – щелочная, изменяет окраску индикаторов
2) с кислотами ® соли аммония (хим.связь образуется по донорно-акцепторному
механизму)
NH3
+ соляная кислота ® NH3 +
серная кислота ®
NH3
+ серная кислота(изб) ® NH3 + СО2
+ Н2О ®
NH3
+ СО2(изб) + Н2О ® NH3
+ фосфорная к-та ®
NH3
+ уксусная кислота ® NH3 +
уксусная к-та ®(при
t)
3) c
кислородом
NH3
+ кислород ®
(сгорание)
NH3
+ кислород ®
(каталитическое окисление, кат Pt)
4)
восстанавливает малоактивные металлы из их оксидов при нагревании
аммиак
+ оксид меди (II) ®
5) с
растворами солей, если образуется ¯
Аммиак
+ вода + сульфат железа (III) ®
Аммиак
+ вода + хлорид хрома (III) ®
6)
комплексообразование (донорно-акцепторн мех-зм)
Сульфат
меди (II) + аммиак ®
Гидроксид
меди (II) + аммиак ®
Нитрат
серебра + аммиак + вода ®
Хлорид
серебра + аммиак ®
6) с
различными окислителями – восстановительные свойства
(чаще до N2)
Аммиак
+ хлор ®
Аммиак
+ пероксид водорода ®
Аммиак
+ перманганат калия ®
7) с
активными металлами ® амиды или нитриды
NH3
+ Na ®
NaNH2 + H2O
NH3
+ Mg®
Mg3N2 + H2O
Амиды и нитриды
легко гидролизуются
NaNH2 + H2O ®
Mg3N2
+ H2O ®

углекислым газом ®
карбамид или мочевина
NH3 + СО2 ® (NH2)2СО
+ H2O
9) с
органическими веществами
+
карбоновые кислоты ®
+
спирты ®
+
галогеналканы ®
+
хлорбензол ®
+
хлоруксусная кислота ®
5. Качественные реакции – образование
белого «дыма» при контакте с газообразным HCl, почернение бумажки,
смоченной раствором Hg2(NO3)2.
6. Применение
Промежуточный продукт при синтезе азотной
кислоты и солей аммония. Применяется в производстве соды,
азотных удобрений (аммиачная селитра – NH4NO3.мочевины (NH2)2СО
и др), красителей, взрывчатых веществ, уротропина, синтетических волокон (нейлона и капрона), в медицине, в быту. Жидкий аммиак в качестве хладагента в промышленных холодильных установках,
в качестве отбеливателя при очистке и крашении хлопка, шерсти и шелка.


![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
























