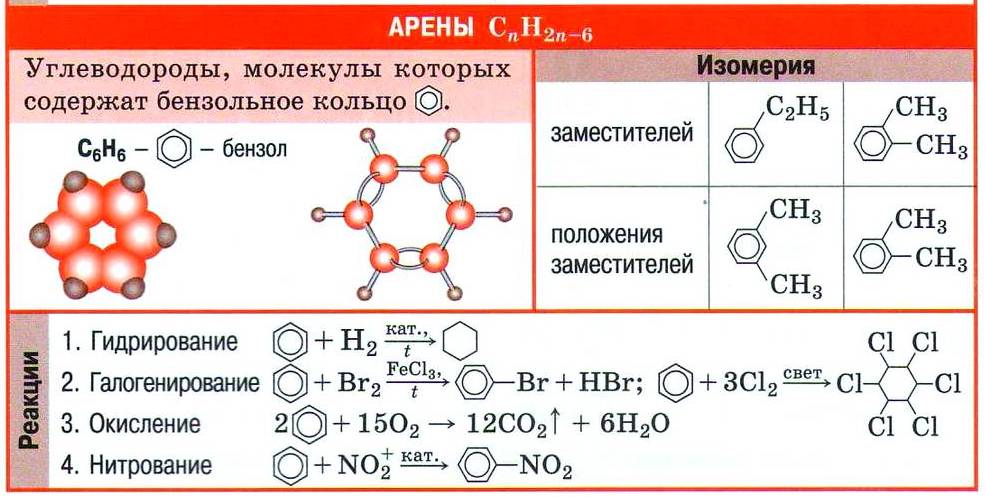
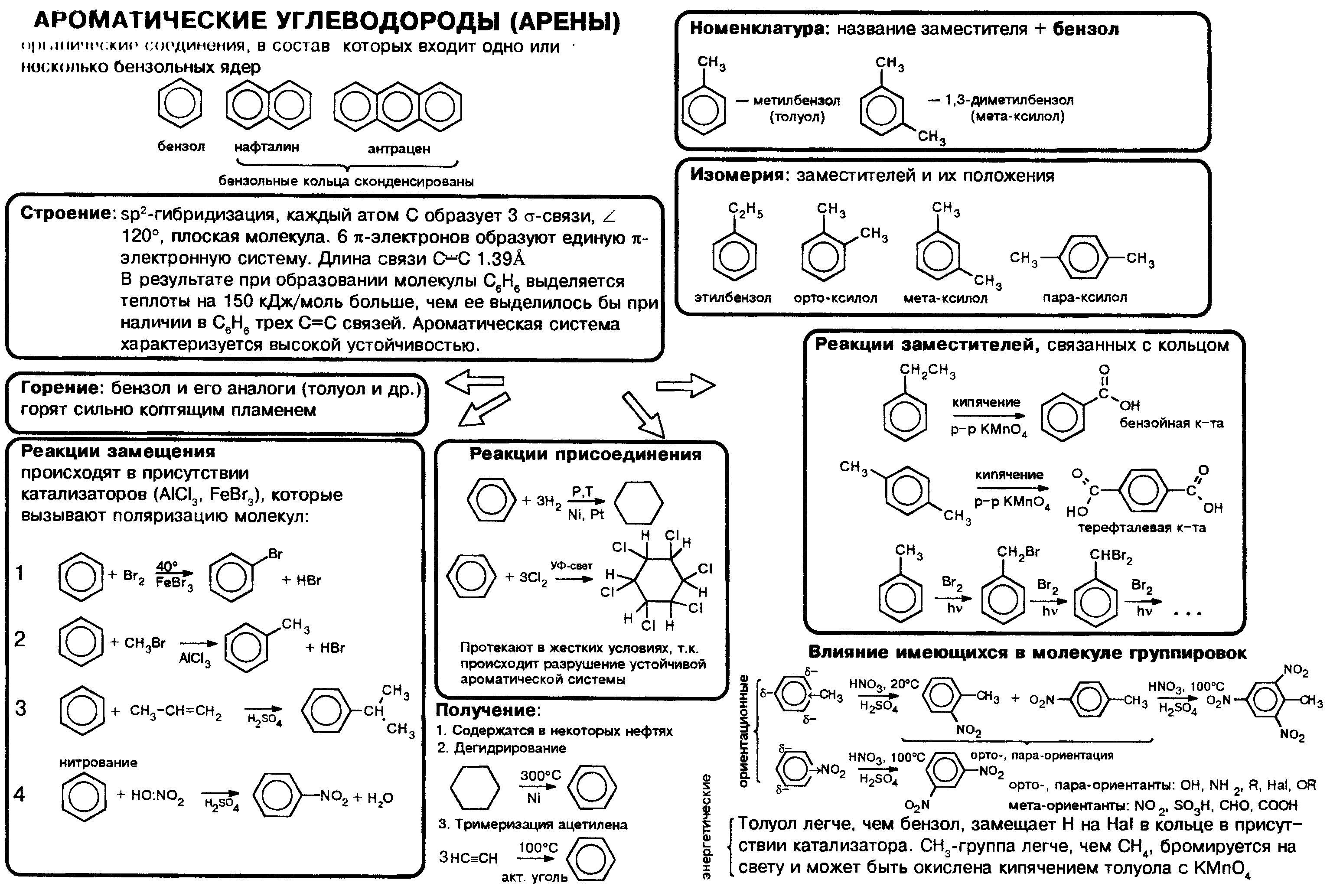
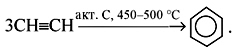Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
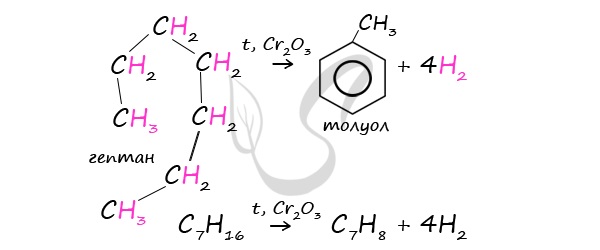
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
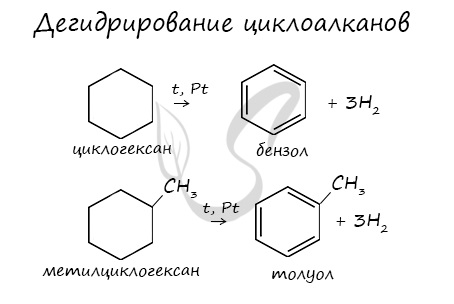
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород
Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород
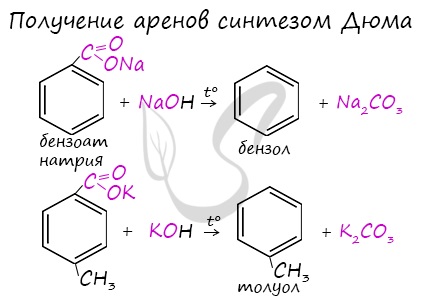
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
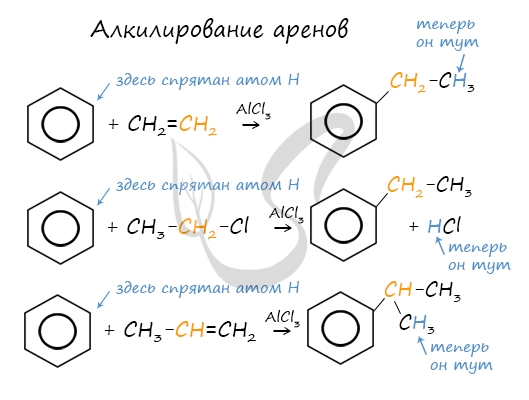
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
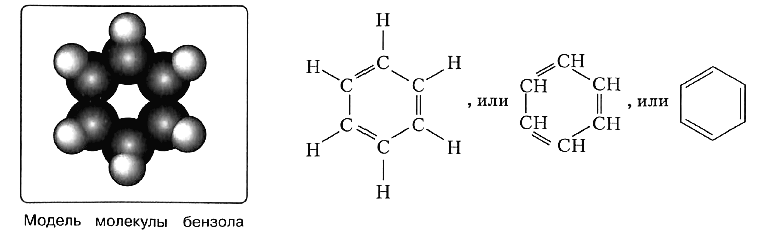
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец.
Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6.
Общая формула их гомологического ряда — CnH2n-6.
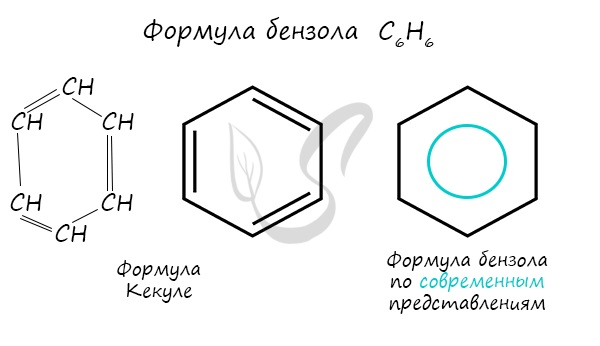
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям
двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2
гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол),
этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей,
то выбирают кратчайший путь между ними.
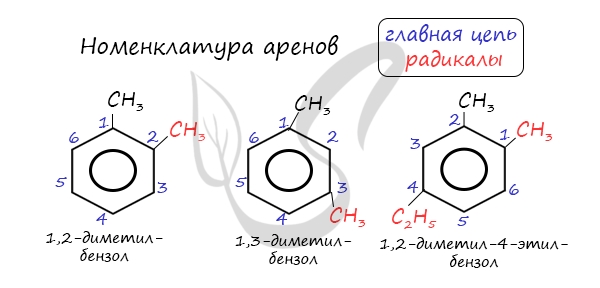
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном
кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 
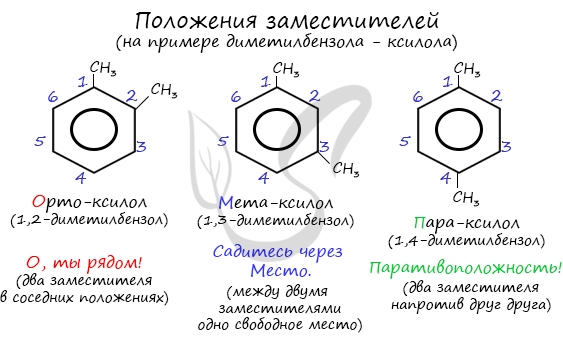
Получение аренов
Арены получают несколькими способами:
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород — бензол.
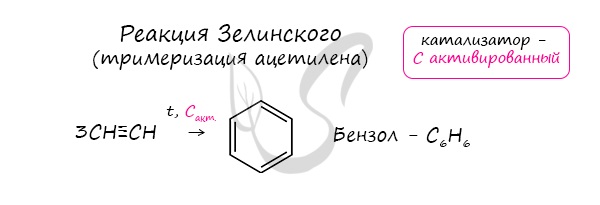
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге
можно добиться образования 1,3,5-триметилбензола.
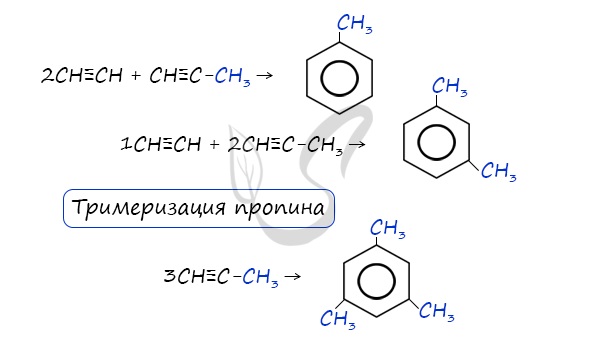
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
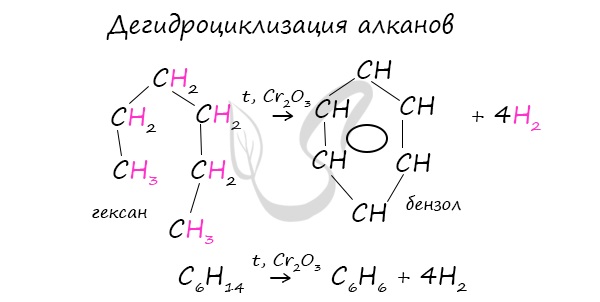
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен,
с теми же заместителями, которые были у циклоалкана.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность
делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
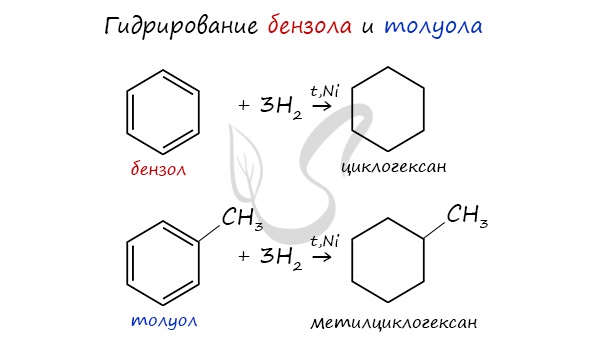
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце
и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор,
то образуется хлорбензол.
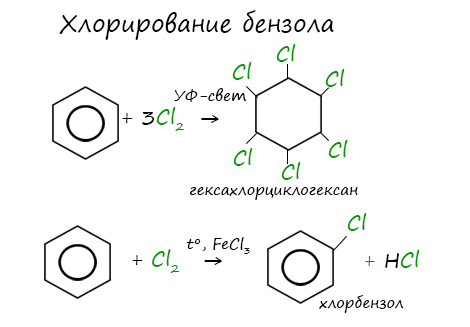
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
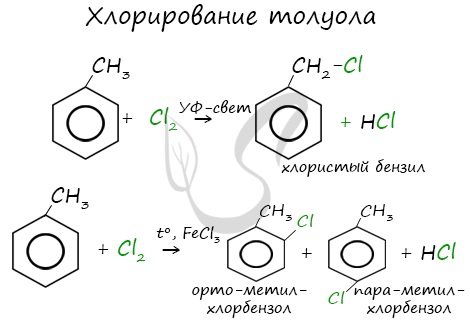
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
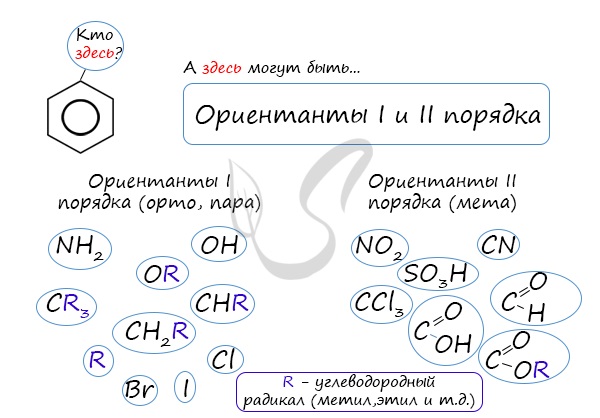
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3,
CHO, COOH, COOR.
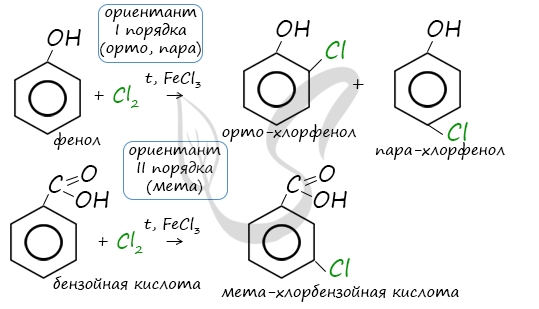
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях.
А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
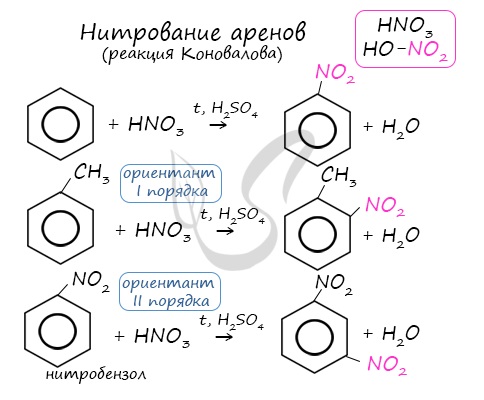
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты,
обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом
углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
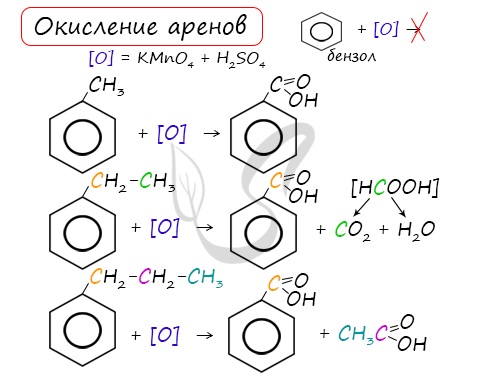
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной
кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
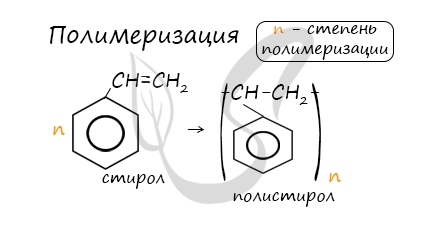
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Чтобы поделиться, нажимайте
Получение аренов (бензола и его гомологов)
В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
C6H5-COONa + NaOH t → C6H6 + Na2CO3
бензоат натрия
2. Реакция Вюрца-Фиттинга: (здесь Г – галоген)
С6H5-Г + 2Na + R-Г → C6H5—R + 2NaГ
С6H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:
C6H14 t, kat→ C6H6 + 4H2

2. Тримеризация ацетилена (только для бензола) – р. Зелинского:
3С2H2 600°C, акт. уголь → C6H6
3. Дегидрированием циклогексана и его гомологов:
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов
C6H12 t, kat→ C6H6 + 3H2

C6H11—CH3 t, kat→ C6H5—CH3 + 3H2
метилциклогексан толуол
4. Алкилирование бензола (получение гомологов бензола) – р Фриделя-Крафтса.
C6H6 + C2H5-Cl t, AlCl3→ C6H5-C2H5 + HCl
хлорэтан этилбензол
Применение ароматических углеводородов
Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол).
Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто-, мета- и пара- ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений.
п-Ксилол используется при получении полимерного материала лавсан, из которого изготавливают синтетические волокна и пленки.
Изопропилбензол (кумол) С6Н4-СН(СН3)2 – исходное вещество для получения фенола и ацетона.
Винилбензол (стирол) C6H5-CН=СН2 используется для получения ценного полимерного материала полистирола.
4.1.7. Основные способы получения углеводородов.
Углеводороды разных классов (алканы, алкены, алкины, алкадиены, арены) можно получать различными способами.
Получение алканов
Крекинг алканов с изначально большей длиной цепи
Процесс, используемый в промышленности, протекает в интервале температур 450-500oC в присутствии катализатора и при температуре 500-700oC в отсутствие катализатора:
Важность промышленного процесса крекинга заключается в том, что он позволяет повысить выход бензина из тяжелых фракций нефти, которые не представляют существенной ценности сами по себе.
Гидрирование непредельных углеводородов
- алкенов:
- алкинов и алкадиенов:
Газификация каменного угля
в присутствии никелевого катализатора при повышенных температуре и давлении может быть использована для получения метана:
Процесс Фишера-Тропша
С помощью данного метода могут быть получены предельные углеводороды нормального строения, т.е. алканы. Синтез алканов осуществляют, используя синтез-газ (смеси угарного газа CO и водорода H2), который пропускают через катализаторы при высоких температуре и давлении:
Реакция Вюрца
С помощью данной реакции могут быть получены углеводороды с большим числом атомов углерода в цепи, чем в исходных углеводородах. Реакция протекает при действии на галогеналканы металлического натрия:
Декарбоксилирование солей карбоновых кислот
Сплавление твердых солей карбоновых кислот со щелочами приводит к реакции декарбоксилирования, при этом образуются углеводород с меньшим числом атомов углерода и карбонат металла (реакция Дюма):
Гидролиз карбида алюминия
Взаимодействие карбида алюминия с водой, а также кислотами-неокислителями приводит к образованию метана:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Получение алкенов
Крекинг алканов
Реакция в общем виде уже была рассмотрена выше (получение алканов). Пример реакции крекинга:
Дегидрогалогенирование галогеналканов
Дегидрогалогенирование галогеналканов протекает при действии на них спиртового раствора щелочи:
Дегидратация спиртов
Данный процесс протекает в присутствии концентрированной серной кислоты и нагревании до температуры более 140оС:
Обратите внимание, что и в случае дегидратации, и в случае дегидрогалогенирования отщепление низкомолекулярного продукта (воды или галогеноводорода) происходит по правилу Зайцева: водород отщепляется от менее гидрированного атома углерода.
Дегалогенирование вицинальных дигалогеналканов
Вицинальными дигалогеналканами называют такие производные углеводородов, у которых атомы хлора прикреплены к соседним атомам углеродной цепи.
Дегидрогалогенирование вицинальных галогеналканов можно осуществить, используя цинк или магний:
Дегидрирование алканов
Пропускание алканов над катализатором (Ni, Pt, Pd, Al2O3 или Cr2O3) при высокой температуре (400-600оС) приводит к образованию соответствующих алкенов:
Получение алкадиенов
Дегидрирование бутана и бутена-1
В настоящий момент основным методом производства бутадиена-1,3 (дивинила) является каталитическое дегидрирование бутана, а также бутена-1, содержащихся в газах вторичной переработки нефти. Процесс проводят в присутствии катализатора на основе оксида хрома (III) при 500—650°С:
Действием высоких температур в присутствии катализаторов на изопентан (2-метилбутан) получают промышленно важный продукт – изопрен (исходное вещество для получения так называемого «натурального» каучука):
Метод Лебедева
Ранее (в Советском Союзе) бутадиен-1,3 получали по методу Лебедева из этанола:
Дегидрогалогенирование дигалогензамещенных алканов
Осуществляется действием на галогенпроизводные спиртового раствора щелочи:
Получение алкинов
Получение ацетилена
Пиролиз метана
При нагревании до температуры 1200-1500оС метан подвергается реакции дегидрирования с одновременным удваиванием углеродной цепи – образуются ацетилен и водород:
Гидролиз карбидов щелочных и щелочноземельных металлов
Действием на карбиды щелочных и щелочно-земельных металлов воды или кислот-неокислителей в лаборатории получают ацетилен. Наиболее дешев и, как следствие, наиболее доступен для использования карбид кальция:
Дегидрогалогенирование дигалогеналканов
Получение гомологов ацетилена
Дегидрогалогенирование дигалогеналканов:
Дегидрирование алканов и алкенов:
Получение ароматических углеводородов (аренов)
Декарбоксилирование солей ароматических карбоновых кислот
Сплавлением солей ароматических карбоновых кислот со щелочами удается получить ароматические углеводороды с меньшим числом атомов углерода в молекуле по сравнению с исходной солью:
Тримеризация ацетилена
При пропускании ацетилена при температуре 400°C над активированным углем с хорошим выходом образуется бензол:
Аналогичным способом можно получать симметричные триалкилзамещенные бензолы из гомологов ацетилена. Например:
Дегидрирование гомологов циклогексана
При действии на циклоалканы с 6-ю атомами углерода в цикле высокой температуры в присутствии платины происходит дегидрирование с образованием соответствующего ароматического углеводорода:
Дегидроциклизация
Также возможно получение ароматических углеводородов из углеводородов нециклического строения при наличии углеродной цепи с длиной в 6 или более атомов углерода (дегидроциклизация). Процесс осуществляют при высоких температурах в присутствии платины или любого другого катализатора гидрирования-дегидрирования (Pd, Ni):
Алкилирование
Получение гомологов бензола алкилированием ароматических углеводородов хлорпроизоводными алканов, алкенами или спиртами:
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ.
Это циклические углеводороды с тремя двойными сопряженными связями в цикле.
Бензол С6Н6 – родоначальник ароматических углеводородов. Впервые выделен Фарадеем в 1825г из светильного газа.
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 1200.
Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
р-Электроны всех атомов углерода образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между одинарной и двойной.

Общая формула гомологического ряда бензола CnH2n-6 (n ≥ 6).
Вещество
Название по номенклатуре
Историческое название
С6Н5-СН3
метилбензол
Толуол
С6Н5-СН2-СН3
этилбензол
—
СН3-С6Н4-СН3
диметилбензол
ксилол
С6Н5-СН(СН3)2
изопропилбензол
кумол

Для дизамещенных бензолов
R-C6H4-R’
используется также другой способ построения названий:
орто— (о-) заместители у соседних атомов углерода кольца, 1,2-;
мета— (м-) заместители через один атом углерода (1,3-);
пара-(п-) заместители на противоположных сторонах кольца(1,4-).
Изомерия у аренов.
Определяется числом заместителей, их расположением в бензольном кольце и возможностью изомерии углеродного скелета в заместителях, содержащих более трёх атомов углерода.

ПОЛУЧЕНИЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
1. Дегидрирование циклоалканов
2. Дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора
3.Тримеризация ацетилена над активированным углем (реакция Зелинского):
4.Алкилирование бензола галогеналканами в присутствии безводного хлорида алюминия или алкенами:
ФИЗИЧЕСКИЕ СВОЙСТВА.
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом, с плотностью менее 1 г/мл. Огнеопасны. Нерастворимы в воде, но хорошо растворимы в неполярных растворителях. Бензол и толуол ядовиты (поражают почки, печень, костный мозг, кровь).
Высшие арены – твердые вещества.
ХИМИЧЕСКИЕ СВОЙСТВА.
Из-за наличия делокализованой -системы арены мало характерны реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции электрофильного замещения атомов водорода, связанных с циклом — SЕ.
1. РЕАКЦИИ ПРИСОЕДИНЕНИЯ К АРЕНАМ
В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
а. Гидрирование. Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
б. Радикальное хлорирование. При радикальном хлорировании бензола получается гексахлорциклогексан — «гексахлоран» (средство борьбы с вредными насекомыми).
2. РЕАКЦИИ РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ АТОМОВ ВОДОРОДА В БОКОВОЙ ЦЕПИ:
В случае гомологов бензола при действии хлора на свету или при нагревании происходит реакция радикального замещения в боковой цепи:
3. Реакции окисления аренов
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко. При действии раствора KMnO4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи, при этом от боковой цепи остаётся карбоксильная группа, а остальное – переходит в углекислый газ:
5С6Н5—СН3 +6КМnO4+9H2SO4 5C6H5—COOH +6MnSO4+3K2SO4+14H2O
5С6Н5—CH2—CH3 +12КМnO4+18H2SO45C6H5—COOH +5СО2+12MnSO4+6K2SO4+28H2O
Если окисление идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты и карбонат калия:
С6Н5—СН2—СН3+4KMnO4C6H5 – COOK+K2CO3+4MnO2+KOH+2H2O
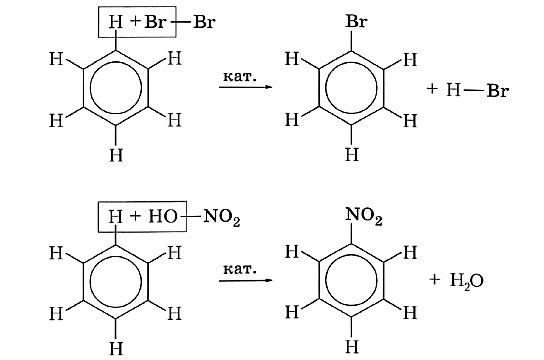
4.РЕАКЦИИ ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ
1. Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п.:
2. Нитрование
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
3. Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование) происходит под действием алкилгалогенидов в присутствии катализаторов AlCl3, FeBr3или алкенов в присутствии фосфорной кислоты:
ЗАМЕЩЕНИЕ В АЛКИЛБЕНЗОЛАХ
Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. Например, при нитровании толуола С6Н5-CH3 может происходить замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола, причём в орто- и пара- положениях:
ОРИЕНТИРУЮЩЕЕ ДЕЙСТВИЕ ЗАМЕСТИТЕЛЕЙ
В БЕНЗОЛЬНОМ КОЛЬЦЕ.
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные (первого рода) и электроноакцепторные (второго рода).
ЭЛЕКТРОНОДОНОРНЫЕ ЗАМЕСТИТЕЛИ проявляют повышают электронную плотность в сопряженной системе.
К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях:
Алкильные группы не могут участвовать в сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности.
Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара— положениях бензольного кольца и называются заместителями (ориентантами) первого рода:
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения:
ЭЛЕКТРОНОАКЦЕПТОРНЫЕ ЗАМЕСТИТЕЛИ снижают электронную плотность в сопряженной системе.
К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, но меньше всего она уменьшается в мета-положениях:
Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца.
Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:
СТИРОЛ (винилбензол) С8Н8
– производное бензола, которое имеет в своём составе двойную связь в боковом заместителе, поэтому он НЕ относится к гомологическому ряду аренов.
Получение стирола:
-
Дегидрирование этилбензола: С6Н5-СН2-СН3 -(t,кат) C6H5—CH=CH2 + H2
-
Дегидрогалогенирование фенилбромэтана:
C6H5-CH-CH3 +KOH –(спирт) C6H5-CH=CH2 +KBr +H2O
│
Br
Свойства стирола:
Стирол проявляет свойства, характерные для алкенов – реакции присоединения, окисления, полимеризации.
Реакции присоединения к стиролу: протекают в соответствии с правилом Марковникова.
С6Н5-СН=СН2 +Н2О С6Н5-СН-СН3
│
ОН
Мягкое окисление стирола:
3С6Н5-СН=СН2 +2 KMnO4 + 4Н2О 3 С6Н5-СН-СН2 + 2MnO2 + 2KOH
│ │
OH OH фенилэтиленгликоль
Жесткое окисление стирола:
С6Н5-СН=СН2 + 2KMnO4 + 3Н2SO4 С6Н5-СOOН + CO2 + 2MnSO4 + K2SO4 + 4H2O
бензойная кислота
3С6Н5-СН=СН2 + 10KMnO4 —to 3С6Н5-СOOК + 3К2CO3 + 10MnO2 + KOH+ 4Н2О
бензоат калия
Полимеризация стирола: в результате получают полистирол.
План урока:
Определение и формула аренов
Строение молекулы бензола
Изомерия и номенклатура аренов
Методы получения аренов
Физические свойства ароматических соединений
Химические реакции ароматических углеводородов
Области применения аренов
Определение и формула аренов
Арены (ароматические углеводороды) – соединения, включающие устойчивый цикл из шести атомов углерода (бензольное кольцо). Важнейший представитель – бензол.
Общая формула ароматических углеводородов: CnH2n-6
Молекула бензола.
Строение молекулы бензола
Бензол – первый представитель гомологического ряда ароматических углеводородов, открытый в 1825 году Майклом Фарадеем. Т.к. его молекулярная формула – С6Н6, значит, в основе лежат двойные связи. Поэтому было предположено, что бензолу свойственна ненасыщенность. В 1865 году Фридрих Кекуле предположил структурную формулу бензола.
Но в экспериментах было доказано, что бензол входит в реакции присоединения только в жестких условиях и устойчив к реакциям окисления. Для него наиболее свойственно замещение, что доказывает принадлежность к предельным соединениям.
Парадоксальное электронное строение было доказано с помощью получения бензола из ацетилена. Его особенность заключается в том, что все атомы в кольце равноценны и имеют характер одинарных и кратных связей. Это можно отразить формулой с равномерным распределением электронной плотности.
Углеродные атомы в кольце имеют по четыре валентных электрона и им свойственна sp2-гибридизация. Атомы располагаются в единой плоскости. Особенности строения бензола состоят в том, что электроны составляют единую π-систему и все связи равноценны. Т.е. формула Кекуле неточна, т.к. отражает наличие двойных связей. Бензольное кольцо – это циклическая сопряженная система, связи которой перекрываются между собой.
Пространственное строение бензола Источник
Изомерия и номенклатура аренов
Для бензола и его гомологов характерна только структурная изомерия, которая включает:
- изомерию углеродного скелета боковой цепи,
- изомерию положения заместителей в кольце.
Источник
Главной цепью в названии аренов принимается ароматическое кольцо, от которого отходят заместители. В следующем представителе гомологического ряда ксилоле (диметилбензоле) имеет значение положение заместителей в кольце. Для его обозначения используются различные приставки:
- орто- (о-) – заместители находятся у соседних углеродных атомов в кольце,
- мета- (м-) – заместители находятся через один атом,
- пара- (п-) – заместители находятся через два атома.
Методы получения аренов
В промышленности бензол и его гомологи можно получить несколькими способами.
- Из каменноугольной смолы.
- Дегидрирование и циклизация алканов при катализаторе и под действием высоких температур.
- Дегидрирование циклоалканов при катализаторе и под действием высоких температур
В лаборатории моноциклические соединения также получают несколькими путями.
- Циклотримеризация ацетилена и его гомологов при катализаторе и под действием высоких температур (реакция получения бензола)
- Реакция Вюрца-Фиттига – взаимодействие галогеналканов и арилгалогенидов с металлическим натрием
- Алкилирование галогеналканами, алкенами и спиртами в присутствии кислот Льюиса
Физические свойства ароматических соединений
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом. Нерастворимы в воде, но растворимы в органических растворителях. Их плотность меньше плотности воды. Они огнеопасны и токсичны для животных и человека.
Химические реакции ароматических углеводородов
Несмотря на то, что бензол включает систему из сопряженных кратных связей, аренам не характерны реакции обесцвечивания бромной воды и перманганата калия.
Реакции присоединения
Бензолу характерны реакции присоединения, образуя циклогексан или его производные.
Реакции замещения
Аренам характерны реакции замещения.
Окисление аренов
При неполной химической реакции окисления гомологи бензола образуется бензойная кислота. Самому бензолу реакции окисления перманганатом калия не характерны.
Полимеризация аренов
В реакции полимеризации способен вступать стирол, образуя полистирол.
Области применения аренов
Без бензола и его гомологов невозможно представить современное промышленное производство. Основные области применения бензола – производство этилбензола, кумола и циклогексана и анилина.
Ароматические углеводороды (арены)
Ключевые слова конспекта: Ароматические углеводороды (арены). Бензол. Фенильный радикал. Реакция нитрования. Экстракция.
Бензол и его строение
В начале XIX в. английский физик и химик Майкл Фарадей получил задание исследовать конденсат, который скапливался в стальных баллонах со сжатым газом, предназначавшимся для освещения улиц. Именно из этой жидкости учёному удалось выделить 3 г вещества и определить его формулу: C6H6. Вскоре новое вещество получило тривиальное название, которое используют до сих пор, — бензол.
В бензоле на шесть атомов углерода приходится только шесть атомов водорода. Значит ли это, что бензол относится к непредельным углеводородам? Как показывает эксперимент, бензол не реагирует ни с бромной водой, ни с раствором перманганата калия.
Долгие десятилетия эту загадку химикам решить не удавалось, до тех пор, пока немецкий химик-органик Фридрих Август Кекуле не высказал предположение, что атомы углерода в молекуле бензола образуют замкнутый цикл:
В формулах Кекуле вы видите чередование простых и двойных связей между атомами углерода в цикле. На самом деле установлено, что все углерод-углеродные связи в молекуле абсолютно одинаковы, т. е. три двойные связи в равной степени принадлежат шести атомам углерода. Возникшая особая ковалентная связь занимает как бы промежуточное положение между одинарными и двойными связями. Поэтому её условно можно назвать полуторной. Чтобы отразить особенности этого типа связей, формулу бензола записывают следующим образом:
Гомологический ряд аренов
Бензол — не единственное в своём роде соединение, он — первый представитель гомологического ряда углеводородов, называемых ароматическими. Подавляющее большинство представителей этого класса обладает ярко выраженным запахом, причём не всегда приятным.
Углеводороды, в молекулах которых содержится бензольное кольцо и которые имеют общую формулу СnН2n-6, называют ароматическими углеводородами или аренами.
Первые представители гомологического ряда аренов имеют следующие молекулярные и структурные формулы:
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Способы получения и химические свойства бензола
Исторически первым способом получения бензола было его выделение из продуктов коксования каменного угля. Теперь на долю этого способа приходится менее 10 % от общего объёма производства. Основное количество бензола получают в результате переработки нефти и нефтепродуктов.
Подобно всем углеводородам, бензол горит: 2С6Н6 + 15O2 → 12СO2 + 6Н2O
Ранее эта реакция находила практическое применение, когда бензол использовался в качестве добавки к моторному топливу.
Для бензола наиболее характерны реакции замещения. В результате таких реакций атом водорода в бензольном кольце замещается другим атомом или группой атомов. Например, действием брома в присутствии катализатора можно заместить один атом водорода на галоген:
В результате реакции образуется бромбензол, или фенилбромид. Одновалентный радикал —С6Н5 называют фенилом.
При обработке бензола концентрированной азотной кислотой в присутствии серной кислоты (катализатор) атом водорода замещается нитрогруппой —NО2. Протекает реакция нитрования, при этом образуется органическое вещество нитробензол и вода:
Получение нитробензола — первый шаг к промышленному получению анилина и органических красителей анилинового ряда.
Использование молекулярных формул позволяет более наглядно представить, как именно протекают реакции замещения:
Бензол — прекрасный растворитель органических веществ. Он легко растворяет жиры, смолы, воски, каучук. При этом сам бензол практически нерастворим в воде и легче её, поэтому, подобно растительному маслу, образует слой над водой. Это свойство можно использовать для извлечения растворённых веществ из водного раствора в органический растворитель.
Извлечение вещества из раствора с помощью второго растворителя, не смешивающегося с первым, называют экстракцией.
Бензол — один из ценных полупродуктов органического синтеза. Термин «полупродукт» означает, что, будучи многотоннажным продуктом химического производства, бензол используется в качестве сырья для получения других органических соединений. При этом сам бензол очень ядовитое вещество.
Одно перечисление практически полезных веществ и материалов, получаемых из бензола, заняло бы целый параграф. Это синтетические красители, ядохимикаты, синтетические моющие средства, лекарственные препараты, пищевые добавки, пластмассы, взрывчатые вещества и многое другое.
Таблица «Ароматические углеводороды (арены)»
Конспект урока по химии «Ароматические углеводороды (арены)». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии