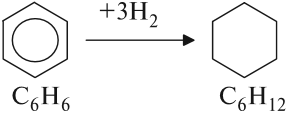
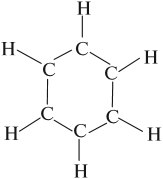
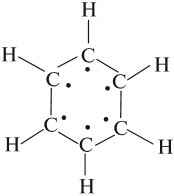
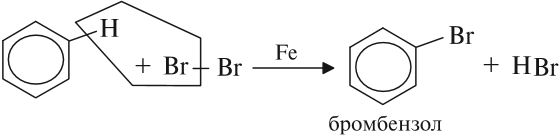
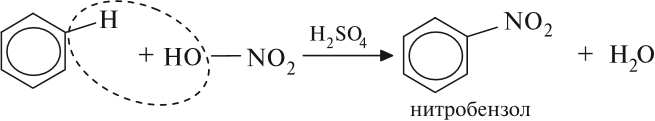
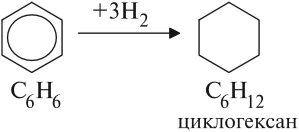
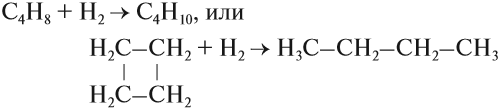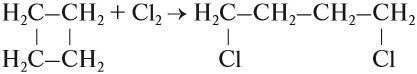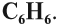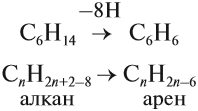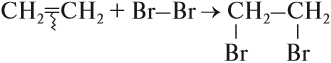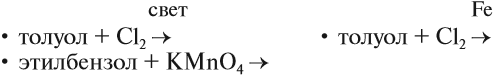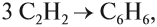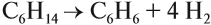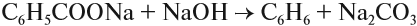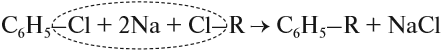Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец.
Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6.
Общая формула их гомологического ряда — CnH2n-6.
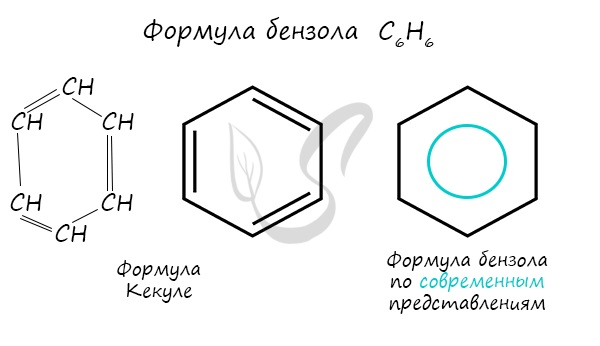
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям
двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2
гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
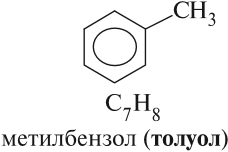
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол),
этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей,
то выбирают кратчайший путь между ними.
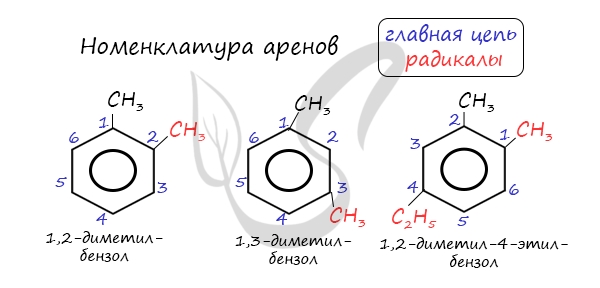
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном
кольце могут располагаться в разных положениях.
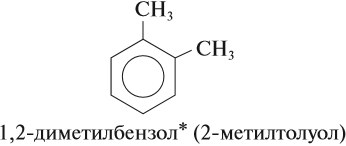
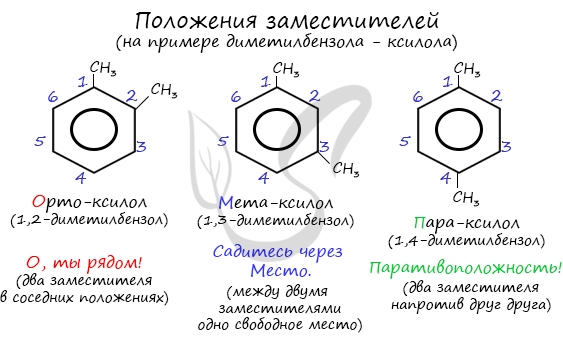
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 
Получение аренов
Арены получают несколькими способами:
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород — бензол.

В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге
можно добиться образования 1,3,5-триметилбензола.
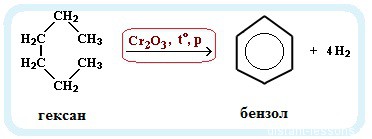
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
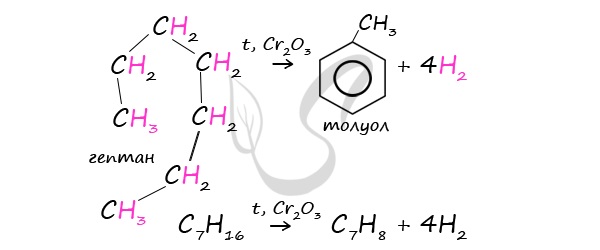
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен,
с теми же заместителями, которые были у циклоалкана.

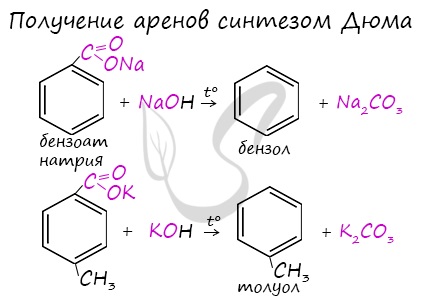
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность
делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце
и превратить арен в циклоалкан.

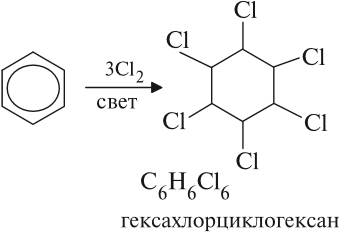
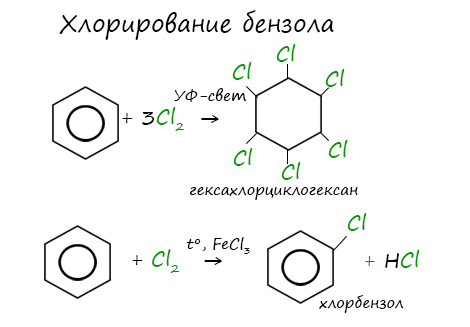
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор,
то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
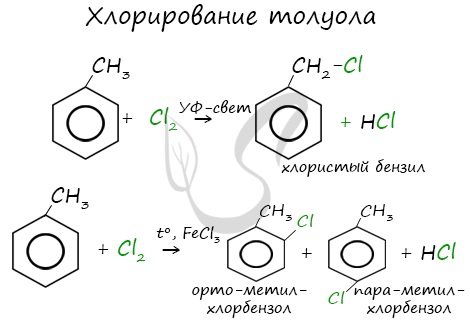
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3,
CHO, COOH, COOR.
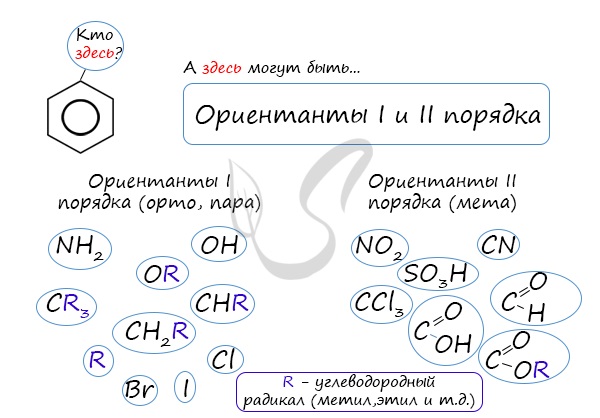
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях.
А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
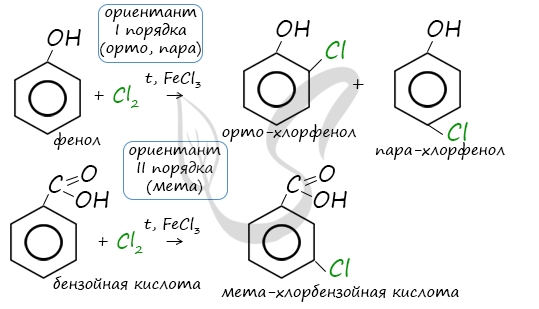
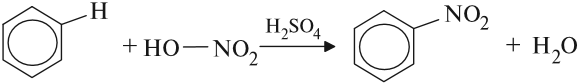
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты,
обладающей водоотнимающими свойствами.
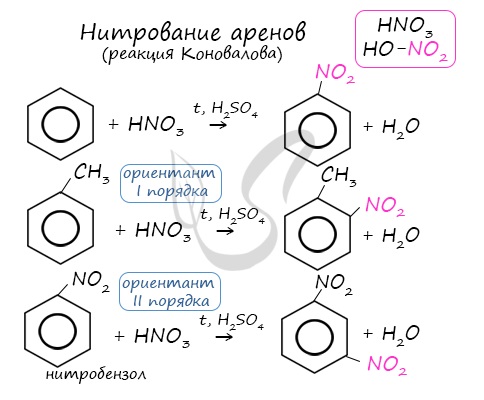
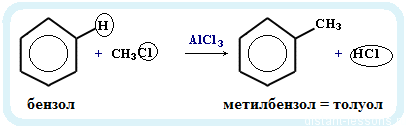
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом
углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
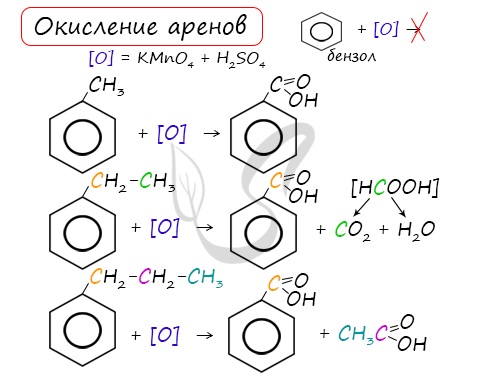
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
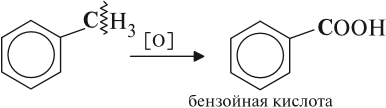
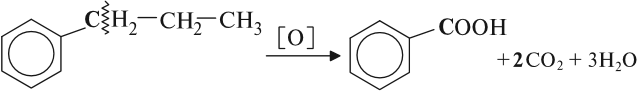
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной
кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
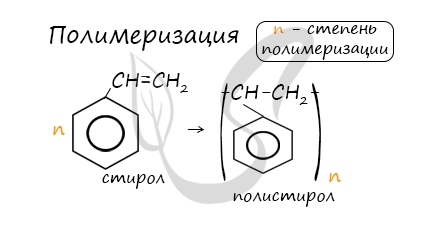
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород
Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Химия, Биология, подготовка к ГИА и ЕГЭ
Получение бензола и его
Мы рассмотрим «классические» методы получения бензола — те, которые описаны в каждом учебнике по химии, и рассмотрим получение из разных классов органических соединений, т.к. цепочки реакций, которые предлагаются в ЕГЭ, подразумевают умение получать бензол «из всего» 🙂
«Классические» реакции
получения бензола
- Ароматизация нефти. Точнее, это реакция циклизации гексана. Называется метод «ароматизация нефти», т.к. из нее получают гексан:
С6H14 → C6H6 + 4H2
Обратите внимание на условия реакции — давление, температуру и катализатор. Они означают, что при обычных условиях гексан не вступит в такую реакцию. Алканы вообще довольно нереакционноспособные вещества.
С6H12 → C6H6 + 3H2
- Получение гомологов бензола: алкилирование бензола:
реакция проводится в присутствии катализатора — галогенидов алюминия, например, AlCl3:
C6H6 + CH3Cl → C6H5CH3 + HCl
Именная реакция — реакция Зелинского. Получение бензола из ацетилена:
3С2H2 → C6H6
1. Получение бензола из неорганических веществ:
- 1 вариант:
Исходное вещество — карбид кальция СaC2:
CaC2 + 2H2O → Ca(OH)2 + C2H2 — ацетилен
дальше — реакция Зелинского : 3С2H2 → C6H6 Это самый короткий путь получения. - 2 вариант:
Исходное вещество — карбид алюминия Al4C3:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 — метан
2СH4 (1500 °C) → C2H2 + 3H2
дальше — реакция Зелинского
2. Получение бензола и его гомологов из других неорганических веществ:
1) получение бензола из алканов:
СH4 (1500 °C) → C2H2 (С, 600ºС) → С6H6
2) получение бензола и его гомологов из алкенов:
С2H4 → C2H2 →C6H6
Схема: алкен → дибромалкан → циклоалкан → гомолог бензола
CH2=CH-(CH2)4-CH3 + HBr → CH3-CH( Br )-(CH2)4-CH3
CH3-CH(Br)-(CH2)4-CH3 + Br2 → CH3-CH( Br )-(CH2)4-CH2 Br
CH3-CH( Br )-(CH2)4-CH2 Br + Zn → C6H13-СH3 — метилциклогексан + ZnBr2
C6H13-СH3 → С6H5-CH3 + 4H2
Способы получения аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород
Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Бензол и его гомологи
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
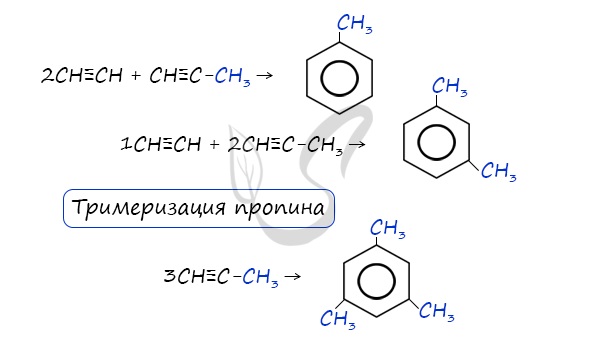
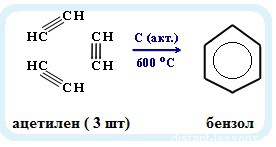
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
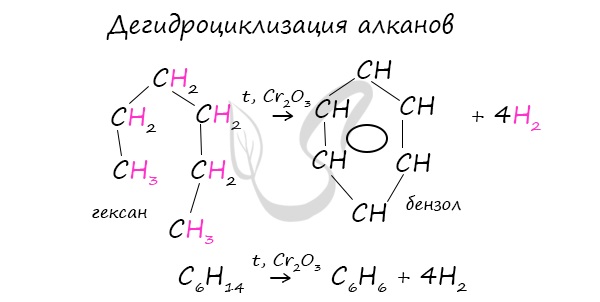
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
источники:
http://chemege.ru/sposoby-polucheniya-arenov/
http://studarium.ru/article/186
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 363 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Установите соответствие между парой веществ и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПАРА ВЕЩЕСТВ
А) бензол и гексен-1
Б) бензол и этиленгликоль
В) бензол и бензиловый спирт (фенилметанол)
Г) бензол и анилин
РЕАГЕНТ
1) фенолфталеин
2) (водн. р-р)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Из предложенного перечня выберите все вещества, с которыми реагируют и ацетилен, и бензол.
1) вода
2) перманганат калия
3) бром
4) бромоводород
5) водород
Запишите в поле ответа номера выбранных соединений.
Источник: ЕГЭ по химии 2021. Основная волна. Вариант 1
Перманганат калия в кислой среде реагирует с каждым из двух углеводородов:
1) гексаном и гексеном-1
2) пропином и толуолом
3) этилбензолом и бутеном-2
4) бензолом и этиленом
5) бензолом и бутином-2
Запишите номера выбранных соединений.
Из предложенного перечня выберите все вещества, которые взаимодействуют как с этиленом, так и с бензолом.
1)
2)
3)
4)
5)
Запишите номера выбранных ответов в порядке возрастания.
Из предложенного перечня выберите все вещества, которые реагируют с этанолом, но не реагируют с бензолом.
1.
2.
3.
4.
5.
Запишите номера выбранных ответов.
Из предложенного перечня выберите две реакции, в ходе которых может образоваться бензол.
1) дегидрирование циклопентана
2) дегидрирование циклогексана
3) гидрирование фенола
4) дегидрирование гептана
5) дегидрирование гексана
Запишите номера выбранных ответов.
Источник: ЕГЭ по химии 2020. Досрочная волна. Вариант 2
В результате реакции тримеризации ацетилена объёмом 26,88 л (н.у) получили 23,4 г бензола. Вычислите массовую долю выхода продукта реакции (%) от теоретически возможного. (Запишите число с точностью до целых.)
Источник: Демонстрационная версия ЕГЭ—2022 по химии
Задана схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) нитробензол
2) бромметан
3) ацетилен
4) этилен
5) бромбензол
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Источник: ЕГЭ по химии 2022. Досрочная волна
Задания Д14 № 548
Бензол можно превратить в циклогексан реакцией
1) гидрирования
2) гидратации
3) дегидрирования
4) дегидратации
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) бензол и хлор
Б) циклопропан и водород
В) бензол и хлор (УФ)
Г) толуол и водород
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропен
2) пропан
3) хлорбензол
4) гексахлорциклогексан
5) ксилол
6) метилциклогексан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) толуол и хлор
Б) толуол и хлор (свет)
В) бензол и водород
Г) бензол и метанол
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) хлористый бензил
2) циклогексан
3) толуол
4) метилгексахлорциклогексан
5) ксилол
6) хлортолуол
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) бензол и хлор
Б) циклопропан и водород
В) бензол и хлор (УФ)
Г) толуол и водород
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропен
2) пропан
3) хлорбензол
4) гексахлорциклогексан
5) ксилол
6) метилциклогексан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
A) толуол и хлор
Б) толуол и хлор (свет)
B) бензол и водород
Г) бензол и метанол
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) хлористый бензил
2) циклогексан
3) толуол
4) метилгексахлорциклогексан
5) ксилол
6) хлортолуол
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между смесью и способом её разделения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СМЕСЬ
А) воды и бензола
Б) железа и меди
В) воды и сульфата бария
Г) гексана и бензола
СПОСОБ РАЗДЕЛЕНИЯ
1) фракционной перегонкой
2) фильтрованием
3) с помощью делительной воронки
4) с помощью магнита
5) перемешиванием
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) бензол и хлорэтан ()
Б) бензол и этилен ()
В) этилбензол (t, кат)
Г) дивинил и водород (t, Ni)
ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ
1) о-ксилол
2) н-бутан
3) винилбензол
4) этилбензол
5) хлорбензол
6) бутин-2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: ЕГЭ по химии 2021. Основная волна. Вариант 1
Задания Д15 № 374
Верны ли следующие суждения о феноле?
А. В отличие от бензола фенол взаимодействует с бромной водой.
Б. Фенол проявляет сильные кислотные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) пропанон и пропанол-2
Б) анилин и триэтиламин
В) пентин-2 и этилацетат
Г) бензол и гексен-2
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2014 по химии
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) этандиол и этанол
Б) этанол и уксусная кислота
В) пропан и пропен
Г) бензол и стирол
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Для полного гидрирования гомолога бензола потребовалось 10,08 л (н. у.) водорода, при этом образовался циклоалкан массой 14,7 г. Запишите уравнение реакции в общем виде. Определите молекулярную формулу гомолога бензола. Считать выход продукта реакции равным 100%.
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 1
Для полного гидрирования гомолога бензола потребовалось 1,68 л (н. у.) водорода, при этом образовался циклоалкан массой 3,15 г. Запишите уравнение реакции в общем виде. Определите молекулярную формулу гомолога бензола. Считать выход продукта реакции равным 100%.
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 3
Всего: 363 1–20 | 21–40 | 41–60 | 61–80 …
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ.
Это циклические углеводороды с тремя двойными сопряженными связями в цикле.
Бензол С6Н6 – родоначальник ароматических углеводородов. Впервые выделен Фарадеем в 1825г из светильного газа.
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 1200.
Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
р-Электроны всех атомов углерода образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между одинарной и двойной.
Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены (делокализованы).
Общая формула гомологического ряда бензола CnH2n-6 (n ≥ 6).
|
Вещество |
Название по номенклатуре |
Историческое название |
|
С6Н5-СН3 |
метилбензол |
Толуол |
|
С6Н5-СН2-СН3 |
этилбензол |
— |
|
СН3-С6Н4-СН3 |
диметилбензол |
ксилол |
|
С6Н5-СН(СН3)2 |
изопропилбензол |
кумол |
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Кольцо нумерют так, чтобы номера радикалов были наименьшими.
Для дизамещенных бензолов
R-C6H4-R’
используется также другой способ построения названий:
орто— (о-) заместители у соседних атомов углерода кольца, 1,2-;
мета— (м-) заместители через один атом углерода (1,3-);
пара-(п-) заместители на противоположных сторонах кольца(1,4-).
Изомерия у аренов.
Определяется числом заместителей, их расположением в бензольном кольце и возможностью изомерии углеродного скелета в заместителях, содержащих более трёх атомов углерода.
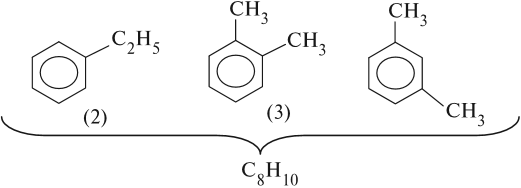
Для ароматического углеводорода С8Н10 существуют 4 изомера: орто-, мета- и пара-ксилолы и этилбензол.
ПОЛУЧЕНИЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
1. Дегидрирование циклоалканов
2. Дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора
3.Тримеризация ацетилена над активированным углем (реакция Зелинского):
4.Алкилирование бензола галогеналканами в присутствии безводного хлорида алюминия или алкенами:
ФИЗИЧЕСКИЕ СВОЙСТВА.
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом, с плотностью менее 1 г/мл. Огнеопасны. Нерастворимы в воде, но хорошо растворимы в неполярных растворителях. Бензол и толуол ядовиты (поражают почки, печень, костный мозг, кровь).
Высшие арены – твердые вещества.
ХИМИЧЕСКИЕ СВОЙСТВА.
Из-за наличия делокализованой -системы арены мало характерны реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции электрофильного замещения атомов водорода, связанных с циклом — SЕ.
1. РЕАКЦИИ ПРИСОЕДИНЕНИЯ К АРЕНАМ
В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
а. Гидрирование. Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
б. Радикальное хлорирование. При радикальном хлорировании бензола получается гексахлорциклогексан — «гексахлоран» (средство борьбы с вредными насекомыми).
2. РЕАКЦИИ РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ АТОМОВ ВОДОРОДА В БОКОВОЙ ЦЕПИ:
В случае гомологов бензола при действии хлора на свету или при нагревании происходит реакция радикального замещения в боковой цепи:
3. Реакции окисления аренов
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко. При действии раствора KMnO4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи, при этом от боковой цепи остаётся карбоксильная группа, а остальное – переходит в углекислый газ:
5С6Н5—СН3 +6КМnO4+9H2SO4 🡪5C6H5—COOH +6MnSO4+3K2SO4+14H2O
5С6Н5—CH2—CH3 +12КМnO4+18H2SO4🡪5C6H5—COOH +5СО2+12MnSO4+6K2SO4+28H2O
Если окисление идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты и карбонат калия:
С6Н5—СН2—СН3+4KMnO4🡪C6H5 – COOK+K2CO3+4MnO2+KOH+2H2O
4.РЕАКЦИИ ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ
1. Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п.:
2. Нитрование
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
3. Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование) происходит под действием алкилгалогенидов в присутствии катализаторов AlCl3, FeBr3или алкенов в присутствии фосфорной кислоты:
ЗАМЕЩЕНИЕ В АЛКИЛБЕНЗОЛАХ
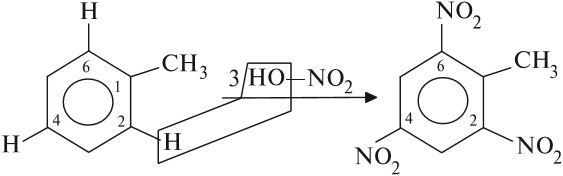
Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. Например, при нитровании толуола С6Н5-CH3 может происходить замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола, причём в орто- и пара- положениях:
ОРИЕНТИРУЮЩЕЕ ДЕЙСТВИЕ ЗАМЕСТИТЕЛЕЙ
В БЕНЗОЛЬНОМ КОЛЬЦЕ.
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные (первого рода) и электроноакцепторные (второго рода).
ЭЛЕКТРОНОДОНОРНЫЕ ЗАМЕСТИТЕЛИ проявляют повышают электронную плотность в сопряженной системе.
К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях:
Алкильные группы не могут участвовать в сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности.
Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара— положениях бензольного кольца и называются заместителями (ориентантами) первого рода:
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения:
ЭЛЕКТРОНОАКЦЕПТОРНЫЕ ЗАМЕСТИТЕЛИ снижают электронную плотность в сопряженной системе.
К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, но меньше всего она уменьшается в мета-положениях:
Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца.
Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:
СТИРОЛ (винилбензол) С8Н8
– производное бензола, которое имеет в своём составе двойную связь в боковом заместителе, поэтому он НЕ относится к гомологическому ряду аренов.
Получение стирола:
- Дегидрирование этилбензола: С6Н5-СН2-СН3 -(t,кат)🡪 C6H5-CH=CH2 + H2
- Дегидрогалогенирование фенилбромэтана:
C6H5-CH-CH3 +KOH –(спирт) 🡪 C6H5-CH=CH2 +KBr +H2O
│
Br
Свойства стирола:
Стирол проявляет свойства, характерные для алкенов – реакции присоединения, окисления, полимеризации.
Реакции присоединения к стиролу: протекают в соответствии с правилом Марковникова.
С6Н5-СН=СН2 +Н2О 🡪 С6Н5-СН-СН3
│
ОН
Мягкое окисление стирола:
3С6Н5-СН=СН2 +2 KMnO4 + 4Н2О 🡪3 С6Н5-СН-СН2 + 2MnO2 + 2KOH
│ │
OH OH фенилэтиленгликоль
Жесткое окисление стирола:
С6Н5-СН=СН2 + 2KMnO4 + 3Н2SO4 🡪 С6Н5-СOOН + CO2 + 2MnSO4 + K2SO4 + 4H2O
бензойная кислота
3С6Н5-СН=СН2 + 10KMnO4 -to🡪 3С6Н5-СOOК + 3К2CO3 + 10MnO2 + KOH+ 4Н2О
бензоат калия
Полимеризация стирола: в результате получают полистирол.
Содержание
- Понятие о циклических углеводородах. Циклоалканы
- Понятие об ароматических углеводородах
- История открытия бензола. Строение молекулы
- Гомологический ряд, номенклатура, изомерия
- Свойства бензола
- Физические свойства
- Химические свойства
- Свойства гомологов бензола
- Влияние боковой цепи на бензольное кольцо
- Влияние бензольного кольца на CH3-группу боковой цепи
- Получение бензола и его гомологов
- Выводы
Понятие о циклических углеводородах. Циклоалканы
Циклические углеводороды — это вещества, в молекулах которых имеется замкнутая цепь атомов углерода.
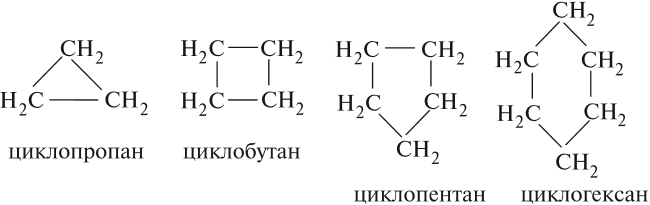
Циклоалканы (циклопарафины) — это углеводороды замкнутого (циклического) строения, в молекулах которых атомы углерода соединены только простыми связями.
Общая формула циклоалканов СnH2n, поэтому эти углеводороды нельзя отнести к предельным углеводородам. Атомы углерода, образующие цикл, соединены между собой простыми σ-связями, как в алканах. В зависимости от величины цикла, т. е. числа сторон в этом углеродном многоугольнике, различают циклоалканы:
- трёхчленные (правильные треугольники);
- четырёхчленные (правильные четырёхугольники);
- пятичленные (правильные пятиугольники) и т. д.
По номенклатуре ИЮПАК названия циклопарафинов образуют, прибавляя приставку цикло- — к названию алкана.
Например:
Первые два представителя — циклопропан и циклобутан (при н. у.) — газы, следующие три — жидкости, высшие — твёрдые вещества.
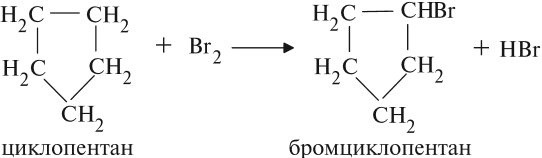
Циклопентан, циклогексан и их гомологи — наиболее устойчивые циклоалканы, поэтому они с трудом вступают в реакции гидрирования, галогенирования и т. д. Если реакция галогенирования происходит, то это реакция замещения, цикл при этом не разрушается:
Трёхчленные и четырёхчленные циклы, имея менее устойчивый цикл, способны присоединять одну молекулу водорода, превращаясь в предельный углеводород:
При этом происходит размыкание цикла. Галогенирование циклобутана идёт так же, как и его гидрирование:
Обратите внимание. Атомы хлора становятся в 1,4-положение: по концам разорванной цепи. Это реакции присоединения. С бОльшим трудом вступают в реакции присоединения и устойчивые пяти— и шестичленные циклоалканы.
Поэтому циклопарафины нельзя отнести к насыщенным углеводородам.
Циклопарафины входят в состав нефти, составляя до 25– 75 % её. Поэтому их называют нафтенами.
Понятие об ароматических углеводородах
К ароматическим углеводородам относятся углеводороды, в молекулах которых содержится одно или несколько бензольных ядер (колец)*.
* Существуют и другие ароматические углеводороды и органические соединения. В данном пособии они не рассматриваются.
Бензольное ядро — это остаток типичного представителя ароматических углеводородов — бензола.
История открытия бензола. Строение молекулы
Бензол был открыт в начале прошлого века. Это было загадочное вещество. Многие учёные пытались разгадать его строение, объяснить его свойства, но не могли. Почему?
Дело в том, что было установлено: состав молекулы бензола выражается формулой
Задание 21.1. По составу молекулы определите, является ли это вещество предельным или непредельным углеводородом.
Если сравнить состав бензола с соответствующим алканом, легко видеть, что бензол — сильно ненасыщенное соединение. Для того чтобы превратиться в алкан, бензол должен присоединить 8 атомов (4 молекулы) водорода. Но оказалось, что бензол, присоединяя 3 молекулы водорода, превращается в вещество циклического строения:
Значит, и бензол имеет циклическое строение!
Теперь возникает вопрос: какие связи соединяют атомы углерода в молекуле бензола? В 1865 году немецкий химик Кекуле* предложил такую модель молекулы бензола:
* Кекуле Фридрих Август (07.09.1829–13.07.1896) — немецкий химик-органик. В 1858 г. выдвинул положение о том, что «конституция» вещества обусловлена «валентностью» элементов, предложил (1865) циклическую структурную формулу бензола, доказал равноценность всех связей внутри бензольного кольца.
Эта модель объясняла многие свойства бензола, но не объясняла особенности химических свойств этого соединения. Ведь если углеводород имеет три двойные связи, то он должен давать качественные реакции на двойную (кратную) связь.
Вопрос. Какие вы знаете качественные реакции на кратную связь?
Но оказалось, что бензол эти качественные реакции не даёт, т. е.
- не обесцвечивает бромную воду (при нормальных условиях);
- не обесцвечивает раствор перманганата калия.
Значит, двойных связей в молекуле бензола НЕТ!
Дальнейшие исследования показали, что в молекуле бензола существует особая, очень прочная ароматическая связь. Рассмотрим её образование на примере бензола.
Как уже было сказано, бензол имеет циклическое строение, причём атомы углерода соединены в правильный шестиугольник при помощи простых σ-связей. Такие σ-связи соединяют атомы углерода и водорода:
Вопрос. Сколько связей образовал каждый атом углерода? Сколько электронов участвует в образовании этих связей?
Поскольку каждый атом углерода имеет по четыре валентных электрона, а в образовании трёх простых σ-связей участвовало по три электрона каждого атома, — у каждого атома углерода осталось по одному «лишнему» электрону (•). Эти электроны объединяются и образуют единую электронную систему — ароматическую связь:
Задание. Соедините точки линией, не отрывая карандаш от бумаги. Что у Вас получилось? Окружность.
Ароматическая связь в молекулах обозначается кружочком:
Формулы (1) и (1а) отражают строение одного и того же вещества бензола, состава С6Н6. Записывая формулу бензола (1а), следует помнить, что:
- в вершинах этого правильного шестиугольника находится атом углерода;
- каждый атом углерода соединён с одним атомом водорода.
Гомологический ряд, номенклатура, изомерия
Для того чтобы вывести общую формулу гомологического ряда бензола, сравним, как всегда, состав алкана и бензола, у которых число атомов углерода одинаково:
Гомологи бензола (арены) должны отвечать формуле СnН2n–6 и содержать одно бензольное кольцо (остаток бензола). Так как у бензола состав C6H6, то ближайший гомолог бензола имеет семь атомов углерода в молекуле:
Вопрос. Существуют ли ароматические изомеры толуола, т. е. можно ли получить новое соединение, «перемещая» метильную группу (СН3) по кольцу?
Поскольку все атомы углерода равноценны, — изомеров ароматического строения у толуола нет и обозначать цифрой положение метильной группы не имеет смысла.
Если n = 8, то составу С8Н10 отвечают несколько формул:
В местах соединения атомов углерода бензольного кольца и радикалов атомов водорода нет!
Вопрос. От чего будет зависеть изомерия таких ароматических соединений?
Очевидно, что для вещества (3) возможны ещё два изомера, которые отличаются взаимным расположением метильных групп. В этом случае положение метильной группы нужно показывать цифрой. Цифрой 1 нумеруют любую метильную группу и, двигаясь по кольцу в сторону ближайшей группы, расставляют остальные номера:
* Ароматические изомеры диметилбензола называются ксилол.
Задание 21.2. Составьте формулы остальных гомологов бензола с n = 8. Назовите полученные изомеры. Назовите также соединение (2).
Свойства бензола
Физические свойства
Бензол — это бесцветная жидкость с характерным запахом. Приятный запах некоторых ароматических соединений (аромат) дал название целому классу соединений. Бензол легче воды и не смешивается с нею. Являясь неполярным соединением, бензол хорошо растворяет неполярные соединения: жиры и масла.
Химические свойства
В молекуле бензола имеется очень прочная ароматическая связь. Поэтому в химических реакциях бензол стремится сохранить ароматическую связь. Для того чтобы понять, какие химические реакции более характерны для бензола, вспомним, как протекают реакции основных типов: замещения и присоединения.
Задание 21.3. Составьте уравнения реакций с бромом для этана и этилена. Укажите тип этих реакций.
Обратите внимание: реакции замещения происходят без изменения структуры молекулы (тип химической связи остался прежним):
А в реакциях присоединения изменяется структура молекулы, изменяется тип химической связи:
Вопрос. Какой тип химической реакции предпочтительнее для бензола: замещения или присоединения? Почему?
Поскольку в реакциях замещения тип химической связи не изменяется, то бензол и другие ароматические углеводороды преимущественно вступают в реакции замещения, так как в этих реакциях ароматическая связь (она наиболее прочная) не разрушается. Следует помнить, что при обычных условиях бензол в химические реакции не вступает.
Вопрос. Почему?
Так, реакция бромирования бензола происходит в присутствии катализатора железа:
Реакция нитрования (с HNO3) происходит при нагревании в присутствии концентрированной серной кислоты:
В особых условиях возможно разрушение ароматической связи, и тогда бензол вступает в реакции присоединения:
На ярком солнечном свету происходит взаимодействие бензола с хлором или бромом:
Бензол при обычных условиях не окисляется, например не обесцвечивает раствор перманганата калия. Окисление идет в особых условиях и сопровождается разрушением бензольного кольца. Бензол легко воспламеняется и горит коптящим пламенем. Пары бензола взрывоопасны. Бензол ядовит!
Задание 21.4. Составьте уравнение реакции горения бензола.
Свойства гомологов бензола
Свойства толуола и других гомологов бензола очень похожи на свойства самого бензола, но всё же имеют определённые особенности.
В теории Бутлерова сказано: атомы в молекуле взаимно влияют друг на друга. Поэтому появление в молекуле любой новой группы оказывает влияние на остальные атомы, т. е. изменяет свойства прежнего вещества.
Рассмотрим взаимное влияние атомов в молекуле на примере толуола.
Влияние боковой цепи на бензольное кольцо
Сравним две реакции: нитрование бензола и толуола. Исходные вещества отличаются друг от друга на группу СН3 (метил).
Отличается ли их поведение в этих реакциях? Да. Бензол вступает в реакцию медленнее, и в его молекуле может быть замещён любой атом водорода:
Толуол реагирует с азотной кислотой в 24 раза быстрее. В его молекуле могут быть замещены только те атомы водорода, которые связаны со вторым, четвёртым или шестым атомом углерода по отношению к CH3 группе:
Вывод. Влияние СН3-группы, а также любых других углеводородных радикалов, заключается в том, что они (эти группы) облегчают реакции замещения и направляют их в 2, 4, 6-положения по отношению к себе.
Влияние бензольного кольца на CH3-группу боковой цепи
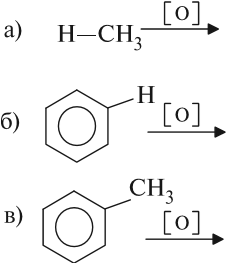
Сравним три реакции окисления (знак [O] означает мягкое окисление в водном растворе окислителя):
Первые две реакции при обычных условиях не происходят, т. е. бензол и метан не окисляются в растворах и не обесцвечивают розовый раствор перманганата калия (КМnО4). Толуол вступает в такую реакцию:
Таким образом, ни СН3-группа, ни бензол по отдельности не окисляются при нормальных условиях. Но влияние бензольного кольца на СН3-группу приводит к тому, что связи в ней становятся более полярными и разрушаются под действием перманганата калия. Такая реакция характерна и для других гомологов бензола:
Под действием бензольного кольца становятся более полярными ближайшие к кольцу С–Н связи. Поэтому при окислении раствором перманганата калия любого гомолога бензола на месте боковой цепи образуется карбоксильная группа СООН.
Задание 21.5. Составьте уравнения реакций:
Укажите тип этих реакций.
Получение бензола и его гомологов
Бензол можно получить из ацетилена:
а также дегидроциклизацией алканов (дегидрирование — отщепление водорода, циклизация — образование замкнутого кольца из атомов углерода):
Бензол и другие ароматические углеводороды, как и алканы, можно получать из солей соответствующих кислот:
Гомологи бензола можно получить, как и алканы, из галогенпроизводных углеводородов:
Выводы
Арены — это непредельные циклические углеводороды, содержащие прочную ароматическую связь. Для таких веществ характерны реакции замещения атома водорода. Возможны также реакции присоединения.