Задания
Версия для печати и копирования в MS Word
Установите соответствие между названием полимера и названием реакции его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) фенолформальдегидная смола
Б) натуральный каучук
В) резина
РЕАКЦИЯ ПОЛУЧЕНИЯ
1) поликонденсация
2) дегидрогенизация
3) вулканизация
4) полимеризация
Запишите в таблицу выбранные цифры под соответствующими буквами.
Спрятать решение
Решение.
Установим соответствие.
A. Поликонденсация — процесс синтеза полимеров из полифункциональных соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (воды, спиртов и т. п.). Для получения фенолформальдегидной смолы используется реакция поликонденсации фенола и формальдегида в соотношении 2:1 (1).
Б. Натуральный каучук получают полимеризацией изопрена (4).
В. Резину получают главным образом вулканизацией каучука (3).
Ответ: 143.
Методика проведения эксперимента: в пробирку помещаем несколько кристалликов фенола и добавляем 2-3 мл раствора формальдегида. Смесь нагреваем до растворения фенола.
Через 3 минуты к раствору добавляем 1 мл концентрированной соляной кислоты и продолжаем нагревание до расслоения смеси.
Пробирку помещаем в стакан холодной воды. После образования границы между слоями сливаем воду и быстро выливаем смолу на предметное стекло.
Испытываем образовавшуюся смолу на растворимость в этиловом спирте.
Небольшое количество смолы нагреваем в фарфоровой чашке до затвердевания и также испытываем на растворимость в спирте.
Опыт выполнен под руководством учителя химии, с соблюдением техники безопасности. Просим не повторять вас без соответствующей подготовки.
Видеофрагмент:
Химизм процесса — Теоретическое обоснование

Задание №1:
Установите соответствие между веществом и схемой его получения:
ВЕЩЕСТВО:
А) дивиниловый каучук
Б) фенолформальдегидная смола
В) нейлон
СХЕМА ПОЛУЧЕНИЯ:
1) nCH2=CHꟷCH=CH2 →
2) nCH2=C(CH3)ꟷCH=CH2 →
3) nC6H5OH + nCH2OH →
4) nHOOCꟷ(CH2)4ꟷCOOH + nH2Nꟷ(CH2)6ꟷNH2 →
5) nCH2(OH)ꟷCH2OH + nHOOCꟷC6H4ꟷCOOH→
Решение:
Первое вещество — дивиниловый каучук; создание этого полимера привело к огромному скачку в химической промышленности, отчасти благодаря синтезу Лебедева, который получил бутадиеновый(дивиниловый) каучук путем пиролиза этилового спирта(1926 г.); соответственно, этот каучук получают из дивинила, ответ 1.
Дивинил непосредственно связан с названием углеводородного непредельного радикала винила (CH2=CHꟷ) . Название «винил» с латинского vinum означает «вино»(указывает на связь с этиловым спиртом).
Второе соединение — фенолформальдегидная смола; по самому названию видно, что данная смола состоит из двух органических веществ — фенола(C6H5OH) и формальдегида(HCOH), которые в процессе поликонденсации образуют столь важное соединение, ответ 3.
Последнее вещество — нейлон(искусственное волокно, класса полиамидов, используется в качестве ткани для одежды), его получают поликонденсацией адипиновой кислоты(HOOCꟷ(CH2)4ꟷCOOH) и гексаметилендиамина(H2Nꟷ(CH2)6ꟷNH2), ответ 4.
Задание №2:
Установите соответствие между веществом, и процессом/оборудованием, который используется для его получения.
ВЕЩЕСТВО:
А) чугун
Б) сталь
В) алюминий
ПРОЦЕСС/ОБОРУДОВАНИЕ:
1) электролиз расплава поваренной соли
2) доменная печь
3) электролиз боксита в расплавленном криолите
4) мартеновская печь
Решение:
Итак, чугун, как ты знаешь, это сплав железа и углерода(С более 2,14%), для его получения используют доменную печь(1200 С), в которой происходит множество реакций, которые в совокупности приводят к образованию твердого, не пластичного, но хрупкого материала, ответ 2.
Сталь, как и чугун, имеет в своем составе углерод и железо, однако, имеет существенное различие в соотношении этих элементов(C до 2,14%), обладает легкостью, высокой пластичностью, стойкостью; сталь получают в мартеновской печи(1700 С), ответ 4.
Алюминий получают электролизом боксита в расплаве криолита, об этом я уже писала на предыдущем уроке, ответ 3.
Задание №3:
Установите соответствие между веществом и способом его получения:
ВЕЩЕСТВО:
А) полипропилен
Б) фторопласт
В) бутадиенстирольный каучук
СПОСОБ ПОЛУЧЕНИЯ:
1) вулканизация
2) полимеризация
3) поликонденсация
4) сополимеризация
Решение:
Полипропилен((C3H6)n) — это полимер, который образуется путем полимеризации соответствующего алкена пропилена(C3H6), ответ 2.
Фторопласт — общее название фторсодержащих полимеров, к которым, в частности, относится политетрафторэтилен(тефлон). Его можно получить реакцией полимеризации тетрафторэтилена, ответ 2.
Бутадиенстирольный каучук является важнейшим сырьем для изготовления таких продуктов, как шины, кабели, и жевательные резинки(!), получить в промышленности такой каучук можно сополимеризацией, ответ 4.
Сополимеризация — это процесс получения сополимеров, по сути представляет совместную полимеризацию нескольких мономеров, например, бутадиена и стирола(оба имеют кратную связь). Различают радикальную, анионную и катионную сополимеризацию.
Задание №4:
Установите соответствие между веществом и областью его применения:
ВЕЩЕСТВО:
А) целлюлоза
Б) фосфоритная мука
В) медь
Г) алюминий
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) производство суперфосфата
2) искусственные волокна
3) электротехническая промышленность
4) получение стекла
5) производство аммиака
Решение:
Целлюлоза, (C6H10O5)n — это органический полимер, растительный углевод, из которого делают искусственные волокна, ответ 2.
Фосфоритная мука представляет собой минеральное фосфорное удобрение с <30% ортофосфата кальция, используется в производстве суперфосфата(кристаллогидрат дигидрофосфата кальция), ответ 1.
Медь используется в электротехнической промышленности за счет идеальной электропроводности и высоких параметров проводимости тепла, ответ 3.
Алюминий, также как медь, нашел свое применение в электротехнической промышленности в качестве материала для кабелей, шинопроводов, выпрямителей переменного тока, ответ 1.
Задание №5:
Установите соответствие между веществом и его воздействием на организм:
ВЕЩЕСТВО:
А) аргон и азот
Б) метанол
В) этанол
Г) соли свинца
ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ:
1) наркотическое воздействие
2) токсическое воздействие, быстро приводящее к летальному исходу
3) токсическое воздействие, приводящее к тяжелым заболеваниям
4) не влияет на жизнеспособность организма
5) улучшает состояние организма
Решение:
Аргон и азот — это два газа, являются составными частями воздуха(азот>70%, аргон<1%), а значит, не имеют отрицательного влияния на организм, ответ 4.
Метанол — это яд, который в целом внешне похож на этанол, однако, употребление его перорально вызывает слепоту, а в дальнейшем смерть от удушья, ответ 2.
Этанол — это токсическое вещество, которое оказывает наркотическое действие на мозг, заставляя организм входить в непривычное и неестественное состояние опьянения, со временем оказывает только отрицательное влияние в виде проблем с почками, кожей, желудком, печенью, усугубляющее нормальное состояние человека, ответ 1.
Соли свинца воздействуют на организм человека отрицательно, приводя к тяжелым заболеваниям, ответ 3.
Задание №6:
Установите соответствие между схемой химической реакции и областью ее применения:
СХЕМА РЕАКЦИИ:
А) 2AgHal(облучение) → 2Ag + Hal2
Б) PbS + 4H2O2 = PbSO4 + 4H2O
В) 2(OCl—) = Cl2 + O2
Г) 2(NH4)2CO3 → 2NH3 + CO2 + H2O
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) реставрация картин
2) отбеливание тканей и дезинфекция
3) черно-белая фотография
4) хлебопекарная и кондитерская промышленность
5) получение синтетических красителей
Решение:
Первая реакция — облучение галогенида серебра применяется для черно-белых фотографий, ответ 3.
Вторая реакция — окисление сульфида свинца применяют в реставрации картин, ответ 1.
Третий процесс — получение чистого хлора и кислорода — всем известные процессы отбеливания и дезинфекции, ответ 2.
Последняя реакция — это разложение карбоната аммония, используется в хлебопекарной промышленности, ответ 4.
Задание №7:
Установите соответствие между раствором вещества и его применением в лаборатории:
РАСТВОР ВЕЩЕСТВА:
А) аммиачный раствор оксида серебра
Б) известковая вода
В) нитрат серебра
Г) бромная вода
ПРИМЕНЕНИЕ В ЛАБОРАТОРИИ:
1) обнаружение карбонат-ионов
2) обнаружение йодид-ионов
3) обнаружение альдегидов
4) обнаружение алкенов
5) обнаружение этанола
Решение:
Начнем с аммиачного раствора оксида серебра — это достаточно известная качественная реакция на альдегиды(в результате выделяется чистое серебра и аммоний — производное карбоновой кислоты), ответ 3.
!ВАЖНО: Муравьиная кислота(HCOOH) также может вступать в реакцию «серебрянного зеркала«.
Известковая вода(гашеная известь, Ca(OH)2) используется в качестве обнаружения карбонат-ионов(карбонат кальция — это осадок белого цвета), ответ 1.
Нитрат серебра — эта соль может обнаруживать йодид-ионы(за счет осадка AgI), ответ 2.
Бромная вода является качественным реагентом на кратные связи, в том числе на алкены, ответ 4.
Задание №8:
Установите соответствие между веществом/ группой веществ и правилами работы с ними в лаборатории:
ВЕЩЕСТВО:
А) приготовление растворов кислот
Б) пламя горящего натрия можно погасить, используя
В) приготовление растворов твердых щелочей проводят
Г) пламя горящих органических веществ можно погасить, используя
ПРАВИЛА РАБОТЫ:
1) песок или порошковый огнетушитель
2) растворение проводят осторожно и в фарфоровой посуде
3) песок или углекислотный огнетушитель
4) растворение проводят осторожно, приливая холодную воду к веществу
5) растворение проводят осторожно, приливая вещество к холодной кислоте
Решение:
Приготовление растворов кислот — это ответственный процесс, так как большинство минеральных кислот являются опасными для органических субъектов, это действие проводят ПРИЛИВАЯ ВЕЩЕСТВО К ВОДЕ! Ответ 5.
Пламя горящего натрия можно погасить с помощью песка или порошкового огнетушителя(горящие щелочные металлы водой тушить НЕЛЬЗЯ), ответ 1.
Приготовление растворов твердых щелочей проводят естественно осторожно и в фарфоровой посуде, ответ 2.
Пламя горящих органических веществ можно погасить, используя песок или углекислотный огнетушитель, ответ 3.
Задание №9:
Установите соответствие между формулой вещества и его токсическими свойствами:
ФОРМУЛА ВЕЩЕСТВА:
А) CO2
Б) CO
В) HCl
Г) N2
ТОКСИЧЕСКИЕ СВОЙСТВА:
1) ядовитый газ желто-зеленого цвета
2) ядовитый газ с резким запахом
3) ядовитый газ без цвета и запаха
4) не ядовитый газ без цвета и запаха
5) ядовитый газ с запахом тухлых яиц
Решение:
Первый в списке — углекислый газ, каждый знает его физические свойства, потому что он является составной частью воздуха, а также представляет собой тот газ, который мы выдыхаем, ответ 4.
Следующий газ — угарный, это ядовитый газ без цвета и запаха, ответ 3.
Хлороводород — это ядовитый газ с резким запахом, ответ 2.
Последним веществом является азот, этот газ входит в состав воздуха(>70%), это газ без запаха и цвета, ответ 4.
Задание №10:
Установите соответствие между формулой вещества и областью его применения:
ФОРМУЛА ВЕЩЕСТВА:
А) C3H8O3
Б) AlCl3
В) CCl4
Г) CH4
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) в качестве топлива
2) в качестве катализатора в органическом синтезе
3) в качестве растворителя
4) в медицине и в косметических средствах
5) получение каучука
Решение:
C3H8O3 это глицерин, трехатомный спирт, который используется в косметических средствах и медицине, ответ 4.
Хлорид алюминия является катализатором в реакции изомеризации алканов, ответ 2.
Тетрахлоруглерод — это галогенпроизводное алканов, используемое в качестве растворителя, ответ 3.
Последнее вещество из списка — метан, так как он входит в состав нефти, то из него получают топливо для двигателей внутреннего сгорания, ответ 1.На этом все!
- Дисциплина: Химия
- Номер вопроса в билете: 26
- Баллы: 1
- Сложность: Базовый
-
Установите соответствие между высокомолекулярным веществом и способом его промышленного получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
-
ВЫСОКОМОЛЕКУЛЯРНОЕ ВЕЩЕСТВО
- А)фенолформальдегидная смола
- Б)резина
- В)каучук
-
СПОСОБ ПОЛУЧЕНИЯ
- 1)полимеризация
- 2)вулканизация каучука
- 3)гидрогенизация
- 4)сополиконденсация
Баллы: 0 из 1
- Подробное решение
-
фенолформальдегидная смола — это надо помнить, что формально реакция получения фенолформальдегидной смолы — это реакция поликонденсации. Поликонденсация — процесс синтеза полимеров из полифункциональных (чаще всего бифункциональных) соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (воды, спиртов и т. п.) при взаимодействии функциональных групп. Но тут нет поликонденсации, а есть сополимеризация. сополимеры — разновидность полимеров, цепочки молекул которых (макромолекулы) состоят из двух или более различных структурных звеньев. А тут как раз 2 молекулы мономеров фенол и формальдегид.
n
O
H
H
+
nH
C
O
HO
H
C
H
2n
+
(n-1)
H
2
O
резина — вулканизация каучука серой. Вулканизация — технологический процесс взаимодействия каучуков с
вулканизирующим реагентом, при котором происходит сшивание молекул
каучука в единую пространственную сеткукаучук — скорее всего речь идет про синтетический каучук, который часто неправильно называют и «натуральным»
это цис- полимер изопрена. Реакция полимеризации.n
H
2
C
C
H
3
C
C
H
C
H
2C
H
2
C
H
3
C
C
H
C
H
2n
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
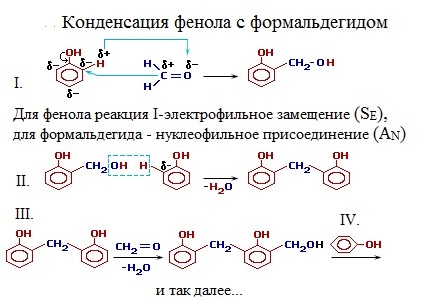
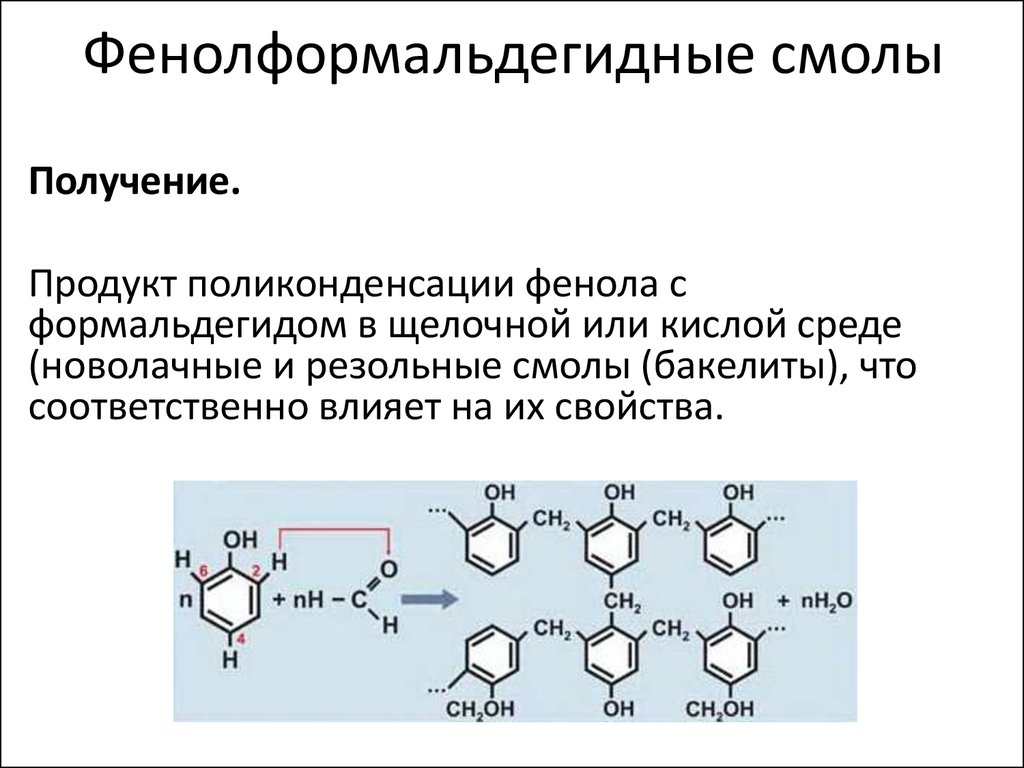
Получение фенолформальдегидной смолы уравнение реакции
Фенолформальдегидные смолы [-C6H3(OH)-CH2-]n – продукты поликонденсации фенола C6H5OH с формальдегидом CH2=O.
Взаимодействие фенола с формальдегидом идет по схеме:
Роль реакционноспособных функциональных групп в этих соединениях играют:
- в феноле – три С-Н-связи в орто— и пара-положениях (легче идет замещение в двух орто-положениях);
- в формальдегиде – двойная связь С=О, способная к присоединению по атомам С и О.
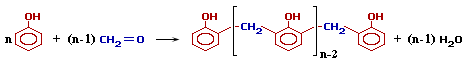
Это определяет возможность образования цепных макромолекул по схеме поликонденсации:
Реакция проводится в присутствии кислых (соляная, серная, щавелевая и другие кислоты) или щелочных катализаторов (аммиак, гидроксид натрия, гидроксид бария).
Механизм конденсации фенола с формальдегидом в условиях кислотного катализа
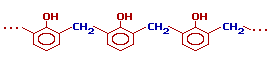
При избытке фенола и кислом катализаторе образуется линейный полимер –новолак, цепь которого содержит приблизительно 10 фенольных остатков, соединенных между собой метиленовыми (-СН2-) мостиками.
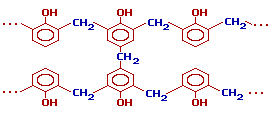
Новолаки – термопластичные полимеры, которые сами по себе не способны переходить в неплавкое и нерастворимое состояние. Но они могут превращаться в трехмерный полимер при нагревании их с дополнительной порцией формальдегида в щелочной среде. При использовании щелочных катализаторов и избытка альдегида в начальной стадии поликонденсации получаются линейные цепи резола:
При дополнительном нагревании эти цепи «сшиваются» между собой за счет групп -CH2OH, находящихся в пара-положении фенольного кольца, с образованием трехмерного полимера – резита:
Таким образом, резолы являются термореактивными полимерами. Фенолоформальдегидные полимеры применяются в виде прессовочных композиций с различными наполнителями, а также в производстве лаков и клея.
Учебный фильм «Фенолоформальдегидные пластмассы»
Учебный фильм «Термоактивные пластмассы»
Свойства, применение и структурная формула фенолформальдегидной смолы
Смолы могут быть получены из натуральных элементов либо промышленным методом, последние называются синтетическими. Они отличаются более приемлемой стоимостью и дают надежный результат при применении. Фенолформальдегидная смола является востребованным типом материала, который используется при строительстве и других работах. Подробно об особенностях формальдегидной смолы будет рассказано далее.
Свойства смолы
Смола с основой из фенола и формальдегида относится к синтетическому типу. Химическое уравнение элемента — C6H3(OH)-CH2-]n. Первым разработал вещество А. Байер, поняв, что реакция фенола и формальдегида при нагревании производит образование воды и полимера. Тот эксперимент дал хрупкий элемент, после его улучшили, сейчас в состав добавляются разные вещества для получения лучших свойств.
Фенол смолы химические свойства заключаются в следующем:
- Структурная характеристика – жидкие либо твердые;
- Образуется в кислой либо щелочной среде;
- Обладает высокой степенью электроизоляции;
- Устойчивость к механическим нагрузкам;
- Стойкость к ржавчине;
- Растворяется в щелочах, углеводороде, кетон, разбавитель хлористого типа.
Резольные смолы
Данный тип смол выделяется тем, что при нагреве и долгом сроке хранения получают неплавкое свойство, также не растворяются. Чтобы при производстве получить смолы под названием резольные они проходят следующие этапы:
- Резолы проходят этапы расплавления либо растворяются в спиртовом, ацетонном или водно-щелочном растворе. Способ дает смесь низко молекулярных слияний элементов реакции;
- Резитолы, получаются из веществ, которые называют резолами. Когда те долго хранятся либо подвергаются влиянию высоких температур. Не растворяются в спиртовом или ацетоном растворе, лишь немного набухают, однако при нагреве размягчаются;
- Резиты, на этой стадии отсутствует набухание в растворителях, размягчение тоже не происходит.
Применение материала
Фенолформальдегидная смола применяется в разных сферах деятельности, с помощью нее в промышленности изготавливают разные классы пластмассы. Использование в быту популярно, разный пластик получают при разном типе воздействия. Пластмасса часто используется в медицине.
Фенолформальдегид применяется при производстве лаковой продукции, клеевых растворов, герметиков.
Так она применяется для производства следующих изделий:
- Тормозные колодки в поездах, элементы автомобиля и т.п.;
- Абразивные приспособления;
- Детали электрических приборов;
- Корпусные части смартфонов;
- В радио-промышленной сфере;
- Для изготовления оружия и другой военной техники;
- Для изготовления посуды, которую не подвергают нагреву;
- Для бижутерии, сувенирной продукции;
- Другое.
Не используется смола для изделий, которые будут напрямую контактировать с пищей.
Механизм образования фенолоформальдегидных смол
Механизм получения смолы предполагает соединение к 1-му молю фенола от 1-3-х молей формальдегида в 2-х ортоположениях и пароположении. Когда второго элемента больше, то вырабатывается резольный тип вещества. Если фенола больше, то образуется новолачный тип.
Первая стадия реакции характеризуется получением в итоге резольной смолы типа А. Присутствие в данном процессе метилольных групп, способствует созданию реакционного взаимодействия поликонденсации, когда мономеры переходят в полимеры. Нагревательный процесс вырабатывает резит.
Фенолспиртовые вещества, когда фенола много образует метилолдиоксидифенилметан. После поликонденсации переходит в новолачный тип смолы.
Производство фенолформальдегидной смолы
Можно получить материал с использованием метана и метанола, тогда преобразуется формальдегид, который соединяют с фенолом. Технологический процесс выполняются следующим образом:
- Используется 40-процентный раствор формальдегида в объеме 3 мл;
- Смешивается раствор с 2-граммами кристаллического фенола;
- Добавляется 3 капли соляной кислоты;
- После закипания раствора он станет прозрачным;
- Если реакция должна проходить медленнее, то тару остужают;
- Чтобы проверить результат, можно в стадии резола использовать спирт, где он легко растворяется;
- Если раствор простоит долгое время, то способность растворяться исчезнет, вещество перейдет в резитол;
- В конце раствор нагревается и становится твердым, цвет переходит в красный.
Горение продукта не происходит, он подвергается обугливанию. Огонь приобретет желтый оттенок, и появится неприятный запах фенола.
Технологический процесс получения фенолоформальдегидной резольной смолы
Сырьевыми компонентами при создании резольных смол могут выбираться фенол, крезол, ксиленол, крезольно-фенольные фракции. Формальдегид используется в концентрации 36-40-процентов.
Могут производиться разные типы материала. Есть жидкие и твёрдые виды, последние применяются при изготовлении лаковой продукции. Бывают другие типы смол с использованием вместо фенола карбамида, карбамидные смолы тоже пользуются популярностью.
Экологические аспекты
Для экологии использование ядовитых компонентов при производстве смолы становится опасностью. Проблемой считается вредность токсичных элементов, а именно процесс их утилизации. Так СанПиН следит за использование элементов, и количеством которые применяются.
Вред материала
Положительные стороны применения смолы сопровождаются вредом, которые вещества могут принести физическому здоровью человека. Фенол и формалин относятся к ядовитым элементам. Им характерны следующие вредные свойства:
- Влияют негативно на нервную систему организма;
- Способствуют появлению сыпи и дерматитов;
- Могут вызвать аллергическую реакцию и бронхиальную астму.
Регулируется не только количество используемых веществ при производстве, но также безопасность работы. Из-за этого фенолформальдегидная смола вреднее эпоксидной.
Процесс изготовления
В прибор добавляется фенол, аммиак и формалин, производится нагревательный процесс, температурный режим ставится на 80-градусов. Когда нужная температура достигнута, то подача пара останавливается. В котле же температура увеличивается и дальше до 100-радусов, способствуя продолжению реакции. Проверяется результат по степени помутнения вещества, когда результат достигает 75-80 градусов, процесс завершается.
Может производиться дальнейшая сушка смолы, если необходимо получить твердый вариант. Если нужен жидкий тип, то процесс завершается после получения конденсата и проверки результата. После отделяется вода от полученной смолы. Резол переливается в емкость.
Крезолоформальдегидные смолы
Данный тип смол получают с использованием пара-, орто- и метакрезола. Берется крезол с формалином в равных пропорциях. Если больше формалины, то вырабатывается резольные смолы, если крезола, то новолачные. Технологический процесс производства одинаков с изготовлением фенолформальдегидных смол.
Жидкие бесспиртовые бакелитовые смолы
При промышленном производстве электроизоляционной техники часто используется данный тип смол. Выбираются типы ОФ и ОК. Связано это с возможностью не использовать дорогой этиловый спирт (этанол).
Смолу получают с помощью конденсации фенола с формальдегидом, также необходим аммиачный вид катализатора. Устройства для изготовления используются те же, что и для работы с сухими смолами. Применяется температурный режим более низкий, до 85-градусов. Не проводится этап просушки, просто удаляется вода от смолы.
Малорастворимые фенолоформальдегидные смолы
Когда применяется реакция конденсации фенола и формальдегида, то получаются не растворяющиеся в масле смолы. Смена фенола на его производные способствует получению маслорастворимых смол. Смешения элементов с маслами дает возможность получить качественные лаки.
Также можно получить масляные эмаль-лаки, которые применяются для эмалирования проводов. Распространено создание разных реакций для получения смол, используемых в электроизоляционных работах.
Этерифицированные смолы
Этерификация способствует соединению смолы с растительными маслами и иными типами смол. Процесс производится с помощью бутилового спирта. Так при определённых условиях можно, например, получить бутоксикрезолоформальдегидную смолу РБ.
Смола производится растворного типа в бутаноле, выделится нижеописанными свойствами:
- Бесцветная жидкость с желто-красным оттенком по виду;
- Уровень вязкости ВЗ4 при 2-градусном воздействие составляет 100-300с.
Данный тип материала используется в 60%-растворе для изготовления электроизоляционных лаковых продуктов (Фл-98, ПЭ-933).
Фенолформальдегидная смола позволяет повысить качество разнообразной продукции, с помощью нее производят различные материалы. Она отличается рядом положительных свойств. Но является опасным веществом, поэтому при производстве должны соблюдаться правила СанПиНа. Ее изобретение важным звеном для получения разнообразных материалов.
Видео: Получение фенолформальдегидной смолы
Фенолоформальдегидные смолы
В зависимости от природы и соотношения компонентов, а также от применяемого катализатора фенолоформальдегидные смолы делят на два вида:
- термореактивные или резольные;
- термопластичные или новолачные смолы.
Резольные смолы
При нагревании или длительном хранении эти смолы переходят в неплавкое и нерастворимое состояние, а новолачные смолы термопластичны и могут сохранять плавкость и растворимость при длительном хранении, а также при нагреве до 200 °С. Резольные смолы при переходе из плавкого растворимого состояния в неплавкое и нерастворимое проходят три стадии, характеризующие их состояние:
- Резолы — смолы в стадии А. Плавятся при нагревании и растворяются в спирте, ацетоне и в водных растворах щелочей. Представляют собой смесь низкомолекулярных соединений продуктов реакции.
- Резитолы — смолы в стадии В. Образуются при нагревании или длительном хранении резолов, представляют собой смесь резольной смолы и высокомолекулярных неплавких и нерастворимых соединений. Они нерастворимы в спирте и ацетоне, а только набухают в них, не плавятся, но размягчаются при нагревании.
- Резиты — смолы в стадии С. Содержат в основном трехмерные высокомолекулярные соединения. Не плавятся и не размягчаются при нагревании и нерастворимы и не набухают ни в каких растворителях. Резольные смолы в стадии С обладают высокими физико-электрическими свойствами.
Механизм образования фенолоформальдегидных смол
Функциональность фенола составляет 1–3, т. е. на 1 моль фенола может присоединяться от 1 до 3 молей формальдегида в двух ортоположениях и в параположении (рис. 1).
Рис. 1.
При эквимолекулярных количествах реагентов или при избытке формальдегида в присутствии щелочного катализатора образуются смолы резольного типа, при избытке фенола в кислой среде — новолачные. При синтезе резольных смол обычно берут на 6 молей фенола 7 молей формальдегида, и реакция идет по схеме, приведенной на рис. 2.
Рис. 2.
На первой стадии процесса одновременно получаются оксибензиловый спирт, ди- и триметилольные производные фенола (рис. 3), которые реагируют между собой с образованием макромолекулы резольной смолы. В щелочной среде в результате взаимодействия фенолоспиртов за счет метилольных групп в пароположении образуется резольная смола в стадии А (рис. 4).
Рис. 3.
Рис. 4.
Наличие в этих макромолекулах метилольных групп позволяет им вступать в дальнейшие реакции поликонденсации между собой. Под влиянием дальнейшего нагрева происходит процесс отверждения смолы с выделением воды и образованием молекул трехмерной структуры резита (рис. 5).
Рис. 5.
Процесс отверждения, то есть превращения в резит, может происходить в условиях нормальной температуры, но длительное время (от 6 мес. до 1 года). При повышении температуры скорость сильно возрастает.
Новолачные смолы образуются при избытке фенола в кислой среде. Обычно берут 7 молей фенола и 6 молей формальдегида, в качестве катализатора применяют соляную кислоту. В этом случае реакция идет по схеме, указанной на рис. 6.
Рис. 6.
Фенолоспирты при избытке фенола реагируют с фенолом и образуют метилолдиоксидифенилметан (рис. 7), который при дальнейшей поликонденсации дает новолачные смолы, имеющие строение, показанное на рис. 8.
Рис. 7.
Рис. 8.
В новолачную смолу входит смесь соединений линейного строения с молекулярной массой 200–1300. В отличие от резола молекулы новолачной смолы не содержат метилольных групп и поэтому не способны вступать в реакцию поликонденсации между собой и не образуют пространственных структур. Новолачные смолы могут быть переведены в неплавкое и нерастворимое состояние путем обработки их формальдегидом, параформом или чаще всего гексаметилентетрамином при повышенной температуре.
Технологический процесс получения фенолоформальдегидной резольной смолы
В производстве резольных смол в качестве сырья применяют фенол, крезол, ксиленол, а также фенольно-крезольные фракции, содержащие их смесь. Применяется и смесь ФДК (фенол, дикрезол, ксиленол). Формальдегид применяют в виде 36–40-процентного раствора (формалин).
Резольные фенолоформальдегидные смолы изготавливают различных марок, в виде жидких (ОФ, ОК) или твердых смол (ИФ, ИК) для получения спиртовых лаков. Приведем процесс получения резольной (бакелитовой) смолы.
Состав:
Фенол 100% — 6 молей
Формалин 40% — 7 молей
Аммиак 25% — 5% (по массе фенола)
Процесс изготовления
В реактор загружают фенол (в виде водного раствора), формалин и аммиак. Смесь в котле нагревают до 80 °С, подавая в рубашку котла водяной пар. При достижении 80 °С начинается экзотермическая реакция, и подачу пара прекращают. Вследствие экзотермичности процесса температура в котле поднимается до 100 °С, и реакция продолжается. В это время холодильник работает по обратной схеме для возможности возврата паров формалина в котел. Процесс варки смолы контролируют по температуре, при которой происходит помутнение охлаждаемой в стаканчике пробы смолы.
Процесс изготовления смолы заканчивают, когда температура помутнения пробы смолы (разделение на два слоя) достигнет 75–80 °С.
Для процесса сушки смолы холодильник переключают на прямую схему и соединяют со сборником конденсата и вакуум-насосом. Массу в реакторе нагревают до70–80 °С и при этой температуре и вакууме 600–700 мм рт. ст. сушат до момента, когда скорость полимеризации будет в пределах 90–120 с при нормальных условиях (температура 18 °C и давление 760 мм рт. ст.). Готовую смолу выгружают через нижний сливной штуцер либо (при получении лака) разбавляют спиртом.
Для получения жидких резольных смол сушку смолы под вакуумом не производят, а процесс изготовления смолы заканчивают после процесса конденсации и определения готовности смолы. После этого смолу перекачивают с помощью сжатого воздуха в отстойник, где происходит отделение надсмольной воды от смолы. После отделения водного слоя жидкий резол (нижний слой) сливают в тару.
Рис. 9. Схема производства фенолоформальдегидных смол и лаков
1 — котел для варки бакелитовых смол;
2 — феноловыплавитель;
3 — конденсатор;
4 — монжус для фенола;
5 — монжус для формалина;
6 — резервуар с обогревом;
7 — резервуар для формалина;
8 — резервуар для аммиака;
9 — монжус для аммиака,
10 — бак для спиртовых лаков;
11 — бак_отстойник;
12 — весовой мерник для фенола;
13 — весовой мерник для формалина;
14 — мерник для аммиака;
15 — мерник для растворителя;
16 — конденсатор;
17 — пеноловушка;
18 — вакуум_насос;
19 — шестеренчатый насос;
20 — вакуум_ловушка
Крезолоформальдегидные смолы
Технический трикрезол, применяемый для производства смол, представляет собой смесь трех изомеров крезола: орто-, мета- и паракрезола (рис. 10).
Рис. 10.
При взаимодействии с формальдегидом орто- и паракрезол реагируют только в двух точках, а метакрезол в трех точках, поэтому могут образоваться смолы с различными свойствами. Так, орто- и паракрезолы образуют термопластичные смолы, метакрезол может образовывать термореактивные. Поэтому количество метакрезола в трикрезоле должно быть не менее 40%. Трикрезол с таким содержанием метакрезола реагирует с формальдегидом так же, как и фенол.
При изготовлении крезолоформальдегидных смол крезол и формалин берут примерно в равных количествах. При избытке формалина получаются резольные смолы, а при избытке крезола — новолачные. Процессы изготовления этих смол аналогичны процессам изготовления фенолоформальдегидных смол.
Свойства крезольных смол несколько отличаются от фенольных. У крезольных смол время полимеризации, влагостойкость и электрические свойства выше.
В таблице 1 приведены сравнительные характеристики фенольных и крезольных смол, в таблице 2 — свойства смолы в стадии С.
Смола
Температура размягчения, °С
Период полимеризации при 160 °С, с
Содержание
свободного фенола, %
Влажность, %
Фенолоформальдегидная спирторастворимая марки ИФ
источники:
http://kraski-net.ru/spetsialnye-materialy/dopolnitelnye-sredstva/svojstva-primenenie-i-strukturnaya-formula-fenolformaldegidnoj-smoly
http://kit-e.ru/circuitbrd/fenoloformaldegidnye-smoly/
Таблица 1. Свойства фенолоформальдегидных (бакелитовых) смол
-
Предельные спирты
-
Фенолы
-
Альдегиды
-
Карбоновые кислоты
-
Жиры
-
Углеводы
Фенолы
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных
групп (OH), присоединенных к бензольному кольцу.
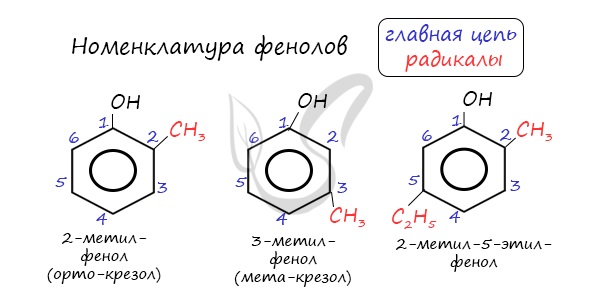
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие
номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования,
нитрования протекают в орто- и пара-положениях.
Получение фенолов
- Гидролиз галогенбензолов
- Кумольный способ
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.

Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению,
в результате получается фенол и ацетон.

Химические свойства фенолов
- Кислотные свойства
- Галогенирование
- Реакции с кислотами
- Гидрирование
- Поликонденсация фенолов с формальдегидом
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей — фенолятов.
В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)

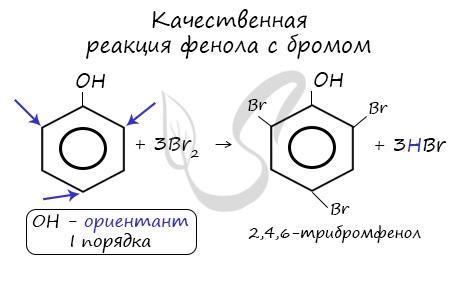
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок
трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал —
нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.

При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.

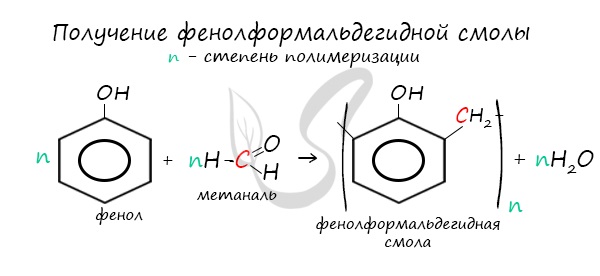
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию
смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Фенолы
1. В отличие от предельных одноатомных спиртов, фенолы реагируют с
Na
NaOH
CH3COOH
HCOOH
В отличие от предельных одноатомных спиртов, фенолы реагируют с щелочами, например NaOH.
2. Качественной реакцией на фенол является реакция с
Азотистой кислотой
Азотной кислотой
Натрием
Бромной водой
Качественной реакцией на фенол является реакция c бромной водой.
3. В результате кумольного синтеза фенола, помимо фенола, получают
Ацетон
Этан
Ацетилен
Пропадиен
В результате кумольного синтеза фенола, помимо фенола, получают ацетон (пропанон-2)
4. Гидроксогруппа в молекуле фенола вступает как
Ориентант II порядка
Ориентант I порядка
Гидроксогруппа в молекуле фенола вступает как ориентант I порядка.
5. Фенол с метаналем вступает в реакцию
Гидратации
Поликонденсации
Дегидрирования
Дегидратации
Фенол с метаналем вступает в реакцию поликонденсации, в результате которой получают фенолформальдегидную смолу.