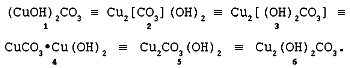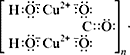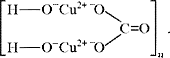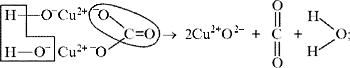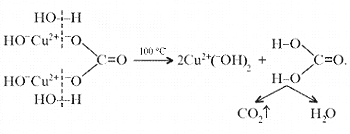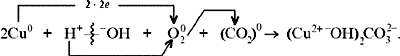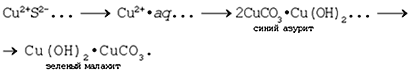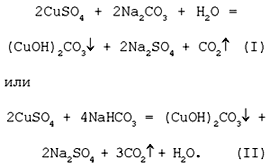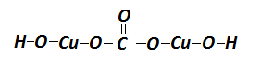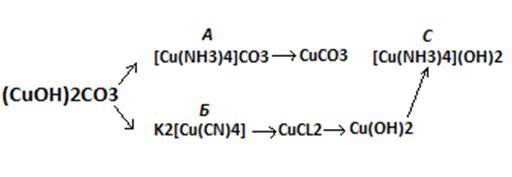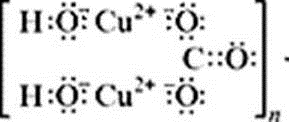Малахит и его химическая природа
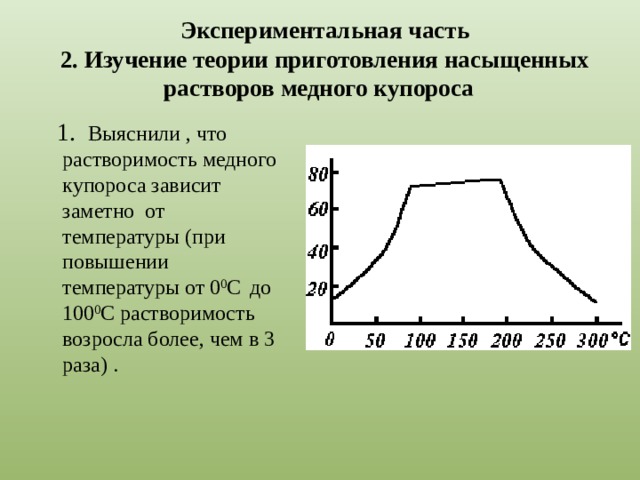
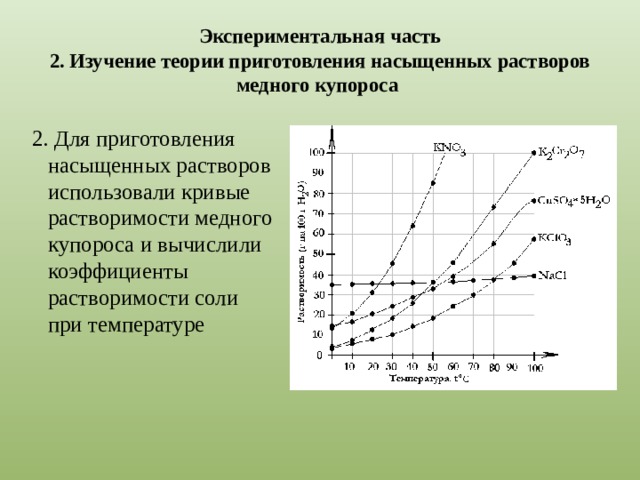
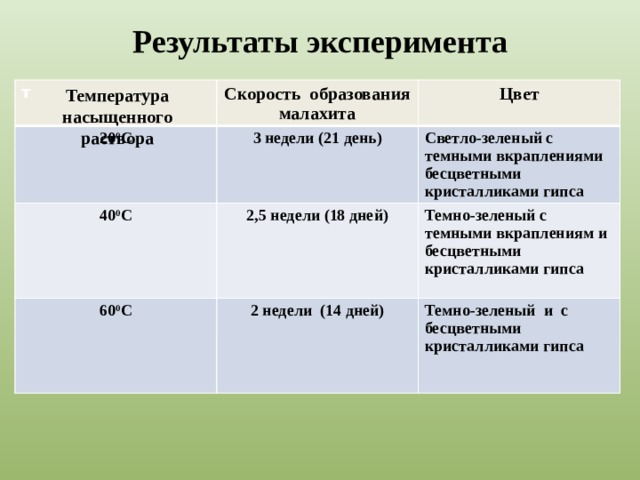
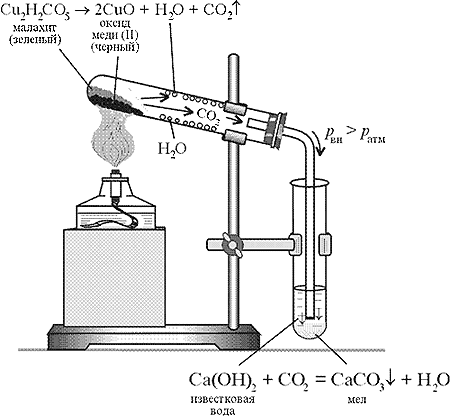 |
Рис.
|
В школьных учебниках описывается
разложение малахита как пример реакции
разложения (рис.).
Обоснование состава малахита вытекает из его
количественного анализа: (Сu) = 57,48%,
(Н)
= 0,91%, (С) = 5,43%,
(О) = 36,18%.
CuxHyCzOk
= ?
Исходя из закона постоянства состава веществ и
понятия «массовая доля», имеем:
63,55х : 1у : 12z : 16k = 57,48 :
0,91 : 5,43 : 36,18.
Освобождаемся от коэффициентов при
неизвестных:
х : у : z : k = 57,48/63,55 :
0,91/1 : 5,43/12 : 36,18/16 = 0,9045 : 0,91 : 0,4525 : 2,2613.
Делим отношение данных чисел на меньшее из них
– находим простейшие мольные отношения как
отношения целых чисел:
х : у : z : k = 0,9045/0,9045 :
0,91/0,9045 : 0,4525/0,9045 : 2,2613/0,9045
1 : 1 : 0,5 : 2,5 = 2 : 2 : 1 : 5.
Состав вещества отвечает формуле Cu2H2CO5.
Всесторонние исследование привели к более
содержательной формуле: Сu2(СО3)(ОН)2.
С учетом современных знаний о составе ионных
кристаллов мы можем записать формулу малахита:
Состав малахита различные авторы выражают
идентично (имея в виду ионный состав кристалла):
У Н.С.Ахметова – СuСО3•3Сu(ОН)2, у
Д.И.Менделеева – СuO2H2CuCO3, что
ближе соответствует формуле 4.
На мой взгляд, если иметь в виду кристаллическую
структуру малахита, состав ионного кристалла
наиболее полно и наиболее содержательно
отражает такая запись:
где n = f(mкрист).
Количество вещества монолитного
кристаллического образования – от
микроскопической частицы до крупного
монокристалла – характеризуется такими
параметрами: твердость = 3,5–4,0 (в среднем около 3,8),
плотность = 3,9–4,1 г/см3.
У малахита – моноклинная система кристаллов,
игольчатых или призматического вида, обычно
сросшихся. Малахит как самоцвет (уральские
самоцветы известны с 1635 г.) имеет натечное
строение, разные образцы могут иметь различную
текстуру. Цвет – преимущественно зеленый. Отсюда
и название malachite (франц.), но первоисточник –
греческое слово
– мальва, по сходству с цветом листьев
ярко-зеленого оттенка. Правда, у малахита он
менее выраженный, более землистый.
С учетом электронно-ионных представлений
формулу малахита можно представить таким
образом:
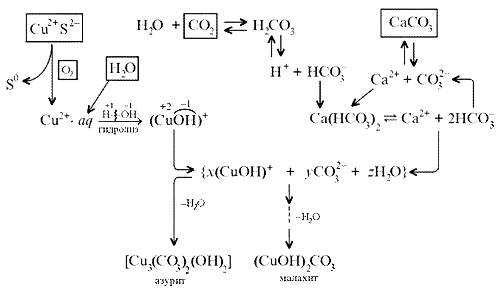
На схеме мы четко видим, что малахит – основный
карбонат меди(II) (когда-то он так и назывался –
основная углекислая медь). Данная запись
отражает ионные взаимодействия.
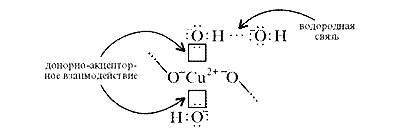
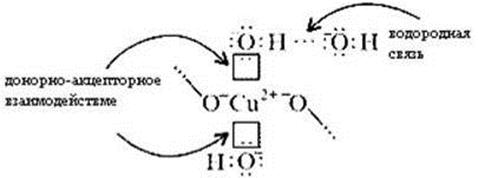
В реальном кристалле имеют место другие типы
взаимодействий – водородная связь между
гидроксильными ионами и донорно-акцепторное
взаимодействие между ионом меди и кислородом
гидроксила:
За счет этого достигается и плотная упаковка, и
достаточно высокая механическая прочность, и
твердость.
На уровне ионно-структурных представлений
химическое строение малахита (для структурных
частиц – химическое строение, для твердого тела
– строение ионного кристалла) можно отразить
следующим образом:
Следовательно, запись (CuOH)2CO3 –
основная соль, дигидроксикарбонат меди(II) –
наиболее полно отражает состав малахита.
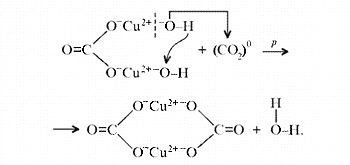
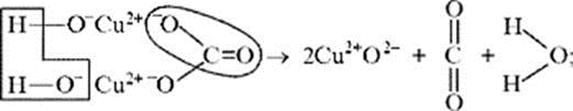
Рассмотренная выше реакция разложения малахита
в зависимости от этапа изучения химии может быть
описана:
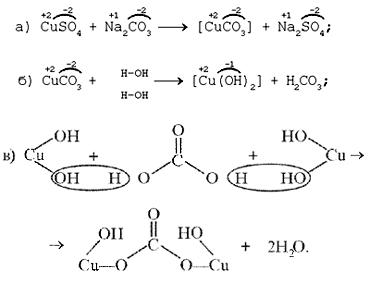
а)
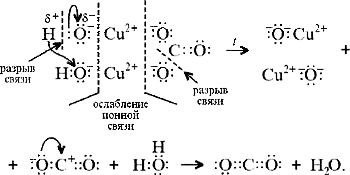
б) на ионно-структурном уровне:
в) на электронно-ионном уровне:
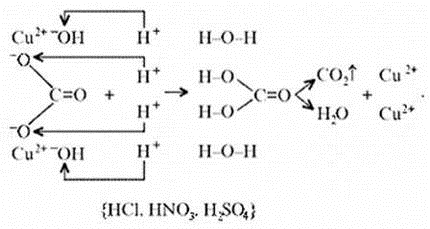
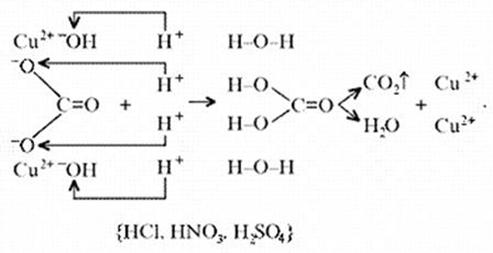
Знание свойств карбонатов и нерастворимых в
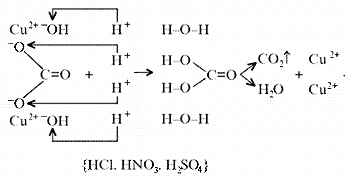
воде оснований позволяет утверждать, что малахит
будет растворяться в кислотах:
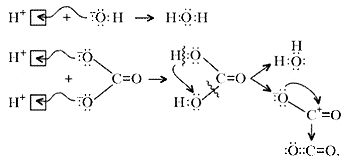
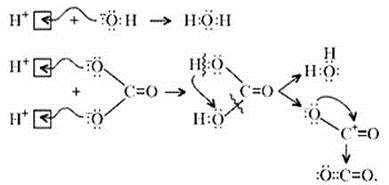
Примечание. Ион Н+ присоединяется к
кислороду в составе гидроксид- и карбонат-ионов
по донорно-акцепторному механизму:
Малахит можно рассматривать как производное
гидроксида меди(II), в котором часть гидроксильных
ионов замещена на карбонат-ионы (таково,
собственно, определение понятия «основная
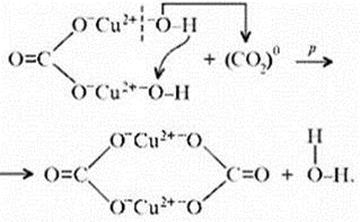
соль»). Кроме реакции с кислотами при
определенных условиях он может реагировать с
кислотными оксидами. Мысль совершенно
невероятная, учитывая нерастворимость малахита
в воде – главнейшее условие взаимодействия
кислотных оксидов с основаниями, точнее со
щелочами. Однако имеет место реакция:
«Химические события» соответствуют такому
механизму:
Читатель может обратить внимание на
образование средней соли. Теперь считается
доказанным, что карбонат меди(II) можно помещать в
список солей угольной кислоты.
Малахит, как известно, не растворяется в воде, но
может подвергаться гидролизу (из-за гидролиза,
собственно, невозможно получить осадок среднего
карбоната меди):
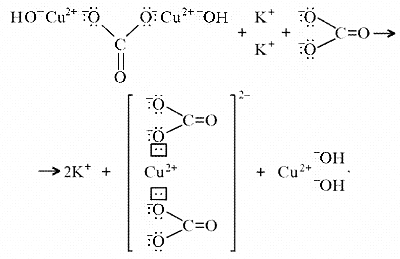
Из-за способности ионов меди образовывать
комплексные ионы малахит растворяется, в
частности, в карбонатах щелочных металлов:
Теоретическим обоснованием этому может
служить запись:
Исходя из изложенного в этой статье и знаний
школьного уровня, можно предложить схему
генетических связей между веществами на основе
малахита, меди и ее соединений.
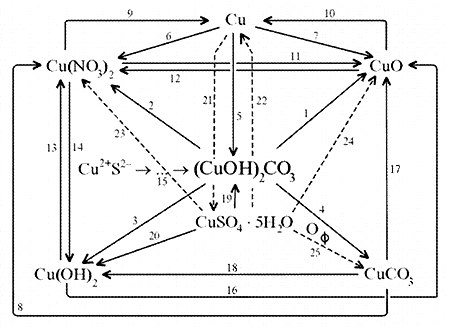 |
Схема генетических связей:
|
1. Разложение малахита.
2. Растворение малахита в азотной кислоте.
3. Гидролиз малахита.
4. Реакция с углекислым газом.
5. Коррозия меди на воздухе (образование зеленого
налета на медных предметах во влажном воздухе):
6. Растворение меди в азотной кислоте.
7. Прокаливание меди на воздухе.
8. Взаимодействие твердого тела карбоната меди(II)
c крепким раствором азотной кислоты.
9. Восстановление меди из ее соли более активным
металлом или в результате электролиза.
10. Восстановление меди из ее оксида водородом или
другим удобным восстановителем (монооксид
углерода, древесный уголь).
11. Нагревание твердого тела нитрата меди(II) до
полного разложения.
12. Растворение оксида CuO в достаточно крепкой
азотной кислоте.
13. Нейтрализация основания Cu(OH)2 азотной
кислотой.
14. Взаимодействие нитрата меди(II) с раствором
щелочи.
15. Образование малахита в природных условиях. В
самых общих чертах генезис сложных
геохимических процессов можно представить так:
Примечание. В природном минерале (малахит) есть
примеси других ионов, особенно цинка, который
изоморфно замещает медь, а также Ca2+, Fe2+.
Присутствуют и некоторые неметаллы, в первую
очередь фосфор.
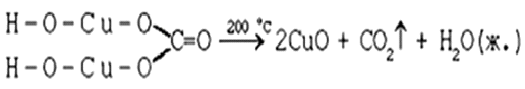
16. Нагревание твердого вещества Cu(ОН)2
(несильно, чтобы не перевести оксид CuO в оксид Cu2O)
до полного разложения.
17. Нагревание CuCO3 до полного разложения на
CuO и СО2.
18. Гидролиз карбоната меди(II).
19. Получение порошкообразного малахита в
лабораторных условиях. Формально химизм
образования дисперсного малахита можно выразить
следующими уравнениями:
Однако это именно тот случай, когда «гладко
пишутся бумаги, а кругом одни овраги».
Химизм образования малахита, если рассматривать
его по стадиям, не может быть однозначно
представленным, здесь допускается вариативность
мышления.
Последовательность превращений для уравнения (I):
Последовательность ионных превращений для
уравнения (II):
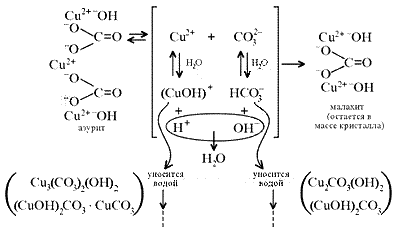
Этим и объясняется слоистая структура
минерала. Концентрация ионов (СuОН)+, (FеОН)+,
(ZnОН)+, Са2+, ,
при
совместном присутствии в растворах минералов
непостоянная. Поэтому испарение воды ведет к
образованию своеобразного рисунка и различной
величины кристаллов в географически разных
местах формирования: Россия (Урал, район Нижнего
Тагила), США (Невада, Юта), Африка (Конго) и др. К
сожалению, технология выращивания кристаллов
малахита в промышленных масштабах засекречена…
20. Взаимодействие сульфата меди(II) со щелочью
аналогично п. 14.
21. Медную стружку обрабатывают
концентрированной серной кислотой при несильном
нагревании. Образовавшийся раствор упаривают до
начала кристаллизации.
22. Восстановление меди из сульфата меди(II)
аналогично п. 9.
23. К раствору сульфата меди(II), который образуется
при растворении в воде медного купороса,
приливают раствор нитрата бария.
Над образующимся осадком сульфата бария будет
находиться раствор нитрата меди, который можно
или декантировать, или отделить фильтрованием.
24. Если прогревать медный купорос в фарфоровой
чашке, то постепенно будет происходить не только
обезвоживание кристаллогидрата, но и разложение
сульфата до оксида меди, сернистого газа и
кислорода.
25. Знак (пустое
множество) обозначает, что данную реакцию
осуществить невозможно.
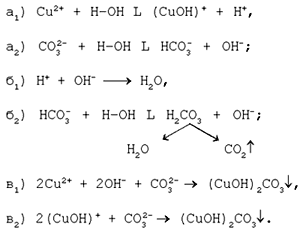
Механизм образования малахита в близком к истине
приближении видится таким (исходные и
включающиеся в процесс вещества взяты в рамки):
Образование малахита из азурита
поддается объяснению, если учесть, что
нерастворимые ионные кристаллы не абсолютно
нерастворимы:
ЛИТЕРАТУРА
Малахит. БСЭ, т. 15, с. 276;
Марченков В.И. Ювелирное дело. М.: Высшая
школа, 1975, с. 37; Соболевский В.И. Занимательная
минералогия. М., 1971; Пiчугiн Б.В., Федченко Ю.З.
Шкiльний визначник мiнералiв i гiрcких порiд. Киiв,
1982;
Ричард С.Митчел. Названия минералов. Что они
означают. М., 1982;
Некрасов Б.В. Основы общей химии, т. 3. М.:
Химия, 1970;
Глинка Н.Л. Общая химия. М.: Высшая школа, 1982;
Ахметов Н.С. Неорганическая химия. М.:
Просвещение, 1992;
Химия. Справочник. Под ред. В.Шретер и др. Пер. с
нем. М.: Химия, 1989;
Реми Г. Курс неорганической химии, т. 1–3. М.:
Мир, 1972–1974;
Михайленко Я.И. Курс общей и неорганической
химии. М., 1966;
Неницеску К. Общая химия. М.: Мир, 1968;
Полинг Л. Общая химия. М.: Мир, 1974;
Карапетьянц М.Х., Дракин С.И. Общая и
неорганическая химия. М.: Химия, 1981;
Менделеев Д.И. Основы химии, т. 1, с. 359; т. 2, с.
291. М.: Гос. науч.-техн. изд-во хим. лит., 1947;
Кульман А.Г. Общая химия. М., 1968;
Леенсон И.А. Загадки малахита. Химия и жизнь,
1993, № 9, с. 56–60;
Карякин Ю.В., Ангелов И.И. Чистые химические
реактивы. М., 1955, с. 352.
Е.Г.ШМУКЛЕР,
кандидат педагогических наук,
заслуженный учитель Украины
(г. Славута, Украина)
Синтез малахита
Содержание
1. Историческая справка. Области
применения вещества. Реклама
. Теоретическая часть
.1 Систематическая характеристика
вещества
.2 Способы получения вещества
. Эксперементальная часть
.1 Условия безопасного и
эффективного проведения синтеза
.2 Методика синтеза
.3 Идентификация вещества
.4 Расчет массовой доли выхода
вещества
. Творческое задание
Список используемой литературы
1. Историческая справка. Области применения
вещества. Реклама
Малахит, являющийся одним из соединений меди,
один из красивейших минералов. По выражению А.Е. Ферсмана, это «камень яркой,
сочной, жизнерадостной и вместе с тем шелковисто-нежной зелени». Название этот
минерал получил от греческого malaкh (маляхэ) —
мальва, окраска листвы которой похожа на цвет малахита.
Окраска малахита очень богата оттенками от
светло-зеленого, почти голубого, до темного, густо-зеленого тона с характерным
черноватым отливом. Очень прихотлива узорчатая разрисовка малахита: ленточная,
струистая, лучисто-звезчатая, конценрически-круговая.
В моей работе речь пойдет именно об этом
замечательном минерале, который по праву может считаться русским, так как
только в нашей стране были открыты те громадные месторождения, которые
прославили его на весь мир.
Историческая справка
Малахит в предгорьях Урала был впервые открыт в
1635 г. и использовался для выплавки из него меди. В конце XVIII века на
уральских медных рудниках стали попадаться крупные скопления сплошного
густозеленого малахита. Первым прославился малахит Гумишевского рудника;
Замечательные образцы этого камня хранятся во многих наших музеях. До сих пор в
музее Горного института в Ленинграде находится великолепный монолит
гумишевского малахита, весящий более 1,5 тонны.
Яркая красота уральского камня произвела большое
впечатление. Малахит быстро завоевал общие симпатии, стал модным камнем,
сравнявшись в цене с дорогими самоцветами. Наряду с лучшими драгоценными
камнями он употреблялся на мелкие изделия — бусы, броши, серьги, вставки для
колец. В большом ходу были также малахитовые табакерки.
Но в начале XIX века (1810-1814 годы) были
открыты Меднорудянские залежи малахита, подобных которым человечество еще не
знало. Здесь были какие-то особенные геологические условия, приведшие к
одновременному скоплению больших количеств меди и больших количеств углекислоты.
Исключительная мощность месторождения наводит на мысль, что малахит возник
здесь не обычным путем переработки первичных медных руд холодными углекислыми
водами поверхности. Можно предполагать, что горячие, поднимающиеся из глубины
медоносные растворы внедрились по трещинам в сплошную массу известняков,
растворяли и перерабатывали их, образуя среди них большие неправильные массы
жилы малахита. Богатства этого месторождения были обнаружены не сразу. В первые
годы добыча малахита из новооткрытого Меднорудянского месторождения была
невелика. Лишь в двадцатых годах XIX столетия разработки рудника достигли
основных залежей малахита и показали невиданный их масштаб. Уже не куски и
кусочки нарядного камня, годные для брошей и табакерок, а громадные глыбы превосходного
сплошного малахита извлекались из чудесного рудника, слава о котором быстро
разнеслась по всему свету. Рудник выдавал ежегодно от 30 до 80 тонн
первоклассного цветного камня. Вес наибольшей глыбы малахита, обнаруженной в
недрах рудника, был путем расчета определен в 500 тонн.
Это месторождение по своему богатству, мощности,
пригодности для изделий и для облицовки архитектурных украшений, а так же по
красоте узоров и по чистоте окраски зеленых тонов является до сих пор
единственным на всем земном шаре. Не приходится удивляться тому, что после
такого открытия в истории нашего камня наступила на несколько десятков лет
«малахитовая эпоха». Малахит стал излюбленным поделочным камнем. Но теперь
кроме бесчисленных мелких предметов, ювелирных украшений и тому подобного,
малахит начинает применяться в крупных изделиях и даже в зодчестве, прекрасные
образцы которых стали теперь достоянием народа.
После многих лет непрерывной добычи малахита
мощные месторождения Урала были, конечно, сильно истощены. Но говорить об их
полной выработанности, конечно, не приходится. В недрах земли, может быть даже
в районе знаменитых уральских месторождений, еще хранятся многие десятки тонн
яркого зеленого камня.
В 1835 г. была обнаружена огромная глыба
малахита массой 250 тонн, а в 1913 г. — массой более 100 тонн.
Из маленьких кусков малахита изготовлялись
великолепные краски.
Этот красивый ювелирно-поделочный камень с эпохи
неолита вплоть до античного времени служил для человека, прежде всего медной
рудой, а также краской и химической добавкой в стекло.
Изделия из малахита разнообразны по своим формам
и назначению. Монументальные вазы украшали интерьеры дворцов, освещенные
торшерами из камня. В парадных комнатах дворцов стояли столы, инкрустированные
зеленым камнем. Мелкие изделия вроде шкатулок, ларцов, чернильных приборов,
табакерок стали предметами обихода более широких слоев общества. Строгие формы
малахитовых изделий великолепно сочетаются с цветовым богатством камня и его
рисунком.
Металлурги в эпоху бронзового века, когда
малахит был основным источником чистой меди, просто выплавляли ее из него.
Медь, получаемая из него, была гораздо важнее самого поделочного камня.
Этот минерал издавна привлекал внимание людей.
Древние греки украшали малахитом нарядные здания и залы. В Древнем Египте из
малахита, добываемого на Синайском полуострове, изготовляли камеи, амулеты и
украшения.
Активно применяли малахит в косметических целях:
в Древнем Египте его порошок наносили на верхние веки, защищая таким образом
роговицу глаза от беспощадного африканского солнца. Лишь во времена Древнего
Рима камнерезы оценили его как великолепный поделочный камень, в полной мере
открыв в нем сочность природных растительных красок и очарование нежного узора.
Из малахита стали изготовлять амулеты, печати,
вставки, а также детали интерьеров. В практических целях малахит используется
до сих пор. Он является спутником, а значит поисковым признаком медных руд,
залегающих близко к земле.
Области применения
Малахит относится к минералам, в которых
соединились польза от практического использования и природная красота.
Ценный поделочный декоративный камень. Наиболее
эффектен плотный малахит зональной структуры, при полировке дающий красивый
рисунок. Медная зелень — важный поисковый признак на месторождениях меди.
Красота и прочность камня сделали его одним из
важнейших материалов в искусстве. Из малахита изготовлялись броши.
Исключительно красивы столешницы, особенно мозаичные. В коллекции изделий из
камня Эрмитажа одно из первых мест принадлежит предметам из малахита — около
200 ваз, столешниц, торшеров и других произведений камнерезного искусства.
В Эрмитаже декоративные вазы, чаши, торшеры и
канделябры из малахита и другого цветного камня размещены в Галерее древней
живописи, в зале итальянской школы, на площадке Советской лестницы, в
Фельдмаршальском и Георгиевском залах. Наиболее художественно ценные бытовые
вещи из малахита выставлены в Малахитовом зале. В его убранстве широко
использован малахит. Вдоль длинных сторон зала установлено 8 малахитовых
колонн, расположенных попарно, вдоль коротких сторон — 8 пилястров с капителями
на белых мраморных постаментах. Под огромными зеркалами в деревянных золоченых
рамах вделаны большие малахитовые камины. В центре паркетного пола, откуда
расходятся деревянные лучи, стоит малахитовая ваза на треножнике из золоченой
бронзы с крылатыми женскими фигурами и козьими ногами. Вдоль стен и окон стоят
покрытые малахитовой мозаикой столы, торшеры и вазы. В четырех витринах
выставлены разнообразные изделия из малахита — настольные украшения,
пресс-папье, письменные приборы, шкатулки и коробочки для бумаг и др.
Кроме чаш, ваз, канделябров и бытовых изделий в
Эрмитаже хранится памятник искусства прошлого века — «Малахитовый храм»,
выполненный в виде античного храма-ротонды. В нем малахит применен в отделке
колонн.
В настоящее время изделия из малахита — бусы,
броши, перстни, кулоны — ценятся наравне с полудрагоценными камнями и
пользуются большим спросом..
Из мелкой крошки изготавливается минеральный
пигмент и краски.
Со времен Древнего Египта малахитовую руду
использовали для получения меди.
Реклама
Малахит — водный карбонат меди всех оттенков
зеленого цвета, вплоть до черно-зеленого. В древности его считали камнем врачей
и ученых, символом исполнения желаний. В Древнем Египте женщины раствором
малахитовой зелени удлиняли глаза, порошком малахита наносили зеленые тени.
Считается, что малахит приносит исполнение желаний, он популярен как детский
амулет. Его надевают на шею ребенку для защиты от болезней и опасностей. В
старину носили перстень с малахитом как оберег от холеры и чумы. Владелец чаши
из малахита, который регулярно пользуются ею для питья, становится способным
«понимать» язык наших меньших братьев — животных. Украшения из малахита хорошо
оправлять серебром и носить в мае.
2. Теоретическая часть
.1 Системная характеристика малахита
Номенклатура:
. Русское — дегидроксид-карбонат димеди.
2. UPAK-
гидроксокарбонат меди (ii)
. Тривиальное-малахит
Классификация:
. По составу — сложное кислородосодержащее
вещество, основная соль двухвалентной меди.
. По растворимости воде(в г/100г) —
нерастворимо, 0.0001г (20′C)
3. Плотность — 4 г/см3 (20, состояние вещества-кристаллы)
. Внешний вид — зеленые моноклинные
кристаллы.
. По летучести — нелетучее.
. По окислительно-восстановительным
свойствам — слабый окислитель, слабый восстановитель.
Строение:
. Стехиометрическая формула
малахита: (CuOH)2CO3
2. В состав входят атомы Cu2+, H+, О2-,
С4+.
. Электронные формулы атомов:
Cu2+: [Ar]4s03d9
H+:
1s1
О2-:
[He]2s22p2
С4+:
[He]2s22p6
Физико-химические свойства:
(CuOH)2CO3—
дигидроксид-карбонат димеди
Иногда встречается в виде зелёных,
моноклинных, игольчатых, большей частью сросшихся кристаллов, но чаще всего в
виде плотной или волокнистой зелёной массы. При слабом нагревании разлагается
без плавления. При нагревании свыше 200˚C он чернеет и превращается в
черный порошок оксида меди, одновременно выделяются пары воды и углекислый газ.
При осаждении из раствора имеет переменный состав (1-2)CuCO3 ∙Cu(OH)2
(минерал малахит). Не растворяется в холодной воде, разлагается кипящей водой,
кислотами; реагирует с цианидом калия, солями аммония. Переводится в среднюю
соль действием CO2 под избыточным давлением.
Химические свойства:
1. Cu2 СO3
(OH)2 = 2CuO + CO2 + H2O (180-200˚C)
. Cu 2СO3
(OH)2 (тв)
+ 8 H 2O (хол)
= 2[Cu(H 2O)4 ]2- + CO32-
+ 2OH—
. Cu 2СO3
(OH)2 (суспензия)
= 2CuO↓+ CO2 ↑ + H 2O (кип.)
. Cu2СO3(OH)2
+ 4NH4Cl(конц.)
= 2CuCl2 + CO2↑+3H2O+4NH3↑(кип.)
. Cu 2СO3
(OH)2 + 8(NH3 ∙H2 O) [кoнц.]
= [Cu(NH 4) ]CO3 +
[Cu(NH )4 ](OH)2
+ 8H 2O
. Cu 2СO3
(OH)2 + 8KCN (конц.)
= 2K 2[Cu(CN)4 ] + K2 CO3 + 2KOH
. Cu 2СO3(OH)2
+ 3CO2 + 4KOH (разб.)
= 2K2[Cu(CO3)2](син.)
+ 3H2 O
. Cu2 СO3(OH)2
+ CO2 = 2CuCO3 (бел.)
+
H2
O (180˚C,
p)
Таблица 1 Термодинамические свойства
2.2 Способы получения вещества
Кристаллы малахита встречаются довольно редко. В
природе этот минерал обычен в виде натечных образований осадочного
происхождения, подобных тем, которые образуются в карстовых и иных полостях: в
виде почек, гроздей, плотных и землистых масс, корок, налетов и других
выделений. Образуется он чаще всего там, где медные руды выходят на земную
поверхность. Особенно крупные залежи малахита образуются там, где медная руда
залегает среди известняков. (Тогда грунтовые воды, размывая залежи сульфидов
меди и окисляя их, постепенно насыщаются сульфатными и медными ионами. Эти
активные растворы, попадая затем в известняки, легко растворяют их. А
карбонатные ионы частично переходят в тот же раствор.) Как только концентрация
меди и углекислоты становится достаточной, в трещинах, пустотах и маленьких
пещерах, возникающих при растворении, отлагается новый минерал меди, ее водный
карбонат — медная зелень, в том числе ее благородная разновидность — малахит.
Cu + CO2
+
O2 =
(CuOH)2CO3
В лаборатории можно получить вещество, по своему
составу напоминающее малахит, можно следующим образом:
. Пропускание углекислоты через суспензию
гидроксида меди:
2Cu(OH)2 + CO2 =
(CuOH)2CO3 + H2O
2. Реакция сульфата меди и гидрокарбоната
натрия:
2CuSO4 + 4NaHCO3
= (CuOH)2CO3 + 2Na2SO4 + CO2+
H2O
3. Экспериментальная часть
.1 Условия безопасного и эффективного проведения
опыта
Синтез малахита не представляет особой опасности
для здоровья человека, однако, некоторые правила предосторожности следует
соблюдать:
1. Обязательно, работая в хим. лаборатории
следует надеть защитный халат.
2. Для нагревания воды, растворов и твердых
веществ в лаборатории чаще всего используются электроплитки, бани, сушильные
шкафы.
При работе с ними нужно соблюдать меры
предосторожности. Например, используя электроплитку необходимо помнить о
наличии асбестированной металлической сетки.
. При обращении со стеклянной посудой следует
избегать ударов, падения, других действий, приводящих к ее поломке.
4. По окончании работы тщательно вымыть
использованную химическую посуду и поместить в предназначенное для ее хранения
место.
.2 Методика синтеза
Приборы:
• Фарфоровая ступка с пестиком — 1,
• термический стакан — 50 мл,
• штатив,
• стеклянная палочка — 2,
• воронка Бюхнера — 1,
• колба Бунзана — 1,
• фильтровальная бумага,
• пробирка,
• горелка.
Ход работы.
В фарфоровой ступке смешали 3,1 г. тонко стёртой
сухой соли CuSO4 •5H2O с гидрокарбонатом натрия 2,4 г.
В стакане нагрели до кипения 25 мл. воды. Смесь
высыпали небольшими порциями в кипящую воду, быстро перемешивая. При этом
наблюдается вспенивание. Следующую порцию смеси вносили после прекращения
вспенивания. Содержимое стакана кипятили 10-15 мин для удаления из раствора СО2.
В результате реакции образуется гидроксокарбонат меди:
CuSO4 ∙5H2O+4NaHCO3
= CuCO3 ∙Cu(OH)2↓+ Na2SO4
+ 3CO2↑+ 11H2O
Осадку дали отстояться, затем промывали
декантацией горячей водой, отмывая от иона SO42- ; после каждого
промывания брали пробу на полноту промывания: для этого в пробирку наливали
небольшое количество данного раствора и приливали несколько капель хлорида
бария. Сначала в пробирке наблюдалось образование белого осадка (BaSO4),
но после семи последовательных декантаций осадок перестал образовываться.
Оставшийся раствор мы поставили в сушильный шкаф
и высушивали в течение пяти дней при температуре 60˚C.
Расчёт исходных масс веществ.
CuSO4
+ 4NaHCO3
= (CuOH)2CO3
↓+ 2Na
2SO4
+ 3CO2
↑+ H2O
m(CuSO
∙5H2O)
= 3,1 г
m(NaHCO3)
= 2,4 г.
. M(CuSO4
∙5H2O)
= 250 г/моль
. н(CuSO4
∙5H2O)
=3,1/250 = 0,0124 моль
. M
(NaHCO3)
= 84 г/моль
. н(NaHCO3)
= 2,4/84 = 0,029 моль
. н(CuSO4
∙5H2O)
: н(NaHCO3)
= 1 : 4,5
Следовательно, расчет ведем по сульфату меди.
. M((CuOH)2CO3)
= 222 г/моль
. m(теор)((CuOH)2CO3)
= 0,0062∙ 222 = 1,4 г

Рис. 1
.3 Индетификация продукта
Химические доказательства образования малахита.
Для доказательства того, что мы получили именно
основный карбонат меди мы провели реакцию разложения и реакцию с HCl.
• В термостойкую пробирку поместили
небольшое количество полученной соли и закрыли её пробкой с газоотводной
трубкой. Второй конец трубки мы поместили в пробирку с раствором Ca(OH)2
. Пробирку с солью нагрели на пламени горелки. Через некоторое время мы
заметили помутнение раствора Ca(OH)2 , что свидетельствует о
выделившемся углекислом газе (образовалась нерастворимая соль CaCO3
, осадок белого цвета). На стенках пробирки осели пары воды. Соль, которая
сначала была светло-зелёного цвета, почернела (образовался CuO).
• При взаимодействии с разбавленной
соляной кислотой мгновенно происходит выделение газа (CO2) и
растворение малахита с образованием хлорида меди (CuCl2).
3.4 Расчет массовой доли выхода вещества
Исходя из количества исходных веществ, по данной
реакции мы должны были получить основой карбонат меди массой 1.4 г. Но в ходе
данного эксперимента мы получили соль массой 1,18 г. Выход продукта составил
84,29 %. Потери могут быть обусловлены оседанием части раствора на стенках стакана,
также, используя метод декантации, возможна утрата части осадка.
минерал малахит химический
4. Творческие задачи
Задача№1.
Медь во влажном воздухе медленно реагирует с
кислородом и диоксидом углерода. При этом образуется минерал зеленого цвета, часто
использующийся в ювелирном деле, содержащий по массе 72% CuO,
19,9% CO2,
8,1% H2O.
) Напишите уравнение образования
минерала.
) Напишите уравнение взаимодействия
минерала с серной кислотой
а) Рассчитайте химической реакции по значениям
стандартных теплот образования веществ. Укажите тип химической реакции.
б)Рассчитайте величину для данного процесса по значениям
стандартных энтропий веществ.
в)Рассчитайте изменение для химической реакции, используя
стандартные значения энергий Гиббса.
Возможно ли самопроизвольное
протекание реакции при ?
Как будет влиять повышение
температуры на протекание этой реакции?
Задача№2.
.Решить цепочку превращений.
.Определить тип гибридизации
комплексных ионов соединений А, Б и С, используя метод ВС.
. Указать структуру и магнитные
свойства комплексных ионов А, Б и С.
. Составить уравнение диссоциации
для комплексного иона соединения С и написать выражение для константы
нестойкости этого катиона.
Карта-план характеристика малахита
1. (CuOH)2CO3
2. Неорганическое соединение,
основная соль, довольно-хрупкий минерал, темно-зеленые кристаллы нерастворимые
в воде, при 200 гидроксокарбонат меди разлагается,
не взрывоопасное вещество, не токсичное, не радиоактивное, также не
корродирует.
Строение вещества
. Русское название — дегидроксид карбонат
димеди, IUPAC —
гидроксокарбонат меди (ii),
тривиальное — малахит, медная зелень, атласная руда, павлиний камень.
Cu2+: [Ar]4s03d9
H+: 1s1
О2-:
[He]2s22p2
С4+:
[He]2s22p6
С учетом электроно-ионных взаимодействий формулу
малахита можно представить таким образом:
Данная запись отражает ионные взаимодействия. В
реальном кристалле имеют место быть другие типы взаимодействий- водородная
связь между гидроксильными ионами и донорно-акцепторное между ионом меди и
кислородом гидроксила.
За счет этого достигается и плотная упаковка, и
небольшая твердость.
Локализованные связи в молекуле гидроксокабоната
меди между кислородом и водородом, потому что электронная пара находится в поле
двух ядер. Делокализованная — двойная связь между углеродом и кислородом, так
как для сопряженных связей характерно рассредоточение электронов.
Наиболее прочная сопряженная связь между
углеродом и кислородом.
Таблица 2
|
связь |
Eдисс., кДж/моль |
|
С=О |
695 |
|
С-О |
335 |
|
О-H |
464 |
В молекуле 9 и 1
связей.
и неподеленных электронных пар у
атомов кислорода.
В разных атомах, разное количество
неспаренных электронов. Так в O-2, в H-1, у меди
тоже 1 электрон.
Взаимодействие вещества с полярным
растворителем.
Таблица 3 Физические свойства малахита
|
Органолептические |
Цвет |
|
Тепловые |
При |
Термодинамические свойства -1051 S
-900,9
|
|
|
|
Оптические |
Непрозрачен, |
|
Летучесть(нелетучесть) |
Не |
|
Кристаллографические |
Моноклинная |
|
Растворимость |
Растворим |
|
Примеси |
Имеются |
Химические свойства
1. При стандартных условиях
вещество достаточно стабильно, при более высоких температурах (200) разлагается.
Рассмотрим реакцию разложения малахита:
(CuOH)2CO32CuO+CO2
+H2O
В зависимости от этапа изучения
химии она может быть описана:
а)
б) на ионно-структурном уровне:
в) на электронно-ионном уровне:
(Cu2+O2-H+)2C4+O2-3
Данное вещество не проявляет
окислительно-восстановительных свойств. Для него характерны реакции разложения
и реакции, идущие по обменному механизму.
(CuOH)2CO3(тв)2CuO(тв)+CO2
+H2O(ж)
Рассчитаем химической реакции по значениям
стандартных теплот образования веществ.
= 2
(CuO)+
(CO2)+
(H2O)-
((CuOH)2CO3))=
2*(-162)+(-393,5)+(-285,84)-(-1051)=47,66Кдж-эндотермическая реакция
Рассчитаем химической реакции по значениям
стандартных энергий Гиббса образования веществ.
= 2
(CuO)+
(CO2)+
(H2O)-
((CuOH)2CO3))=
-129,4)+(-394,4)+(-237,19)-(-900,9)=10,51
Кдж/моль
самопроизвольное протекание процесса
невозможно, так как 0.
Рассчитаем химической реакции по значениям
стандартных энтропий образования веществ.
=2
(CuO)+
(CO2)+
(H2O)-
((CuOH)2CO3))=43,5+213,65+69,94-211,6=115,49кдж/моль
Малахит, как известно не
растворяется в воде, следовательно, водный раствор малахита не существует.
Однако, вещество может подвергаться гидролизу:
Знание свойств карбонатов и
нерастворимых в воде оснований позволяет утверждать, что малахит будет
растворяться в кислотах, также малахит можно рассматривать как производное Cu(OH)2,
в ктором часть гидроксильных ионов замещена на карбонат-ионы. Кроме реакции с
кислотами при определенны условиях он может реагировать с кислотными оксидами.
Следовательно для данного вещества характерны основные свойства.
Взаимодействие с кислотами
Рассчитаем химической реакции по значениям
стандартных теплот образования веществ.
= 2
(CuCL2)+
(CO2)+
(H2O)-
(CuOH)2CO3))+
(HCL)]=2*(-149)+(-394,4)+(-237,19)-[-900,9+(-95,265)]=66,575
кдж/моль
Поскольку , то она не может протекать только
за счет энтальпийного фактора, необходимо учесть и энтропийный фактор, при
повышении температуры реакция становится возможной.
Взаимодействие с
оксидом.(спецефическая реакция)
Из-за особенности ионов меди
образовывать комплексные ионы малахит растворяется в карбонатах щелочных
металлов:
Специфические реакции:
· Cu
2СO
3
(OH)2 + 4NH
4Cl
(конц.)
= 2CuCl2+ CO2↑ + 3H 2O
+ 4NH3↑
· Cu2СO3(OH)2+8(NH3∙H2O)[кoнц.]=[Cu(NH3)4]CO3+[Cu(NH3)4](OH)2+8H2O
· Cu 2СO3
(OH)2 + CO2 = 2CuCO3 (бел.) + H
2O
(180˚C, p)
· 2Cu
+ CO2 +
O2 =
(CuOH)2CO3-медь
во влажном воздухе медленно реагирует с кислородом и диоксидом углерода.
· 2Cu+H2O+O2+CO2=(CuOH)2CO3—
коррозия меди на воздухе.
· 2Cu(OH)2+CO2=
(CuOH)2CO3+H2O
· 2CuSO4+4NaHCO3(CuOH)2CO3
+2Na2SO4+3CO2+H2O
Области применения:
Малахит относится к минералам, в которых
соединились польза от практического использования и природная красота.
Ценный поделочный декоративный камень. Наиболее
эффектен плотный малахит зональной структуры, при полировке дающий красивый
рисунок. Медная зелень — важный поисковый признак на месторождениях меди.
Красота и прочность камня сделали его одним из
важнейших материалов в искусстве. Из малахита изготовлялись броши.
Исключительно красивы столешницы, особенно мозаичные. В коллекции изделий из
камня Эрмитажа одно из первых мест принадлежит предметам из малахита — около
200 ваз, столешниц, торшеров и других произведений камнерезного искусства.
В Эрмитаже декоративные вазы, чаши, торшеры и
канделябры из малахита и другого цветного камня размещены в Галерее древней
живописи, в зале итальянской школы, на площадке Советской лестницы, в
Фельдмаршальском и Георгиевском залах. Наиболее художественно ценные бытовые вещи
из малахита выставлены в Малахитовом зале. В его убранстве широко использован
малахит. Вдоль длинных сторон зала установлено 8 малахитовых колонн,
расположенных попарно, вдоль коротких сторон — 8 пилястров с капителями на
белых мраморных постаментах. Под огромными зеркалами в деревянных золоченых
рамах вделаны большие малахитовые камины. В центре паркетного пола, откуда
расходятся деревянные лучи, стоит малахитовая ваза на треножнике из золоченой
бронзы с крылатыми женскими фигурами и козьими ногами. Вдоль стен и окон стоят
покрытые малахитовой мозаикой столы, торшеры и вазы. В четырех витринах
выставлены разнообразные изделия из малахита — настольные украшения,
пресс-папье, письменные приборы, шкатулки и коробочки для бумаг и др.
Кроме чаш, ваз, канделябров и бытовых изделий в
Эрмитаже хранится памятник искусства прошлого века — «Малахитовый храм»,
выполненный в виде античного храма-ротонды. В нем малахит применен в отделке
колонн.
В настоящее время изделия из малахита — бусы,
броши, перстни, кулоны — ценятся наравне с полудрагоценными камнями и
пользуются большим спросом..
Из мелкой крошки изготавливается минеральный
пигмент и краски.
Со времен Древнего Египта малахитовую руду
использовали для получения меди.
Список использованной литературы
1. Под ред. Третьякова Ю.Д.
Неорганическая химия: в 3 т. — М.: Издательский центр Академия, 2007. — Т.3.
. Степин Б.Д., Аликберова Л.Ю. Книга
по химии для домашнего чтения. М., Химия, 1994.;
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим
разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные,
+6 — кислотные.

В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из
его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 —
происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3

Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑

Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III),
реагирует с кислотами, кислотными оксидами.

CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами,
кислотными оксидами.

Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + Ba(OH)2 → (t°) Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)

Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в
растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают
раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O

В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит

Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается
бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t < 700°C)
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов
FeO*Fe2O3)
При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi

Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными
серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.

Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа +3 до +2.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа (II) проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа (II)
распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O

При хранении на открытом воздухе соли железа (II) приобретают коричневый цвет из-за окисления до железа +3.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] —
гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании
легко распадается на воду и соответствующий оксид.

Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6].
В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко
красного цвета.
FeCl3 + KCNS = Fe(CNS)3 + KCl

И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными
окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3
в щелочи.
Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O

Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит

Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди
более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной
— реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O

Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди (I) окисляется кислородом до оксида меди (II).
Cu2O + O2 = (t) CuO
Оксид меди (I) вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2.
Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
CuO + H2SO4 = CuSO4 + H2O
CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
CuO + CO = Cu + CO2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.

CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства.
В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди (II) — (CuOH)2CO3)
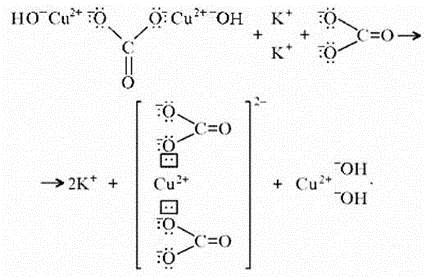
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
CuSO4 + Na2CO3 + H2O = (CuOH)2CO3 + Na2SO4 + CO2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Тренажер задания 31 из ЕГЭ по химии меди, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии меди с текстовыми решениями и ответами.
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2NaOH + 2NO2 = NaNO3 + NaNO2 + H2O
6NaOH(гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
Cu + S = CuS
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2↑ + 4H2O
или CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
NaNO3(тв.) + H2SO4(конц.) = HNO3 + NaHSO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
2NaNO3 → 2NaNO2 + O2↑
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
CuO + C → Cu + CO
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O

(CuOH)2CO3 → 2CuO + CO2 + H2O
CuO + H2 → Cu + H2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
2Na + O2 = Na2O2
2Na2O2 + CO2 = 2Na2CO3 + O2
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
(CuOH)2CO3 → 2CuO + CO2 + H2O
CuO + 2HNO3 → Cu(NO3)2 + H2O
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
3CuO + 2NH3 → 3Cu + N2 + 3H2O
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
CuO + H2SO4 → CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 → CuO + H2O
CuO + H2 → Cu + H2O
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
Cu + Cl2 → CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2 → CuO + H2O
CuO + C → Cu + CO
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
4NO2 + O2 + 2H2O = 4HNO3
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
CuO + H2 → Cu + H2O
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + NaOH = Cu(OH)2↓ + Na2SO4
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 → CuO + H2O
CuO + C → Cu + CO
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
2Cu + I2 = 2CuI
2CuI + 4H2SO4 → 2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 → CuO + H2O
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3 → 2CuO + CO2 + H2O
CuO + H2 → Cu + H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
Fe + 2HCl = FeCl2 + H2
CuO + H2 = Cu + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 → CuO + H2O
3CuO + 2NH3 → 3Cu + N2 + 3H2O
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
CuO + H2SO4 = CuSO4 + H2O
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
CuO + CO → Cu + CO2
Cu + Cl2 = CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
CuO + CO → Cu + CO2
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Задания
Версия для печати и копирования в MS Word
Образец малахита массой 12 г растворили в избытке серной кислоты и собрали 896 мл углекислого газа (н. у.). Считая, что малахит не содержит карбонатных примесей, определите массовую долю (в %) основного карбоната меди в нем. В расчете примите
(Запишите число с точностью до целых.)
Спрятать решение
Решение.
Малахит — минерал, состоящий из основного карбоната меди и различных примесей. При растворении гидроксокарбоната меди в серной кислоте происходит следующая реакция:
В ходе реакции выделилось 0,896 л углекислого газа, найдем его количество:
Согласно уравнению реакции, из 1 моль основного карбоната меди образуется 1 моль углекислого газа. Тогда на образование 0,04 моль углекислого газа затратилось 0,04 моль гидроксокарбоната меди. Найдем его массу:
Исходный малахит имел массу 12 г, а основного карбоната в нем содержалось 8,88 г. Найдем его массовую долю:
Ответ: 74.
Муниципальное автономное общеобразовательное учреждение
средняя общеобразовательная школа № 41 села Аксаково
муниципального района Белебеевский район Республики Башкортостан
Получение малахита искусственным путем
в условиях школьной лаборатории
Выполнили:
обучающиеся 8 класса МАОУ СОШ № 41 с.Аксаково
Минигалиев Алексей,
Низамутдинова Эвелина
Руководитель:
учитель химии МАОУ СОШ № 41 с.Аксаково
Старостина Е.В.
2014
Содержание
|
стр |
||
|
Введение |
3 |
|
|
1. |
Обзор литературы |
5 |
|
1.1. |
История открытия и применения малахита |
5 |
|
1.2. |
Происхождение. Формы нахождения в природе |
7 |
|
1.3. |
Искусственные аналоги |
7 |
|
1.4. |
Химический состав. Кристаллическая структура |
8 |
|
2. |
Материал и методика исследования |
9 |
|
2.1. |
Материал исследования |
9 |
|
2.2. |
Методика исследования. Синтез малахита |
9 |
|
3. |
Результаты и их обсуждение |
11 |
|
Выводы |
13 |
|
|
Список литературы |
15 |
Введение
Малахит получил свое название от цветка. Французы называли его malachite, а греки maláche — мальва. По всей видимости, имелся ввиду цвет не самого цветка, а его красивые ярко-зеленые листья. Это минерал из класса карбонатов, содержащий 57,4% меди. Цвет минерала варьирует от ярко-зелёного, голубовато-зелёного до тёмного, иногда буро-зелёного. Изменение цвета по различным зонам и слоям малахита создаёт на срезах и полированных плоскостях очень красивый, причудливый рисунок.
Этот камень привлекал внимание людей с глубокой древности (только представьте себе, что самая ранняя поделка из малахита была изготовлена 10500 лет назад). На Руси считался всегда символом исполнения желаний. В Индии — помощником человеку в очищении сознания, избавлении от тревог и обид.
Боэций де Боодт еще в 1603 году в своей «Истории драгоценных камней» писал о том, что особой силой обладает камень малахита, на котором выгравировано изображение солнца. Камень этот будет помогать только добрым и честным людям – им он подарит удачу и счастье.
И у нас в старину на Урале говорили, что «малахит нужно носить людям добрым, которым счастья недостает». Малахит запрещает человеку врать, кривить душой и сплетничать, он помогает разобраться, где правда, а где ложь. Камень любит людей корректных, которые лишнего не говорят. А еще считалось, что сделает он своего владельца независимым и упорным в достижении благородных целей. Много еще что на Урале сказывали о малахите и Малахитнице – владычице подземных недр. Множество сказок и легенд поведали уральские старатели Павлу Петровичу Бажову, воплотившему устные предания уральских горнорабочих в прекрасные, всем известные произведения «Малахитовая шкатулка», «Медной горы хозяйка», «Каменный цветок».
Применение малахита разнообразно. Еще в древности из малахита делали камеи, амулеты, украшения. Египтянки малахитовой зеленью удлиняли глаза. Однако настоящую известность этот минерал получил после того, как на Урале в конце XVIII века были открыты крупные месторождения малахита. Вообще-то малахит был известен на Урале с 1635 года и использовался как порода для выплавки меди.) С тех пор малахит известен как любимый камень Хозяйки Медной горы.
Русские умельцы изготавливали из малахита прекрасные чаши, вазы, столешницы, шкатулки. Кроме того, был разработан особый способ изготовления изделий из малахита — «русская мозаика». Этим способом создавали целые сказочные колонны из малахита. Землистый малахит и мелкие скопления чистого минерала использовались для изготовления ценной краски — «малахитовой зелени», которая затем применялась, например, в иконописи.
Заинтересовавшись этим чудесным минералом, зная его химическую формулу и технику получения в лабораторных условиях, нами была поставлена цель: получить малахит искусственным путем.
Для достижения цели определены следующие задачи:
- Получить по технологии синтеза малахита минерал. Доказать химическим путем, что полученное вещество – это малахит
- Рассчитать выход продукта реакции
- Описать полученное вещество и сделать вывод о возможности и целесообразности получения минерала в школьной лаборатории.
- Обзор литературы
- История открытия и применения малахита
Малахит в предгорьях Урала был впервые открыт в 1635 г. и использовался для выплавки из него меди. В конце XVIII века на уральских медных рудниках стали попадаться крупные скопления сплошного густо-зелёного малахита. Первым прославился малахит Гумишевского рудника. Замечательные образцы этого камня хранятся во многих наших музеях. До сих пор в музее Горного института в Ленинграде находится великолепный монолит гумишевского малахита, весящий более 1,5 тонны [1]. Яркая красота уральского камня произвела на всех большое впечатление. И сам рудник и окрестности его оказались насыщены медью и железом, золотом и платиной, мрамором и малахитом. Недаром именно в этих местах и родились легенды о Хозяйке Медной горы, которая олицетворяла богатство и красоту уральских недр [13]. Малахит быстро завоевал общие симпатии, стал модным камнем, сравнявшись в цене с дорогими самоцветами. Наряду с лучшими драгоценными камнями он употреблялся на мелкие изделия — бусы, броши, серьги, вставки для колец. В большом ходу были также малахитовые табакерки [5].
В течение многих лет анализом и обобщением результатов изучения Гумешевского и Меднорудянского месторождений занимался профессор Свердловского горного института Г. Н. Вертушков. Им собран наиболее полный материал о геологическом строении районов этих месторождений, об истории их открытия, изучения и разработке, о генезисе малахита и т. д.
Специалисты установили, что все известные в мире месторождения малахита относятся к единому генетическому типу и связаны с зонами окисления медной руды. Г. Н. Вертушков тоже считает, что все уральские месторождения «сходны между собой и приурочены к вулканогенно-осадочной толще Тагило-Магнитогорского прогиба», где в коре выветривания развились контактово-карстовые месторождения меди [11].
Но в начале XIX века (1810-1814 годы) были открыты Меднорудянские залежи малахита, подобных которым человечество еще не знало. Здесь были какие-то особенные геологические условия, приведшие к одновременному скоплению больших количеств меди и больших количеств углекислоты. Исключительная мощность месторождения наводит на мысль, что малахит возник здесь не обычным путем ᴨпереработки первичных медных руд холодными углекислыми водами поверхности. Можно предполагать, что горячие, поднимающиеся из глубины медоносные растворы внедрились по трещинам в сплошную массу известняков, растворяли и перерабатывали их, образуя среди них большие неправильные массы жил малахита. Богатства этого месторождения были обнаружены не сразу. В первые годы добыча малахита из новооткрытого Меднорудянского месторождения была невелика. Лишь в двадцатых годах XIX столетия разработки рудника достигли основных залежей малахита и показали невиданный их масштаб [3]. Уже не куски и кусочки нарядного камня, годные для брошей и табакерок, а громадные глыбы превосходного сплошного малахита извлекались из чудесного рудника, слава о котором быстро разнеслась по всему свету. Рудник выдавал ежегодно от 30 до 80 тонн первоклассного цветного камня. Вес наибольшей глыбы малахита, обнаруженной в недрах рудника, был путем расчета определен в 500 тонн.Это месторождение по своему богатству, мощности, пригодности для изделий и для облицовки архитектурных украшений, а так же по красоте узоров и по чистоте окраски зеленых тонов является до сих пор единственным на всем земном шаре.
Не приходится удивляться тому, что после такого открытия в истории нашего камня наступила на несколько десятков лет «малахитовая эпоха». Малахит стал излюбленным поделочным камнем. Но теперь кроме бесчисленных мелких предметов, ювелирных украшений и тому подобного, малахит начинает применяться в крупных изделиях и даже в зодчестве, прекрасные образцы которых стали теперь достоянием народа.
После многих лет непрерывной добычи малахита мощные месторождения Урала были, конечно, сильно истощены. Но говорить об их полной выработанности, конечно, не приходится. В недрах земли, может быть даже в районе знаменитых уральских месторождений, еще хранятся многие десятки тонн яркого зеленого камня.
Этот красивый ювелирно-поделочный камень с эпохи неолита вплоть до античного времени служил для человека, прежде всего медной рудой, а также краской и химической добавкой в стекло.
Изделия из малахита разнообразны по своим формам и назначению [2]. Монументальные вазы украшали интерьеры дворцов, освещенные торшерами из камня. В парадных комнатах дворцов стояли столы, инкрустированные зеленым камнем. Мелкие изделия вроде шкатулок, ларцов, чернильных приборов, табакерок стали предметами обихода более широких слоев общества. Строгие формы малахитовых изделий великолепно сочетаются с цветовым богатством камня и его рисунком.
Металлурги в эпоху бронзового века, когда малахит был основным источником чистой меди, просто выплавляли ее из него. Медь, получаемая из него, была гораздо важнее самого поделочного камня.
Этот минерал издавна привлекал внимание людей. Древние греки украшали малахитом нарядные здания и залы. В Древнем Египте из малахита, добываемого на Синайском полуострове, изготовляли камеи, амулеты и украшения [4].
Активно применяли малахит в косметических целях: в Древнем Египте его порошок наносили на верхние веки, защищая таким образом роговицу глаза от беспощадного африканского солнца. Лишь во времена Древнего Рима камнерезы оценили его как великолепный поделочный камень, в полной мере открыв в нем сочность природных растительных красок и очарование нежного узора.
Из малахита стали изготовлять амулеты, печати, вставки, а также детали интерьеров. В практических целях малахит используется до сих пор. Он является спутником, а значит поисковым признаком медных руд, залегающих близко к земле.
Месторождений малахита в мире немного, но добываемый там камень отличается от уральского и уступает ему по красоте. На данный момент основной мировой поставщик малахита – Заир. Современные предметы из зеленого минерала имеют скромные размеры по сравнению с роскошью прошлых веков. Это ювелирные изделия: вставки в серьги, кулоны, браслеты, подвески, кольца, броши, ожерелья [10].
Сегодня малахит поставляют из Африки и Заира, Западной Европы и Казахстана. Ранее, в России на Урале его было много, но месторождения исчерпались. В Западной Европе месторождения малахита находятся в Шесси (близ Лиона), в Корнуолле, Рецбании, на Гарце и др. Основным источником малахита для ювелирных и отделочных работ является Демократическая Республика Конго. Характерной особенностью африканского малахита являются мелкие правильные концентрические кольца (в отличие от колец неправильной формы у уральского малахита) с более контрастным чередованием светлых и тёмных зон [11].
- Происхождение. Формы нахождения в природе
Малахит — экзогенный минерал, образующийся в зонах окисления медно-сульфидных месторождений [6].
Образуется он чаще всего там, где медные руды выходят на земную поверхность. Особенно крупные залежи малахита образуются там, где медная руда залегает среди известняков (тогда грунтовые воды, размывая залежи сульфидов меди и окисляя их, постепенно насыщаются сульфатными и медными ионами. Эти активные растворы, попадая затем в известняки, легко растворяют их. А карбонатные ионы частично переходят в тот же раствор). Как только концентрация меди и углекислоты становится достаточной, в трещинах, пустотах и маленьких пещерах, возникающих при растворении, отлагается новый минерал меди, ее водный карбонат — медная зелень, в том числе ее благородная разновидность — малахит.
Обычно в каждой пустоте сферолитов множество. Теснясь, сдавливая друг друга, наползая один на другой, они сливаются в прихотливые гроздевидные и почковидные сростки. Медные растворы, питающие растущие почки, содержат меди то чуть больше, то чуть меньше. Подчас между слоями малахита кристаллизуются другие, вторичные минералы, и каждый из вновь нарастающих слоев становится то темнее, то светлее. Волокна в таких почках часто и не видны, гораздо заметнее их концентрически-зональное строение.
Кристаллы малахита встречаются довольно редко. В природе этот самый минерал обычен в виде натечных образований осадочного происхождения, подобных тем, которые образуются в карстовых и иных полостях: в виде почек, гроздей, плотных и землистых масс, корок, налетов и других выделений.
Минералы — спутники — азурит, куприт, тенорит, лимонит, кальцит, хальцедон, хризоколла, церуссит и др. сульфиды меди. На поверхности устойчив, очень редко замещается азуритом и купритом [7].
- Искусственные аналоги
Строго говоря, искусственным камнем называется любое вещество неестественного происхождения, которое по своим свойствам, структуре и внешнему виду напоминает камень натуральный. Но нас интересует декоративная область применения искусственного камня. В этом случае годится следующее определение: искусственный камень — полноценная имитация натурального природного камня и изделий из него с применением современных искусственных и синтетических материалов по специальным технологиям. Предметы, изготовленные из высококачественного искусственного камня, похожи как внешне (сочетание цветов, фактуры и текстуры, блеск), так и на ощупь.
Еще в России в XVIII веке Петр I активно интересовался способами имитации многих отделочных камней, в том числе и малахита, для украшения зданий, улиц и площадей своей новой столицы. Также изготовлялись элементы мебели со вставками из искусственного малахита.
В России малахит добывают в небольших количествах, в основном получают его искусственным путем.
Неоднократно делались попытки синтезировать малахит, и Н.М. Салову при консультации Д.П. Григорьева в 1936-1937 гг. удалось получилось получить камень, правда, не обладающий декоративными качествами. Многолетние работы по получению малахита в лаборатории ЛГУ, проводившиеся под руководством Т.Г. Петрова, сравнительно недавно завершились успехом и сейчас освоено производство ювелирного малахита в промышленных условиях. Изделия из него были показаны на Международном геологическом конгрессе в Москве в 1984г [8].
Сегодня синтез чудесного зеленого камня уже вышел из стен лаборатории кристаллографии Ленинградского университета, и в Свердловском объединении «Уральские самоцветы» уже работает промышленная установка искусственного малахита, из него созданы первые изделия. Синтезирован малахит и во Всесоюзном НИИ минерального сырья. Искусственный малахит обладает равномерной плотностью, зеленым шелковистым блеском после полировки, совсем не имеет пор и раковин… [11]
- Химический состав. Кристаллическая структура
Малахит — один из главных минералов меди, содержит 57,4% чистого металла. Кроме меди, в его состав входят кислород, углерод и вода.
По составу малахит представляет собой водную углекислую соль меди — Cu(OH)2·CuCO3 . Окиси меди в малахите содержится до 72%, в связи с этим он использовался как медная руда [9].
Окраска малахита объясняется присутствием иона меди. В результате взаимодействия медно-сульфатных растворов с карбонатными или углекислыми водами образуется малахит. Натечные формы малахита возникают в карстовых пещерах и полостях рудоносных известняков, куда фильтруются воды с бикарбонатом меди.
Крупные почковидные и гроздевидные образования, иногда сталактиты, характеризуются концентрически-зональным строением. Собственно кристаллы малахита — это очень тонкие иголочки. Они-то и образуют сплошные шары — сферолиты. Гроздья таких сферолитов срастаются в малахитовые почки.
В сечении натечные образования малахита часто имеют радиально-лучистые, полосатые и концентрические текстурные узоры.
«Шелковистость» малахита, вдохновлявшая мастеров-камнерезов на создание замечательных украшений и шедевров русской мозаики, обусловлена строением минерала из сферолитов [10]. Каждый сферолит состоит из тончайших кристаллических волокон, расходящихся в разных направлениях по радиусам от одного центра. В сечении сферолитов можно видеть концентрические узоры, которыми и слагается кружевной рисунок малахита. Иногда сферолит состоит из отдельных, не сросшихся между собой иголочек и напоминает ежа.
- Материал и методика исследования
- Материал исследования
Малахит — минерал, основной карбонат меди (дигидроксокарбонат меди(II)). Состав минерала почти точно выражен формулой [Cu(OH)]2CO3, но более верное современное написание кристаллохимической формулы малахита Cu2(CO3)(OH)2. Устаревший синоним — медная зелень углекислая. При нагревании в колбе выделяет воду, углекислый газ и становится чёрным:
(CuOH)2CO3 →2CuO + CO2 + H2O
Характерна растворимость малахита в кислотах с выделением углекислого газа, а также в аммиаке, который окрашивается при этом в красивый голубой цвет.
- Методика исследования
Синтез малахита
1) Подготовить исходные вещества заданной массы
1. m (CuSO4•5H2O) = 5,5 г
2. m (NaHCO3) = 3,696 г.
3. V (H2O) = 100 мл
2) Подготовить оборудование:
1. Фарфоровая ступка с пестиком – 1 шт
2. Термический стакан объемом 250 мл – 1 шт
3. Штатив – 1 шт
4. Стеклянная палочка – 2 шт
5. Воронка Бюхнера – 1шт
6. Колба – 1шт
7. Фильтровальная бумага
8. Пробирки
9. Горелка – 1 шт
3) Ход работы
В фарфоровой ступке смешать 5,5 г. тонко стёртой сухой соли CuSO4 ·5H2O с гидрокарбонатом натрия (NaHCO3) массой 3,696 г.
В стакане нагреть до кипения 100 мл воды. Смесь высыпать небольшими порциями в кипящую воду, быстро перемешивая. При этом должно наблюдаться вспенивание.
Следующую порцию смеси вносить после прекращения вспенивания. Содержимое стакана кипятить 10-15 мин для удаления из раствора СО2. В результате реакции образуется гидроксокарбонат меди:
2CuSO4•5H2O+ 4NaHCO3= Cu(OH)2·CuCO3 + 2Na2SO4+ 3CO2+ 11H2O
Осадку дать отстояться, затем промыть декантацией горячей водой, отмывая от иона SO42-; после каждого промывания брать пробу на полноту промывания: для этого в пробирку налить небольшое количество данного раствора и прилить несколько капель хлорида бария. Сначала в пробирке будет наблюдаться образование белого осадка (BaSO4), но после семи последовательных декантаций осадок должен ᴨперестать образовываться.
Оставшийся раствор поместить в сушильный шкаф и высушивать в течение пяти дней при температуре 600 C.
Для доказательства того, что получили именно основный карбонат меди следует провести реакцию разложения и реакцию с HCl.
В термостойкую пробирку поместить небольшое количество полученной соли и закрыли её пробкой с газоотводной трубкой. Второй конец трубки м направить в пробирку с раствором Ca(OH)2 . Пробирку с солью нагреть на пламени горелки. Через некоторое время должны заметить помутнение раствора Ca(OH)2, что свидетельствует о выделившемся углекислом газе (образовалась нерастворимая соль CaCO3, осадок белого цвета). На стенках пробирки осядут пары воды. Соль, которая сначала была светло-зелёного цвета, почернеет — образовался CuO.
При взаимодействии с разбавленной соляной кислотой должно мгновенно происходить выделение газа (CO2) и растворение малахита с образованием хлорида меди (CuCl2).
Исходя из количества исходных веществ, по данной реакции должны получить основой карбонат меди массой 2,442 г.
Чтобы рассчитать практический выход продукта реакции, взвесьте получившийся осадок (до разложения и взаимодействия с соляной кислотой).
|
Выход продукта рассчитайте по формуле: |
|
Сравните полученное вещество с образцами природного малахита.
Сделайте вывод о возможности и целесообразности получения минерала в школьной лаборатории.
- Результаты и их обсуждение
Вещество получили по доступной технологии синтеза. Для этого необходимую массу исходных веществ (сульфат меди и гидрокарбонат натрия) смешали, предварительно измельчив в фарфоровой посуде. Нагрели в колбе 100 мл дистиллированной воды и небольшими порциями всыпали в воду смесь, постоянно помешивая стеклянной палочкой. Содержимое колбы кипятили 10 минут, периодически мешая. В результате образовался осадок красивого бирюзового цвета. Осадку дали отстояться и охладиться. В процессе отстаивания цветовая палитра осадка стала смещаться в сторону зеленого цвета.
Далее способом декантации трижды промыли осадок горячей водой – к осадку добавили горячую дистиллированную воду и взбалтывали. Затем суспензии давали отстояться и осветленную жидкость осторожно сливали с осадка на фильтр по стеклянной палочке так, чтобы осадок остался в сосуде. К оставшемуся осадку снова добавляли промывную жидкость в небольшом количестве и операцию декантации повторяли до тех пор, пока качественная реакция на сульфат–ионы не дала отрицательный результат. Третий слив показал отсутствие сульфат-ионов. Можно с уверенностью сказать, что реакция прошла успешно, вещества прореагировали достаточно полно.
В итоге осадок с последней порцией промывной жидкости перенесли на фильтр, высушили в сушильном шкафу и взвесили на аптечных весах. Масса осадка составила 1,750 г.
Так как в результате образовался ожидаемый нами осадок, было составлено уравнение данной реакции:
2CuSO4•5H2O+ 4NaHCO3= Cu(OH)2·CuCO3 + 2Na2SO4+ 3CO2+ 11H2O
Для доказательства того, что получили именно основный карбонат меди провели реакцию с разбавленной соляной кислотой (HCl). При приливании кислоты к веществу осадок растворился, и начал выделяться газ. Предположение, что это углекислый газ (СО2) подтвердили, поднеся зажжённую лучинку к пробирке. Огонь погас.
(CuOH)2CO3 + 4HCl = 2CuCl2+ 3H2O + CO2
Далее, в термостойкую пробирку поместили небольшое количество полученной соли и закрыли её пробкой с газоотводной трубкой. Второй конец трубки направили в пробирку с раствором известковой воды (Ca(OH)2).
Пробирку с солью нагрели на пламени горелки и через некоторое время раствор гидроксида кальция помутнел, что также свидетельствует о выделившемся углекислом газе (образовалась нерастворимая соль CaCO3, осадок белого цвета). На стенках пробирки осели пары воды. Соль, которая сначала была бирюзового цвета, почернела — образовался оксид меди (II) (CuO).
(CuOH)2CO3 = 2CuO + CO2 + H2O
CO2 + Са(ОН)2 = СаСО3 + Н2О
В результате проведенных нами реакций, было доказано, что полученное вещество по составу является малахитом.
С целью определения выхода продукта реакции проведены количественные расчеты. Рассчитана теоретическая масса продукта.
5,5 г 3,696 г х г
2CuSO4•5H2O+ 4NaHCO3= (CuOH)2CO3 + 2Na2SO4+ 3CO2+ 11H2O
250 г/моль 84 г/моль 222 г/моль
n (CuSO4•5H2O) = 5,5/250 = 0,022 моль
n (NaHCO3) = 3,696/84 = 0,044 моль (в избытке)
n ((CuOH)2CO3) = ½ n (CuSO4•5H2O) = 0,011 моль
m ((CuOH)2CO3) = 0,011 * 222 = 2,442 г – это теоретический выход продукта реакции.
Однако, нами была получена масса немного меньше ожидаемой. Процентный выход найден по отношению практического выхода к теоретическому.
ἠ = (1,750/2,442) * 100% ≈ 72%
Если говорить о целесообразности получения минерала малахита в школьной лаборатории, то необходимо кратко охарактеризовать его органолептические показатели. Полученный нами малахит имеет порошкообразную консистенцию и красивый насыщенный бирюзовый цвет. Не блестит и даже близко не напоминает камень. Пахнет мелом. Однако, данный порошок можно использовать при изготовлении сувениров.
Так как по преданиям этот Камень помогает добрым, честным и целеустремленным людям, дарит удачу и счастье, то изготовленные своими руками сувениры для родных, любимых вами людей, украшенные самодельным малахитом, будут радовать их долгие годы.
Выводы
Волшебный камень – малахит,
Сияет изумрудом!
Данила-мастер тут сидит.
Заказ его так труден!
Он должен чашу изваять
Живую, с лепестками!
И чтоб могла она играть
Роскошными цветами.
Переливалась бы она
Чудесным блеском ярким.
А как тонка – насквозь видна,
Сияет блеском жарким!
Хозяйка сей дала наказ:
Вот сделает – отпустит
Его на волю в тот же час,
Хотя и не без грусти…
Сказал Данила: «Бог с тобой,
Я изготовлю чашу.
Видать, дано мне то судьбой,
То – испытанье наше»
Старался мастер, что есть сил,
Из малахита вазу
Он сделал. И отпущен был
Он на свободу сразу
Малахит – какой загадочный камень с точки зрения настоящего мастера и, какой простой по химическому составу для химика. Всего лишь основный карбонат меди, если изготовить его в школьной лаборатории. Но, когда за дело берется сама Хозяйка — Природа, то ни один, даже самый искусный мастер не может с ней тягаться. Ведь природный малахит – это смесь и основного карбоната меди, и оксидов кремния, железа, цинка, фосфора, кальция.
Конечно же, наши мастера научились изготавливать искусственные аналоги камня, данное изобретение запатентовано, но и они отмечают, что «недостатком являются невысокие декоративно-художественные характеристики получающегося малахита, в частности ограниченные возможности получения заданной текстуры и цветовой гаммы. Так, основная текстура поверхности синтетического малахита, получаемого по данному способу, является преимущественно полосчатой, характеризуемой чередованием светло — и темно-зеленых слоев, что характерно для ювелирно-поделочного малахита из Заира. В то же время, по данному способу не получается малахит других разновидностей и текстуры природного малахита, обладающие более высокими художественно-декоративными качествами, характерными, например, для знаменитого уральского бирюзового малахита» [14]
По итогам работы можно сделать следующие выводы:
- Нам удалось в условиях школьной лаборатории синтезировать вещество
малахит искусственным путем по предложенной технологии.
Причем данное вещество имеет характерный для знаменитого уральского малахита бирюзовый цвет.
В ряде проведенных экспериментов, было доказано, что в состав полученного вещества входят медь и карбонат-ион, поэтому можно утверждать, что это малахит.
- Рассчитанный выход продукта реакции, показал удовлетворительный
результат. Значит, синтезировать его целесообразно, так как получить его можно и дома из медного купороса и пищевой соды.
- Синтезированный нами малахит имеет порошкообразную консистенцию и
красивый насыщенный бирюзовый цвет. Не блестит и даже близко не напоминает камень. Пахнет мелом. Однако, данный порошок можно использовать при изготовлении сувениров.
Список литературы
- Гумёшевский рудникru //wikipedia.org
- Камень малахит как выглядит: …на Урале и изделия из малахита// kamni.ws
- Книга — Рассказы о драгоценных камнях //detectivebooks.ru
- Малахит //devchatam.ru
- Малахит — Википедия //ru.wikipedia.org
- Малахит — Горная энциклопедия //mining-enc.ru
- Малахит — символ жизни и роста. Обсуждение на LiveInternet — Российский… //liveinternet.ru
- Малахитовое убранство Исаакиевского собора и оценка его состояния// isaac.spb.ru
- Малахит. Происхождение и описание малахита. Реферат – StudFiles// StudFiles.ru
- Малахит Редкая находка //zoloto.peterlife.ru
- Месторождения малахита //treeland.ru
- Получение и свойства малахита — учебная работа | реферат, курсовая..// referat7.ru
- Происхождение малахита и его месторождения //malachite-ural.ru
- Реферат патента РФ 2308554 // Способ получения синтетического малахита. Патент РФ 2308554 //FindPatent.ru
Проектно- исследовательская работа
Получение искусственного малахита из яичной скорлупы и изучение влияния температуры насыщенных растворов медного купороса на скорость химической реакции и интенсивность окраски малахита
Выполнили обучающиеся 8 класса
МКОУ Бутурлиновская ООШ №4
Цупикова И.А, Шабанова В.А.
Научный руководитель
учитель химии Гайворонская Т.М.
Что такое малахит?
Малахит — один из главных минералов меди, содержит 57,4% чистого металла. Кроме меди, в его состав входят кислород, углерод и вода. По составу малахит представляет собой водную углекислую соль меди — Cu(OH) 2 ·CuCO 3 . Окиси меди в малахите содержится до 72%, поэтому он использовался как медная руда. Окраска малахита объясняется присутствием иона меди.
Характерный узор малахита на полированном срезе
Малахит в настоящее
время хорошо известен
как ювелирный и
поделочный
камень изумрудный
и темно-зеленый,
названный из-за
сходства своего цвета с
цветом листьев мальвы
(по-гречески «малахэ»)
Это интересно
Месторождения малахита есть на Урале, в Африке, в Южной Австралии и США. Однако, по цвету и красоте узоров малахит зарубежных стран не может сравниться с уральским. В историю минералогии вошло уральское месторождение Гумешки, где в 1835 году была найдена глыба в 250 тонн.
Минерал подвешивали над колыбелью младенца, чтобы защитить его от злых духов и болезней. Малахитовый камень – первый подарок, который преподносили младенцу
В Древнем Египте считалось, что этот камень — наилучший помощник фараонов в принятии решений
Образование малахита в природе
В природных условиях некоторые руды образовались за счет взаимодействия карбонатных пород с растворами солей металлов, главным образом в виде сульфатов. Сульфаты меди получаются в природных условиях при окислении сульфидов кислородом воздуха в присутствии воды. Для имитации этих процессов, которые в природе протекают миллионы лет, можно в малахит превратить яичную скорлупу.
Цель работы
доказать влияние температуры и концентрации насыщенных растворов соли на скорость химической реакции на примере получения малахита из яичной скорлупы
Задачи работы:
— изучить состав малахита и области его применения из литературных источников;
— изучить методику приготовления насыщенных растворов медного купороса по кривым растворимости;
- изучить методику и химизм получения малахита из яичной скорлупы;
- воспроизвести в лабораторных условиях природный процесс образования малахита;
- провести исследование на предмет влияния температуры и концентрации растворов медного купороса на скорость образования малахита и интенсивность его окраски.
Объект исследования :
Физические факторы (температура, концентрация растворов), влияющие на скорость химической реакции
Предмет исследования :
— насыщенные растворы медного купороса , приготовленные при различных температурах, интенсивность окраски малахита
Гипотеза:
В лабораторных условиях можно получить малахит из яичной скорлупы.
На скорость образования малахита в природе и интенсивность его окраски влияют температура и концентрация насыщенных растворов солей меди ( II)
Химизм процесса
При некотором избытке солей в растворе образуются гидроксиды металлов, а в некоторых случаях — основные соли :
2СаCO 3 + 2CuSO 4 + H 2 O CuCO 3 Cu(OH) 2 +
2CaSO 4 + CO 2
Малахит в природе
Экспериментальная часть 1.Реактивы и оборудование
Оборудование:
- Лабораторные весы
- Лабораторные разновесы
- Мензурка
4. Термометр
5. Ложечка для сыпучих реактивов
- Склянки для растворов емкостью 500мл.
7. Нагревательный прибор
Реактивы:
- Яичная скорлупа
- Медный купорос
- Дистиллированная вода
Экспериментальная часть 2. Изучение теории приготовления насыщенных растворов медного купороса
1. Выяснили , что растворимость медного купороса зависит заметно от температуры (при повышении температуры от 0 0 С до 100 0 С растворимость возросла более, чем в 3 раза) .
Экспериментальная часть 2. Изучение теории приготовления насыщенных растворов медного купороса
2. Для приготовления насыщенных растворов использовали кривые растворимости медного купороса и вычислили коэффициенты растворимости соли при температуре
Экспериментальная часть 3. Определение коэффициентов растворимости медного купороса
3.Коэффициент растворимости –максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре
Результаты расчетов внесли в таблицу
Температура раствора
20 0 С
Коэффициент растворимости
40 0 С
0,20 (20 /100)
(число г соли/100г растворителя)
0.30 (30 /100)
60 0 С
0,45 (45 /100)
(число г соли/100г растворителя)
Экспериментальная часть 4. Практическая часть
4. В куриных яйцах сделали два отверстия с противоположных его сторон, «выдули» содержимое и поместили в насыщенные растворы медного купороса при температурах 20 0 С, 40 0 С, 60 0 С.
Результат – через 3 недели
Результаты эксперимента
Температура насыщенного раствора
т
Скорость образования малахита
20 0 С
Цвет
3 недели (21 день)
40 0 С
Светло-зеленый с темными вкраплениями бесцветными кристалликами гипса
60 0 С
2,5 недели (18 дней)
Темно-зеленый с темными вкраплениям и бесцветными кристалликами гипса
2 недели (14 дней)
Темно-зеленый и с бесцветными кристалликами гипса
20 0 С
40 0 С
60 0 С
Заключение
1. В лабораторных условиях получили искусственный малахит из яичной скорлупы в течение 2-3 недель.
В растворе сульфата меди на поверхности
образовавшегося малахита выпали мельчайшие кристаллики гипса, а в насыщенных растворах , приготовленных при температуре 40 0 С, 60 0 С,
еще образовались кристаллы медного купороса.
2. В ходе эксперимента мы подтвердили свою гипотезу о том, что в природных условиях температура растворов солей и концентрация повлияли на окрасу малахита.
Список литературы
1. Большая Советская энциклопедия ∕ издание четвертое, исправленное
и дополненное, гл. ред. А.М. Прохоров, М.: «советская энциклопедия» 1990 – 1631 с.
2. Химия 8: учебник для учащихся общеобразовательных учреждений ∕ Н.Е. Кузнецова, И.М. Титова, Н.Н. Гара и др.- 3 — е издание. , перераб. – М: Издательский центр «Вентана – Графф» 2010 — 223 с .
3.Химия. Неорганическая химия 8 класс: учебник для общеобразовательных учреждений ∕ Г.Е. Рудзитис, Ф.Г. Фельдман- 13 издание. – М: Просвещение 2009 — 176 с .
4. Научно-методический журнал «Химия в школе» ,№3, 1990г.с. 40-41
5.Энциклопедическийсловарь юного химика ∕Составители В.А.Крицман, В.В.Станцо. М.: Просвещение 1982 -362 с.
6. Я познаю Мир. Детская энциклопедия: Химия ∕ Авт.-сост. Л.А.Савина; — М. :
АСТ 1996. -446с.
. https://ru.wikipedia.org/wiki/ Малахит
https://tvoi-uvelirr.ru/malaxit-istoriya-proisxozhdenie-i-svojstva-minerala/
https://yandex.ru/images/search?text= малахит& stype = image&lr =193&source=wiz
https://yandex.ru/images/search?text= кривые%20растворимости%20солей%20в%2
0воде%20таблица
Спасибо за внимание