Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атом кислорода в спиртах находится в состоянии sp3-гибридизации.
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5оС).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде.
Метанол смешивается с водой в любых соотношениях.
Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Например, метанол взаимодействует с калием с образованием метилата калия и водорода.
2CH3-OH + 2K → 2CH3OK + H2
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, метилат калия разлагается водой:
CH3OK + H2O → CH3-OH + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, метанол реагирует с бромоводородом.
CH3-OH + HBr → CH3Br + H2O
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии метанола с аммиаком образуется метиламин.
CH3-OH + NH3 → CH3NH2 + H2O
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты):
CH3-OH + CH3COOH → CH3COOCH3 + H2O
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, метанол взаимодействует с азотной кислотой:
CH3-OH + HNO3 → CH3ONO2 + H2O
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации метанола при температуре до 140оС образуется диметиловый эфир:
2CH3-OH → CH3OCH3 + H2O
4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Метанол → формальдегид → углекислый газ
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
Например, метанол окисляется оксидом меди до муравьиного альдегида
CH3-OH + CuO → CH2O + H2O + Cu
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
2CH3-OH + O2 → 2CH2=O + 2H2O
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
Например, уравнение сгорания метанола:
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
CH3-OH → CH2=O + H2
Получение метанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
Например, при гидрировании формальдегида образуется метанол
CH2=O + H2 → CH3-OH
4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
CO + 2H2 ⇄ CH3OH
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
АММИАК NH₃ — бесцветный газ с чрезвычайно острым, характерным, вызывающим слезы запахом
Схема производства аммиака включает следующие стадии:
Вспомогательный материал: катализатор (пористое железо)
1. Основной химический процесс: азотоводородную смесь получают парокислородной конверсией метана:
СН4 + Н2O(г) ↔ СО + ЗН2 — 207 кДж
2СН4+ O2 ↔ 2СО + 4Н2 + 70 кДж
СО + Н2O(г) ↔ СO2 + Н2 + 42 кДж
Газы реагируют при 450—500 °С в присутствии катализатора под давлением 15-106 Па с образованием 10—20% аммиака:
N2 + ЗН2 ↔ 2NН3 + 92 кДж
Данная реакция:
- обратимая
- экзотермическая
- каталитическая
- гетерогенная (катализатор – твердое вещество)
Оптимальные условия:
- температура 400-500 0С
- давление 15-30 МПа
- катализатор – порошкообразное железо с примесью оксидов алюминия и калия
ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ
H2SO4 -бесцветная маслянистая жидкость без запаха плотностью 1,83 г/см3
Пагубно действует на растительные и животные ткани, отнимая от них воду, вследствие чего они обугливаются.
С водой смешивается во всех соотношениях, причём при разбавлении соединения водой происходит сильное разогревание, сопровождающееся разбрызгивание жидкости.
Одна из самых сильных кислот. В водных растворах практически полностью диссоциирует на ионы:
H2SO4 = 2 Н+ + SO42-
Раствор оксида серы (+6) SO3 в серной кислоте называется олеумом H2SO4∙SO3
- S(самородная сера)
- H2S(сероводород)
- Cu2S, ZnS, PbS (цветные металлы)
- CaSO4*2H2O (гипс)
- FeS2 (пирит) – содержание серы 54,3%.
Вспомогательные материалы:
серная кислота (98%), катализатор — оксид ванадия (V).
ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВА
I СТАДИЯ
Обжиг сырья (пирита) и получение оксида серы SO2.
4FeS₂ + 11O₂ = 2Fe₂O₃ + 8SO₂ + Q
(минерал пирит)
Условия
1. Воздух, обогащенный кислородом.
2. t=8000 , теплота экзотермической реакции отводиться.
3. «Кипящий» слой (принцип противотока — увеличение площади соприкосновения).
4. Время обжига — несколько секунд, процесс непрерывный
ПОДГОТОВКА СЫРЬЯ ДЛЯ II СТАДИИ
Прежде чем приступить ко II стадии SO2 очищают от пыли:
Циклон – от крупных частиц пыли.
Электрофильтр – от мелких частиц пыли
Осушить в сушильной башне – поглощается газ концентрированной серной кислотой
Нагреть до t=4000 в теплообменнике
ПРИНЦИПЫ II СТАДИИ (контактный аппарат)
2 SO2 + O2 ↔ 2 SO3 + Q
1. Понижение температуры от 6000С до 4000С.
2. Повышение давления
3. Катализатор V2O5 на керамике.
4. Окисление в «кипящем слое» катализатора.
5. Противоточное движение.
6. Теплообмен.
III СТАДИЯ: ПОГЛОЩЕНИЕ СЕРНОГО ГАЗА (ПОГЛОТИТЕЛЬНАЯ БАШНЯ)
SO3+H2O=H2SO4+Q (t до 300оС)
1. Противоток газа и кислоты
2. Увеличивают площадь соприкосновения (керамические кольца Рашига)
3. Отводят продукты реакции
4. Орошают 98% серной кислотой, образуется олеум (раствор SO3 в H2SO4)
ТРАНСПОРТИРОВКА И ХРАНЕНИЕ СЕРНОЙ КИСЛОТЫ
Транспортируют в железнодорожных и автоцистернах из кислотостойкой стали
Хранят в герметически закрытых емкостях из полимера или нержавеющей стали, покрытой кислотоупорной плёнкой
ПОТРЕБЛЕНИЕ СЕРНОЙ КИСЛОТЫ
1. Производство минеральных удобрений.
2. Производство сульфатов (солей серной кислоты).
3. Производство синтетических волокон.
4. Черная и цветная металлургия.
5. Производство органических красителей.
6. Спирты, кислоты, эфиры(орг. вещества).
7. Пищевая промышленность(патока, глюкоза), эмульгатор (загуститель) Е513.
8. Нефтехимия(минеральные масла).
9. Производство взрывчатых веществ.
ЭКОЛОГИЧЕСКИЙ УЩЕРБ ПРОИЗВОДСТВА
При аварийных выбросах в атмосферу попадают соединения серы: SO2;SO3; H2S; H2SO4; Fe2O3(пыль)
ПОСЛЕДСТВИЯ: «закисление» почв и водоёмов, «металлизация» атмосферы
РЕШЕНИЕ ЭКОЛОГИЧЕСКИХ ПРОБЛЕМ:
1. Непрерывность технологического процесса;
2. Комплексное использование сырья;
3. Совершенствование технологического оборудования.
ПРОИЗВОДСТВО МЕТАНОЛА
Сегодня исходный синтез-газ (сингаз) для синтеза метанола получают в результате конверсии (превращения) углеводородного сырья:
природного газа, коксового газа, жидких углеводородов (нефти, мазута, легкого каталитического крекинга) и твердого топлива (угля, сланцев).
Исходный газ для синтеза метанола можно получить почти из всех видов сырья, которые используют при получении водорода, например в процессах синтеза аммиака. Поэтому производство метанола часто базируется на тех же сырьевых ресурсах, что и производство аммиака и поэтому является составной частью основного химического производства.
Примером такого смешанного производства являются ОАО «Невинномысский Азот», расположенное в г. Невинномысске (Ставропольский край) и НПО «Азот» в г. Новомосковске.
ПОЛУЧЕНИЕ МЕТАНОЛА ИЗ СИНТЕЗ-ГАЗА.
1 стадия:
Конверсия природного газа в синтез-газ:
СН4 +Н2О = СО + 3Н2
метан синтез-газ
2 стадия:
Каталитический синтез метанола из монооксида углерода и водорода
Сырьем для синтеза метанола служит синтез-газ (CO + H2), обогащенный водородом:
Процесс осуществляют на цинк-хромовых и медьсодержащих катализаторах.
На отечественных производствах метанола в основном используют активный цинк-хромовый катализатор (3ZnO-ZnCr2О4) при 380—4000C и давлении 20 – 30 МПа.
Выбирая оптимальный температурный режим и величину давления, необходимо учитывать возможность образования побочных соединений: метана, высших спиртов, кислот, альдегидов, кетонов и эфиров.
Эти реакции обусловливают бесполезный расход синтез-газа и удорожают очистку метанола.
Таким образом, промышленный синтез метилового спирта включает три основные стадии:
1. получение смеси окиси углерода и водорода (синтез-газ);
2. получение метилового спирта-сырца;
3. выделение и очистка метилового спирта (ректификация).
Получение одноатомных cпиртов
Гидратация алкенов
В присутствии сильных минеральных кислот, алкены вступают в реакцию гидратации с образованием спиртов:
В случае несимметричных алкенов присоединение происходит в соответствии с правилом Марковникова – атом водорода молекулы воды присоединяется к более гидрированному атому углерода, а гидрокси-группа к менее гидрированному при двойной связи:
Гидрирование (восстановление) альдегидов и кетонов
Гидрирование альдегидов на металлических катализаторах (Pt, Pd или Ni) при нагревании приводит к образованию первичных спиртов:
В аналогичных условиях из кетонов получаются вторичные спирты:
Гидролиз сложных эфиров
При действии на сложные эфиры сильных минеральных кислот они подвергаются гидролизу с образованием спирта и карбоновой кислоты:
Гидролиз сложных эфиров в присутствии щелочей называют омылением. Данный процесс является необратимым и приводит к образованию спирта и соли карбоновой кислоты:
Данный процесс протекает по действием на моногалогенпроизводные углеводородов водного раствора щелочи:
Другие способы получения отдельных представителей одноатомных спиртов
Спиртовое брожение глюкозы
В присутствии некоторых дрожжей, точнее под действием вырабатываемых ими ферментов, возможно образование этилового спирта из глюкозы. При этом в качестве побочного продукта образуется также углекислый газ:
Получение метанола из синтез-газа
Синтез-газом называют смесь угарного газа и водорода. Действием на данную смесь катализаторов, нагрева и повышенных давлений в промышленности получают метанол:
Получение многоатомных спиртов
Реакция Вагнера (мягкое окисление алкенов)
При действии на алкены нейтрального раствора перманганата калия на холоду (0oC) образуются вицинальные двухатомные спирты (диолы):
Схема, представленная выше, не является полноценным уравнением реакции. В таком виде ее проще запомнить, для того чтобы суметь ответить на отдельные вопросы тестовые вопросы ЕГЭ. Однако, если данная реакция попадется в заданиях высокой сложности, то ее уравнение обязательно нужно записывать в полном виде:
Хлорирование алкенов с последующим гидролизом
Данный метод является двустадийным и заключается в том, что на первой стадии алкен вступает в реакцию присоединения с галогеном (хлором или бромом). Например:
А на второй, полученный дигалогеналкан подвергается обработке водным раствором щелочи:
Получение глицерина
Основным промышленным способом получения глицерина является щелочной гидролиз жиров (омыление жиров):
Получение фенола
Трехстадийный метод через хлорбензол
Данный метод является трехстадийным. На первой стадии осуществляют бромирование или хлорирование бензола в присутствии катализаторов. В зависимости от используемого галогена (Br2 или Cl2) в качестве катализатора используется соответствующий галогенид алюминия или железа (III)
На второй стадии полученное выше галогенпроизводное обрабатывается водным раствором щелочи:
На третьем этапе фенолят натрия обрабатывается сильной минеральной кислотой. Фенол вытесняется поскольку является слабой кислотой, т.е. малодиссоциирующим веществом:
Окисление кумола
Получение альдегидов и кетонов
Дегидрирование спиртов
При дегидрировании первичных и вторичных спиртов на медном катализаторе при нагревании получаются альдегиды и кетоны соответственно
Окисление спиртов
При неполном окислении первичных спиртов получаются альдегиды, а вторичных – кетоны. В общем виде схемы такого окисления можно записать как:
и
Как можно заметить неполное окисление первичных и вторичных спиртов приводит к тем же продуктам, что и дегидрирование этих же спиртов.
В качестве окислителей можно использовать оксид меди при нагревании:
Или другие более сильные окислители, например раствор перманганата калия в кислой, нейтральной, или щелочной среде.
Гидратация алкинов
В присутствии солей ртути (часто вместе с сильными кислотами) алкины вступают в реакцию гидратации. В случае этина (ацетилена) образуется альдегид, в случае любого другого алкина — кетон:
Пиролиз солей карбоновых кислот двухвалентных металлов
При нагревании солей карбоновых кислот двухвалентных металлов, например, щелочно-земельных, образуется кетон и карбонат соответствующего металла:
Гидролиз геминальных дигалогенпроизводных
Щелочной гидролиз геминальных дигалогенпроизводных различных углеводородов приводит к альдегидам если атомы хлора были прикреплены к крайнему атому углерода и к кетонам,если не к крайнему:
Каталитическое окисление алкенов
Каталитическим окислением этилена получают ацетальдегид:
Получение карбоновых кислот
Каталитическое окисление алканов
Окисление алкенов и алкинов
Для этого чаще всего используют подкисленный раствор перманганата или дихромата калия. При этом происходит разрыв кратной углерод-углеродной связи:
Окисление альдегидов и первичных спиртов
В этом способе получения карбоновых кислот также наиболее распространенные используемые окислители это подкисленный раствор перманганата или дихромата калия:
С помощью гидролиза тригалогензамещенных углеводородов
На первой стадии тригалогеналкан подвергается обработке водным раствором щелочи. При этом образуется соль карбоновой кислоты:
На второй стадии следует обработка соли карбоновой кислоты сильной минеральной кислотой. Т.к. карбоновые кислоты являются слабыми они легко вытесняются сильными кислотами:
Гидролиз сложных эфиров
Из солей карбоновых кислот
Данная реакция уже была рассмотрена при получении карбоновых кислот посредством гидролиза тригалогенпроизодных (см. выше). Заключается в том, что карбоновые кислоты, являясь слабыми, легко вытесняются сильными неорганическими кислотами:
Специфические методы получения кислот
Получение муравьиной кислоты из угарного газа
Данный метод является промышленным и заключается в том, что на первой стадии угарный газ под давлением при высоких температурах реагирует с безводной щелочью:
а на второй полученный формиат обрабатывают сильной неорганической кислотой:
2HCOONa + H2SO4 > 2HCOOH + Na2SO4
Получение высших карбоновых кислот гидролизом жиров
Данный метод является основным для получения высших карбоновых кислот:
Получение бензойной кислоты окислением гомологов бензола
Автор: С.И. Широкопояс https://scienceforyou.ru/
4.2.2.1 Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола).
Производство аммиака
Промышленный синтез аммиака основан на прямом взаимодействии простых веществ — азота N2 и водорода H2. Азот, используемый при производстве аммиака, получают фракционной перегонкой жидкого воздуха, а водород – паровой конверсией угля или природного газа:
Рассмотрим уравнение взаимодействия азота с водородом:
Данная реакция является каталитической, т.е. ее скорость многократно возрастает в присутствии катализатора. В качестве катализатора синтеза аммиака из азот-водородной смеси используют катализатор на основе пористого железа.
Поскольку реакция взаимодействия азота с водородом является экзотермической, то для смещения равновесия в сторону образования аммиака процесс целесообразно проводить при низких температурах. Однако без нагревания скорость реакции взаимодействия азота с водородом ничтожно мала, поэтому для синтеза аммиака при выборе температурных условий приходится ориентироваться на «золотую середину». Такой «золотой серединой» является температура около 400-500 оС.
Негативным следствием использования высокой температуры является то, что равновесие реакции сильно смещается в сторону обратной реакции – разложения аммиака, вследствие чего падает его выход.
Согласно уравнению взаимодействия азота и водорода, при протекании реакции суммарное количество газообразных веществ уменьшается, ведь при взаимодействии 3 моль водорода и 1 моль азота (всего 4 моль) взамен образуется только 2 моль аммиака. Поэтому, исходя из принципа Ле Шателье, негативные эффекты, связанные с разложением аммиака, можно снизить, осуществляя процесс под высоким давлением. Давление азот-водородной смеси в колонне синтеза создается с помощью турбокомпрессора и составляет около 300 атм. Тем не менее, даже несмотря на использование колоссального давления, степень превращения азот-водородной смеси «за один заход» не превышает 20 %. Дальнейшее повышение давления по ряду причин невозможно, поэтому проблема низкого выхода решается довольно простым способом. Образовавшийся аммиак отделяется в сепараторе от непрореагировавшей азот-водородной смеси, а оставшаяся смесь направляется с помощью циркуляционного компрессора обратно в колонну синтеза вместе с новой порцией сырья. Такой прием носит название принципа циркуляции. Благодаря принципу циркуляции степень превращения азот-водородной смеси в аммиак удается повысить до 95%.
Производство серной кислоты
В качестве серосодержащего сырья для производства серной кислоты могут быть использованы сера или сероводород (побочные продукты нефтепереработки), минерал пирит FeS2, а также сульфиды некоторых других d-элементов. Никакие другие виды сырья не используются.
В настоящий момент основным сырьем для производства серной кислоты являются сероводород и сера, поскольку они в огромных количествах образуются в качестве побочных продуктов нефтепереработки.
Однако же в школьной программе пока еще по-прежнему считается, что серная кислота производится преимущественно из пирита, в связи с чем и мы будем рассматривать основные стадии производства серной кислоты именно этого же сырья.
Первая стадия
Заключается в сжигании предварительно измельченного пирита в токе обогащенного кислородом воздуха. Процесс протекает в соответствии с уравнением:
Обжиг осуществляют при температуре около 800 оС в печи для обжига. В процессе обжига используют так называемый метод кипящего слоя – частицы измельченного пирита подаются в печь сверху, а воздух — снизу. В результате этого раскаленные частицы пирита оказываются подвешенными в токе воздуха, внешне напоминая кипящую жидкость.
После обжига пирита полученный печной газ, содержащий диоксид серы, отделяется от твердых примесей огарка (Fe2O3) с помощью циклона. Циклоном называют аппарат, в котором происходит грубая очистка печных газов за счет центробежной силы от наиболее крупных твердых частиц. Далее после грубой очистки смесь газов проходит более глубокую очистку уже от оставшихся мелких твердых частиц с помощью электрофильтра. Принцип действия электрофильтра основан на том, что к наэлектризованным металлическим пластинам прилипает пыль, которая после скопления ссыпается с них под собственным весом в приемник.
После очистки от твердых примесей печной газ направляется в нижнюю часть так называемой сушильной башни, в верхнюю часть которой впрыскивается концентрированная серная кислота на встречу газу. При таком варианте осуществления фактически сталкиваются два потока — смеси газов, идущей снизу, и струи жидкой концентрированной серной кислоты, текущей сверху. Очевидно, что в результате этого достигается максимальная степень «смешения» газа с осушающей жидкостью. Данный прием носит название принципа противотока.
Вторая стадия
После очистки от твердых примесей и осушки концентрированной серной кислотой газы поступают в контактный аппарат. В контактном аппарате расположены полки с катализатором V2O5, который катализирует взаимодействие диоксида серы с кислородом в соответствии с уравнением:
Аналогично реакции взаимодействия азота с водородом, рассмотренной выше, данная реакция также является каталитической, экзотермической и протекает с уменьшением количества газообразных веществ. Поэтому с точки зрения принципа Ле Шателье ее следовало бы проводить при низких температурах. Однако при низких температурах скорость реакции крайне низка, и ее осуществляют при оптимальной температуре около 400-500 оС. Смещения равновесия реакции в сторону разложения SO3 при повышении температуры удается практически полностью избежать, проводя реакцию при повышенном давлении.
Третья стадия (заключительная)
После второй стадии образовавшийся триоксид серы поступает в часть установки, называемую поглотительной башней.
Из названия данного аппарата логичным было бы предположить, что триоксид серы в нем поглощается в этой части установки водой, ведь триоксид серы, взаимодействуя с водой, образует серную кислоту. Однако в реальности серный ангидрид SO3 поглощают не водой (!!!), а концентрированной серной кислотой. Связано это с тем, что при смешении серного ангидрида с водой выделяется колоссальное количество теплоты, в результате чего сильно возрастают температура, давление и образуются мельчайшие капли трудноуловимого сернокислотного тумана.
В результате поглощения SO3 концентрированной серной кислотой фактически образуется раствор SO3 в безводной серной кислоте, который называют олеумом. Далее образующийся олеум собирается в металлические емкости и отправляется на склад. Серную кислоту необходимой концентрации получают, добавляя к олеуму воду в нужной пропорции. В результате добавления воды избыток SO3 превращается в серную кислоту.
Производство метанола
Производство метанола основано на реакции взаимодействия угарного газа CO с водородом H2, которая протекает в соответствии с уравнением:
Технологическая цепочка производства метанола практически идентична таковой для получения аммиака. Это обусловлено определенным сходством реакций. Так, например, реакции образования аммиака и метанола являются экзотермическими, обратимыми, каталитическими и протекают с уменьшением объема газообразных веществ.
В синтезе метанола из угарного газа и водорода используются все те же приемы, что и в синтезе аммиака из азот-водородной смеси, в частности:
- наличие катализатора в колонне синтеза;
- принцип теплообмена;
- использование высокого давления для повышения выхода продукта;
- использование высокой температуры для увеличения скорости реакции;
- принцип циркуляции.
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у
насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH.
Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы
OH — глицерины) и т.д.

Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода),
вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).

Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол,
этанол, пропанол, бутанол, пентанол и т.д.

Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с
простыми эфирами, которых мы также коснемся в данной статье.

Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором
щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.

В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.

Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных
химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.

В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).

Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения.
У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся
алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.

В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более
высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при
которых углеродный скелет подвергается деструкции.

Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой
реакции выпадает маслянистый осадок.

Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие
от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.

Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор
окрашивается в характерный синий цвет.

Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов).
Это говорит об их более выраженных кислотных свойствах.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Промышленное получение серной кислоты
1) 4FeS
2
+ 11O
2
→ 2Fe
2
O
3
+ 8SO
2
2) 2SO
2
+ O
2
V
2
O
5
→ 2SO
3
3) nSO
3
+ H
2
SO
4
→ H
2
SO
4
·nSO
3 (
олеум
)
Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в «
кипящем слое
«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом.
Из печи выходит печной газ, состав которого: SO
2
, O
2
, пары воды (пирит был влажный) и мельчайшие частицы огарка (оксида железа). Газ очищают от примесей твёрдых частиц (в циклоне и электрофильтре) и паров воды (в сушильной башне).
В контактном аппарате происходит окисление сернистого газа с использованием катализатора
V
2
O
5
( пятиокись ванадия) для увеличения скорости реакции. Процесс окисления одного оксида в другой является обратимым. Поэтому подбирают оптимальные условия протекания прямой реакции — повышенное давление (т.к прямая реакция идет с уменьшением общего объема) и температура не выше 500 С ( т.к реакция экзотермическая).
В поглотительной башне происходит поглощение оксида серы (VI) концентрированной серной кислотой.
Поглощение водой не используют, т.к оксид серы растворяется в воде с выделением большого количества теплоты, поэтому образующаяся серная кислота закипает и превращается в пар. Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H
2
SO
4
·nSO
3
Промышленное получение аммиака
Предварительно получают азотоводородную смесь. Водород получают конверсией метана (из природного газа):
СН
4
+ Н
2
О(г) → СО + ЗН
2
— Q
2СН
4
+ О
2
→ 2СО + 4Н
2
+ Q
СО + Н
2
О(г) → СО
2
+ Н
2
+ Q
Азот получают из жидкого воздуха.
В турбокомпрессоре происходит сжатие смеси до необходимого давления 25·10
6
Па. В колонне синтеза газы реагируют при 450—500 °С в присутствии катализатора (пористое железо с примесями Al
2
O
3
и K
2
O) :
N
2
+ 3H
2
↔ 2NH
3
+ 92 кДж (выход 10—20% аммиака)
Образующийся аммиак отделяют от непрореагировавших азота и водорода сжижением в холодильнике, возвращая непрореагировавшую азотоводородную смесь в колонну синтеза.
Процесс непрерывный, циркуляционный.
Применение: производство азотных удобрений, взрывчатых веществ, пластических масс и др.
Производство метилового спирта
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Современный способ:
Сырье: синтез-газ — смесь оксида углерода (II) с водородом (1:2).
Вспомогательные материалы: катализаторы (ZnO и CuO).
Основной химический процесс: синтез-газ при температуре 250 °С и давлении 7 МПа превращается каталитически в метанол:
СО + 2Н
2
↔ СНзОН + Q
Особенности технологического процесса: при прохождении газовой смеси через слой катализатора образуется 10—15% метанола, который конденсируют, а непрореагировавшую смесь смешивают со свежей порцией синтез — газа и после нагревания снова направляют в слой катализатора (циркуляция). Общий выход — 85%.
Условия проведения синтеза метанола и аммиака при среднем давлении сходны, а сырье (природный газ) общее для обоих процессов. Поэтому чаще всего производства метанола и аммиака объединяют (азотно-туковые заводы).
Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование
Правила работы в лаборатории
При проведении работ в химической лаборатории обязательно соблюдение правил техники безопасности. Перечислим основные из них:
- Во время работы в лаборатории необходимо соблюдать чистоту, тишину, порядок и правила техники безопасности, так как поспешность и небрежность часто приводят к несчастным случаям с тяжелыми последствиями.
- В каждой лаборатории обязательно должны быть защитные маски, очки.
- В каждом помещении лаборатории необходимо иметь средства противопожарной защиты: ящик с просеянным песком и совком для него, противопожарное одеяло (асбестовое или толстое войлочное), заряженные огнетушители.
- Каждый работающий в лаборатории должен знать, где находятся средства противопожарной защиты и аптечка, содержащая все необходимое для оказания первой помощи.
- На посуде, где хранятся реактивы, должны быть этикетки с указанием названий веществ.
- Категорически запрещается в лаборатории принимать пищу или класть продукты на рабочий стол.
- Опыты нужно проводить только в чистой химической посуде. После окончания эксперимента посуду сразу же следует помыть.
- В процессе работы необходимо следить, чтобы вещества не попадали на лицо и руки, так как многие из них вызывают раздражение кожи и слизистых оболочек.
- Вещества в лаборатории нельзя пробовать на вкус. Нюхать вещества можно, лишь осторожно направляя на себя пары или газы легким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
- Сосуды с веществами или растворами необходимо брать одной рукой за горлышко, а другой — снизу поддерживать за дно.
- Во время нагревания жидких и твердых веществ в пробирках и колбах нельзя направлять их отверстия на себя и окружающих. Нельзя заглядывать сверху в открытые нагреваемые сосуды во избежание возможного поражения при выбросе горячей массы.
- Категорически запрещается выливать в раковины концентрированные растворы кислот и щелочей, а также различные органические растворители, сильно пахнущие и огнеопасные вещества. Все эти отходы нужно сливать в специальные бутыли.
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии.
- Для ускорения растворения твердых веществ в пробирке нельзя закрывать ее отверстие пальцем при встряхивании.
- Растворение щелочи следует производить в фарфоровой посуде путем прибавления к воде небольших порций вещества, при непрерывном перемешивании.
- Пролитую кислоту или щелочь следует засыпать чистым сухим песком и перемешивать его до полного впитывания всей жидкости. Влажный песок убрать совком в широкий стеклянный сосуд для последующей промывки и нейтрализации.
- Растворы из реактивных склянок необходимо наливать так, чтобы при наклоне этикетка оказывалась сверху (этикетка — в ладонь). При попадании на кожу растворов щелочей или кислот необходимо смыть их после стряхивания видимых капель сильной струей холодной воды, а затем обработать нейтрализующим раствором ($2%$-ным раствором уксусной кислоты или $2%$-ным раствором гидрокарбоната натрия) и ополоснуть водой.
Лабораторная посуда и оборудование
Лабораторная посуда — это специальные и специализированные емкости различного конструктивного исполнения, объема, изготовляемые из разнообразных материалов (стекла, фарфора), устойчивых в агрессивных средах, обладающие термостойкостью.
При выполнении опытов используется такая лабораторная посуда: стеклянные пластинки и палочки, выпарительные фарфоровые чаши, пробирки, химические стаканы, плоскодонные и конические колбы, банки, склянки с пипеткой, воронки, мерные цилиндры и стаканы, капельницы и $U$-образные трубки.
Стеклянные пробирки предназначены для работы с малыми объемами веществ. При работе с пробирками следует соблюдать следующие правила:
- Запрещается встряхивать пробирку, закрывая отверстие пальцем. Попадание любых химических веществ на незащищенные участки кожи может быть опасным, а в пробирку при этом могут попасть сторонние вещества, влияющие на ход эксперимента.
- Перемешивать растворы в пробирке следует быстрыми энергичными постукиваниями по стенкам пробирки.
При работе с большими объемами веществ используются химические колбы и стаканы. При работе с ними следует также придерживаться определенных правил:
- Содержимое колбы следует перемешивать круговыми движениями, а содержимое стакана — стеклянной палочкой, надев на ее конец отрезок резиновой трубки, чтобы не повредить стенку стакана.
- При переливании жидкостей из сосудов с широким горлышком в сосуды с узким горлышком следует использовать химические воронки.
Для фильтрования веществ также используются химические воронки и фильтровальная бумага. Бумажный фильтр вкладывается в воронку и смачивается водой для плотного прилегания к стенкам воронки.
Жидкость следует выливать на фильтр тонкой струей по стеклянной палочке, направляя палочку на стенки воронки. При такой работе осадок останется на фильтре и не попадет в фильтрат.
Для выпаривания растворов используются фарфоровые выпаривательные чаши, которые устанавливаются на кольце химического штатива и нагреваются над пламенем спиртовки.
При получении в ходе химических опытов газов используют колбы или пробирки с плотно подогнанными пробками и газоотводными трубками. Перед использованием посуду стоит проверить на герметичность: кончик газоотводной трубки опустить в стакан с водой, а пробирку плотно обхватить ладонью. Тепло ладони будет способствовать расширению воздуха в пробирке или колбе. При условии герметичности из газоотводной трубки в воду будут выходить пузырьки воздуха.
Для закрепления химической посуды используется лабораторный штатив.
Лабораторный штатив состоит из массивной металлической подставки, в которую ввинчен стержень. На стержне укреплены лапка и кольцо. С помощью муфты лапку и кольцо можно перемещать по стрежню, регулируя высоту их закрепления на штативе. Закрепляется положение муфты и кольца винтами. Пробирки и колбы укрепляются в лапке в вертикальном положении отверстием вверх, закрепляются возле отверстия. Не следует слишком крепко зажимать в лапке химическую посуду, иначе она может лопнуть при нагревании.
Для нагревания веществ используются нагревательные приборы — спиртовка и горелка.
Спиртовка состоит из сосуда, в который налит спирт (не менее 2/3 объема резервуара), фитиля, укрепленного в металлической трубке с диском, и колпачка. Перед началом работы со спиртовки следует снять колпачок, затем проверить, плотно ли прилегает диск к отверстию сосуда (отверстие должно быть закрыто полностью, иначе спирт в сосуде может вспыхнуть). Поджигать спиртовку следует только горящей спичкой.
Газовая горелка состоит из металлической трубки с двумя круглыми отверстиями внизу, расположенными друг напротив друга. Трубка ввинчена в металлическую подставку, имеющую боковую трубку с надетым на нее шлангом, который соединяется с газовым краном. Газ, поступая в горелку, смешивается с воздухом, поступающим через боковые отверстия. Горелку также следует зажигать только горящей спичкой.
Пламя имеет три зоны. Нижняя зона (темная) — самая холодная. Затем средняя — наиболее яркая и верхняя — зона самой высокой температуры. Нагревать посуду при проведении химических опытов следует в верхней зоне пламени.
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии.
- При разбавлении кислот водой помните: наливают кислоту медленно, при перемешивании, в воду, а не наоборот.
- Кусочки щелочи можно брать только пинцетом или щипцами. Растворяют щелочь в фарфоровой посуде, прибавляя к воде небольшие порции вещества при помешивании.
- Пролитые кислоту или щелочь следует засыпать чистым сухим песком и перемешать его до полного впитывания жидкости. Влажный песок убирают совком в широкий стеклянный сосуд для последующей промывки и нейтрализации.
- При попадании на кожу раствора кислоты необходимо стряхнуть капли, обмыть кожу сильной струей холодной воды, обработать $3%$-ным содовым раствором и смазать вазелином.
- Работы, связанные с выделением вредных паров или газов, проводить только в вытяжном шкафу при включенной вентиляции.
- При попадании на кожу раствора щелочи необходимо стряхнуть капли, смыть сильной струей холодной воды, обработать $1%$-ным раствором уксусной кислоты.
- Внимательно читайте инструкцию и неукоснительно соблюдайте правила обращения с любым средством бытовой химии.
- Неукоснительно следуйте инструкции, касающейся срока годности любого препарата, особенно если это лекарства.
Научные методы исследования химических веществ и превращений
Весь окружающий нас мир, все существующее — это материя, которая проявляется в двух формах: вещества и поля. Вещество состоит из частиц, имеющих собственную массу, например, атомов, молекул, ионов. Поле — это такая форма существования материи, которая, в первую очередь, характеризуется энергией, посредством поля осуществляется взаимодействие между частицами.
Неотъемлемым свойством материи является движение. Формы движения материи изучаются разными естественными науками: физикой, химией, биологией и др.
Химия имеет дело прежде всего с веществами, их свойствами, взаимными превращениями и процессами, сопровождающими эти превращения.
Химия — фундаментальная наука об одной из основных форм движения материи — химической.
При изучении химии, как и других естественных дисциплин, широко используют такой важнейший метод по знания, как наблюдение.
Наблюдение — это целенаправленное восприятие химических объектов (веществ и их свойств) с целью их изучения.
Для того чтобы наблюдение было плодотворным, необходимо соблюдать ряд условий:
- Нужно четко определить предмет наблюдения, т.е. то, на что будет обращено внимание наблюдателя, — конкретное вещество, его свойства, то или иное превращение вещества и т.д.
- Необходимо знать, зачем проводится наблюдение, т.е. четко сформулировать его цель.
- Нужно составить план наблюдения. А для этого следует выдвинуть гипотезу о том, как будет происходить наблюдаемое явление. Гипотеза может быть выдвинута и в результате наблюдения, когда получен какой-то результат, который нужно объяснить.
Научное наблюдение отличается от наблюдения в житейском смысле этого слова. Как правило, научное наблюдение проводится в строго контролируемых условиях, причем условия эти можно изменять по желанию наблюдателя. Чаще всего такое наблюдение проводится в специальном помещении — лаборатории.
Исследования, которые проводятся в строго контролируемых и управляемых условиях, называют экспериментом.
Эксперимент позволяет подтвердить или опровергнуть гипотезу. Так формулируется вывод.
Некоторые наблюдения неудобно или невозможно проводить непосредственно в природе, поэтому в изучении химии большую роль играет моделирование.
В лабораторных условиях используют особые приборы, установки и предметы — модели, в которых копируются только самые важные, существенные признаки и свойства объектов изучения.
Моделирование — это изучение объекта с помощью по строения и изучения моделей, т.е. его заменителей или аналогов.
Условно химические модели можно разделить на две группы: предметные (модели атомов, молекул, кристаллов, химических установок и т.д.) и знаковые, или символьные (символы химических элементов, формулы веществ, уравнения реакций).
А что изучает химия? Химия — это наука о веществах, их свойствах и превращениях.
Вещество — это то, из чего состоят физические тела.
В жизни, как правило, мы встречаемся не с чистыми веществами, а со смесями веществ. Эти смеси могут быть неоднородными (например, мутная речная вода содержит в себе нерастворимые частицы песка и глины, которые видны невооруженным глазом) и однородными (растворы спирта, сахара), в которых нельзя заметить границу раздела между веществами.
Среди однородных смесей можно выделить жидкие, твердые и газообразные. Важнейшая газообразная смесь — воздух — представляет собой смесь азота, кислорода, углекислого газа, аргона и других веществ. К твердым смесям можно отнести стекло и различные сплавы — сталь, бронзу, латунь и др.
Состав смесей может быть самым разнообразным, и они, в отличие от чистых веществ, имеют другие свойства. Так, чистая вода замерзает при $0°С$, а если растворить в ней поваренную соль, то можно добиться значительного понижения температуры замерзания.
Состав смесей устанавливают с помощью химического анализа. Химический анализ применяется очень широко, он необходим при решении важнейших хозяйственных и научно-технических задач. Проведение анализа стали по ходу ее выплавки (например, определение содержания углерода) — обязательное условие успешного проведения металлургического процесса.
Без определения концентрации примесей, загрязняющих воду и воздух, невозможен контроль за состоянием окружающей среды. Химический анализ горных пород и руд используется при разведке полезных ископаемых. С помощью особых методов с применением химического анализа получают особо чистые вещества, в которых содержание примесей, влияющих на их специфические свойства, не превышает одной стотысячной и даже одной миллионной процента. Эти вещества играют важную роль в атомной энергетике, полупроводниковой промышленности, волоконной оптике. Свойства особо чистых веществ используются для создания принципиально новых приборов или технологических процессов.
Понятие о металлургии: общие способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов.
В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода ($Ag, Hg, Pt, Au, Cu$), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
${M}↖{n+}+ne↖{-}→{M}↖{0}$
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы. В соответствии с этим существуют следующие способы получения металлов: пирометаллургический, гидрометаллургический, электрометаллургический.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита $SnO_2$, а медь — из куприта $Cu_2O$ прокаливанием с углем (коксом):
$SnO_2+2C=Sn+2CO↑,$
$Cu_2O+C=2Cu+CO↑.$
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
${2ZnS}↙{text»сфалерит(цинковая обманка)»}+3O_2=2ZnO+2SO_2↑;$
$ZnO+C=Zn+CO↑.$
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т.к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
${FeCO_3}↙{text»сидерит(шпатовый железняк)»}=FeO+CO_2↑,FeO+C=Fe+CO↑.$
Восстановлением углем можно получить $Fe, Cu, Zn, Cd, Ge, Sn, Pb$ и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород (а) или активные металлы (б):
а) $MoO_3+3H_2=Mo+3H_2O$ (водородотермия).
К достоинствам этого метода относится получение очень чистого металла.
б) $TiO_2+2Mg=Ti+2MgO$ (магниотермия),
$3MnO_2+4Al=3Mn+2Al_2O_3$ (алюминотермия).
Чаще всего в металлотермии используют алюминий, теплота образования оксида которого очень велика ($2Al+1.5O2=Al_2O_3+1676$ кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции ($Q$), зная значения теплот образования оксидов:
$Q=∑Q_1-∑Q_2,$
где $Q_1$ — теплота образования продукта, $Q_2$ — теплота образования исходного вещества.
Гидрометаллургия — это восстановление металлов из их солей в растворе. Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди $CuO$, ее обрабатывают разбавленной серной кислотой:
$CuO+H_2SO_4=CuSO_4+H_2O$.
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
$CuSO_4+Fe=Cu+FeSO_4$.
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Производство аммиака и метанола
Основные стадии химического производства
I. Подготовка сырья и подвод реагирующих веществ в зону реакции.
II. Химические процессы.
III. Отвод продуктов и непрореагировавших веществ из зоны реакции.
Сравним два химических производства: синтез аммиака и синтез метанола. Оба процесса очень похожи по условиям их проведения и источникам сырья. Их осуществляют на аналогичных установках, которые часто монтируют на одном предприятии.
Все аппараты этих производств максимально герметичны, используется только энергия экзотермических реакций. Благодаря циклической (замкнутой) схеме синтеза эти производства служат примерами малоотходных, почти не имеющих выбросов в окружающую среду. Затраты на производство существенно снижены за счет осуществления непрерывного процесса: исходные вещества постоянно поступают в реактор, а продукты постоянно из него выводятся. Непрерывность процесса позволяет его полностью автоматизировать.
Производства аммиака и метанола считаются наиболее передовыми с точки зрения химической технологии.
Аммиак в дальнейшем используют для получения азотной кислоты, которая идет на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ. Большие количества аммиака расходуются на получение мочевины, являющейся прекрасным азотным удобрением, да и сам жидкий аммиак и его водный раствор — это жидкие удобрения. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Метанол используют для получения большого количества разных органических веществ, в частности, формальдегида 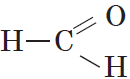
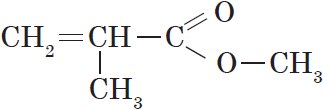
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Промышленное получение веществ и охрана окружающей среды
Химическая промышленность и химическая технология
Многие химические реакции, с которыми вы познакомились в лабораторных условиях, или аналогичные им осуществляют в промышленных условиях при производстве важнейшей для повседневной жизни химической продукции.
Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, мыла и моющие средства, красители, пестициды, косметика и парфюмерные изделия и даже компоненты пищи — все это только некоторые виды продукции, выпуск которой полностью или частично зависит от химической промышленности. Одиннадцать первых мест по объему производства принадлежат следующим химическим веществам: $H_2SO_4, NH_3, N_2, CaO, O_2, C_2H_4, NaOH, Cl_2, HCl, H_3PO_4, HNO_3$. Эти-то вещества и используются в больших количествах далее для получения столь необходимых видов продукции, названных выше.
Даже если речь идет о $100%$-ном природном продукте, это означает лишь то, что в нем нет синтетических добавок, и совсем не означает, что при его получении не использовали какие-либо химические технологии.
Химическая промышленность — это отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья.
Основой ее является химическая технология — наука о наиболее экономичных методах и средствах массовой химической переработки природных материалов (сырья) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства. Главная задача химии и химической технологии — производство разнообразных веществ и материалов с определенным комплексом механических, физических, химических и биологических свойств.
Любое химическое производство создается на основе общих научных принципов.
Научные принципы организации химических производств.
| Общие принципы | Частные принципы |
| Создание оптимальных условий проведения химических реакций | Противоток веществ, прямоток веществ, увеличение площади поверхности соприкосновения реагирующих веществ, использование катализатора, повышение давления, повышение концентрации реагирующих веществ |
| Полное и комплексное использование сырья | Циркуляция, создание смежных производств (по переработке отходов) |
| Использование теплоты химических реакций | Теплообмен, утилизация теплоты реакции |
| Принцип непрерывности | Механизация и автоматизация производства |
| Защита окружающей среды и человека | Автоматизация вредных производств, герметизация аппаратов, утилизация отходов, нейтрализация выбросов в атмосферу |
Важнейшими составляющими химического производства являются:
- аппаратура;
- сырье;
- энергия;
- вода и другие вспомогательные мате риалы.
Сырье
Сырьем называют природные материалы (природные ресурсы), используемые в промышленности для получения различных продуктов и еще не прошедшие промышленную переработку.
Иногда используют вторичное сырье — это изделия, отслужившие свой срок, или отходы каких- либо производств, которые экономически выгодно снова переработать в химические продукты. Сырье химической промышленности классифицируют по различным признакам.
По составу сырье делят на минеральное и органическое (растительное и животное).
По агрегатному состоянию различают твердое (руды, горные породы, твердое топливо), жидкое (нефть, рассолы) и газообразное (природный и попутный газы, воздух) сырье.
К минеральному сырью относятся все виды руд (из них получают металлы), а также нерудные ископаемые: сера, фосфориты, калийные соли, поваренная соль, песок, глины, слюда (из них получают неметаллы, удобрения, соду, щелочи, кислоты, керамику, цемент, стекло и другие продукты).
К органическому сырью относится ископаемое горючее: торф, уголь, нефть, природный и попутный нефтяной газы — это ценное энергетическое сырье и сырье для химических синтезов. К органическому сырью также относится сырье растительного и животного происхождения, его дают сельское, лесное и рыбное хозяйства. В основном оно используется для производства продуктов питания, но частично, к сожалению, является и техническим сырьем. Кроме природных веществ, на химических заводах применяют полупродукты и отходы предприятий, а также вспомогательные материалы: воду, топливо, окислители, растворители, катализаторы.
В связи с бурным развитием промышленности растет и объем потребления полезных ресурсов. Это приводит к тому, что многие сырьевые источники быстро истощаются, поэтому необходимо решать проблему бережного и рационального использования сырья.
Вода
Особое место среди природных ресурсов занимает вода. Она играет важную роль в химической промышленности.
В ряде производств это сырье и реагент, непосредственно участвующий в основных химических реакциях, например, при получении водорода, серной, азотной и фосфорной кислот, щелочей; в реакциях гидратации и гидролиза.
Будучи универсальным растворителем и одним из наиболее распространенных катализаторов, вода дает возможность осуществлять многие химические реакции с большой скоростью в растворах или в присутствии ее следов. В химической, металлургической, пищевой и легкой промышленности воду используют как растворитель твердых, жидких, газообразных веществ. Часто ее применяют для перекристаллизации, очистки различных продуктов производства от примесей.
Вода используется как теплоноситель из-за ее большой теплоемкости, доступности и безопасности в применении. Ею охлаждают реагирующие массы, нагретые в результате экзотермических реакций. Водяным паром или горячей водой подогревают взаимодействующие вещества для ускорения реакций или проведения эндотермических процессов.
Современные химические комбинаты расходуют миллионы кубических метров воды в сутки. Например, для получения $1$т аммиака требуется $1500м^3$ воды. Поэтому химические предприятия, нефтехимические заводы строят рядом с водными источниками.
Задачу сокращения расхода воды химическими предприятиями решают в трех основных направлениях: широкое применение оборотного водоснабжения (вода, используемая в теплообменных аппаратах, охлаждается и снова поступает в теплообменные аппараты, и так повторяется многократно), замена водяного охлаждения воздушным, очистка сточных вод и их повторное использование.
Энергия
Вы знаете, что большинство химических процессов требует затраты энергии. В химическом производстве энергию также расходуют на проведение вспомогательных операций: транспортировку сырья и готовой продукции, сжатие газов, дробление твердых веществ, контрольно-измерительное обслуживание и др. Химическая промышленность относится к одной из самых энергоемких. Средний расход только электрической энергии на производство $1$т аммиачной селитры $NH_4NO_3$ равен $11 000$ кВт·ч; $1$т синтетического аммиака — $3200$; $1$т фосфора — $16 500$; $1$т алюминия — $19 000$.
В химической промышленности используют различные виды энергии: электрическую, тепловую, ядерную, химическую и световую.
Электрическую энергию используют для проведения электролиза расплавов и растворов веществ, нагревания, в операциях, связанных с электростатическими явлениями (например, в электрофильтрах при производстве серной кислоты для очистки оксида серы(IV)). Электроэнергию вырабатывают тепловые (ТЭС), атомные (АЭС) электростанции и гидроэлектростанции (ГЭС).
Тепловая энергия в химической промышленности необходима для нагревания реагирующих веществ при проведении химических реакций, а также для сушки, плавления, дистилляции, выпаривания и других операций. Ее источником в производстве цемента, стекла, керамики служат различные виды топлива (твердого, жидкого, газообразного). Большинство же химических предприятий используют тепловую энергию в виде пара, горячей воды, получаемых из котельных установок или ТЭЦ.
Ядерную энергию главным образом используют для получения электроэнергии. Но такие реакции, как полимеризация, синтезы фенола и анимина, отвердевание полимеров, проводят с помощью радиоактивного излучения.
Химическая энергия выделяется в виде теплоты в результате экзотермических реакций. Ее используют для предварительного подогрева исходных веществ, получения горячей воды, водяного пара. Химическая энергия может превращаться в электрическую, например, в аккумуляторах. А есть такие производства, в которых за счет энергии химических реакций покрывают собственные потребности, а излишки отпускают другим потребителям.
При получении $1$т серной кислоты из серы выделяется $5$МДж теплоты, а общие затраты на ее производство составляют всего $0.36$ МДж. Излишки поступают к другим потребителям в виде пара и электроэнергии.
Световую энергию (ультрафиолетовое, инфракрасное, лазерное излучение) используют при синтезе хлороводорода, галогенировании органических веществ, реакциях изомеризации.
Ученые разрабатывают способы использования солнечной энергии, например фотохимическое разложение воды.
Химия и проблемы охраны окружающей среды
В наши дни проблема охраны окружающей среды чрезвычайно остра в связи со значительным, а часто и катастрофическим воздействием хозяйственной деятельности человека на природу.
Производственная деятельность человека нанесла биосфере — живой оболочке Земли — серьезный урон, нарушив сложившееся за время существования планеты экологическое равновесие. Загрязнение окружающей среды в нашем сознании связывается, в первую очередь, с отравлением воды, воздуха, почвы, которое может непосредственно влиять на здоровье и самочувствие человека. Однако химическое загрязнение чревато косвенными эффектами. Например, большие выбросы углекислого газа сказываются на климате, что в свою очередь отражается на производстве продуктов питания; изменение концентраций биогенных элементов (азота, серы, фосфора, калия) приводит к гибели одних популяций и бурному размножению других.
Химическое загрязнение окружающей среды обусловлено следующими факторами:
- повышением концентрации биогенных элементов из-за канализационных сбросов и стока с полей удобрений, вызывающих бурное развитие водорослей и нарушение баланса в существующих экосистемах;
- отравлением воды, почвы и воздуха отходами химических производств;
- воздействием на воду и почву продуктов сжигания топлива, снижающих качество воздуха и вызывающих кислотные дожди;
- потенциальным заражением воды, воздуха и почвы радиоактивными отходами, образующимися при производстве ядерного оружия и атомной энергии;
- выбросами углекислого газа и химических веществ, снижающих содержание озона, что может привести к изменению климата и образованию озоновых дыр.
Природные источники углеводородов. Их переработка
Углеводороды являются важнейшим видом сырья для химической промышленности. В свою очередь, углеводороды достаточно широко распространены в природе и могут быть выделены из различных природных источников: нефти, попутного нефтяного и природного газа, каменного угля. Рассмотрим их подробнее.
Нефть
Это природная сложная смесь углеводородов, в основном алканов линейного и разветвленного строения, содержащих в молекулах от $5$ до $50$ атомов углерода, с другими органическими веществами. Состав ее существенно зависит от места ее добычи (месторождения), она может, помимо алканов, содержать циклоалканы и ароматические углеводороды.
Газообразные и твердые компоненты нефти растворены в ее жидких составляющих, что и определяет ее агрегатное состояние.
Нефть — маслянистая жидкость темного (от бурого до черного) цвета с характерны











![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
















