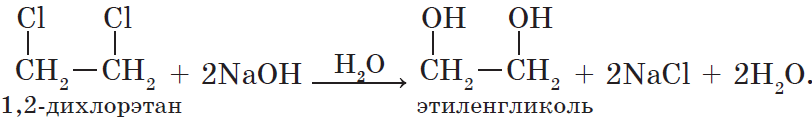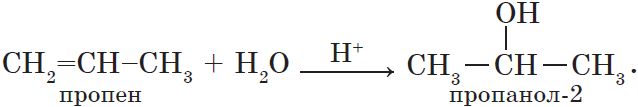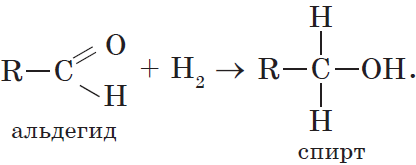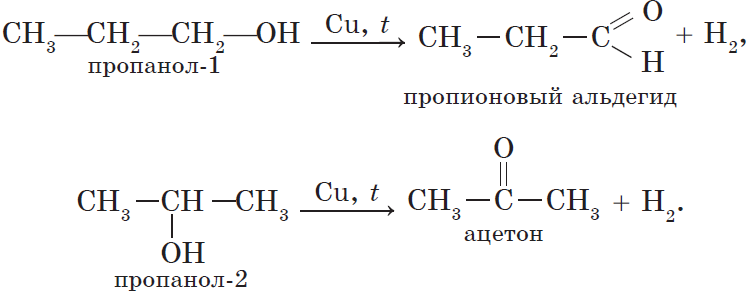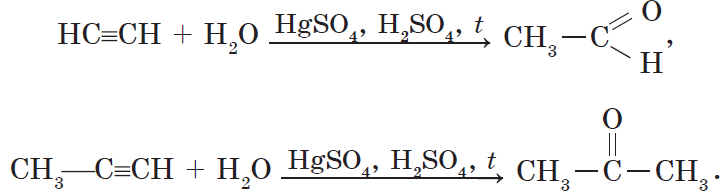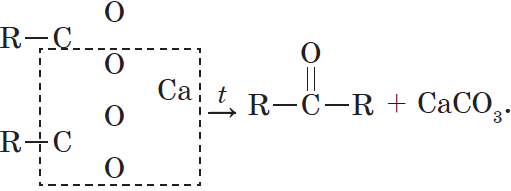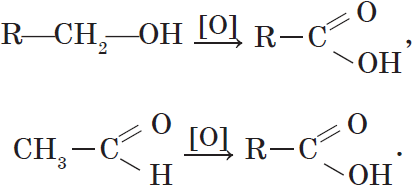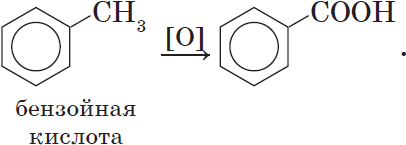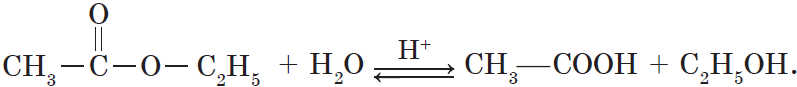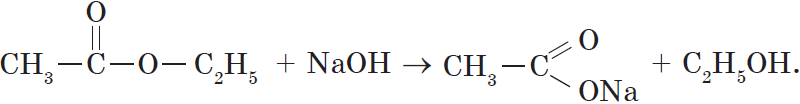Учебное пособие может быть использовано учащимися для закрепления изученного материала и самоподготовки к экзамену. Данный материал содержит химические свойства и способы получения углеводородов, кислород- и азотсодержащих органических соединений.
Химические свойства алканов
Способы получение алканов
Химические свойства циклоалканов
Способы получения циклоалканов
Химические свойства алкенов
Способы получения алкенов
Химические свойства алкадиенов
Способы получения алкадиенов
Химические свойства алкинов
Способы получения алкинов
Химические свойства ароматических углеводородов
Способы получения бензола и его гомологов
Химические свойства одноатомных спиртов
Способы получения предельных одноатомных спиртов
Химические свойства многоатомных спиртов
Способы получения предельных многоатомных спиртов
Химические свойства фенолов
Способы получения фенолов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
Химические свойства аминов
Химические свойства анилина
Способы получения аминов
Химические свойства аминокислот
Способы получения аминокислот
Химические свойства жиров
Химические свойства моносахаридов на примере глюкозы
Химические свойства дисахаридов и полисахаридов
По материалам учебного пособия Кавериной А.А., Молчановой Г.Н., Свириденковой Н.В., Стахановой С.В. «Как получить максимальный балл на ЕГЭ. Решение заданий повышенного и высокого уровня сложности».
12 сентября 2022
В закладки
Обсудить
Жалоба
Памятка по органической химии
Таблица.
pm-h.doc
pm-h.pdf
Класс | Химические свойства | Способы получения
Алканы
Алкены
Алкины
Алкадиены
Арены
Предельные одноатомные спирты
Многоатомные спирты
Альдегиды
Предельные одноосновные карбоновые кислоты
Моносахариды
Дисахариды
Полисахариды
Амины
Аминокислоты
Белки
Автор: Столярова В.А.
Способы получения органических веществ
Способы получения органических веществ
Получение органических соединений, относящихся к различным классам, является основной задачей органического синтеза, как основного, так и тонкого. В основе многих методов получения лежат именные реакции, условия проведения которых необходимо запомнить, поскольку в органической химии именно условия определяют образующийся продукт реакции. В целом все реакции, лежащие в основе получения органических веществ, можно условно разделить на следующие типы:
1. Реакции, направленные на удлинение цепи (конструктивные реакции), например, алкилирование, полимеризация, (поли)конденсация
2. Реакции, направленные на укорочение углеродной цепи (реакции расщепления)
3. Реакции введения, удаления или взаимопревращения функциональных групп
4. Реакции образования кратных связей
5. Реакции циклизации и ароматизации
Далее, в виде справочного материала представлены основные методы получения углеводородов и их основных производных — спиртов, альдегидов, кетонов, карбоновых кислот, аминов, нитро- и галогенпроизводных. Подробно методы получения будут рассматриваться по классам соединений в отдельных темах.
Методы получения алканов
1. Синтез симметричных насыщенных углеводородов (наращивание углеводородной цепи) действием металлического натрия на алкилгалогениды (Реакция Вюрца)
C2H5Br+CH3Br + 2Na →C3H8+2NaBr
2. Восстановление непредельных углеводородов (гидрирование двойной кратной связи) :
H3C−CH=CH2 +H2 → H3C−CH2−CH3
3. Получение метана сплавлением солей карбоновых кислот с твердой щелочью :
t0
CH3COONa + NaOH → Na2CO3+CH4
4. Получение метана — гидролиз карбида алюминия (взаимодействием карбида алюминия с водой):
Al4C3+12H2O → 4Al(OH)3+3CH4
5. Ректификация (прямая перегонка) нефти подробно разбирается в теме «Принципы переработки и применение горючих ископаемых»
Методы получения алкенов
1. Дегидрогалогенирование (действие спиртовых растворов щелочей на моногалогенпроизводные УВ)
спиртNaOH
H3C−CH2−CH2Br → H3C−CH=CH2+NaBr+H2O
2. Дегидратация спиртов (действие на спирты водоотнимающих средств):
3. Дегалогенирование (действие металлического Zn или Mg на дигалогенпроизводные с двумя атомами галогена у соседних атомов):
4. Гидрирование ацетиленовых углеводородов над катализаторами с пониженной активностью ( Fe)
3-метилбутин-1 3-метилбутен-1
5. Пиролиз (дегидрирование) алканов (этана) (см. п. 2 «Методы получения алкинов»)
Методы получения алкинов
Получение ацетилена:
1. Пиролиз метана — межмолекулярное дегидрирование (промышленный метод):
1500∘C
H−CH3 + H3C−H → H−C≡C−H + 2H2
2. Пиролиз (дегидрирование) этана или этилена (промышленный метод)
t0C t0C
H3C−CH3 → H2C=CH2 + H2 → H−C≡C−H + H2
3. Гидролиз карбида кальция (взаимодействие карбида кальция с водой):
CaC2 + 2H2O → HC≡CH + Ca(OH)2
Получение гомологов ацетилена
1. Дегидрогалогенирование (действие спиртового раствора щелочи на дигалогеналканы (щелочь и спирт берутся в избытке):
2. Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами:
Методы получения алкадиенов
Общие способы получения диенов аналогичны способам получения алкенов.
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:
В промышленности каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:
2. Синтез бутадиена (дивинила) из этилового спирта (реакция Лебедева):
3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
4. Дегидрогалогенирование вицинальных дигалогенпроизводных в присутствии спиртового раствора щелочи:
Методы получения Бензола и его гомологов (ароматических УВ)
Основные методы получения ароматических углеводородов основаны либо на процессах циклизации с последующим дегидрированием, при наличии в УВ-цепи более шести атомов углерода, образуются гомологи безола с боковой цепью. Процесс тримеризации ацетилена используется при синтезе бензола и, тем самым, подтверждает его структуру.
1. Дегидрирование циклогексана (получение бензола)
2. Тримеризация ацетилена (получение бензола) реакция Зелинского
3.Риформинг (ароматизация нефти)
4. Коксование каменного угля — нагрев без доступа воздуха до 1000°С. Образуется смесь летучих веществ, каменноугольной смолы и твердый остаток – кокс. Смола – жидкая смесь органических веществ, из которой выделяют многие органические соединения, в том числе и арены.
Методы получения спиртов:
предельных одноатомных, гликолей, фенолов
1. Щелочной гидролиз моногалогенпроизводных алканов (нуклеофильное замещение)
бромэтан этанол
2. Гидратация этилена и несимметричных алкенов (электрофильное присоединение) по правилу Марковникова
3. Восстановление (гидрирование) альдегидов (первичные спирты) и кетонов (вторичные спирты)
диметилкетон изопропиловый
(ацетон) спирт
4.Спиртовое брожение растительного сырья, содержащего углеводы:
C6H12O6 → 2C2H5OH+ 2CO2↑+ 23,5⋅104Дж
Получение гликолей (двухатомных предельных спиртов)
1. Окисление двойной кратной связи (только мягкое окисление!) реакция Вагнера:
Обратите внимание, что при действии жестких окислителей (подкисленного раствора пераманганата калия или озона) образуются карбонильные соединения (карбоновые кислоты и альдегиды), поскольку реакция протекает с разрывом и σ- π-связей.
Получение фенола (ароматического спирта)
1. Кумольный способ (основной промышленный способ)
2. Щелочной гидролиз хлорбензола
3. Выделение из каменноугольной смолы — продукта коксования каменного угля.
Методы получения альдегидов и кетонов
В классе кислородсодержащих углеводородов альдегиды занимают промежуточное положение в генетической цепочке: спирты — альдегиды — кислоты. Поэтому основные методы получения основаны на восстановлении кислот или на окислении спиртов.
1. Восстановление (дегидрирование) спиртов: первичных — до альдегидов, вторичных — до кетонов
пропанол-2 пропанон-2 (ацетон)
2. Окисление спиртов (условный окислитель — CuO,KMnO4, кислород воздуха в присутствии катализатора — Pt, Cu): первичных — до альдегидов, вторичных — до кетонов
этанол ацетальдегид
первичный спирт
изопропанол диметилкетон
вторичный спирт
3. Избирательное восстановление карбоновых кислот
4. Восстановление (гидрирование) хлорангидридов кислот по Розенмунду (катализатор — платиновая чернь, палладий)
5. Сухая перегонка кальциевых и бариевых солей одноосновных кислот: для всех кислот — кетоны; для муравьиной кислоты — альдегид.
В промышленности альдегиды получают следующими способами:
а) каталитическим окислением алканов (метана):
б) каталитическим окислением этилена кислородом воздуха (Вакер-процесс):
в) гидратацией ацетилена в присутствии солей ртути (реакция Кучерова):
Методы получения карбоновых кислот
Карбоновые кислоты являются последним звеном окислительной цепочки «спирты — альдегиды — кислоты», поэтому методы их получения основаны на реакциях окисления.
В промышленности карбоновые кислоты получают мягким каталитическим окислением кислородом воздуха алканов, спиртов и альдегидов. В качестве катализатора используют платину, палладий, соли олова и др., реакции проводят при нормальном давлении и 2000C. Окисление альдегидов происходит наиболее легко без дополнительного нагревания.
1. Окисление алканов:
Специфическими методами синтеза простейших карбоновых кислот (муравьиной и уксусной) являются:
1. Синтез уксусной кислоты каталитическим формилированием метанола (катализатор оксид вольфрама, температура 400∘C давление
2. Синтез муравьиной кислоты из окиси углерода и гидроксида натрия при нагревании с последующей обменной реакцией с серной кислотой:
3. Синтез муравьиной кислоты из окиси углерода и паров воды (катализатор соли меди, серная или фосфорная кислота):
p,t0C,kat
CO + H2O → HCOOH
4. Получение карбоновых кислот из цианидов (нитрилов) проводится в две стадии и позволяет наращивать углеродную цепь:
Методы получения аминов и анилина
1. Взаимодействие аммиака с алкилгалогенидами (RX):
2. Взаимодействие аммиака со спиртами (катализатор — Al2O3,SiO2; t=300−500∘C)
3. Восстановление азотсодержащих органических соединений (получение анилина):
Реакция Зинина:
В общем виде восстановление нитропроизводных до аминов происходит следующим образом:
где [H] — условный восстановитель: H2 в присутствии катализатора (Cu, Ni, Pt, Pd); металл (Fe, Zn, Sn) и кислота; соли металлов в низших степенях окисления (SnCl2,TiCl3)
4. Восстановление нитрилов:
где [H] — восстановитель: H2/Ni;LiAlH4
5. Восстановление амидов карбоновых кислот:
6. Перегруппировка Гоффмана:
RC(O)NH2 + Br2 + 2NaOH →RNH2 + 2NaBr + CO2+H2O
Методы получения нитропроизводных углеводородов: нитроалканов, ароматических нитросоединений
1. Синтез первичных нитроалканов из галогенпроизводных (реакция Мейера):
где Х= Br или I. Условия: абсолютный эфир, t = 0−200C
2. Реакция Коновалова — нитрование алифатических, алициклических и жирноароматических соединений разбавленной НNО3 при повышенном или нормальном давлении (свободнорадикальный механизм) и при температуре 140—150 °C.
2. Нитрование ароматических углеводородов нитрующей смесью — электрофильное замещение:
Реакция электрофильного нитрования лежит в основе синтеза взрывчатых веществ, в том числе тринитротолуола (тротила):
Методы получения галоидпроизводных углеводородов
1. Свободнорадикальное (гомолитическое) галогенирование предельных УВ: замещение атомов водорода, преимущественно у наименее гидрогенизированного атома углерода:
УФ,t0C
R−H + X2 → R−X + HX
и далее продолжение цепи до полного замещения. Реакционная способность галогенов по отношению к алканам уменьшается в ряду:
F2>Cl2>Br2>I2
2. Гидрогалогенирование непредельных УВ: присоединение по кратным связям. Для получения дигалогенпроизводных — галогенирование
H2C=CH−CH3 + HCl → H3C−CH(Cl)−CH3
материал взят в основном здесь:http://foxford.ru/wiki/himiya/sposoby-polucheniya-organicheskih-veschestv
Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам органических соединений.
Лабораторные способы получения веществ отличаются от промышленных:
| Лабораторные способы получения веществ | Промышленные способы получения веществ |
| Реагенты могут быть редкими и дорогими | Реагенты распространенные в природе и дешевые |
| Условия реакции мягкие, без высоких давлений и сильного нагревания | Условия реакции могут быть довольно жесткими, допустимы высокие давления и температуры |
| Как правило, реагенты — жидкости или твердые вещества | Реагенты — газы или жидкости, реже твердые вещества |
Получение алканов в лаборатории
Декарбоксилирование солей карбоновых кислот
Метан CН4 в лаборатории получают при сплавлении ацетата натрия CH3COONa с гидроксидом натрия NaOH:
CH3COONa + NaOH → CH4 + Na2CO3
Метан легче воздуха, поэтому его можно собирать методом вытеснения воздуха.
Синтез Вюрца
Взаимодействие галогеналканов с активным металлом (натрия) — это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Хлорэтан взаимодействует с натрием с образованием бутана:
Реакция больше подходит для получения симметричных алканов.
При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
Получение циклоалканов в лаборатории
В лаборатории циклоалканы получают действием активных металлов на дигалогеналканы, в которых между атомами галогенов находится три и более атомов углерода.
Например, 1,4-дибромбутан реагирует с цинком с образованием циклобутана
Таким образом можно синтезировать циклоалканы заданного строения, в том числе циклоалканы с малыми циклами (С3 и С4).
Получение алкенов в лаборатории
В лаборатории алкены получают нагреванием спиртов (выше 140оС) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота). Дегидратация — это отщепление молекул воды.
Например, при дегидратации этанола при высокой температуре образуется этилен.
Получение ацетилена в лаборатории
Ацетилен C2Н2 в лаборатории получают взаимодействием карбида кальция CaC2 с водой (гидролиз карбида кальция):
CaC2 + 2H2O → C2H2 + Ca(OH)2
Получение альдегидов в лаборатории
В лаборатории альдегиды получают окислением первичных спиртов. В качестве окислителей применяют оксид меди (II), пероксид водорода и другие окислители.
Например, при окислении этанола оксидом меди образуется уксусный альдегид
Получение карбоновых кислот в лаборатории
Получение кислот из солей
В лаборатории карбоновые кислоты можно получить из солей, действую на растворы их солей более сильными неорганическими кислотами.
Например, муравьиную кислоту можно получить, подействовав на формиат натрия раствором серной кислоты:
Окисление альдегидов
При окислении альдегидов также образуются карбоновые кислоты или их соли. Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота.
Например, при окислении альдегидов гидроксидом меди (II) также образуются карбоновые кислоты
Получение сложных эфиров в лаборатории
Сложные эфиры в лаборатории получают при взаимодействии карбоновых кислот с одноатомными и многоатомными спиртами (реакция этерификации).
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
Реакции, характеризующие основные способы получения кислородсодержащих соединений
1. Гидролиз галогеналканов. Вы уже знаете, что образование галокеналканов при взаимодействии спиртов с галогеноводородами — обратимая реакция. Поэтому понятно, что спирты могут быть получены при гидролизе галогеналканов — реакции этих соединений с водой:
$R-Cl+NaOH{→}↖{H_2O}R-OH+NaCl+H_2O$
Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих более одного атома галогена в молекуле. Например:
2. Гидратация алкенов — присоединение воды по $π$-связи молекулы алкена — уже знакома вам, например:
${CH_2=CH_2}↙{этен}+H_2O{→}↖{H^{+}}{C_2H_5OH}↙{этанол}$
Гидратация пропена приводит, в соответствии с правилом Марковникова, к образованию вторичного спирта — пропанола-2:
3. Гидрирование альдегидов и кетонов. Вы уже знаете, что окисление спиртов в мягких условиях приводит к образованию альдегидов или кетонов. Очевидно, что спирты могут быть получены при гидрировании (восстановлении водородом, присоединении водорода) альдегидов и кетонов:
4. Окисление алкенов. Гликоли, как уже отмечалось, могут быть получены при окислении алкенов водным раствором перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется при окислении этилена (этена):
$CH_2=CH_2+[O]+H_2O{→}↖{KMnO_4}HO-CH_2-CH_2-OH$
5. Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности получают при взаимодействии водорода с оксидом углерода (II) (угарным газом) при повышенном давлении и высокой температуре на поверхности катализатора (оксида цинка):
$CO+2H_2{→}↖{t,p,ZnO}CH_3-OH$
Необходимую для этой реакции смесь угарного газа и водорода, называемую также синтез-газом ($СО + nН_2О$), получают при пропускании паров воды над раскаленным углем:
$C+H_2O{→}↖{t}CO+H_2-Q$
6. Брожение глюкозы. Этот способ получения этилового (винного) спирта известен человеку с древнейших времен:
${C_6H{12}O_6}↙{глюкоза}{→}↖{дрожжи}2C_2H_5OH+2CO_2$
Способы получения альдегидов и кетонов
Альдегиды и кетоны могут быть получены окислением или дегидрированием спиртов. Еще раз отметим, что при окислении или дегидрировании первичных спиртов могут быть получены альдегиды, а вторичных спиртов — кетоны:
Реакция Кучерова. Из ацетилена в результате реакции гидратации получается уксусный альдегид, из гомологов ацетилена — кетоны:
При нагревании кальциевых или бариевых солей карбоновых кислот образуются кетон и карбонат металла:
Способы получения карбоновых кислот
Карбоновые кислоты могут быть получены окислением первичных спиртов альдегидов:
Ароматические карбоновые кислоты образуются при окислении гомологов бензола:
Гидролиз различных производных карбоновых кислот также приводит к получению кислот. Так, при гидролизе сложного эфира образуются спирт и карбоновая кислота. Как уже говорилось выше, реакции этерификации и гидролиза, катализируемые кислотой, обратимы:
Гидролиз сложного эфира под действием водного раствора щелочи протекает необратимо, в этом случае из сложного эфира образуется не кислота, а ее соль:

Подготовка к ЕГЭ начинается с
психологического настроя на успех, обязательную сдачу ЕГЭ.
Поэтому не
лишними будут помощь психолога, советы родителей и учителей.
Теория к ЕГЭ. Методика самостоятельной подготовки к ЕГЭ
ТЕОРИЯ ДЛЯ СДАЮЩИХ ЕГЭ
Дopoнькин ЕГЭ. Химия. Большой справочник
Adobe Acrobat Document
7.6 MB
РАСПЕЧАТАТЬ И ИСПОЛЬЗОВАТЬ
Методические рекомендации по подготовке
Adobe Acrobat Document
375.5 KB
ПРОРАБОТАТЬ И ПРИНЯТЬ К СВЕДЕНИЮ
анализ типичных ошибок ЕГЭ-2019 г.pdf
Adobe Acrobat Document
771.7 KB
ПРОГРАММА ПОДГОТОВКИ К ЕГЭ ПО ХИМИИ.doc
Microsoft Word Document
129.5 KB
ВНИМАНИЕ
Тривиальные названия органических вещест
Adobe Acrobat Document
340.1 KB
Теория и тест для самостоятельной проработки.
Основные способы получения металлов.pptx
Microsoft Power Point Presentation
920.7 KB
Все свойства органических веществ.
Реакции к основным темам курса 10 класса
Microsoft Word Document
158.0 KB
Общие формулы. УЧИТЬ!!!
Общие формулы классов органических вещес
Adobe Acrobat Document
188.4 KB
Металлы. Соединения металлов. УЧИТЬ!!!
Свойства металлов и их соединений.docx
Microsoft Word Document
2.5 MB
Цепочки превращений.
Задание С3. Цепочки превращений..docx
Microsoft Word Document
674.8 KB
Теория по основным классам неорганических соединений.
Основные классы и их свойства.doc
Microsoft Word Document
880.0 KB
Нужно разобраться и выучить.
Ряд активности металлов.pdf
Adobe Acrobat Document
315.0 KB

Документация и подготовка к ЕГЭ
таблица ПСХЭ.doc
Microsoft Word Document
396.5 KB
Таблица растворимости некоторых веществ
Microsoft Word Document
578.5 KB

Дополнительная информация, теория к ЕГЭ
Адреса сайтов подготовки.
Материалы для подготовки к ОГЭ и ЕГЭ.doc
Microsoft Word Document
15.2 KB
Таблица. Качественные признаки веществ.d
Microsoft Word Document
44.8 KB
Ряд ЭО. Названия кислот и остатков. Степ
Microsoft Word Document
518.7 KB
Таблица ПСХЭ . С обозначением классов со
Microsoft Word Document
498.4 KB
цвета оксидов.doc
Microsoft Word Document
24.0 KB
Номенклатура неорганических веществ.doc
Microsoft Word Document
135.5 KB
Определение ионов. Качественные реакции.
Microsoft Word Document
51.0 KB
Часть представленных здесь материалов взята с
сайта учителя химии Сикорской О.Э.