Установите правильную последовательность процессов, происходящих при свёртывании крови у человека. Запишите в таблицу соответствующую последовательность цифр.
1) образование тромба
2) взаимодействие тромбина с фибриногеном
3) разрушение тромбоцитов
4) повреждение стенки сосуда
5) образование фибрина
6) образование протромбина
Спрятать пояснение
Пояснение.
Последовательность процессов, происходящих при свёртывании крови у человека: повреждение стенки сосуда → разрушение тромбоцитов → образование протромбина → взаимодействие тромбина с фибриногеном → образование фибрина → образование тромба.
Ответ: 436251.
Примечание.
Свертывание крови – это защитный механизм, предотвращающий потерю крови при ранениях кровеносных сосудов. Процесс свертывания заключается в последовательной цепи биохимических превращений белков плазмы. По современным представлениям существует не менее 12 веществ-факторов свертывания.
Основная последовательность процессов свертывания следующая:
тромбоциты разрушаются при контакте с неровными краями раны сосуда, и при этом из разрушившихся клеток выделяется активный фермент тромбопластин
тромбопластин взаимодействует с неактивным белком плазмы протромбином, и последний переходит в активное состояние — фермент тромбин
тромбин действует на растворимый белок плазмы фибриноген и переводит его в нерастворимый белок фибрин
фибрин выпадает в виде белых тонких нитей, которые натягиваются в области раны в виде сеточки
в нитях фибрина оседают эритроциты, лейкоциты, формируется полужидкий кровяной сгусток
нити фибрина сокращаются, отжимают жидкую часть из сгустка, и формируется тромб.
На всех этапах свертывания крови обязательно должны присутствовать ионы кальция и витамин К. Время свертывания крови у человека составляет 5—12 минут. Недостаток какого-либо фактора свертывания приводит к снижению свертывания.
———-
Формулировка вопроса некорректна. Протромбин (профермент, неактивная форма тромбина) постоянно синтезируется в печени и постоянно присутствует в плазме, а НЕ образуется при свертывании крови. В задании целесообразно заменить «6) образование протромбина» на «6) активация протромбина» или на «6) образование тромбина», поскольку при повреждении кровеносных сосудов запускаются процессы, приводящие к превращению постоянно присутствующего в крови протромбина в активную форму — тромбин (фермент), который превращает растворимый фибриноген в нерастворимый фибрин.
Из предыдущих статей вы уже знаете состав крови и строение сердца. Очевидно, что все функции кровь выполняет только благодаря своей постоянной циркуляции, которая осуществляется благодаря работе сердца. Работа сердца напоминает насос, который нагнетает кровь в сосуды, по которым кровь течет к внутренним органам и тканям.

Кровеносная система состоит из большого и малого (легочного) кругов кровообращения, которые мы подробно обсудим.
Описал их Уильям Гарвей, английский врач, в 1628 году.

Большой круг кровообращения (БКК)
Этот круг кровообращения служит для доставки кислорода и питательных веществ ко всем органам. Он начинается выходящей из
левого желудочка аортой — самым крупным сосудом, которая последовательно разветвляется на артерии, артериолы и капилляры.
Открыл БКК и понял значение кругов кровообращения известный английский ученый, врач Уильям Гарвей.
Стенка капилляров однослойна, поэтому через нее происходит газообмен с окружающими тканями, которые к тому же через нее получают питательные вещества. В тканях происходит дыхание, в ходе которого окисляются белки, жиры, углеводы. В результате в клетках
образуется углекислый газ и продукты обмена веществ (мочевина), которые также выделяются в капилляры.
Венозная кровь по венулам собирается в вены, возвращаясь в сердце через самые крупные — верхнюю и нижнюю полые вены, которые
впадают в правое предсердие. Таким образом, БКК начинается в левом желудочке и заканчивается в правом предсердии.
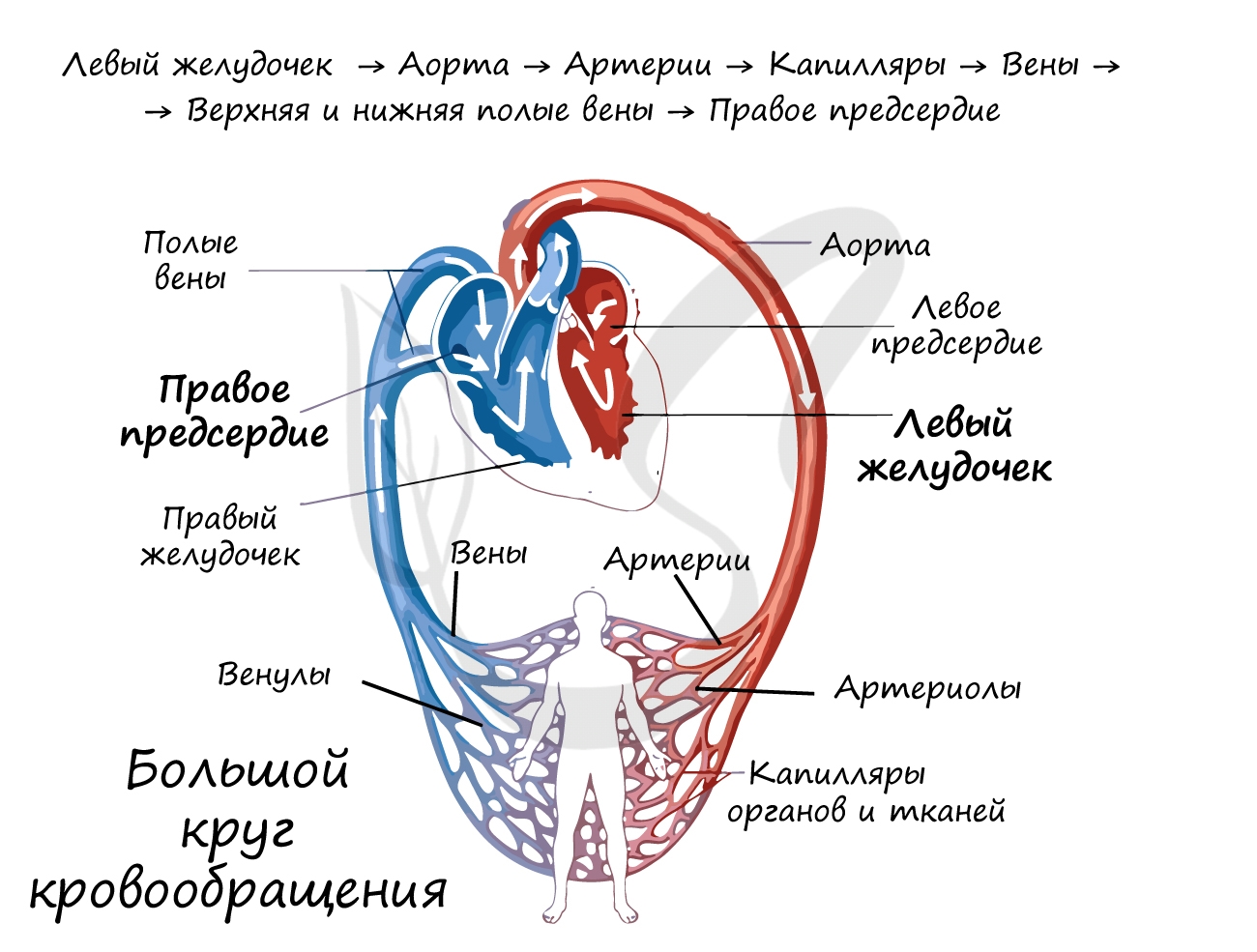
Кровь проходит БКК за 23-27 секунд. По артериям БКК течет артериальная кровь, а по венам — венозная. Главная функция этого
круга кровообращения — обеспечить кислородом и питательными веществами все органы и ткани организма. В сосудах БКК высокое
артериальное давление (относительно малого круга кровообращения).
Малый круг кровообращения (легочный)
Напомню, что БКК заканчивается в правом предсердии, которое содержит венозную кровь. Малый круг кровообращения (МКК) начинается
в следующей камере сердца — правом желудочке. Отсюда венозная кровь поступает в легочный ствол, который делится на две легочные артерии.
Правая и левая легочные артерии с венозной кровью направляются к соответствующим легким, где разветвляются до капилляров,
оплетающих альвеолы. В капиллярах происходит газообмен, в результате которого кислород поступает в кровь и соединяется с гемоглобином, а углекислый газ диффундирует в альвеолярный воздух.
Обогащенная кислородом артериальная кровь собирается в венулы, которые затем сливаются в легочные вены. Легочные
вены с артериальной кровью впадают в левое предсердие, где заканчивается МКК. Из левого предсердия кровь поступает
в левый желудочек — место начала БКК. Таким образом два круга кровообращения замыкаются.
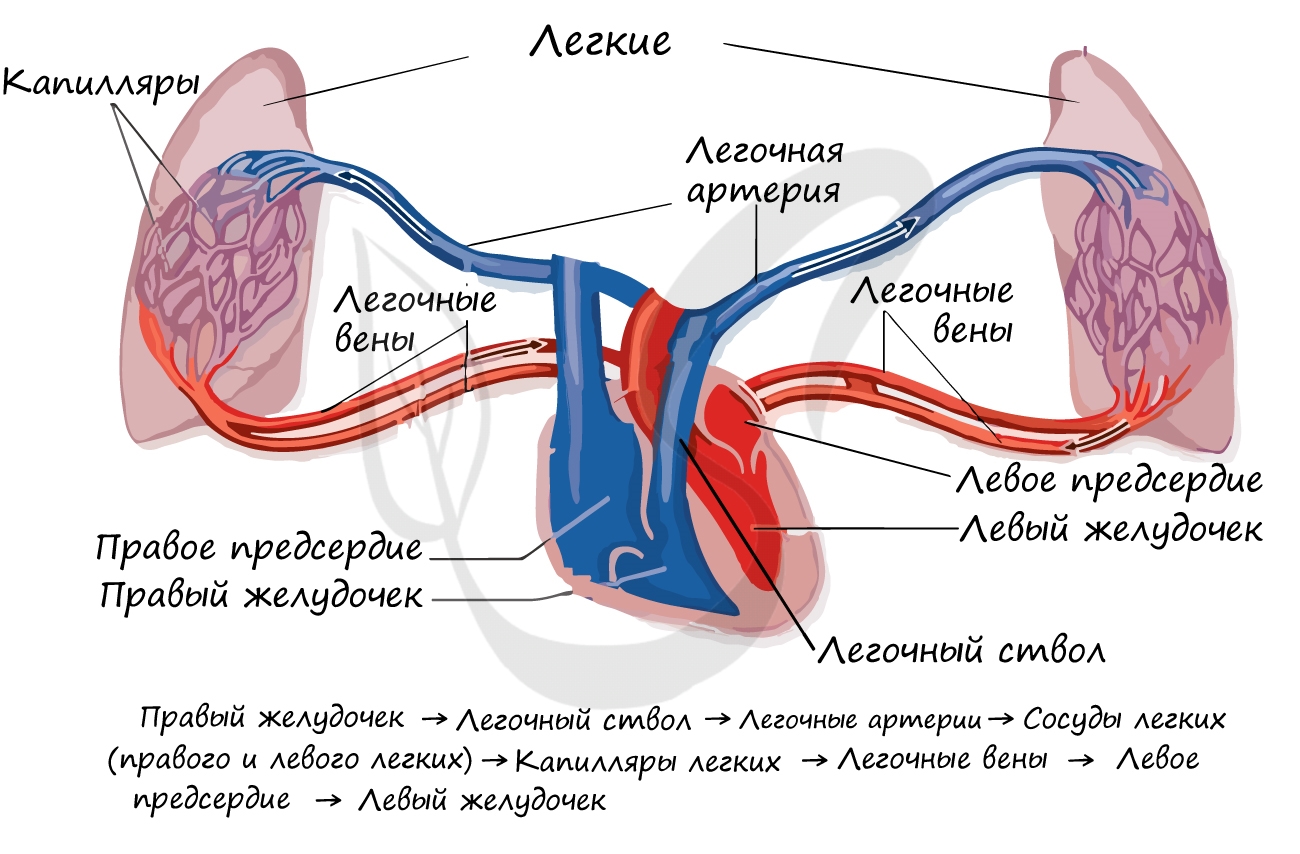
МКК кровь проходит за 4-5 секунд. Основная его функция состоит в насыщении кислородом венозной крови, в результате чего она становится артериальной, богатой кислородом. Как вы заметили, по артериям в МКК течет венозная, а по венам — артериальная кровь. Артериальное давление
здесь ниже, чем БКК.
Интересные факты
В среднем за каждую минуту сердце человека перекачивает около 5 литров, за 70 лет жизни — 220 млн. литров крови. За один день сердце человека совершает примерно 100 тысяч ударов, за всю жизнь — 2,5 млрд. ударов.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Свёртывание крови
Статья профессионального репетитора по биологии Т. М. Кулаковой
Свёртывание крови является важной защитной реакцией организма, препятствующей кровопотере и способствующей сохранению постоянства объёма циркулирующей крови.
Процесс свёртывания крови складывается из ряда последовательных процессов:
1. При повреждении кровеносных сосудов происходит выделение веществ из разрушенных тромбоцитов и повреждённых клеток.
2. Происходит рефлекторное сужение сосуда, возникающее под влиянием веществ, освобождающимися из тромбоцитов. Сужение кровеносного сосуда приводит лишь к временной остановке или уменьшению кровотечения.
3. Из разрушенных тромбоцитов и повреждённых клеток высвобождаются ферменты, вещество тромбопластин, катализирующие превращение растворённого в плазме протромбина в тромбин. Эти реакции происходят в присутствии солей Ca и витамина К.
4. Тромбин взаимодействует с фибриногеном (растворимый белок, находящийся в плазме) с образованием фибрина – нерастворимого белка.

Высыхая, такой сгусток, уплотняется и стягивает края раны, этим способствуя заживлению. При уплотнении сгустка из него выделяется желтоватая жидкость – сыворотка. Кровяная сыворотка – это плазма крови, не содержащая белок фибриноген.
В процессе свёртывания крови, в образовании тромбопластина принимают участие белки плазмы крови. Если тромбопластин отсутствует совсем или содержится в ничтожно малом количестве, то у человека возникает болезнь – гемофилия. При таком заболевании даже маленькая ранка становится смертельно опасной.
Подготовка к ЕГЭ по биологии и поступлению в медицинский вуз.
Благодарим за то, что пользуйтесь нашими материалами.
Информация на странице «Свёртывание крови» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
09.03.2023
Свертывание крови — крайне сложный и во многом еще загадочный биохимический процесс, который запускается при повреждении кровеносной системы и ведет к превращению плазмы крови в студенистый сгусток, затыкающий рану и останавливающий кровотечение. Нарушения этой системы крайне опасны и могут привести к кровотечению, тромбозу или другим патологиям, которые совместно отвечают за львиную долю смертности и инвалидности в современном мире. Здесь мы рассмотрим устройство этой системы и расскажем о самых современных достижениях в ее изучении.
Каждый, кто хоть раз в жизни получал царапину или рану, приобретал тем самым замечательную возможность наблюдать превращение крови из жидкости в вязкую нетекучую массу, приводящее к остановке кровотечения. Этот процесс называется свертыванием крови и управляется сложной системой биохимических реакций.
Иметь какую-нибудь систему остановки кровотечения — абсолютно необходимо для любого многоклеточного организма, имеющего жидкую внутреннюю среду. Свертывание крови является жизненно необходимым и для нас: мутации в генах основных белков свертывания, как правило, летальны. Увы, среди множества систем нашего организма, нарушения в работе которых представляют опасность для здоровья, свертывание крови также занимает абсолютное первое место как главная непосредственная причина смерти: люди болеют разными болезнями, но умирают почти всегда от нарушений свертывания крови. Рак, сепсис, травма, атеросклероз, инфаркт, инсульт — для широчайшего круга заболеваний непосредственной причиной смерти является неспособность системы свертывания поддерживать баланс между жидким и твердым состояниями крови в организме.
Если причина известна, почему же с ней нельзя бороться? Разумеется, бороться можно и нужно: ученые постоянно создают новые методы диагностики и терапии нарушений свертывания. Но проблема в том, что система свертывания очень сложна. А наука о регуляции сложных систем учит, что управлять такими системами нужно особым образом. Их реакция на внешнее воздействие нелинейна и непредсказуема, и для того, чтобы добиться нужного результата, нужно знать, куда приложить усилие. Простейшая аналогия: чтобы запустить в воздух бумажный самолетик, его достаточно бросить в нужную сторону; в то же время для взлета авиалайнера потребуется нажать в кабине пилота на правильные кнопки в нужное время и в нужной последовательности. А если попытаться авиалайнер запустить броском, как бумажный самолетик, то это закончится плохо. Так и с системой свертывания: чтобы успешно лечить, нужно знать «управляющие точки».
Вплоть до самого последнего времени свертывание крови успешно сопротивлялось попыткам исследователей понять его работу, и лишь в последние годы тут произошел качественный скачок. В данной статье мы расскажем об этой замечательной системе: как она устроена, почему ее так сложно изучать, и — самое главное — поведаем о последних открытиях в понимании того, как она работает.
Как устроено свертывание крови
Остановка кровотечения основана на той же идее, что используют домохозяйки для приготовления холодца — превращении жидкости в гель (коллоидную систему, где формируется сеть молекул, способная удержать в своих ячейках тысячекратно превосходящую ее по весу жидкость за счет водородных связей с молекулами воды). Кстати, та же идея используется в одноразовых детских подгузниках, в которые помещается разбухающий при смачивании материал. С физической точки зрения, там нужно решать ту же самую задачу, что и в свертывании — борьбу с протечками при минимальном приложении усилий.
Свертывание крови является центральным звеном гемостаза (остановки кровотечения). Вторым звеном гемостаза являются особые клетки — тромбоциты, — способные прикрепляться друг к другу и к месту повреждения, чтобы создать останавливающую кровь пробку.
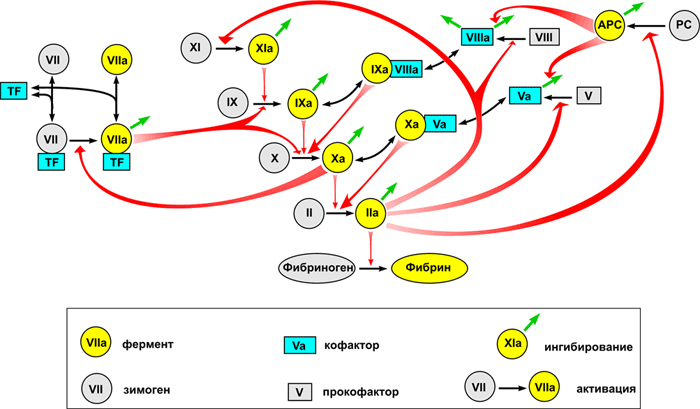
Общее представление о биохимии свертывания можно получить из рисунка 1, внизу которого показана реакция превращения растворимого белка фибриногена в фибрин, который затем полимеризуется в сетку. Эта реакция представляет собой единственную часть каскада, имеющую непосредственный физический смысл и решающую четкую физическую задачу. Роль остальных реакций — исключительно регуляторная: обеспечить превращение фибриногена в фибрин только в нужном месте и в нужное время.
Рисунок 1. Основные реакции свертывания крови. Система свертывания представляет собой каскад — последовательность реакций, где продукт каждой реакции выступает катализатором следующей. Главный «вход» в этот каскад находится в его средней части, на уровне факторов IX и X: белок тканевый фактор (обозначен на схеме как TF) связывает фактор VIIa, и получившийся ферментативный комплекс активирует факторы IX и X. Результатом работы каскада является белок фибрин, способный полимеризоваться и образовывать сгусток (гель). Подавляющее большинство реакций активации — это реакции протеолиза, т.е. частичного расщепления белка, увеличивающего его активность. Почти каждый фактор свертывания обязательно тем или иным образом ингибируется: обратная связь необходима для стабильной работы системы.
Обозначения: Реакции превращения факторов свертывания в активные формы показаны односторонними тонкими черными стрелками. При этом фигурные красные стрелки показывают, под действием каких именно ферментов происходит активация. Реакции потери активности в результате ингибирования показаны тонкими зелеными стрелками (для простоты стрелки изображены как просто «уход», т.е. не показано, с какими именно ингибиторами происходит связывание). Обратимые реакции формирования комплексов показаны двусторонними тонкими черными стрелками. Белки свертывания обозначены либо названиями, либо римскими цифрами, либо аббревиатурами (TF — тканевый фактор, PC — протеин С, APC — активированный протеин С). Чтобы избежать перегруженности, на схеме не показаны: связывание тромбина с тромбомодулином, активация и секреция тромбоцитов, контактная активация свертывания.
[1], рисунок адаптирован
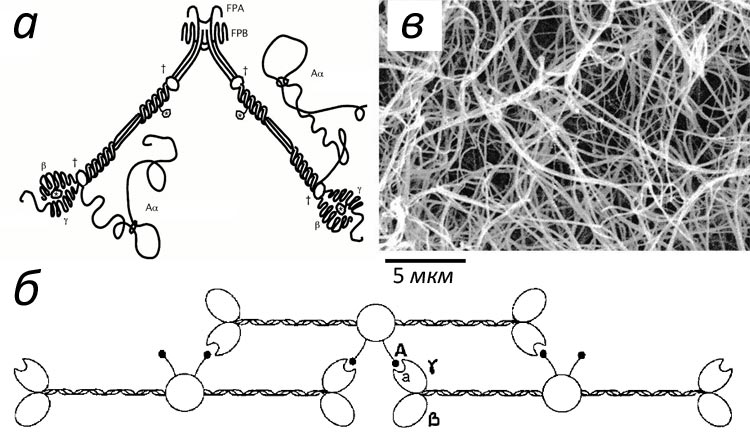
Фибриноген напоминает стержень длиной 50 нм и толщиной 5 нм (рис. 2а). Активация позволяет его молекулам склеиваться в фибриновую нить (рис 2б), а затем в волокно, способное ветвиться и образовывать трехмерную сеть (рис. 2в).
Рисунок 2. Фибриновый гель. а — Схематическое устройство молекулы фибриногена. Основа ее составлена из трех пар зеркально расположенных полипептидных цепей α, β, γ. В центре молекулы можно видеть области связывания, которые становятся доступными при отрезании тромбином фибринопептидов А и Б (FPA и FPB на рисунке). б — Механизм сборки фибринового волокна: молекулы крепятся друг к другу «внахлест» по принципу головка-к-серединке, образуя двухцепочечное волокно. в — Электронная микрофотография геля: фибриновые волокна могут склеиваться и расщепляться, образуя сложную трехмерную структуру.
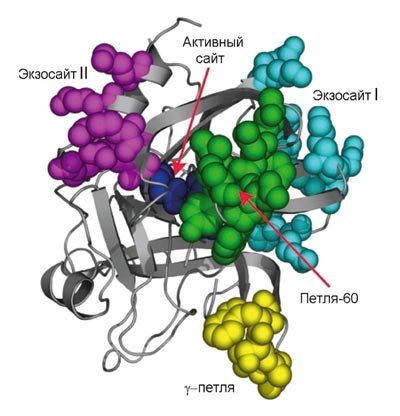
Рисунок 3. Трехмерная структура молекулы тромбина. На схеме показаны активный сайт и части молекулы, ответственные за связывание тромбина с субстратами и кофакторами. (Активный сайт — часть молекулы, непосредственно распознающее место расщепления и осуществляющее ферментативный катализ.) Выступающие части молекулы (экзосайты) позволяют осуществлять «переключение» молекулы тромбина, делая его мультифункциональным белком, способным работать в разных режимах. Например, связывание тромбомодулина с экзосайтом I физически перекрывает доступ к тромбину прокоагулянтным субстратам (фибриноген, фактор V) и аллостерически стимулирует активность по отношению к протеину C.
Активатор фибриногена тромбин (рис. 3) принадлежит к семейству сериновых протеиназ — ферментов, способных осуществлять расщепление пептидных связей в белках. Он является родственником пищеварительных ферментов трипсина и химотрипсина. Протеиназы синтезируются в неактивной форме, называемой зимогеном. Чтобы их активировать, необходимо расщепить пептидную связь, удерживающую часть белка, которая закрывает активный сайт. Так, тромбин синтезируется в виде протромбина, который может быть активирован. Как видно из рис. 1 (где протромбин обозначен как фактор II), это катализируется фактором Xa.
Вообще, белки свертывания называют факторами и нумеруют римскими цифрами в порядке официального открытия. Индекс «а» означает активную форму, а его отсутствие — неактивный предшественник. Для давно открытых белков, таких как фибрин и тромбин, используют и собственные имена. Некоторые номера (III, IV, VI) по историческим причинам не используются.
Активатором свертывания служит белок, называемый тканевым фактором, присутствующий в мембранах клеток всех тканей, за исключением эндотелия и крови. Таким образом, кровь остается жидкой только благодаря тому, что в норме она защищена тонкой защитной оболочкой эндотелия. При любом нарушении целостности сосуда тканевой фактор связывает из плазмы фактор VIIa, а их комплекс — называемый внешней теназой (tenase, или Xase, от слова ten — десять, т.е. номер активируемого фактора) — активирует фактор X.
Тромбин также активирует факторы V, VIII, XI, что ведет к ускорению его собственного производства: фактор XIa активирует фактор IX, а факторы VIIIa и Va связывают факторы IXa и Xa, соответственно, увеличивая их активность на порядки (комплекс факторов IXa и VIIIa называется внутренней теназой). Дефицит этих белков ведет к тяжелым нарушениям: так, отсутствие факторов VIII, IX или XI вызывает тяжелейшую болезнь гемофилию (знаменитую «царскую болезнь», которой болел царевич Алексей Романов); а дефицит факторов X, VII, V или протромбина несовместим с жизнью.
Такое устройство системы называется положительной обратной связью: тромбин активирует белки, которые ускоряют его собственное производство. И здесь возникает интересный вопрос, а зачем они нужны? Почему нельзя сразу сделать реакцию быстрой, почему природа делает ее исходно медленной, а потом придумывает способ ее дополнительного ускорения? Зачем в системе свертывания дублирование? Например, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа); это выглядит совершенно бессмысленным.
В крови также присутствуют ингибиторы протеиназ свертывания. Основными являются антитромбин III и ингибитор пути тканевого фактора. Кроме этого, тромбин способен активировать сериновую протеиназу протеин С, которая расщепляет факторы свертывания Va и VIIIa, заставляя их полностью терять свою активность.
Протеин С — предшественник сериновой протеиназы, очень похожей на факторы IX, X, VII и протромбин. Он активируется тромбином, как и фактор XI. Однако при активации получившаяся сериновая протеиназа использует свою ферментативную активность не для того, чтобы активировать другие белки, а для того, чтобы их инактивировать. Активированный протеин С производит несколько протеолитических расщеплений в факторах свертывания Va и VIIIa, заставляя их полностью терять свою кофакторную активность. Таким образом, тромбин — продукт каскада свертывания — ингибирует свое собственное производство: это называется отрицательной обратной связью. И опять у нас регуляторный вопрос: зачем тромбин одновременно ускоряет и замедляет собственную активацию?
Подводя итог, система свертывания изучена очень хорошо. В ней уже пятнадцать лет не открывали новых белков или реакций, что для современной биохимии составляет вечность. Конечно, нельзя совсем исключить вероятность такого открытия, но пока что не существует ни одного явления, которое мы не могли бы объяснить при помощи имеющихся сведений. Скорее наоборот, система выглядит гораздо сложнее, чем нужно: мы напомним, что из всего этого (довольно громоздкого!) каскада собственно желированием занимается только одна реакция, а все остальные нужны для какой-то непонятной регуляции.
Именно поэтому сейчас исследователи-коагулологи, работающие в самых разных областях — от клинической гемостазиологии до математической биофизики, — активно переходят от вопроса «Как устроено свертывание?» к вопросам «Почему свертывание устроено именно так?», «Как оно работает?» и, наконец, «Как нам нужно воздействовать на свертывание, чтобы добиться желаемого эффекта?». Первое, что необходимо сделать для ответа — научиться исследовать свертывание целиком, а не только отдельные реакции.
Как исследовать свертывание?
Для изучения свертывания создаются различные модели — экспериментальные и математические. Что именно они позволяют получить?
С одной стороны, кажется, что самым лучшим приближением для изучения объекта является сам объект. В данном случае — человек или животное. Это позволяет учитывать все факторы, включая ток крови по сосудам, взаимодействия со стенками сосудов и многое другое. Однако в этом случае сложность задачи превосходит разумные границы. Модели свертывания позволяют упростить объект исследования, не упуская его существенных особенностей.
Попытаемся составить представление о том, каким требованиям должны отвечать эти модели, чтобы корректно отражать процесс свертывания in vivo.
В экспериментальной модели должны присутствовать те же биохимические реакции, что и в организме. Должны присутствовать не только белки системы свертывания, но и прочие участники процесса свертывания — клетки крови, эндотелия и субэндотелия. Система должна учитывать пространственную неоднородность свертывания in vivo: активацию от поврежденного участка эндотелия, распространение активных факторов, присутствие тока крови.
Рассмотрение моделей свертывания естественно начать с методов исследования свертывания in vivo. Основа практически всех используемых подходов такого рода заключается в нанесении подопытному животному контролируемого повреждения с тем, чтобы вызвать гемостатическую или тромботическую реакцию. Данная реакция исследуется различными методами:
- наблюдение за временем кровотечения;
- анализ плазмы, взятой у животного;
- вскрытие умерщвленного животного и гистологическое исследование;
- наблюдение за тромбом в реальном времени с использованием микроскопии или ядерного магнитного резонанса (рис. 4).
Рисунок 4. Формирование тромба in vivo в модели тромбоза, индуцированного лазером. Эта картинка воспроизведена из исторической работы, где ученые впервые смогли пронаблюдать развитие тромба «вживую». Для этого в кровь мыши впрыснули концентрат флуоресцентно меченных антител к белкам свертывания и тромбоцитам, и, поместив животное под объектив конфокального микроскопа (позволяющего осуществлять трехмерное сканирование), выбрали доступную для оптического наблюдения артериолу под кожей и повредили эндотелий лазером. Антитела начали присоединяться к растущему тромбу, сделав возможным его наблюдение.
Классическая постановка эксперимента по свертыванию in vitro заключается в том, что плазма крови (или цельная кровь) смешивается в некоторой емкости с активатором, после чего производится наблюдение за процессом свертывания. По методу наблюдения экспериментальные методики можно разделить на следующие типы:
- наблюдение за самим процессом свертывания;
- наблюдение за изменением концентраций факторов свертывания от времени.
Второй подход дает несравненно больше информации. Теоретически, зная концентрации всех факторов в произвольный момент времени, можно получить полную информацию о системе. На практике исследование даже двух белков одновременно дорого и связано с большими техническими трудностями.
Наконец, свертывание в организме протекает неоднородно. Формирование сгустка запускается на поврежденной стенке, распространяется с участием активированных тромбоцитов в объеме плазмы, останавливается с помощью эндотелия сосудов. Адекватно изучить эти процессы с помощью классических методов невозможно. Вторым важным фактором является наличие потока крови в сосудах.
Осознание этих проблем привело к появлению, начиная с 1970-х годов, разнообразных проточных экспериментальных систем in vitro. Несколько больше времени потребовалось на осознание пространственных аспектов проблемы. Только в 1990-е годы стали появляться методы, учитывающие пространственную неоднородность и диффузию факторов свертывания, и только в последнее десятилетие они стали активно использоваться в научных лабораториях (рис. 5).
Рисунок 5. Пространственный рост фибринового сгустка в норме и патологии. Свертывание в тонком слое плазмы крови активировалось иммобилизованным на стенке тканевым фактором. На фотографиях активатор расположен слева. Серая расширяющаяся полоса — растущий фибриновый сгусток.
Наряду с экспериментальными подходами для исследований гемостаза и тромбоза также используются математические модели (этот метод исследований часто называется in silico [8]). Математическое моделирование в биологии позволяет устанавливать глубокие и сложные взаимосвязи между биологической теорией и опытом. Проведение эксперимента имеет определенные границы и сопряжено с рядом трудностей. Кроме того, некоторые теоретически возможные эксперименты неосуществимы или запредельно дороги вследствие ограничений экспериментальной техники. Моделирование упрощает проведение экспериментов, так как можно заранее подобрать необходимые условия для экспериментов in vitro и in vivo, при которых интересующий эффект будет наблюдаем.
Регуляция системы свертывания
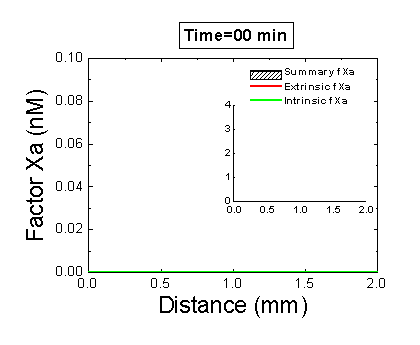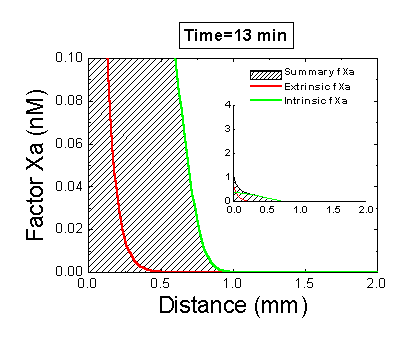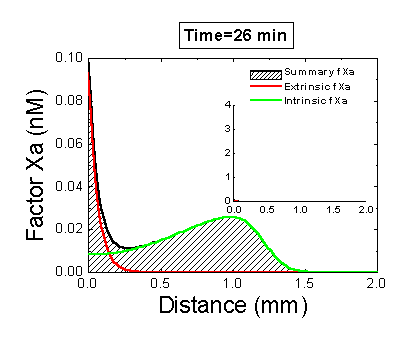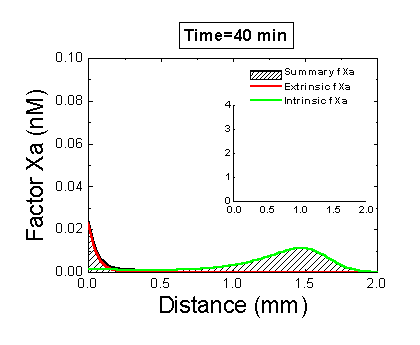
Рисунок 6. Вклад внешней и внутренней теназы в формирование фибринового сгустка в пространстве. Мы использовали математическую модель, чтобы исследовать, как далеко может простираться влияние активатора свертывания (тканевого фактора) в пространстве. Для этого мы посчитали распределение фактора Xa (который определяет распределение тромбина, который определяет распределение фибрина). На анимации показаны распределения фактора Xa, произведенного внешней теназой (комплексом VIIa–TF) или внутренней теназой (комплексом IXa–VIIIa), а также общее количество фактора Xa (заштрихованная область). (Вставка показывает то же самое на более крупной шкале концентраций.) Можно видеть, что произведенный на активаторе фактор Xa не может проникнуть далеко от активатора из-за высокой скорости ингибирования в плазме. Напротив, комплекс IXa–VIIIa работает вдали от активатора (т.к. фактор IXa медленнее ингибируется и потому имеет большее расстояние эффективной диффузии от активатора), и обеспечивает распространение фактора Xa в пространстве.
Сделаем следующий логический шаг и попробуем ответить на вопрос — а как описанная выше система работает?
Каскадное устройство системы свертывания
Начнем с каскада — цепочки активирующих друг друга ферментов. Один фермент, работающий с постоянной скоростью, дает линейную зависимость концентрации продукта от времени. У каскада из N ферментов эта зависимость будет иметь вид tN, где t — время. Для эффективной работы системы важно, чтобы ответ носил именно такой, «взрывной» характер, поскольку это сводит к минимуму тот период, когда сгусток фибрина еще непрочен.
Запуск свертывания и роль положительных обратных связей
Как упоминалось в первой части статьи, многие реакции свертывания медленны. Так, факторы IXa и Xa сами по себе являются очень плохими ферментами и для эффективного функционирования нуждаются в кофакторах (факторах VIIIa и Va, соответственно). Эти кофакторы активируются тромбином: такое устройство, когда фермент активирует собственное производство, называется петлей положительной обратной связи.
Как было показано нами экспериментально и теоретически, положительная обратная связь активации фактора V тромбином формирует порог по активации — свойство системы не реагировать на малую активацию, но быстро срабатывать при появлении большой. Подобное умение переключаться представляется весьма ценным для свертывания: это позволяет предотвратить «ложное срабатывание» системы.
Роль внутреннего пути в пространственной динамике свертывания
Одной из интригующих загадок, преследовавших биохимиков на протяжении многих лет после открытия основных белков свертывания, была роль фактора XII в гемостазе. Его дефицит обнаруживался в простейших тестах свертывания, увеличивая время, необходимое для образования сгустка, однако, в отличие от дефицита фактора XI, не сопровождался нарушениями свертывания.
Один из наиболее правдоподобных вариантов разгадки роли внутреннего пути был предложен нами с помощью пространственно неоднородных экспериментальных систем. Было обнаружено, что положительные обратные связи имеют большое значение именно для распространения свертывания. Эффективная активация фактора X внешней теназой на активаторе не поможет сформировать сгусток вдали от активатора, так как фактор Xa быстро ингибируется в плазме и не может далеко отойти от активатора. Зато фактор IXa, который ингибируется на порядок медленнее, вполне на это способен (и ему помогает фактор VIIIa, который активируется тромбином). А там, куда сложно дойти и ему, начинает работать фактор XI, также активируемый тромбином. Таким образом, наличие петель положительных обратных связей помогает создать трехмерную структуру сгустка.
Путь протеина С как возможный механизм локализации тромбообразования
Активация протеина С тромбином сама по себе медленна, но резко ускоряется при связывании тромбина с трансмембранным белком тромбомодулином, синтезируемым клетками эндотелия. Активированный протеин С способен разрушать факторы Va и VIIIa, на порядки замедляя работу системы свертывания. Ключом к пониманию роли данной реакции стали пространственно-неоднородные экспериментальные подходы. Наши эксперименты позволили предположить, что она останавливает пространственный рост тромба, ограничивая его размер.
Подведение итогов
В последние годы сложность системы свертывания постепенно становится менее загадочной. Открытие всех существенных компонентов системы, разработка математических моделей и использование новых экспериментальных подходов позволили приоткрыть завесу тайны. Структура каскада свертывания расшифровывается, и сейчас, как мы видели выше, практически для каждой существенной части системы выявлена или предложена роль, которую она играет в регуляции всего процесса.
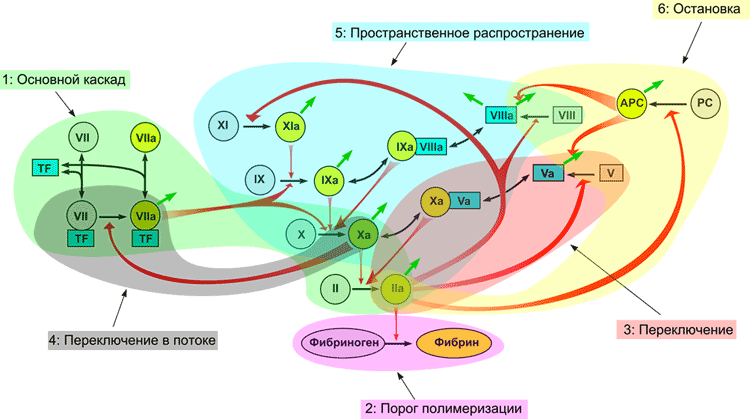
На рисунке 7 представлена наиболее современная попытка пересмотреть структуру системы свертывания. Это та же схема, что и на рис. 1, где разноцветным затенением выделены части системы, отвечающие за разные задачи, как обсуждалось выше. Не все в этой схеме является надежно установленным. Например, наше теоретическое предсказание, что активация фактора VII фактором Xa позволяет свертыванию пороговым образом отвечать на скорость потока, остается пока еще непроверенным в эксперименте.
Рисунок 7. Модульная структура системы свертывания: роль отдельных реакций свертывания в функционировании системы.
Вполне возможно, что эта картина еще не вполне полна. Тем не менее, прогресс в этой области в последние годы вселяет надежду, что в обозримом будущем оставшиеся неразгаданные участки на схеме свертывания обретут осмысленную физиологическую функцию. И тогда можно будет говорить о рождении новой концепции свертывания крови, пришедшей на смену старинной каскадной модели, которая верно служила медицине на протяжении многих десятилетий.
Статья написана при участии А.Н. Баландиной и Ф.И. Атауллаханова и была в первоначальном варианте опубликована в «Природе» [10].
- Mikhail A. Panteleev, Anna N. Balandina, Elena N. Lipets, Mikhail V. Ovanesov, Fazoil I. Ataullakhanov. (2010). Task-Oriented Modular Decomposition of Biological Networks: Trigger Mechanism in Blood Coagulation. Biophysical Journal. 98, 1751-1761;
- Cristina Fuss, Julio C. Palmaz, Eugene A. Sprague. (2001). Fibrinogen: Structure, Function, and Surface Interactions. Journal of Vascular and Interventional Radiology. 12, 677-682;
- Pratt K.P., Côté H.C., Chung D.W., Stenkamp R.E., Davie E.W. (1997). The primary fibrin polymerization pocket: three-dimensional structure of a 30-kDa C-terminal gamma chain fragment complexed with the peptide Gly-Pro-Arg-Pro. Proc. Natl. Acad. Sci. U.S.A. 94, 7176–7181;
- Joseph D. Mills, Robert A.S. Ariëns, Michael W. Mansfield, Peter J. Grant. (2002). Altered Fibrin Clot Structure in the Healthy Relatives of Patients With Premature Coronary Artery Disease. Circulation. 106, 1938-1942;
- Crawley J.T., Zanardelli S., Chion C.K., Lane D.A. (2007). The central role of thrombin in hemostasis. J. Thromb. Haemost. 5 Suppl 1, 95–101;
- Russell F. Doolittle, Yong Jiang, Justin Nand. (2008). Genomic Evidence for a Simpler Clotting Scheme in Jawless Vertebrates. J Mol Evol. 66, 185-196;
- Shahrokh Falati, Peter Gross, Glenn Merrill-Skoloff, Barbara C. Furie, Bruce Furie. (2002). Real-time in vivo imaging of platelets, tissue factor and fibrin during arterial thrombus formation in the mouse. Nat Med. 8, 1175-1180;
- In vivo — in vitro — in silico;
- Mikhail A. Panteleev, Mikhail V. Ovanesov, Dmitrii A. Kireev, Aleksei M. Shibeko, Elena I. Sinauridze, et. al.. (2006). Spatial Propagation and Localization of Blood Coagulation Are Regulated by Intrinsic and Protein C Pathways, Respectively. Biophysical Journal. 90, 1489-1500;
- Баландина А.Н., Пантелеев М.А., Атауллаханов Ф.И. (2011). Система свертывания крови и ее регуляция. «Природа». 3, 32–38.
Разработки уроков (конспекты уроков)
Среднее общее образование
Биология
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
КРОВЕНОСНАЯ СИСТЕМА
Задание 14 № 10808
Установите последовательность движения крови по большому кругу кровообращения.
1) левый желудочек
2) капилляры
3) правое предсердие
4) артерии
5) вены
6) аорта
Пояснение.
Из левого желудочка кровь попадает в аорту, проходит по артериям, в капиллярах происходит обмен газами, и возвращается по венам в правое предсердие. Путь большого круга кровообращения.
Ответ: 164253.
Задание 14 № 10811
Установите в какой последовательности надо расположить кровеносные сосуды в порядке уменьшения в них кровяного давления.
1) вены
2) аорта
3) артерии
4) капилляры
Пояснение.
Наибольшее давление крови на выходе крови из сердца в левом желудочке, несколько меньшее давление в артериях, ещё более низкое в капиллярах, самое низкое в венах и на входе сердца в правом предсердии.
Давление крови в аорте 120. В артериях различают у взрослых здоровых людей максимальное (систолическое) давление — равное 110−120 мм рт. ст. , а минимальное (диастолическое) — 70−80 мм рт. ст. В артериолах колебания давлений исчезает и оно составляет 40−70 мм рт. ст. В капиллярах давление крови резко падает: в артериальном конце капилляра оно равняется 35 мм рт. ст, в венозном — 8−15 мм рт. ст. Затем давление крови в сосудах постепенно уменьшается и в полых венах приближается к 0 или к 2−3 мм рт. ст.
Ответ: 2341.
Задание 14 № 19091
Установите правильную последовательность процессов, происходящих при свёртывании крови у человека.
1) образование тромба
2) взаимодействие тромбина с фибриногеном
3) повреждение стенки сосуда
4) образование фибрина
5) образование протромбина
Пояснение.
Последовательность процессов, происходящих при свёртывании крови у человека: повреждение стенки сосуда → образование протромбина → взаимодействие тромбина с фибриногеном → образование фибрина → образование тромба.
Ответ: 35241.
Задание 14 № 10806
Установите, в какой последовательности в организме человека кровь передвигается по большому кругу кровообращения
1) вены большого круга
2) артерии головы, рук и туловища
3) аорта
4) капилляры большого круга
5) левый желудочек
6) правое предсердие
Пояснение.
Из левого желудочка кровь по аорте поступает ко всем органам и возвращается в правое предсердие.
Ответ: 532416.
Задание 14 № 10807
Установите, в какой последовательности в организме человека кровь проходит малый круг кровообращения.
1) левое предсердие
2) легочные капилляры
3) легочные вены
4) легочные артерии
5) правый желудочек
Пояснение.
Из правого желудочка кровь идет по легочной артерии в легкие, в легочных капиллярах происходит обмен газами, по легочным венам кровь возвращается в левое предсердие.
Ответ: 54231.
Задание 14 № 18447
Установите, в какой последовательности надо расположить кровеносные сосуды в порядке увеличения скорости движения в них крови
А) воротная вена печени
Б) подвздошная артерия
В) аорта
Г) капилляры
Пояснение.
Кровеносные сосуды в порядке увеличения скорости движения в них крови: капилляры → воротная вена печени → подвздошная артерия → аорта.
Ответ: ГАБВ.
Примечание.
Чем больше общая площадь сечения сосудов, тем меньше скорость движения крови, самая большая площадь сечения в капиллярах, поэтому скорость в них меньше. Наименьшим просветом обладает аорта, в связи с чем скорость движения крови здесь наибольшая — 50−70 см/сек. В средних артериях она равна 20−40 см/сек, в артериолах — 0,5 см/сек. Наибольшей суммарной площадью просвета обладают капилляры (у человека она примерно в 800 раз больше, чем просвет аорты). Скорость движения крови в капиллярах — 0,05 см/сек. Очень низкая скорость движения крови по капиллярам — один из важнейших механизмов, позволяющих протекать обменным процессам между кровью и тканями. По мере приближения вен к сердцу их суммарный просвет уменьшается, следовательно, постепенно растет скорость движения крови. В полой вене скорость равна 20 см/сек.
Задание 14 № 21779
Установите правильную последовательность прохождения по кругам кровообращения лекарственного препарата, введённого в вену левой руки. Запишите в таблицу соответствующую последовательность цифр.
1) вена левого предплечья
2) левое предсердие
3) левый желудочек
4) правый желудочек
5) лёгочный ствол
6) лёгочные вены
Пояснение.
Последовательность прохождения по кругам кровообращения лекарственного препарата, введённого в вену левой руки: вена левого предплечья → правый желудочек → лёгочный ствол → лёгочные вены → левое предсердие → левый желудочек.
Ответ: 145623.
Задание 14 № 21504
Установите правильную последовательность прохождения порции крови из правого желудочка до правого предсердия. Запишите в таблицу соответствующую последовательность цифр.
1) лёгочная вена
2) левый желудочек
3) лёгочная артерия
4) правый желудочек
5) правое предсердие
6) аорта
Пояснение.
Последовательность процессов прохождения порции крови из правого желудочка до правого предсердия: правый желудочек → лёгочная артерия → лёгочная вена → левый желудочек → аорта → правое предсердие.
Ответ: 431265.
Примечание.
Часть сосудов не указана, распределять нужно только предлагаемые компоненты.
Задание 14 № 22269
Установите правильную последовательность процессов, происходящих при свёртывании крови у человека. Запишите в таблицу соответствующую последовательность цифр.
1) образование тромба
2) взаимодействие тромбина с фибриногеном
3) разрушение тромбоцитов
4) повреждение стенки сосуда
5) образование фибрина
6) образование протромбина
Пояснение.
Последовательность процессов, происходящих при свёртывании крови у человека: повреждение стенки сосуда → разрушение тромбоцитов → образование протромбина → взаимодействие тромбина с фибриногеном → образование фибрина → образование тромба.
Ответ: 436251.
Примечание.
Свертывание крови – это защитный механизм, предотвращающий потерю крови при ранениях кровеносных сосудов. Процесс свертывания заключается в последовательной цепи биохимических превращений белков плазмы. По современным представлениям существует не менее 12 веществ-факторов свертывания.
Основная последовательность процессов свертывания следующая:
тромбоциты разрушаются при контакте с неровными краями раны сосуда, и при этом из разрушившихся клеток выделяется активный фермент тромбопластин
тромбопластин взаимодействует с неактивным белком плазмы протромбином, и последний переходит в активное состояние — фермент тромбин
тромбин действует на растворимый белок плазмы фибриноген и переводит его в нерастворимый белок фибрин
фибрин выпадает в виде белых тонких нитей, которые натягиваются в области раны в виде сеточки
в нитях фибрина оседают эритроциты, лейкоциты, формируется полужидкий кровяной сгусток
нити фибрина сокращаются, отжимают жидкую часть из сгустка, и формируется тромб.
На всех этапах свертывания крови обязательно должны присутствовать ионы кальция и витамин К. Время свертывания крови у человека составляет 5–12 минут. Недостаток какого-либо фактора свертывания приводит к снижению свертывания.
Гемостаз — это сложная биологическая система, которая обеспечивает сохранение жидкого состояния крови в обычных условиях, а при нарушении целостности сосудистого русла останавливает кровотечение.
По современным представлениям, в остановке кровотечения задействовано два механизма1:
1.
Физиология человека. Под ред. Покровского В.М., Коротько Г.Ф. 2-е изд., перераб. и доп. — М.: 2003.
1) первичный гемостаз (сосудисто-тромбоцитарный), в котором принимают участие стенки сосудов, тромбоциты и отчасти эритроциты;
2) вторичный гемостаз, когда в процесс свертывания крови включаются белки плазмы крови (плазменные факторы свертывания крови).
Следует отметить, что деление гемостаза на клеточные и плазменные является условным, так как в организме эти два звена свертывающей системы крови тесно связаны.
Итак, при повреждении стенки кровеносного сосуда события следуют одно за другим таким образом1:
- кровеносный сосуд сокращается;
- в месте повреждения изменяются свойства сосудистой стенки: она становится липкой;
- тромбоциты в большом количестве начинают прилипать к внутренней стенке сосуда, набухая и образуя все более крупные агрегаты (происходит агрегация тромбоцитов, или их склеивание друг с другом);
- этап сосудисто-тромбоцитарного гемостаза заканчивается формированием рыхлого тромбоцитарного тромба, и начинается вторичный гемостаз, или собственно свертывание крови;
- в процессе свертывания крови, подобно принципу домино, запускается каскад реакций, в результате которых растворенный в плазме белок фибриноген превращается в нерастворимый фибрин, формирующий подобие тонкой сетки;
- сеть фибрина захватывает находящиеся рядом лейкоциты и эритроциты, уплотняя сгусток крови. В результате свертывания сгусток крови становится красным и плотным.
Рисунок 1. Процесс свертывания крови
Таким образом, следует разграничивать понятия «гемостаз» (остановка кровотечения) и «свертывание крови» (формирование плотного тромба). Свертывание крови — это, безусловно, самый важный и, без сомнения, наиболее сложный механизм гемостаза1.
Врачи могут управлять временем свертывания крови при помощи специальных лекарственных препаратов — антикоагулянтов.
- Главная
- Анализы
- Справочник по анализам
- Анализы крови
- Система гемостаза
Система гемостаза
Алексеев Андрей Викторович
Врач клинической лабораторной диагностики,
Система свертывания крови — гемостаз
В дословном переводе с латыни гемостаз означает остановку кровотечения (гема – кровь, стаз – остановка, стабилизация, застой). В основе гемостаза лежит деятельность трех систем, среди которых:
Свертывающая (коагуляционная) – ответственная за остановку кровотечения путем формирования тромба.
- Противосвертывающая (антикоагуляционная) – препятствует формированию тромба
- Фибринолитическая – растворяет уже сформировавшийся тромб.
Именно благодаря гармоничной и сбалансированной деятельности этих трех систем кровь в наших сосудах постоянно циркулирует в жидком состоянии, выполняет возложенные на нее функции по транспорту газов и питательных веществ, и при этом не сворачивается в сосудистом русле. Но как только кровеносный сосуд повреждается, на месте этого повреждения через некоторое время формируется кровяной сгусток, тромб, закупоривающий сосудистый просвет и препятствующий дальнейшему кровоизлиянию.
Свертывание крови
Свертывание крови – это сложный многоступенчатый процесс, который эволюционировал у позвоночных, млекопитающих и человека в течение миллионов лет. В механизме свертывания крови принимают участие следующие структуры:
- Эпителиальная внутренняя выстилка сосудов (эндотелий)
- Гладкие мышцы, регулирующие сосудистый тонус
- Форменные элементы крови – тромбоциты, эритроциты
- Биологически активнее вещества – т.н. факторы свертывания крови
- Ионы Кальция (Са).
Виды гемостаза
Следует различать тромбоцитарный гемостаз и коагуляционный гемостаз. Свертывание крови осуществляется в две фазы и первая, – это сосудисто-тромбоцитарный гемостаз. Между тромбоцитарным и коагуляционным гемостазом нет строгой очередности. На определенном этапе эти два процесса могут идти синхронно. Уже на этапе повреждения сосудистой стенки активируется тромбопластин. Это липопротеид (белково-жировой комплекс), присутствующий в клеточной мембране большинства тканевых структур. Почитать более подробно о тромбоцитарном и коагуляционном гемостазе, а также заказать анализы, Вы можете на соответствующих страницах нашего сайта.




 Свертывающая (коагуляционная) – ответственная за остановку кровотечения путем формирования тромба.
Свертывающая (коагуляционная) – ответственная за остановку кровотечения путем формирования тромба.