Темы кодификатора. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии.
Правила работы в лаборатории
Техника безопасности при работе в химической лаборатории. При работе в лаборатории необходимо строго соблюдать правила и инструкции техники безопасности.
1. В химической лаборатории можно работать только в халате. Халат должен быть застегнут на все пуговицы. Длинные волосы необходимо подбирать (убрать в пучок или иным способом).
2. На рабочем столе могут находиться только те вещи, которые необходимы для выполнения работы. На рабочем месте необходимо поддерживать чистоту и порядок.
3. Перед выполнением работы необходимо познакомиться с описанием работы, последовательностью действий, которые необходимо выполнять во время работы. При работе с приборами и установками необходимо изучить их устройство и правила работы с ними.
4. Категорически запрещено работать в лаборатории одному, так как при несчастном случае никто не сможет оказать помощь пострадавшему, вызвать помощь, ликвидировать последствия аварии и т.д.
5. В лаборатории категорически запрещается курить, принимать пищу и воду. Также в лаборатории запрещено хранить продукты питания.
6. Помещение обязательно должно быть оборудовано противопожарным оборудованием (средства пожаротушения: огнетушители в рабочем состоянии и др.). Все работники лаборатории должны знать, где находятся средства пожаротушения, а также аптечка.
7. Неизрасходованные реактивы нельзя высыпать и выливать обратно в те сосуды, откуда они были взяты.
8. При работе в лаборатории необходимо соблюдать чистоту и аккуратность. Вещества не должны попадать на кожу лица и рук, так как многие вещества вызывают раздражение кожи и слизистых оболочек.
9. Необходимо использовать только целую и чистую лабораторную посуду. После завершения работы необходимо помыть лабораторную посуду.
10. После окончания работы необходимо выключить газ, воду, электроэнергию.
11. При нагревании растворов и веществ в пробирке необходимо использовать держатель. Во время нагревания жидких и твердых веществ в пробирках и колбах нельзя направлять отверстия сосудов на себя и соседей. Может произойти внезапный выброс вещества.
12. Вещества в лаборатории категорически запрещается пробовать на вкус.
13. Чтобы определить запах вещества, необходимо осторожно направить на себя пары вещества или газы легким движением руки — от сосуда с веществом к лицу. Нельзя наклоняться к сосуду и нельзя вдыхать пары полной грудью.
14. Твердые химические реактивы можно брать только шпателем, пинцетом или ложечкой (ни в коем случае не руками!).
15. Жидкости категорически запрещается набирать в пипетки ртом. Для набора жидкости в пипетку используется специальная груша. Жидкие химические вещества следует переливать, обязательно пользуясь воронкой.
16. При появлении любых вопросов необходимо обращаться к преподавателю.
Лабораторная посуда и оборудование
| Оборудование | Название оборудования | Назначение |
 |
Делительная воронка | Для разделения несмешивающихся жидкостей |
 |
Бюретка | Для отбора точных объёмов жидкостей |
| Пипетка Мора | Для отбора точных объёмов жидкостей | |
 |
Мерный цилиндр | Для отбора точных объёмов жидкостей |
 |
Воронка химическая | Для фильтрования растворов |
 |
Колба двугорлая | Для проведения химических синтезов |
 |
Колба трехгорлая | Для проведения химических синтезов |
 |
Колба Вюрца | Для проведения химических синтезов |
 |
Бюкс | Для хранения веществ |
 |
Пробирка | Для проведения химических опытов |
 |
Химический стакан | Для приготовления и отбора порции растворов |
 |
Колба плоскодонная | Для приготовления растворов с заданной концентрацией |
 |
Колба коническая | Для проведения химических опытов |
 |
Колба круглодонная | Для проведения химических опытов |
 |
Штатив | Для проведения химических опытов |
 |
Шпатель химический | Отбор твердых веществ |
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
К ядовитым веществам относятся:
1. Вещества, раздражающие слизистые оболочки и действующие на кожные покровы: щелочи, кислота, газообразный аммиак, оксиды азота, оксиды серы (VI) и (IV).
2. Вещества, которые воздействуют на нервную систему, например, аммиак, сероводород, бензол и др.
3. Вещества, поражающие кровь и органы: оксид углерода (II), соединения свинца и др.
К горючим веществам относятся бензин, ацетон, метиловый и этиловый спирты, толуол и др.
К едким веществам относятся концентрированные кислоты и щелочи, концентрированные растворы некоторых солей и др.
При работе с горючими, едкими и токсичными веществами необходимо соблюдать следующие правила безопасности:
1. Категорически запрещается сливать в раковину легковоспламеняющиеся и горючие жидкости, концентрированные растворы кислот и щелочей. Их необходимо собирать в специальные герметические сосуды.
2. Работу с кислотами, твердыми щелочами, едкими и токсичными веществами проводить только в защитных очках и перчатках. При растворении твердых щелочей в воде необходимо добавлять щелочь небольшими порциями в воду, избегая перегревания раствора. Разбавление кислот или щелочей необходимо производить в жаростойкой посуде.
3. Кислота в воду или вода в кислоту? При разбавлении концентрированных кислот и щелочей необходимо небольшими порциями приливать кислоту (или концентрированный раствор щелочи) в воду, а не наоборот. Растворение кислот и щелочей в воде сопровождается выделением большого количества теплоты. Небольшая порция воды может нагреться при добавлении в кислоту, смесь закипит и может попасть на лицо или руки. Поэтому необходимо добавлять небольшое количество кислоты в большое количество воды.
4. При разливе легковоспламеняющейся или горючей жидкости необходимо отключить все электроприборы и погасить газовые горелки. Место разлива засыпают песком, который затем удаляют с помощью лопатки. Запрещено использовать металлические совки, т.к. они могут дать искру и вызвать пожар.
5. Кислоту, пролитую на пол, нейтрализуют содой, а щелочь нейтрализуют борной кислотой. Для удаления нейтрализованных жидкостей также используют песок. Нейтрализацию и уборку концентрированных кислот необходимо проводить в противогазе.
6. При ожоге кислотой необходимо немедленно промыть пораженное место большим количеством воды. После чего промыть место поражения двухпроцентным раствором соды.
7. При ожоге щелочью необходимо длительное промывание пораженного места под струей воды, затем однопроцентным раствором борной кислоты или уксусной кислоты.
8. При ожоге глаз кислотой или щелочью необходимо немедленно промыть глаза водой длительное время.
9. Работы с токсичными, легковоспламеняющимися или горючими веществами необходимо проводить строго под включенной вытяжкой.
10. Легковоспламеняющиеся и горючие жидкости запрещено нагревать на открытом пламени.
11. Запрещено сливать горючие, едкие и токсичные вещества в канализацию. Для их утилизации и слива используют специальные емкости.
12. Работа с плавиковой кислотой требует особой осторожности и проводится обязательно в вытяжном шкафу. Хранить плавиковую кислоту необходимо в полиэтиленовой таре (угадайте, почему).
13. Щелочные и щелочноземельные металлы необходимо хранить в сосуде, не пропускающем ультрафиолет, под слоем керосина или другого инертного по отношению к этим металлам вещества. При работе с этими металлами необходимо соблюдать осторожность, избегать контакта этих металлов с водой. Запрещается трогать щелочные или щелочноземельные металлы руками. Небольшие остатки таких металлов запрещается выкидывать в канализацию или мусорное ведро. Их необходимо «погасить» этанолом или другим веществом (но не водой!).
При работе со средствами бытовой химии также необходимо соблюдать определенные правила:
1. В обязательном порядке пользуйтесь перчатками при работе с агрессивными средствами бытовой химии. Если вы работаете с хлорсодержащими препаратами, рекомендуется надеть специальные защитные очки из пластика.
2. Не забывайте тщательно удалять остатки чистящих или моющих средств после каждой уборки. Многие порошки состоят из мелких частиц, которые оставаться на поверхностях и вещах. При испарении такие химикаты выделяют ряд вредных веществ.
3. Хранить средства бытовой химии следует в герметично закрытых ёмкостях вдали от источников тепла и прямого солнечного света.
4. Все средства бытовой химии следует применять только по прямому назначению, строго соблюдая инструкции и рекомендации по их использованию.
- Правила работы в лаборатории.
- Лабораторная посуда и оборудование.
- Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии.
- Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ.
Правила работы в лаборатории
•Работать одному в лаборатории категорически запрещается, так как в ситуации несчастного случая некому будет оказать помощь пострадавшему и ликвидировать последствия аварии.
•Во время работы в лаборатории необходимо соблюдать чистоту, тишину, порядок и правила техники безопасности, так как поспешность и небрежность часто приводят к несчастным случаям с тяжелыми последствиями.
•Каждый работающий должен знать, где находятся в лаборатории средства противопожарной защиты и аптечка, содержащая все необходимое для оказания первой помощи.
•Категорически запрещается в лаборатории курить, принимать пищу, пить воду.
•Нельзя приступать к работе, пока учащиеся не усвоят всей техники ее выполнения.
•Опыты нужно проводить только в чистой химической посуде. После окончания эксперимента посуду сразу же следует мыть.
•В процессе работы необходимо соблюдать чистоту и аккуратность, следить, чтобы вещества не попадали на кожу лица и рук, так как многие вещества вызывают раздражение кожи и слизистых оболочек.
•Никакие вещества в лаборатории нельзя пробовать на вкус. Нюхать вещества можно, лишь осторожно направляя на себя пары или газы легким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
•На любой посуде, где хранятся реактивы, должны быть этикетки с указанием названия веществ.
•Сосуды с веществами или растворами необходимо брать одной рукой за горлышко, а другой снизу поддерживать за дно.
•Категорически запрещается затягивать ртом в пипетки органически вещества и их растворы.
•Во время нагревания жидких и твердых веществ в пробирках и колбах нельзя направлять их отверстия на себя и соседей. Нельзя также заглядывать сверху в открыто нагреваемые сосуды во избежание возможного поражения при выбросе горячей массы.
•После окончания работы необходимо выключить газ, воду, электроэнергию.
•Категорически запрещается выливать в раковины концентрированные растворы кислот и щелочей, а также различные органические растворители, сильно пахнущие и огнеопасные вещества. Все эти отходы нужно сливать в специальные бутыли.
•В каждой лаборатории обязательно должны быть защитные маски, очки.
•В каждом помещении лаборатории необходимо иметь средства противопожарной защиты: ящик с просеянным песком и совком для него, противопожарное одеяло (асбестовое или толстое войлочное), заряженные огнетушители.
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
•Для ускорения растворения твёрдых веществ в пробирке нельзя закрывать её отверстие пальцем при встряхивании.
•Растворение щелочи следует производить в фарфоровой посуде путём прибавления к воде небольших порций вещества, при непрерывном перемешивании.
•При определении запаха вещества нельзя наклоняться над ним, вдыхать пары или выделяющийся газ. Нужно лёгким движением руки над горлом сосуда направить пар или газ к носу и вдыхать осторожно.
•Пролитую кислоту или щёлочь следует засыпать чистым сухим песком и перемешивать его до полного впитывания всей жидкости. Влажный песок убрать совком в широкий стеклянный сосуд для последующей промывки и нейтрализации.
•Растворы из реактивных склянок необходимо наливать так, чтобы при наклоне этикетка оказывалась сверху (этикетка — в ладонь). При попадании на кожу растворов щелочей или кислот необходимо смыть их после встряхивания видимых капель сильной струёй холодной воды, а затем обработать нейтрализующим раствором (2% раствором уксусной кислоты или 2% раствором гидрокарбоната натрия) и ополоснуть водой.
Методы разделения смесей и очистки веществ. Чистые вещества и смеси
веществ
Смесь — материал, состоящий из двух или нескольких веществ, хаотично чередующихся друг с другом в пространстве.
Чистое вещество — физически и химически однородный материал, обладающий определенным комплексом постоянных свойств. Содержание примесей в препаратах особой чистоты измеряется миллионными и миллиардными долями процента.
Смеси
|
|
| Однородные (гомогенные) | Неоднородные (гетерогенные) |
| Однородными называют такие смеси, частицы в которых нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне | Неоднородными называют смеси, в которых частицы можно обнаружить либо визуально, либо с помощью оптических приборов. Причём эти вещества находятся в разных агрегатных состояниях (фазах) |
| Примеры смесей | |
| Истинные растворы (поваренная соль + вода, раствор спирта в воде) | Суспензии (твёрдое + жидкость), например вода + песок |
| Твёрдые растворы, сплавы, например,латунь, бронза. | Эмульсии (жидкость + жидкость), например вода + жир |
| Газовые растворы (смеси любых количеств и любого числа газов) | Аэрозоли (газ + жидкость), например туман |
Способы разделения смесей
|
|
| Однородные (гомогенные) | Неоднородные (гетерогенные) |
| Дистилляция (вода-поваренная соль) | Фильтрование (вода-песок) |
| Кристаллизация (вода-сахар) | Отстаивание (вода-мел) |
| Выпаривание (вода-поваренная соль) | Центрифугирование (вода-мел) |
| Перегонка (нефть) | Магнитная сепарация (железо-медь) |
Отстаивание – это способ, основанный на различной плотности веществ.
Например, смесь растительного масла и воды можно разделить на масло и воду, дав смеси просто отстояться.
Фильтрование – это способ, основанный на различной способности фильтра пропускать вещества, из которых состоит смесь. Например, с помощь фильтра можно отделить твердые примеси от жидкости.
Выпаривание – это выделение нелетучих твердых веществ из раствора в летучем растворителе – в частности в воде. Например, чтобы выделить соль, растворенную в воде, надо просто выпарить воду. Вода испарится, а соль останется.
Существует целый ряд нормативных актов и документов, в которых прописаны правила поведения в химической лаборатории, особенности работы с едкими и токсичными веществами.
Школьная химическая лаборатория оборудована самым простым оборудованием и наиболее безопасными реактивами, поэтому в качестве основных и самых необходимых правил поведения можно выделить следующие.
- Работать в лаборатории необходимо в специальной одежде (халате), а при проведении опытов с особо опасными веществами использовать респиратор, защитные очки, перчатки. Волосы должны быть убраны.
- В лаборатории следует вести себя аккуратно, не бегать, не размахивать руками. На лабораторном столе во время работы не должно быть посторонних предметов.
- Работать нужно аккуратно, результат опыта зависит от чистоты проведения эксперимента.
- Строго запрещается принимать в лаборатории пищу и напитки. После проведения опытов необходимо тщательно вымыть руки. Запрещается пробовать вещества на вкус.
- Все опыты с ядовитыми и пахучими веществами выполнять в вытяжном шкафу.
- Химические реактивы брать только шпателем, пинцетом или ложечкой (не руками!).
- Неизрасходованные реактивы не высыпать и не выливать обратно в те сосуды, откуда они были взяты.
- Опасные продукты реакции сливать только в соответствующие банки в вытяжном шкафу.
9. Жидкости переливать через химические воронки. Склянку, из которой переливают жидкость, необходимо держать этикеткой к руке во избежание ее порчи.
10. При нагревании растворов и веществ в пробирке необходимо использовать держатель. Отверстие пробирки должно быть направлено в сторону от себя и других работающих.
11. Нельзя наклоняться над сосудом, в котором происходит нагревание или кипячение жидкости.
12. При необходимости определить запах выделяющихся при реакции газов нужно легким движением ладони направить струю газа от горлышка сосуда к себе и осторожно вдохнуть.
При разбавлении концентрированных кислот и щелочей небольшими порциями приливать кислоту (или концентрированный раствор щелочи) в воду, а не наоборот.
Химические приборы и посуда
Химическое оборудование можно разделить на две большие группы: крупногабаритное оборудование (как правило, для физико-химических методов анализа) и малогабаритное (применяемое и часто используемое в химической лаборатории).
К наиболее часто используемому лабораторному оборудованию можно отнести:
Весы. Самый необходимый инструмент химика. Необходим для приготовления навесок и растворов заданной концентрации. В большинстве лабораторий используют электронные весы, так как их точность позволяет определять массу вещества с точностью до тысячных долей грамма.
Магнитная мешалка.
Используется практически ежедневно в «мокрой химии», то есть при работе с растворами. Служит для равномерного перемешивания реакционной смеси, особенно в течение длительного времени и для растворения труднорастворимых веществ. В некоторых моделях есть функция нагревания.
Водяная баня. Незаменима при работе с растворами.
Колба или любой другой подходящий сосуд помещаются в емкость с водой, которая расположена на плитке и постоянно нагревается. Температура нагревания может достигать
(температуры кипения воды). Поэтому если синтез требует более высоких температур используют более высококипящие жидкости с большой теплопроводностью, например, масло. Следует отметить, что колба, помещаемая в баню, должна быть круглодонной, иначе велика вероятность повреждения дна.
Штатив лабораторный. Необходим для закрепления колб, воронок, пробирок и других емкостей. Используется при нагревании веществ, фильтровании, синтезе и выпаривании. На штатив можно закрепить с помощью муфты различные приспособления для фиксирования посуды — кольцо, лапки.
Горелка спиртовая. Используется для нагревания на открытом пламени. Не рекомендуется использовать при работе с легковоспламеняющимися и горючими жидкостями.
Ротационный испаритель.
Применяется для очистки и осушки веществ. Снабжен вращающейся колбой. Увеличивает область испарения за счет пленки жидкости, образующейся на внутренней поверхности вращающейся испарительной колбы, что увеличивает интенсивность испарения вдвое. Вращение одновременно устраняет вспенивание испаряемой жидкости.
Центрифуга.
Используется для разделения нескольких жидкостей или отделения твердого продукта от жидкого под действием центробежной силы. Основным рабочим элементом данного оборудования является барабан, который содержит несколько отверстий для пробирок. Количество таких отверстий, их размеры и диаметры могут быть различными. Кроме этого, лабораторные центрифуги имеют крышку, которая плотно закрывает барабан и имеет, как правило, закрепляющий винт. Работа данного оборудования обеспечивается за счет действия мотора, расположенного в основании центрифуги.
Эксикатор.
Полезен при хранении токсичных или «влаголюбивых» веществ. Состоит из плотно пригнанной притертой крышки, обеспечивающей вкупе со смазкой практически герметичное закрывание (?). На дно эксикатора обычно помещают поглотитель влаги, например, концентрированную серную кислоты или оксид фосфора (V).
Реактивы
Вещества, используемые в лаборатории, называют реактивами.
Каждая емкость с реактивом должна быть снабжена этикеткой, на которой написана формула вещества или его название. При этом желательно указывать степень чистоты реагента или квалификацию вещества.
Квалификация вещества указывается, как правило, на реактивах советского или российского производства. В мировой практике такое понятие, как «квалификация вещества», не встречается, на емкости с реактивом указывается лишь степень чистоты вещества в процентах и процентное содержание примесей.
Современная российская квалификация веществ (степень чистоты вещества) базируется на принятой в СССР — по содержанию основного компонента).
|
Квалификация |
Сокращение (написано на этикетке) |
Содержание основного компонента |
|
технический |
т. |
<95 % |
|
очищенные |
очищ. |
<95 % |
|
чистый |
ч. |
>98 % |
|
чистый для анализа |
ч.д.а. |
99 % |
|
химически чистый |
х.ч. |
99,9 % |
|
особой чистоты |
ос.ч. или о.х.ч |
>99,9 % |
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Правила работы в лаборатории. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии.
ДОКУМЕНТЫ, РЕГЛАМЕНТИРУЮЩИЕ РАБОТУ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
1. СанПиН 2.4.2.2821-10 «Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях»;
2. ПНД Ф 12.13.1-03 «Методические рекомендации. Техника безопасности при работе в аналитических лабораториях (общие положения)»;
3. Правила техники безопасности для кабинетов (лабораторий) химии общеобразовательных школ Министерства просвещения СССР, введенные в действие приказом Минпроса СССР от 10.07.1987 № 127 (Сборник приказов и инструкций Министерства просвещения РСФСР, 1987, № 35, с. 2-32);
4. Федеральный закон 08.01.1998 № 3-ФЗ (ред. от 25.11.2013, с изм. от 04.06.2014) «О наркотических средствах и психотропных веществах» (с изм. и доп., вступающими в силу с 25.05.2014).
ОБЩИЕ ТРЕБОВАНИЯ К УЧАЩИМСЯ В ЛАБОРАТОРИИ И КАБИНЕТЕ ХИМИИ.
1. Работать в лаборатории необходимо в специальной одежде (халате), а при проведении опытов с особо опасными веществами использовать респиратор, защитные очки, перчатки. Волосы должны быть убраны.
СОБЛЮДЕНИЕ НАСТОЯЩИХ ТРЕБОВАНИЙ ОБЯЗАТЕЛЬНО ДЛЯ ВСЕХ УЧАЩИХСЯ, РАБОТАЮЩИХ В КАБИНЕТЕ ХИМИИ.
1. Учащиеся могут находиться в кабинете только в присутствии учителя.
2. Пребывание учащихся в помещении лаборантской запрещается.
3. Присутствие посторонних лиц в кабинете химии во время эксперимента допускается только с разрешения учителя.
4. Не допускается нахождение учащихся в кабинете химии во время его проветривания.
5. Учащимся запрещается бегать по кабинету, шуметь и устраивать игры.
6. Перед работой необходимо внимательно выслушать инструктаж учителя!!!
7. В кабинете химии запрещается принимать пищу и напитки.
8. Учащимся запрещается бегать самостоятельно проводить опыты, не предусмотренные в работе.
9. Запрещается самостоятельно устранять неполадки в оборудовании!!!
10. По окончании практической работы учащиеся должны помыть руки с мылом.
ОБЩИЕ ТРЕБОВАНИЯ К РАБОТЕ С ВЕЩЕСТВАМИ И РЕАКТИВАМИ.
1. Помни: щелочь и кислота вмиг прожгут одежду и кожу. Будь внимателен с ними!!!
2. Наливать и насыпать вещества нужно только над столом.
3. Наливать и насыпать вещества можно через воронку, кончик воронки должен касаться стенки пробирки.
4. Твердые сыпучие реактивы запрещено брать руками.
Их измельчение производится с помощью пестика в ступке.
5. Химические вещества НЕЛЬЗЯ пробовать на вкус!!!
6. При определении запаха запрещается наклоняться над пробиркой.
Нужно легкими движениями руки направить пар или газ к носу и осторожно вдыхать.
7. При разбавлении концентрированных кислот и щелочей небольшими порциями приливать кислоту (или концентрированный раствор щелочи) в воду, а не наоборот.
8. При встряхивании пробирки ее отверстие нельзя закрывать пальцем
9. Перед нагреванием заполнять пробирку жидкостью более чем на 1/3 часть. Необходимо начинать со слабого нагревания сосуда. Пробирку нагревайте сначала всю, а только затем ту часть, где находится вещество.
10. Отверстие пробирки при нагревании направлять на себя и других
11. В ходе нагревания заглядывать в сосуд и наклоняться над ним.
12. Запрещается вносить в кабинет и выносить из кабинета вещества и оборудование.
13. Запрещается излишек реактива ссыпать (выливать) обратно в банку (склянку).
14. Запрещается выливать в канализацию отработанные растворы. Остатки собираются в специально предназначенную посуду.
ОБЩИЕ ТРЕБОВАНИЯ К РАБОТЕ С НАГРЕВАТЕЛЬНЫМИ ЭЛЕМЕНТАМИ
1. Гасите спиртовку только накрывая пламя колпачком или крышкой
2. Запрещается зажигать одну спиртовку от другой
3. Запрещается передавать зажженную спиртовку
4. Запрещается оставлять без присмотра нагревательные приборы!!!
ОКАЗАНИЕ ПЕРВОЙ МЕДИЦИНСКОЙ ПОМОЩИ В КАБИНЕТЕ ХИМИИ.
Во всех случаях после оказания первой медицинской помощи необходимо обратиться в медицинское учреждение!!!
ПОПАДАНИЕ НА КОЖУ ЕДКИХ РАСТВОРОВ
1. Стряхнуть видимые капли раствора
2. Смыть остальное широкой струей воды.
3. При ожоге кислотой раствор ожог обрабатывается 2% раствором питьевой соды, при ожоге щелочью — 2% раствором борной или уксусной кислоты.
4. При любом ожоге запрещается пользоваться жирами для обработки обожженного участка и красящими веществами (йодная настойка, бриллиантовая зелень).
5. Место ожога необходимо обработать этиловым спиртом и наложить сухую стерильную повязку.
6. Обратиться в медицинское учреждение
ПОРЕЗЫ
1. Необходимо остановить кровотечение.
2. Кожу вокруг раны обеззараживают йодной настойкой.
3. Закрывают рану стерильной салфеткой и перебинтовывают.
ОТРАВЛЕНИЕ ГАЗАМИ.
Чистый воздух и покой; В тяжелых случаях — кислород
ОТРАВЛЕНИЕ КИСЛОТАМИ
1. Выпить 4-5 стаканов теплой воды и вызвать рвоту.
2. Сделать два промывания желудка чистой теплой водой. Общий объем жидкости не менее 6 литров.
1. Выпить 4-5 стаканов теплой воды и вызвать рвоту.
2. Выпить 2%-ный раствор уксусной кислоты.
3. Сделать два промывания желудка чистой теплой водой. Общий объем жидкости не менее 6 литров.
ЛАБОРАТОРНАЯ ПОСУДА И ОБОРУДОВАНИЕ
СРЕДСТВА ЗАЩИТЫ
1. халат
2. очки
3. перчатки
4. средства для защиты органов дыхания
ПОСУДА ДЛЯ ПРОВЕДЕНИЯ ОПЫТОВ
1. Лотки для посуды и химреактивов
2. пробирки — для проведения опытов;
3. конические колбы Къельдаля — для проведения опытов;
4. круглодонные колбы — для проведения опытов;
5. воронки — для фильтрования растворов;
6. Аппарат Киппа для собирания газов;
7. колба Вюрца перегонная для разделения жидкостей с различной температурой кипения;
8. Кристаллизатор — для охлаждения веществ;
9. Эксикатор — для осушки или токсичных
и «влаголюбивых» веществ;
МЕРНАЯ ПОСУДА
1. Мензурка
2. мерная пробирка
3. мерный цилиндр;
4. мерный стакан
5. Ареометр – прибор для измерения плотности жидкости
6. делительная воронка — для разделения несмешивающихся жидкостей.
ПРИБОРЫ ДЛЯ ВЗВЕШИВАНИЯ
1. рычажные весы
2. электронные весы
ОБОРУДОВАНИЕ ДЛЯ ПРОВЕДЕНИЯ ОПЫТОВ
1. штатив для пробирок
2. лабораторный штатив — для закрепления посуды и оборудования
3. ложечка для сжигания сухих веществ
4. тигельные щипцы — для удерживания горячей посуды
4. Ручной пробиркодержатель
ФАРФОРОВАЯ ПОСУДА
1. Ступка с пестиком — для размельчения сухих веществ
2. фарфоровые тигли и
3. чашечки — служат для прокаливания веществ.
НАГРЕВАТЕЛЬНЫЕ ПРИБОРЫ
1.спиртовка
2. водяная баня
3. газовая горелка
4. электроплитка
22(Б) Тесты ЕГЭ ФИПИ 2015 Правила работы в лаборатории
Экспериментальные основы химии
Ключевые слова: экспериментальные основы химии, правила работы в лаборатории, правила безопасности, научные методы исследования химических веществ и превращений, индикаторы, качественные реакции на неорганические вещества и ионы, качественные реакции органических соединений, основные способы получения углеводородов, основные способы получения кислородсодержащих соединений.
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии.
Правила работы в лаборатории
- Каждый опыт выполняйте строго по инструкции в соответствии с рекомендациями преподавателя.
- Опыты с использованием или образованием вредных летучих веществ, а также газов с резким запахом проводите в вытяжном шкафу с включенным мотором.
- За ходом опыта в пробирке наблюдайте через её стенки. Нельзя смотреть на вещества в отверстие пробирки, особенно во время нагревания.
- Работая с огнём, будьте особенно внимательны и осторожны!
- Нагревайте пробирку с раствором или веществом равномерно. При этом запрещено наливать или насыпать в неё какое-либо вещество, ставить горячую пробирку в пластмассовый штатив.
- Категорически запрещается брать вещества руками, пробовать их на вкус, рассыпать, разбрызгивать или поджигать.
- Знакомясь с запахом вещества, делайте движения ладонью от отверстия сосуда к носу.
- Для опытов используйте только чистую лабораторную посуду.
- При попадании на кожу какого-либо вещества стряхните его, смойте достаточным количеством проточной воды и сразу обратитесь к учителю (лаборанту).
- После проведения опытов уберите рабочее место и тщательно вымойте руки с мылом.
- Не употребляйте пищу в химической лаборатории!
- При несчастном случае немедленно обратитесь к учителю.
Лабораторная посуда и оборудование
Стеклянная посуда:
- Делительная воронка — для отделения друг от друга несмешивающихся жидкостей.
- Колба коническая — для приготовления и хранения растворов.
- Колба круглодонная — для проведения синтезов.
- Кристаллизатор — для охлаждения растворов и при сборе газов под водой.
- Пробирка — для проведения самых разных опытов.
- Стеклянная палочка — для перемешивания жидкостей.
- Химическая воронка — для переливания жидкостей и для фильтрования.
- Химический стакан — для приготовления растворов и проведения химических реакций.
- Цилиндр — для собирания газов.
- Часовое стекло — для исследования твердых веществ, закрывания стаканов при проведении синтезов.
- Чашка Петри — для высушивания различных веществ.
Фарфоровая посуда:
- Тигель — для прокаливания веществ, для проведения различных синтезов при высоких температурах.
- Треугольник — для закрепления тиглей, чашек на кольце штатива.
- Фарфоровая ступка с пестиком — для измельчения твердых веществ, перемешивания смесей.
- Фарфоровая чашка — для упаривания растворов на водяной или песчаной бане.
- Фарфоровый шпатель — для пересыпания реактивов.
Оборудование:
- Ареометр — для измерения плотности раствора.
- Асбестовая сетка — для нагревания веществ на электрической плитке.
- Держатели для пробирок — для закрепления пробирок при нагревании.
- Ложка для сжигания вещества — для сжигания веществ.
- Муфельная печь — для прокаливания веществ, проведения синтеза при высокой температуре.
- Спиртовка — для нагревания веществ.
- Сушильный шкаф — для сушки веществ и посуды.
- Термометр — для определения температуры.
- Тигельные щипцы — для переноса небольших предметов.
- Штатив для пробирок — для проведения опытов в пробирках
- Штатив с кольцом, лапкой и зажимами — для закрепления приборов при проведении эксперимента.
- Электрические плитки — для нагревания веществ.
- Электронные весы — для взвешивания веществ.
Правила безопасности
при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
- При разбавлении кислот водой помните: наливают кислоту медленно, при перемешивании, в воду, а не наоборот.
- Кусочки щёлочи можно брать только пинцетом или щипцами. Растворяют щёлочь в фарфоровой посуде, прибавляя к воде небольшие порции вещества при помешивании.
- Пролитые кислоту или щёлочь следует засыпать чистым сухим песком и перемешать его до полного впитывания жидкости. Влажный песок убирают совком в широкий стеклянный сосуд для последующей промывки и нейтрализации.
- При попадании на кожу раствора кислоты необходимо обмыть кожу сильной струёй холодной воды, обработать 2%-ным раствором пищевой соды и ополоснуть водой.
- Работы, связанные с выделением вредных паров или газов, проводить только в вытяжном шкафу при включенной вентиляции.
- При попадании на кожу раствора щёлочи необходимо промыть кожу сильной струёй холодной воды, обработать 2%-ным раствором уксусной (или лимонной) кислоты.
- Внимательно читайте инструкцию и неукоснительно соблюдайте правила обращения с любым средством бытовой химии.
- Неукоснительно следуйте инструкции, касающейся срока годности любого препарата, особенно, если это — лекарства.
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ Методы исследования объектов, изучаемых в химии
Вы смотрите конспект «Экспериментальные основы химии»
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
Индикатор – это вещество, способное изменять окраску в растворах кислот и щелочей.
Таблица 4.1.3. Изменение окраски индикаторов в зависимости от среды раствора
| Индикатор | Нейтральная среда | Кислая среда | Щелочная среда |
| Лакмус | фиолетовый | красный | синий |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метиловый оранжевый | оранжевый | розовый | жёлтый |
4.1.4. Качественные реакции на неорганические вещества и ионы
Таблица 4.1.4 а). Качественные реакции на катионы
Таблица 4.1.4 б). Качественные реакции на анионы
4.1.5. Качественные реакции органических соединений
Таблица 4.1.5. Качественные реакции на органические вещества.
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
Способы получения простых веществ:
А) Получение водорода
- Взаимодействие металлов с кислотами (кроме азотной и концентрированной серной кислот):
Zn + H2SO4 (разб.) = ZnSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑ - Разложение воды под действием постоянного тока в присутствии сильного электролита (электролиз): 2H2O → 2H2↑(катод) + O2↑(анод)
- Взаимодействие амфотерных металлов с водой в щелочной среде: 2H2O + 2NaOH + Zn = Na2[Zn(OH)4] +H2↑
- Взаимодействие металлов с водой:
2H2O + 2Li = 2LiOH + H2↑
4H2O (пар) + 3Fe = (FeIIFe2III)O4 + 4H2↑ - Реакция гидридов металлов с водой: 2H2O + CaH2 = Ca(OH)2 + 2H2↑
- Взаимодействие углерода с водой: H2O + C (кокс) = CO + H2↑ (800-1000 °С)
- Конверсия метана (каталитический процесс): CH4 + H2O = CO + 3H2
Б) Получение кислорода
- Перегонка жидкого воздуха.
- Термическое разложение сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
2H2O2 = 2H2O + O2↑
В) Получение галогенов
- Электролиз: 2Cl– – 2e = Cl2
- Из солей с помощью более активного галогена или сильного окислителя: Cl2 + 2NaI = 2NaCl + I2
Г) Получение кремния
Восстановление коксом из кремнезема: SiO2 + 2C = Si + 2CO.
Д) Получение фосфора
Восстановление из фосфата кальция: Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO.
Вы смотрите конспект «Экспериментальные основы химии»
Способы получения оксидов
- Взаимодействие простых веществ с кислородом: 2Cu + O2 = 2CuO; S + O2 = SO2
Такие реакции, как правило, протекают с выделением значительного количества теплоты. - Взаимодействие сложных веществ с кислородом:
СН4 + 2O2 = СO2 + 2H2О
2СО + O2 = 2СO2 - Дегидратация гидроксидов: Mg(OH)2 →t→ MgO + H2O.
Гидроксиды щелочных металлов (кроме лития) плавятся без разложения.
2HIO3 →t→ I2O5 + H2O
6HNO3 + P2O5 = 3N2O5 + 2H3PO4 - Термическое разложение солей: CaCO3 →t→ CaO + CO2
Cульфаты и карбонаты щелочных металлов термически устойчивы. Они плавятся без разложения.
Способы получения оснований и амфотерных гидроксидов
- Взаимодействие щелочи или гидрата аммиака с растворимой солью соответствующего металла (нерастворимые основания и амфотерные гидроксиды): FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl.
Гидроксиды меди(I), серебра(I), золота(I) разлагаются на воду и оксид уже в процессе их образования, поэтому получить их из водного раствора не удается. - Взаимодействие металлов или их оксидов с водой (щелочи):
2Na + 2H2О = 2NaOH + H2↑
Na20 + H2О = 2NaOH.
Способы получения кислот
- Взаимодействие кислотных оксидов с водой:
SO3 + H2O = H2SO4
N2O5 + H2O = 2HNO3 - Реакция между сильной кислотой и солью слабой кислоты:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl - Из простых веществ (для бескислородных кислот): H2 + Cl2 = 2HCl.
Способы получения солей
- Действие растворов кислот на металлы: Ca + H2SO4(разб.) = CaSO4 + H2
- Взаимодействие основного или амфотерного оксида и кислоты:
Li2O + 2HNO3 = 2LiNO3 + H2O
BeO + 2HCl = BeCl2 + H2O. - Взаимодействие кислоты и основания (или амфотерного гидроксида):
CsOH + HI = CsI + H2O
Zn(OH)2(T) + 2HCl = ZnCl2 + 2H2O
KOH + Н3РО4 = КH2РО4 + H2О
2KOH + Н3РО4 = К2НРО4 + 2H2О
Al(OH)3(T) + 3H2SO4 = Al(HSO4)3 + 3H2O
Cu(NO3)2 + NaOH = CuOHNO3(T) + NaNO3. - Взаимодействие кислотного и основного или амфотерного оксидов: SrO + SO3 = SrSO4
- Реакции между основаниями и кислотными оксидами: Са(ОН)2 + СO2 = СаСО3 + H2O
- Действие сильной кислоты на соли слабой кислоты: NaNO2 + HCl = NaCl + HNO2
- Взаимодействие щелочей с солями, протекающее с образованием осадка:
2KOH + FeCl2 = Fe(OH)2↓ + 2KCl. - Обменные реакции между двумя солями (если образуются малорастворимые соли): Pb(NO3)2 + 2NaCl = PbCl2↓ + 2HNO3
- Термическое разложении солей другой кислоты: 2KNO3 = 2KNO2 + O2
- Взаимодействие металла и неметалла (некоторые соли бескислородных кислот): Ca + S = CaS.
- Вытеснение металла из раствора его соли более активным металлом (с учетом положения в ряду напряжений): Zn + CuSO4 = Cu + ZnSO4
- Действие кислотного оксида на соль соответствующей кислоты:
СаСО3 + СO2 + H2О = Са(НСО3)2 - Взаимодействие амфотерных металлов с щелочами:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑ - Взаимодействие амфотерных гидроксидов с щелочами:
Zn(OH)2 + 2KOH = K2[Zn(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4].
Вы смотрите конспект «Экспериментальные основы химии»
4.1.7. Основные способы получения углеводородов (в лаборатории)
Основные способы получения углеводородов (в лаборатории) представлены в таблицах: а) Получение алканов; б) Получение алкенов; в) Получение алкадиенов; г) Получение алкинов; д) Получение аренов (бензола).
Таблица 4.1.7 а). Получение алканов.
Таблица 4.1.7 б). Получение алкенов.
Таблица 4.1.7 в). Получение алкадиенов.
Таблица 4.1.7 г). Получение алкинов.
Таблица 4.1.7 д). Получение аренов (бензола).
4.1.8. Основные способы получения кислородсодержащих соединений (в лаборатории)
Основные способы получения кислородсодержащих соединений (в лаборатории) представлены в таблицах: а) Получение спиртов; б) Получение фенола; в) Получение альдегидов; г) Получение кетонов; д) Получение карбоновых кислот; е) Получение сложных эфиров.
Таблица 4.1.8 а). Получение спиртов.
Таблица 4.1.8 б). Получение фенола.
Таблица 4.1.8 в). Получение альдегидов.
Таблица 4.1.8 г). Получение кетонов.
Таблица 4.1.8 д). Получение карбоновых кислот.
Таблица 4.1.8 е). Получение сложных эфиров.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Экспериментальные основы химии». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
ЕГЭ по химии задание 25
План
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
Понятие о металлургии: общие способы получения металлов
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
Природные источники углеводородов, их переработка
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Применение изученных неорганических и органических веществ
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Правила работы в лаборатории
Лабораторная посуда и оборудование
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Химия — полезный предмет, который любят многие школьники благодаря интересным опытам. Однако, попав в лабораторию, многие не придают значения установленным правилам, касающимся техники безопасности. Устроившись на работу в лабораторию, каждый молодой специалист желает показать более опытным коллегам свою осведомленность и серьезное отношение к новым обязанностям. И, если какие-то пробелы школьных знаний можно восполнить в процессе работы, то несоблюдение элементарных требований безопасности часто ведет к плачевным результатам.
Поэтому необходимо знать, как правильно вести себя в лаборатории, как обращаться с оборудованием, лабораторной посудой, химическими веществами.
Правила работы в лаборатории
- Приступая к работе, надеть халат, застегнув все пуговки. Это необходимо для защитить от испарений и мельчайших брызг, которые образуются в процессе работы. С этой же целью надевается закрытая обувь, собираются в пучок длинные волосы, используются защитные очки, маски, перчатки. (только при работе с токсичными, огнеопасными веществами)
- Соблюдать порядок и чистоту, строго придерживаться правил техники безопасности на рабочем месте
- Избегать употребления и хранения пищевых продуктов, питьевой воды.
- Избегать проведения анализов с использованием неисправного оборудования, треснувшей или грязной посуды: посуда для проведения опытов с использованием горелок должна быть из огнеупорного стекла, на пробирке должен находиться знак с отметкой о термической устойчивости посуды.
- Прикреплять этикетки с названиями и формулами реактивов ко всей имеющейся посуде.
- Осторожно обращаться с веществами и растворами: переливать из склянки в пробирку нужно только при соприкосновении горлышка склянки и горлышка пробирки. Пересыпать твердое вещество в пробирку или ступку необходимо в строго определенном отмеренном количестве и при помощи мерной ложечки.
- Не направлять горлышко емкости с химическими веществами в сторону другого человека во время их нагревания: направлять горлышко пробирки при нагревании нужно от себя и от соседа.
- Прогревание сначала осуществляется по всей длине пробирки и только затем в месте, где находится вещество Обеспечить свободный доступ к аптечке со средствами, предназначенными для оказания первой помощи.
- Обеспечить свободный доступ к противопожарным средствам — ящику с песком и лопаткой, противопожарному войлочному или асбестовому одеялу, исправному огнетушителю.
- Избегать попадания химических веществ на слизистые оболочки, открытые участки тела: при попадании вещества в зависимости от состава необходимо незамедлительно промыть раствором щелочи, перекиси водорода и большим количеством проточной воды.
- Обратиться в медпункт.
- Опыты с использованием ядовитых и вредных веществ проводить только во включенном вытяжном шкафу под наблюдением старшего лаборанта или учителя
- По окончанию работы следует тщательно помыть всю посуду под проточной водой.
- Запрещается пробовать химические вещества на вкус. Чтобы понюхать его, следует легким движением руки направить к себе газы из сосуда.
- Наклоняться над сосудом и заглядывать в него сверху нельзя, чтобы не получить травму при случайном выбросе горячего препарата.
Нужно помнить, что для утилизации концентрированных щелочей и кислот, органических растворителей предусмотрены специальные бутыли, которыми оснащается любая лаборатория. Для хранения бутылей используется вытяжной шкаф. Выливать такие средства в раковину категорически запрещено, поскольку это ведет к загрязнению окружающей среды, а также образованию ядовитых побочных продуктов, которые могут выбрасываться из раковины в виде паров или капель жидкости
Лабораторная посуда и оборудование
Лабораторная тара изготавливается из фарфора или термоустойчивого стекла. Применять какие-либо другие емкости, не предусмотренные для использования в лабораторных условиях, запрещено.
К лабораторной посуде относятся:
Исследование небольших объемов веществ осуществляется в пробирках, при работе с которыми запрещается использовать собственные пальцы для закрытия пробирки во время ее встряхивания. Нельзя проводить анализы в не помытой после предыдущего опыта пробирке.
Большие объемы препаратов помещаются для исследования в колбу или стакан. При работе с данными емкостями необходимо:
- Осуществлять перемешивание содержимого путем совершения круговых движений, или используя специальную стеклянную палочку. Чтобы она не повреждала стенки стеклянной емкости, на ее конец надевают кусочек резиновой трубки.
- Переливание химических растворов из сосудов с широким горлышком в емкости с узким горлышком осуществляется с использованием воронки.
- Фильтрование реактивов необходимо проводить в воронке, на дно которой помещается предварительно смоченный водой бумажный фильтр. Раствор выливают на фильтр тонкой струйкой, направляя ее на стеклянную палочку, расположенную у стенки воронки.
- Выпаривание жидкостей осуществляется в выпарительных чашах, надежно закрепленных на кольце штатива. Держать их в руках во время нагрева категорически запрещено. Для нагревания чаш используется пламя спиртовки. Наклоняться над чашей во время ее нагревания нельзя.
- Если процесс исследования вещества предполагает выделение каких-либо газов, их отводят из используемой посуды газоотводной трубкой, герметично соединенной с горлышком емкости.
Лабораторный штатив, при помощи которого закрепляется посуда пи проведении опытов, представляет собой подставку со стержнем, оснащенным кольцом, лапкой и муфтой. Последняя выполняет функцию перемещения лапки и кольца по стержню и регулировки их высоты. Для их фиксации применяются специальные винты. Колбы и пробирки, закрепляются в лапке, должны смотреть отверстием кверху и располагаться вертикально.
Спиртовка, с помощью которой нагреваются реактивы, представляет собой сосуд, заполненный спиртом. В сосуде имеется колпачок и фитиль, прикрепленный к металлической трубочке с диском. Перед проведением опыта колпачок снимают и проверяют плотность прилегания диска к отверстию емкости. Для поджигания спиртовки допускается использовать только горящую спичку.
Нагревание реактивов также можно осуществлять при помощи горелки, которая выполнена в виде металлической трубочки с двумя отверстиями. На подставке имеется боковая трубка со шлангом, присоединенным к газовому крану. Поступающий в горелку газ смешивается с воздухом, проникающим сквозь боковые отверстия. Верхняя, средняя и нижняя части пламени отличаются разной температурой. Наиболее высокая температура в верхней зоне пламени. Использовать для нагревания сосудов во время проведения опытов допускается только данную зону.
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
Манипуляции с препаратами бытовой химии, легковоспламеняющимися, едкими и токсичными средствами требуют соблюдения определенных правил, позволяющих избежать неприятных ситуаций в ходе проведения опытов.
- При возникновении необходимости разбавить кислоту водой, кислоту вливают в воду как можно медленнее, тонкой струйкой.
- Для растворения щелочей допускается использовать только фарфоровую посуду. Для захвата кусочков твердого щелочного материала используется пинцет или щипцы. Растворение щелочи в фарфоровой емкости осуществляется путем добавления в воду небольших порций вещества. Во время выполнения данных манипуляций нужно постоянно помешивать раствор.
- При случайном проливе щелочи или кислоты на рабочую столешницу нужно как можно скорее насыпать на загрязненное место сухой песок. Смесь вытекшего вещества на стол с песком требуется постоянно перемешивать до тех пор, пока песок полностью поглотит всю жидкость. Далее осуществляется немедленная уборка загрязненного песка в стеклянную емкость с его последующим промыванием и нейтрализацией.
- В случае попадания щелочи или кислоты на открытые участки кожи их немедленно стряхивают и промывают кожу под краном с сильным напором холодной воды. Затем пораженное место обрабатывается раствором соды (3%), и смазывается вазелином.
- Переливая растворы из тары нужно следить, чтобы этикетка с наименованием вещества находилась сверху.
- При работе с агрессивными средствами бытовой химии (стиральными порошками, препаратами для чистки сантехники, отбеливателями) нужно использовать защитные перчатки.
- Работа с сильно пахучими веществами должна проводиться в хорошо проветриваемом помещении.
- При хранении бытовой химии необходимо следить, чтобы все емкости были плотно закрыты. Все реактивы следует хранить в прохладном месте, защищенном от прямых солнечных лучей.
Каждое химическое вещество и средство бытовой химии отличается своими свойствами и особенностями взаимодействия с другими препаратами. Прежде, чем приступать к проведению лабораторных анализов, надо изучить всю информацию, касающуюся безопасного обращения с препаратами. При работе следует неукоснительно соблюдать требования и инструкции, касающиеся особенностей веществ, сроков их годности и прочих данных.
Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
Смесь — система, включающая в себя два или более веществ, которые не реагируют между собой.
Типы смесей:
Гетерогенные или неоднородные (механические смеси). Это такие смеси, в которых невооружённым глазом, в редких случаях при помощи увеличительного прибора, можно отчётливо наблюдать границы между молекулами разных веществ. Для примера можно привести суспензии, смесь порошков, эмульсии, дым.
Гомогенные или однородные (растворы). Это такие смеси, в которых невозможно наблюдать границы между молекулами, даже при сильном увеличении, так как молекулы веществ сильно перемешаны друг с другом. Для примера можно привести жидкие (смесь спирта с водой), твёрдые (сплавы) и газовые (смесь газов, не реагирующих друг с другом) растворы.
Методы разделения смесей
- Метод отстаивания. Этот метод основан на разности плотностей различных веществ. Для этого смесь, которую необходимо разделить, помещают в воду, вещества с низкой плотностью поднимаются на верху, а вещества с большей – опускаются на дно посуды. Чтобы ускорить этот процесс в лаборатории используется метод центрифугирования. Он основан на центробежной силе, которая зависит от скорости вращения центрифуги. Для разделения различных веществ существуют индивидуальная скорость вращения в секунду, благодаря которой смесь разделяется.
- Метод декантации. После отстаивания жидкостей, образовавшиеся слои можно разделить при помощи делительной воронки. Суть метода можно увидеть в следующем рисунке.
- Метод фильтрации. Суть метода заключается в способности фильтра задерживать твёрдые частички и пропускать жидкость. . В случае использования отстаивания для разделения веществ разных агрегатных состояний, завершающим этапом является фильтрация.
Методы разделения смесей
- Метод магнитной сепарация. Основан на магнитных свойствах веществ, под действием магнитного поля. Для примера можно привести смесь серы и порошка железы. Железо, обладающие магнитными свойствами притягивается к магниту, а сера остаётся в посуде.
- Метод выпаривания. Используется для разделения тугоплавкого вещества и жидкости. Скорость выпаривание регулируется температурой, давлением, площади поверхности испарения.
- Метод перегонки (дистилляция). Этот метод используется для разделения веществ с приблизительно одинаковыми температурами кипения, а так же используется для разделения летучих веществ от нелетучих. Суть в том, что при закипании смеси быстрее улетучиваются жидкости с более низкой температурой кипения. Пары конденсируются и стекают в приёмник.
- Метод хроматографии. Этот метод основан на разности скоростей поглощения одних частиц другими. В стеклянную трубку насыпается порошок мела и смачивается бензолом. Сверху вливают раствор, который необходимо разделить. Все молекулы из-за разного строения и состава по-разному сорбируются, могут прочно крепиться или более слабо, меньше находиться в растворе и больше в связанном состоянии. На следующей иллюстрации можно наблюдать хроматографию хлорофилла.
- Метод адсорбции. Суть метода в том, что твёрдый компонент (адсорбент) всей поверхностью тела поглощает газовый компонент в результате реакции. Вещество, образованное на адсорбенте, можно отделить от него путём десорбции. Адсорбент используется повторно, а отделённое вещество по назначению. В качестве адсорбентов обычно служат пористые твердые вещества, имеющие большую удельную поверхность.
Понятие о металлургии
Металлургия — получение металлов из руд — один из древнейших видов человеческой деятельности. Еще во втором тысячелетии до н. э. в Египте умели выплавлять железо из железной руды. Так называемый железный век пришел на смену бронзовому, тот, в свою очередь, наступил после каменного.
Получают металлы из рудных полезных ископаемых. Например, халькопирит или медный колчедан — сырье для производства железа, меди и серы (Рис. 1). Химическая формула минерала CuFeS2. Металлы в составе других руд находятся в виде оксидов или солей неорганических кислот, химически связанных катионов.
Суть металлургического процесса заключается в восстановлении положительных ионов до свободных атомов металла. Используют в качестве источников электронов углерод и его соединения, водород, металлы. В процессе восстановления катионы получают недостающие электроны. Происходит восстановление электронных оболочек металла. Схема процесса:
Ме+n + ne- → Me, где
Ме+n — металл в окисленной форме;
+n — степень окисления;
ne- — количество присоединяемых электронов;
Ме — металл в восстановленной форме.
Способы получения металлов
В зависимости от того, кокой восстановитель используют в металлургическом процессе различают: пиро — , гидро, электро — и биометаллургию.
Наиболее распространенные способы получения металлов: пирометаллургический и электрометаллургический. Большинство реакций восстановления протекают при высоких температурах. Так как металлическая связь обладает повышенной прочностью, то выделение металлов в чистом виде из природных соединений проводят при высоких температурах.
Пирометаллургический способ
Пирометаллургия — получение металлов из руд при высоких температурах при участии восстановителей. В переводе с греческого «пирос» означает «огненный». Используют в качестве восстановителей кокс, диоксид углерода, водород. Применяют активные металлы для получения менее активных.
Пирометаллургия подразделяется на
карботермия,
водородотермия,
металлотермию.
Карботермия: перевод сульфида металла путем обжига в оксид и дальнейшим восстановлением углем до чистого состояния.
2ZnS + 3O2 = 2ZnO + 2 SO2
ZnO + C = CO + Zn
Руды, состоящие из оксидов и сульфидов железа, подвергают карботермии. Проводят восстановление коксом или диоксидом углерода (угарным газом). Получают сплавы железа — чугун и сталь. Первый содержит больше углерода, а также оксидов серы, фосфора и кремния. Углерод снижает твердость и другие характерные для металлов качества.
Химические реакции, лежащие в основе выплавки чугуна:
C + O 2 = CO 2 ↑,
CO 2 + C ↔ 2CO↑,
3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2 ↑,
Fe 3 O 4 + CO = 3FeO + CO 2 ↑,
FeO + CO = Fe + CO 2 ↑.
Сталь выплавляют в специальных печах
Сталь выплавляют в специальных печах — электрических, конвертерных, мартеновских. При продувании обогащенного кислородом воздуха выгорает избыточный углерод, его содержание уменьшается до 2% и ниже. Этот способ является более экономически применим, т.к. при помощи него получают сталь и чугун, которые широко используются в современной промышленности.
Восстановлением углем можно получить железо, медь, цинк, кадмий, германий, олово, свинец и другие металлы. В качестве сырья используют медную (Cu 2 O), оловянную (SnO 2 ) , марганцевую (MnO 2 ) руды.
Металлы можно извлечь из сульфидных руд. Сначала проводят обжиг, затем — восстановление полученного оксида углем. Схемы обжига цинковой обманки и получение цинка:
2ZnS +3O 2 = 2ZnO + 2SO 2 ↑;
ZnO + C = Zn + CO↑.
Карбонаты тоже прокаливают с углем для получения оксидов и последующего восстановления углем. Схемы обжига сидерита и восстановления оксида железа:
FeCO 3 = FeO + CO 2 ↑;
FeO + C = Fe + CO↑.
Водородотермия — производство металлов восстановлением водородом
Достоинством этого металлургического метода является получение очень чистых металлов. Восстановление меди из оксида CuO — пример восстановительных свойств водорода из школьного курса неорганической химии. Схема протекания реакции
Водородом восстанавливают из оксидов тугоплавкие металлы молибден и вольфрам.
Металлотермия
Проводят восстановление одного металла другим, более химически активным. Этот способ применяют для получения металлов из оксидов и галогенидов.
В зависимости от природы металла-восстановителя различают алюминотермию, или алюмотермию, — восстановление алюминием и магнийтермию — восстановление магнием.
Силикотермия — восстановление металлов кремнием. Процесс протекает согласно схеме: 2MgO + Si → 2Mg + SiO 2 .
Гидрометаллургический способ
Гидрометаллургия — способ получения благородных, цветных, редких металлов. Например, оксид меди сначала переводят в сульфат с помощью серной кислоты. Медь вытесняют из раствора железом. Протекает следующая реакция замещения: CuSO 4 + Fe = Cu + FeSO 4 . Либо медь извлекают из раствора электролизом. Пропускают электрический ток, ионы Cu 2+ осаждаются на катоде.
Преимущество гидрометаллургического способа — возможность получать металлы из бедных руд. Еще один плюс метода — снижение газообразных выбросов в атмосферу. Большое количество вредных газов и сажи поступает в воздух при обжиге руды и пирометаллургии.
Электролиз
Электролиз расплавов оксидов, солей и гидроксидов проводят для получения металлов, расположенных в ряду активности от лития до марганца. Электролиз водных растворов служит для производства менее активных металлов.
Электролиз расплавов
Катодные (восстановительные) процессы . На катоде происходит восстановление катионов металлов и водорода или молекул воды.
Для растворов кислот: К(-) Н + + 2 е — ⟶H 2 0 ↑.
Для растворов солей или щелочей: К(-) M n+ , H 2 O.
Характер восстановительного процесса зависит от значения стандартного потенциала металла:
Схема электролиза расплава хлорида натрия: 2NaCl (эл. ток) → 2Na + Cl 2 ↑.
Схема электролиза сульфата марганца в растворе: 2MnSO 4 + 2H 2 O (эл. ток) → 2Mn + O 2 ↑+2H 2 SO 4 .
Способ термического разложения
Железо с диоксидом углерода при повышенных давлении и температуре образует пентакарбонил Fe(CO)5. Эту жидкую субстанцию перегоняют для очистки от примесей, затем нагревают. Карбонил разлагается с образованием порошка железа. Дальнейшее нагревание в вакууме или атмосфере водорода приводит к получению очень чистого железа. Схема процесса: Fe(CO)5 → Fe + 5CO↑.
Биометаллургия
Способ, основанный на биохимических процессах с участием микроорганизмов. Метод получил распространение на Западе, так как позволяет меньше загрязнять окружающую среду. Биометаллургия служит для получения меди, серебра, никеля, свинца, урана, рения и ряда других металлов.
общие способы получения металлов
Кроме собственно добычи металла из природных соединений (руд), металлургия включает в себя вторичную переработку сплавов и металлических изделий. Минеральные ресурсы Земли огромны, но конечны, а переплавка бывших в употреблении изделий бывает выгоднее и проще. Иногда обработку металлов тоже относят к металлургии, поэтому можно сказать, что это действительно одна из самых крупных областей промышленности.
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
Научные принципы химического производства
Производство аммиака
Производство серной кислоты
Производство метанола
Химическое загрязнение окружающей среды и его последствия
Научные принципы химического производства
Производство аммиака
Первый шаг – получение из азота и водорода азотоводородной смеси. Азот получается посредством фракционной перегонки жидкого воздуха. Источником водорода выступает процесс паровой природного газа или угля.
Турбокомпрессор сжимает смесь, пока не будет получено давление в 25*10 6 Па. Температура для протекания требуемых химических реакций находится в диапазоне: 400-500 °С. Для ускорения используется катализатор – пористое железо, содержащее примеси K 2 O и Al 2 O 3 .
Данный химический процесс является равновесным: при изменении условий происходит изменение количество продукта реакции, поэтому при проведении данного процесса нужно следить за внешними факторами, которые влияют на протекание химического процесса.
Создаваемый аммиак отделяют от непрореагировавшего водорода и азота в холодильнике процессом сжижения. Непрореагировавшая смесь возвращается в колонну синтеза. Процесс циркулирует непрерывно, пока не будет истрачен требуемый исходный материал. Применяется получаемый аммиак для производства взрывчатых веществ, азотных удобрений, пластических масс и ещё ряда продукции химического производства.
Производство серной кислоты
Серная кислота относится к числу сильных кислот. Для получения используется очищенный измельченный влажный пирит (другое название – серный колчедан). Сырьё сверху засыпается в печь, чтобы обжечь вещество. Снизу, по принципу противотока, пропускается воздух, обогащенный кислородом.
Результат обжига в печи: SO 2 , пары воды и мельчайшие частицы оксида железа (огарок). Газ очищается от примесей. Твёрдые частицы задерживает электрофильтр и циклон. Для водных паров предусматривается сушильная башня.
Контактный аппарат окисляет сернистый газ с помощью катализатора пятиокиси ванадия. Процесс окисления обратим, для чего подбирают оптимальные условия, способствующие протеканию прямой реакции: повышается давление и поддерживается температура на свыше отметки в 500 °С.
Производство метанола
Для производства метанола используется реакция взаимодействия угарного газа и водорода. Технологическая цепочка практически повторяет ту, что используется для получения аммиака. Схожесть обусловлена частичным сходством проходимых реакций. И аммиак, и метанол – это экзотермические, обратимые, каталитические реакции, процесс протекания которых предусматривает уменьшение объема газообразных веществ.
Для синтеза метанола используются следующие приёмы:
Применение в колонне синтеза катализатора.
Использование высокого давления, повышающего уровень выхода продукта.
Принципы теплообмена и циркуляции.
Для увеличения скорости реакции используется высокая температура.
Химическое загрязнение окружающей среды и его последствия
Недостаток химического производства – загрязнение окружающей среды, вредоносное влияние на здоровье и жизнь человека и местной флоры с фауной. Негативные последствия накапливаются, приводя к ухудшению самочувствия. При размещении химического предприятия окружающая обстановка может кратно ухудшиться. Падает уровень жизни и удовлетворенность.
Чтобы не допустить этого, с химическим загрязнением окружающей среды борются. Это достигается с помощью следующих мер:
Создание новых технологий и технических объектов, ориентированных на ресурсосбережение и малоотходность.
Получение наибольшего объема продукции требуемого качества с наименьшими вложениями.
Стремление к полному использованию исходного сырья.
Поддержание экологической безопасности на предприятии.
Государство заинтересовано в поддержания благоприятной экологической обстановки. Для стимулирования уменьшения химического загрязнения окружающей среды и последствий используется налоговая экологическая политика, привязанная к объему выбросов и уровню опасности.
Природные источники углеводородов, их переработка
Природные источники углеводородов
Их переработка
Обработка попутного нефтяного газа
Природные источники углеводородов
Нефть – это природная маслянистая горючая жидкость, обладающая специфическим запахом, темно-коричневого (черного, красного, синего, белого) цвета или бесцветная, состоящая из сложной смеси углеводородов различной молекулярной массы (алканов, циклоалканов, аренов) и ряда других химических соединений.
Различают два вида нефти, в зависимости от плотности и содержания серы:
Легкая – извлекается насосами или фонтанным способом. Массовая доля серы – незначительно, вследствие чего ценность продукта выше. Используется для производства горючих продуктов — бензина и керосина.
Тяжелая – добывается шахтным способом. Из-за содержания примесей данный вид горючего ископаемого требует дополнительной очистки. Применяется для изготовления различных масел, мазута.
К преимуществам применения топлива можно отнести – простоту, дешевизну добычи и беспроблемность транспортировки.
К недостаткам – низкую ресурсообеспеченность, то есть соотношение между количеством ресурсов и размерами их использования.
Природный газ
Природный газ — это смесь газов, образовавшихся в недрах земли посредством анаэробного разложения органических веществ. Содержание углеводородов в природном ресурсе низкое, 80- 97% составляет метан и незначительный процент – пропан, бутан, этан.
Преимущества данного вида топлива – простота добычи и транспортировки, экономичность.
Недостатки – сложность межконтинентальной транспортировки с помощью дорогостоящих танкеров.
Природный газ не имеет запаха, но для обнаружения протечек вещества в быту, в него добавляют специальные компоненты – меркаптаны. Это связано с тем, что смесь метана с воздухом взрывоопасна, небольшая искра способна спровоцировать происшествие.
Попутный нефтяной газ
Попутный нефтяной газ – это смесь газообразных углеводородов, содержащихся в нефти и выделяющихся при ее добыче и подготовке. Чем ниже молекулярная масса алкана, тем выше его концентрация в природном ресурсе.
Смесь бутана и пропана образует сжиженный газ, который применяется в качестве бытового топлива.
В зависимости от содержания углеводорода попутный газ делится на следующие группы:
- чистый (95–100%);
- углеводородный с примесью углекислого газа 4-20%;
- углеводородный с примесью азота 3-15%;
- углеводородно-азотный, содержанием примесей до 50% соответственно.
Каменный уголь
Данный вид горючего ископаемого относится к твердым, и представляет собой многокомпонентную смесь углеводородов, азота, серы, кислорода и неорганических веществ. Доля углерода составляет 80 %, остальные 20% — органические и неорганические компоненты. Чем выше содержание газа, тем большей теплотворностью обладает вещество, чем ниже – тем дольше уголь может храниться.
Образование данного вида горючего ископаемого проходит в два этапа:
Появление торфа из остатков растений и живых организмов.
Формирование твердого угля.
Данный вид топлива является достаточно перспективным для получения ряда химических продуктов и энергии.
Их переработка
Полезные ископаемые требуют переработки для дальнейшего использования и получения необходимых продуктов.
Переработка нефти
В сыром виде данный ресурс не применяется. Переработка может быть первичной и вторичной.
1. Первичная переработка – заключается в ректификации нефти, путем ее нагревания, не приводящая к химическим изменениям вещества. В процессе повышения температуры улетучиваются сначала легкокипящие элементы, затем требующие более высокой температуры.
На подготовительном этапе требуется очитка нефти от воды, солей и твердых механических частиц. Далее вещество поступает в трубчатую печь, где подвергается нагреванию до 350 °С. Горячий состав перемещается в нижнюю часть ректификационной колонны, в которой осуществляется испарение отдельных фракций на разные уровни, в зависимости отих температуры кипения:
ректификационные газы (верхняя часть, температура кипения не более 40 о С);
бензиновая фракция (35 -200 о С);
лигроиновая фракция (150 — 250 о С);
керосиновая фракция (190 — 300 о С);
дизельную фракцию (200 -300 о С);
мазут (нижняя часть колонны, температура кипения более 350 о С).
2. Вторичная: крекинг и риформинг – необходимы для повышения выхода после переработки более дорогих и качественных фракций.
Крекинг – способ обработки мазута путем нагревания с совместным воздействием катализатора, для увеличения выхода бензиновой фракции.
Риформинг – направлен на улучшение качественных характеристик бензиновой фракции путем реакций дегидроциклизации.
Переработка природного газа
Содержание примесей в природном газе затрудняет его дальнейшую транспортировку и использование. В связи с этим он подвергается переработке:
Сушке – для удаления серы и воды.
Переработка производственным методом в целях придания товарного вида:
- термохимическим способом – при высокой температуре и давлении; физико-энергетическим – охлаждением или нагреванием ресурса для его сжатия и деления; химико-каталитическим – методом парциального окисления или паровой, углекислой конверсии.
- термохимическим способом – при высокой температуре и давлении;
- физико-энергетическим – охлаждением или нагреванием ресурса для его сжатия и деления;
- химико-каталитическим – методом парциального окисления или паровой, углекислой конверсии.
В результате процессов образуются вещества: источники энергии и химические продукты (аммиак, уксусная кислота, метонол и др.).
Обработка попутного нефтяного газа
Концентрация продуктов нефтепереработки негативно влияет на экологию и здоровье населения. В связи с этим возникла необходимость в переработке ПНГ и практическом применении.
Существуют несколько способов утилизации и переработки:
Фракционный метод – основан на разделении газа на компоненты.
Закачка в пласт нефти, для повышения давления и увеличения объемов добычи.
Мембранная очистка с дальнейшим сжижением и использованием для получения топлива и нефтехимического сырья.
Переработка в сжиженный газ.
Переработка каменного угля
Переработка данного вида ресурса называется коксованием, которое осуществляется путем накаливания угля до 900-1100°С без доступа воздуха.
В результате получаются следующие продукты:
кокс с высоким содержанием углерода;
коксовый газ;
каменноугольная смола.
Более 90% всей энергии, потребляемой человечеством в настоящее время, добывается из ископаемых природных органических соединений. ПО своим свойствам газ превосходит нефть.
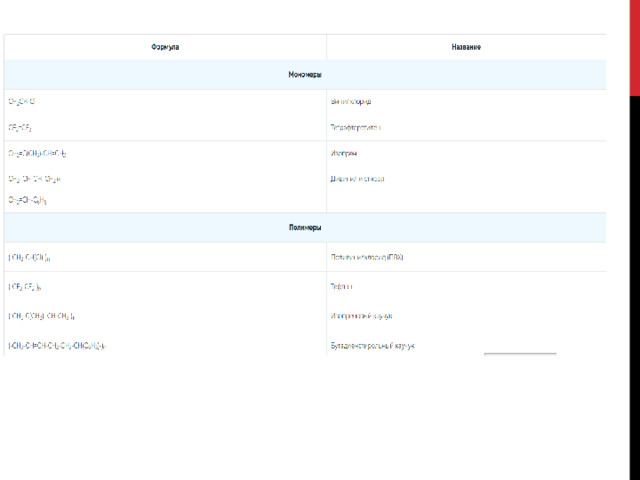
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации
Реакции полимеризации
Реакции поликонденсации
Характеристика полимеров
Высокомолекулярные соединения
Высокомолекулярные соединения – это полимеры, у которых молекулярная масса больше 10000. Полимер – это соединение, состоящее из большого числа звеньев – мономеров (низкомолекулярных веществ), которые повторяются в полимерной цепи большое количество раз .
Число n показывает, из скольких мономеров состоит полимер, и называется степенью полимеризации. Молекулярная масса иногда достигает нескольких миллионов.
Высокомолекулярные соединения классифицируются по характеру мономеров:
гомополимеры – вещества, состоящие из одинаковых мономеров. Например, пропилен CH 2 =CH-CH 3 – это мономер полипропилена (-CH(CH 3 )-CH 2 -) n ;
гетерополимеры – вещества, состоящие из двух разных мономеров. Например, при взаимодействии 1,3-дивинила и стирола получается стирольный каучук.
n CH 2 =CH-CH=CH 2 + n C 6 H 5 -CH=CH 2 → (-CH 2 -CH=CH-CH 2 -CH(C 6 H 5 )-CH 2 -) n
Полимеры получают с помощью:
реакции полимеризации;
реакции поликонденсации.
Реакции полимеризации
Реакции полимеризации заключаются в объединении большого количества низкомолекулярных соединений, количество которых определяется степенью полимеризации. Общее уравнение реакции:
n X → (-X-) n
Самой распространенной реакций полимеризации является реакция получения полиэтилена:
nC 2 H 4 = (CH 2 – CH 2 ) n
реакции полимеризации вступают непредельные соединения. Это могут быть молекулы одного мономера, либо разных. В первой ситуации реакцию называют гомополимеризацией, во второй – сополимеризацией.
I. Гомополимеризация
К этим реакциям относят получение полиэтилена, полипропилена поливинилхлорида и т.д. Например, получение полипропилена из пропена под действием ультрафиолетовых лучей:
n CH 2 =CH-CH 3 → (CH 2 -CH(CH 3 )-) n
II. Сополимеризация
К этим реакциям относят получение сополимера этилена и пропилена:
n CH 2 =CH 2 + n CH 2 =CH-CH 3 → [(-CH 2 -CH 2 -) x – (-CH 2 -CH(CH 3 )-) y ] n , где 1
Полимеры, которые получают в результате реакций полимеризации
Реакции поликонденсации
Реакции поликонденсации заключаются в образовании полимера из мономеров, а также выделении побочного низкомолекулярного вещества. В этих уравнениях исходные реактивы — молекулы мономера с функциональными группами.
I. Гомополиконденсация
К данным реакциям относят получение полимера из одного мономера с выделением конденсата. Например, получение полисахарида из глюкозы – этот процесс происходит в природе.
n C6H12O6 → (-C6H10O5-)n + n H2O
Синтетическое волокно получают в промышленности из аминоэнантовой кислоты под воздействием температуры, давления и катализатора в виде молекулярного азота.
n NH2-(CH2)6-COOH → (-NH-(CH2)6-CO)n + n H2O
II. Сополиконденсация
К данным реакциям относят получение полимера из нескольких мономеров с выделением конденсата. Например, получение фенолформальдегидной смолы из фенола и формальдегида в щелочной или подкисленной среде.
n C6H5-OH + n H-CHO → (-C6H4(OH)-CH2-)n + n H2O
С помощью реакций сополиконденсации в промышленности получают полиэфиры, полиамины, полиакрил и т.д.
Характеристика полимеров
Полимеры – это соединения, которые имеют особые свойства и множество классификаций.
Классификация полимеров
Полимеры
По способу получения высокомолекулярные вещества делятся на:
- природные (целлюлоза, крахмал, белки);
- искусственные (эфиры целлюлозы);
- синтетические (капрон, полиэтилен, тефлон).
Также по форме макромолекул:
- линейные (волокна, полиэтилен низкого давления);
- разветвленные (крахмал, полиэтилен высокого давления);
- пространственные (резина, кварц).
А еще по свойствам и применению:
- пластмассы;
- каучуки;
- волокна.
Все полимеры активно используются в отраслях жизнедеятельности человека.
Пластмассы
Пластик (пластические массы) – полезные материалы, которые способны под воздействием температур или давления плавиться и при застывании оставлять заданную форму. Этот процесс сопровождается переходом из вязкотекучего в стеклообразное состояние. Главный компонент пластмассы – полимер, а остальные части – это наполнители, пластификаторы, красители и т.д.
Каучуки
Эластомеры – это высокомолекулярные соединения, которые обладают высокоэластичными свойствами. Каучуки используют для изготовления автомобильных шин, промышленных товаров и медицинских препаратов. Натуральный каучук получают из латекса (млечный сок каучуконосных растений). Получают по методу С.В. Лебедева с помощью полимеризации дивинила при действии металлического натрия.
n CH2=CH-CH=CH2 → (-CH2-CH(CH=CH2)-…-CH2-CH=CH-CH2-)n
Волокна
Волокна – это высокомолекулярные соединения, для которых характерна строгая упорядоченность молекул и используется в изготовлении нитей. Существует три типа волокон, которые разделяются еще на несколько подтипов.
- Натуральные.
- Искусственного происхождения. Животного происхождения. Минерального происхождения.
- Искусственного происхождения.
- Животного происхождения.
- Минерального происхождения.
- Искусственные. Ацетатное волокно. Вискозное волокно.
- Ацетатное волокно.
- Вискозное волокно.
- Синтетические. Полиамидное волокно. Полиэфирное волокно.
- Полиамидное волокно.
- Полиэфирное волокно.
Полимеры – это соединения, с помощью которых человечество способно изготавливать высокопрочные материалы и довольствоваться благами технологий.
Применение изученных неорганических и органических веществ
Применение неорганических веществ
Применение органических веществ
Применение неорганических веществ
К неорганическим относят соединения, которые не содержат углерод, а также углеродосодержащие вещества, традиционно относящиеся к неорганическим (карбиды, оксиды и др.).
Применение данных соединений достаточно распространено в повседневной деятельности человека, и без них невозможно полноценное ведение хозяйства, лечение, производство и т.п.
Пищевая сода
Гидрокарбонат натрия (NaHCO 3 ) – представляет собой мелкий порошок белого цвета, без запаха, растворимый в воде. Используется преимущественно в кулинарии, для выпечки. Это обусловлено тем, что во время нагревания сода легко разлагается с выделением углекислого газа.
2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2 .
Кроме этого гидрокарбонат натрия используется для придания пышности омлету, смягчения мяса, усиления аромата чая или кофе, добавления сладости плодам фруктов, очищения продуктов от нитратов и т.д.
Кальцинированная сода
Na 2 CO 3 — применяется для бытовых нужд:
мытья посуды (из фаянса, фарфора, керамики в том числе);
чистки раковин, ванн, плитки;
стирки (замачивание, кипячение натуральных тканей);
смягчения жесткой воды;
удобрения кислых дерново-подзолистых почв.
Для использования необходимо развести раствор от 10 до 100 °С.
Соль
Поваренная соль (NaCl) – незаменимая приправа при приготовлении первых, вторых блюд, консервации и даже выпечки. Суточная норма натрия для организма человека составляет 1 г, но употребление значительно превышает эту норму (4-6 г). Осторожнее к потреблению данного продукта следует относиться людям, страдающим повышенным давлением, склонным к появлению отеков.
Серная кислота
Сильная двуосновная кислота (H 2 SO 4 ) представляет собой бесцветную тяжелую маслянистую жидкость, не обладающую запахом. Широко распространено использование средства в различных отраслях промышленности:
сельском хозяйстве (производство минеральных удобрений);
химической (изготовление красителей, химволокна, взрывчатых веществ);
пищевой (пищевая добавка E513)$
металлообрабатывающей;
в промышленном органическом синтезе (реакции дегидратации, гидратации, сульфирования, алкилирования).
Так же соединения серы используется в качестве электролита в свинцовых аккумуляторах.
Оксид цинка
Цинковые белила (ZnO) – представляет собой белый порошок, меняющий цвет при нагревании. Применение продукта известно в медицине, химической промышленности в качестве наполнителя или пигмента:
при производстве красок и эмалей;
при изготовлении бумаги, резины, пластмассы, косметики и парфюмерии;
в составе мазей и присыпок.
Данное соединение обладает фотокаталитической активностью, что нашло свое применение при изготовлении самоочищающихся поверхностей, бактерицидных покрытий для помещений больниц и подобных учреждений.
Медный купорос
Сульфат меди II (CuSO4) – бесцветное кристаллическое соединение, растворимое в воде. При реакции с воздухом или водой образуется голубой пентагидрат.
Применяется вещество как основа для других соединений или в качестве индикатора влажности помещения. Медный купорос – эффективное средство в борьбе с вредителями, грибковыми заболеваниями. Но есть и безвредное применение — изготовление минеральных красок, меднение ванн, пищевые добавки (консервант).
Применение органических веществ
Органические вещества – это класс химических соединений, объединяющий все вещества, в состав которых входит углерод.
Алканы
Предельные (насыщенные) углеводороды, атомами водорода: СН 4 – метан (основа природного газа), С 2 Н 6 – этан, С 3 Н 8 – пропан, С 8 Н 18 – октан (основа бензина).
Применяются в качестве топлива: бензин, дизельное, авиационное, пропан-бутановая смесь для бытовых плит.
Вазелин – незаменим в медицине, парфюмерии, косметологии.
Входят в состав смазочных масел.
Хладагент для холодильников.
Петролейный эфир и циклогексан используются в качестве растворителя.
Метан незаменимый компонент при производстве шин.
Широко распространено применение данной группы органических соединений в химической промышленности (для производства пластмасс, синтетических волокон и т.д.) и медицине.
Алкены
Соединения служат исходными веществами для получения ряда готовых продуктов:
растворителей (спиртов, дихлорэтана, эфира);
полимеров (полиэтилена, поливинилхлорида, полиизобутилена);
Этилен (Н 2 С=С Н 2 ) используется для получения, тефлона, этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Алкены применяются и для ускорения процесс созревания фруктов.
Алкины (ацетиленовые углеводороды)
Ацетилен – необходим в качестве исходного продукта в органическом синтезе при производстве:
полимеров (каучука, поливинилхлорида и др.);
растворителей (1,1,2,2-тетрахлорэтана , 1,1,2-трихлорэтена);
уксусной кислоты.
Температура пламени вещества достигает 3150°С, что нашло свое применение при резке металла и в сварке.
Спирты
Алкоголи – производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу ОН.
Метанол (СН 3 ОН) –применяется в производстве муравьиной кислоты и формальдегида. Рассматривается как вариант для применения в качестве моторного топлива.
Этанол (С 2 Н 5 ОН)- востребован в виде исходного соединения для получения уксусной кислоты, сложных эфиров, карбоновых кислот. Вещество служит основой производства спиртосодержащей продукции и антисептических средств.
Этиленгликоль – компонент необходимый в производстве пластмасс, антифризов, органическом синтезе.
Глицерин – незаменим в разных отраслях промышленности, в том числе текстильной, пищевой, фармакологии.
Фенолы
Основное использование соединений приходится на химическую промышленность, медицину (производство синтетических смол, красителей, антисептиков, взрывчатых веществ и т.д.).
Альдегиды
Метаналь – используется при получении фенолформальдегидных и карбамидных смол, синтезе лекарственных средств, как дезинфицирующее средство.
Этаналь — нашел свое применение в органическом синтезе.
Карбоновые кислоты
Соединения, карбоксильной группы –СООН.
Муравьиная кислота (НСООН) –применяется в фармацевтической и пищевой промышленности. Уксусная кислота (СН 3 СООН) — востребована для производства искусственных волокон на основе целлюлозы и в пищевой промышленности.
Бензойная кислота (С 6 Н 5 СООН) – незаменима в фармацевтике для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов.
Сложные эфиры
Применяются в пищевой и парфюмерной отраслях в качестве отдушек. А также обеспечивают эластичность и пластичность пластмасс и резины.
Также широко распространено в пищевой промышленности, медицине применение глюкозы, аминов, аминокислот. Целлюлоза основной компонент при изготовлении бумаги, пленок, искусственных волокон и т.д.
Много соединений еще не изучено до конца, и возможно, благодаря науке человек сможет заменить натуральные продукты на искусственные, органических соединений природного происхождения применяется все меньше.
Задание для подготовки к егэ
Ответ: 4235.
Пояснение
Установим соответствие.
A) Аммиак широко используется как исходное азотсодержащее вещество в производстве удобрений (4).
Б) Одно из основных применений метана — в качестве топлива (2).
В) Изопрен — исходный мономер при получении каучука (3).
Г) Этилен может использоваться для различных целей, но из представленных вариантов наиболее подходящий — получение пластмасс (5).
Ответ: 4235.
Задание для подготовки к егэ
Ответ: 5412.
Пояснение
Установим соответствие.
А) Перегонка (фракционирование) сжиженного воздуха используется для получения легких газов (азот, кислород) (5).
Б) Прокаливание фосфатов кальция с углем и диоксидом кремния — получение белого фосфора (4).
В) Крекинг нефтепродуктов — получение бензина (1).
Г) Каталитическое окисление диоксида серы в триоксид — одна из стадий получения серной кислоты (2).
Ответ: 5412.
Домашняя работа
Вариант № 5511119
Ссылка — https:// chem-ege.sdamgia.ru/test?id=5511119
За это задание ты можешь получить 1 балл. На решение дается около 7 минут. Уровень сложности: базовый.
Средний процент выполнения: 66.8%
Ответом к заданию 25 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Установите соответствие между мономером, используемым в реакции полимеризации, и схемой реакции его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| МОНОМЕР | СХЕМА РЕАКЦИИ |
| А) $CH_2=CH–CH=CH_2$ Б) $CH_2=C(Cl)–CH=CH_2$ В) $CH_2=CHCl$ |
1) $CH_2=CH–C≡CH + HCl →$ 2) $C_2H_5OH {→}↙{катализатор}↖{t°}$ 3) $C_2H_2 + HCl →$ 4) $CH_2=CH–CH=CH_2 + HCl →$ 5) $CH_2=CH_2 + HCl →$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Бутадиен синтезируется пропусканием этилового спирта через катализатор из оксидов металлов при температуре 400—450 °C.
Б) Хлоропрен получается в реакции винилацетилена с хлороводородом.
В) Винилхлорид получается в реакции ацетилена с хлороводородом.
Ответ: 213
Задача 2
Установите соответствие между реагирующими веществами и изменениями, которые наблюдаются в ходе реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСТОЧНИК | ПРОДУКТ ПЕРЕРАБОТКИ |
| А) нефть Б) древесина В) природный газ |
1) глицерин 2) метан 3) мазут 4) этиловый спирт |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Мазут – один из видов топлива, фракция нефти.
Б: Благодаря брожению продуктов древесины получаются сахаро-подобные вещества, за счет гидролиза которых образуется этанол.
В: Метан – главный продукт переработки природного газа.
Ответ: 342
Задача 3
Установите соответствие между аппаратом, который используется в химическом производстве, и технологическим процессом, происходящим в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АППАРАТ | ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС |
| А) контактный аппарат Б) компрессор В) поглотительная башня |
1) синтез аммиака 2) обжиг пирита 3) получение олеума 4) окисление диоксида серы |
Запишите выбранные цифры под соответствующими буквами.</
Решение
А) Контактный аппарат используется для окисления диоксида серы кислородом в присутствии катализатора.
Б) Компрессор используется для производства аммиака, потому что смесь газов в процессе производства должны быть под давлением.
В) Поглотительная башня используется для получения олеума. В нее подается оксид серы (VI) и 98% серная кислота, а выходит олеум.
Ответ: 413
Задача 4
Установите соответствие между веществом и схемой его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СХЕМА ПОЛУЧЕНИЯ |
| А) дивиниловый каучук Б) фенолформальдегидная смола В) нейлон |
1) nCH2=CH–CH=CH2 → 2) nCH2=C(CH3)–CH=CH2 → 3) nC6H5OH + nCH2O → 4) nHOOC–(CH2)4–COOH + nH2N–(CH2)6–NH2 → 5) nCH2(OH)–CH2OH + nHOOC–C6H4–COOH → |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Дивиниловый(бутадиеновый) каучук получается путем полимеризации бутадиена ($CH_2 =CH–CH=CH_2$).
Б) Фенолформальдегидные смолы – продукты поликонденсации фенола $C_6H_5OH$ с формальдегидом $CH_2=O$.
В) Нейлон синтезируется поликонденсацией адипиновой кислоты ($HOOC–(CH_2)_4 –COOH$) и гексаметилендиамина ($H_2N–(CH_2)_6 –NH_2$).
Ответ: 134
Задача 5
Установите соответствие между лабораторным оборудованием и его применением: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОБОРУДОВАНИЕ | ПРИМЕНЕНИЕ |
| А) ступка Б) стеклянная воронка В) шпатель |
1) отбор твёрдых веществ 2) измельчение веществ 3) разделение несмешивающихся жидкостей 4) разделение осадка от раствора |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Ступка используется для измельчения веществ.
Б) Воронка используется для фильтрования (в неё помещают фильтровальную бумагу, через которую пропускают фильтруемую жидкость).
В) Шпатель используется для отбора твёрдых веществ.
Ответ: 241
Задача 6
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) изопропилбензол Б) этанол В) триолеин |
1) получение полиэфиров 2) получение ацетона 3) производство маргарина 4) получение дивинила |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Изопропилбензол (кумол) является сырьём для получения ацетона.
Б) Этанол используют для получения дивинила (бутена-1,3): $2CH_3CH_2OH = CH_2=CH−CH=CH_2 + 2H_2O + H_2$
В) Триолеин — жир, используемый для получения маргарина
Ответ: 243
Задача 7
Установите соответствие между получаемым в промышленности веществом и сырьём, используемым для его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ИСПОЛЬЗУЕМОЕ СЫРЬЁ |
| А) аммиак Б) азотная кислота В) водород |
1) раствор поваренной соли 2) атмосферный азот 3) нитрат аммония 4) аммиак |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Аммиак получают реакцией соединения водорода и азота, азот дешевле всего получать из атмосферы, так как он составляет бо́льшую её часть.
Б) Азотная кислота может быть получена в несколько стадий из аммиака.
В) Водород выделяется при электролизе растворов солей активных металлов, в том числе раствора поваренной соли (хлорида натрия).
Ответ: 241
Задача 8
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящим в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АППАРАТ | ПРОЦЕСС |
| А) печь для обжига Б) компрессор В) ректификационная колонна |
1) получение сернистого газа 2) синтез метанола 3) переработка нефти 4) дегидрирование метана |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) В печи для обжига протекает первая стадия получения серной кислоты — сжигание пирита до сернистого газа.
Б) Компрессор увеличивает давление газов, что является необходимым условием для проведения реакции синтеза метанола из синтез-газа — смеси СО и $Н_2$.
В) В ректификационной колонне нефть делят на фракции, это одна из основных стадий переработки нефти.
Ответ: 123
Задача 9
Установите соответствие между осуществляемым в промышленности процессом и оборудованием, которое используется в производстве: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОЦЕСС | ОБОРУДОВАНИЕ |
| А) получение сернистого газа Б) получение олеума В) получение оксида серы(VI) |
1) окислительная башня 2) печь «кипящего слоя» 3) контактный аппарат 4) поглотительная башня |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Для получения сернистого газа используют печь кипящего слоя, в ней происходит обжиг пирита.
Б: Для получения олеума используют поглотительную башню, в которой серная кислота поглощает $SO_3$.
В: Оксид серы (VI) можно получить в контактном аппарате, где, при помощи катализатора, оксид серы (IV) реагирует с кислородом.
Ответ: 243
Задача 10
Установите соответствие между веществом и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СПОСОБ ПОЛУЧЕНИЯ |
| А) сернистый газ Б) анилин В) натрий |
1) электролиз расплава поваренной соли 2) обжиг пирита в «кипящем слое» 3) восстановление нитробензола 4) электролиз раствора хлорида натрия |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) сернистый газ является промежуточным продуктом при получении серной кислоты в промышленности, он образуется при обжиге пирита в «кипящем слое».
Б) анилин (фениламин) $С_6Н_5-NH_2$ получают реакцией Зинина — восстановлением нитробензола $С_6Н_5-NO_2$.
В) Натрий — очень активный металл, поэтому получают его электролизом расплавов солей, например, поваренной соли (хлорида натрия). При электролизе раствора на катоде выделяется водород.
Ответ: 231
Задача 11
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) криолит Б) пирит В) метилметакрилат |
1) производство антифриза 2) получение алюминия 3) производство серной кислоты 4) получение органического стекла |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Криолит – гексафторалюминат натрия, из него электролитически получают алюминий.
Б: Из пирита можно получить оксид серы (IV), который позже окисляют и получают серную кислоту.
В: Из метилметакрилата получает полиметилметакрилат путем поликонденсации, а это и есть органическое стекло.
Ответ: 234
Задача 12
Установите соответствие между металлом и веществом, которое используется для получения металла в промышленности, или способом промышленного получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| МЕТАЛЛ | ВЕЩЕСТВО/СПОСОБ ПОЛУЧЕНИЯ |
| А) железо Б) алюминий В) натрий |
1) красный железняк 2) электролиз раствора оксида в криолите 3) электролиз раствора поваренной соли 4) электролиз расплава поваренной соли |
Запишите выбранные цифры под соответствующими буквами.
Решение
Красный железняк (гематит) — $Fe_2O_3$, используется для получения железа. В природе алюминий больше всего встречается в составе оксида $Al_2O_3$, из которого и получают металлический алюминий. Поваренная соль — NaCl используется для получения металлического натрия. Активные металлы удается получить только электролизом расплава соли (при электролизе раствора на катоде будет восстанавливаться водород).
Ответ: 124
Задача 13
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящим в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АППАРАТ | ПРОЦЕСС |
| А) печь кипящего слоя Б) колонна синтеза В) поглотительная башня |
1) взаимодействие водорода и азота 2) окисление окcида азота(IV) 3) получение олеума 4) получение оксида серы(IV) |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) В печи кипящего слоя обжигают пирит, получая сернистый газ.
$4FeS_2 +11O_2 = 2Fe_2O_3 + 8SO_2$
Это первая стадия производства серной кислоты.
Б) Колонна синтеза — основной реактор производства аммиака, в нём протекает реакция соединения водорода и азота.
$3H_2 + N_2 = 2 NН_3$
В) В поглотительной башне протекает последняя стадия производства серной кислоты — взаимодействие оксида серы 6 с концентрированным раствором серной кислоты, в результате которого получают олеум.
Ответ: 413
Задача 14
Установите соответствие между веществом и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СПОСОБ ПОЛУЧЕНИЯ |
| А) полипропилен Б) фторопласт В) бутадиенстирольный каучук |
1) вулканизация 2) полимеризация 3) поликонденсация 4) сополимеризация |
Запишите выбранные цифры под соответствующими буквами.
Решение
Вещества А и Б являются полимерами, а полимеры получаются в результате полимеризации.
В: Как мы видим по названию, это полимер двух веществ: бутадиен и стирол, значит нужно использовать сополимеризацию.
Ответ: 224
Задача 15
Установите соответствие между органическим веществом и способом его промышленного получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СПОСОБ ПОЛУЧЕНИЯ |
| А) метан Б) бензол В) метанол |
1) ароматизация продуктов перегонки нефти 2) получение из синтез-газа 3) выделяют из природного газа 4) димеризация ацетилена |
Запишите выбранные цифры под соответствующими буквами.
Решение
Метан — одна из основных составляющих природного газа, из которого его и получают.
Самое дешёвое сырьё для получения бензола — продукты перегонки нефти, из которых его получают реакцией ароматизации алифатических соединений.
Реакция синтеза метанола: $CO + 2H_2 = CH_3OH$.
Смесь угарного газа и водорода называется синтез-газом.
Ответ: 312
Задача 16
Установите соответствие между процессом и технологическим приёмом/оборудованием, который(-ое) используется при осуществлении этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОЦЕСС | ТЕХНОЛОГИЧЕСКИЙ ПРИЁМ / ОБОРУДОВАНИЕ |
| А) получение олеума Б) обжиг пирита В) очистка обжигового газа |
1) циркуляционный процесс 2) циклон 3) контактный аппарат 4) принцип противотока |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: При получении олеума кислота распыляется сверху, а оксид серы (VI) поступает снизу.
Б: Обжиг пирита происходит в кипящем слое, а это принцип противотока.
В: Циклон используется для очистки газа после обжига от крупных пылинок.
Ответ: 442









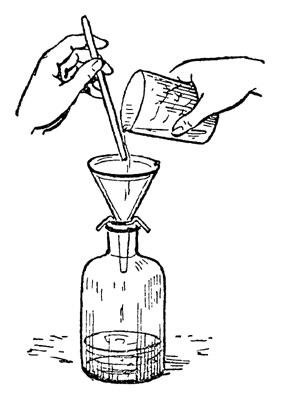

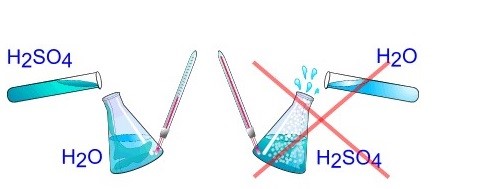




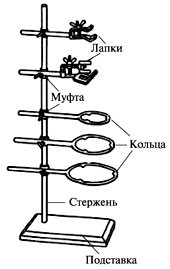




![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)




































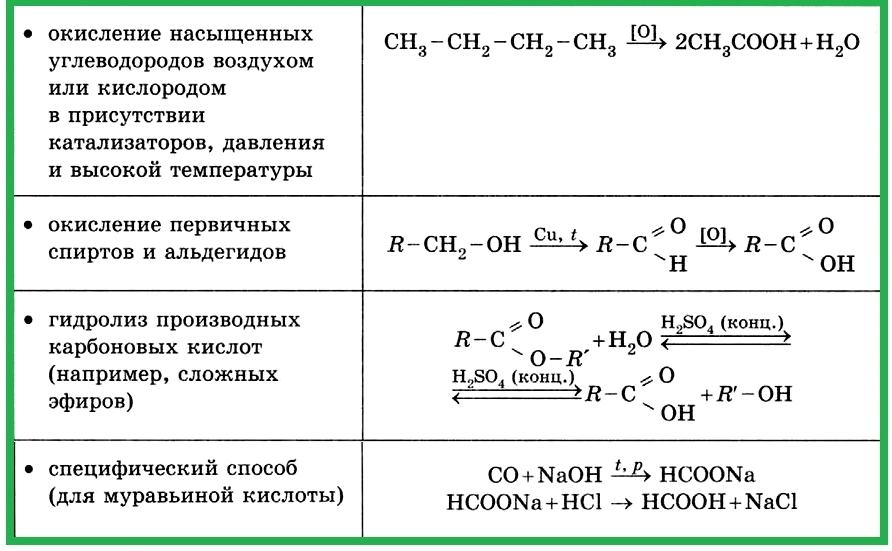














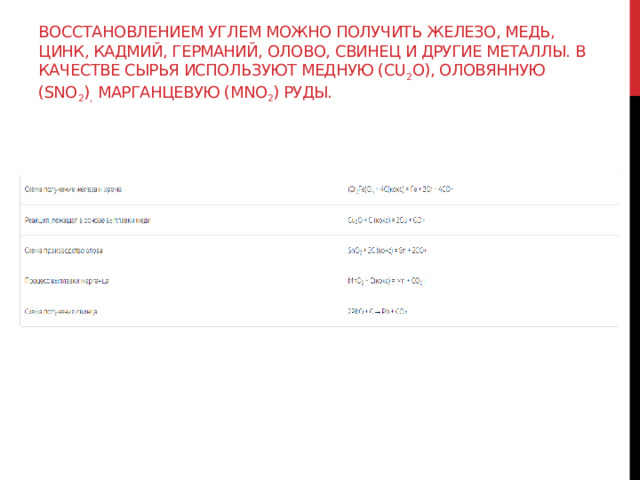

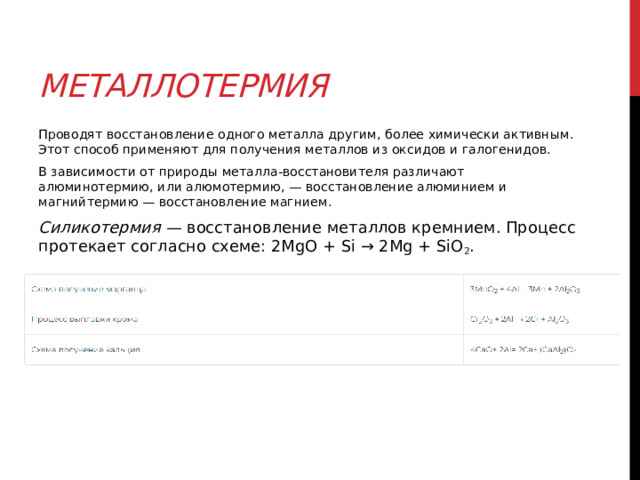




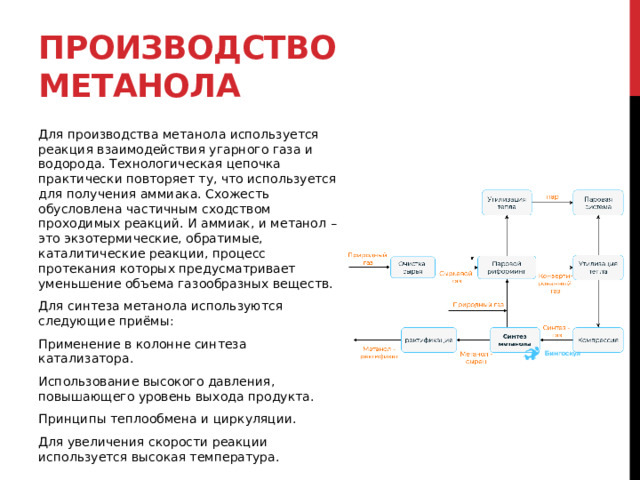

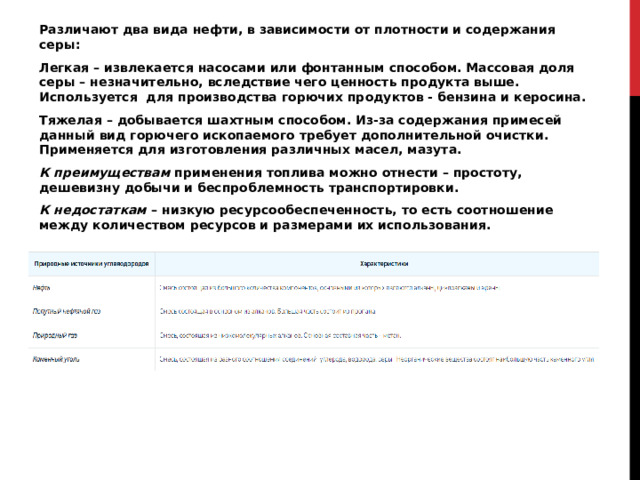








![Реакции полимеризации Реакции полимеризации заключаются в объединении большого количества низкомолекулярных соединений, количество которых определяется степенью полимеризации. Общее уравнение реакции: n X → (-X-) n Самой распространенной реакций полимеризации является реакция получения полиэтилена: nC 2 H 4 = (CH 2 – CH 2 ) n реакции полимеризации вступают непредельные соединения. Это могут быть молекулы одного мономера, либо разных. В первой ситуации реакцию называют гомополимеризацией, во второй – сополимеризацией. I. Гомополимеризация К этим реакциям относят получение полиэтилена, полипропилена поливинилхлорида и т.д. Например, получение полипропилена из пропена под действием ультрафиолетовых лучей: n CH 2 =CH-CH 3 → (CH 2 -CH(CH 3 )-) n II. Сополимеризация К этим реакциям относят получение сополимера этилена и пропилена: n CH 2 =CH 2 + n CH 2 =CH-CH 3 → [(-CH 2 -CH 2 -) x – (-CH 2 -CH(CH 3 )-) y ] n , где 1Полимеры, которые получают в результате реакций полимеризации](https://fsd.multiurok.ru/html/2022/07/17/s_62d3ba5b4efd3/img43.jpg)