Скачать материал

Скачать материал


- Курс добавлен 13.12.2022


- Сейчас обучается 40 человек из 30 регионов


- Сейчас обучается 32 человека из 20 регионов


Описание презентации по отдельным слайдам:
-
1 слайд
Современные методы и приемы по подготовке учащихся к итоговой аттестации в формате ОГЭ и ЕГЭ химии в 2020 -2021гг
Учитель химии МАОУ СОШ № 12
Попова Елена Михайловна -
2 слайд
Государственный заказ – создание условий для развития свободной, мыслящей, деятельной социально-адаптированной личности, получившей качественное общее образование
-
3 слайд
Единый государственный экзамен
2009 г –введен в штатный режим
Итоговая аттестация
Форма приема в вузы
Обязательные – русский язык и математика
С 2022 + иностранный язык -
4 слайд
Единый государственный экзамен
Мониторинг
Рособрнадзор
Федеральные эксперты
Федеральные и региональные общественные наблюдатели
Онлайн-наблюдатели -
5 слайд
Единый государственный экзамен
По результатам ЕГЭ нельзя сравнивать эффективность работы школ и учителей
На основе результатов ЕГЭ готовятся программы повышения квалификации педагогов -
6 слайд
Основной государственный экзамен
с 2014 года введен в штатный режим
1.2 млн учеников сдают ОГЭ
Ученик может продолжить обучение в школе
Ученик может поступить в учреждения СПО
Русский и математика обязательные + два по выбору -
7 слайд
Методы и приемы при подготовке к ЕГЭ и ОГЭ
Онлайн-курсы
Онлайн – тесты
Целевые сайтыОпорные конспекты
Опорные таблицы
Опорные схемы
Вебинары
Чек листы
Алгоритмы
Мемы загадки
Рабочие тетради -
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
23 слайд
5 учебных пособий, которые подходят для подготовки к ЕГЭ по химии
1. Начала химии, Н. Е. Кузьменко, В. В. Еремин, В. А. Попков
В учебном пособии, написанном профессорами химического факультета МГУ имени М. В. Ломоносова и Первого МГМУ имени И. М. Сеченова, изложены основы современной химии в объеме школьной программы углубленного уровня. Подробно рассмотрены важнейшие теоретические представления химии.2. Химия. Углублённый уровень. 10-11 класс, Дроздов А. А., Еремин В. В., Кузьменко Н. Е.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования. Учебник на первый взгляд может показаться сложным, но мне очень нравится насколько тщательно там разбирается теория.3. Новый репетитор по химии для подготовки к ЕГЭ, А. С. Егоров
Пособие содержит подробное изложение основ общей, неорганической и органической химии в объеме, соответствующем программам углубленного изучения химии в средней школе и программам для поступающих в вузы. В пособии представлены все типы расчетных задач с решениями и типовые упражнения с эталонами ответов4. Химия. 10-11 класс. Углубленный уровень., Гара Н. Н., Титова И. М., Кузнецова Н. Е.
Учебник предназначен для изучения химии на углублённом уровне. В тексты учебника включены мотивирующие вопросы, разноуровневые задания и задачи, предложены темы проектной деятельности, дано описание химического эксперимента, приведены дополнительные сведения познавательного характера.5. Пузаков, Попков, Машнина: Химия. 10 и 11 класс. Учебник. Углублённый уровень.
Учебник углублённого уровня включает основные сведения о строении атома, химической связи, межмолекулярных взаимодействиях, термодинамике, кинетике и стехиометрии химических реакций, классификации и свойствах важнейших неорганических веществ. Особое внимание уделено медико-биологическому значению химических процессов, химических элементов и их соединений.. -
-
25 слайд
Опорные конспекты
Опорный конспект — система опорных сигналов, имеющих структурную связь и представляющих собой наглядную конструкцию, замещающую систему значений, понятий, идей как взаимосвязанных элементов. -
26 слайд
Опорные конспекты
-
-
-
-
30 слайд
Обобщающие таблицы
-
-
-
-
-
-
-
37 слайд
Опорная схема — это наглядное отображение когнитивной схемы, формирование которой является целью определенного этапа обучения.
Опорные схемы -
-
-
-
-
-
-
44 слайд
Конспекты текстовые
-
-
46 слайд
Образное мышление
Мем (англ. meme) — единица культурной информации. Мемом может считаться любая идея, символ, манера или образ действия, осознанно или неосознанно передаваемые от человека к человеку посредством речи, письма, видео, ритуалов, жестов -
-
-
-
-
-
-
53 слайд
Примеры решения заданий
-
-
-
-
-
-
59 слайд
Метод стаканчиков
-
60 слайд
Задание 27
Смешали 80 г раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с массовой долей 40 %. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых. -
61 слайд
РЕШЕНИЕ
25 *80 + 40*20 = 100*X
X= 28%
-
62 слайд
Задание 28
В результате реакции, термохимическое уравнение которой
2H2+O2=2H20+482 кДж
выделилось 1479 кДж теплоты.
Вычислите массу образовавшейся при этом воды. Ответ дайте в граммах и округлите до целых. -
63 слайд
Решение
2H2+O2=2H20+482 кДжХ г (Н2О) – 1479 кДж
2моль *18 гмоль (Н2О) – 484 кДжХ =110 г
Ответ: 110 г. -
64 слайд
Задание 28
Вычислите объём газа (н. у.), который не вступит в реакцию, если сжигать 50 л водорода в 50 л кислорода. Ответ укажите в литрах с точностью до целых. -
65 слайд
Решение
2H2+O2=2H20Согласно уравнению реакции, каждые два объёма водорода реагируют с одним объёмом кислорода, и при этом получается два объёма газообразной воды.
Тогда 50 л водорода прореагируют с 25 л кислорода, а ещё 25 л кислорода не вступят в реакцию
Ответ :25 л -
66 слайд
Задание 29
Вычислите массу кислорода, необходимого для полного сжигания 6,72 л (н. у.) сероводорода. Ответ дайте в граммах с точностью до десятых.
2.При растворении серебра в разбавленной азотной кислоте выделился оксид азота(II) объёмом 3,36 л (в пересчёте на н. у.). Вычислите массу образовавшейся соли. Ответ дайте в граммах с точностью до десятых. -
67 слайд
Задание 29
3.Вычислите массу дихромата калия, который потребуется для получения 13,44 л (н. у.) хлора при взаимодействии с концентрированной соляной кислотой. Ответ дайте в граммах с точностью до десятых. -
68 слайд
Решение
1. 2Н2S + 3O2=2H2O + 2SO22. 3Ag+4HNO3 (p)=3AgNO3+NO+2H2O
3.K2Cr2O7 +14HCl=2KCl+2CrCl3+7H20+3Cl2
-
69 слайд
Алгоритм решения задания 34
file:///C:/Users/ELENA%20MIHALOVNA/Desktop/курсы%20для%20учителей/Новая%20папка/Algoritm_34_zadania.pdf -
70 слайд
Задание 35
Нахождение формулы по известному элементному составу.
По продуктам сгорания
По известной общей формуле с массовой долей одного элемента
По реакционной способности вещества -
71 слайд
Чек лист – Работа с периодической системой
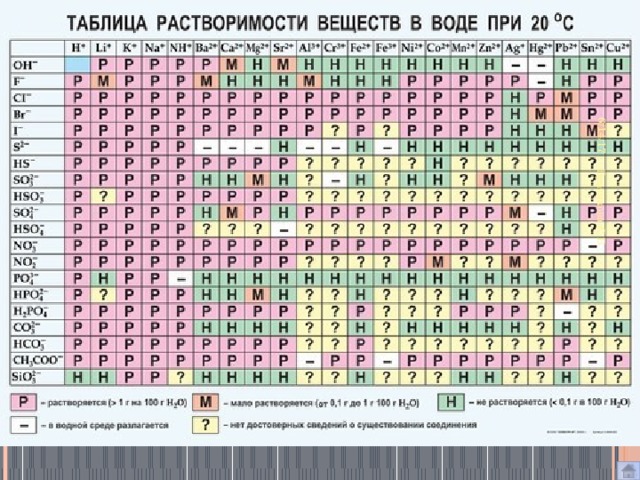
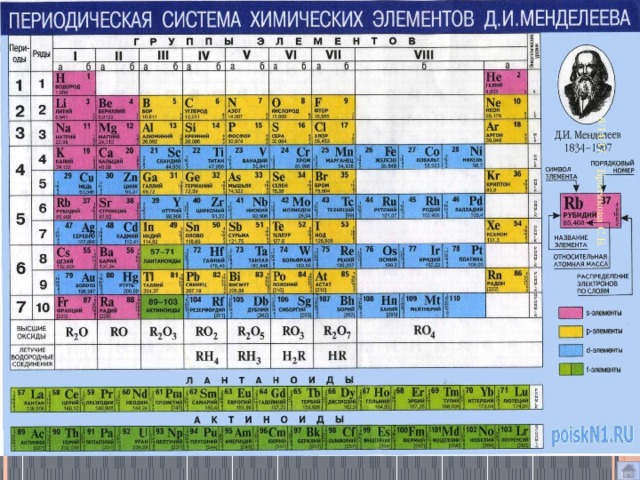
file:///C:/Users/ELENA%20MIHALOVNA/Desktop/курсы%20для%20учителей/Chek-list_Rabota_s_tablitsey_Mendeleeva-1.pdfЗадания: ОГЭ №2,4,6
ЕГЭ №1,2,3 -
72 слайд
Чек лист
«Свойства классов неорганических веществ» №6,7,8,9 (ЕГЭ) и №7-11,15,21(ОГЭ) -
-
74 слайд
Задания 7
В пробирку с раствором соли Х добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.1) KOH
2) HCl
3) Cu(NO3)2
4) K2SO3
5) Na2SiO3 -
75 слайд
Ответ: Здесь Х — K2SO3, а Y — HCl.
-
-
77 слайд
Отвтет
Здесь Х —AgNO3 , а Y —Fe . -
-
-
80 слайд
Чек листы
Чек лист — часть 2 на максимум баллов:
file:///C:/Users/ELENA%20MIHALOVNA/Desktop/курсы%20для%20учителей/чек%20лист%20вторая%20часть.pdf
-
81 слайд
Учим уравнения!!!!
file:///C:/Users/ELENA%20MIHALOVNA/Desktop/курсы%20для%20учителей/Новая%20папка/OVR_zadania_9_10_21_30_32.pdf
file:///C:/Users/ELENA%20MIHALOVNA/Desktop/курсы%20для%20учителей/Новая%20папка/8_Problemnye_reaktsii_iz_neorganiki_zadania_6-10_31_32.pdf
file:///C:/Users/ELENA%20MIHALOVNA/Desktop/курсы%20для%20учителей/Новая%20папка/5_Schelochi_zadania_7-10_14_15_17_18_31_32_33.pdf
file:///C:/Users/ELENA%20MIHALOVNA/Desktop/курсы%20для%20учителей/Новая%20папка/100_reaktsiy_OVR.pdf -
82 слайд
Учим названия!!!!!
file:///C:/Users/ELENA%20MIHALOVNA/Desktop/курсы%20для%20учителей/Новая%20папка/Trivialnye_nazvania.pdf -
83 слайд
Практическая часть в ОГЭ
23, 24 задания
Решение экспериментальных задач по теме «Неметаллы IV–VII групп и их соединений»; «Металлы и их соединения». Качественные реакции на ионы в растворе (хлорид-, иодид-, сульфат-, карбонат-, силикат-, фосфат-; ион аммония; катионы изученных металлов, а также бария, серебра, кальция, меди и железа) -
-
85 слайд
Правила работы с химическим оборудованием
3. Перед началом выполнения эксперимента осмотрите ёмкости с реактивами и продумайте способ работы с ними. При этом обратите внимание на рекомендации, которым Вы должны следовать.
3.1 В склянке находится пипетка. Это означает, что отбор жидкости и переливание её в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива.
3.2 Пипетка в склянке с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при её наклоне этикетка оказалась сверху («этикетку – в ладонь!»). Склянку медленно наклоняют над пробиркой, пока нужный объём раствора не перельётся в неё. Объём перелитого раствора должен составлять 1–2 мл (1–2 см).
3.3 Для проведения опыта требуется порошкообразное (сыпучее) вещество. Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя.
3.4 При отборе исходного реактива взят его излишек. Возврат излишка реактива в исходную ёмкость категорически запрещён. Его помещают в отдельную, резервную пробирку.
3.5 Сосуд с исходным реактивом (жидкостью или порошком) обязательно закрывается крышкой (пробкой) от этой же ёмкости.
3.6 При растворении в воде порошкообразного вещества или при перемешивании реактивов следует слегка ударять пальцем по дну пробирки.
3.7 Для определения запаха вещества следует взмахом руки над горлышком сосуда направлять на себя пары этого вещества.
3.8 Если реактив попал на рабочий стол, кожу или одежду, необходимо незамедлительно обратиться за помощью к специалисту по обеспечению лабораторных работ в аудитории -
86 слайд
Часто задаваемые вопросы Задание 33
Что необходимо знать для решения, и сколько баллов дает это задание?
Нужно ли писать условия реакции, названия веществ и стрелочки ↑, ↓?
Нужны ли коэффициенты?
Лучше писать «→» или «=» в уравнениях реакции?
Можно ли записывать неоднозначные структурные формулы (C3H7OH, C6H14 и т.д.)?
Можно ли указывать связь между анионом и катионом металла (катионом аммония)?
Нужно ли расписывать электронный баланс для органической ОВР? -
87 слайд
Ловушки на ГИА
1. Невнимательность
2. Путаница в тривиальных названиях
3. Тонкости таблицы Менделеева
4. Специфические реакции и Внезапные ОВР
5. Исключения и подвохи
6. Исключительные свойства конкретных веществ -
88 слайд
Путаница в тривиальных названиях
Анилин и аланин
Глицин и глицерин
Карболовая кислота – это фенол, а не карбоновая кислота -
89 слайд
Тонкости таблицы Менделеева
в задании 2 тебя просят расположить вещества из ряда: 1) Rb 2) Cu 3) Cr 4) Na 5) Ti в порядке увеличения радиуса атома
большинство дает ответ 352
Правильный ответ 235 -
90 слайд
Специфические реакции и внезапные ОВР
специфические реакции, которые выбиваются из общих правил:
кислотный оксид с кислотой не взаимодействуют, но
SiO2 + 4HF → SiF4 + 2H2O
оксиды не реагируют с солями, но
Na2CO3 + SiO2 → Na2SiO3 + CO2
FeCl3 + Na2S, я уверена, что в продуктах ты запишешь FeS и NaCl, но
2FeCl3 + 3Na2S → 6NaCl +2FeS + S – это ОВР -
91 слайд
Исключения и подвохи
Проскок электрона – это переход электрона с внешнего энергетического уровня на более низкий.
Cu
Cr
Ag
Au
Mo -
92 слайд
Исключения и подвохи
Валентность элементов в сложных соединениях практически всегда численно равна степени окисления этих элементов.
Ловушки экзамена!
Исключения :
ион аммония (с.о. «N» -3; валентность «N» IV);
угарный газ(с.о. «О» -2; валентность «О» III);
ион тетрафторида бора(с.о. «В» +3; валентность «В» IV) В простых веществах степень окисления и валентность не совпадают -
93 слайд
Исключения и подвохи
Разложение нитратов идет по следующим правилам:
нитрат, образованный металлом до Mg (кроме Li)
MeNO3 𝑡 → MeNO2 + O2
2. нитрат, образованный металлами от Mg до Cu + Li
MeNO3 𝑡 → MeO + NO2 + O2
3. нитрат, образованный металлом после Cu
MeNO3 𝑡 → Me + NO2 + O2Ловушки экзамена!
Исключения :
Mn(NO3)2 𝒕 → MnO2 + 2NO2
4Fe(NO3)2 𝒕 → 2Fe2O3 + 8NO2 + O2
4Fe(NO3)3 𝒕 → 2Fe2O3 + 12NO2 + 3O2 -
94 слайд
Исключения и подвохи
галогены с кислородом не реагируют, но ФТОР
2F2 + O2 = 2OF2
2F2 + C = CF4
Si + 2F2 = SiF4
Муравьиная кислота – карбоновая кислота, но проявляет некоторые свойства альдегидов -
-
Краткое описание документа:
Презентация содержит обобщение методических находок современных сайтов по подготовке к ЕГЭ и ОГЭ по химии (название сайтов, комплекс опорных конспектов, схем, таблиц, мемомов и т.д.)
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 155 062 материала в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
Другие материалы
- 09.04.2021
- 183
- 0

- 09.04.2021
- 123
- 0


- 08.04.2021
- 221
- 5
- 08.04.2021
- 147
- 0
- 08.04.2021
- 249
- 4
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Правовое обеспечение деятельности коммерческой организации и индивидуальных предпринимателей»
-
Курс повышения квалификации «Методика написания учебной и научно-исследовательской работы в школе (доклад, реферат, эссе, статья) в процессе реализации метапредметных задач ФГОС ОО»
-
Курс повышения квалификации «Основы местного самоуправления и муниципальной службы»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Организация деятельности помощника-референта руководителя со знанием иностранных языков»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс повышения квалификации «Актуальные вопросы банковской деятельности»
-
Курс профессиональной переподготовки «Организация деятельности по водоотведению и очистке сточных вод»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Курс профессиональной переподготовки «Информационная поддержка бизнес-процессов в организации»
Слайд 1
Формы и методы подготовки к ЕГЭ Ставропольский край с.Бурукшун В.А.Звада
Слайд 3
ЭТАПЫ ПОДГОТОВКИ УЧАЩИХСЯ К ЕГЭ ПО ХИМИИ №п / п Содержание этапа период 1 Формирование: интереса к предмету и мотивации его изучения; прочных базовых знаний; умений самостоятельно работать с литературой, систематически заниматься решением задач; умений работать с тестами различных типов. 8-9класс
Слайд 4
ЭТАПЫ ПОДГОТОВКИ УЧАЩИХСЯ К ЕГЭ ПО ХИМИИ №п / п Содержание этапа период 2 Углубленная подготовка группы учащихся по химии: дифференцированный подход на уроках элективные курсы индивидуальные консультации 10-11класс
Слайд 5
ЭТАПЫ ПОДГОТОВКИ УЧАЩИХСЯ К ЕГЭ ПО ХИМИИ №п / п Содержание этапа период 3 Непосредственная подготовка к экзамену: знакомство с структурой КИМ по химии, нормативными документами; выделение особо сложных тем, подбор заданий разного уровня сложности по этим темам; изучение материала по темам, при этом: — повторение теории; — самостоятельная работа с заданиями ЕГЭ, относящимися к данной теме; — разбор всего непонятого и нерешенного. 11класс
Слайд 6
СТРАТЕГИЯ РАБОТЫ НА ЭКЗАМЕНЕ Правила первого круга: Отмечай верное и пропускай сложное.(45мин.) Правила второго круга: Проверяй сделанное, отбрасывай неверное, используй «три шпаргалки» и законы химии.(95мин.) Правило третьего круга: Проверяй сделанное и угадывай ненайденное.
Слайд 7
Опыт работы позволяет мне выделить основные проблемы у учащихся при подготовке к ЕГЭ: 1.Количество часов по программе базового уровня (10 кл.-2 часа, 11 кл.-2 часа) недостаточно для успешной сдачи ЕГЭ. 2. Трудности при проведении практической части (реактивы, оборудование не все имеются в достаточном количестве). 3.Учащиеся, выбравшие химию для сдачи в форме ЕГЭ, имеют разный уровень подготовки. 4.Технические ошибки при заполнении КИМов . 5. Нерациональное распределение времени при выполнении заданий. 6. Слабые или недостаточные знания по математике и физике.
Слайд 11
Индивидуальное календарно-тематическое планирование (Мамедова М.)
Слайд 14
Совет 1. Освойте химический язык. Фосфат, нитрат, вольфрамат . Что у них общего? Чем сульфат отличается от сульфида? А перманганат – от манганата ? Правила составления формул и названий в химии — универсальны. Каждый суффикс или префикс соответствует определенной формуле. Зная этот язык, вы по названию определите класс вещества и сможете описать его свойства.
Слайд 15
Совет 2. Три главные таблицы – ваши официальные шпаргалки на экзамене. На экзамене по химии выдаётся три справочных таблицы: таблица Менделеева таблица растворимости ряд активности металлов 70% всей химической информации можно получить из этих таблиц, если уметь ими пользоваться.
Слайд 17
Совет 3. Подтяните математику. Если у вас не получаются задачи по химии – возможно, проблема с математикой? Задачи на проценты, сплавы, растворы отработайте до совершенства.
Слайд 18
Совет 4. Ничего не принимайте на веру. Задавайте вопросы.
Слайд 19
Совет 5. Считаю одним из важнейших. Уделяй повторению теоретического материала каждый день 20-30 минут. Помни! Не зубрить, а именно читать, осмысленно анализировать. Чередуй чтение с выполнением тестовых, демонстрационных вариантов. Выбирай для этого время, когда тебе ничто не мешает сосредоточиться.
Слайд 20
Самое главное при подготовке к ЕГЭ чтобы дети заранее осознали, что это обыкновенная процедура, почувствовали уверенность в своих силах и по достоинству оценили свой уровень знаний. И мы с вами, коллеги, никогда не должны забывать о психологическом аспекте проблемы подготовки к ЕГЭ. И настраивать своих учеников на положительный результат, развеивать их страхи, учить сохранять эмоциональное равновесие и сосредотачиваться даже в условиях стресса.
Слайд 21
Ведь жизнь не заканчивается экзаменом. И будущее в их собственных руках.
1
Система подготовки к ЕГЭ по химии
2
Единый государственный экзамен является итогом всего школьного курса химии. Подготовка к нему – это задача не 2-3 месяцев, не последнего года или даже двух. Такая подготовка должна вестись системно, на протяжении всего процесса обучения химии в школе.
3
ЭТАПЫ ПОДГОТОВКИ УЧАЩИХСЯ К ЕГЭ ПО ХИМИИ п/пп/п Содержание этапа период 1 Формирование: интереса к предмету и мотивации его изучения; прочных базовых знаний; умений самостоятельно работать с литературой, систематически заниматься решением задач; умений работать с тестами различных типов. 8-9класс
4
ЭТАПЫ ПОДГОТОВКИ УЧАЩИХСЯ К ЕГЭ ПО ХИМИИ п/пп/п Содержание этапа период 2 Профильная ориентация учащихся Определение круга предметов, по которым необходима подготовка к ГИА и ЕГЭ Формирование группы учащихся, которым необходима подготовка к ГИА и ЕГЭ по химии 9-10класс
5
ЭТАПЫ ПОДГОТОВКИ УЧАЩИХСЯ К ЕГЭ ПО ХИМИИ п/пп/п Содержание этапа период 3 Углубленная подготовка группы учащихся по химии: дифференцированный подход на уроках элективные курсы индивидуальные консультации класс
6
ЭТАПЫ ПОДГОТОВКИ УЧАЩИХСЯ К ЕГЭ ПО ХИМИИ п/пп/п Содержание этапа период 4 Непосредственная подготовка к экзамену: знакомство с структурой КИМ по химии, нормативными документами; выделение особо сложных тем, подбор заданий разного уровня сложности по этим темам; изучение материала по темам, при этом: — повторение теории; — самостоятельная работа с заданиями ЕГЭ, относящимися к данной теме; — разбор всего непонятого и нерешенного класс
7
ЭТАПЫ ПОДГОТОВКИ УЧАЩИХСЯ К ЕГЭ ПО ХИМИИ п/пп/п Содержание этапа период 5 Тренировка в форме и по материалам ЕГЭ Пробное тестирование Формирование умений распределения времени и работы с бланками 11класс
8
План подготовки к ЕГЭ по химии 1.Объяснение учащимся целей ЕГЭ: 1. Оценить знания учащихся по предмету за курс полной средней школы; 2.Объяснение нормативной базы ЕГЭ по химии, структуры тестов и типы проверочных заданий (сентябрь). 3.Повторение изученного материала в школьном курсе (сентябрь-февраль). 4.Базовые темы для повторения. 5.Периодический закон и строение атома 6.Строение вещества 7.Классификация неорганических веществ. Свойства веществ различных классов 8.Многообразие органических веществ 9.Химические свойства и способы получения органических веществ 10.Химические реакции 11.Промышленное получение веществ и охрана окружающей среды 12.Расчетные задачи. 13.Работа на элективных курсах «Подготовка к ЕГЭ по химии. 11 класс», «Решение расчетных задач» (в течение года). 14.Использование интернет-технологий и предоставление возможности выпускникам работать с образовательными сайтами: mioo.ru, ege.edu.ru, rustest.ru, ed.gov.ru. Работа с демонстрационными версиями ЕГЭ, кодификаторами и спецификацией тестов по химии. Заполнение бланков (в течение года). 15.Проведение диагностических контрольных работ в формате ЕГЭ в системе СтатГрад (апрель, май) и анализ ошибок каждого учащегося.
9
РАБОТА С РОДИТЕЛЯМИ Целью работы: осознание определенной их частью того факта, что для реализации жизненных целей их детьми им необходима углубленная естественнонаучная подготовка. Федеральный стандарт базового уровня не предусматривает своей целью подготовки учащихся к поступлению в вуз по данному направлению. Ученик, выбирающий этот экзамен, должен планировать большой объем самостоятельной работы по предмету. Обратить внимание родителей на роль их помощи в подготовке своих детей. Учитель должен рассказать и о той помощи, какую он способен оказать ученикам в их работе (материалы, консультации).
10
ДИФФЕРЕНЦИРОВАННЫЙ ПОДХОД НА УРОКАХ Подготовка к ЕГЭ небольшой группы учащихся. Учитель должен подготовить задания более высокого уровня, задания в формате ЕГЭ. Учитель предлагает дополнительное свободное домашнее задание. Привлечение этих учеников в качестве помощников учителя, тьюторов при организации взаимообучения и взаимоконтроля в учебном процессе.
11
САМОСТОЯТЕЛЬНАЯ РАБОТА УЧАЩИХСЯ Часть тестов для самостоятельной работы может даваться ученикам с готовыми ответами. Выполняя такие тесты, ученик сверяет свои ответы с «ключом», отмечает допущенные ошибки. Затем он должен проанализировать их. Особым значком отмечаются ошибки, допущенные по невнимательности, особым – те, которые удалось исправить с помощью пособия, особым – те, которые ученик не смог понять. Результаты этого разбора ученик показывает учителю на собеседованиях-консультациях или в любое удобное время. Могут быть и контрольные тесты, которые проверяются непосредственно на консультациях.
12
Для подготовки к ЕГЭ используются разнообразные методические пособия, но приоритет следует отдать тем пособиям, которые выпущены под редакцией Корощенко,Снастиной, Добротина, Кавериной, выпущенные под знаком ФИПИ.
13
Предлагаемый в этих пособиях материал может быть с успехом применн для контроля, изучения и повторения школьного курса химии. Постановка вопросов в тестовых заданиях соответствует таковой в КИМах. В данных пособии предложены тренировочные задания с ответами, методическими рекомендациями. Даны алгоритмы решения заданий всех типов.
14
Известно, что готовиться к ЕГЭ школьник начинает в основном за год до проведения экзамена, в лучшем случае за два. Не секрет, что бывают даже случаи, что, к сожалению, не редкость, когда ученики и их родители «хватаются за голову» за месяц до экзамена. Смена экзамена напрямую связана с проблемой выбора вуза. В такой непростой ситуации, когда «поджимает» время, а знания подопечного фактически нулевые, необходимо грамотно организовать учебно-познавательную деятельность ребёнка. Кроме того, нужно уметь выбрать из содержания учебного предмета важные, ключевые моменты, на которых заостряется внимание составителей КИМ. Целью нашей группы было изучение именно данной ситуации, рекомендации по интенсивной структуре подготовки «перебежчиков». В зависимости от уровня подготовки, проверка которого осуществляется на первом занятии, для каждого учащегося составляется индивидуальный учебный план. Обучение осуществляется по индивидуальным образовательным траекториям. Содержание учебной дисциплины при этом сгруппировано в несколько блоков.
15
По химии: Химический элемент. Вещество. Химическая реакция. Познание и применения веществ и химических реакций. Исходя из строгой структуры содержания, становится возможной подготовка к частям А и В (для учащихся с низким уровнем подготовки и большими пробелами в знаниях); подготовка к части С (для тех, кто отлично справился с подготовкой к частям A и В); Отметим, что подготовка по блокам содержания носит вариативный характер. То есть, для конкретных целей и для конкретных школьников можно блоки «переставлять местами». Подготовку к экзамену по химии со школьниками с низким и средним уровнями подготовки целесообразнее начинать с тем «Основные понятия химии. Номенклатура неорганических и органических веществ». С сильными школьниками, при этом, лучше идти дедуктивным путём, т.е. начинать повторение с тем «Строение атома. Химическая связь».
16
Отметим, что в настоящий момент у подавляющего большинства школьников слабые знания по разделу «Органическая химия», что вполне может быть связано с переходом на концентрическую систему построения школьных программ, т.е. часть материала этого раздела изучается в 9 классе, а углубляются знания в 10 классе. У учащихся в голове возникает, не побоимся этого слова, «каша». Поэтому начинать подготовку к этому разделу лучше всего с «белого листа» и обратить на него особое внимание. Особое внимание в химии следует уделить также решению расчётных задач и упражнений по типу «цепочки превращений». «Цепочки превращений» хороши, тем, что с их помощью в короткие сроки можно изучить довольно большое число химических реакций. И не только изучить, но и закрепить полученные знания. Что еще может использовать для интенсификации курса подготовки к ЕГЭ? В настоящее время интенсивно развивается дистанционная форма обучения школьников. И будет, по крайней мере, неразумно не воспользоваться её достижениями в практике подготовки к ЕГЭ. Дальнейший этап работы нашей группы – разработка дистанционных курсов по разным предметам. А сей час мы даем подробные рекомендации об использовании Интернет – сайтов.
17
Часть содержания учебного материала (относительно простые темы, тесты, домашнее задание и т.д.) переносится на дистанционную форму. На очных занятиях при этом внимание уделяется только сложным теоретическим вопросам. Колоссальная часть ценного учебного времени высвобождается. Ученик уже не может относиться к домашним заданиям халатно, или попросту их не выполнять. Он прекрасно знает, что любое его действие, любой шаг, любое задание будут преподавателем проверены и оценены. Родители, так же как и учитель могут контролировать работу ребёнка. Бывают случаи, когда ученик заболел, ну что делать, с кем не случается. В этой ситуации так же занятия можно проводить в дистанционной форме, не теряя времени.
18
ОСОБЕННОСТИ ПОДГОТОВКИ СИЛЬНЫХ УЧЕНИКОВ Целью подготовки к ЕГЭ для сильных учеников является овладение навыками выполнения наиболее сложных заданий части С. Однако они должны регулярно тренировать себя на выполнении заданий части А и В. При этом перед ними ставятся задачи: а) свести к минимуму ошибки, допускаемые по невнимательности; б) выявить те темы курса химии, где ошибки допускаются по незнанию, изучить эти разделы, отработать полученные знания на тематических тестах.
19
ПОДГОТОВКА СЛАБЫХ И СРЕДНИХ УЧЕНИКОВ Ориентирована на успешную сдачу ЕГЭ как минимум на удовлетворительную отметку. Для этого достаточно уверенного выполнения части А контрольно-измерительных материалов (30 первичных баллов, которые можно набрать в части А, примерно соответствуют 50 баллам по шкале ЕГЭ). Подготовку надо вести по самым характерным свойствам веществ, наиболее распространенным типам реакций, самым простым и чаще всего используемым алгоритмам решения задач.
20
СТРАТЕГИЯ РАБОТЫ НА ЭКЗАМЕНЕ Правила первого круга: Отмечай верное и пропускай сложное.(45мин.) Правила второго круга: Проверяй сделанное, отбрасывай неверное, используй «три шпаргалки» и законы химии.(95мин.) Правило третьего круга: Проверяй сделанное и угадывай ненайденное.
21
22
23
24
25
Подготовка к ЕГЭ по химии
Работу выполнила учащаяся 11 «а» класса
МБОУ СОШ №26 Козина Лариса.
Руководитель: Алексеева Лариса Александровна
Цели:
- Ознакомиться с материалом экзаменационной работы по химии.
- Проверить свою подготовленность к экзамену.
- Расширить опыт выполнения тестовых заданий по химии
В презентации представлены задания из трех частей:
В презентации представлены задания из трех частей:
- часть «А» в виде тестов – 28 заданий с одним правильным ответом;
- часть «В» – 9 заданий (В1-6 — с выбором 4 цифр – цифры могут повторяться, В7-9- с выбором трех последовательных цифр
- часть «С» – 5 заданий с развернутым ответом.
Чтобы выбрать правильный ответ на вопрос части А1-28 наведите курсор на выбираемый ответ и кликните на левую кнопку мышки, при правильном ответе появится слово «Верно», при неправильном — «Неверно»
Ответы и решения заданий части С1 – С5 появятся по щелчку
Инструкции и рекомендации:
ТР
ТМ
Таблица Менделеева
Таблица растворимости
Неверно
Неверно
Неверно
Верно
1) верны оба суждения
2) обы суждения неверны
4) верно только А
3) верно только Б
25. Верны ли следующие суждения о синтезе метанола и аммиака в промышленности?
А. Реакции синтеза метанола и аммиака экзотермические.
Б. В производстве метанола и аммиака применяется циркуляционный
ТМ
ТР
Верно
Неверно
Неверно
Неверно
4) 8,4 г
2) 4,2 г
1) 2,8 г
3) 5,6 г
26. Какую массу оксида кальция необходимо взять для приготовления 200 г раствора гидроксида кальция с массовой долей 3,7%?
ТМ
ТР
Верно
Неверно
Неверно
Неверно
4) 5,6 л
2) 22,4 л
1) 33,6 л
3) 11,2 л
27. В результате реакции, термохимическое уравнение которой
2С2Н2 +5О2 = 4СО2 + 2Н2О + 2610 кДж.
Выделилось 652,5 кДж теплоты.
Объем сгоревшего ацетилена равен
ТМ
Неверно
Неверно
Неверно
Верно
1) 50
2) 40
4) 60
3) 30
28. Сколько литров кислорода потребуется для каталитического окисления 100 л оксида серы (IV) до оксида серы (VI)? Объёмы газов измерены при одинаковых условиях
B1. Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит
классы соединений
- 1) алкен
- 2) одноатомный спирт
- 3) многоатомный спирт
- 4) простой эфир
- 5) сложный эфир
название вещества
- А) CH3OCH3
- Б) HOCH2CH2CH3
- В) HCOOCH2CH3
- Г) CH3C(OH)2CH3
Неверно
Верно
Неверно
Неверно
4) 4352
2) 1523
3) 4253
1) 2351
B2. Установите соответствие между названием вещества и степенью окисления углерода
вещества степень окисления С
А) метанол 1) –4
Б) метановая кислота 2) –3
В) метан 3) –2
Г) этан 4) 0
5) +2
6) +4
Неверно
Верно
Неверно
Неверно
4) 4352
2) 1523
1) 3512
3) 2351
ТМ
B3. Установите соответствие между веществом и продуктом на аноде при электролизе его раствора
формула соли продукт на аноде
А) Na2CO3 1) H2S
Б) Na2S 2) Cu
В) NaNO3 3) O2
Г) CuCl2 4) Cl2
5) S
6) CO2
Неверно
Верно
Неверно
Неверно
4) 1452
1) 1423
2) 3534
3) 3351
ТР
B4. Установите соответствие между формулой соли и её способностью к гидролизу.
формула соли
1)Al2S3
2)K2SO3
3)CrCl3
4)K2SO4
Неверно
Верно
Неверно
Неверно
4) 1412
1) 1213
2) 3214
3) 3141
отношение к гидролизу
1)по катиону
2)по аниону
3)по катиону и аниону
4)гидролизу не подвергается
ТР
B5. Установите соответствие между реагентом и продуктом реакции
Реагенты
А) СО2 + Н2О
Б) СО2 + СаО
В) СО2 + Са(ОН)2
Г) СО2(из6ыток) + Са(ОН)2
Неверно
Верно
Неверно
Неверно
4) 6123
1) 1213
2) 6234
3) 1241
Продукты
1) СаСО3
2) СаСО3 + Н2О
3) Са(НСО3)2
4) Са(НСО3)2+ Н2О
5) СО + Н2
6) Н2CO3
ТР
Вещества Реактив
B6. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества:
ТМ
Вещества Реактив
А) бутанон-2 и этанол 1) HCl (р-р)
Б)гексен-1 и этилформиат 2) FeCl3 (водн)
В)анилин и фенол 3) Br2 (водн.)
Г)бензол и анилин 4) Na
5) HNO3
Неверно
Верно
Неверно
Неверно
4) 4323
1) 4364
2) 2561
3) 1453
B7. Как для бензола, так и для стирола характерны
Неверно
Верно
Неверно
Неверно
4) 135
1) 236
2) 134
3) 145
1) наличие в молекуле сопряженной электронной системы
2) sp3-гибридизация атомов углерода
3) взаимодействие с водородом в присутствии катализатора
4) обесцвечивание бромной воды
5) горючесть
6) хорошая растворимость в воде
B8. Метанол вступает в реакции с
Неверно
Верно
Неверно
Неверно
4) 456
1) 235
2) 156
3) 146
- CH3COOH
- NaOH
- Ag2O(NH3)
- Br2(H2O)
- KMnO4(H+)
- Na
B9. И анилин, и диметиламин реагируют с
Неверно
Верно
Неверно
Неверно
4) 234
1) 136
2) 256
3) 145
1) водой
2) бромэтаном
3) серной кислотой
4) бромоводородом
5) гидроксидом натрия
6) раствором перманганата калия
C1. Используя метод электронного баланса, составьте уравнение реакции:
NaNO2+NaI+…=NO+…+Na2SO4+…
Определите окислитель и восстановитель.
Ответ: 2NaNO2+2NaI+2H2SO4=2NO+I2+2Na2SO4+2H2O
N+3 + e- -> N+2 окислитель
2I- + 2e- -> I2 восстановитель
C2. Медь растворили в концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия.
Выпавший голубой осадок отфильтровали и прокалили. Затем, полученное вещество прокалили с углём.
Напишите уравнения четырёх описанных реакций.
Ответ: 1) Сu+2H2SO4 конц. = CuSO4 + SO2 + 2H2O
2) CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
3) Cu(OH)2 = CuO + H2O
4) 2CuO + C = 2Cu + CO2
C3. Напишите уравнения реакций, с помощью которых можно осуществить
следующие превращения.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
2CH4 → C2H2 + 3H2
3C2H2 →C6H6
C6H6 +Br2 → C6H5Br + HBr
C6H5Br + 3NH3 → C6H2Br(NH2)3 + 3H2
Х1 CH4 метан; Х2 CH4 ацетилен; Х3 C6H6 бензол;
Х4 C6H5Br бромбензол; X5 C6H2Br(NH2)3 1-бром-2,4,6-триаминбензол
(+H2O) 15000С Сакт. t0 (+Br2), AlBr3 (+NH3), t0, p
Al4C3 → Х1 → Х2 → Х 3 → Х4 → X5
C4. Сероводород, выделившийся при взаимодействии избытка концентрированной серной кислоты с 1,44 г магния, пропустили через 160 г 1,5%-ного раствора брома. Определите массу выпавшего при этом осадка
1) 5H2SO4конц. + 4Mg = 4MgSO4 + H2S + 4H2O
Br2 + H2S = 2HBr + S
2) n(Mg ) = 1,44/ 24 = 0,06 (моль)
n(H2S)=0,015 (моль)
n(Br2) = 160⋅0,015/160=0,015 (моль) (оба вещества реагируют полностью)
3)n(H2S)=n(Br2)=n(S)=0,015 (моль)
m(S)=32г/моль 0,015 моль=0,48г
Ответ: масса осадка = 0,48 г.
C5. При взаимодействии 11,6 г предельного альдегида с избытком гидроксида меди (II) при нагревании образовался осадок массой 28,8 г. Выведите молекулярную формулу альдегида.
1) СnH2nO + Cu(OH)2 = СnH2n+1O2 + H2O + Cu2O
2) n(Cu2O) = 28,8/144= 0,2 (моль)
n(Cu2O) = n(СnH2nO) = 0,2 моль
М(СnH2nO) = 11,6/0,2 = 58 г/моль
3)М(СnH2nO) = 12n + 2n + 16 = 58
14n + 16 = 58
14n = 42
n = 3
Молекулярная формула – C3H6O — пропаналь
х
Литература:
1. Открытый банк заданий ЕГЭ
http://www.fipi.ru/os11/xmodules/qprint/afrms.php?proj
=
2.
http://chem.reshuege.ru/test?theme=20
3.
http://www.otbet.ru/ege/demo-varianty-ege/demo-himiya/
4. О.С. Габриелян. Химия 10 класс. Дрофа. М. 2012
5. О.С. Габриелян. Химия 11 класс. Дрофа. М. 2012
6. Шаблон Алексеевой Л.А.
6/14/17
Братякова С.Б.
Подготовка к ЕГЭ по химии Задания часть 1, часть 2
6/14/17
Братякова С.Б.
Цели:
- Ознакомиться с материалом экзаменационной работы по химии.
- Проверить свою подготовленность к экзамену.
- Расширить опыт выполнения тестовых заданий по химии
6/14/17
Братякова С.Б.
Инструкции и рекомендации:
В презентации представлены задания из двух частей:
- Чтобы выбрать правильный ответ на вопрос части 1 наведите курсор на выбираемый ответ и кликните на левую кнопку мышки, при правильном ответе появится слово «Верно», при неправильном — «Неверно»
Ответы и решения заданий части 2 появятся по щелчку
ТМ
Таблица Менделеева
Таблица растворимости
ТР
6/14/17
Братякова С.Б.
Верны ли следующие суждения о синтезе метанола и аммиака в промышленности?
А. Реакции синтеза метанола и аммиака экзотермические. Б. В производстве метанола и аммиака применяется циркуляционный
1) верны оба суждения
Верно
2) обы суждения неверны
Неверно
3) верно только Б
Неверно
ТМ
4) верно только А
Неверно
ТР
6/14/17
Братякова С.Б.
Какую массу оксида кальция необходимо взять для приготовления 200 г раствора гидроксида кальция с массовой долей 3,7%?
1) 2,8 г
Неверно
2) 4,2 г
Неверно
Верно
3) 5,6 г
ТМ
ТР
4) 8,4 г
Неверно
6/14/17
Братякова С.Б.
В результате реакции, термохимическое уравнение которой
2С 2 Н 2 +5О 2 = 4СО 2 + 2Н 2 О + 2610 кДж.
Выделилось 652,5 кДж теплоты.
Объем сгоревшего ацетилена равен
1) 33,6 л
Неверно
2) 22,4 л
Неверно
ТМ
Верно
3) 11,2 л
4) 5,6 л
Неверно
6/14/17
Братякова С.Б.
Сколько литров кислорода потребуется для каталитического окисления 100 л оксида серы (IV) до оксида серы (VI)? Объёмы газов измерены при одинаковых условиях
1) 50
Верно
2) 40
Неверно
3) 30
Неверно
4) 60
Неверно
Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит
6/14/17
Братякова С.Б.
название вещества
классы соединений
- А) CH 3 OCH 3
- Б) HOCH 2 CH 2 CH 3
- В) HCOOCH 2 CH 3
- Г) CH 3 C(OH) 2 CH 3
- 1) алкен
- 2) одноатомный спирт
- 3) многоатомный спирт
- 4) простой эфир
- 5) сложный эфир
Неверно
Верно
Неверно
4) 4352
2) 1523
Неверно
3) 4253
1) 2351
Установите соответствие между названием вещества и степенью окисления углерода
6/14/17
Братякова С.Б.
вещества степень окисления С
А) метанол 1) –4
Б) метановая кислота 2) –3
В) метан 3) –2
Г) этан 4) 0
5) +2
6) +4
ТМ
2) 1523
Неверно
4) 4352
Неверно
Неверно
Верно
1) 3512
3) 2351
Установите соответствие между веществом и продуктом на аноде при электролизе его раствора
6/14/17
Братякова С.Б.
формула соли продукт на аноде
А) Na 2 CO 3 1) H 2 S
Б) Na 2 S 2) Cu
В) NaNO 3 3) O 2
Г) CuCl 2 4) Cl 2
5) S
6) CO 2
ТР
Неверно
4) 1452
Верно
Неверно
1) 1423
2) 3534
3) 3351
Неверно
Установите соответствие между формулой соли и её способностью к гидролизу.
6/14/17
Братякова С.Б.
отношение к гидролизу
1)по катиону
формула соли
1)Al 2 S 3
2)по аниону
3)по катиону и аниону
2)K 2 SO 3
4)гидролизу не подвергается
3)CrCl 3
4)K 2 SO 4
ТР
Неверно
Верно
Неверно
4) 1412
3) 3141
2) 3214
Неверно
1) 1213
Установите соответствие между реагентом и продуктом реакции
6/14/17
Братякова С.Б.
Продукты
1) СаСО 3
2) СаСО 3 + Н 2 О
3) Са(НСО 3 ) 2
4) Са(НСО 3 ) 2 + Н 2 О
5) СО + Н 2
6) Н 2 CO 3
Реагенты
А) СО 2 + Н 2 О
Б) СО 2 + СаО
В) СО 2 + Са(ОН) 2
Г) СО 2 (из6ыток) + Са(ОН) 2
ТР
Неверно
3) 1241
1) 1213
4) 6123
Неверно
Неверно
Верно
2) 6234
6/14/17
Братякова С.Б.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества:
Вещества Реактив
А) бутанон-2 и этанол 1) HCl (р-р)
Б)гексен-1 и этилформиат 2) FeCl 3 (водн)
В)анилин и фенол 3) Br 2 (водн.)
Г)бензол и анилин 4) Na
5) HNO 3
ТМ
Неверно
Верно
Неверно
Неверно
4) 4323
1) 4364
2) 2561
3) 1453
Как для бензола, так и для стирола характерны
6/14/17
Братякова С.Б.
1) наличие в молекуле сопряженной электронной системы
2) sp 3 -гибридизация атомов углерода
3) взаимодействие с водородом в присутствии катализатора
4) обесцвечивание бромной воды
5) горючесть
6) хорошая растворимость в воде
Неверно
4) 135
1) 236
2) 134
3) 145
Неверно
Верно
Неверно
Метанол вступает в реакции с
6/14/17
Братякова С.Б.
- CH 3 COOH
- NaOH
- Ag 2 O(NH 3 )
- Br 2 (H 2 O)
- KMnO 4 (H+)
- Na
Неверно
Верно
Неверно
4) 456
Неверно
1) 235
2) 156
3) 146
И анилин, и диметиламин реагируют с
6/14/17
Братякова С.Б.
1 ) водой
2) бромэтаном
3) серной кислотой
4) бромоводородом
5) гидроксидом натрия
6) раствором перманганата калия
Неверно
4) 234
1) 136
2) 256
3) 145
Неверно
Верно
Неверно

6/14/17
Братякова С.Б.
30. Используя метод электронного баланса, составьте уравнение реакции:
NaNO 2 +NaI+…=NO+…+Na 2 SO 4 +…
Определите окислитель и восстановитель.
Ответ: 2NaNO 2 +2NaI+2H 2 SO 4 =2NO+I 2 +2Na 2 SO 4 +2H 2 O
N +3 + e — — N +2 окислитель
2I — + 2e — — I 2 восстановитель
31. Медь растворили в концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия.
Выпавший голубой осадок отфильтровали и прокалили. Затем, полученное вещество прокалили с углём.
Напишите уравнения четырёх описанных реакций .
6/14/17
Братякова С.Б.
Ответ: 1) Сu+2H 2 SO 4 конц. = CuSO 4 + SO 2 + 2H 2 O
2) CuSO 4 + 2NaOH = Na 2 SO 4 + Cu(OH) 2
3) Cu(OH) 2 = CuO + H 2 O
4) 2CuO + C = 2Cu + CO 2
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения .
6/14/17
Братякова С.Б.
(+H 2 O) 1500 0 С Сакт. t 0 (+Br 2 ), AlBr 3 (+NH 3 ), t 0 , p
Al 4 C 3 → Х 1 → Х 2 → Х 3 → Х 4 → X 5
Al 4 C 3 + 12H 2 O → 3CH 4 + 4Al(OH) 3
2CH 4 → C 2 H 2 + 3H 2
3C 2 H 2 →C 6 H 6
C 6 H 6 +Br 2 → C 6 H 5 Br + HBr
C 6 H 5 Br + 3NH 3 → C 6 H 2 Br(NH 2 ) 3 + 3H 2
33. Сероводород, выделившийся при взаимодействии избытка концентрированной серной кислоты с 1,44 г магния, пропустили через 160 г 1,5%-ного раствора брома. Определите массу выпавшего при этом осадка
6/14/17
Братякова С.Б.
1) 5H 2 SO 4конц. + 4Mg = 4MgSO 4 + H 2 S + 4H 2 O
Br 2 + H 2 S = 2HBr + S
2) n(Mg ) = 1,44/ 24 = 0,06 (моль)
n(H 2 S)=0,015 (моль)
n(Br 2 ) = 160⋅0,015/160=0,015 (моль) (оба вещества реагируют полностью)
3)n(H 2 S)=n(Br 2 )=n(S)=0,015 (моль)
m(S)=32г/моль 0,015 моль=0,48г
Ответ: масса осадка = 0,48 г.
34. При взаимодействии 11,6 г предельного альдегида с избытком гидроксида меди (II) при нагревании образовался осадок массой 28,8 г. Выведите молекулярную формулу альдегида. Запишите структурную формулу и уравнение реакции
6/14/17
Братякова С.Б.
1) С n H 2n O + Cu(OH) 2 = С n H 2n+1 O 2 + H 2 O + Cu 2 O
2) n(Cu 2 O) = 28,8/144= 0,2 (моль)
n(Cu 2 O) = n(С n H 2n O) = 0,2 моль
М(С n H 2n O) = 11,6/0,2 = 58 г/моль
3)М(С n H 2n O) = 12n + 2n + 16 = 58
14n + 16 = 58 , 14n = 42 , n = 3
Молекулярная формула – C 3 H 6 O — пропаналь
6/14/17
Братякова С.Б.
6/14/17
Братякова С.Б.
х
6/14/17
Братякова С.Б.
Литература:
1 . Открытый банк заданий ЕГЭ http://www.fipi.ru/os11/xmodules/qprint/afrms.php?proj =
2. http://chem.reshuege.ru/test?theme=20
3. http://www.otbet.ru/ege/demo-varianty-ege/demo-himiya/
4. О.С. Габриелян. Химия 10 класс. Дрофа. М. 2012
5. О.С. Габриелян. Химия 11 класс. Дрофа. М. 2012
6. Шаблон Алексеевой Л.А.
1. Рекомендации по подготовке учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Стаханова Светлана Владленовна,
к.х.н., доцент НИТУ «МИСиС», член ФКР КИМ ЕГЭ по химии,
[email protected]
Свириденкова Наталья Васильевна,
к.х.н., доцент НИТУ «МИСиС», член ФКР КИМ ЕГЭ по химии,
[email protected]
11 апреля 2019 г.
2.
ПЛАН ВЕБИНАРА:
1. Общие рекомендации по планированию подготовки
учащихся к ЕГЭ по химии.
2. Рекомендации по подготовке учащихся к
выполнению некоторых заданий тематических блоков
«Строение вещества» и «Неорганическая химия».
3. Коротко задачах 27, 28, 29, 34.
4. Рекомендации по подготовке учащихся к
выполнению некоторых заданий тематических блоков
«Органическая химия» и «Химическая реакция.
Методы познания в химии».
5. О задачах 35.
3.
Важная информация о ЕГЭ
Записи вебинаров
Вебинар МГУ 29 августа 2018 г:
https://www.youtube.com/watch?v=AX1iOh9UCp0
информация о наиболее сложных заданиях 1-ой части работы
Вебинар издательства «Просвещение»:
https://www.youtube.com/watch?v=tQynD4W-FkY
Подробно о заданиях 30 и 31
4.
Важная информация о ЕГЭ
www.fipi.ru
5.
Важная информация о ЕГЭ
www.fipi.ru
• Видеоконсультации — в разделе «Для выпускников»
6.
Важная информация о ЕГЭ
www.fipi.ru
• Информация о правилах оценивания и требованиях к
оформлению заданий 2-ой части работы – в разделе
«Для предметных комиссий субъектов РФ»
7.
Каких заданий не бывает на ЕГЭ по химии и почему
1. В на стоящее время содержание КИМ ЕГЭ базируется на
требованиях Федерального компонента государственного
образовательного стандарта среднего (полного) и основного общего
образования (приказ Минобразования РФ от 05.03.2004 г.).
Действующим стандартом не предусмотрено изучение,
например, магнийорганического синтеза, молярной
концентрации растворов, константы равновесия, водородного
показателя, произведения растворимости и т.п.
2. Некоторые темы школьного курса являются обязательными для
изучения, но не выносятся как проверяемый элемент содержания
на экзамен в его текущей модели.
Это, например, гетероциклические соединения,
пиримидиновые и пуриновые основания, стереохимические
формулы, линейные и циклические формы углеводов и т.п.
См. «Кодификатор элементов содержания…»!
8.
Каких заданий не бывает на ЕГЭ по химии и почему
3. Для проверки усвоения определенных элементов содержания
курса химии достаточно привлечения ограниченного объема
фактологического материала.
Так, знание свойств комплексных солей проверяется
только на примере гидроксокомплексов цинка и алюминия;
амфотерные свойства оксидов и гидроксидов – на примере
оксидов ZnO, BeO, Al2O3, Cr2O3, Fe2O3 и соответствующих
гидроксидов и т.п.
4. Для построения заданий 1-ой части работы с выбором
ответа не используется материал, который может
трактоваться неоднозначно.
Разложение нитратов некоторых металлов,
взаимодействие магния с водой, взаимодействие меди
с соляной кислотой и т.п.
9.
Рекомендации по подготовке к ЕГЭ
Основной этап подготовки – изучение школьного курса
химии на углубленном уровне, выполнение заданий в
различной форме, решение задач, выполнение
лабораторных работ.
Советуем обратить внимание на математическую
подготовку и подготовку по физике.
Основная литература – учебники
и пособия для изучения химии на
углубленном уровне.
Дополнительная литература:
Н.Е. Кузьменко, В.В. Еремин, В.А. Попков
Начала химии. Современный курс для
поступающих в вузы.
10.
Рекомендации по подготовке к ЕГЭ
Дополнительная литература:
Пособие содержит весь
необходимый теоретический и
фактологический материал,
изучение которого является залогом
успешной сдачи ЕГЭ.
Предложена система
тематических тренировочных
заданий и заданий для
самопроверки при подготовке к
ЕГЭ по химии.
11.
Рекомендации по подготовке к ЕГЭ
Завершающий этап подготовки – тренировка в выполнении
заданий и типовых вариантов ЕГЭ + повторение теории по
укрупненным тематическим блокам с последующей
отработкой заданий по этим тематическим блокам.
ЕГЭ-2019. Химия. Готовимся к
итоговой аттестации. Издательство
Интеллект-центр, 2019. Каверина
А.А., Медведев Ю.Н., Молчанова Г.Н.,
Свириденкова Н.В., Стаханова С.В.
Приведены подборки заданий
по тематическим блокам.
12.
Рекомендации по подготовке к ЕГЭ
Ю.Н. Медведев. Химия.
ЕГЭ 2019. Типовые тестовые
задания. 14 вариантов
ЕГЭ 2019. Химия.
30 вариантов. Типовые
экзаменационные варианты.
Под ред. Добротина Д.Ю.
13.
Выполнение заданий блока «Строение
атома. Строение вещества» в 2018 г.
№
задания
Ведущий проверяемый элемент
содержания
Уровень
сложности
Процент
выполнения,
%
1
Электронная конфигурация атома
Б
61
2
Закономерности изменения
химических свойств элементов и их
соединений по периодам и группам
Б
62
3
Степень окисления и валентность
химических элементов
Б
80
4
Химическая связь. Типы
кристаллических решеток
Б
53
14.
Пример 1-1
О заданиях 1
Эти задания – письменные!
Нужно выработать
приемы выполнения
заданий,
снижающие
вероятность
случайных ошибок.
Вариант формулировки: определите , атомы каких из указанных в ряду
элементов в основном состоянии содержат одинаковое число неспаренных
электронов во внешнем слое.
15.
Систематизация теоретического материала
Давайте вспомним!
1. Как определить число протонов и нейтронов в ядре атома? Что
такое изотопы? Различаются ли изотопы одного и того же химического
элемента по свойствам и почему?
2. Приведите примеры элементов, атомы которых имеют сходное
строение внешнего электронного слоя.
3. Назовите элементы, атомы которых имеют в невозбужденном
состоянии конфигурацию внешнего электронного слоя ns1, ns2
(не забудьте о d-элементах!), ns2np3 и т.п.
4. Для каких элементов четвертого периода характерен «проскок»
электронов? Назовите три элемента, атомы которых в невозбужденном
состоянии имеют электронную конфигурацию внешнего слоя 4s1.
5. Как записать электронную конфигурацию атома в возбужденном
состоянии? Рассмотрите на примере атомов С, P, S, Cl… Какие
валентности могут проявлять эти атомы в соединениях? Для каких
элементов второго периода и почему не реализуется высшая
валентность, равная номеру группы?
16.
Систематизация теоретического материала
Давайте вспомним!
6. Как определить общее число электронов во внешнем слое? Общее
число неспаренных электронов в атоме? Число неспаренных
электронов во внешнем электронном слое в основном и в
возбужденном состояниях?
7. Как определить количество валентных электронов для атомов s- pи d-элементов?
8. Как записать электронные конфигурации ионов? Приведите пример
двух катионов и двух анионов, имеющих электронную конфигурацию
атома аргона.
Если бы ты составлял задания ЕГЭ, какие самые
сложные задания по этой теме ты бы придумал?
17.
Пример 1-2
Пример 1-3
О заданиях 1
18.
О заданиях 1
Пример 1-4
Пример 1-5
19.
Пример 1-6
О заданиях 1
20.
О заданиях 4
Задание 4. Ковалентная химическая связь, её разновидности и механизмы
образования. Характеристики ковалентной связи (полярность и энергия
связи). Ионная связь. Металлическая связь. Водородная связь. Вещества
молекулярного и немолекулярного строения. Тип кристаллической решётки.
Зависимость свойств веществ от их состава и строения.
Примеры трудных для выполнения заданий
Ковалентная
неполярная
связь в
сложном
веществе
H
H C
H
H
C H
H
H
O
O
H
21.
О заданиях 4
Примеры трудных для выполнения заданий
Разные типы
связей в одном
веществе
O
S
O
–
+
–
+
O Li
O Li
22.
О заданиях 4
Примеры трудных для выполнения заданий
Водородная
связь
Возникает между молекулами NH3, H2O, HF, гидроксильных соединений,
в т.ч. многоатомных спиртов, карбоновых кислот, аминов. Приводит к
повышению температуры кипения, вязкости и т.п.
H
H
N
…
H
O
…
CH3
H
O
CH3
O
…
H
O
H
OH … O
F
…
N
H
O … HO
CH3 C
F … H
H
H
H
H
H
H
H
N
C
CH3
H
N
CH3
H
H
CH3
23.
Ионная кристаллическая решетка
Кристалл NaCl
В узлах
кристаллической
решетки ионы
Характерные свойства: высокие
температуры плавления,
электропроводность растворов и
расплавов
Большинство солей, щелочи, оксиды
металлов IА и IIА групп.
Примеры: KOH, СaO, BaCO3, NH4Cl, органические соли, в т.ч.
соли карбоновых кислот, алкоголяты, феноляты, соли аминов
24.
Алмаз
Атомная кристаллическая решетка
В узлах кристаллической
решетки – атомы, связанные
ковалентными связями
Характерные свойства: высокая
твердость, высокие температуры
плавления, хрупкость, отсутствие
растворимости.
.
Вещества с данным типом решетки:
алмаз, графит, кремний,
SiO2 (кремнезем, кварц),
карбид кремния SiC
25.
Молекулярная кристаллическая решетка
Кристаллы I2
Между атомами в молекулах
ковалентная связь
Между молекулами
— слабые
межмолекулярные
взаимодействия
В узлах кристаллической решетки —
молекулы
Характерные свойства: низкая твердость,
хрупкость, низкие температуры
плавления и кипения, летучесть.
Органические вещества (кроме солей),
газы и жидкости, легкоплавкие и летучие
твердые вещества, в молекулах которых
ковалентные связи.
26.
Металлическая кристаллическая решетка
Na
Характерные свойства: высокая
электро- и теплопроводность,
ковкость и пластичность,
металлический блеск
В узлах кристаллической
решетки атомы и катионы
металла. Валентные
электроны обобществлены,
образуют «электронный газ»
+
е
+ +
е
е
Вещества с данным типом
решетки: металлы, сплавы
е
е
+
е
е
+е
+
+ +
е
+ е + +е +
е
27.
Тип
кристаллической решетки
МОЛЕКУЛЯРНАЯ
АТОМНАЯ
ИОННАЯ
МЕТАЛЛИЧЕСКАЯ
Частицы в
узлах
кристаллической решетки
Молекулы
Атомы
Ионы
Атомы и катионы
металлов
Характер сил
взаимодействия между
частицами
Слабые
межмолекулярные
взаимодействия
Ковалентная
связь
Ионная связь
Обобществленные
валентные электроны –
«электронный газ»
Характерные
свойства
веществ с
данным типом
решетки
Малая твердость,
низкие температуры
плавления и кипения,
летучесть.
Высокая
твердость,
высокие
температуры
плавления,
хрупкость,
отсутствие
растворимости.
Высокие
температуры
плавления,
растворы и
расплавы
проводят
электрический
ток.
Ковкость,
пластичность,
теплопроводность
электропровод-ность.
Примеры
веществ с
данным типом
решетки
Большинство
органических веществ,
многие неметаллы в
твердом состоянии:
сера, галогены, азот,
кислород и др.,
углекислый газ,
галогеноводороды и др.
Алмаз, графит,
кремний,
кремнезем SiO2,
карбид кремния
SiC
Большинство
солей, щелочи,
оксиды металлов
IА и IIА групп
Металлы, сплавы
Важно обратить внимание на взаимосвязь структуры и свойств вещества!
28.
О заданиях 4
Пример 4-1
Пример 4-2
29.
О заданиях 4
Пример 4-3
Пример 4-4
30.
О заданиях 4
Пример 4-5
Пример 4-6
31.
О заданиях 7
Задание 7. Характерные химические свойства оснований и амфотерных
гидроксидов. Характерные химические свойства кислот. Характерные
химические свойства солей: средних, кислых, оснóвных; комплексных (на
примере гидроксосоединений алюминия и цинка). Электролитическая
диссоциация электролитов в водных растворах. Сильные и слабые
электролиты. Реакции ионного обмена.
Выполнение – 67 %
32.
Вопрос по заданию 7
Такого
задания
не будет!
33.
О заданиях 8
Задание 8. Характерные химические свойства неорганических веществ: –
простых веществ–металлов: щелочных, щелочноземельных, магния,
алюминия, переходных металлов (меди, цинка, хрома, железа); – простых
веществ–неметаллов: водорода, галогенов, кислорода, серы, азота,
фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; –
оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых,
оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка)
Выполнение: 2017 г. – 47,1 %; 2018 г. — 49,3 %
34.
Систематизация теоретического материала
Давайте вспомним!
1. Вещества, имеющие кислотный характер, реагируют с веществами
основного характера.
2. Амфотерные оксиды (ZnO, BeO, Al2O3, Cr2O3, Fe2O3) и
соответствующие им гидроксиды реагируют как с веществами,
имеющими кислотный характер (кислотами, кислотными оксидами), так
и с веществами основного характера (щелочами, основными
оксидами). С водой амфотерные оксиды не реагируют!
3. Вспомните, что с водой реагируют практически все кислотные
оксиды (кроме SiO2), а среди основных – только оксиды щелочных и
щелочноземельных металлов.
4. Между веществами-электролитами протекают реакции ионного
обмена. Обязательно нужно проверить, будут ли выполняться условия
их протекания. Проверяйте, РАСТВОРИМЫ ЛИ СОЛИ В ВОДЕ!
35.
Систематизация теоретического материала
Давайте вспомним!
5. Оксиды, как правило, не реагируют с солями. Иногда встречаются
реакции типа
t
Na2CO3 + Al2O3 = 2NaAlO2 + CO2;
t
CaCO3 + SiO2 = CaSiO3 + CO2.
6. Кислород не реагирует с хлором, а фосфор – с водородом.
7. Более активный металл вытесняет менее активный из раствора соли:
CuSO4 + Fe = FeSO4 + Cu,
Но это правило не применимо к активным металлам (левее магния)!!!
8. Не забывайте об
окислительно-восстановительных
реакциях: t
Cr2O3 + 2Al = 2Cr + Al2O3;
FeO + CO = Fe + CO2 и т.п.
Тренируясь в выполнении
заданий 8, продолжайте
самостоятельно вести
записи и придумывать свои
способы запоминания!
36.
Пример 8-1
О заданиях 8
2334
Пример 8-2
4153
37.
Пример 8-3
О заданиях 8
1542
Пример 8-4
4513
38.
Пример 8-5
О заданиях 8
1523
Пример 8-6
5214
39.
Выполнение заданий по общей химии в 2018 г.
№
задани
я
Ведущий проверяемый элемент
содержания
Уровень
сложности
Процент
выполнения,
%
19
Классификация химических
реакций
Б
54,3
20
Скорость реакции
Б
78,6
21
Реакции окислительновосстановительные
Б
79,9
22
Электролиз
П
75
23
Гидролиз солей
П
62,6
24
Химическое равновесие
П
64,0
25
Качественные реакции
П
44,8
26
Производство и применение
Б
41,8
40.
О заданиях 23
Гидролиз солей. Среда водных растворов: кислая, нейтральная,
щелочная
Пример 23-1
Пример 23-2
41.
О заданиях 23
42.
О заданиях 23
В заданиях 23 могут встретиться:
• соли рубидия и цезия, аммония и метиламмония;
• ацетаты, пальмитаты, стеараты, феноляты.
В заданиях 23 не бывает:
• хроматов и дихроматов;
• нерастворимых солей.
Кислые соли (NaHCO3, (NH4)2НPO4, KHSO4 и т.п.) используются
только в заданиях с формулировкой «ОТНОШЕНИЕ К
ГИДРОЛИЗУ».
Заданий на установление характера среды в растворах этих
солей НЕТ!
43.
Гидролиз бинарных соединений (задания 9, 32, 34)
Гидролиз карбидов кальция и алюминия:
CaC2 + 2H2O = Ca(OH)2 + C2H2,
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
В кислой среде:
CaC2 + 2HCl = CaCl2 + C2H2
Гидролиз гидридов, нитридов, фосфидов:
NaH + H2O = NaOH + H2;
Li3N + 3H2O = 3LiOH + NH3;
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
В кислой среде:
Li3N + 4HCl = 3LiCl + NH4Cl
Гидролиз хлорида фосфора(V):
PCl5 + 4H2O = H3PO4 + 5HCl
В щелочной среде:
PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
44.
Совместный гидролиз (задания 9, 32, 34)
Al3+
CO32-
Cr3+
SO32-
Fe3+
S2-
Совместный гидролиз с
участием двухзарядных
катионов не используется
в заданиях ЕГЭ
При сливании растворов солей железа(III) и карбонатов протекает
совместный гидролиз:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(OH)3↓ + 6KCl + 3CO2↑;
При сливании растворов солей железа(III) и сульфидов –
окислительно-восстановительная реакция:
2FeCl3 + 3K2S = 2FeS↓ + S↓ + 6КС1
45.
О заданиях 30: выбор окислителя и
восстановителя
Важнейшие окислители:
Cl2, Br2, HNO3, H2SO4(конц.), KMnO4, MnO2, K2Cr2O7,
K2CrO4, KClO, KClO3, H2O2, (O2, соединения Fe(III))
Важнейшие восстановители:
металлы, неметаллы: S, P, C;
сульфиды, иодиды, бромиды, а также H2S, HI, HBr, HCl,
NH3, PH3;
нитриты, сульфиты, соединения Fe(II), Cr(III)
(Н2, C, СО, соединения Cr(II), Cu(I), H2O2)
46.
Задание 30
Из «Методических рекомендаций по оцениванию…»
Эксперту необходимо в первую очередь сосредоточить внимание
на тех ведущих умениях, которые по своей сути обеспечивают
успешное выполнение задания.
Задания 30 ориентированы на проверку следующих умений:
• определять степень окисления химических элементов, окислитель
и восстановитель;
• прогнозировать продукты окислительно-восстановительных
реакций, в том числе с учетом характера среды (кислой, щелочной,
нейтральной), концентрации реагентов, относительной
устойчивости соединений элементов в различных степенях
окисления;
• составлять уравнения окислительно-восстановительных реакций;
• составлять электронный баланс, на его основе расставлять
коэффициенты в уравнениях реакций.
47.
Вопрос по оцениванию задания 30
48.
Оформление ответа к заданию 30
Запись электронного баланса
K2Cr2O7 + KBr + H2SO4 → Cr2(SO4)3 + Br2 + …
Допустимы
записи:
2Cr+6 + 6ē → 2Cr+3
2Br-1 — 2ē → Br2
или
Cr+6 + 3ē → Cr+3
Br- — ē → Br0
или
2Cr+6 + 6ē → 2Cr+3
2Br- — 2ē → 2Br
Недопустима запись:
+3
Cr2 + 6ē → 2Cr+3
1
3
1
3
1
3
Такие обозначения
степеней окисления
как N5+ и N4+
(сначала цифра,
затем знак)
считаются
неверными.
49.
Задание 31
Реакции в растворах электролитов идут практически до конца в
том случае, если происходит связывание исходных ионов с
образованием:
− слабого электролита,
− осадка малорастворимого вещества,
− газообразного продукта.
Ионные уравнения реакций отражают суть тех изменений, которые
происходят при взаимодействии веществ − электролитов. .
В ионном уравнении реакции хорошо
растворимые сильные электролиты
записывают в виде соответствующих
ионов, а слабые электролиты,
нерастворимые вещества и газы − в
молекулярном виде.
В сокращённом ионном уравнении
дробные или удвоенные
коэффициенты не допускаются.
Слабый
электролит
α, %
(С = 0,1М)
H2SO3
20
HF
8
HNO2
4
NH3·H2O
1,4
CH3COOH
1,4
H2CO3
0.2
H2S
0,07
50.
Задание 31
• Если в качестве одного из исходных веществ выбрана соль,то она
должна быть растворима в воде (исключение – взаимодействие
нерастворимых карбонатов с кислотами).
•Кислые соли диссоциируют ступенчато:
NaHSO3 → Na+ + HSO3− (первая ступень);
HSO3− → H+ + SO32− (вторая ступень).
В ионном уравнении используется записи типа: Na+ + HSO3−
Пример: взаимодействие азотной кислоты и гидрокарбоната аммония
HNO3 + NH4HCO3 = H2O + CO2 + NH4NO3
H+ + NO3- + NH4+ + HCO3- = H2O + CO2 + NH4+ + NO3H+ + HCO3- = H2O + CO2
Примечание: В случае H3PO4 в ионном уравнении
возможны записи
как H+ + H2PO4- , так и H3PO4
51.
Задание 31
•Реакции образования гидроксокомплексов при взаимодействии
растворов щелочей и растворимых солей цинка и алюминия
также можно отнести к реакциям ионного обмена:
ZnSO4 + 4NaOH = Na2[Zn(OH)4] + Na2SO4
Zn2+ + SO42- + 4Na+ + 4OH- = 2Na+ + [Zn(OH)4]2- + 2Na+ + SO42Zn2+ + 4OH- = [Zn(OH)4]2•При взаимодействии солей аммония со щелочами допустимы
записи NH3∙H2O, NH3 + H2O, например:
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3.H2O
2NH4+ + SO42- +2K+ + 2OH- = 2K+ + SO42- + 2NH3.H2O
NH4+ + OH- = NH3.H2O или
NH4+ + OH- = NH3 + H2O
52.
Задание 31
Образование слабых кислот в качестве продуктов:
Нитрит калия KNO2 и ацетат натрия CH3COONa представляют собой
соли слабых кислот. Сильная азотная кислота способна вытеснить
более слабые кислоты из их солей. Поэтому возможны следующие
реакции ионного обмена:
KNO2 + HNO3 = HNO2 + KNO3
K+ + NO2– + H+ + NO3– = HNO2 + K+ +NO3–
H+ + NO2– = HNO2
CH3COONa + HNO3 = CH3COOH + NaNO3
CH3COO– + Na+ + H+ + NO3– = CH3COOH + Na+ + NO3–
Н+ + CH3COO– = CH3COOH
53.
О задачах
1. Растворимость безводного сульфата меди при некоторой
температуре составляет 24,2 г на 100 г воды. Найдите массу
безводного сульфата меди, необходимую для приготовления
насыщенного при данной температуре раствора (97,4 г)
2. Растворимость сероводорода в воде при н.у. составляет 2,5 л
на 1 л воды. Найдите массовую долю растворенного вещества в
насыщенном растворе (0,38 %)
54.
СПАСИБО ЗА ВНИМАНИЕ!
Стаханова Светлана Владленовна
[email protected]
Презентация по химии » Подготовка к ЕГЭ»
Оценка 4.6
презентация состоит из тридцати слайдов. Включает перечень основных документов, необходимых для качественной подготовки к экзамену. Указана структура ЕГЭ по химии, приблизительное время выполнения каждого задания. Сделан разбор типичных ошибок участников ЕГЭ по химии разных лет. В материале содержатся примеры учебных пособий и электронных ресурсовФайл содержит тридцать слайдов по теме » ЕГЭ по химии»
Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.