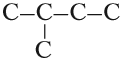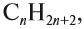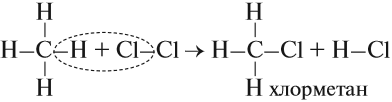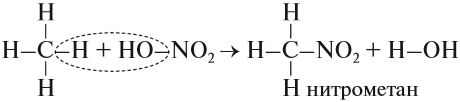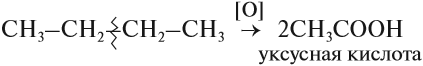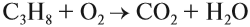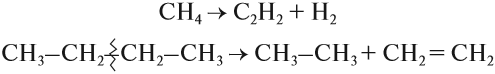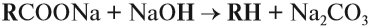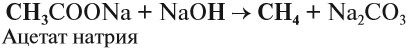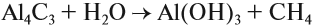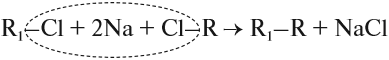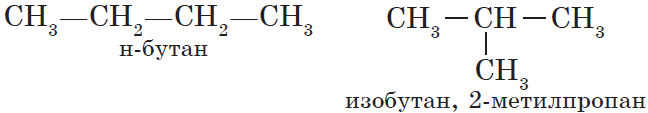Применение алканов

4.5
Средняя оценка: 4.5
Всего получено оценок: 402.
4.5
Средняя оценка: 4.5
Всего получено оценок: 402.
Алканы получают из нефтепродуктов, природного газа, каменного угля. Главное применение алканов – использование в качестве топлива. Из веществ также изготавливают растворители, косметические средства, асфальт.
Описание
Алканы – класс насыщенных или предельных углеводородов. Это значит, что молекулы алканов содержат максимальное количество атомов водорода. Общая формула соединений гомологического ряда алканов – CnH2n+2. Названия веществ составляются из греческого обозначения числительных и суффикса -ан.
Физические и химические свойства алканов зависят от их строения. С возрастанием количества атомов углерода в молекуле происходит переход от газообразных веществ к твёрдым соединениям.
Агрегатное состояние алканов в зависимости от количества атомов углерода:
- С1-С4 – газы;
- С5-С15 – жидкости;
- С16-С390 – твёрдые вещества.
Газы горят голубым пламенем с выделением большого количества тепла. Алканы содержащие 18-35 атомов углерода – воскообразные, мягкие вещества. Из их смеси изготавливают парафиновые свечи.
С увеличением молекулярной массы в гомологическом ряду повышаются температуры плавления и кипения.
Применение
Алканы выделяют из полезных ископаемых – нефти, газа, каменного угля. На разных этапах переработки получают бензин, керосин, мазут. Алканы используются в медицине, косметологии, строительстве.
В таблице описаны основные области применения предельных углеводородов.
|
Область |
Что используют |
Как используют |
|
Энергетическая промышленность |
Бензин, керосин, мазут |
В качестве ракетного, моторного топлива |
|
Газообразные алканы |
В качестве бытового газа для приготовления пищи |
|
|
Химическая промышленность |
Петролейный эфир (смесь изопентанов и изогексанов), |
Изготовление растворителей, смазочных масел, пропитки |
|
Парафин |
Изготовление вазелинового масла (смесь жидких алканов), вазелина (смесь жидких и твёрдых алканов), свечей, моющих средств, лаков, эмалей, мыла. В качестве пропитки спичек. Использование при производстве органических кислот |
|
|
Хлорпроизводные алканы |
Изготовление спиртов, альдегидов, кислот |
|
|
Косметология |
Вазелин, вазелиновое масло |
Производство мазей |
|
Газы |
В качестве пропеллентов для изготовления аэрозолей |
|
|
Сквалан |
Изготовление увлажняющих косметических средств |
|
|
Строительство |
Гудрон (дёготь) – конечный продукт переработки нефти, содержащий смесь алканов, циклоалканов, аренов, металлов, неметаллов |
Для изготовления асфальтовых дорог |
|
Бумажно-целлюлозная промышленность |
Парафин |
В качестве пропитки упаковочной бумаги |
|
Пищевая промышленность |
Парафин |
Производство жевательных резинок |
Алканы используются при изготовлении каучука, синтетических тканей, пластмасс, поверхностно-активных веществ. В качестве заправки баллонов для тушения пожаров используются пропан и бутан в сжиженном виде.
Что мы узнали?
Узнали кратко об области применения алканов. Насыщенные углеводороды в газообразном, жидком, твёрдом состоянии используются в химической, пищевой, бумажной, энергетической отраслях, в косметологии и строительстве. Из алканов производят растворители, краски, лаки, мыло, свечи, мази, асфальт. Бензин, керосин, мазут, состоящие из жидких алканов, используют в качестве топлива. Газообразные алканы применяются в быту и для производства аэрозолей. Основные источники алканов – нефть, природный газ, каменный уголь.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Daniile Malahov
4/5
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 402.
А какая ваша оценка?
Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько
основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает
химическое строение. - Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его
свойствах. - Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда
— CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления
этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos —
соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить
читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они
связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи
и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д. - Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный
атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по
строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной
(геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28′

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить
одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Гриньяра
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного
радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).

На схеме выше мы сначала получили реактив Гриньяра, а потом
использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для
алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее — у вторичного и значительно труднее — у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы,
которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция
идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)

Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное
отличие пиролиза от горения — в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат.) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их
химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Содержание
- Понятие об алканах
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства алканов
- Физические свойства
- Химические свойства
- Получение и применение алканов
- Выводы
Понятие об алканах
Алканы — это углеводороды незамкнутого (нециклического) строения, в молекулах которых атомы углерода соединены только простыми связями. Например:
Задание 18.1. Допишите атомы водорода и попробуйте ответить на вопрос: существует ли углеводород, имеющий большее число атомов водорода в молекуле?
Поэтому-то алканы обычно называют предельными углеводородами, то есть содержащими максимально возможное (предельное) число атомов водорода в молекуле.
Гомологический ряд, номенклатура, изомерия
Алканы образуют гомологический ряд с общей формулой
где n — число атомов углерода в молекуле. Если
- n = 1 → СН4, это метан;
- n = 2 → С2Н6, это этан;
- n = 3 → С3Н8, или СН3–СН2–СН3, это пропан.
Начиная с n = 4 для алканов возможна изомерия, то есть для вещества состава C4H10 существуют два соединения различного строения, а значит, различные по свойствам:
Следующий гомолог с n = 5 имеет уже три изомера, один из них н-пентан, то есть пентан нормального (неразветвлённого) строения.
Задание 18.2. Составьте графические формулы всех изомеров пентана (их три). Назовите эти изомеры.
Строение молекул
Атомы углерода и водорода в молекулах алканов соединены только простыми связями. Это ковалентные, слабо полярные связи.
Все С–Н связи в молекуле метана равноценны и направлены в пространстве к вершинам тетраэдра. Это σ-связи (сигма-связи), очень прочные. Поэтому метан и другие алканы с трудом вступают в химические реакции (на разрыв σ-связей нужно затратить много энергии). Все химические реакции алканов идут в особых условиях (нагревание, присутствие катализатора, освещение и др.), то есть при обычных условиях реакции алканов невозможны.
Свойства алканов
Физические свойства
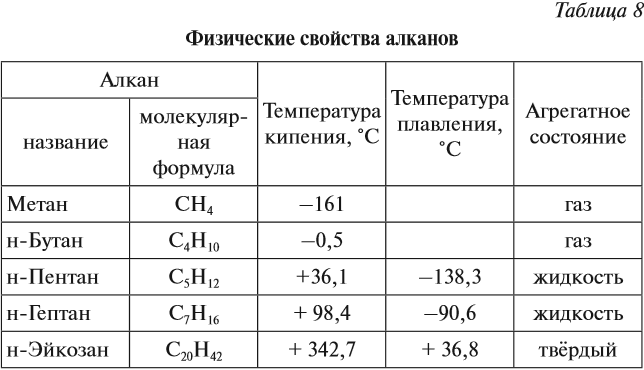
Поскольку все связи в молекулах алканов слабо полярны, то в молекулах отсутствуют какие-либо значительные заряды. Поэтому молекулы алканов слабо притягиваются друг к другу. В результате все алканы — это либо газы, либо летучие жидкости, либо твёрдые легкоплавкие вещества (табл. 8).
Смесь газообразных углеводородов образует природный газ. Начиная с n = 16, алканы являются твёрдыми веществами. Очищенные твёрдые предельные углеводороды называют парафином.
Неполярные углеводороды практически нерастворимы в полярном растворителе, например в воде, но прекрасно растворяются в неполярных растворителях. Таким растворителем является смесь жидких алканов (бензин, керосин). Природная смесь твёрдых, жидких и газообразных углеводородов называется нефтью. Нефть в основном состоит из алканов и циклоалканов. При переработке нефти получают: попутный нефтяной газ, смесь жидких алканов (бензин, керосин), твёрдых алканов (асфальт, парафин) и другие нефтепродукты. Такой способ переработки нефти называется нефтеперегонкой и осуществляется при её нагревании в специальных ректификационных колоннах.
Задание 18.3. Бензин представляет собой смесь алканов с числом атомов углерода от 5 до 9. Составьте их молекулярные формулы.
Химические свойства
Алканы, в принципе, не способны к реакциям присоединения, так как имеют максимально возможное число атомов водорода. Поэтому их называют насыщенными углеводородами.
Для алканов наиболее характерна реакция замещения. В результате такой реакции происходит замещение одного атома водорода алкана на новую группу или на атом (на каждой стадии). Характер химической связи при этом не изменяется.
К таким реакциям относятся:
- Реакция хлорирования, которая происходит под действием солнечного света:
- Реакция нитрования, которая происходит при нагревании:
Обратите внимание: молекулу азотной кислоты в органических реакциях рекомендуется записывать как НО–NO2, так как в результате реакций с ней в молекуле исходного вещества появляется нитрогруппа –NО2.
Для алканов возможны реакции окисления. В растворе они не происходят. Но в присутствии катализаторов алканы окисляются до кислот:
Обратите внимание! Знак [О] означает, что происходит неполное (мягкое) окисление. Окислителями могут быть разные вещества, не только кислород, например, перманганат калия KMnO4.
При полном окислении (горении) любой алкан (и любой углеводород!) превращается в углекислый газ и воду:
Газообразные алканы горят бесцветным пламенем, т. е. сгорают полностью! При этом выделяется много теплоты, поэтому алканы применяются в качестве топлива: природный газ, бензин, керосин, мазут и т. д.
Задание 18.4. Расставьте коэффициенты в уравнении реакции горения.
При нагревании до очень высоких температур в отсутствии кислорода происходит разрушение (крекинг) молекулы углеводорода:
При этом образуются и непредельные углеводороды.
Задание 18.5. Укажите формулы непредельных углеводородов.
Процессы крекинга используют при переработке нефти.
Задание 18.6. Напишите уравнения реакций:
- хлорирования этана;
- нитрования метана;
- горения пентана.
Получение и применение алканов
Алканы широко распространены в природе. Простейший алкан — метан — образуется в результате разложения без доступа воздуха остатков растительных и животных организмов, этот газ выделяется на болотах, поэтому он так и называется: «болотный газ». Метан накапливается в шахтах, где добывают каменный уголь, из-за этого на шахтах иногда бывают взрывы, так как смесь метана с воздухом взрывоопасна. Это следует учитывать и в быту, так как природный газ является источником тепла в газовых плитах. Метан составляет 95–97 % природного газа.
Алканы — ценное сырьё для получения смазочных масел, пластмасс, красок, стиральных порошков и т. д. Смеси алканов — бензин, керосин — топливо для автомобилей, тракторов, ракет, самолётов. Поэтому их получают в больших количествах в основном при переработке нефти и газа.
В лаборатории в небольших количествах алканы можно получить нагреванием соли карбоновой кислоты со щёлочью:
Внимание! Здесь и далее буквой R обозначается любой углеводородный радикал.
Так, метан получают нагреванием ацетата натрия в присутствии щёлочи:
Метан можно получить гидролизом карбида алюминия (см. урок 13.1):
Кроме того, в лаборатории алканы получают синтезом Вюрца из галогенпроизводных под действием натрия:
где R и R1 — предельные радикалы.
Выводы
Алканы — предельные, насыщенные углеводороды, в молекулах которых имеется максимально возможное (предельное) числа атомов углерода. Поэтому состав всех алканов СnH2n+2 и они не способны вступать в реакции присоединения. Все связи в молекулах алканов — неполярные, простые, очень прочные, поэтому алканы с трудом вступают в химические реакции. Это реакции замещения, крекинга, горения и каталитического окисления.
Применение алканов
Содержание
- 1 Применение алканов
- 1.1 Применение в промышленности
- 1.2 Применение в медицине и фармации
- 2 Значение алканов
Предельные углеводороды с общей формулой CnH2n+2, основным источником которых служат нефть, газ и каменный уголь, являются сырьевой базой для химической промышленности и основными природным источником энергии.
Применение алканов
Первоначально насыщенные углеводороды использовались как топливо — в результате горения высвобождается энергия:
CnH2n+2 + O2→CO2 + H2O +Q
Области применения алканов связаны с их физико-химическими свойствами:
- Газообразные алканы (метан, пропан и бутан). Горят бледно-голубым или бесцветным пламенем, при этом выделяется большое количество тепла. Применяются для бытовых нужд – как топливо в газовых плитах, зажигалках и газовых баллончиках для туристических горелок. В промышленных объемах — как топливо для газовых электростанций, вырабатывающих тепло и электроэнергию. Метан как часть природного газа — один из лучших природных субстратов, используемых в биотехнологии.
- Жидкие алканы. Являются основной частью горючего для двигателей внутреннего сгорания – от мотоциклетных до ракетных. Изомеры линейных алканов применяют как добавку для повышения качества топлива. Смесь предельных углеводородов с длиной цепочки не более 15 атомов углерода — вазелиновое масло применяют в косметологии и медицине. В промышленности применяют гудрон (остаточный продукт после переработки нефти) для производства строительных кровельных и дорожных битумов и кокса.
- Твердые алканы. Смесь жидких и твердых углеводородов с цепочкой до 25 атомов углерода – вазелин — густая масса, используется в медицине и косметических целях. Смесь алканов С20 -С35 называют парафином и используют для производства свечей, обработки упаковочных материалов и спичек. Парафиновые углеводороды служат основным сырьем для биосинтеза.
Это интересно:
Применение алкенов
Циклические углеводороды
Применение в промышленности
Парафины являются основой для производства целого ряда веществ:
- азотной кислоты HNO3;
- насыщенных одноатомных cпиртов СnH2n+1OH;
- сажа (аморфный углерод) — для типографской краски и резины;
- галогензамещенных растворителей и хладонов;
- алкенов;
- альдегидов, которые используются в производстве органических кислот и пластмасс;
- как нефтехимическое сырье для производства ПАВ.
Алканы применяются при производстве синтетических моющих средств.
Исходными веществами для этого служат парафины фракции С41-С44 .
Применение в медицине и фармации
Смесь жидких и твердых парафинов с С < 25 (вазелин очищенный) – белая пластичная масса без вкуса и запаха, применяется:
- для обработки трещин на коже;
- в качестве основы лекарственных мазей;
- при проведении различных процедур (для смягчения поверхности кожи, когда ставят банки; смазывают наконечники клизмы и газоотводной трубки).
Парафин – смесь алканов С19-С35, твердое вещество кристаллического строения. Используется в расплавленном виде для тепловых процедур -наслаивания, аппликаций компрессов и ванн.
Парафин
Хлорэтан С2H5Сl – применяется как местный анестетик и для замораживания (жидкость быстро испаряется с поверхности, что сопровождается сильным местным охлаждением).
Йодоформ CHI3 – применяется как заменитель йода, поскольку является менее токсичным.
Фторотан C2HBrClF3 – наркотическое средство, применяется для наркоза.
Сводная таблица применения алканов
| Область применения | представитель CnH2n+2 | использование |
|
Промышленность |
газообразные до С4 | Топливо для бытовых целей;
сажа для производства резины и типографских красок; основа для органического синтеза и производства ПАВ. |
| жидкие С5-С15 | Горючее для двигателей внутреннего сгорания;
изомеры применяют для улучшения качества бензина; из гудрона делают битумы и кокс. |
|
| твердые С20-С35 | Изготовление свечей; для обработки упаковочных материалов и спичек. | |
|
Медицина и косметология |
вазелин (очищенный) | Обработка трещин на коже;
основа для лекарственных мазей; для медицинских процедур (обработка наконечников клизм и газоотводных трубок). |
| парафин | Для тепловых процедур. | |
| хлорэтан С2H5Сl | Для местной анестезии. | |
| йодоформ CHI3 | Аналог йода. | |
| фторотан C2HBrClF3 | Наркоз. |
Значение алканов
Предельные углеводороды применяются в пищевой и химической промышленности, в энергетике, косметологии и медицине.
Алканы служат растворителями и сырьем для производства лаков, красок, мазей. Их используют в качестве топлива и компонентов для различных битумов.
Химическое производство пластика, ПАВов и синтетических тканей использует в качестве сырья алканы.
С развитием технологий сферы применения насыщенных углеводородов расширяется.
Оценка статьи:
Загрузка…
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_{n}Н_{2n+2}$.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
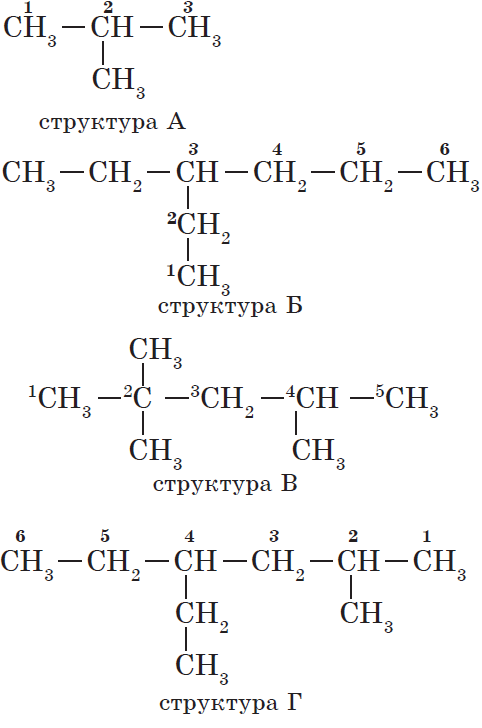
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_{12}$ до $С_{15}Н_{32}$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
$CH_4+Cl_2→CH_3Cl+HCl$.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
$CH_3Cl+Cl_2→HCl+{CH_2Cl_2}↙{text»дихлорметан(хлористый метилен)»}$,
$CH_2Cl_2+Cl_2→HCl+{CHСl_3}↙{text»трихлорметан(хлороформ)»}$,
$CHCl_3+Cl_2→HCl+{CCl_4}↙{text»тетрахлорметан(четыреххлористый углерод)»}$.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
$CH_3—CН_3→СH_2=CH_2+Н_2↑$
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
$СН_4+2О_2→СО_2+2Н_2O+880 кДж.$
В общем виде реакцию горения алканов можно записать следующим образом:
$C_{n}H_{2n+2}+({3n+1}/{2})O_2→nCO_2+(n+1)H_2O$
Термическое расщепление углеводородов:
$C_{n}H_{2n+2}{→}↖{400-500°C}C_{n-k}H_{2(n-k)+2}+C_{k}H_{2k}$
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
$CH_4{→}↖{1000°C}C+2H_2↑$
При нагревании до температуры $1500°С$ возможно образование ацетилена:
$2CH_4{→}↖{1500°C}CH=CH+3H_2↑$
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
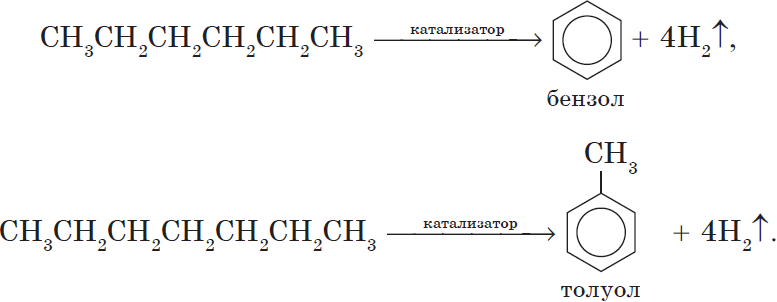
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
В обычных условиях
С1— С4 – газы
С5— С15 – жидкие
С16 – твёрдые
Температуры плавления и кипения алканов, их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями. Физические свойства некоторых алканов представлены в таблице.
Таблица 2. Физические свойства некоторых алканов
|
Название |
Формула |
tпл °С |
tкип °С |
|
Метан |
СН4 |
-182,5 |
-161,5 |
|
Этан |
С2Н6 |
-182,8 |
-88,6 |
|
Пропан |
С3Н8 |
-187,7 |
-42 |
|
Бутан |
С4Н10 |
-138,3 |
-0,5 |
|
Пентан |
C5H12 |
-129,7 |
+36,1 |
|
Гексан |
С6Н14 |
-95,3 |
68,7 |
|
Гептан |
С7H16 |
-90,6 |
98,4 |
|
Октан |
C8H18 |
-56,8 |
124,7 |
|
Нонан |
С9Н20 |
-53,7 |
150,8 |
|
Декан |
C10H22 |
-29,6 |
174,0 |
|
Пентадекан |
C15H32 |
+10 |
270,6 |
|
Эйкозан |
С20Н42 |
36,8 |
342,7 |
|
Пентакозан |
C25H52 |
53,7 |
400 |
Плотности алканов
II. Химические свойства алканов
1. Реакции замещения
а) Галогенирование
При действии света — hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
В реакции образуются вещества галогеналканы RГ или Сn H2n+1Г
(Г — это галогены F, Cl, Br, I)
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
метан хлорметан
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия)
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия)
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия)
тетрахлорметан
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом углерода в метильной группе ( — СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
CH3 – CH2 – Cl + Cl2 hν → CH3 – CHCl2 + HCl
хлорэтан 1,1 -дихлорэтан
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Иодирование происходит обратимо, поэтому требуется окислитель для удаления HI из рекции.
Внимание!
В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается при T>400˚C.
б) Нитрование (реакция М.И. Коновалова, он провёл её впервые в 1888 г)
CH4 + HNO3 (раствор) t˚С → CH3NO2 + H2O
нитрометан
RNO2 или Сn H2n+1 NO2 (нитроалкан)
2. Реакции отщепления (дегидрирование)
а) CnH2n+2 t˚С, Ni или Pd → CnH2n + H2
б) При нагревании до 1500 С происходит образование ацетилена и водорода:
2CH4 1500°С → C2H2 + 3H2
3. Реакции перегруппировки (изомеризация)
н-алкан AlCl3, t°С → изоалкан
Анимация: “Реакция изомеризации”
4. Реакции горения (горят светлым не коптящим пламенем)
CnH2n+2 + O2 t°С → nCO2 + (n+1)H2O
Помните! Смесь метана с воздухом и кислородом взрывоопасна
V(CH4) : V(O2) = 1: 2
V(CH4) : V(воздуха) = 1 : 10
Видео: “Взрыв метана с кислородом”
Видео: “Горение парафина в условиях избытка и недостатка кислорода”
Видео: “Горение метана и изучение его физических свойств”
Видео: “Горение жидких углеводородов”
Видео: “Горение твердых углеводородов (на примере парафина)”
5. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
C10H22 t°С → C5H12 + C5H10
алкан алкен
Анимация: “Термическое разложение алканов (крекинг)”
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С и Н2:
СH4 1000°С → C + 2H2
в) Конверсия метана с образованием синтез – газа (СО + Н2)
CH4 + H2O 800˚C, Ni → СО + 3Н2
III. Получение алканов
1. Получение в лаборатории
1. Гидролиз карбида алюминия (получение метана):
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
2. Реакция Вюрца (взаимодействие натрия с галогенпроизводными алканов):
R-Г + 2Na + Г-R1 → R-R1 + 2NaГ
(R- это радикал; Г- это галоген)
a) CH3-Cl + 2Na + Cl-CH3 → CH3-CH3 + 2NaCl
или
2CH3Cl + 2Na → C2H6 + 2NaCl
б) CH3-I + 2Na + I-C2H5 → CH3-C2H5 + 2NaI
или
CH3I + 2Na + C2H5I → C3H8 + 2NaI
3. Термическое декарбоксилирование солей карбоновых кислот в присутствии щелочей:
Видео: “Получение метана”
R-COONa + NaOH —t ˚С→ R-H + Na2CO3
a) CH3-COONa + NaOH —t ˚С→ CH4 + Na2CO3
(ацетат натрия+ едкий натр=(метан+карбонат натрия)
б) C2H5-COONa + NaOH —t ˚С→ C2H6 + Na2CO3
этилат натрия этан
4. Каталитическое гидрирование алкенов и алкинов:
a) CnH2n + H2 —t,kat,p → CnH2n+2
алкен
C2H4 + H2 —300°C,Ni → C2H6
б) CnH2n-2 + 2H2 — t,kat→ CnH2n+2
алкин
C2H2 + 2H2 — t,kat→ C2H6
5. Электролиз растворов солей карбоновых кислот — реакция КОЛЬБЕ
Пример. Электролиз водного раствора ацетата натрия
H2O, CH3COONa ↔ Na+ + CH3COO—
Катод (-): H2O, Na+ — Процесс восстановления: 2H2O + 2ē → H2↑ + 2OH—
Анод (+): H2O, CH3COO—(анионы органических кислот активнее воды) – Процесс окисления:
CH3COO— -1e—→ CH3COO∙ (радикал)
CH3COO∙ → CH3∙ + СО2↑
2СН3 ∙ → С2Н6
Итог:
2H2O + 2CH3COONa эл.ток= H2 + 2CO2 + 2NaOH + C2H6
2H2O + 2CH3COONa эл.ток= H2 + 2NaHCO3 + C2H6
2. Получение в промышленности
1. Из природного и попутного нефтяного газа
Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье — нефть и сопутствующие ей нефтяные газы. Природный газ на 95 процентов состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов.
Метан называют ещё и болотным; рудничным газом.
Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. При отсутствии газоконденсатных станций попутные нефтяные газы сжигают в факелах, что является крайне неразумной и разорительной практикой в нефтедобыче. Одновременно с газами нефть очищается от воды, грязи и песка, после чего поступает в трубу для транспортировки. Из нефти при ее разгонке (перегонке, дистилляции) отбирая последовательно все более и более высококипящие фракции получают:
бензины — т. кип. от 40 до 180 С, (содержит углеводороды С5-С10), состоит более, чем из 100 индивидуальных соединений, нормальных и разветвленных алканов, циклоалканов, алкенов и ароматических углеводородов;
керосин 180-230 C, (С11-С12);
легкий газойль (дизельное топливо) 230-305 С (С13-С17);
тяжелый газойль и легкий дистиллят смазочного масла 305-405 С (С18-С25);
смазочные масла 405-515 С (С26-С38).
Остаток после перегонки нефти называется асфальтом или битумом.
2. Синтезом из водяного газа:
nCO + (2n + 1) H2 — t,kat→ CnH2n+2 + n H2O
CO + 3H2 — t,kat→ CH4 + H2O
3. Синтезом из простых веществ:
nC + (n + 1) H2 —t,kat,p → CnH2n+2
C + 2 H2 — 500°C,Ni → CH4
IV. Применение
1. Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
2. Использование в качестве топлива – в котельных установках, бензин, дизельное топливо, авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит.
3. Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках.
4. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров.
5. Метан используется для производства шин и краски.
6. Значение алканов в современном мире огромно. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Велико значение в медицине, парфюмерии и косметике.
Использование алканов в качестве смазочных материалов
Использование алканов в качестве топлива
Использование парафина для получения водостойкой бумаги
Применение алканов в медицине (вазелин, парафин и др.)
Применение галогенопроизводных алканов
Применение сажи
V. Тренажёры
Тренажер №1: “Алканы: строение, номенклатура, получение и физические свойства”
Тренажер №2: “Алканы: строение, номенклатура, получение и физические свойства (расчетные задачи)”
Тренажер №3: “Определение качественного состава парафина по продуктам окисления”
Тренажер №4: “Химические свойства алканов”
ЦОРы
Анимация:“Реакция изомеризации”
Анимация:“Термическое разложение алканов (крекинг)”
Видео: “Горение парафина в условиях избытка и недостатка кислорода”
Видео:“Горение метана и изучение его физических свойств”
Видео:“Горение жидких углеводородов”
Видео: “Горение твердых углеводородов (на примере парафина)”
Видео: “Установление качественного состава предельных углеводородов”
Видео: “Определение содержания хлора в органических соединениях”
Видео: “Отношение метана к раствору перманганата калия и бромной воде”
Видео: “Взрыв метана с кислородом”
Видео: “Получение метана”
Подготовили всё самое важное, что нужно знать по алканам для ЕГЭ по химии! Тема не самая сложная, но довольно обширная. Тут вы найдёте:
- Строение алканов;
- Изомерию и применение;
- Способы получения алканов;
- Химические свойства алканов;
- Окисление и горение алканов.
🔹 ОБЩИЕ СВЕДЕНИЯ
Алканы — предельные углеводороды с общей формулой CnH2n+2
Атом углерода находится в состоянии sp³-гибридизации и образует 4 σ-связи.
Фрагменты молекул алканов могут вращаться, при таком вращении молекула принимает различные конформации (привет, оптическая изомерия!)
Для алканов характерна структурная изомерия (изомерия углеродного скелета). У метана, этана и пропана изомеров нет ☹️
🔹 НОМЕНКЛАТУРА
Для названия углеродной цепи к корню (см. шаг 99) необходимо добавить суффикс -ан.
Радикалы необходимо указывать в алфавитном порядке.
Кстати, вот список самых часто встречающихся алкильных радикалов:
-СH₃ метил
-СН₂СН₃ этил
-СН₂СН₂СН₃ пропил
-СН(СН₃)₂ изопропил
🔹 ФИЗИЧЕСКИЕ СВОЙСТВА
от CH₄ до C₄H₁₀ газы
от С₅H₁₂ до С₁₉H₄₀ жидкости
от С₂₀Н₄₂ и далее — твёрдые вещества
🔹 СПОСОБЫ ПОЛУЧЕНИЯ
1) Добыча и переработка природного газа, нефти.
2) Прямой синтез из простых веществ (кроме как на бумаге, нигде не используется):
С + 2H₂ → CH₄ (t°C, p, кат.)
3) Декарбоксилирование солей карбоновых кислот (реакция Дюма):
СH₃COONa + NaOH (тв.) → CH₄ + Na₂CO₃ (t°C)
4) Электролиз растворов солей карбоновых кислот (реакция Кольбе):
2СH₃COONa + 2H₂O → СH₃-СH₃ + 2CO₂ + H₂ + 2NaOH (эл. ток)
5) Реакция Вюрца (для получения симметричных алканов):
СH₃Сl + 2Na + ClСH₃ → 2NaCl + СH₃-СH₃ (t°C)
6) Гидролиз карбидов (получение метана):
Al₄C₃ + 12H₂O → 4Al(OH)₃ + 3CH₄
Al₄C₃ + 12HCl → 4AlCl₃ + 3CH₄ (в кислой среде)
🔹 ПРИМЕНЕНИЕ АЛКАНОВ
Метан — основной компонент природного газа, используется в быту для отопления и приготовления пищи.
Газообразные алканы используются в качестве топлива.
Некоторые жидкие алканы (гептан, октан) являются распространёнными неполярными растворителями.
Производные алканов (хлороформ CHCl₃ и тетрахлорид углерода CCl₄) используются в качестве растворителей.






Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!