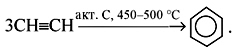Чтобы поделиться, нажимайте
Получение аренов (бензола и его гомологов)
В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
C6H5-COONa + NaOH t → C6H6 + Na2CO3
бензоат натрия
2. Реакция Вюрца-Фиттинга: (здесь Г – галоген)
С6H5-Г + 2Na + R-Г → C6H5—R + 2NaГ
С6H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:
C6H14 t, kat→ C6H6 + 4H2

2. Тримеризация ацетилена (только для бензола) – р. Зелинского:
3С2H2 600°C, акт. уголь → C6H6
3. Дегидрированием циклогексана и его гомологов:
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов
C6H12 t, kat→ C6H6 + 3H2

C6H11—CH3 t, kat→ C6H5—CH3 + 3H2
метилциклогексан толуол
4. Алкилирование бензола (получение гомологов бензола) – р Фриделя-Крафтса.
C6H6 + C2H5-Cl t, AlCl3→ C6H5-C2H5 + HCl
хлорэтан этилбензол
Применение ароматических углеводородов
Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол).
Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто-, мета- и пара- ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений.
п-Ксилол используется при получении полимерного материала лавсан, из которого изготавливают синтетические волокна и пленки.
Изопропилбензол (кумол) С6Н4-СН(СН3)2 – исходное вещество для получения фенола и ацетона.
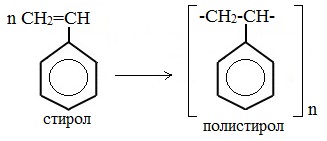
Винилбензол (стирол) C6H5-CН=СН2 используется для получения ценного полимерного материала полистирола.
Применение аренов
Ароматические углеводороды – важнейшее сырье для синтеза ценных веществ.
Бензол С6Н6 — хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива.
Он также используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола, из которых в свою очередь получают лекарства, пластмассы, красители, ядохимикаты и многие другие органические вещества.
Толуол С6Н5-СН3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто- , мета- и пара-ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений.
Изопропилбензол (кумол) С6Н4-СН(СН3)2 – исходное вещество для получения фенола и ацетона.
Винилбензол (стирол) C6H5-CН=СН2 используется для получения ценного полимерного материала полистирола, т.к. очень легко полимеризуется.
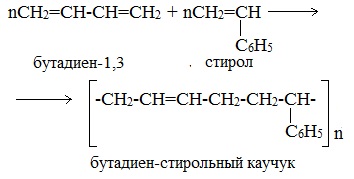
Особенно ценна его способность к совместной полимеризации с бутадиеном, в результате которой получают различные сорта бутадиенстирольных каучуков (жаро- и морозоустойчивые, прочные на износ, высокоэластичные, устойчивые к маслам). Из них изготовляют шины, ленты для транспортеров, эскалаторов, облегченную микропористую подошву.
Применение бензола
Применение бензола: анилин
Применение бензола: полистирол
Применение толуола: тол
Ароматические углеводороды (арены)
Особенности структуры
Термин «ароматический» присвоен классу до того, как был обнаружен физический механизм, определяющий ароматичность. Его придумали просто потому, что многие арены имеют сладкий запах. Бензольным кольцом называют конфигурацию из шести атомов углерода. Оно присуще почти всем представителям класса, которые могут быть моноциклическими и полициклическими.
Некоторые, не основанные на бензоле соединения, называемые гетероаренами, следуют правилу Хюккеля, также называются ароматическими. В них по меньшей мере один атом углерода заменён одним из гетероатомов кислорода, азотом или серой. Примером таких веществ является гетероциклическое соединение фуран с пятичленным кольцом и атомом кислорода. А также пиридин с шестичленным кольцом и азотом.
Простейшим представителем гомологического ряда аренов является бензол (С6Н6). Его структурный вид — это плоская молекула в форме правильного шестиугольника. В ней все углерод-углеродные связи имеют одинаковую длину. Молекулярное строение включает 6 p-электронов делокализованных выше и ниже плоскости кольца. Такая особенность делает бензол очень стабильным. Следующий — это метилбензол (толуол), у которого один из атомов водорода присоединён к кольцу и заменён метильной группой — С6Н5СР3. К характерным свойствам ароматических углеводородов относятся:
- обладают ароматичностью;
- все соединения имеют изомерию боковых цепей;
- имеют высокое соотношение углерода и водорода;
- легко горят;
- подвергаются реакциям электрофильного и нуклеофильного ароматического замещения.
Реакция, которая образует соединения арена из полностью или частично ненасыщенного предшественника, называется просто — ароматизацией. Существует много лабораторных способов синтеза аренов. Например, ароматизация циклогексанов и других алифатических колец. В таких реакциях реагенты представляют собой катализаторы, используемые в гидрировании, такие как платина, палладий и никель. Для получения ареновых соединений в качестве сырья используют нефть и нефтепродукты.
Физические и химические свойства
Летучие ароматические углеводороды легко воспламеняются и горят ярким, коптящим пламенем, оставляя мало углеродного остатка. Помимо горения, выделяют следующие физические свойства аренов:
- Точка кипения. Поскольку на бензольной молекуле нет постоянного диполя, единственное притяжение между ними — дисперсионные силы Ван-дер-Ваальса. Бензол кипит при 80 °C, что значительно выше, чем у других углеводородов схожего молекулярного размера (например, пентана и гексана). Метилбензол кипит при 111 °C. Это большая молекула и она имеет постоянный диполь.
- Точка плавления. Бензол плавится при 5,5 °C, толуол при -95 °C. Молекулы должны эффективно упаковываться в твёрдом теле, если они хотят наилучшим образом использовать свои молекулярные силы. Метильная группа, торчащая в метилбензоле, имеет тенденцию нарушать плотность упаковки. Поэтому температура плавления у него ниже.
- Растворимость в воде. Арены таким свойством не обладают. Бензол довольно большой по сравнению с водной молекулой. Надо сказать, что для растворения бензольному соединению пришлось бы разорвать множество существующих водородных связей между частицами воды. При этом нужно ещё сломать дисперсионные силы. Оба этих занятия стоят большого количества энергии.
Основными типами химических реакций с участием ароматических колец являются присоединение, окисление и замещение. Последняя — самая распространённая. Химические свойства аренов:
- Ароматическое замещение. Один заместитель в ареновом кольце, обычно водород, заменяется другим. Двумя основными типами являются электрофильное и нуклеофильное ароматическое замещение. А также нитрирование, например, салициловой кислотой, алкилирование и другие.
- Сочетание. Здесь металл катализирует связь между двумя фрагментами формального радикала. Обычно такие реакции с аренами приводят к образованию новых углерод-углеродных связей. Например, алкиларенов, виниларенов, биарилов, анилинов (углерод-азотные связи) или арилоксисоединений (углерод-кислород).
- Гидрирование. Эта реакция создаёт насыщенные кольца. Например, соединение резорцин, гидрированное никелем Ренея в присутствии одного гидроксида натрия, образует энолы, которые алкилируются йодистым метилом до 2-метил-1,3-циклогександиона.
- Присоединение. Реакция циклоприсоединения не распространена.
- Деароматизация. В органической химии представляет собой реакцию, при которой продукты утрачивают ароматичность. Здесь арены выступают реагентами.
Ароматические соединения обладают высокими показателями поглощения и преломления УФ и видимой части спектра.
Классификация и номенклатура
Многие производные бензола приобрели довольно тривиальные названия. Например, имя для C6H5 — фенил. Более сложные кольцевые системы, имеющие два и более бензольных кольца, имеют несистематические наименования и нелогичные системы нумерации. Они описаны как многоядерные ароматические углеводороды.
Три наиболее важных — нафталин, антрацен и фенантрен. Названия, которые были даны этим и другим сложным типам соединений, по большей части неинформативны в отношении их структур. Классификацию аренов можно представить в виде таблицы:
| Системы π-связи, кол-во π-электронов | Представители | Пояснения |
|---|---|---|
| 2 | производные катиона (перхлорат циклопропенилия) | |
| 6 | бензол и гомологичные соединения | |
| дианион циклобутадиена | ||
| пирол, фуран и др. | ||
| циклопентадиен-анион | ||
| 10 | нафталин | конденсированные бензольные кольца, широко встречающиеся в природе |
| азулен | входит в состав эфирных масел | |
| азонин | ||
| индол | распространены в природе | |
| пурин | содержат атомы азота | |
| 14 | фенантрен | такие соединения называют полиценами |
| [14]-аннулен | ||
| от 15 и более | кекулен | |
| коронен | антиароматичен, его π-электронная система 18 внешних и 6 внутренних электронов | |
| 18-аннулен |
Если бензольное кольцо не может расположиться в плоскости, один его атом выводится из неё. При этом он сохраняет sp3-гибридизацию, а также не принимает участия в сопряжении. Такие соединения классифицируются как гомоароматичные.
Типичный представитель — трисгомоциклопропенильный катион. Ещё один вид — спироароматичные системы, которые подчиняются правилу Хюккеля. Примером служит [4,2]спирарен.
Области применения
Многие, возможно, и не слышали о бензоле и его производных, но скорее всего все сталкивались с продуктами, производимыми с ним каждый день. Пластмассы, моющие средства, пестициды и даже красители, используемые для окрашивания одежды, пищевых и фармацевтических продуктов, изготавливаются с применением бензольных соединений.
Молекулы производных бензола довольно универсальны и сегодня широко используются в промышленности. Первым стоит выделить этилбензол. Заменяет один из атомов водорода, присоединённых к кольцу, этильной группой. Естественным образом содержится в каменноугольной смоле и нефти. Из него производят чернила, пестициды, краски и другие химикаты. Однако основное применение этилбензола заключается в производстве стирола, а затем полистирола:
- Стирол. Используется для изготовления латекса и синтетического каучука. Можно посмотреть на нижнюю часть придверного коврика, который обычно есть в каждом доме. Его резиновая подложка, скорее всего, сделана из стирол-бутадиенового каучука — типа стирола. Он также используется для конвейерных лент, напольных покрытий, изоляции проводов и даже для резиновых обувных подошв.
- Полистирол. Изготовлен из стирола. Является распространённым материалом для производства упаковки для пищевых продуктов, одноразовых стаканчиков, контейнеров.
В какой-то момент большинство людей принимает аспирин для лечения головной боли, ушибов или снижения температуры. Этот препарат на самом деле сделан с применением фенола, ещё одним производным бензола. Он также используется в изготовлении пластмасс, взрывчатых веществ и красителей, используемых для одежды и пищевых продуктов (азокраситель). Сам фенол часто применяется в качестве антисептика и дезинфицирующего средства в бытовых чистящих составах, конечно, в низких концентрациях. Кстати, это соединение было одним из первых антисептических средств для, применённых в хирургии Джозефом Листером.
Ещё одним универсальным производным бензола является анилин. Используется для производства многих продуктов, как и предыдущие представители. Например, входит в состав ацетаминофена, или тиленола, другого безрецептурного обезболивающего средства. Применяется в процессах деревообработки. Все яркие элементы мебели изготовлены с его участием.
Толуол в настоящее время часто используется в качестве заменителя бензола, например, как присадка к топливу. Свойства обоих растворителей похожи, но этот менее токсичен и имеет более широкий диапазон содержания жидкости. Бензол также используют в качестве бензиновой добавки, он повышает октановое число и снижает детонацию.
Все ароматические соединения проявляют уникальные химические и физические свойства благодаря своей дополнительной стабильности. Применение аренов довольно масштабно и распространяется на многие отрасли промышленности. Например, фенантрен является промежуточным продуктом различных синтетических процессов для производства красителей, взрывчатых веществ и лекарств. Катехин (пирокатехол) — один из ключевых компонентов фотографического проявителя.
Влияние на человека
Ароматические углеводороды выделяются главным образом в результате антропогенных процессов, например, из-за неполного сгорания органического топлива. Их нахождению в окружающей среде способствуют такие природные явления, как извержение вулканов и лесные пожары. Арены присутствуют в окружающей среде в виде частиц или в газообразной форме, в зависимости от их летучести. В атмосфере эти соединения реагируют с другими загрязнителями, такими как диоксид серы, оксид азота и озон.
На людей воздействует смесь ароматических углеводородов в газообразной или дисперсной формах. Некоторые арены считаются канцерогенами, вдыхание которых несёт потенциальный риск для здоровья. Это связанно с возникновением рака лёгких. Основными источниками токсичных выбросов являются:
- Отопление и приготовление пищи путём сжигания и пиролиза угля, нефти, газа, мусора и древесины.
- Выбросы от промышленной деятельности. Например, при производстве первичного алюминия и кокса, резиновых шин и цемента, битума и асфальта, тепла и электроэнергии, сжигании отходов.
- Мобильные источники. Выхлопные газы от транспортных средств, включая автомобили, железные дороги, корабли, самолёты и другие.
- Сельское хозяйство. Ароматические соединения образуются в результате открытого сжигания биомассы.
Ароматические углеводороды могут попасть в организм человека в процессе дыхания, при употреблении пищи или воды, а также через кожные покровы. Они транспортируются во все органы и ткани, которые содержат жировые клетки.
При многократном длительном воздействии арены накапливаются в печени, почках, селезёнке и даже яичниках, вызывая рост раковых клеток. Помимо этого, соединения могут способствовать развитию сердечно-сосудистых заболеваний.
Теория
| 1. | Физические свойства бензола и его гомологов | |
| 2. | Химические свойства бензола | |
| 3. | Химические свойства гомологов бензола | |
| 4. | Стирол: свойства и получение | |
| 5. | Получение и применение бензола и его гомологов |
Задания
| 1. |
Физические свойства аренов
Сложность: |
1 |
| 2. |
Выбери формулы реагентов
Сложность: |
1 |
| 3. |
Применение бензола
Сложность: |
1 |
| 4. |
Реакции бензола
Сложность: |
2 |
| 5. |
Получение веществ
Сложность: |
2 |
| 6. |
Продукты реакций
Сложность: |
3 |
| 7. |
Вещества в цепочке превращений
Сложность: |
3 |
| 8. |
Масса продукта реакции
Сложность: |
3 |
| 9. |
Состав смеси
Сложность: |
4 |
Экзаменационные задания (подписка)
| 1. |
Как на ЕГЭ. Определи вещества
Сложность: |
1 |
| 2. |
Как на ЕГЭ. Продукты реакций
Сложность: |
3 |
Тесты
| 1. |
Тренировка по теме Арены: свойства, получение и применение
Сложность: среднее |
12 |
Материалы для учителей
| 1. | Методическое описание |
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ.
Это циклические углеводороды с тремя двойными сопряженными связями в цикле.
Бензол С6Н6 – родоначальник ароматических углеводородов. Впервые выделен Фарадеем в 1825г из светильного газа.
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 1200.
Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
р-Электроны всех атомов углерода образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между одинарной и двойной.
Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены (делокализованы).
Общая формула гомологического ряда бензола CnH2n-6 (n ≥ 6).
|
Вещество |
Название по номенклатуре |
Историческое название |
|
С6Н5-СН3 |
метилбензол |
Толуол |
|
С6Н5-СН2-СН3 |
этилбензол |
— |
|
СН3-С6Н4-СН3 |
диметилбензол |
ксилол |
|
С6Н5-СН(СН3)2 |
изопропилбензол |
кумол |
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Кольцо нумерют так, чтобы номера радикалов были наименьшими.
Для дизамещенных бензолов
R-C6H4-R’
используется также другой способ построения названий:
орто— (о-) заместители у соседних атомов углерода кольца, 1,2-;
мета— (м-) заместители через один атом углерода (1,3-);
пара-(п-) заместители на противоположных сторонах кольца(1,4-).
Изомерия у аренов.
Определяется числом заместителей, их расположением в бензольном кольце и возможностью изомерии углеродного скелета в заместителях, содержащих более трёх атомов углерода.
Для ароматического углеводорода С8Н10 существуют 4 изомера: орто-, мета- и пара-ксилолы и этилбензол.
ПОЛУЧЕНИЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
1. Дегидрирование циклоалканов
2. Дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора
3.Тримеризация ацетилена над активированным углем (реакция Зелинского):
4.Алкилирование бензола галогеналканами в присутствии безводного хлорида алюминия или алкенами:
ФИЗИЧЕСКИЕ СВОЙСТВА.
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом, с плотностью менее 1 г/мл. Огнеопасны. Нерастворимы в воде, но хорошо растворимы в неполярных растворителях. Бензол и толуол ядовиты (поражают почки, печень, костный мозг, кровь).
Высшие арены – твердые вещества.
ХИМИЧЕСКИЕ СВОЙСТВА.
Из-за наличия делокализованой -системы арены мало характерны реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции электрофильного замещения атомов водорода, связанных с циклом — SЕ.
1. РЕАКЦИИ ПРИСОЕДИНЕНИЯ К АРЕНАМ
В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
а. Гидрирование. Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
б. Радикальное хлорирование. При радикальном хлорировании бензола получается гексахлорциклогексан — «гексахлоран» (средство борьбы с вредными насекомыми).
2. РЕАКЦИИ РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ АТОМОВ ВОДОРОДА В БОКОВОЙ ЦЕПИ:
В случае гомологов бензола при действии хлора на свету или при нагревании происходит реакция радикального замещения в боковой цепи:
3. Реакции окисления аренов
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко. При действии раствора KMnO4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи, при этом от боковой цепи остаётся карбоксильная группа, а остальное – переходит в углекислый газ:
5С6Н5—СН3 +6КМnO4+9H2SO4 🡪5C6H5—COOH +6MnSO4+3K2SO4+14H2O
5С6Н5—CH2—CH3 +12КМnO4+18H2SO4🡪5C6H5—COOH +5СО2+12MnSO4+6K2SO4+28H2O
Если окисление идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты и карбонат калия:
С6Н5—СН2—СН3+4KMnO4🡪C6H5 – COOK+K2CO3+4MnO2+KOH+2H2O
4.РЕАКЦИИ ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ
1. Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п.:
2. Нитрование
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
3. Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование) происходит под действием алкилгалогенидов в присутствии катализаторов AlCl3, FeBr3или алкенов в присутствии фосфорной кислоты:
ЗАМЕЩЕНИЕ В АЛКИЛБЕНЗОЛАХ
Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. Например, при нитровании толуола С6Н5-CH3 может происходить замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола, причём в орто- и пара- положениях:
ОРИЕНТИРУЮЩЕЕ ДЕЙСТВИЕ ЗАМЕСТИТЕЛЕЙ
В БЕНЗОЛЬНОМ КОЛЬЦЕ.
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные (первого рода) и электроноакцепторные (второго рода).
ЭЛЕКТРОНОДОНОРНЫЕ ЗАМЕСТИТЕЛИ проявляют повышают электронную плотность в сопряженной системе.
К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях:
Алкильные группы не могут участвовать в сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности.
Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара— положениях бензольного кольца и называются заместителями (ориентантами) первого рода:
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения:
ЭЛЕКТРОНОАКЦЕПТОРНЫЕ ЗАМЕСТИТЕЛИ снижают электронную плотность в сопряженной системе.
К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, но меньше всего она уменьшается в мета-положениях:
Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца.
Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:
СТИРОЛ (винилбензол) С8Н8
– производное бензола, которое имеет в своём составе двойную связь в боковом заместителе, поэтому он НЕ относится к гомологическому ряду аренов.
Получение стирола:
- Дегидрирование этилбензола: С6Н5-СН2-СН3 -(t,кат)🡪 C6H5-CH=CH2 + H2
- Дегидрогалогенирование фенилбромэтана:
C6H5-CH-CH3 +KOH –(спирт) 🡪 C6H5-CH=CH2 +KBr +H2O
│
Br
Свойства стирола:
Стирол проявляет свойства, характерные для алкенов – реакции присоединения, окисления, полимеризации.
Реакции присоединения к стиролу: протекают в соответствии с правилом Марковникова.
С6Н5-СН=СН2 +Н2О 🡪 С6Н5-СН-СН3
│
ОН
Мягкое окисление стирола:
3С6Н5-СН=СН2 +2 KMnO4 + 4Н2О 🡪3 С6Н5-СН-СН2 + 2MnO2 + 2KOH
│ │
OH OH фенилэтиленгликоль
Жесткое окисление стирола:
С6Н5-СН=СН2 + 2KMnO4 + 3Н2SO4 🡪 С6Н5-СOOН + CO2 + 2MnSO4 + K2SO4 + 4H2O
бензойная кислота
3С6Н5-СН=СН2 + 10KMnO4 -to🡪 3С6Н5-СOOК + 3К2CO3 + 10MnO2 + KOH+ 4Н2О
бензоат калия
Полимеризация стирола: в результате получают полистирол.
План урока:
Определение и формула аренов
Строение молекулы бензола
Изомерия и номенклатура аренов
Методы получения аренов
Физические свойства ароматических соединений
Химические реакции ароматических углеводородов
Области применения аренов
Определение и формула аренов
Арены (ароматические углеводороды) – соединения, включающие устойчивый цикл из шести атомов углерода (бензольное кольцо). Важнейший представитель – бензол.
Общая формула ароматических углеводородов: CnH2n-6
Молекула бензола.
Строение молекулы бензола
Бензол – первый представитель гомологического ряда ароматических углеводородов, открытый в 1825 году Майклом Фарадеем. Т.к. его молекулярная формула – С6Н6, значит, в основе лежат двойные связи. Поэтому было предположено, что бензолу свойственна ненасыщенность. В 1865 году Фридрих Кекуле предположил структурную формулу бензола.
Но в экспериментах было доказано, что бензол входит в реакции присоединения только в жестких условиях и устойчив к реакциям окисления. Для него наиболее свойственно замещение, что доказывает принадлежность к предельным соединениям.
Парадоксальное электронное строение было доказано с помощью получения бензола из ацетилена. Его особенность заключается в том, что все атомы в кольце равноценны и имеют характер одинарных и кратных связей. Это можно отразить формулой с равномерным распределением электронной плотности.
Углеродные атомы в кольце имеют по четыре валентных электрона и им свойственна sp2-гибридизация. Атомы располагаются в единой плоскости. Особенности строения бензола состоят в том, что электроны составляют единую π-систему и все связи равноценны. Т.е. формула Кекуле неточна, т.к. отражает наличие двойных связей. Бензольное кольцо – это циклическая сопряженная система, связи которой перекрываются между собой.
Пространственное строение бензола Источник
Изомерия и номенклатура аренов
Для бензола и его гомологов характерна только структурная изомерия, которая включает:
- изомерию углеродного скелета боковой цепи,
- изомерию положения заместителей в кольце.
Источник
Главной цепью в названии аренов принимается ароматическое кольцо, от которого отходят заместители. В следующем представителе гомологического ряда ксилоле (диметилбензоле) имеет значение положение заместителей в кольце. Для его обозначения используются различные приставки:
- орто- (о-) – заместители находятся у соседних углеродных атомов в кольце,
- мета- (м-) – заместители находятся через один атом,
- пара- (п-) – заместители находятся через два атома.
Методы получения аренов
В промышленности бензол и его гомологи можно получить несколькими способами.
- Из каменноугольной смолы.
- Дегидрирование и циклизация алканов при катализаторе и под действием высоких температур.
- Дегидрирование циклоалканов при катализаторе и под действием высоких температур
В лаборатории моноциклические соединения также получают несколькими путями.
- Циклотримеризация ацетилена и его гомологов при катализаторе и под действием высоких температур (реакция получения бензола)
- Реакция Вюрца-Фиттига – взаимодействие галогеналканов и арилгалогенидов с металлическим натрием
- Алкилирование галогеналканами, алкенами и спиртами в присутствии кислот Льюиса
Физические свойства ароматических соединений
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом. Нерастворимы в воде, но растворимы в органических растворителях. Их плотность меньше плотности воды. Они огнеопасны и токсичны для животных и человека.
Химические реакции ароматических углеводородов
Несмотря на то, что бензол включает систему из сопряженных кратных связей, аренам не характерны реакции обесцвечивания бромной воды и перманганата калия.
Реакции присоединения
Бензолу характерны реакции присоединения, образуя циклогексан или его производные.
Реакции замещения
Аренам характерны реакции замещения.
Окисление аренов
При неполной химической реакции окисления гомологи бензола образуется бензойная кислота. Самому бензолу реакции окисления перманганатом калия не характерны.
Полимеризация аренов
В реакции полимеризации способен вступать стирол, образуя полистирол.
Области применения аренов
Без бензола и его гомологов невозможно представить современное промышленное производство. Основные области применения бензола – производство этилбензола, кумола и циклогексана и анилина.
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Строение аренов
Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н.
Структурная формула бензола:
Сокращенная структурная формула бензола:
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации.
Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 1200:
Атомы углерода и водорода в молекуле бензола, соединенные σ-связями, образуют правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
Негибридные р-орбитали атомов углерода образуют единую циклическую (ароматическую) π-систему – единое электронное облако над и под плоскостью кольца.
Соответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь).
Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника и кружка внутри него, который обозначает делокализованные π-связи:
Гомологический ряд аренов
Простейший представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
Еще один представитель гомологического ряда бензола – этилбензол:
Изопропилбензол (кумол):
Номенклатура аренов
Первый представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
Например, 1,2-диметилбензол
Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок:
- орто— (о-) если заместители расположены у соседних атомов углерода в бензольном кольце (1,2-положения);
- мета— (м-) заместители расположены через один атом углерода (1,3-положения);
- пара— (п-) заместители расположены на противоположных сторонах кольца (1,4-положения).
Для названия многих производных бензола используют тривиальные названия:
| Структурная формула | Системное название | Тривиальное название |
 |
Метилбензол | Толуол |
 |
1,2-Диметилбензол | орто-Ксилол |
 |
Изопропилбензол | Кумол |
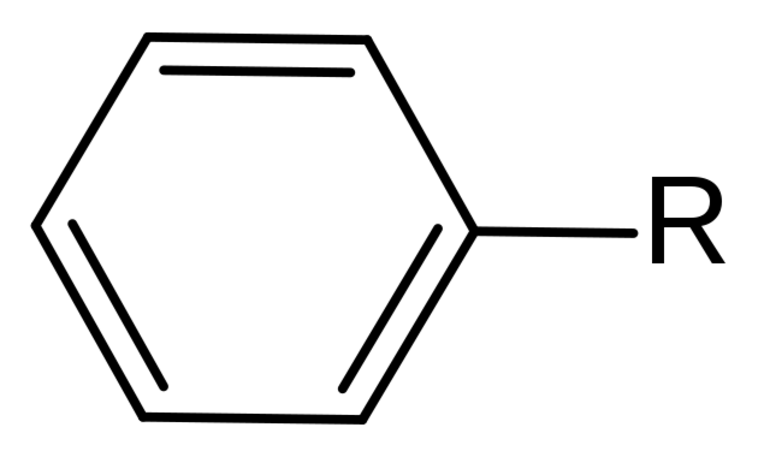
Названия радикалов, содержащих ароматическое кольцо:
Изомерия аренов
Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
- Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
Формуле С9Н12 соответствуют изомеры изопропилбензол и пропилбензол
- Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
Формуле С8Н10 соответствуют изомеры 1,3-диметилбензол, 1,2-диметилбензол и др.
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму
Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца.
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
Например, при хлорировании толуола на свету образуется бензилхлорид
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, этилбензол реагирует с хлором на свету
2. Реакции замещения
Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.).
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо.
Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения
Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
Серная кислота способствует образованию электрофила NO2+:
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
Уравнение сгорания аренов в общем виде:
CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. Окисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты.
Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ
Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода).
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода.
В уравнении реакции в качестве продукта записывается либо орто-хлортолуол, либо пара-хлортолуол.
Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-бромнитробензол. Нитро-группа — заместитель второго рода
5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации.
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
Например, при гидратации стирола образуется спирт:
Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород
Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):