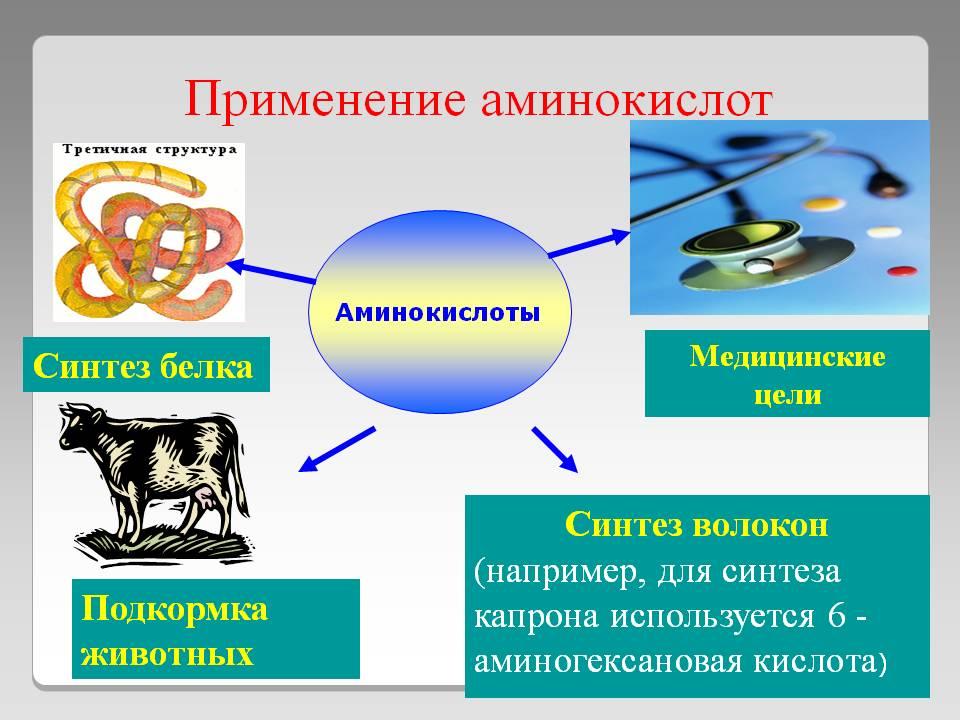
Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
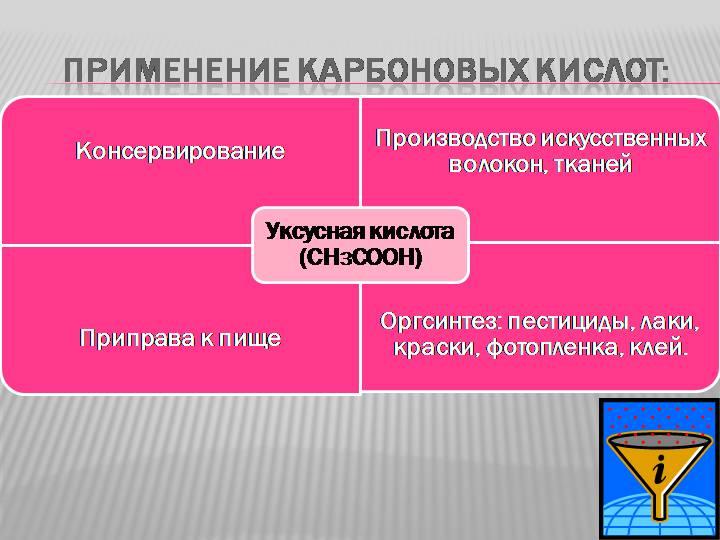
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
Применение
веществ
Органика
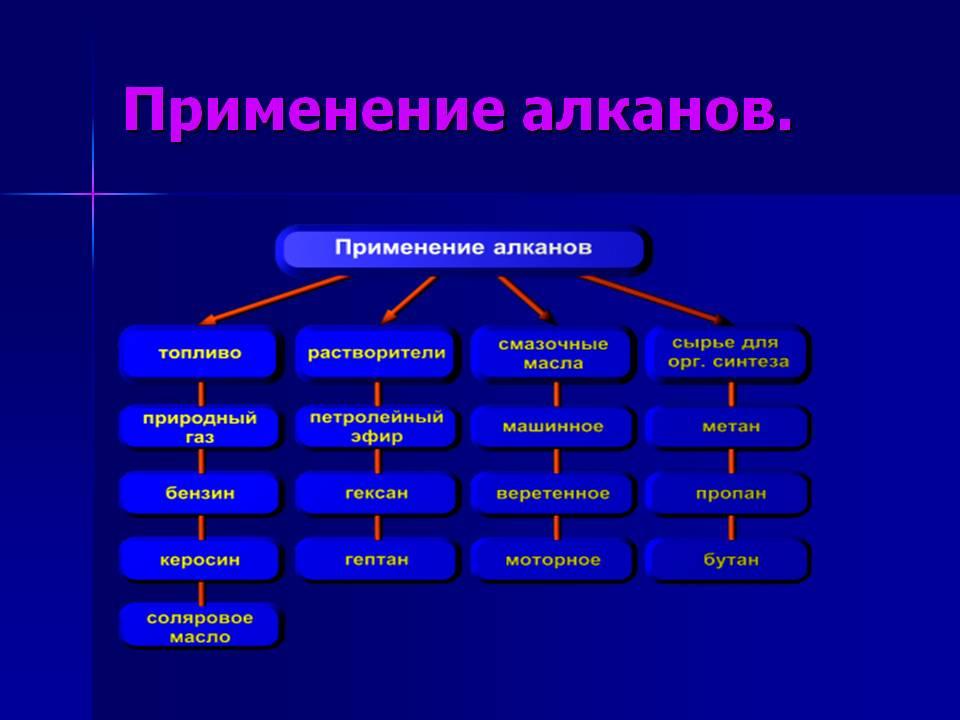
Алканы
Алканы
используются при изготовлении каучука,
синтетических тканей, пластмасс,
поверхностно-активных веществ.
Пропан,
бутан – исп-ся в качестве заправки
баллонов для тушения пожаров в сжиженном
виде
Пропан-бутановая
— смесь в зажигалках
Пропан
— баллоны для дачи
Алканы-газы
– в качестве пропеллентов для изготовления
аэрозолей
СН4
– горючее для газовых плит
С5-С19
– бензин, керосин, смеси для розжига,
топливо
С20
и далее – свечи
С₁₈Н₃₈
до С₃₅Н₇₂ (парафин) — Изготовление
вазелинового масла (смесь жидких
алканов), вазелина (смесь жидких и твёрдых
алканов), свечей, моющих средств, лаков,
эмалей, мыла. В качестве пропитки спичек.
Использование при производстве
органических кислот. В качестве пропитки
упаковочной бумаги. Производство
жевательных резинок
Хлорпроизводные
алканов — изготовление спиртов, альдегидов,
кислот, РАСТВОРИТЕЛИ
Алкены
Циклоалканы
Циклопропан
– анестетик
Циклопентан
— добавка к моторному топливу для
повышения качества.
Циклогексан
используется для синтеза полупродуктов
при производстве синтетических волокон
нейлона и капрона, для получения
циклогексанола, циклогексанона,
адипиновой кислоты, а также в качестве
растворителя.
Алкины
Ацетилен
– газовая сварка, получение технического
карбона; прим-ся в автономных светильниках
и при производстве ракетного топлива
Алкадиены
Синтез
каучуков => пол-е резины, эбонита (не
проводит эл. ток, исп-ся для изоляции),
пвх и т.д.
Бензол
Применяется
в синтезе современных отхаркивающих
средств, препаратов для лечения кожных
заболеваний и других лекарств. В малых
количествах практически не обладает
токсичностью. Применяется в качестве
исходного реагента для синтеза. Он
эффективно растворяет смолы, масла,
жиры, йод и серу.
Бензойная
кислота
Снижает
активность ферментов в структуре
микробов их
Проявляет
дезинфицирующие свойства.
Это
качество нашло активное применение
бензойной кислоты и с успехом используется
для изготовления лекарственных составов
от кашля, отхаркивающих и антисептических
средств
Получение
фунгицид, применяющихся в сельском
хозяйстве для защиты разнообразных
культурных растений.
Консервавнт
Толуол
Лакокрасочные
материалы
Лаки
Краски
РАСТВОРИТЕЛЬ
полимеров
Спирты
—
В
органическом синтезе.
— Биотопливо,
добавки в топливо, ингредиент тормозной
жидкости, гидравлических жидкостей.
—
Растворители.
— Сырье для производства
ПАВ, полимеров, пестицидов, антифризов,
взрывчатых и отравляющих веществ,
бытовой химии.
— Душистые вещества
для парфюмерии. Входят в состав
косметических и медицинских средств.
—
Основа алкогольных напитков, растворитель
для эссенций; сахарозаменитель (маннит
и т.п.); краситель (лютеин), ароматизатор
(ментол).
Этиленгликоль
Производство
теплоносителей и охлаждающих жидкостей,
задачами которых является теплопередача
и теплоотвод соответственно. Производство
пластиковых бутылок. Производство
синтетических волокон. Производство
гидравлических жидкостей. Изготовление
лекарственных средств.
Глицерин
Фенол
АНТИСЕПТИКИ,
лекарства, заменители сахара, красители,
клеи, фенолформальдегидная смола
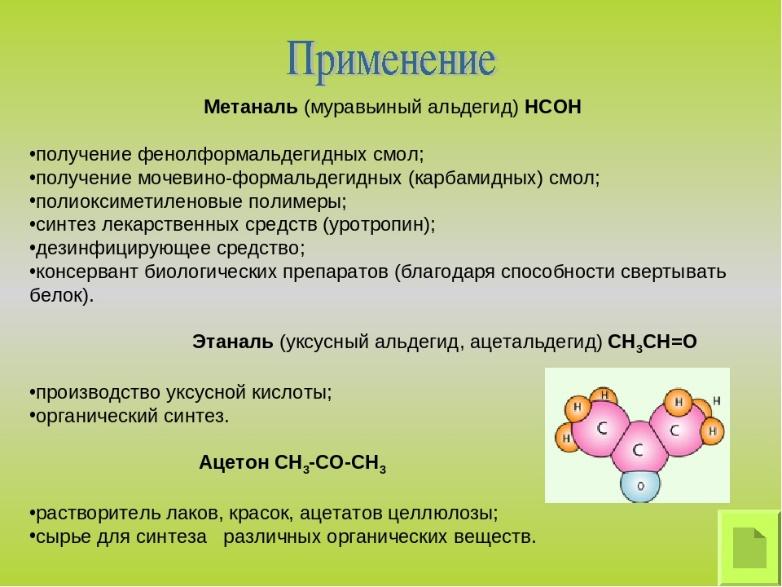
Альдегиды
и ацетон
Альдегиды
нашли широкое применение в качестве
сырья для синтеза различных продуктов.
Так, из формальдегида (крупнотоннажное
производство) получают различные смолы
(фенол-формальдегидные и т.д.), лекарственные
препараты (уротропин); ацетальдегид —
сырье для синтеза уксусной кислоты,
этанола, различных производных пиридина
и т.д. Многие альдегиды (масляный, коричный
и др.) используют в качестве ингредиентов
в парфюмерии
Карб
кислоты
Стеарат/пальмитат
натрия – мыло
Амины
Нитросоединения
Аминокислоты
Жиры
Неорганика
Нитраты
– азотсодержащие удобрения
Фосфат,
гидрофосфат кальция; суперфосфат –
фосфорные удобрения
SiO2
– керамика, стекло
S
– резина
NaHCO3
– разрыхлитель теста, чистящее средство
(NH4)2CO3
– разрыхлитель теста
С
акт. – поглотитель в фильтрах и при
отравлениях
ССl4
– растворитель
NH3
– пол-е удобрений, пол-е азотной к-ты
NH3*H2O
– стеклоочистительные ж-ти и при потере
сознания
O3
– Дезинфекция воды; обнаруживание KI
с крахмалом
Cl2
– Дезинфекция воды; обнаруживание KI
с крахмалом
Лимонная
кислота – удвление накипи с внутр.
пов-ти чайника
H2O2
– антисептик для ран
I2
— антисептик для ран; обнар-е крахмала
№ п/п
Вещество
Применение
1
Сера
Для получения серной кислоты, вулканизации каучука (производство резины), изготовления горючих и светящихся составов, в сельском хозяйстве и в медицине.
2
Соляная кислота
Пищевая добавка Е507, которая применяется в процессе изготовления водочной продукции, а так же различных сиропов. В металлургии для очистки металла перед паянием или лужением. Входит в состав чистящих средств.
3
Серная кислота
Очистка нефтепродуктов от сернистых, непредельных органических соединений; Удаление окалины с проволоки, а также листов перед лужением и оцинкованием (разбавленная), для травления различных металлических поверхностей перед покрытием их хромом, медью, никелем. Средство при получении красителей и лекарственных веществ, для производства удобрений, этилового спирта, искусственного волокна, анилиновых красителей.
4
Сероводород и сульфиды
В производстве серной кислоты, в медицине, для проведения химического анализа катионов.
5
Сернистый газ (SO2) и сульфиты
В производстве серной кислоты, получение бумаги, для отбеливания шелковых и шерстяных тканей, для уничтожения микроорганизмов и грибковых заболеваний (окуривание виноградников, подвалов, добавление в вино). Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве консервирующего агента.
6
Оксид серы (VI)
Для получения серной кислоты.
7
Соли серной кислоты
- Na2SO4 ∙ 10H2O (глауберова соль) – применяют в медицине в качестве слабительного средства, а безводный сульфат натрия – для производства соды и стекла.
- (NH4)2SO4 – азотное удобрение, K2SO4 – калийное удобрение.
- CaSO4 ∙ 2H2O (гипс) – в медицине и строительстве.
- MgSO4 (горькая соль) – в медицине в качестве слабительного средства.
- ВаSO4 (баритовая каша) – в медицине как рентгеноконтрастное вещество.
- Купоросы: CuSO4 ∙ 5H2O – используют для протравливания семян, для борьбы с болезнями растений; FeSO4 ∙ 7H2O – для приготовления чернил, минеральных красок; ZnSO4 ∙ 7H2O – для производства минеральных красок и в медицине (как антисептик).
8
Азот
Жидкий азот применяется для глубокого охлаждения, газообразный – для синтеза аммиака, для создания инертной атмосферы (лампы накаливания, сварка).
9
Азотная кислота
Производство азотных и комбинированных удобрений (натриевой, аммиачной, кальциевой и калиевой селитры, нитрофоса, нитрофоски). Взрывчатые вещества (тринитротолуола и др.), органических красителей. В металлургии — для растворения и травления металлов, а также для разделения золота и серебра.
10
Аммиак
Производство азотной кислоты, которая идет на производство удобрений (аммиачная селитра NH4NO3, мочевины (NH2)2CO, аммофос – смесь гидрофосфата (NH4)2HPO4 и дигидрофосфата аммония NH4H2PO4). В качестве дешевого хладагента в промышленных холодильных установках. Для получения синтетических волокон, например, найлона и капрона. При очистке и окрашивании хлопка, шерсти и шелка. Водный раствор аммиака (нашатырь) – в медицине.
11
Соли аммония
Производство взрывчатых веществ в смеси с порошками алюминия и угля при горных разработках, в качестве удобрений, при пайке металлов.
12
Оксиды азота
N2O – в медицине (наркоз), NO2 – производство азотной кислоты.
13
Водород
Экологически чистое топливо, для сварки и резки металлов, для получения металлов, аммиака, метанола, хлороводорода, гидрирования жидких жиров (в производстве маргарина).
14
Кислород
Реагент в органическом и неорганическом синтезе, для обеспечения дыхания в медицине.
15
Фосфор
Производство фосфорных удобрений (фосфоритной муки, простых и двойных суперфосфатов, комплексных азотно-фосфорных удобрений). Производство синтетических моющих средств, фосфатных стёкол, для обработки и крашения натуральных и синтетических волокон.
16
Оксид фосфора (V)
Получение ортофосфорной кислоты, в качестве осушителя (поглощает воду)
17
Ортофосфорная кислота
Производство фосфорных удобрений, в органическом синтезе.
18
Галогены
- Фтор — для получения смазочных веществ, выдерживающих высокую температуру, тефлона, фреонов и т.д.
- Хлор – в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов, для отбеливания тканей и целлюлозы, идущей на изготовление бумаги, для стерилизации питьевой воды и обеззараживания сточных вод, полимеров.
- Бром — выработка различных лекарственных веществ, расителей, а также бромида серебра, использующегося в производстве фотоматериалов.
- Йод — в медицине в виде 10%-го раствора в этаноле в качестве антисептического и кровоостанавливающего средства. Йод входит в состав ряда фармацевтических препаратов.
19
Хлориды
- NaCl – для получения хлороводорода, натрия, хлора, едкого натра, водорода, в производстве соды, в пищевой промышленности медицине.
- KCl – в качестве калийного удобрения.
- ZnCl2 – для пропитки древесины от гниения и при пайке металлов, в медицине в качестве антисептика.
- BaCl2 — для борьбы с вредителями растений.
- CaCl2 — в качестве осушителя и в медицине.
- AlCl3 – катализатор в органическом синтезе.
- HgCl2 – для протравливания семян, дубления кожи в органическом синтезе.
20
Углерод
Алмазы применяются для обработки твёрдых материалов (бурение горных пород, металлообрабатывающий инструмент) в ювелирной промышленности (производство бриллиантов). Графит используется в производстве карандашей и электродов. Уголь и кокс используют в качестве топлива и для получения металлов, активированный уголь является адсорбентом.
21
Угарный газ
В качестве топлива, при получении метанола, металлов, фосгена (COCl2), в органическом синтезе.
22
Углекислый газ
В производстве напитков, соды, сахара, в огнетушителях, для хранения скоропортящихся продуктов («сухой лёд»), для получения угарного газа и участвует в процессе фотосинтеза.
23
Соли угольной кислоты
- Na2CO3 – кальцинированная сода и Na2CO3 ∙ 10Н2О – кристаллическая сода применяются в производстве бумаги, стекла, мыла, в быту.
- NaHCO3 – гидрокарбонат натрия (питьевая сода, двууглекислая сода) применяется в медицине, в пищевой и кондитерской промышленности.
- K2CO3 – поташ, применяется для производства мыла и специальных сортов стекла, в химической промышленности.
- CaCO3 – применяется для получения негашеной извести CaO, в строительстве, в архитектуре, для изготовления скульптур.
24
Кремний
Для получения легированных сталей, производства полупроводниковых приборов и изготовления кислотоустойчивой аппаратуры.
25
Оксид кремния (IV)
При производстве стекла, цемента, в строительстве, в производстве керамических изделий, химической посуды.
26
Натрий и калий
Получение пероксидов и амидов, сплав этих металлов используется в качестве теплоносителей в ядерных реакторах.
27
Бериллий
Получение сплавов
28
Медь
Для изготовления электропроводов и сплавов – бронзы, латуни, дюралюминия.
29
Серебро
Компонентов сплавов ювелирных изделий, монет, медалей, столовой и лабораторной посуды, для серебрения зеркал, как катализатор в органическом синтезе.
30
Цинк
Получение сплавов, для цинкования стали и чугуна в антикоррозионных целях.
31
Хром
Компонент стали (хромированная сталь), изготовление инструментов.
32
Железо
В качестве катализатора (губчатое железо), производство чугуна и сталей.
33
Алюминий
Используется для изготовления различных сплавов, применяемых в авиационной, машиностроительной, пищевой и электротехнической промышленности; для получения металлов методом алюмотермии (Cr, Mn, V, Ti и др.)
34
Ртуть
Производство люминесцентных и ртутных ламп, контрольно-измерительных приборов (термометров, манометров, барометров и т.д.), в медицине для изготовления мазей для лечения кожных заболеваний.
35
Гидроксид натрия
NaOH (едкий натр, каустическая сода, каустик) применяют для очистки нефтепродуктов, в производстве мыла, бумаги, в текстильной и химической промышленности.
36
Гидроксид кальция
В строительстве, производстве стекла, смягчитель воды.
37
Гидроксид магния
Очистка сахарных растворов, входит в состав зубной пасты.
38
Гидроксид алюминия
Для очистки воды, в медицине как обволакивающее и адсорбирующее вещество.
39
Алканы (метан, пропан)
В качестве топлива, как растворители и как сырьё для получения органических веществ.
40
Алкены (изопрен, этилен, пропилен)
Получение полимеров, фенола, ацетона, ацетальдегида, растворителей; для улучшения детонационных качеств топлива. Этилен – для ускорения созревания плодов растений.
41
Алкины
Ацетилен используется для резки и сварки металлов, в органическом синтезе: в производстве синтетических каучуков, поливинилхлорида, уксусной кислоты и растворителей.
42
Алкадиены
Производство полимеров (каучуков).
43
Бензол и его производные
Получение красителей, лекарственных веществ, взрывчатых веществ, ядохимикатов, пластмасс и синтетических волокон; используются в качестве растворителей; добавляются в бензины, повышая их октановое число.
44
Спирты
В качестве растворителей и в органическом синтезе. Этанол применяется для изготовления спиртных напитков, в медицине как дезинфицирующее средство, в качестве топлива. В промышленности – растворитель в производстве каучука, сложных эфиров, лаков, медикаментов. Метанол применяют для получения формальдегида, растворителей, в органическом синтезе.
45
Многоатомные спирты
Этиленгликоль применяется для приготовления охлаждающей жидкости (антифризов) для автомобилей, для получения растворителей и взрывчатых веществ. Глицерин – используется в медицине, парфюмерии, кожевенной промышленности, для получения взрывчатого вещества (тринитроглицерин), лакокрасочных материалов.
46
Фенолы
Применяют для получения фенолформальдегидной смолы, взрывчатых веществ, красителей, лекарственных препаратов, капрона, для дезинфекции (карболка).
47
Альдегиды и кетоны
Формальдегид – используется для получения фенолформальдегидной и карбамидной смол, в органическом синтезе; 40%-ный раствор (формалин) применяется в медицине, для консервирования биологических препаратов, в кожевенной промышленности и для протравливания семян.
Ацетальдегид – применяется для получения уксусной кислоты и для синтеза различных органических веществ.
Ацетон – в качестве растворителя лаков, красок.
48
Карбоновые кислоты
Муравьиная кислота – 1,25% -ный спиртовой раствор (муравьиный спирт) применяется в медицине, для производства сложных эфиров.
Уксусная кислота – в пищевой промышленности, для производства красителей, лекарств (аспирин), сложных эфиров, ацетатного волокна.
Стеариновая C17H35COOH и пальмитиновая C17H33COOH кислоты – входят в состав жиров. Натриевая и калиевая соли входят в состав мыла.
Щавелевая кислота – используется в кожевенной и текстильной промышленности.
Акриловая и метакриловая кислоты – для получения полимеров (органического стекла), волокон.
Бензойная кислота – в качестве консерванта в пищевой промышленности.
49
Сложные эфиры
Применяются в качестве растворителей лакокрасочных материалов, в парфюмерии, при производстве напитков.
50
Жиры
Жиры применяются в качестве продукта питания, для получения мыла, в косметической и фармацевтической промышленности. Гидрированные жиры применяются для изготовления маргарина.
51
Целлюлоза
Нитраты целлюлозы используются для производства бездымного пороха и лаков, ацетаты – в производстве ацетатного волокна, лаков, плёнок. Целлюлоза используется в производстве бумаги, волокон (ацетатного и вискозного), одежды, бинтов, ваты
52
Крахмал
Применяется для получения клея (декстриновый клей), накрахмаливания белья, в кондитерском производстве (получение патоки), в производстве спирта и вина.
53
Амины
Анилин и другие ароматические амины используются для получения красителей, лекарственных и взрывчатых веществ. Алифатические амины используются для получения лекарственных препаратов, пестицидов и пластмасс.
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) пропилен
Б) пропан
В) изопрен
Г) глицерин
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение динамита
2) получение полипропилена
3) получение каучука
4) в качестве топлива
5) в металлургии
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
Установим соответствие.
А) Пропилен используется для получения полипропилена (2).
Б) Пропан часто используют в качестве топлива (4).
В) Изопрен — исходный мономер при получении каучука (3).
Г) Глицерин применяют для получения динамита (1).
Ответ: 2431.
Источник: РЕШУ ЕГЭ
| Глицерин | ||
|---|---|---|
|
||
 |
||
| Традиционные названия | глицерин | |
| Хим. формула | C3H8O3 | |
| Рац. формула | HOCH2-CH(OH)-CH2OH | |
| Молярная масса | 92,09 г/моль | |
| Плотность | 1,261 г/см³ | |
| Температура | ||
| • плавления | 17,9 °C | |
| • кипения | 290 °C | |
| • разложения | 554 ± 1 °F | |
| • вспышки | 320 ± 1 °F и 160 °C | |
| Давление пара | 0,003 ± 0,001 мм рт.ст. | |
| Показатель преломления | 1,4740 | |
| ГОСТ | ГОСТ 6824-96 ГОСТ 6823-2017 ГОСТ 6259-75 | |
| Рег. номер CAS | 56-81-5 | |
| PubChem | 753 | |
| Рег. номер EINECS | 200-289-5 | |
| SMILES |
OCC(O)CO |
|
| InChI |
1S/C3H8O3/c4-1-3(6)2-5/h3-6H,1-2H2 PEDCQBHIVMGVHV-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E422 | |
| RTECS | MA8050000 | |
| ChEBI | 17754 | |
| ChemSpider | 733 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
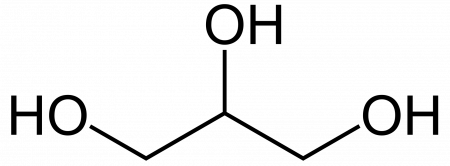
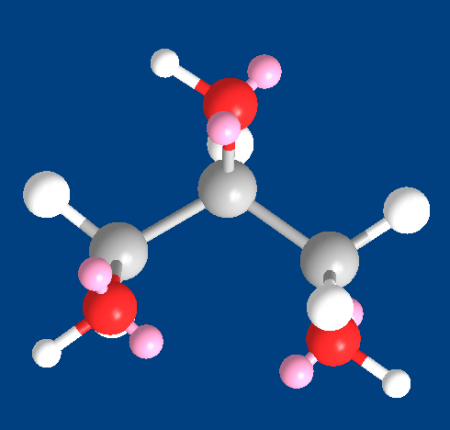
Глицерин (от греч. γλυκερός — сладкий) — органическое соединение, простейший представитель трёхатомных спиртов с формулой C3H5(OH)3. Представляет собой вязкую прозрачную жидкость со сладким вкусом.
Синонимы: глицерóл, пропантриол-1,2,3.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Производные глицерина и их место в обмене веществ живых организмов
- 4.1 Глицериды
- 5 Применение
Физические свойства
Бесцветная вязкая жидкость без запаха. Сладкий на вкус, отчего и получил своё название (греч. γλυκερός — сладкий). Имеет молярную массу 92,09 г/моль, относительную плотность d420 = 1,260, коэффициент преломления nD20 = 1,4740. Температура плавления составляет 17,9 °C, кипит при 290 °C, частично при этом разлагаясь. Гигроскопичен, поглощает воду из атмосферы в количестве до 40 % от собственной массы. С водой, метанолом, этанолом, ацетоном смешивается в любых пропорциях, но не растворим в эфире и хлороформе, хотя и способен растворяться в их смесях с этанолом.
При растворении глицерина в воде происходит выделение тепла и происходит контракция — уменьшение объёма раствора. Смеси глицерина с водой обладают температурой плавления значительно более низкой, чем каждое из веществ по отдельности, например, при массовом содержании глицерина в 66,7 % его смесь с водой будет замерзать при −46,5 °C.
Образует азеотропы с нафталином, его производными и рядом других веществ.
Химические свойства
Химические свойства глицерина типичны для многоатомных спиртов.
Взаимодействие глицерина с галогеноводородами или галогенидами фосфора ведёт к образованию моно- и дигалогенгидринов.
Глицерин этерифицируется карбоновыми и минеральными кислородосодержащими кислотами с образованием соответствующих сложных эфиров. Так, с азотной кислотой глицерин образует тринитрат — нитроглицерин (получен в 1847 г. Асканио Собреро), использующийся в настоящее время в производстве бездымных порохов.
При дегидратации он образует токсичный акролеин:
-
- HOCH2CH(OH)−CH2OH ⟶ H2C = CH−CHO + 2H2O,
и окисляется до глицеринового альдегида CH2OHCHOHCHO, дигидроксиацетона CH2OHCOCH2OH или глицериновой кислоты CH2OHCHOHCOOH.
Сложные эфиры глицерина и высших карбоновых кислот — жиры являются важными метаболитами, важное биологическое значение играют также фосфолипиды — смешанные глицериды фосфорной и карбоновых кислот.
Получение
Глицерин впервые был получен в 1779 году Карлом Вильгельмом Шееле при омылении жиров в присутствии оксидов свинца. Основную массу глицерина получают как побочный продукт при омылении жиров.
Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта. Хлорированием пропилена при 450—500 °С получают аллилхлорид, при присоединении к последнему хлорноватистой кислоты образуются хлоргидрины, например, CH2ClCHOHCH2Cl, которые при омылении щёлочью превращаются в глицерин.
На превращениях аллилхлорида в глицерин через дихлоргидрин или аллиловый спирт основаны другие методы. Известен также метод получения глицерина окислением пропилена в акролеин; при пропускании смеси паров акролеина и изопропилового спирта через смешанный ZnO — MgO катализатор образуется аллиловый спирт. Он при 190—270 °C в водном растворе перекиси водорода превращается в глицерин.
Глицерин можно получить также из продуктов гидролиза крахмала, древесной муки, гидрированием образовавшихся моносахаридов или гликолевым брожением сахаров. Также глицерин получается в качестве побочного продукта при производстве биотоплива.
Производные глицерина и их место в обмене веществ живых организмов
Глицериды
Глицерин (3D модель), показаны атомы и электронные пары при атомах кислорода (розовый цвет)
Триглицериды являются производными глицерина и образуются при присоединении к нему высших жирных кислот. Триглицериды являются важными компонентами в процессе обмена веществ в живых организмах.
Жиры и масла гидрофобны и нерастворимы в воде, так как гидроксильные группы глицерина заменены малополярными остатками жирных кислот.
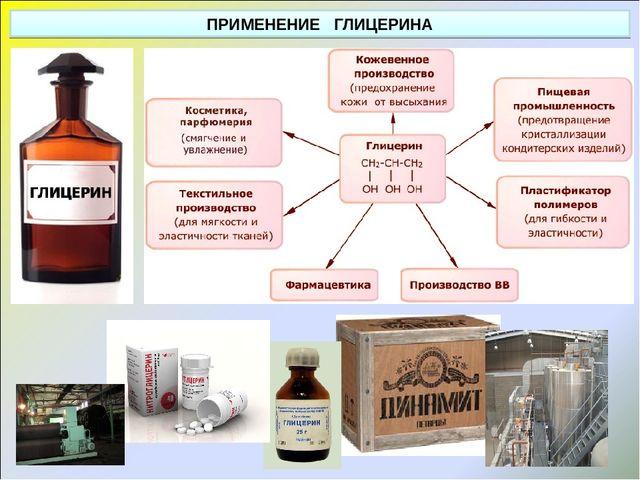
Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, электронные сигареты, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке).
Глицерин относится к группе стабилизаторов, обладающих свойствами сохранять и увеличивать степень вязкости и консистенции пищевых продуктов. Зарегистрирован как пищевая добавка E422, и используется в качестве эмульгатора, при помощи которого смешиваются различные несмешиваемые смеси.
Поскольку глицерин хорошо поддается желированию и горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей и основы для жидкости, используемой в дым-машинах.
Также глицерин используется при изготовлении динамита.
В последние годы глицерин используется, наряду с пропиленгликолем, в качестве основного компонента для приготовления жидкости и картриджей для электронных сигарет.
Используется в криобиологии и крионике как основной компонент популярных проникающих криопротекторов для криоконсервирования анатомических препаратов, биологических тканей и организмов.
Реклама глицеринового зубного крема, 1906 г.
Обновлено: 11.03.2023
Глицери́н (1,2,3-тригидроксипропан; 1,2,3-пропантриол) (гликос — сладкий) химическое соединение с формулой HOCH2CH(OH)-CH2OH или C3H5(OH)3. Простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость.
Содержание
Физические свойства
Глицерин — бесцветная, вязкая, гигроскопичная жидкость, неограниченно растворимая в воде. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества.
Химические свойства
Химические свойства глицерина типичны для многоатомных спиртов.
Взаимодействие глицерина с галогеноводородами или галогенидами фосфора ведёт к образованию моно- и дигалогенгидринов.
Глицерин этерифицируется карбоновыми и минеральными кислотами с образованием соответствующих эфиров. Так, с азотной кислотой глицерин образует тринитрат — нитроглицерин (получен в 1847 г. Асканьо Собреро), использующийся в настоящее время в производстве бездымных порохов.
HOCH2CH(OH)-CH2OH H2C=CH-CHO + 2 H2O,
и окисляется до глицеринового альдегида СН2ОНСНОНСНО, дигидроксиацетона СН2ОНСОСН2ОН или глицериновой кислоты СН2ОНСНОНСООН.
Эфиры глицерина и высших карбоновых кислот — жиры являются важными метаболитами, важное биологическое значение играют также фосфолипиды — смешанные глицериды фосфорной и карбоновых кислот.
Получение
Глицерин впервые был получен в 1779 году Шееле при омылении жиров в присутствии окислов свинца. Основную массу глицерина получают как побочный продукт при омылении жиров.
Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта. Хлорированием пропилена при 450—500° С получают аллилхлорид, при присоединении к последнему хлорноватистой кислоты образуются хлоргидрины, например, CH2ClCHOHCH2Cl, которые при омылении щёлочью превращаются в глицерин.
На превращениях аллилхлорида в глицерин через дихлоргидрин или аллиловый спирт основаны другие методы. Известен также метод получения глицерина окислением пропилена в акролеин; при пропускании смеси паров акролеина и изопропилового спирта через смешанный ZnO — MgO катализатор образуется аллиловый спирт. Он при 60—70 °C в водном растворе перекиси водорода превращается в глицерин.
Глицерин можно получить также из продуктов гидролиза крахмала, древесной муки, гидрированием образовавшихся моносахаридов или гликолевым брожением сахаров.
Глицерин и триглицериды
Триглицериды являются производными глицерина и образуются при присоединении к нему высших жирных кислот. Триглицериды являются важными компонентами в процессе обмена веществ в живых организмах.
Жиры и масла гидрофобны и нерастворимы в воде, так как гидроксильные группы глицерина заменены малополярными остатками жирных кислот.
Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника.
Глицерин используется как пищевая добавка Е422 в производстве кондитерских изделий для улучшения консистенции, для предотвращения проседания шоколада, увеличения объёма хлеба.
Технический глицерин используется для заполнения виброустойчивых манометров типа ДМ8008ВУ, заполнения торцевых уплотнений мешалок и др.
См. также
Примечания
Ссылки
На русском и английском языках:
На русском языке:
На английском языке:
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное. статью.
- Многоатомные спирты
- Пищевые добавки
- Продукция основного органического синтеза
- Косметические вещества
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Глицерин» в других словарях:
ГЛИЦЕРИН — (греч., от glykys сладкий). Бесцветная сиропообразная жидкость сладкого вкуса, получаемая при производстве стеарина от разложения жиров при их обмыливании. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ГЛИЦЕРИН… … Словарь иностранных слов русского языка
ГЛИЦЕРИН — прозрачная, бесцветная, вязкая жидкость сладкого вкуса; хорошо смешивается с водой и спиртом. Обладает способностью обезвоживать кожу, поэтому для смягчения кожи глицерин применяется в разведённом виде. Неразведённый глицерин можно втирать только … Краткая энциклопедия домашнего хозяйства
глицерин — а, м. glycérine f., нем. Glyzerin. Составная часть всех жиров, густая, сладкая, растворимая в воде жидкость. Получается при перегонке сала в стеариновом производстве. Употребляется для приготовления нитроглицерина, динамита, в фотографии, для… … Исторический словарь галлицизмов русского языка
ГЛИЦЕРИН — Glycerinum. Трехатомный алкоголь. С3Н5(ОН)3. Получают из растительных и животных жиров путем омыления их растворами едких щелочей или при воздействии перегретым паром. Также синтезируют из пропилена. Свойства. Глицерин бесцветная, прозрачная, си … Отечественные ветеринарные препараты
глицерин — Глицерин представляет собой сиропообразную сладковатую на вкус жидкость, не имеющую запаха и цвета. Он входит в состав всех натуральных жиров. При украшении тортов его используют для придания пластичности яичной глазури (смесь яичных белков … Кулинарный словарь
ГЛИЦЕРИН — (от греческого glykeros сладкий), CH2(OH)CH(OH)CH2OH, бесцветная горючая вязкая жидкость сладкого вкуса, tкип 290шC. Эфиры глицерина глицериды основа жиров. Глицерин сырье в производстве нитроглицерина, алкидных (глифталевых) смол, полиуретанов,… … Современная энциклопедия
ГЛИЦЕРИН — (1, 2, 3 триоксипропан, НОСН2СН (ОН) СН2ОН), сладкая сиро пообразная жидкость, которую получают из жиров растительного и животного происхождения, пропилена, а также масел. Используется при изготовлении мыла. Глицерин добавляют в пластмассу,… … Научно-технический энциклопедический словарь
ГЛИЦЕРИН — ГЛИЦЕРИН, глицерина, мн. нет, муж. (от греч. glykeros сладкий). Сладкая сиропообразная прозрачная жидкость, добываемая из жиров для медицинских, гигиенических и технических целей. Глицерин побочный продукт при производстве стеарина и при… … Толковый словарь Ушакова
ГЛИЦЕРИН — ГЛИЦЕРИН, из жиров химически извлеченный продукт. Глицериновое мыло (Наумов). Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
Глицерин — (от греческого glykeros сладкий), CH2(OH)CH(OH)CH2OH, бесцветная горючая вязкая жидкость сладкого вкуса, tкип 290°C. Эфиры глицерина глицериды основа жиров. Глицерин сырье в производстве нитроглицерина, алкидных (глифталевых) смол, полиуретанов,… … Иллюстрированный энциклопедический словарь
Глицерин (от греч. γλυκερός — сладкий) — органическое соединение, простейший представитель трёхатомных спиртов с формулой C3H5(OH)3 . Представляет собой вязкую прозрачную жидкость со сладким вкусом.
Синонимы: глицерóл, пропантриол-1,2,3.
Содержание
Физические свойства
Бесцветная вязкая жидкость без запаха. Сладкий на вкус, отчего и получил своё название (греч. γλυκερός — сладкий). Имеет молярную массу 92,09 г/моль, относительную плотность d4 20 = 1,260, коэффициент преломления nD 20 = 1,4740. Температура плавления составляет 17,9 °C, кипит при 290 °C, частично при этом разлагаясь. Гигроскопичен, поглощает воду из атмосферы в количестве до 40 % от собственной массы. С водой, метанолом, этанолом, ацетоном смешивается в любых пропорциях, но не растворим в эфире и хлороформе, хотя и способен растворяться в их смесях с этанолом.
При растворении глицерина в воде происходит выделение тепла и происходит контракция — уменьшение объёма раствора. Смеси глицерина с водой обладают температурой плавления значительно более низкой, чем каждое из веществ по отдельности, например, при массовом содержании глицерина в 66,7 % его смесь с водой будет замерзать при −46,5 °C.
Образует азеотропы с нафталином, его производными и рядом других веществ.
Химические свойства
Химические свойства глицерина типичны для многоатомных спиртов.
Взаимодействие глицерина с галогеноводородами или галогенидами фосфора ведёт к образованию моно- и дигалогенгидринов.
Глицерин этерифицируется карбоновыми и минеральными кислородосодержащими кислотами с образованием соответствующих сложных эфиров. Так, с азотной кислотой глицерин образует тринитрат — нитроглицерин (получен в 1847 г. Асканио Собреро), использующийся в настоящее время в производстве бездымных порохов.
При дегидратации он образует токсичный акролеин:
и окисляется до глицеринового альдегида CH2OHCHOHCHO , дигидроксиацетона CH2OHCOCH2OH или глицериновой кислоты CH2OHCHOHCOOH .
Сложные эфиры глицерина и высших карбоновых кислот — жиры являются важными метаболитами, важное биологическое значение играют также фосфолипиды — смешанные глицериды фосфорной и карбоновых кислот.
Получение
Глицерин впервые был получен в 1779 году Карлом Вильгельмом Шееле при омылении жиров в присутствии оксидов свинца. Основную массу глицерина получают как побочный продукт при омылении жиров.
Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта. Хлорированием пропилена при 450—500 °С получают аллилхлорид, при присоединении к последнему хлорноватистой кислоты образуются хлоргидрины, например, CH2ClCHOHCH2Cl , которые при омылении щёлочью превращаются в глицерин.
На превращениях аллилхлорида в глицерин через дихлоргидрин или аллиловый спирт основаны другие методы. Известен также метод получения глицерина окислением пропилена в акролеин; при пропускании смеси паров акролеина и изопропилового спирта через смешанный ZnO — MgO катализатор образуется аллиловый спирт. Он при 190—270 °C в водном растворе перекиси водорода превращается в глицерин.
Глицерин можно получить также из продуктов гидролиза крахмала, древесной муки, гидрированием образовавшихся моносахаридов или гликолевым брожением сахаров. Также глицерин получается в качестве побочного продукта при производстве биотоплива.
Производные глицерина и их место в обмене веществ живых организмов
Глицериды
Триглицериды являются производными глицерина и образуются при присоединении к нему высших жирных кислот. Триглицериды являются важными компонентами в процессе обмена веществ в живых организмах.
Жиры и масла гидрофобны и нерастворимы в воде, так как гидроксильные группы глицерина заменены малополярными остатками жирных кислот.
Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, электронные сигареты, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке).
Поскольку глицерин хорошо поддается желированию и горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей и основы для жидкости, используемой в дым-машинах.
Также глицерин используется при изготовлении динамита.
В последние годы глицерин используется, наряду с пропиленгликолем, в качестве основного компонента для приготовления жидкости и картриджей для электронных сигарет.
Используется в криобиологии и крионике как основной компонент популярных проникающих криопротекторов для криоконсервирования анатомических препаратов, биологических тканей и организмов.
В медицинской, косметической и кондитерской областях часто используется глицерин. Свойства этого вещества известны не всем, хотя многие использовали продукты, в составе которых содержится такой компонент. Органическое соединение широко распространено в природе и входит в большинство липидов, содержащихся в животных и растениях.
Свойства вещества
Глицерин представлен органическим соединением, которое получают из растительных и животных масел. В нем хорошо растворяются различные вещества. Средство не относится к токсичным и ядовитым соединениям. На марки дистиллированного вещества распространяются действия государственного стандарта ГОСТ 6824–96 .
Химическая формула глицерина — C3H8O3. В структурной формуле вещество состоит из цепочки трех атомов углерода, каждый из которых связан с атомом водорода и гидроксильной группы. Сложные эфиры глицерина с длинноцепочными карбоновыми кислотами называются триглицеридами. Они выступают важными производными в метаболизме живых организмов.
Основные физические свойства глицерина:
- плотность — 1,261 г/см3;
- молярная масса — 92,1 г/моль;
- температура кипения (испарения) — 290 °C.
В чистом виде вещество не замерзает, поэтому температура замерзания глицерина определяется в зависимости от его концентрации в растворах. Простейший представитель трехатомных спиртов выглядит как вязкая прозрачная жидкость. Его можно смешивать с водой в разных пропорциях. Глицерин характеризуется сладким вкусом. В сочетании с пропиленгликолем жидкое вещество становится более текучим. Сильно нагретое и зажженное соединение горит синим пламенем.
Химические свойства вещества характерны для многоатомных спиртов. При его взаимодействии с галогеноводородами или галогенидами фосфора образуются моно- и дигалогенгидрины. С азотной кислотой формируется нитроглицерин, который используется в изготовлении бездымных порохов.
При дегидратации образуется токсичный акролеин, после чего окисляется до глицеринового альдегида, дигидроксиацетона или глицериновой кислоты.
Получение глицерина
Впервые вещество было получено в 1779 году путем нагревания масла оливы с оксидом свинца. Этот метод разработал шведский исследователь Карл Шееле. Химик смог доказать, что во все жиры и масла включена сладкая основа.
До начала XIX века технический трехатомный спирт делали именно по способу Шееле. Вскоре его стали широко использовать в промышленной сфере, что заставило увеличить его производство. Француз Мишель Шеврель изучил органическое соединение, выведенное шведским ученым, и дал ему название в 1811 году. Химик открыл первый промышленный метод получения вещества, на который получил патент. При использовании его способа жировые вещества обрабатываются известью или щелочью, чтобы при разложении получились жирные кислоты. Сегодня к этой схеме все еще прибегают во многих странах.
В середине XIX века А. Тилгман открыл еще один промышленный метод создания трехатомного спирта в биохимии. Вещество начали получать путем перемешивания и давления жиров и воды. В течение 12 часов жиры расщепляются на жирные кислоты и глицерин при температуре 180−200 °С. Когда глицериновую воду охлаждают, жирные кислоты всплывают на поверхность. Этот способ часто используют в современной промышленности.
Сделать глицерин можно и мыловарам. Вещество выступает побочным продуктом при изготовлении продукта для ухода за кожей. Он образуется при реакции омыления тристеарата глицерина гидроксидом натрия.
Сферы использования
Не все люди знают, зачем и для чего нужен глицерин. Он используется в различных областях и быту, благодаря своим химическим и физическим свойствам. Глицерин придает мягкость разным видам текстиля, а также регулирует влажность табака. Его часто включают в состав моющих средств и препаратов для обработки сельскохозяйственных культур.
Сферы применения вещества:
- Пищевая промышленность. Глицерин используется в качестве подсластителя для создания различных пищевых продуктов и напитков, а также как загуститель в ликерах. А также он прекрасный увлажнитель и растворитель. Органическое соединение входит в состав низкокалорийных продуктов вместо жира. В пищевой промышленности компонент обозначают как Е422. Он может заменить сахар и препятствовать размножению бактерий.
- Косметика. Девушки часто интересуются, где взять глицерин растительного и животного происхождения. Компонент включают в качественные средства личной гигиены. Он используется в увлажняющей косметике по уходу за лицом и телом, кремах для бритья и других продуктах. Вещество считается одним из главных составляющих глицеринового мыла, которое предназначено для сухой и чувствительной кожи. Его применяют при раздражениях, зуде кожного покрова и шелушениях.
Поскольку вещество не реагирует с маслами и имеет высокую устойчивость к окислению, оно может применяться в качестве смазочного материала для механических деталей, подвергающихся воздействию бензина. Органическое соединение используют в технической промышленности при обработке алюминия и при изготовлении смол и пластмассы.
Оно применяется в типографии при нанесении красок, для создания кальки, салфеток и пергаментной бумаги.
Область медицины
Глицерин считается безопасным средством для взрослых, не вызывает брожение в организме или размножение болезнетворных бактерий. Вещество хорошо всасывается в тонком кишечнике и не попадает в толстую кишку. Еще оно не обладает канцерогенными свойствами, повреждающими ДНК и вызывающими врожденные эффекты.
Компонент добавляют в аптечные сиропы от кашля и отхаркивающие средства. Он может присутствовать в зубных пастах и жидкостях для полоскания полости рта. В таблетках вещество используется как влагоудерживающий агент. Оно входит в состав слабительных средств. Глицерин принимают в качестве первой помощи при экстренном лечении глазного давления, он быстро его понижает.
Глицерин безопасен для здоровья человека. Иногда его используют для приема внутрь при лечении различных заболеваний.
Полезные действия лекарственного средства:
- снижает вес;
- улучшает выносливость при физических нагрузках и помогает организму удерживать влагу;
- избавляет от диареи и поноса;
- снижает отек мозга при нейрохирургических операциях;
- предотвращает обмороки при нарушении кровотока к мозгу.
Глицерин может использоваться и внутривенно в неврологии. Он применяется для понижения внутричерепного давления при инсульте, менингите, синдроме Рейна, энцефалите, менингите, травмах ЦНС. Спортсмены принимают средство, чтобы предотвратить обезвоживание.
Вред для организма и меры безопасности
Если человек использует препараты или косметику, в которых содержится глицерин, ему необходимо предварительно узнать о вреде этого вещества, а также в каких случаях его не следует использовать.
Когда средство применяется в домашних условиях без контроля или назначения специалиста, у человека могут проявляться побочные последствия или обезвоживание организма:
Препараты с органическим соединением необходимо применять согласно инструкции на упаковке. Некоторые лекарства с этим веществом следует предварительно встряхивать перед употреблением. Если глицерин применяется для увлажнения и смягчения кожи или при лечении опрелостей, тогда его придется наносить после каждого мытья рук.
Необходимо следить, чтобы средство не попало в глаза, рот и нос. После лучевой терапии для лечения ожогов кожи рекомендуется проконсультироваться с врачом о приеме вещества.
Глицерин незаменим в пищевой и промышленной сфере. Он обладает множеством полезных свойств, которые особенно ценятся в медицине. При правильном применении средств с таким подсластителем получится улучшить здоровье без вреда организму.
Благодаря уникальным технико-физическим свойствам область применения глицерина довольно широка: он может использоваться как на производстве, так и в быту. Это трехатомный спирт, без цвета и запаха со сладким привкусом. Имеет вязкую консистенцию.
Основные свойства глицерина
Компонент выделяется такими особенностями и параметрами:
- Хорошо растворяется в воде и спирте. Растворяет йод, бром, фенол, тимол, хлорид ртути, алкалоиды;
- Плохо растворяется в натуральных растворителях, эфирах, не растворяется в углеводородах;
- Высокая гигроскопичность – притягивает молекулы воды из окружающей среды (поэтому глицерин имеет активное применение в косметике – для увлажнения кожи);
- Энергетическая ценность – 27 калорий на ч. ложку (состав примерно на 60% более сладкий, чем сахароза). При этом не повышает уровень сахара в крови и не способствует образованию бактерий, вызывающих кариес;
- температура плавления – 18 °C;
- температура кипения – 290 °C.
Области применения глицерина
Вещество является безвредным для организма и востребовано во многих сферах нашей жизни, перечислим некоторые из них.
Глицерин в косметологии
Используется для придания мягкости продуктам личной гигиены. В качестве увлажняющего компонента применяется для производства кремов и масок для лица, мазей для тела.
Популярно использование глицерина для волос – шампуни с его содержанием делают волосы более шелковистыми. Улучшает качества мыла, смягчает кожу. Глицериновое мыло подходит людям с чувствительной кожей. Его нередко делают в домашних условиях, потому что оно хорошо способствует сохранению свежести кожи.
При этом вещество хорошо впитывает влагу, это стоит учитывать при изготовлении какого-либо средства. Поэтому обычно не рекомендуют применять косметику с глицерином слишком активно.
Глицерин в медицине
Глицерин медицинский – компонент, который используется в фармацевтической и медицинской промышленности для улучшения эластичности различных препаратов и растворов. Глицерин используется в медицине в препаратах, предназначенных для снижения воспаления слизистой горла и полости рта (например, в сиропах от кашля).
Другие варианты применения глицерина в фармацевтике:
- Подготовка высококонцентрированных растворов – используется вместо воды, потому что отлично растворяет воду и спирт. С его помощью можно как повысить, так и понизить вязкость лекарства, продлив срок годности препарата, мази, пасты и пр.;
- На основе глицерина производят суппозитории (ректальные свечи) и оболочку для таблеток;
Также глицерин в последнее время особенно востребован для производства антисептиков и антибактериальных растворов в качестве смягчения воздействия изопропилового спирта на кожу рук, чтобы она не пересушивалась. Антисептики эффективно помогают бороться с коронавирусной инфекцией по всему миру.
Пищевой глицерин
Глицерин пищевой используется для производства следующей продукции:
- Хлебобулочных изделий – предотвращает образование черствой корки, придает пышности;
- Кондитерских изделий – улучшает консистенцию;
- Безалкогольных жидкостей, ликеров – глицерин делает их более мягкими на вкус, используется в качестве загустителя;
- Жевательной резинки – улучшает вязкость, применяется в качестве заменителя сахара;
- Макаронных изделий – уменьшает склеивание при варке;
- Печенья и другой продукции с низким содержанием жиров – в качестве наполнителя;
- Шоколада – ингредиент делает его более нежным на вкус;
- Мороженого – в качестве стабилизатора вкуса.
Глицерин в табачной промышленности
Он регулирует уровень влажности курительных смесей. Им обрабатывают табак для защиты от пересыхания. В производстве электронных сигарет вещество применяется для парообразования, является основным компонентом смеси (добавляется непосредственно в готовую курительную жидкость). Картриджи с применением VG (глицерина для вейпа) дольше не засыхают.
Использование глицерина дома
Глицерин востребован и в быту. Например, из него можно делать теплые ванночки для кожи рук (нужно добавить несколько капель вещества в воду и погрузить руки в состав на 5 минут). Глицерин используется в домашних условиях и для приготовления масок и патчей для лица (например, из глицерина и витамина Е, смешивать нужно в одинаковых пропорциях). В целом, есть много народных рецептов по уходу за телом, в которых одним из ключевых компонентов выступает данное вещество.
Глицерин технический используется для улучшения блеска ламината, добавляется в средства, которые помогают срезанным цветам дольше стоять в вазе и пр.
В заключении стоит добавить, что глицерин в разных формах используется еще в производстве пластмасс, электро- и радиотехники, в сельском хозяйстве, в текстильной, бумажной, лакокрасочной и кожевенной отраслях промышленности.
Читайте также:
- Жизнь обломова в петербурге кратко цитаты
- Отцовская власть в римском праве кратко
- Поздравление с новым годом коллегам кратко в прозе
- Настройка интернет на windows 7 кратко
- Обыкновенные акции и необыкновенные доходы кратко
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.