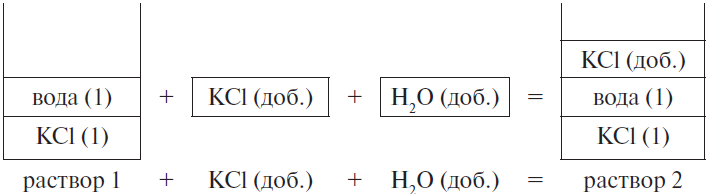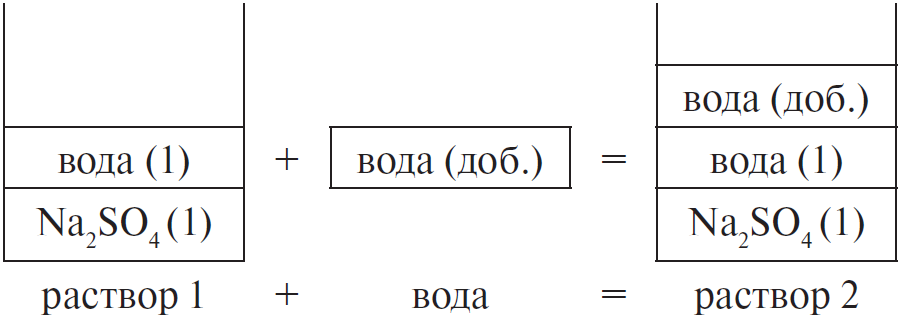Блок «Химическая реакция. Методы познания в химии. Химия и жизнь. Расчеты по химическим формулам и уравнениям реакций»
Усвоение элементов содержания этого блока проверяется заданиями различного уровня сложности, в их числе 4 задания базового уровня сложности, 4 задания повышенного уровня сложности и 2 задания высокого уровня сложности.
Элементы содержания блока имеют прикладной и практико-ориентированный характер, что обусловливает некоторую особенность заданий, ориентированных на проверку усвоения данного материала.
Выполнение заданий этого блока предусматривает проверку сформированности следующих умений: использовать в конкретных ситуациях знания о применении изученных веществ и химических процессов, а также о промышленных методах получения некоторых веществ и способах их переработки; планировать проведение эксперимента по получению и распознаванию важнейших неорганических и органических веществ на основе приобретённых знаний о правилах безопасной работы с веществами в быту; проводить вычисления по химическим формулам и уравнениям.
Некоторые из элементов содержания данного блока, такие как определение характера среды водных растворов веществ, индикаторы, расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного, расчёты массовой доли (массы) химического соединения в смеси, проверялись в рамках одного задания в комплексе с другими элементами содержания.
Рассмотрим задания этого блока из демонстрационного варианта.
#ADVERTISING_INSERT#
Задание 26 проверяет усвоение правил работы в лаборатории, общих представлениях о промышленных способах получения важнейших веществ и их применении.
Задание 26
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВО |
ОБЛАСТЬ ПРИМЕНЕНИЯ |
|
|
A) метан Б) изопрен В) этилен |
1) получение капрона 2) в качестве топлива 3) получение каучука 4) получение пластмасс |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Это задание, как и задание 25, имеет практико-ориентированный характер. Для успешного выполнения этого задания экзаменуемый должен обладать фактологическими знаниями о способах получения веществ, областях их применения, методах разделения смесей, о технологических принципах некоторых химических производств.
Вещества, представленные в этом задании, находят широкое применение в технике, в промышленности, в быту. Метан в первую очередь используется в качестве топлива (2). Изопрен является мономером для производства каучука (3), этилен – мономером для производства пластмасс (4). Следует отметить, что процент выполнения этого задания даже после изменения его содержательной насыщенности и снижения уровня сложности с повышенного на базовый всё равно остаётся чрезвычайно низким: в 2018 г. с ним справились лишь 44,8 % экзаменуемых.

ЕГЭ-2020. Химия. Сборник заданий: 600 заданий с ответами
Пособие содержит тренировочные задания базового и повышенного уровней сложности, сгруппированные по темам и типам. Задания расположены в такой же последовательности, как предлагается в экзаменационном варианте ЕГЭ. В начале каждого типа задания указаны проверяемые элементы содержания – темы, которые следует изучить, прежде чем приступать к выполнению. Пособие будет полезно учителям химии, так как дает возможность эффективно организовать учебный процесс на уроке, проведение текущего контроля знаний, а также подготовку учащихся к ЕГЭ.
Купить
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 58.9%
Ответом к заданию 26 по химии может быть целое число или конечная десятичная дробь.
Задачи для практики
Задача 1
Какую массу цинкового купороса $ZnSO_4 · 7H_2O$ необходимо добавить к 100 г раствора сульфата цинка с массовой долей 5 % для получения 10 %-ного раствора соли? (Запишите число с точностью до целых.) Ответ в (г).
Решение
Для начала найдем массу сульфата цинка в растворе:
100*0.05 = 5 г
Найдем массовую долю сульфата цинка в купоросе:
M($ZnSO_4$)/(7*M($H_2O$) + M($ZnSO_4$)) = 161/287 = 0.56
Примем массу купороса за m — тогда масса безводного сульфата цинка будет равна 0.56m
Составим уравнение:
5 + 0.56m = 0.1(m+100)
0.46m = 5
m = 5/0.46 = 10.87
Округлим до целых чисел – 11 грамм
Ответ: 11
Показать решение
Полный курс
Задача 2
К раствору сульфида калия массой 60 г с массовой долей 4 % добавили 1,6 г этой же соли и выпарили 11,6 г воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
$m_{(комп.)}$ = $m_{(р-ра)}$ х ω
4% = 0.04
m($K_2S$) = 60 x 0.04 = 2.4 г
$m_{(р-ра)_2} = m_{(р-ра)_1}$ + 1.6 — 11.6
$m_{(р-ра)_2}$ = 50 г
ω($K_2S$) = (2.4 +1.6) : 50
ω($K_2S$) = 0.08 = 8%
Ответ: 8
Показать решение
Полный курс
Задача 3
200 мл 36,5 %-ного раствора соляной кислоты (плотностью 1,18 г/мл) оставили в открытой колбе в вытяжном шкафу, в результате концентрация кислоты снизилась до 30 %. Рассчитайте массу улетучившегося хлороводорода (испарением воды пренебречь). (Запишите число с точностью до сотых.) Ответ в (г).
Решение
Найдем массу начального раствора, умножив его объем на плотность:
m(раствор) = 200*1.18 = 236 г.
Найдем массу кислоты в растворе, умножив массу раствора на процентное содержание кислоты:
m(HCl, 1) = 236*0.365 = 86.14 г.
Найдем массу воды в растворе:
m($H_2O$) = 236 – 86.14 = 149.86 г.
Составим пропорцию:
149.86 – 70%
X – 30%
X – конечное количество кислоты
X = 64.23 г.
Найдем разницу масс кислоты:
∆m(HCl) = 86.14 – 64.23 = 21.91 г.
Ответ: 21.91
Показать решение
Полный курс
Задача 4
Сколько граммов хлорида натрия необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %? (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Раз соли в растворе 20%, то воды будет 80%
Составим пропорцию:
50 г. – 80%
X г. – 20%
Теперь составим уравнение и решим его:
50*20 = 80X
X = 12.5 г.
Ответ: 12.5
Показать решение
Полный курс
Задача 5
Смешали 60 г раствора гидроксида калия с массовой долей 15 % и 140 г раствора этого же вещества с массовой долей 18 %. Вычислите массу щёлочи в полученном растворе. (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Найдем массу гидроксида в первом растворе, умножив массовую долю на массу раствора:
m(KOH, 1 раствор) = 60 * 0.15 = 9 г.
Таким же образом найдем массу вещества во втором растворе:
m(KOH, 2 раствор) = 140 * 0.18 = 25.2 г.
А теперь просто сложим массы и получим общую массу гидроксида калия в конечном растворе:
m(KOH, кон.) = 25.2 + 9 = 34.2 г.
Ответ: 34.2
Показать решение
Полный курс
Задача 6
К 480 г раствора соли с массовой долей 10 % добавили 320 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу конечного раствора, сложив массу изначального с добавляемым:
$m_к = m_1 + m_2$ = 480 + 320 = 800 г.
Определим массу вещества в исходном растворе:
m (соли) = 480*0.1 = 48 г
Найдем массовую долю соли в конечном растворе:
M = $m_{(соли)}$ / $m_к$ = 48/800 = 0.06 = 6%
Ответ: 6
Показать решение
Полный курс
Задача 7
Смешали 200 г 10 %-ного и 400 г 20 %-ного раствора хлорида натрия, и из раствора выпарили 30 г Н2О. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Массовая доля хлорида натрия в 3-м растворе вычисляется по формуле:
$ω_3(NaCl) = {m_3(NaCl)}/{m_{р-ра 3}} = {m_1(NaCl) + m_2(NaCl)}/{m_{р-ра 1} + m_{р-ра 2} – m(H_2O)}$,
где $m_1(NaCl)$ и $m_2(NaCl)$ — массы NaCl в 1-м и во 2-м растворах,
$m_{р-ра 1}$ и $m_{р-ра 2}$ — массы 1-го и 2-го растворов соответственно,
$m(H_2O)$ — масса испарившейся воды.
Массы хлорида натрия в 1-м и 2-м растворах можно найти по формулам:
$m_1(NaCl) = ω_1 · m_{р-ра 1}(NaCl)$
$m_2(NaCl) = ω_2 · m_{р-ра 2}(NaCl)$
Проводим вычисления:
1) $m_1(NaCl)$ = 0.1 · 200 = 20 г
2) $m_2(NaCl)$ = 0.2 · 400 = 80 г
3) $m_3(NaCl)$ = 20 + 80 = 100 г
4) $m_{р-ра 3}$ = 200 + 400 – 30 = 570 г
5) $ω_3(NaCl)$ = 100 / 570 ≈ 0.1754, или 17.54 %
Ответ: 17.54
Показать решение
Полный курс
Задача 8
К 200 г 10 %-ного раствора хлорида калия добавили 25 г этой же соли и 15 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
Массовая доля хлорида калия во 2-м растворе вычисляется по формуле:
$ω_2(KCl) = {m_2(KCl)}/{m_{р-ра2}}$,
где $m_2(KCl)$ — масса KCl во 2-м растворе, $m_{р-ра2}$ — масса 2-го раствора.
Очевидно, что:
1) масса хлорида калия равна сумме массы хлорида калия в первом растворе и массы добавленной соли, т. е.:
$m_2(KCl) = m_1(KCl) + m(KCl)_{доб.}$
Массу хлорида калия в 1-м растворе можно найти по формуле:
$m_1(KCl) = ω_1 · m_{р-ра 1}(KCl)$
2) масса второго раствора равна сумме масс первого раствора, добавленной соли и воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(KCl)_{доб.} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(KCl)$ = 0.1 · 200 = 20 г
2) $m_2(KCl)$ = 20 + 25 = 45 г
3) $m(H_2O)_{доб.}$ = 1 ∙ 15 = 15 г
4) $m_{р-ра 2}$ = 200 + 25 + 15 = 240 г
5) $ω_2(KCl)$ = 45 / 240 = 0.1875, или 18.75 %
Ответ: 18.75
Показать решение
Полный курс
Задача 9
Вычислите массовую долю сульфата натрия в растворе, полученном добавлением 100 мл воды к 250 г 15 %-ного раствора соли. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
Массовая доля сульфата натрия во 2-м растворе вычисляется по формуле:
$ω_2(Na_2SO_4) = {m_2(Na_2SO_4)}/{m_{р-ра 2}},$
где $m_2(Na_2SO_4)$ — масса $Na_2SO_4$ во 2-м растворе,
$m_{р-ра 2}$ — масса 2-го раствора.
Очевидно, что:
1) масса сульфата натрия не изменяется, т. е. $m_1(Na_2SO_4) =$
$m_2(Na_2SO_4)$. Массу сульфата натрия в 1-м растворе можно найти
по формуле:
$m_1(Na_2SO_4) = ω_1 · m_{р-ра 1}(Na_2SO_4)$
2) масса второго раствора равна сумме масс первого раствора
и добавленной воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(Na_2SO_4) = 0.15 · 250 = 37.5$ г
2) $m(H_2O) = ρ · V = 1 · 100 = 100$ г
$m_{р-ра 2} = 250 + 100 = 350$ г
3) $ω_2(Na_2SO_4) = 37.5 / 350 ≈ 0.1071$, или $10.71$ %
Ответ: 10.71
Показать решение
Полный курс
Задача 10
Какую массу поваренной соли нужно добавить к 250 г раствора этой же соли с массовой долей 10 % для получения раствора соли с массовой долей 18 %? (Запишите число с точностью до десятых, г.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу исходной соли в растворе:
m (NaCl, исх.) = 250*0.1 = 25 г
Составим уравнение и решим:
25+x – масса соли
250+x – масса раствора
(250+x)*0.18 = 25+x
20 = 0.82x
x = 20/0.82 = 24.4 г.
Ответ: 24.4
Показать решение
Полный курс
Задача 11
Вычислите массовую долю йодоводорода (в %) в растворе, полученном при растворении 112 л (н. у.) HI в 1 л воды. (Запишите число с точностью до целых, %.)
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
ω(HI) = m(HI) : $m_{(р-ра)}$
$m_{(р-ра)}$ = m(HI) + $m(H_2O)$
n(газа) = V : Vm
n(HI) = 112 : 22.4 = 5 моль
m = nM
m(HI) = 5 x 128 = 640 г
$m(H_2O)$ = 1000 г
$m_{(р-ра)}$ = 1000 + 640 = 1640 г
ω(HI) = 640 : 1640 = 0.39 = 39%
Ответ: 39
Показать решение
Полный курс
Задача 12
Через 500 мл раствора с концентрацией аммиака 4 моль/л (ρ = 1,05 г/мл) пропустили 67,2 л (н. у.) аммиака. Рассчитайте массовую долю аммиака в полученном растворе. (Запишите число с точностью до десятых, %.)
Решение
n = CV, 500 мл = 0.5 л
$n(NH_3)_1$ = 4 · 0.5 = 2 моль
m = nM
$m(NH_3)_1$ = 2 · 17 = 34 г
n = V : Vm
n$(NH_3)_2$ = 67.2 : 22.4 = 3 моль
m$(NH_3)_2$ = 3 · 17 = 51 г
m$(NH_3)$ = m$(NH_3)_1$ + m$(NH_3)_2$ = 34 + 51 = 85 г
m = Vρ
m(р-ра1) = 500 · 1.05 = 525г
Массовая доля равна отношению массы компонента к массе раствора.
m(р-ра2) = m(р-ра1) + m$(NH_3)_1$ = 525 + 51 = 576г
Массовая доля $NH_3$ = 85 : 576 = 0.148 = 14.8 %
Ответ: 14.8
Показать решение
Полный курс
Задача 13
50 г медного купороса добавили в 200 г 10%-ного раствора сульфата меди(II). Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до десятых, %.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Определим массу вещества в исходном растворе:
m(в-во, исх.) = 10*200/100 = 20 г.
Определим массу добавленного сульфата меди, для этого найдем моли купороса, а затем умножим моли на молярную массу сульфата меди:
n(купорос) = 50/250 = 0.2 моль
m(в-во, доб.) = 0.2*160 = 32 г
Определим массу конечного раствора:
m(р-р, кон.) = 50 + 200 = 250 г.
Определим массу вещества в конечном растворе:
m(в-во, кон.) = 32 + 20 = 52 г.
Определим массовую долю в конечном растворе:
w(кон.) = 52/250 = 0.208 = 20.8%
Ответ: 20.8
Показать решение
Полный курс
Теория ЕГЭ по химии 2017
Задания 1.
Электронная конфигурация атома
Задания 2.
Закономерности изменения химических свойств элементов
.
Общая характеристика металлов
,
переходных элементов (меди, цинка, хрома, железа)
и
неметаллов
Задания 3.
Электроотрицательность. Степень окисления и валентность химических элементов
Задания 4.
Характеристики ковалентной, ионной
,
металлической
и
водородной связей
.
Зависимость свойств веществ от их состава и строения
Задания 5.
Классификация и номенклатура органических
и
неорганических веществ
Задания 6.
Характерные химические свойства простых веществ — металлов:
щелочных
,
щелочноземельных
,
алюминия;
переходных металлов
:
меди
,
цинка
,
хрома
,
железа
.
Характерные химические свойства простых веществ — неметаллов
:
водорода
,
галогенов
,
кислорода
,
серы
,
азота
,
фосфора
,
углерода
,
кремния
Задания 7.
Характерные химические свойства оксидов: основных, амфотерных, кислотных
.
Задания 8.
Характерные химические свойства
оснований
,
амфотерных гидроксидов
и
кислот
.
Характерные химические свойства
солей
.
Электролитическая диссоциация электролитов в водных растворах
и
Реакции ионного обмена
Задания 9.
Взаимосвязь неорганических веществ
Задания 10.
Реакции окислительно-восстановительные
Задания 11. Характерные химические свойства неорганических веществ:
–
простых веществ – металлов:
щелочных
,
щелочноземельных
,
алюминия
,
переходных металлов
(меди
,
цинка
,
хрома,
железа
простых веществ – неметаллов:
водорода
,
галогенов
,
кислорода
,
серы
,
азота
,
фосфора
,
углерода
,
кремния
оксидов: оснóвных, амфотерных, кислотных;
–
оснований,
амфотерных гидроксидов
и
кислот
солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
Задания 12.
Классификация органических веществ. Номенклатура органических веществ(тривиальная и международная).
Задания 13.
Теория строения органических соединений: гомология и изомерия (структурная и пространственная)
.
Взаимное влияние атомов в молекулах.
Типы связей в молекулах органических веществ.
Гибридизация атомных орбиталей углерода.
Радикал. Функциональная группа
Задания 14.
Характерные химические свойства углеводородов: алканов, циклоалканов
,
алкенов
,
диенов
,
алкинов
,
ароматических углеводородов (бензола и толуола).
Основные способы получения углеводородов (в лаборатории).
Задания 15.
Характерные химические свойства предельных одноатомных и многоатомных спиртов,
фенола
. Характерные химические свойства
альдегидов
,
предельных карбоновых кислот
,
сложных эфиров
.
Основные способы получения кислородсодержащих соединений (в лаборатории).
Задания 16.
Характерные химические свойства азотсодержащих органических соединений: аминов
и
аминокислот
.
Биологически важные вещества:
жиры
,
белки
,
углеводы (моносахариды, дисахариды, полисахариды)
Задания 17.
Взаимосвязь углеводородов и кислородосодержащих органических соединений
Задания 18. Характерные химические свойства углеводородов:
алканов, циклоалканов
,
алкенов
,
диенов
,
алкинов
,
ароматических углеводородов (бензола и толуола)
.
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Задания 19.
Характерные химические свойства предельных одноатомных и многоатомных спиртов,
фенола
. Характерные химические свойства
альдегидов
,
предельных карбоновых кислот
,
сложных эфиров
.
Задания 20.
Классификация химических реакций в неорганической и органической химии
Задания 21.
Скорость реакции, ее зависимость от различных факторов
Задания 22.
Электролиз расплавов и растворов
Задания 23.
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Задания 24.
Обратимые и необратимые химические реакции. Химическое равновесие.Смещение равновесия под действием различных факторов
Задания 25.
Качественные реакции на неорганические вещества и ионы
.
Качественные реакции органических соединений
Задания 26.
Правила работы в лаборатории. Методы разделения смесей и очистки веществ.
Понятие о металлургии: общие способы получения металлов
.
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола).
Химическое загрязнение окружающей среды и его последствия.
Природные источники углеводородов, их переработка.
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Задания 27.
Вычисление массы/ массовой доли вещества в растворе
Задания 28.
Расчеты объемных отношений газов при химических реакциях
.
Тепловой эффект химической реакции
Задания 29. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
Задания 27.
Классификация органических
и
неорганических соединений
Задания 30.
Реакции окислительно-восстановительные.
Задания 31.
Взаимосвязь различных классов неорганических веществ
Задания 32.
Взаимосвязь органических соединений
Задания 33.
Расчетные задачи на примеси, избыток-недостаток, выход от теоретически возможного, массовую долю растворенного вещества, массовую долю химического соединения в смеси
Задания 34.
Нахождение молекулярной формулы вещества
Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
|
Элемент и его соединения |
Применение |
|
Ø Al Ø Al₂O₃ Ø AlCl₃ Ø Al₂(SO₄)₃ ∙ 18H₂O |
· Алюмотермия используется в металлургии для получения металлов: 2Al + Fe₂O₃ = 2Fe + Al₂O₃ · Машиностроение, авиастроение, судостроение · Алюминиевая посуда · Некоторые соли применяются в медицине для лечения кожных заболеваний · Адсорбент в хроматографии · Катализатор в органической химии · Очистка воды |
|
Ø Fe Ø FeCl₃ Ø Fe(NO₃)₃ |
· Сплавы железа являются основным конструкционным материалом · Катализатор в органической химии · Окраска тканей |
|
Ø Cr Ø «Хромовая смесь» — раствор K₂Cr₂O₇ вH₂SO₄(конц) |
· В металлургии для получения специальных сортов стали · Хромом покрывают другие металлы с целью предохранения их от коррозии · Окислитель для очистки стеклянной химической посуды |
|
Ø KMnO₄ |
· Дезинфицирующее средство |
|
Ø Cu |
· Соединения меди используются для борьбы с вредителями сельскохозяйственных растений |
|
Ø H₂ Ø H₂O₂ |
· Сырьё для получения NH₃, HCl, CH₃OH · В пищевой промышленности водород используют для выработки твёрдых жиров путём гидрогенизации растительных масел · В металлургии для восстановления некоторых металлов и оксидов · Летательные аппараты, воздушные шары, зонды наполняют водородом · «водородная горелка» для сварки и резки металлов · Жидкий водород – одно из наиболее эффективных видов ракетного топлива · В энергетике водород используют в качестве топлива · Дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство |
|
Ø Cl₂ |
· В производстве пластмасс · Отбеливатель бумаги и тканей · Обеззараживание воды – «хлорирование» · В химической промышленности для получения соляной кислоты, фосгена, хлорной извести, хлороформа, моющих средств, ядохимикатов, каучуков |
|
Ø O₂ |
· В металлургии при выплавке чугуна и стали · В смеси с ацетиленом используют для сварки и резки металлов · В химической промышленности · В медицине (кислородные подушки, кислородные коктейли и др.) |
|
Ø S Ø H₂S Ø SO₂ Ø H₂SO₄ Ø MgSO₄ ∙ 7H₂O(горькая английская соль)и Na₂SO₄ ∙ 10H₂O(глауберова соль) Ø CaSO₄ ∙ 2H₂O |
· Широко применяется для борьбы с вредителями сельского хозяйства · Для вулканизации каучука · В производстве спичек, пороха · В медицине для лечения кожных заболеваний · В медицине для лечения ревматизма и кожных заболеваний · Сероводород – один из компонентов минеральных вод · В текстильной промышленности для отбеливания различных изделий · Для уничтожения вредных микроорганизмов · Получение серной кислоты · Осушка газов · Получение других кислот · Получение удобрений · Различные красители · Слабительное · Гипсовые повязки |
|
Ø N₂ Ø NH₃ Ø NH₄OH(нашатырный спирт) и NH₄Cl Ø Аммонийные соли Ø N₂O(веселящий газ) Ø HNO₃ |
· Исходное сырьё для получения аммиака, азотной кислоты, азотных удобрений · Получение азотной кислоты, гидроксида аммония и т.д. · В медицине · Удобрения · В медицине для наркоза · Для получения удобрений, лекарственных и взрывчатых веществ |
|
Ø P Ø H₃PO₄ |
· Производство фосфорной кислоты · Красный фосфор используется при изготовлении спичек · Производство удобрений · Изготовление реактивов, многих органических веществ, для получения катализаторов · Для создания защитных покрытий на металлах · В фармацевтической промышленности |
|
Ø C Ø CO Ø CO₂ Ø Na₂CO₃ |
· Алмаз применяется в промышленности для обработки твердых сплавов и бурения, также для изготовления ювелирных изделий · Графит применяется в электротехнике для изготовления электродов · В металлургии для получения металлов и руд · Пищевая промышленность (газированная вода, лимонады) · Сухой лёд · Пищевая промышленность (сода) |
|
Ø Si Ø SiO₂ |
· Получение полупроводниковых материалов и сплавов · Из сплава кремния с железом (ферросилиций) изготавливают химическую аппаратуру · Сырьё для производства стекла · Изготовление цемента |
Задание №1:
Установите соответствие между аппаратом, который используется в химическом производстве, и процессом, происходящем в этом аппарате.
АППАРАТ:
А) печь кипящего слоя
Б) колонна синтеза
В) поглотительная башня
ПРОЦЕСС:
1) взаимодействие водорода и азота
2) окисление оксида азота(IV)
3) получение олеума
4) получение оксида серы(IV)
Решение:
Итак, рассмотрим первый пункт — печь для обжига в «кипящем слое».
Кипящий слой — это часть процесса производства серной кислоты, в которой совмещены твердая и жидкая фазы; при помощи этой технологии получают сернистый газ(SO2), ответ 4.
Колонна синтеза — это сложный аппарат, направленный на получение аммиака из водорода и азота, ответ 1.
Поглотительная башня используется при получении олеума(раствор SO3 в серной кислоте), ответ 3.
Задание №2:
Установите соответствие между осуществляемым в промышленности процессом и оборудованием, которое используется при получении серной кислоты.
ПРОЦЕСС:
А) получение сернистого газа
Б) получение олеума
В) получение оксида серы(VI)
ОБОРУДОВАНИЕ:
1) окислительная башня
2) печь «кипящего слоя»
3) контактный аппарат
4) поглотительная башня
Решение:
Получение сернистого газа сопровождается обжигом пирита(FeS) в печи «кипящего слоя», ответ 2.
Получение олеума происходит путем растворения оксида серы(SO3) в серной кислоте, сам процесс осуществляется в поглотительной башне, ответ 4.
Оксид серы(VI) получают в контактном аппарате с помощью каталитического окисления SO2, ответ 3.
Задание №3:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) стирол
Б) этиленгликоль
В) синтез-газ
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) производство маргарина
3) производство метанола
4) получение пластмасс
Решение:
Стирол(винилбензол) — это гомолог бензола, имеет формулу C6H5ꟷCH=CH2, за счет наличия кратной связи способен к реакциям полимеризации, в частности, в производстве пластмасс, ответ 4.
Этиленгликоль(1,2-этандиол) — это двухатомный спирт, который используется при получении полиэфиров, так как имеет две OH группы, которые потенциально могут вступать в реакцию поликонденсации с образованием полиэтилентерефталата (наши «любимые» пластиковые бутылки), ответ 1.
Синтез-газ(CO + H2) — довольно известная смесь угарного газа и водорода, используется при промышленном способе получения метилового спирта(метанола), ответ 3.
Задание №4:
Установите соответствие между веществом и способом его попадания в окружающую среду.
ВЕЩЕСТВО:
А) углекислый газ
Б) оксиды азота
В) гексахлоран
СПОСОБ ПОПАДАНИЯ В ОКРУЖАЮЩУЮ СРЕДУ:
1) сгорание углеводородного топлива
2) борьба с насекомыми
3) протравливание семян
4) сточные воды
Решение:
Углекислый газ и оксиды азота попадают в окружающую среду путем сгорания углеводородного топлива, А и Б ответ 1.
Гексахлоран используется в качестве инсектицида, ответ 2.
Задание №5:
Установите соответствие между названием процесса переработки нефти и его результатом.
НАЗВАНИЕ ПРОЦЕССА:
А) риформинг
Б) перегонка нефти
В) крекинг
РЕЗУЛЬТАТ:
1) разделение нефти на фракции
2) получение смазочных масел
3) увеличение количества легкокипящих фракций
4) получение ароматических углеводородов
Решение:
Риформинг — это процесс переработки алифатических углеводородов в ароматические(например, бензол), здесь подходит вариант 4.
Перегонка нефти приводит к разделению ее на фракции(лигроин, мазут, бензин), ответ 1.
Крекинг — это процесс высокотемпературного расщепления нефти с получением низкомолекулярных органических соединений, ответ 3.
Задание №6:
Установите соответствие между металлом и веществом, которое используется для получения этого металла в промышленности, или способом промышленного получения.
МЕТАЛЛ:
А) железо
Б) алюминий
В) натрий
ВЕЩЕСТВО /СПОСОБ ПОЛУЧЕНИЯ:
1) красный железняк
2) электролиз раствора оксида в криолите
3) электролиз раствора поваренной соли
4) электролиз расплава поваренной соли
Решение:
Железо — в промышленности его получают из красного железняка, или гематита, который имеет формулу Fe2O3, ответ 1.
Алюминий можно получить электролизом Al2O3 в расплаве криолита, ответ 2.
Криолит, или гексафторалюминат натрия(Na3AlF6) — это необычный, редкий минерал, впервые обнаружен в Гренландии(отсюда название(криос — холод, литос — камень)), плавится при температуре 1012 С,
может растворять оксиды алюминия, что позволяет легко извлекать алюминий электролизом.
Натрий — для него здесь указано два возможных пункта, 3 и 4, однако, чистый Na можно получить только в РАСПЛАВЕ поваренной соли(NaCl), ответ 4.
Задание №7:
Установите соответствие между смесью веществ и способом разделения данной смеси.
СМЕСЬ ВЕЩЕСТВ:
А) вода и этиловый спирт
Б) вода и глина
В) вода и поташ
СПОСОБ РАЗДЕЛЕНИЯ:
1) фильтрование
2) выпаривание
3) использование делительной воронки
4) перегонка
Решение:
Первая смесь — вода и этиловый спирт, она может быть разделена перегонкой, ответ 4.
Следующая смесь — вода и глина, здесь нужно использовать фильтрование, ответ 1.
Последний ряд веществ — вода и поташ; поташ имеет формулу K2CO3, как и все соли калия, она растворима, и отделить ее от воды можно путем выпаривания, ответ 2.
Задание №8:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) изопропилбензол
Б) этанол
В) триолеин
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение ацетона
3) производство маргарина
4) получение дивинила
Решение:
Первое вещество — изопропилбензол, или кумол, оно используется для получения ацетона, ответ 2.
Второе соединение — этанол, который имеет важное значение для получения дивинила, или бутадиена-1,3(это реакция Лебедева, проведенная в 1926 году, давшая начало производству синтетического каучука), ответ 4.
Последнее вещество в списке — триолеин, составной частью этого химического соединения является «олеин», что означает принадлежность к жирам, а соответственно, к получению маргарина, ответ 3.
Задание №9:
Установите соответствие между веществом и основной областью его применения.
ВЕЩЕСТВО:
А) криолит
Б) пирит
В) метилметакрилат
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) производство антифриза
2) получение алюминия
3) производство серной кислоты
4) получение органического стекла
Решение:
Криолит(Na3AlF6) используется при получении чистого алюминия путем электролиза, ответ 2.
Пирит(FeS2) является начальной составной частью производства серной кислоты, ответ 3.
Метилметакрилат(метил-2-метилпроп-2-еноат) — это сложное органическое соединение, из которого получают органическое стекло, ответ 4.
Задание №10:
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО:
А) глицерин
Б) формальдегид
В) глюкоза
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) получение полиэфиров
2) получение взрывчатых веществ
3) хранение биологических препаратов
4) источник энергии в организме
Решение:
Глицерин, или 1,2,3 — пропантриол, это трехатомный спирт, который используется для получения нитроглицерина, являющегося составной частью взрывчатых веществ, ответ 2.
Формальдегид, или муравьиный альдегид, хорошо знаком биологам для сохранения биологических объектов в течение длительного времени, ответ 3.
Глюкоза(C6H12O6) — это моносахарид, который является источником АТФ(энергия) в организме живых существ, ответ 4.
Задание №11:
Установите соответствие между происхождением полимера и его названием.
ПРОИСХОЖДЕНИЕ ПОЛИМЕРА:
А) природный органический
Б) синтетический органический
В) искусственный органический
Название полимера:
1) сахароза
2) пенька
3) полиэфир
4) вискоза
Решение:
Природный органический полимер — из данного списка нам подходит пенька(грубое лубяное конопляное волокно), ответ 2.
Синтетический органический полимер из указанных веществ — полиэфир, ответ 3.
Искусственным органическим полимером является вискоза, ответ 4.
На сегодня все!