Чтобы поделиться, нажимайте
Скачать Пробный вариант 10. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 10
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) H; 2) O; 3) B; 4) Zn; 5) N.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют вакантные орбитали. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые образуют простые вещества молекулярного строения. Расположите выбранные элементы в порядке возрастания их неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, которые способны в соединениях проявлять валентность III только за счёт образования ковалентных связей по обменному механизму. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня характеристик выберите две, которые могут быть справедливы для веществ с металлической кристаллической решёткой.
1) низкая электропроводность
2) высокая электропроводность
3) ковкость и пластичность
4) ионный тип связи между атомами
5) газообразное агрегатное состояние при н.у.
Запишите в поле ответа номера выбранных характеристик.
- Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) Pb(OH)2 | 1) кислоты |
| Б) H2SeO4 | 2) гидроксиды амфотерные |
| В) N2O | 3) оксиды несолеобразующие |
| 4) основания |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует железо с образованием продукта, в котором железо проявляет степень окисления +2.
1) S
2) H2SO4 конц.
3) Cl2
4) HCl
5) O2 изб.
Запишите в поле ответа номера выбранных веществ.
- В пробирку с избытком гидроксида меди (II) добавили несколько капель соляной кислоты. В результате чего над осадком появился раствор соли, который отделили от осадка и разлили в две пробирки. В одну из пробирок добавили раствор вещества Х, а в другую – раствор вещества Y. В результате в первой пробирке наблюдали образование осадка, а во второй пробирке протекала реакция, которую можно описать сокращённым ионным уравнением: CuOH+ + H+ = Cu2+ + H2O. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) NaOH
2) HCl
3) NaCl
4) Al2O3
5) H2O
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Be | 1) HBr, SO2, NaHSO3 |
| Б) Be(OH)2 | 2) O2, Cl2, Ba |
| В) NaOH | 3) HNO3, Cu, H3PO4 |
| Г) CuCl2 | 4) HCl, H2SO4, KOH (p-p) |
| 5) CsOH (p-p), (NH4)2S (p-p), AgNO3 (p-p) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходным(и) веществом(-ами), вступающим(и) в реакцию, и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ(-ОЕ) ВЕЩЕСТВА(-О) | ПРОДУКТЫ РЕАКЦИИ |
| А) MgO и HNO3 (разб.) | 1) Mg(NO3)2 и H2O |
| Б) Mg и HNO3 (разб.) | 2) MgO, NO2 и O2 |
| В) Mg(NO3)2 и NH3 (p-p) | 3) Mg(NO2)2 и O2 |
| Г) Mg(NO3)2 прокаливание |
4) Mg(NO3)2, NH4NO3 и H2O |
| 5) Mg(NO3)2 и H2 | |
| 6) Mg(OH)2 и NH4NO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NaH
2) Na2O2
3) H2
4) HBr (р-р, изб.)
5) CO2 (p-p)
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) бензол
Б) толуол В) стирол |
1) кетоны
2) спирты 3) аминокислоты 4) углеводороды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите две пары веществ, которые являются изомерами.
1) метилпропан и метилпропен
2) бутен-1 и пентен-1
3) метан и этан
4) метилпропан и бутан
5) пропен и циклопропан
Запишите в поле ответа номера выбранных пар веществ.
- Из предложенного перечня выберите два вещества, каждое из которых может полимеризоваться.
1) стирол
2) 2-хлорбутадиен-1,3
3) 2-бромпропан
4) толуол
5) циклогексан
Запишите в поле ответов номера выбранных веществ.
- Из предложенного перечня выберите два вещества, с которыми реагирует циклопентанол.
1) K2Cr2O7
2) HBr
3) Cu(OH)2
4) NaOH
5) K2SO4
Запишите в поле ответа номера выбранных веществ.
- Из предложенного перечня выберите два вещества, с помощью которых НЕЛЬЗЯ различить водные растворы сахарозы и глюкозы.
1) гидроксид натрия
2) гидроксид меди (II)
3) аммиачный раствор оксида серебра (I)
4) бромная вода
5) хлорид натрия
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с хлороводородом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ |
| А) пентен-1 | 1) 1-хлорпентан |
| Б) пентин-1 | 2) 2-хлорпентан |
| В) пентен-2 | 3) 1,1-дихлорпентан |
| Г) пентин-2 | 4) 2,2-дихлорпентан |
| 5) 3-хлорпентен-1 | |
| 6) 3,3-дихлорпентен-1 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между схемой реакции и органическим продуктом, который образуется в результате этого взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) C6H5ONa
2) C6H5NH2
3) C6H5COONa
4) C6H5NH3Cl
5) C6H5COONH4
Запишите в таблицу номера веществ под соответствующими буквами.
- Из предложенного перечня типов реакций выберите два типа реакций, к которым можно отнести взаимодействие припилена с бромом при обычных условиях.
1) присоединение
2) замещение
3) гидрогенизация
4) изомеризация
5) необратимая
Запишите в поле ответа номера выбранных типов реакций.
- Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции 2AgNO3(тв) = 2Ag(тв) + O2(г) + 2NO2(г).
1) понижение давления в системе
2) повышение давления в системе
3) понижение температуры
4) повышение температуры
5) размельчение AgNO3
Запишите в поле ответа номера выбранных внешних воздействий.
- Установите соответствие между формулой вещества и окислительно-восстановительными свойствами атомов серы, которые она способна проявлять: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА |
| А) H2S | 1) является только восстановителем |
| Б) H2SO4 | 2) является и окислителем, и восстановителем |
| В) Na2S2O3 | 3) не проявляет окислительно-восстановительных свойств |
| 4) является только окислителем |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и одним из продуктов электролиза водного раствора этой соли (электроды инертные): к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕМ СОЛИ | ПРОДУКТ |
| А) сульфат меди (II) | 1) гидроксид калия |
| Б) нитрат серебра (I) | 2) гидроксид натрия |
| В) хлорид калия | 3) азотная кислота |
| Г) хлорид натрия | 4) серная кислота |
| 5) соляная кислота | |
| 6) гидроксид меди (II) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) Na3PO4 | 1) щелочная |
| Б) (C2H5COO)2Sr | 2) кислая |
| В) Rb2CO3 | 3) нейтральная |
| Г) NH4Cl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между способом воздействия на равновесную систему
алкан ↔ алкен + водород,
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) введение катализатора | 1) смещается в сторону прямой реакции |
| Б) повышение концентрации водорода | 2) смещается в сторону обратной реакции |
| В) понижение давления | 3) практически не смещается |
| Г) повышение давления |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между реагирующими веществами, и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) гидрокарбонат натрия (р-р) и азотная кислота (разб.) | 1) растворение осадка |
| Б) гидроксид цинка и гидроксид калия (р-р) | 2) видимых изменений не наблюдается |
| В) уксусная кислота и цинка | 3) образование осадка |
| Г) бутаналь и гидроксид меди (II), t | 4) выделение газа |
| 5) обесцвечивание раствора |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) алебастр | 1) в пищевой промышленности |
| Б) карборунд | 2) в органическом синтезе |
| В) угарный газ | 3) вяжущий строительный материал |
| 4) абразивный материал |
Запишите в таблицу выбранные цифры под соответствующими буквами.
27. Рассчитайте массу воды (г), которую необходимо добавить к раствору гидроксида калия массой 200 г с массовой долей растворённого вещества 12% для приготовления раствора с массовой долей гидроксида калия 5%. (Запишите число с точностью до целых.)
28. Учитывая термохимическое уравнение реакции 2H2S(г) + 3O2(г) = 2SO2(г) + 2Н2О(г) + 857,3 кДж, вычислите, сколько теплоты (кДж) выделится при сжигании сероводорода массой 17 г. (Запишите число с точностью до целых.)
- Вычислите массу сероводорода (в граммах), который может прореагировать с 3,36 л (н.у.) сернистого газа. (Запишите число с точностью до десятых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
хлор, оксид цинка, гидроксид натрия, хлорид железа (II), оксид железа (II), хлороводород. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора и образованием осадка. Выделение газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите амфотерный оксид, который в данном случае будет проявлять кислотные свойства, и вещество, которое вступает с этим оксидом в реакцию ионного обмена с образованием бесцветного раствора. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Силицид кальция обработали раствором бромоводородной кислоты и выделяющийся газ сожгли. Твердый продукт реакции смешали с кальцинированной содой, смесь нагрели до плавления и выдержали температуру некоторое время. После охлаждения проукт реакции растворили в воде и обработали раствором соляной кислоты, в результате чего образовался студенистый осадок. Напишите уравнения четырёх описанных реакций.
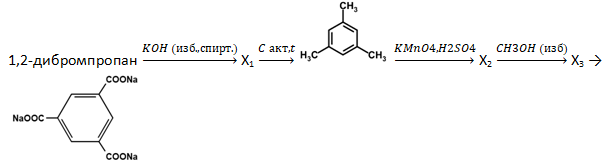
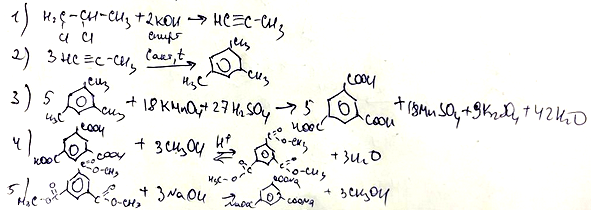
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- Смесь кальция и алюминия общей массой 18,8 г прокалили без доступа воздуха со стехиметрическим количеством порошка графита. К образовавшимся продуктам реакции прилили воду объёмом 200 мл, при этом выделилось 11,2 л газа. Определите массовую долю гидроксида кальция в конечном растворе, если его растворимость при данных условиях составляет 0,185 г на 100 г воды. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
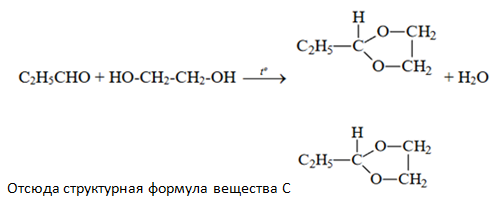
- Органическое ещество А при нагревании реагирует с двухатомным спиртом Б с образованием воды и органического вещества С, которое является гетероциклическим и содержит радикал этил. В состав вещества А входит 62,07% углерода, 10,34% водорода и 27,59% кислорода, функциональная группа находится у первого атома углерода. А при сжигании двухатомного спирта Б массой 62 г образуется 54 г воды и 88 г углекислого газа.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества С;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения вещества С из веществ А и Б (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 34 |
| 2 | 152 |
| 3 | 35 |
| 4 | 23 |
| 5 | 213 |
| 6 | 14 |
| 7 | 12 |
| 8 | 4415 |
| 9 | 1462 |
| 10 | 25 |
| 11 | 444 |
| 12 | 45 |
| 13 | 12 |
| 14 | 12 |
| 15 | 15 |
| 16 | 2424 |
| 17 | 6144 |
| 18 | 42 |
| 19 | 15 |
| 20 | 45 |
| 21 | 142 |
| 22 | 4312 |
| 23 | 1112 |
| 24 | 3212 |
| 25 | 4143 |
| 26 | 342 |
| 27 | 280 |
| 28 | 214 |
| 29 | 10,2 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
2FeCl2 + Cl2 + 6NaOH → 2Fe(OH)3↓ + 6NaCl
1 Cl20 + 2ē → 2Cl-1
2 Fe+2 – ē → Fe+3
Хлорид железа (II) или железо в степени окисления +2 является восстановителем.
Хлор – окислителем
Задание 31
Вариант ответа:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2Na+ + 2OH— + H2O = 2Na+ + [Zn(OH)4]2-
ZnO + 2OH— + H2O = [Zn(OH)4]2-
Задание 32
Вариант ответа:
Ca2Si + 4HBr = 2CaBr2 + SiH4
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 0,18%
Задание 35
Найдём формулу вещества А.
Примем массу соединения А за 100 грамм, тогда количество вещества элементов следующее:
n (С) = 62,07 г/12 г/моль = 5,173 моль
n (H) = 10,34 г/1 г/моль = 10,34 моль
n (O) = 27,59 г/16 г/моль = 1,724 моль
Соотношение углерода к водороду, кислороду и азоту 5,173 : 10,34 : 1,724 = 3 : 6 : 1
Молекулярная формула вещества А C3H6O – это пропаналь.
Найдём формулу вещества Б.
n (CO2) = 88 г/44 г/моль = 2 моль
n (С) = n (СО2) = 2 моль
m (C) = 2 моль ∙ 12 г/моль = 24 г
n (H2O) = 54 г / 18 г/моль = 3 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 3 моль = 6 моль
m (H) = 6 моль ∙ 1 г/моль = 6 г
m (O) = 62 г – 24 г – 6 г = 32 г
n (O) = 32 г / 16 г/моль = 2 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 2 : 6 : 2
Следовательно молекулярная формула вещества Б: C2H6O2 – это этиленгликоль.
Чтобы вывести структурную формулу вещества С, лучше сначало написать уравнение взаимодействия пропаналя с этиленгликолем, с учётом образования воды и того, что вещество С является гетероциклическим (т.е. в состав цикла входят НЕ только атомы углерода) и содержит радикал этил:
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 3. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 4. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 5. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 6. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 7. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 8. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 9. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 10. ЕГЭ 2020 по химии с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- 09.02.2020
10-й пробный вариант тренировочного ЕГЭ по химии в формате 2020 года, для выпускников 11 классов.
Полный КИМ содержит все задания (аналогично реальному ЕГЭ), согласно официальному кодификатору ФИПИ ЕГЭ 2020. В конце варианта приведены ответы для каждого задания, а также подробное письменное решение для второй части (и критерии для проверки).
Тренировочная работа проводилась 6 января 2020 года, добровольно 
Обсудить решение каждого задания можно в комментариях ниже.
- Другие варианты по химии
- Тренировочные работы ЕГЭ СТАТГРАД 2019-2020
Вариант создан и распространяется безвозмездно командой https://vk.com/ege100ballov
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Школьный портал
→
ЕГЭ
→
ЕГЭ по химии
→
Тренировочный вариант ЕГЭ 2020 по химии № 10

Пробный вариант № 10 ЕГЭ по химии на 2020 год составлен в соответствии с кодификатором ФИПИ и официальными демоверсиями.
Файл в формате pdf содержит задания, решения и ответы.
Скачать вариант в формате pdf — СКАЧАТЬ.
Тренировочный вариант составлен авторами группы ЕГЭ на 100 БАЛЛОВ.
Смотрите также:
- Все тренировочные ЕГЭ по химии
- Расписание ЕГЭ
- Шкала перевода баллов ЕГЭ
Одноклассники
Вконтакте
Мой мир
- ЕГЭ по химии
Диагностические (тренировочные) работы предназначены для учащихся 10-11 классов, которые планируют сдавать экзамен в форме ЕГЭ по химии.
Наполнение и продолжительность работ соответствуют формату ЕГЭ согласно демонстрационной версии, опубликованной на сайте ФИПИ.
Работы содержат задания по всем темам, включенным в программу экзамена.
Использование диагностических (тренировочных) работ СтатГрад в формате ЕГЭ дает представление об уровне подготовки учащихся к успешной сдаче итогового экзамена.
→ скачать 2 варианта от 27.01.2020
→ скачать 2 варианта от 15.10.2019
Работа по химии состоит из двух частей, включающих в себя 35 заданий.
Часть 1 содержит 29 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом.
На выполнение работы отводится 3,5 часа (210 минут).
При выполнении работы используйте Периодическую систему химических элементов Д.И. Менделеева, таблицу растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов.
Для вычислений используйте непрограммируемый калькулятор.
Смотрите также:
Тренировочный вариант №10.
Ответом к заданиям 1–25 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами.
Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22–25 могут повторяться.
Задание №1
Из указанных в ряду химических элементов выберите два элемента, атомы которых в возбужденном состоянии содержат три неспаренных электрона:
1) P 2) Ti 3) As 4) Al 5) B
Запишите в поле ответа номера выбранных элементов.
Задание №2
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания атомного радиуса.
1) Li 2) F 3) S 4) Al 5) O
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Задание №3
Из предложенного перечня химических элементов выберите два таких, в водородных соединениях которых водород проявляет отрицательную степень окисления.
1) N 2) Al 3) P 4) Sr 5) Se
Запишите в поле ответа номера выбранных элементов.
Задание №4
Из предложенного перечня соединений кремния выберите два с наиболее низкими температурами кипения.
1) SiH4
2) SiO2
3) SiCl4
4) SiC
5) Si
Запишите в поле ответа номера выбранных соединений.
Задание №5
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) пирита; Б) бурого газа; В) железной окалины.
| 1) Fe | 2) N2O | 3) N2O3 |
| 4) NO2 | 5) Fe2O3 | 6) FeS |
| 7) N2O5 |  FeS2 FeS2 |
9) Fe3O4 |
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
[adsp-pro-3]
Задание №6
Даны две пробирки с раствором вещества X. В одну из них добавили раствор йодида алюминия, в результате чего образовался желтый осадок. В другую пробирку добавили раствор сильного электролита Y. При этом произошла реакция, не сопровождавшаяся видимыми признаками. Из предложенного перечня выберите вещества X и Y, удовлетворяющие условию задания.
1) Sr(OH)2
2) CH3COOAg
3) NH3
4) Si
5) Na2CO3
6) HNO3
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №7
Установите соответствие между названием вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | РЕАГЕНТЫ |
|
А) гидроксид бария Б) оксид углерода (IV) В) литий Г) гидрокарбонат кальция |
1) H2, KOH, K2SO4 2) HCl, Ca(OH)2, K2SO4 3) KOH, C, Mg 4) Li2SO4, KHCO3, CuCl2 5) N2, H2O, Br2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №8
Установите соответствие между исходными веществами и продуктами, которые образуются при их взаимодействии: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
|
А) Ba(OH)2 + NO2 Б) Ba(NO2)2 + NH4Cl В) Ba(OH)2 + NH4NO3 Г) Ba(OH)2 + N2O3 |
1) Ba(NO3)2 + NH3 + H2O 2) Ba(NO3)2 + NaCl + H2O 3) BaCl2 + N2 + H2O 4) Ba(OH)2 + NH3 5) Ba(NO2)2 + Ba(NO3)2 + H2O 6) Ba(NO2)2 + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №9
В данной схеме превращенийвеществами X и Y являются соответственно:
1) HNO3
2) HNO2
3) O2
4) H2O2
5) H2O
6) KMnO4
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
[adsp-pro-3]
Задание №10
Установите соответствие между названием вещества и общей формулой веществ гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ОБЩАЯ ФОРМУЛА ГОМОЛОГИЧЕСКОГО РЯДА |
|
А) бензойная кислота Б) гексиламин В) изопрен |
1) CnH2n+1N 2) CnH2n-6O2 3) CnH2n-2 4) CnH2n 5) CnH2n-8O2 6) CnH2n+1NO2 7) CnH2n+3N |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №11
Из предложенного перечня выберите два вещества, которые являются по отношению друг к другу структурными изомерами.
1) 1,1-диметилциклопропан
2) пентин
3) 2-метилциклобутен
4) цис-бутен-2
5) транс-бутен-2
Запишите в поле ответа номера выбранных веществ.
Задание 12
Из предложенного перечня соединений выберите все, которые реагируют с водным раствором гидроксида натрия.
1) метанол
2) фенилхлорметан
3) бутандиол-1,4
4) фенол
5) метилэтиловый эфир
6) этилэтаноат
Запишите в поле ответа номера выбранных соединений.
Ответ:___________________
Задание №13
Из предложенного перечня соединений выберите два таких, которые образуются при гидролизе пропилового эфира 2-аминопропановой кислоты, если гидролиз осуществляют действием раствора хлороводородной кислоты.
1) NH2-CH(CH3)-COOH
2) Cl—NH3+-CH(CH3)-COOH
3) CH3-CH(NH2)-COOH
4) CH3-CH2-CH2-OH
5) CH3-CH2-CH2-Cl
Запишите в поле ответа номера выбранных соединений.
[adsp-pro-3]
Задание №14
Установите соответствие между названием углеводорода и продуктом его полного гидрирования: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ УГЛЕВОДОРОДА | ПРОДУКТ ГИДРИРОВАНИЯ |
|
А) циклогексен Б) бензол В) бутин-2 Г) винилацетилен |
1) бутан 2) бутен-2 3) гексан 4) циклогексан 5) бензиловый спирт 6) бутадиен-1,3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №15
Установите соответствие между схемой реакции и органическим продуктом, образующимся в результате нее: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ |
|
А) пропеноат калия + HBr(р-р) Б) пропионат кальция В) пропилат калия + HBr(р-р) Г) пропаноат калия(тв.) + KOH(тв.) |
1) пропановая кислота 2) 2-бромпропановая кислота 3) 3-бромпропановая кислота 4) 3-бромпропаноат калия 5) пропан 6) пропанол-1 7) пентанон-2 9) пентанон-3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №16
В заданной схеме превращений
Х 1,2-дихлорпропан
пропен
веществами X и Y являются:
1) NaOH (спирт. р-р)
2) Mg
3) CH3-C≡CH
4) CH3-CH=CH2
5) CH2(OH)-CH(OH)-CH3
6)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задание №17
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие изопропилового спирта с пропионовой кислотой:
1) гомогенная
2) окислительно-восстановительная
3) обратимая
4) каталитическая
5) гетерогенная
Запишите в поле ответа номера выбранных типов реакций.
Ответ:___________________
Задание №18
Из предложенного перечня выберите все внешние воздействия, которые приводят к увеличению скорости реакции натрия с водородом.
1) понижение давления в системе
2) понижение температуры
3) добавление гидрида натрия
4) увеличение степени измельчения натрия
5) повышение температуры
Запишите в поле ответа номера выбранных воздействий.
Ответ:___________________
Задание №19
Установите соответствие между уравнением реакции и свойством выделенного вещества в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
|
А) 2NaNO2 + 2NaI + 2H2SO4 → 2Na2SO4 + I2 + 2NO + 2H2O Б) 5KNO2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 5KNO3 + 3H2O В) 4NO2 + O2 + 2H2O → 4HNO3 |
1) и окислитель, и восстановитель 2) не проявляет окислительно-восстановительных свойств 3) окислитель 4) восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №20
Установите соответствие между веществом и продуктами, образующимися на инертных электродах при электролизе его водного раствора с инертными электродами: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТЫ НА ЭЛЕКТРОДАХ |
|
А) Cs2S Б) SrI2 В) CuCl2 |
1) H2, O2 2) H2, I2 3) Sr, I2 4) H2, CO2, C2H6 5) H2, S 6) H2, Cl2 7) Cu, Cl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Для выполнения задания 21 используйте следующие справочные данные. Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V). pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
Задание №21
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) сульфат цинка
2) сульфат натрия
3) гидрокарбонат натрия
4) гидросульфат калия
Запишите номера веществ в порядке убывания значения рН их водных растворов.
Задание №22
Установите соответствие между способом воздействия на равновесную систему и направлением смещения химического равновесия
BaO(тв.) + CO2(г) ⇄ BaCO3(тв.) + Q
| ВОЗДЕЙСТВИЕ | СМЕЩЕНИЕ РАВНОВЕСИЯ |
|
А) охлаждение системы Б) добавление катализатора В) уменьшение объема реакционного сосуда Г) уменьшение давления |
1) в сторону обратной реакции 2) в сторону прямой реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №23
В замкнутый реактор поместили смесь хлора с нитрозилхлоридом (NOCl) и нагрели. В результате протекания обратимой реакции
2NO(г) + Cl2(г) ⇆ 2NOCl(г)
в системе установилось равновесие. При этом исходная концентрация хлора была равна 0,2 моль/л, а равновесные концентрации хлора и нитрозилхлорида (NOCl) — 0,4 моль/л и 0,1 моль/л соответственно.
Определите исходную концентрацию нитрозилхлорида (X) и равновесную концентрацию оксида азота (II) (Y).
Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,4 моль/л
3) 0,3 моль/л
4) 0,45 моль/л
5) 0,5 моль/л
6) 0,55 моль/л
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №24
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
|
А) ZnO + NaOH(р-р) Б) K2CrO4 + HNO3(р-р) В) AgNO3 + HCl Г) H2SO4 + NaHCO3(р-р) |
1) образование белого осадка 2) образование желтого осадка 3) растворение твердого осадка 4) выделение газа 5) изменение окраски раствора на оранжевую |
Запишите в таблицу выбранные цифры под соответствующими буквами.
[adsp-pro-3]
Задание №25
Установите соответствие между процессом и аппаратом, в котором этот процесс происходит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОЦЕСС | АППАРАТ |
|
А) перегонка нефти Б) получение аммиака В) получение натрия |
1) ректификационная колонна 2) доменная печь 3) электролизер 4) колонна синтеза 5) сепаратор 6) контактный аппарат |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответом к заданиям 26–28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
Задание №26
5,6 л газообразного бромоводорода (н.у.) поглотили водой объемом 150 мл. Рассчитайте массовую долю (в %) бромоводородной кислоты в полученном растворе. (Запишите число с точностью до сотых.)
Ответ:___________________ %.
Задание №27
Обжиг сульфида свинца (II) происходит согласно термохимическому уравнению
2PbS(тв) + 3O2(г) → 2PbO(тв) + 2SO2(г) + 832 кДж
Рассчитайте массу навески сульфида свинца (II) (в граммах), если в процессе выделилось 72,8 кДж энергии. (Ответ округлите до десятых.)
Ответ:___________________ г.
Задание №28
При дегидратации 25,3 г этанола было получено 11,2 л этилена (н.у.). Рассчитайте выход продукта в реакции. (Запишите число с точностью до целых.)
Ответ:___________________ %.
Не забудьте перенести все ответы в бланк ответов № 1 в соответствии с инструкцией по выполнению работы. Проверьте, чтобы каждый ответ был записан в строке с номером соответствующего задания.
Для выполнения заданий 29, 30 используйте следующий перечень веществ:
гидроксид натрия, сульфид железа (II), перманганат натрия, хлорид аммония, гидроксид алюминия, нитрит натрия. Допустимо использование водных растворов веществ.
Задание №29
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает при нагревании с выделением бесцветного газа.
В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель. .
[adsp-pro-3]
Задание №30
Из предложенного перечня веществ выберите гидроксид и вещество, которое вступает с этим гидроксидом в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Задание №31
Через водный раствор силиката натрия пропустили избыток углекислого газа. Полученный осадок отфильтровали, высушили и прокалили. Полученный твердый остаток прокалили вместе с углем и фосфатом кальция. Одно из полученных веществ растворили в концентрированной серной кислоте, в результате чего наблюдали выделение газа.
Задание №32
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Задание №33
Плотность паров некоторого спирта А в пересчете на н.у. составляет 3,39 г/л. Известно, что данный спирт может быть получен при окислении алкена Б нейтральным холодным раствором перманганата калия.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите возможную молекулярную формулу вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) запишите уравнение образования спирта А при взаимодействии алкена Б с нейтральным холодным раствором перманганата калия (используйте структурные формулы органических веществ).
Задание №34
В результате непродолжительного нагревания навески карбоната бария часть вещества разложилась. При этом масса твердого остатка составила 54,7 г, а массовая доля протонов в нем равна 43,14%. Полученный в результате прокаливания твердый остаток растворили в 182,5 г насыщенного раствора хлороводорода. Рассчитайте массовую долю хлороводорода в конечном растворе, если его растворимость в пересчете на нормальные условия составляет 448 л в 1 л воды.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Ответы к первой части варианта №10
| № задания, ответ | №задания, ответ |
|
1) 45 2) 251 3) 24 4) 13 5) 849 6) 26 7) 4352 9) 31 10) 573 11) 23 12) 246 13) 24 14) 4411 |
15) 3968 16) 42 17) 134 18) 45 19) 344 20) 527 21) 3214 22) 2321 23) 52 24) 3514 25) 143 26) 11,89 27) 41,8 28) 91 |
[adsp-pro-3]
Ответы ко второй части варианта №10
Задание 29
NH4Cl + NaNO2 = N2 + NaCl + 2H2O
1∙ | N-3 − 3ē → No
1∙ | N+3 + 3ē → N0
азот в степени окисления +3 (или нитрит натрия) является окислителем.
азот в степени окисления -3 (или хлорид аммония) – восстановителем.
Задание 30
Вариант ответа
NH4Cl + NaOH = NaCl + NH3 + H2O
NH4+ + Cl— + Na+ + OH— = Na+ + Cl— + NH3 + H2O
NH4+ + OH— = NH3 + H2O
Задание 31
1) Na2SiO3 + 2CO2 + 2H2O = 2NaHCO3 + H2SiO3
2) H2SiO3 = H2O + SiO2
3) 3SiO2 + Ca3(PO4)2 + 5C = 3CaSiO3 + 2P + 5CO
4) 2P + 5H2SO4(конц.) = 2H3PO4 + 5SO2 + 2H2O
Задание 32
1) 5C2H5OH + 2KMnO4 + 3H2SO4 = 5CH3CHO + K2SO4 + 2MnSO4 + 8H2O
2) CH3CHO + H2 = CH3CH2OH
3) HCOOH + C2H5OH = H-C(O)-O-C2H5 + H2O
4) H-C(O)-O-C2H5 + KOH = HCOOK + C2H5OH
5) HCOOK + 2KMnO4 + 3KOH = K2CO3 + 2K2MnO4 + 2H2O
Задание 33
Плотность паров некоторого спирта А в пересчете на н.у. составляет 3,39 г/л. Известно, что данный спирт может быть получен при окислении алкена Б нейтральным холодным раствором перманганата калия.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите возможную молекулярную формулу вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) запишите уравнение образования спирта А при взаимодействии алкена Б с нейтральным холодным раствором перманганата калия (используйте структурные формулы органических веществ).
Решение:
M(спирта) = ρ · Vm = 3,39 г/л · 22,4 л/моль = 76 г/моль,
Обозначим формулу алкена Б как CnH2n. При окислении алкенов нейтральным холодным раствором перманганата калия образуются вицинальные диолы, которые отличаются по составу от исходных алкенов на две гидроксильные группы. То есть, формулу спирта А можно записать как CnH2n(OH)2 или CnH2n+2O2. Тогда молярная масса спирта А может быть выражена следующим образом:
M(спирта) = M(CnH2n+2O2) = 12n + 2n + 2 +32 = (14n + 34) г/моль.
Тогда справедливым будет уравнение:
14n + 34 = 76, решим его
14n = 42
n = 3
Таким образом, молекулярная формула спирта А − C3H8O2.
Структурная формула
Уравнение реакции:
3CH2=CH-CH3 + 2KMnO4 + 4H2O = 3CH2(OH)-CH(OH)-CH3 + 2KOH + 2MnO2
.
Задание 34
В результате непродолжительного нагревания навески карбоната бария часть вещества разложилась. При этом масса твердого остатка составила 54,7 г, а массовая доля протонов в нем равна 43,14%. Полученный в результате прокаливания твердый остаток растворили в 182,5 г насыщенного раствора хлороводорода. Рассчитайте массовую долю хлороводорода в конечном растворе, если его растворимость в пересчете на нормальные условия составляет 448 л в 1 л воды.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение:
BaCO3 = BaO + CO2 (I)
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (II)
BaO + 2HCl = BaCl2 + H2O (III)
В одной формульной единице оксида бария содержится 64 протона, а в случае карбоната бария — 86. Пусть после прокаливания было х моль оксида бария и у моль карбоната. Тогда можно записать следующие вычисления:
m(BaO) = 153х г
m(BaCO3) = 197у г
m(смеси) = 153х + 197у = 54,7 г
Выразим массовую долю протонов в смеси:
m(p) = 64x + 86y г
ω(р) = m(p)/m(смеси) · 100% = (64x + 86y)/54,7 · 100% = 43,14%
Решим систему уравнений:
153х + 197у = 54,7
(64x + 86y)/54,7 · 100% = 43,14%
153х + 197у = 54,7
(64x + 86y)/54,7 = 0,4314
153х + 197у = 54,7
64x + 86y = 23,6
х = 0,1
у = 0,2
nII(HCl) = 2nост.(BaCO3) = 2 · 0,2 моль = 0,4 моль,
nIII(HCl) = 2n(BaO) = 2 · 0,1 моль = 0,2 моль,
nобщ. израсх.(HCl) = nII(HCl) + nIII(HCl) = 0,4 моль + 0,2 моль = 0,6 моль.
Состав насыщенного раствора какого-либо вещества является постоянным при одной и той же температуре. Поэтому узнать концентрацию 182,5 г насыщенного раствора хлороводорода мы можем, рассчитав концентрацию эталонного раствора по данным о растворимости.
Нам сказано что в пересчете на нормальные условия в 1 литре воды растворяется 448 л хлороводорода, т.е.
nэт.(HCl) = Vэт.(HCl)/Vm = 448 л/22,4 л/моль = 20 моль,
mэт.(HCl) = nэт.(HCl) · M(HCl) = 20 моль · 36,5 г/моль = 730 г.
1 литр воды в виду плотности воды равной 1 кг/л имеет массу 1 кг, т.е. 1000 г.
Таким образом, масса эталонного раствора будет равна:
mэт.(р-ра HCl) = mэт.(H2O) + mэт.(HCl) = 1000 г + 730 г = 1730 г,
Тогда концентрация эталонного насыщенного раствора хлороводорода:
ωнас.(HCl) = mэт.(HCl)/mэт.(р-ра HCl) = 730 г/1730 г = 0,422 или 42,2%.
Тогда масса хлороводорода, содержащегося в 182,5 г его насыщенного раствора будет равна:
mисх.(HCl) = ωнас.(HCl) · mисх.(р-ра HCl) = 0,422 · 182,5 = 77,015 г,
nисх.(HCl) = mисх.(HCl)/M(HCl) = 77,015 г / 36,5 г/моль = 2,11 моль,
nост.(HCl) = nисх.(HCl) − nобщ. израсх.(HCl) = 2,11 моль − 0,6 моль = 1,51 моль,
mост.(HCl) = nост.(HCl) · M(HCl) = 1,51 моль · 36,5 г/моль = 55,115 г,
Рассчитаем массу конечного раствора. Она будет равна:
mконечн.(р-ра) = m(остатка) + mисх.(р-ра HCl) − mII(CO2), где mII(CO2) − масса углекислого газа, образовавшегося по реакции II.
nII(CO2) = nост.(BaСO3) = 0,2 моль,
mII(CO2) = nII(CO2) · M(CO2) = 0,2 моль · 44 г/моль = 8,8 г,
Тогда mконечн.(р-ра) = 54,7 г + 182,5 г − 8,8 г = 228,4 г,
массовая доля хлороводорода в конечном растворе будет составлять:
ωконечн.(HCl) = mост.(HCl)/mконечн.(р-ра) = 55,115 г/228,4 г = 0,2413 или 24,13%
[adsp-pro-10]
Смотреть видео:
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Задание 15. ЕГЭ 2020 по химии. Демо. Пробный вариант
Your system education

Задание 14. ЕГЭ 2020 по химии. Демо. Пробный вариант
Your system education

Задание 5. ЕГЭ 2020 по химии. Демо. Пробный вариант
Your system education

Задание 3. ЕГЭ 2020 по химии. Демо. Пробный вариант
Your system education
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
25.05.2020
- Комментарии
RSS
Написать комментарий
Нет комментариев. Ваш будет первым!
Ваше имя:
Загрузка…
ХИМИЯ
2022—2023 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2023 года с решениями.
2021—2022 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2022 года с решениями.
2020—2021 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2021 года с решениями.
2019—2020 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2020 года с решениями.
2018—2019 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2019 года с решениями.
ЕГЭ по химии 25.03.2019. Досрочная волна. Вариант.
ЕГЭ по химии 31.05.2019. Основная волна. Вариант.
2017—2018 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2018 года с решениями.
2016—2017 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2017 года с решениями.
ЕГЭ по химии 29.03.2017. Досрочная волна. Вариант.
2015—2016 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2016 года с решениями.
2014—2015 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2015 года с решениями.
ЕГЭ по химии 05.05.2015. Досрочная волна. Вариант.
2013—2014 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2014 года с решениями.
2012—2013 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2013 года с решениями.
2011—2012 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2012 года с решениями.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 5.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 5.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 5.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5.