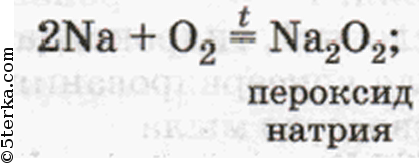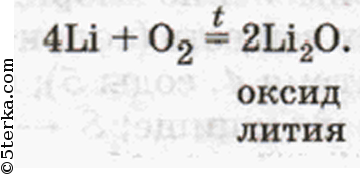Назад к содержанию
Решение на Вопрос 3, Параграф 14 из ГДЗ по Химии за 9 класс Габриелян О.С.
Условие
Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991).
Добрый литий.
В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий — самый лёгкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую «шубу», так как был очень лёгким и всплывал в керосине.Но всё же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны Кислороду отдаёшь? Не лучше ли делать так, как мы?» Отвечал Литий: «Я всегда рад помочь другим, не то что вы — жадничаете. Я рад, что в моём оксиде Кислород имеет свою обычную степень окисления —2, не то что -1 в ваших странных, ни на что не похожих пероксидах». Сказал так и ушёл восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава М2O дают лишь тогда, когда их силой заставят, т. е. создадут соответствующие условия — нагреют пероксид (Na2O2) с таким же металлом-«жадиной» (Na)».Какие химические понятия использовала в художественной форме Наташа?
Решение 1
Популярные решебники
Прочитайте сочинение, написанное ученицей 9 класса
531-й школы Москвы Наташей Фроловой (1991).
В большом семиэтажном доме, в подъезде щелочных ме-
таллов, на втором этаже жил Литий — самый лёгкий и
беззаботный металл. Он, как и все щелочные металлы,
очень активно взаимодействовал с кислородом, неметал-
лами, водородом и водой. Как и все, защищался от кисло-
рода, но носил не керосиновую, а вазелиновую «шубу»,
так как был очень лёгким и всплывал в керосине.
Но всё же Литий не был во всех отношениях похожим на
своих собратьев: он был добр, щедр и прост. Он с охотой
отдавал свои электроны и кислороду, и азоту, и многим
другим элементам. Из-за этих-то особенностей Литий
страдал, так как другие щелочные металлы, особенно та-
кие хитрые, как Калий и Натрий, не давали ему прохода.
Дело было в том, что, когда щелочные металлы горели
в кислороде, каждые их два атома отдавали одной молеку-
ле Кислорода два своих электрона — каждому атому по
одному. Остальные электроны они припрятывали до поры
до времени. Литий же был честен — отдавал молекуле Ки-
слорода в два раза больше электронов, чем остальные ме-
таллы: на четыре атома Лития — четыре электрона. Да и с
Азотом Литий взаимодействовал спокойно, при обычной
температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему
он так поступает? Нет ли в его поведении каких-либо
скрытых выгод?
Спрашивает Натрий: «Почему ты, брат Литий, все свои
электроны Кислороду отдаёшь? Не лучше ли делать так,
как мы?» Отвечал Литий: «Я всегда рад помочь другим,
не то что вы — жадничаете. Я рад, что в моём оксиде Ки-
слород имеет свою обычную степень окисления -2, не то
что -1 в ваших странных, ни на что не похожих перокси-
дах» . Сказал так и ушёл восвояси. Долго стояли Натрий и
Калий в раздумье, но так ничего и не поняли. И сейчас с
Кислородом продолжают пероксиды образовывать. А ок-
сиды состава М2O дают лишь тогда, когда их силой заста-
вят, т. е. создадут соответствующие условия — нагреют
пероксид (Nа2O2) с таким же металлом-«жадиной» (Nа)».
Какие химические понятия использовала в художествен-
ной форме Наташа?
3 Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991). Какие химические понятия использовала в художественной форме Наташа?
Добрый Литий
В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий — самый легкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую «шубу», так как был очень легким и всплывал в керосине.
Но все же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и Кислороду, и Азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны Кислороду отдаешь? Не лучше ли делать так, как мы?» Отвечал Литий: «Я всегда рад помочь другим, не то что вы — жадничаете. Я рад, что в моем оксиде Кислород имеет свою обычную степень окисления -2, не то что -1 в ваших странных, ни на что не похожих пероксидах». Сказал так и ушел восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава М2O дают лишь тогда, когда их силой заставят, т. е. создадут соответствующие условия — нагревают пероксид (Na2O2) с таким же металлом — «жадиной (Na)».
Ответ:
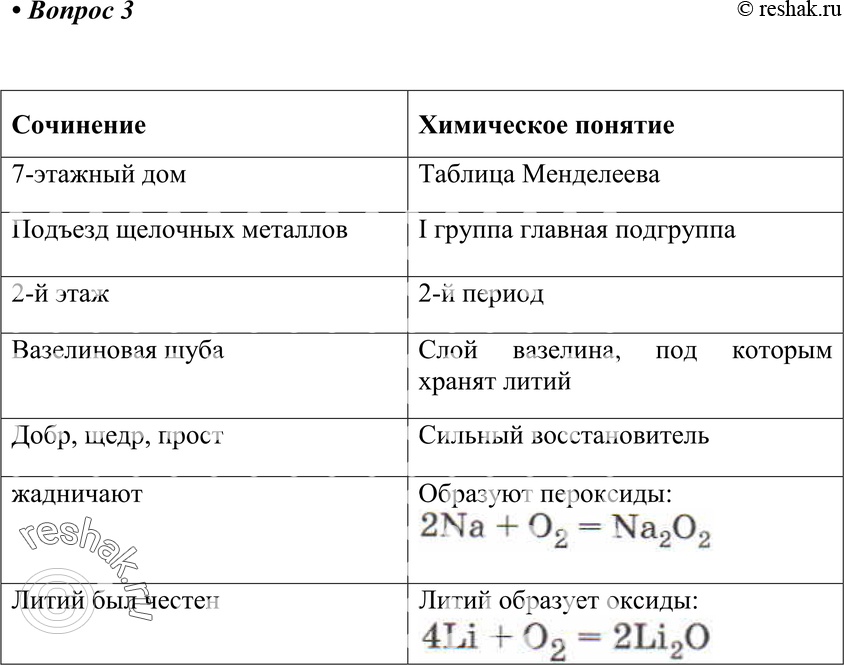
Семиэтажный дом— периодическая таблица; подъезд щелочных металлов — I группа элементов; вазелиновая «шуба» способ хранения лития под слоем вазелина. Также Наташа использовала художественный язык для описания и объяснения химических свойств Li (восстановительные свойства, реакция с кислородом).
Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991). Какие химические понятия использовала в художественной форме Наташа?
В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий — самый легкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую «шубу», так как был очень легким и всплывал в керосине.
Но все же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и Кислороду, и Азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны Кислороду отдаешь? Не лучше ли делать так, как мы?» Отвечал Литий: «Я всегда рад помочь другим, не то что вы — жадничаете. Я рад, что в моем оксиде Кислород имеет свою обычную степень окисления -2, не то что -1 в ваших странных, ни на что не похожих пероксидах». Сказал так и ушел восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава М2O дают лишь тогда, когда их силой заставят, т. е. создадут соответствующие условия — нагревают пероксид (Na2O2) с таким же металлом — «жадиной (Na)».

ГДЗ #1
Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991).
Добрый Литий
B большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий — самый лёгкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую «шубу», так как был очень лёгким и всплывал в керосине.
Ho всё же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны Кислороду отдаёшь? He лучше ли делать так, как мы?» Отвечал Литий: «Я всегда рад помочь другим, не то что вы — жадничаете. Я рад, что в моём оксиде Кислород имеет свою обычную степень окисления —2, не то что -1 в ваших странных, ни на что не похожих пероксидах». Сказал так и ушёл восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. A оксиды состава M2O дают лишь тогда, когда их силой заставят, т. e. создадут соответствующие условия — нагреют пероксид (Na2O2) с таким же металлом-«жадиной» (Na)».
Какие химические понятия использовала в художественной форме Наташа?
На этой странице вы сможете найти и списать готовое домешнее задание (ГДЗ) для школьников по предмету Химия, которые посещают 9 класс из книги или рабочей тетради под названием/издательством «Учебник», которая была написана автором/авторами: Габриелян. ГДЗ представлено для списывания совершенно бесплатно и в открытом доступе.
Обновлено: 09.01.2023
Но все же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и Кислороду, и Азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Ответы
это записи с урока обществознания. надеюсь, )
1. теа́тр (греч. θέατρον — основное значение — место для зрелищ, затем — зрелище, от θεάομαι — смотрю, вижу) — форма исполнительского искусства. театр — это синтез всех искусств, он включает в себя музыку, архитектуру, живопись, кинематограф, фотографию и т. д. основным средством выразительности является актёр, который через действие, используя разные театральные приёмы и формы существования, доносит до зрителя суть происходящего на сцене. при этом актёром не обязательно должен быть живой человек. это может быть кукла или какой-либо предмет, человеком. театр считается самым сильным средством влияния на человека, поскольку, видя происходящее на сцене, зритель ассоциирует себя с тем или иным персонажем, и через катарсис (очищение через страдание) внутри него происходят изменения.
основные работники театра: режиссёр, актеры, гримеры, гардеробщики, осветители, билетеры, , художники, рабочие сцены.
2. музыка и изо. их роднит искусство. музыка и изо — это определенный язык. в музыке — ноты, а в изо — изображения (картины)
4. музыку и роднит примерно то же, что и музыку и изо..
почти каждая опера начинается с увертюры -симфонического вступления, которое знакомит слушателя в общих чертах с содержанием всего действия.
6. актеров много, например: максим аверин, владислав галкин, кирилл плетнев, антон макарский, виталий абдулов, сергей безруков, гела месхи, леонид быков, денис рожков, дмитрий дюжев, константин хабенский, александр дедюшко.. и т. д.
3 Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991). Какие химические понятия использовала в художественной форме Наташа?

Но все же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и Кислороду, и Азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Ответ:
На этой странице вы сможете найти и списать готовое домешнее задание (ГДЗ) для школьников по предмету Химия, которые посещают 9 класс из книги или рабочей тетради под названием/издательством «Учебник», которая была написана автором/авторами: Габриелян. ГДЗ представлено для списывания совершенно бесплатно и в открытом доступе.
Материал подготовил
В.М.АНДРАМОНОВ,
учитель химии, математики
Среднетатмышской
общеобразовательной школы
(Канашский р-н, Республика Чувашия)
К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns 1 . В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
3Na + AlCl3 = 3NaCl + Al
Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li + окрашивает пламя в красный цвет, Na + — в желтый, а K + , Rb + , Cs + — в фиолетовый.
Примеры решения задач
Найдем количество вещества хлора:
Исходя из уравнения реакции, количество вещества натрия равно:
v(Na) = 0,3/2 =0,15 моль
Найдем массу натрия, выделившегося на катоде:
m(Na) = 0,15?23 = 3,45г
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Внимание, только СЕГОДНЯ!
3 Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991). Какие химические понятия использовала в художественной форме Наташа?
Ответ:
Глава 1. Металлы. § 12(12). Бериллий, магний и щелочноземельные металлы
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Внимание, только СЕГОДНЯ!
Читайте также:
- Сочинение для чего нужен обереги на руси куклы благополучница
- Что дает основание рассматривать пьесу а с грибоедова горе от ума как трагикомедию сочинение
- На что способен человек ради родины сочинение
- Сочинение поездка в псков
- Сочинение на тему какие мысли и рассуждения автора очерка земля родная мне близки и почему
Обновлено: 11.03.2023
Но все же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и Кислороду, и Азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Ответы
это записи с урока обществознания. надеюсь, )
1. теа́тр (греч. θέατρον — основное значение — место для зрелищ, затем — зрелище, от θεάομαι — смотрю, вижу) — форма исполнительского искусства. театр — это синтез всех искусств, он включает в себя музыку, архитектуру, живопись, кинематограф, фотографию и т. д. основным средством выразительности является актёр, который через действие, используя разные театральные приёмы и формы существования, доносит до зрителя суть происходящего на сцене. при этом актёром не обязательно должен быть живой человек. это может быть кукла или какой-либо предмет, человеком. театр считается самым сильным средством влияния на человека, поскольку, видя происходящее на сцене, зритель ассоциирует себя с тем или иным персонажем, и через катарсис (очищение через страдание) внутри него происходят изменения.
основные работники театра: режиссёр, актеры, гримеры, гардеробщики, осветители, билетеры, , художники, рабочие сцены.
2. музыка и изо. их роднит искусство. музыка и изо — это определенный язык. в музыке — ноты, а в изо — изображения (картины)
4. музыку и роднит примерно то же, что и музыку и изо..
почти каждая опера начинается с увертюры -симфонического вступления, которое знакомит слушателя в общих чертах с содержанием всего действия.
6. актеров много, например: максим аверин, владислав галкин, кирилл плетнев, антон макарский, виталий абдулов, сергей безруков, гела месхи, леонид быков, денис рожков, дмитрий дюжев, константин хабенский, александр дедюшко.. и т. д.
3 Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991). Какие химические понятия использовала в художественной форме Наташа?

Но все же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и Кислороду, и Азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Ответ:
На этой странице вы сможете найти и списать готовое домешнее задание (ГДЗ) для школьников по предмету Химия, которые посещают 9 класс из книги или рабочей тетради под названием/издательством «Учебник», которая была написана автором/авторами: Габриелян. ГДЗ представлено для списывания совершенно бесплатно и в открытом доступе.
Материал подготовил
В.М.АНДРАМОНОВ,
учитель химии, математики
Среднетатмышской
общеобразовательной школы
(Канашский р-н, Республика Чувашия)
К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns 1 . В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
3Na + AlCl3 = 3NaCl + Al
Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li + окрашивает пламя в красный цвет, Na + — в желтый, а K + , Rb + , Cs + — в фиолетовый.
Примеры решения задач
Найдем количество вещества хлора:
Исходя из уравнения реакции, количество вещества натрия равно:
v(Na) = 0,3/2 =0,15 моль
Найдем массу натрия, выделившегося на катоде:
m(Na) = 0,15?23 = 3,45г
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Внимание, только СЕГОДНЯ!
3 Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991). Какие химические понятия использовала в художественной форме Наташа?
Ответ:
Глава 1. Металлы. § 12(12). Бериллий, магний и щелочноземельные металлы
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Внимание, только СЕГОДНЯ!
Читайте также:
- Сочинение для чего нужен обереги на руси куклы благополучница
- Что дает основание рассматривать пьесу а с грибоедова горе от ума как трагикомедию сочинение
- На что способен человек ради родины сочинение
- Сочинение поездка в псков
- Сочинение на тему какие мысли и рассуждения автора очерка земля родная мне близки и почему