Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет иодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары
желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной
кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

Получение
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
NH3 + O2 → (кат. Pt) NO + H2O
NO + O2 → NO2
NO2 + H2O + O2 → HNO3
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
Химические свойства
- Кислотные свойства
- Термическое разложение
- Реакции с неметаллами
- Реакции с металлами
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии
выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в
темном месте.
HNO3 → (hv) NO2 + H2O + O2
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2,
если разбавленная — до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой
именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием
нитрата и преимущественно NO2.
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2,
NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка
с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит
за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так
как оксидная пленка на поверхности металлов разрушается.
Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Соли азотной кислоты — нитраты NO3—
Получение
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
MgO + HNO3 → Mg(NO3)2 + H2O
Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O

Нитрат аммония получают реакция аммиака с азотной кислотой.
NH3 + HNO3 → NH4NO3
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная
кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
Химические свойства
- Реакции с металлами, основаниями и кислотами
- Разложение нитратов
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате
реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
AgNO3 + KCl → AgCl↓ + KNO3

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.

Pb(NO3)2 → (t) PbO + NO2 + O2
NaNO3 → (t) NaNO2 + O2
Cu(NO3)2 → (t) CuO + NO2 + O2
PtNO3 → (t) Pt + NO2 + O2

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Алхимики
«Кто не понимает ничего, кроме химии, тот и ее понимает недостаточно…»
(Георг Кристоф Лихтенберг)
- Главная страница
- СОДЕРЖАНИЕ
- УЧИТЕЛЬСКАЯ
- ЕГЭ
- 11 класс
- 10 класс
- 8 класс
- МОЯ ИНТЕРНЕТ — БИБЛИОТЕКА
- ОЛИМПИАДА
- Домашняя лаборатория
- РАЗВЛЕКИСЬ!
вторник, 25 февраля 2014 г.
Производство азотной кислоты.
Получение
1.
Лабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
2.
Промышленный способ
Осуществляется в три этапа:
a)
Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 →
4NO + 6H2O (Условия: катализатор – Pt,
t = 500˚С)
б) Окисление
кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в)
Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O
↔ 4HNO3
или
3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
Закрепление:
Тренажёр «Получение азотной кислоты»
Источники:
- Урок №31. Азотная кислота. Строение молекулы. Получение
Автор:
Носова Е.Ю.
на
11:49
Ярлыки:
11 класс,
9 класс,
ЕГЭ,
ЭКЗАМЕН
Комментариев нет:
Отправить комментарий
Следующее
Предыдущее
Главная страница
Подписаться на:
Комментарии к сообщению (Atom)
Производство азотной кислоты
Азотную
кислоту, известную с VIII в., до XVIII в.
получали нагреванием селитры NaNO2
с железным купоросом. Последний
впоследствии заменили серной кислотой.
Этот способ просуществовал до начала
XX в., когда запасы природной селитры
были исчерпаны. Из других источников
сырья промышленное значение имеют азот
атмосферы и органические вещества
(уголь, торф, биомасса растений и т.д.).
Синтетические способы фиксации
атмосферного азота (плазменный и
аммиачный) были разработаны в начале
XX в. По первому из них азот реагирует с
кислородом под действием высоких
температур (3000 — 4000° С), создаваемых
плазмотроном. Аммиачный способ благодаря
высокой экономической эффективности
в настоящее время является основным
(95% в мировой практике). Сырьем служит
азотоводородная смесь в соотношении 1
: 3. Современная технология основана
на конверсии природного газа и воздуха.
Таким способом сейчас получают более
95% азотоводородной смеси для синтеза
аммиака.
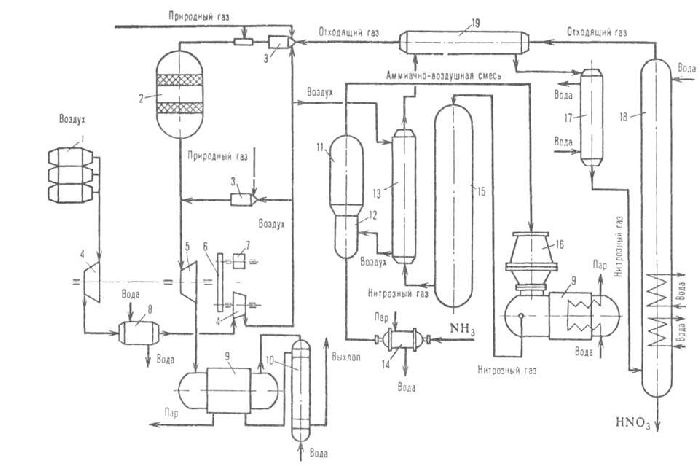
Производство
разбавленной азотной кислоты из аммиака
включает три основных процесса (рис.
52, в):
4NH3+502=4NO+6H20+Q
2NO+O2<->2N02+Q
3N02+H20<->2HNO3+NO+Q
Первый
из них идет интенсивно в присутствии
катализатора из платины или ее сплавов,
выполненного в виде пакета тончайших
сеток (1024 ячейки на 1 см), при температуре
окисления аммиака 700—800° С, два других
— при повышенном давлении. Увеличение
давления в 10 раз ускоряет процесс
окисления оксида азота (II). Перед подачей
в контактный аппарат реагенты (NНз
и воздух) глубоко очищают в фильтрах
и от примесей, пыли, масла. Аммиак
нагревают в подогревателе и подают
во встроенный (внутренний) теплообменник
контактного аппарата, а затем на
платиновые сетки. Сюда же компрессором
нагнетают воздух. После охлаждения
нитрозные газы компрессором подают в
абсорбционную колонну, в которой
параллельно проходят два последних
процесса. Противоточно в нее поступает
вода, нагретая до 30° С. Непрореагировавшие
нитрозные газы улавливают, а выхлопные
газы выбрасываются в атмосферу через
трубу высотой до 100 м. Температуру
абсорбции поддерживают в пределах
30—40°С. Вытекающая 60-процентная азотная
кислота из абсорбционной колонны
освобождается от нитрозных газов
(отбеливается) воздухом и направляется
на склад готовой продукции или, что
происходит чаще всего, на производство
минеральных удобрений.
Теплота
экзотермических реакций полностью
покрывает затраты на технологические
нужды, в результате повышаются все
технико-экономические показатели
производства. Производительность таких
агрегатов составляет 1360 т/сут, строятся
еще более мощные — до 2260 т/сут.
Концентрированную
азотную кислоту чаще всего получают
прямым синтезом.
2N2О4+2H2О<->2HNО3+Q
Поступающие
из контактного отделения нитрозные
газы (рис. 44) после охлаждения в
аппарате 1 компрессором 2 подаются в
окислительную колонну 3, где 96 – 97% NO
превращается в NO4.
После холодильника 4 газы поступают в
нитроолеумную колонну 5, где абсорбируются
до 36% N2O4.
В отбелочной колонне 6 N2O4
десорбируется, а в холодильнике 7
конденсируется и в смеси с разбавленной
азотной кислотой поступает в автоклав
9. Неокислившиеся и несконденсировавшиеся
нитрозные газы, отдавая теплоту в
теплообменнике 8, возвращаются в цикл,
а образовавшийся в колоннах и холодильниках
25-процентный раствор азотной кислоты
частично через колонну 6 и холодильник
7 подается в автоклав, а частично идет
на производство минеральных удобрений,
например аммиачной селитры.
Рис.
44. Схема производства концентрированной
азотной кислоты прямым синтезом:
1-аппарат для охлаждения, 2-компрессор,
3-окислительная колонна, 4, 7-холодильник,
5-нитроолеумная колонна, 6-отбелочная
колонна, 8-теплообменник, 9-автоклав
На
современных предприятиях, использующих
мощные агрегаты, показатели затрат
электроэнергии, пара и воды в 3 — 5 раз
ниже. Выхлопные газы подвергаются
высокотемпературной каталитической
очистке. Содержание нитрозных газов
в них после этого не превышает 0,0005%.
Большие
затраты аммиака отражаются на себестоимости
азотной кислоты, которая в 1,5 — 2 раза
выше себестоимости серной.
Основные
направления азотно-кислотного
производства:
-
увеличение
производственной мощности агрегатов
до 2500 т/сут; -
полная автоматизация;
-
повышение качества
продукции комплексным использованием
сырья, энергии и воды, полной утилизацией
отходов; -
поиск более
эффективных технологических схем; -
промышленное
освоение способов биологической и
низкотемпературной фиксации
атмосферного азота.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Муниципальное автономное
общеобразовательное учреждение- средняя общеобразовательная школа № 1 имени
В.И. Фадеева станицы Калининской
Консультация по химии
для подготовки к единому
государственному экзамену
на тему «Азотная кислота»
Выполнила:
Учитель химии
Каблучкина Наталья Борисовна
Ст. Калининская
2014г
Задачи занятия:
Обобщить
знания об азотной кислоте, полученные в курсе неорганической и органической
химии.
На
примере азотной кислоты повторить классификацию и основные свойства кислот в
свете ТЭД, закономерности протекания ОВР, реакции гидролиза и электролиза,
решение задач на растворы, по алгоритму.
Продолжить
отработку умений выполнять тестовые задания части А,В,С единого
государственного экзамена.
Оборудование:
—
опорные схемы по теории,
—
раздаточные таблицы по взаимодействию азотной кислоты с металлами,
—
тестовые задания.
Ход занятия
1. Организационный момент.
Приветствие
учащихся. Сообщение темы и цели занятия.
2.Учитель обобщает материал по данной теме с
использованием опорных схем на экране компьютера:
Азотная
кислота
НNO3 (N+5,
NIV)
— одноосновная
— кислородсодержащая
— сильный электролит
— сильный окислитель
Получают: NH3
→ NO → NO2
→HNO3
Физ. свойства:
Ж, беcцветная, дымящая,
резкий запах,
tкип.
= 860С,
Хим. свойства:
1.
Нестойкая, разлагается на свету, при t
4НNO3
→ 4NO2↑ + 2Н2О + О2↑
( желтеет при неправильном хранении)
2.
Диссоциирует НNO3
→Н+ + NO3—
кислотные свойства
+ основные, амфотерные оксиды
+ основания
+ соли слабых кислот
3.
Окисляет все металлы, кроме Аu, Pt
с образованием
трёх продуктов:
Ме + НN+5O3 → соль +
вода + ↑ соед. N+4,
N+2,
N+1,
N20
, N-3
|
HNO3 |
-не Au,Pt |
||||||
|
Концентрированная (пассивация |
Разбавленная |
||||||
|
активные |
неактивные в-ва |
неактивные в-ва |
активные |
активные |
|||
|
|
|
NO↑ |
N2↑ |
NH3 ( NH4NO3) |
|||
|
HNO3 концентрированная
|
кислота или 4HNO3 2HNO3 |
||||||
4.Реагирует
с органическими веществами( алканы, арены,
фенол, анилин, целлюлоза, белки)
реакции замещения — нитрования
НNO3
→ НО — NO2 –
нитрогруппа
СН4 + HNO3
→ СН3—
NO2 + Н2О
С6Н6 + HNO3
→ С6Н5—
NO2 + Н2О
Качественная реакция на нитраты
нитрат
+ конц. Н2SO4 + Cu → … + NO2↑
Разложение нитратов
(по
ряду активности металлов)
|
1. Металлы левее магния |
KNO3 à КNO2 + O2 |
|
2. до |
Mg(NO3) металла* + NO2 + O2 |
|
3. |
|
3.Учащиеся
задают вопросы, используя записи собственного конспекта и предложенных
опорных схем.
Например: — Что
значит пассивация?
— Какая кислота называется оксикислотой?
— Как правильно записать качественные реакции на нитраты?
— Какие соли называются силитрами?
4.
Отработка умения записывать уравнения ОВР химических
реакций и расставлять коэффициенты методом электронного баланса.
Два
ученика у доски работают с уравнениями:
Cu
+ 4HNO3(конц) = Cu(NO3)2
+ 2H2O + 2NO2
3Cu
+ 8HNO3(разб) = 3Cu(NO3)2
+ 4H2O + 2NO
5. Выполнение
учащимися тестовых заданий и задания уровня С .
Учащиеся
работают дифференцированно: 2 ученика с заданиями С у доски, 3 ученика с
заданиями В вместе, остальные с заданиями А самостоятельно. Учитель выполняет
роль консультанта.
Часть
А
1.Какой
оксид реагирует с раствором НNO3,
но не реагирует с раствором NaOH?
1)
CO 3) P2O5
2)
SO3 4) MgO
2.
Азотная кислота реагирует с каждым веществом набора:
1)
KOH и Na2СO3
2)
HCl и NaOH
3) CuO
и KNO3
4) Fe2O3
и H2SO4
3.В
схеме превращений NH3⎯→ X ⎯→ Y⎯→ НNO3 ⎯→ Y
веществами
«X» и «Y» являются соответственно
1) NO2
и NO
2) NO и NO2
3)
Н2 и Н2О
4)
HCl и H2O
4.Взаимодействие
азотной кислоты с аммиаком относится к реакциям
1)
соединения, необратимым
2)
обмена, обратимым
3)
замещения, обратимым
4)
обмена, необратимым
5.В
отличие от этилена, этан реагирует с
1)
хлором
2)
водородом
3)
азотной кислотой
4)
кислородом
6.
Наибольшее количество нитрат-ионов образуется в растворе при диссоциации 1 моль
1)
нитрата натрия
2)
нитрата меди(II)
3)
нитрата алюминия
4)
нитрата кальция
7.
Одинаковую реакцию среды имеют растворы нитрата меди(II) и
1)
хлорида кальция
2)
нитрата натрия
3)
сульфата алюминия
4)
ацетата натрия
8.
Окислительные свойства азотная кислота проявляет в реакции, схема которой:
1) НNO3+ NH3
→ NH4NO3
2) НNO3+
KOH →
KNO3+
H2O
3) НNO3 + P
→ H3 PO4
+ NO2
4) НNO3+ CuO
→ Cu(NO3)2
+ H2O
Часть
В
В-1. Установите
соответствие между формулой соли и её способностью к гидролизу.
ФОРМУЛА СОЛИ СПОСОБНОСТЬ
К ГИДРОЛИЗУ
1) NН4NO3
А) по катиону
2) Ва(NO3)2
Б) по аниону
3) Аl(NO3)3
В) по катиону и аниону
Г) гидролизу не подвергается
В-2. Установите
соответствие между формулой вещества и продуктом, который образуется на аноде в
результате электролиза водного раствора этого вещества.
|
ФОРМУЛА |
ПРОДУКТ |
|
А) AgNO3 Б) HNO3 В) NaNO3 |
1) оксид 2) азот 3) 4) |
В-3. Определите массу воды, которую надо добавить к 20
г раствора азотной
кислоты с массовой долей 70% для получения раствора
азотной кислоты
с массовой долей 5%. (Запишите число с точностью до
целых.)
Ответ: ___________ г.
В-4. Рассчитайте объём оксида азота (+4), полученный
при разложении 126 г азотной кислоты. %. (Запишите число с точностью до
десятых.)
Ответ: ___________ л.
Часть С
С-1. Используя метод электронного баланса,
составьте уравнение реакции
НNO3
+ СuS
→ СuSO4
+ … + H2O
Укажите окислитель и восстановитель.
С- 2. Сплав серебра с медью массой 0,5 кг
обработали раствором азотной кислоты. К полученному раствору добавили соляную
кислоту. Масса образовавшегося осадка равна 430 г. Определите массовую долю
серебра в сплаве.
6. Разбор
выполненных заданий:
Ответы на
задания части А с комментариями.
Ответы на
задания части В с комментариями.
Комментарии
выполненных на доске заданий части С.
Получение азотной кислоты

4
Средняя оценка: 4
Всего получено оценок: 235.
4
Средняя оценка: 4
Всего получено оценок: 235.
Азотную кислоту впервые стали получать ещё в XVII веке. Современный лабораторный метод предполагает получение кислоты из нитратов. Для получения азотной кислоты в промышленности используется метод окисления аммиака.
Общее описание
Формула азотной кислоты HNO3. Это сильная бесцветная кислота с резким запахом. Она неограниченно растворима в воде. Имеет небольшие температуры плавления (-41°C) и кипения (82,6°С). Плотность кислоты – 1,52 г/см3.
Концентрированная азотная кислота выделяет ядовитые газы – оксиды азота. Азотная кислота окисляет органические вещества: разрушает бумагу, натуральную ткань, вызывает ожоги на коже.
Азотная кислота в небольшом количестве образуется в дождевой воде при разрядах молнии.
Получение
Азотную кислоту впервые получили алхимики из селитры и железного купороса при термической реакции:
4KNO3 + 2FeSO4 ∙ 7H2O → Fe2O3 + 2K2SO4 + 2HNO3↑ + 2NO2↑ + 6H2O.
В современной химии существуют лабораторные и промышленные способы получения азотной кислоты. В лабораториях кислоту получают путём нагревания смеси из нитратов и концентрированной серной кислоты:
KNO3 + H2SO4 → KHSO4 + HNO3.
В промышленности азотную кислоту получают окислением аммиака. Метод осуществляется в три этапа.
Сначала аммиак окисляют на платиновых катализаторах до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O.
Это реакция необратима.
Оксид азота (II) или монооксид окисляют до диоксида или оксида азота (IV):
2NO + O2 ↔ 2NO2.
Конечным этапом является поглощение диоксида азота водой в избытке кислорода:
4NO2 + O2 + 2H2O ↔ 4HNO3.
Все реакции протекают с выделением тепла, т.е. являются экзотермическими. Две последние реакции обратимы, поэтому итоговая концентрация чистой азотной кислоты невысока (45-58 %).
Для повышения концентрации в реакции оксида азота (IV) с водой смещают равновесие, увеличивая давление. Также разбавленную азотную кислоту могут смешивать с серной кислотой и нагревать. Азотная кислота испаряется и конденсируется.
Лабораторный метод получения азотной кислоты обнаружил немецкий алхимик Иоганн Рудольф Глаубер в XVII веке.
Применение
Азотная кислота используется:
- при производстве удобрений;
- в изготовлении взрывчатых веществ;
- в качестве окислителя ракетного топлива;
- для травления печатных форм в типографии;
- при изготовлении красок и лаков;
- в производстве лекарств;
- для определения золота в сплавах;
- для получения органических соединений.
Азотная кислота ядовита. При попадании на кожу разрушает белок, оставляя долго заживающие язвы.
Что мы узнали?
Азотную кислоту получают промышленным и лабораторным путём. В промышленности используется метод окисление аммиака, который включает три реакции. Сначала окисляется аммиак, затем оксид азота (II). Конечной реакцией является поглощение диоксида азота водой. Для повышения концентрации в обратимых реакциях повышают давление. В лабораториях кислоту получают действием серной кислоты на нитраты. Азотная кислота используется в промышленности для производства удобрений, взрывчатки, лекарств, красок.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Лиза Каренина
5/5
Оценка доклада
4
Средняя оценка: 4
Всего получено оценок: 235.
А какая ваша оценка?