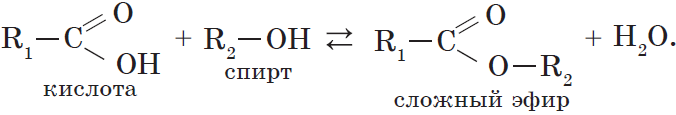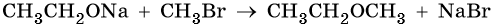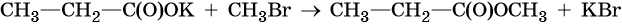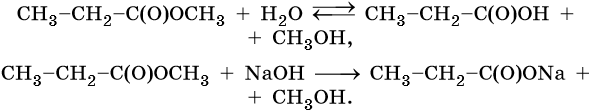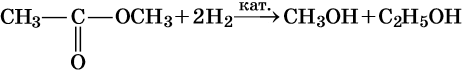Эфиры – простые и сложные
Разбор сложных заданий в тг-канале:
Сложные эфиры
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
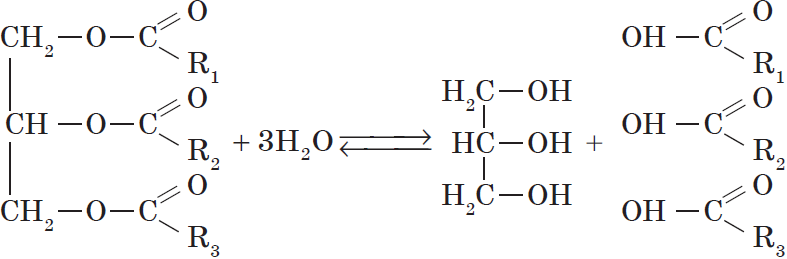
Жиры — производные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
При проведении гидролиза жира в щелочной среде $(NaOH)$ и в присутствии кальцинированной соды $Na_2CO_3$ он протекает необратимо и приводит к образованию не карбоновых кислот, а их солей, которые называются мылами. Поэтому гидролиз жиров в щелочной среде называются омылением.
Простые и сложные эфиры
Простыми эфирами называют класс химических соединений, в которых два углеводородных радикала связаны между собой атомом кислорода (кислородным мостиком). В общем виде формула простых эфиров R—O—R1, где R и R1 — углеводородные радикалы. Для этого класса соединений характерны структурная изомерия, а также межклассовая изомерия со спиртами.
Простые эфиры образуются при межмолекулярной дегидратации спиртов, а также при взаимодействии алкоголятов с галоидными алкилами, например:
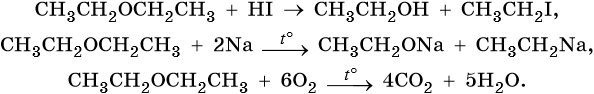
Простые эфиры химически инертны. Их характерные реакции на примере диэтилового эфира:
Пары диэтилового эфира пожаро- и взрывоопасны.
Сложными эфирами называют класс химических соединений, который отвечает общей формуле R—C(O)O—R1, где R и R1 — углеводородные радикалы. Таким образом, сложные эфиры можно рассматривать как производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал, или производные спиртов, в которых атом водорода гидроксильной группы замещен на кислотный остаток карбоновой кислоты.
Сложные эфиры образуются в результате реакции этерификации (урок 25). При этом следует отметить, что при одной и той же кислоте скорость этерификации первичных спиртов в два раза выше, чем у вторичных и во много раз превосходит третичные.
Кроме того, сложные эфиры можно получить в результате взаимодействия солей карбоновых кислот с галоидными алкилами:
Для сложных эфиров характерны изомерия углеводородных радикалов кислот и спиртов, составляющих сложный эфир, а также межклассовая изомерия с карбоновыми кислотами. Ниже приведены реакции, иллюстрирующие характерные химические свойства сложных эфиров.
1. Кислый или щелочной гидролиз:
2. Реакция переэтерификации (идет в том случае, если брать избыток спирта и отгонять образующийся более легкокипящий спирт):
3. Восстановление:
Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R’–O–R», где R’ и R» — различные или одинаковые радикалы.
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные
непредельные
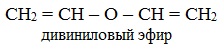
ароматические

циклические
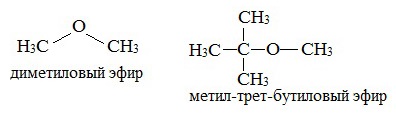
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, CH3-O-CH3 — диметиловый эфир; C2H5-O-CH3 — метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
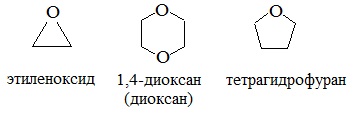
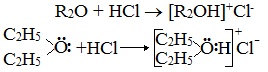
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
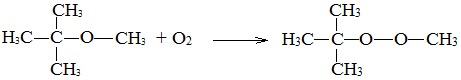
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы):
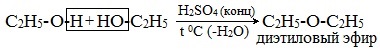
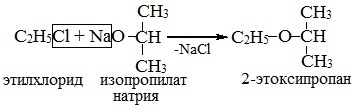
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (CH3O–):
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры)
этиленоксид (эпоксид)

диоксан
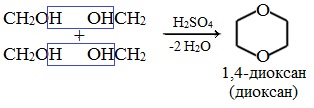
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Химические свойства фенолов
…
Некоторые способы получения простых эфиров были рассмотрены при изучении галогеналканов, алкенов, одноатомных спиртов. В данном разделе подробнее рассмотрим получение, физические и химические свойства простых эфиров .
Получение простых эфиров
- Реакция Вильямсона – взаимодействие галогенированных углеводородов с алкоголятами:
При этом способе получения используются первичные реагирующие соединения.
- Межмолекулярная дегидратация спиртов протекает под действием окиси алюминия и температуре 300°С или серной кислоты как дегидратирующего агента. В результате получают симметричные простые эфиры, например, по этому принципу получают серный эфир (диэтиловый эфир):
Его получение происходит в 2 стадии. Сначала, при взаимодействии этанола с избытком серной кислоты, получается этилсерная кислота, которая, затем реагирует с новой порцией этанола с образованием диэтилового эфира:
- Каталитическое присоединение спиртов к олефинам или алкинам:
При присоединении спиртов к алкинам образуются виниловые эфиры:
- Оксимеркурирование алкенов протекает в несколько стадий. Сначала при действии на алкены ацетата ртути в водном растворе тетрагидрофурана (ТГФ) или в водной уксусной кислоте при 20°С образуется ртутьорганические соединения. При этом присоединение ацетата ртути к алкену происходит согласно правилу Марковникова. Далее при воздействии таких растворителей как спирты, уксусная кислота, ацетонитрил и др. получаются простые эфиры:
Физические свойства
Простые эфиры — это прозрачные бесцветные жидкости, обладающие характерным «эфирным» запахом. Они являются легколетучими и пожароопасными.
Растворимость простых эфиров
Простые эфиры растворимы в протонных кислотах, что связано с основными свойствами эфирного кислорода. Этот кислород имеет две свободные электронные пары, которые не могут использоваться для проявления обычной валентности и принять электроны. Однако для осуществления связи кислород может предоставить свою электронную пару в общее пользование:
В зависимости от строения эфира, они могут иметь хорошую растворимость в воде или вовсе не растворяться (см. таблицу ниже). В большинстве органических растворителей простые эфиры хорошо растворимы.
Точки плавления и кипения простых эфиров
Простые эфиры кипят при гораздо более низких температурах, чем соответствующие спирты. Например, метиловый спирт кипит при +65°С, а метиловый эфир – при -23,7°С. Это связано с тем, что эфиры, в отличие от спиртов, лишены гидроксильного водорода и поэтому не имеют возможности образовывать водородные связи, объединяющие одну молекулу с другой. Т.е. простые эфиры не способны к ассоциации молекул.
Химические свойства простых эфиров
Простые эфиры – малореакционноспособная группа органических соединений, проявляющие слабоосновные свойства. Они могут расщепляются лишь некоторыми веществами при нагревании (концентрированной йодистоводородной кислотой или воздействием металлического натрия). Водные растворы кислот и щелочей не действуют на простые эфиры.
Под действием концентрированных йодоводородной или бромоводородной кислот:
Под действием активных металлов при повышенной температуре (Шорыгин П.П.):
Под действием серной кислоты:
- Окисление простых эфиров происходит с образованием перекисных соединений (автоокисление):
Простые эфиры при хранении легко окисляются кислородом воздуха с образованием перекисей. При использовании простых эфиров, особенно при перегонке их необходимо хорошо очистить от накопленных перекисей, которые могут стать причиной взрыва.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у
насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH.
Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы
OH — глицерины) и т.д.

Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода),
вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).

Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол,
этанол, пропанол, бутанол, пентанол и т.д.

Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с
простыми эфирами, которых мы также коснемся в данной статье.

Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором
щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.

В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.

Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных
химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.

В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).

Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения.
У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся
алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.

В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более
высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при
которых углеродный скелет подвергается деструкции.

Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой
реакции выпадает маслянистый осадок.

Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие
от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.

Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор
окрашивается в характерный синий цвет.

Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов).
Это говорит об их более выраженных кислотных свойствах.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Добавил:
Вуз:
Предмет:
Файл:
Карцова, Лёвкин Органическая химия для школьников.pdf
Скачиваний:
77
Добавлен:
16.11.2022
Размер:
29.37 Mб
Скачать
Качественной реакцией, позволяющей обнаружить фенольный гидроксил, является взаимодействие с раствором хлорида железа(III). Для незамещенного фенола, резорцина и α-нафтола наблюдается появление характерного фиолетового окрашивания, для пирокатехина и β-нафтола — зеленого окрашивания; для флороглюцина, гидрохинона, о-крезола образующийся комплекс имеет голубой цвет.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Как влияет характер заместителей в бензольном кольце на кислотные свойства фенола? Приведите примеры соответствующих реакций.
2.Известно, что фенол и алкилфенолы растворяются в водных растворах щелочей
ине способны растворяться в растворе карбоната натрия. В то же время нитро-
иполинитрофенолы растворяются не только в растворе карбоната натрия, но
игидрокарбоната натрия. Дайте объяснение этим фактам.
3.Как различить следующие соединения: гексен-1, гексин-1, гексанол-1, гексан, фенол (водный раствор)?
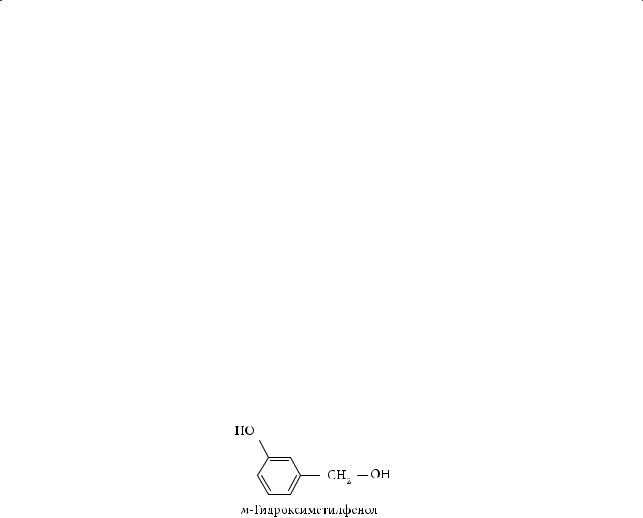
4.Как м-гидроксиметилфенол будет взаимодействовать: а) с натрием; б) гидроксидом натрия; в) бромоводородом; г) метанолом? Напишите уравнения соответствующих реакций.
5.Смесь фенола и о-крезола массой 310 г подвергли гидрированию в жестких условиях над никелевым катализатором. В результате образовалась смесь спиртов массой 328 г. Вычислите массовую долю фенола в исходной смеси.
§ 34. ПРОСТЫЕ ЭФИРЫ
Общие сведения о простых эфирах
Простыми эфирами называются органические соединения, в молекулах которых два углеводородных радикала соединены между собой атомом кислорода. Общая формула простых эфиров — R1–O–R2:
|
H3С–О–СН3 |
С2Н5–О–СН3 |
|
диметиловый |
метилэтиловый |
|
эфир |
эфир |
197
Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
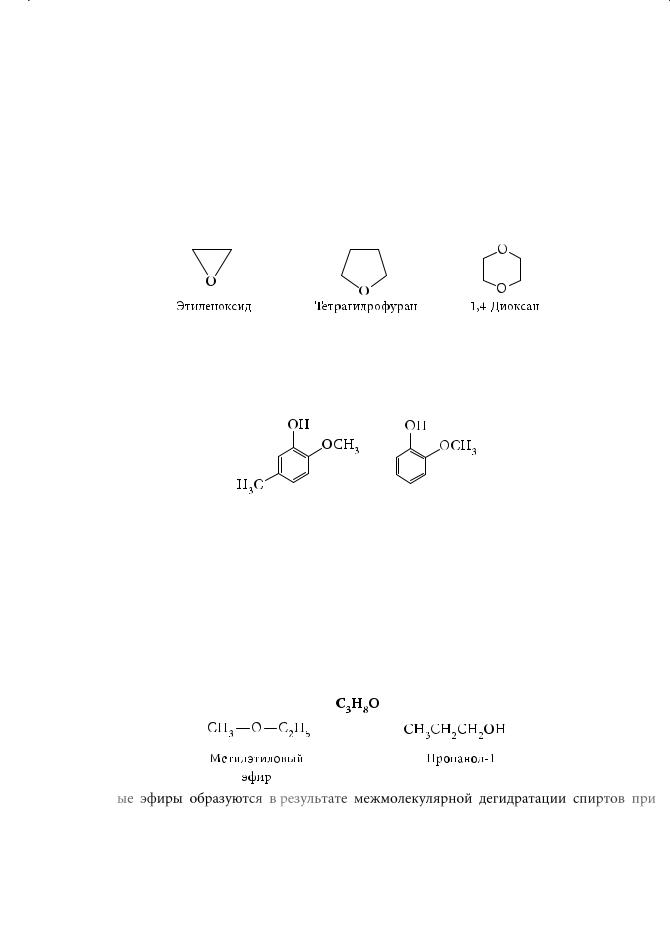
Простые эфиры могут быть подразделены на алифатические, ароматические и эфиры смешанного ряда. Особо выделяют циклические эфиры, в молекулах которых в качестве радикала выступают соединенные между собой метиленовые группы.
Циклические эфиры являются гетероциклическими (греч. heteros — чужой) соединениями. В их молекулах в составе цикла наряду с углеродными атомами имеется атом (атомы) кислорода. Важнейшими из циклических эфиров, являются этиленоксид, или оксиран, тетрагидрофуран и 1,4-диоксан:
В природе чаще всего встречаются простые эфиры фенолов. При перегонке дегтя выделяют так называемое фенольное масло, основными компонентами которого являются креозол и гваякол:
Последний был также извлечен из смолы гваякового дерева, за что и получил свое название. Было установлено, что он способен поражать туберкулезную палочку. А в гвоздичном масле и в масле мускатного ореха обнаружены изомерные эфиры, различающиеся лишь расположением двойной связи в боковой цепи ароматического кольца. Они используются в парфюмерии в качестве душистых добавок.
Простые эфиры изомерны одноатомным алифатическим спиртам, например
198
§ 34. Простые эфиры
Получение простых эфиров
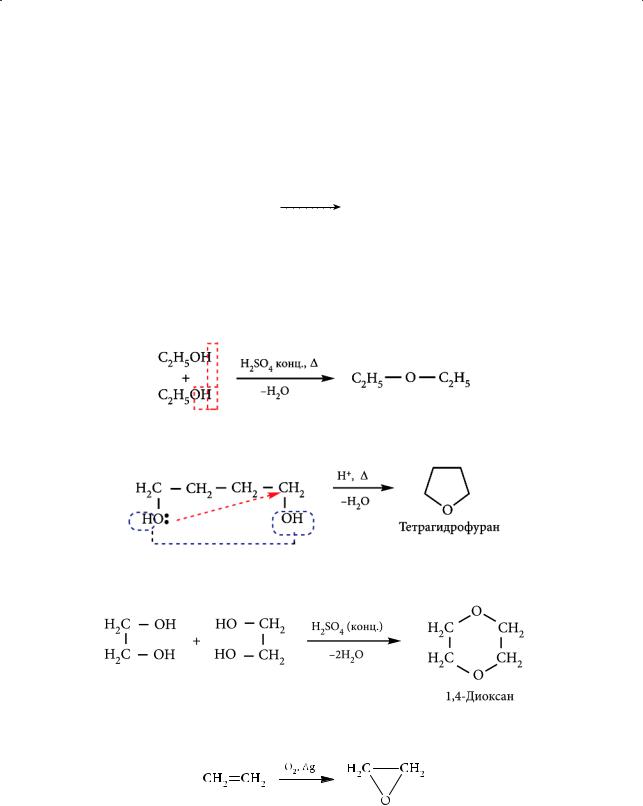
А. Главный метод синтеза простых эфиров — взаимодействие алкилгалогенидов со спиртами или с алкоголятами натрия или калия (реакция Вильямсона (Alexander William Williamson)). Из этилата натрия и метилиодида образуется метилэтиловый эфир:
СН3СН2ОNa + CH3I кипячение CH3CH2OCH3 + NaI.
Использование в реакции Вильямсона вторичных и третичных спиртов приводит к меньшим выходам простых эфиров из-за проходящей конкурентной реакции дегидрогалогенирования с образованием алкенов.
Б. Простые эфиры образуются в результате межмолекулярной дегидратации спиртов при температуре ниже 140 °С:
В этих условиях 1,4-диолы подвергаются внутримолекулярной дегидратации с образованием тетрагидрофурана и его гомологов:
Из этиленгликоля в процессе межмолекулярной дегидратации получают циклический эфир 1,4-диоксан:
3. Простой циклический эфир этиленоксид получают окислением этилена кислородом воздуха в присутствии металлического серебра:
199
Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
Физические свойства простых эфиров
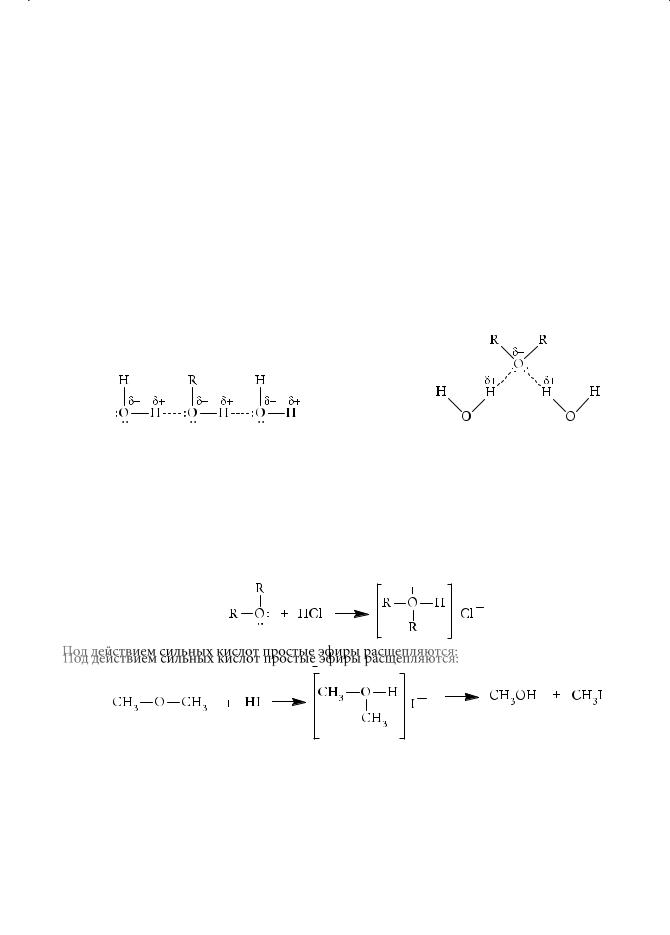
Простые эфиры существенно отличаются по физическим свойствам от изомерных спиртов. Температуры кипения эфиров значительно ниже, чем у спиртов с близкой молекулярной массой, поскольку в случае простых эфиров отсутствуют межмолекулярные водородные связи, характерные для спиртов.
Например, диметиловый эфир СН3–О–СН3 является газом, кипящим при –24,9°С, а этанол (почти с такой же молекулярной массой) — жидкостью, кипящей при +78°С. В этом отношении простые эфиры близки к предельным углеводородам: гептан С7Н16 и метилпентиловый эфир СН3–О–С5Н11, имеющие близкие значения молекулярных масс (100 и 102 соответственно), кипят примерно при одинаковой температуре (98 и 100°С). При этом растворимость в воде изомерных спиртов и эфиров различается не столь существенно, так как оба класса соединений способны образовывать водородные связи с молекулами воды:
Химические свойства простых эфиров
Простые эфиры — малореакционноспособные органические соединения. Их чаще используют в качестве среды для проведения реакции, нежели в качестве реагентов. Главной особенностью химического поведения простых эфиров является их склонность к комплексообразованию с электронодефицитными агентами с образованием оксониевых солей:
Под действием сильных кислот простые эфиры расщепляются:
Реакция также проходит через промежуточное образование оксониевых солей. Наличие акцепторных заместителей (например, атомов фтора или фенильных групп) приводит к заметному снижению оснóвных свойств простых эфиров.
200
§ 34. Простые эфиры
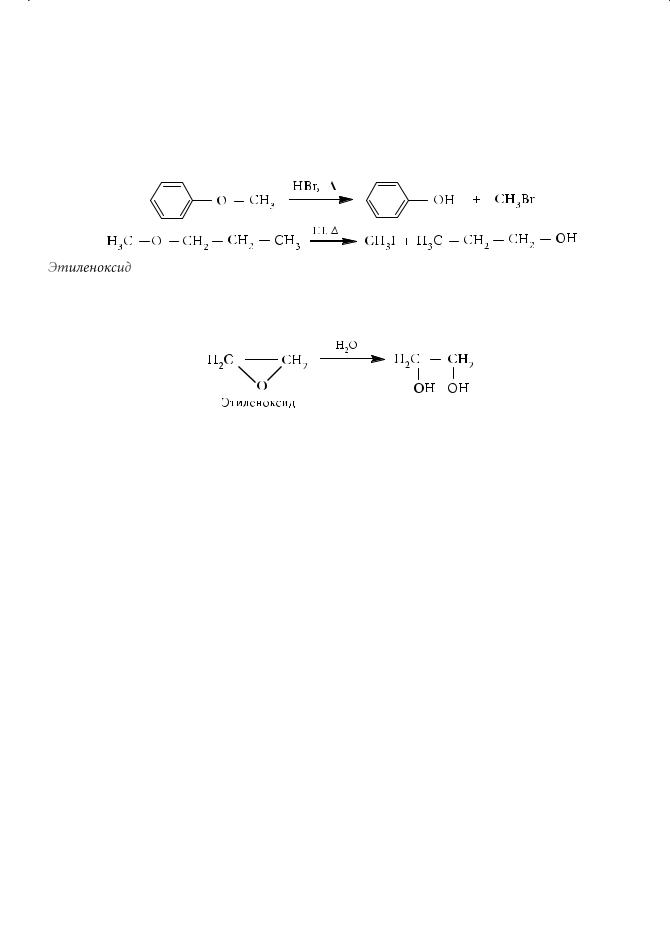
Полностью фторированные эфиры уже не образуют оксониевых солей. Устойчив к действию минеральных кислот и дифениловый эфир. Он не претерпевает расщепления, свойственного простым эфирам с алкильными заместителями. В алкилариловых эфирах — простых эфирах смешанного типа — под действием галогеноводородных кислот всегда разрывается связь О–R (R — алкильный радикал):
Этиленоксид, в отличие от обычных эфиров, является чрезвычайно реакционноспособным соединением благодаря значительному угловому напряжению трехчленного цикла. При взаимодействии этиленоксида с водой в присутствии кислоты образуется этиленгликоль:
Важнейшие представители простых эфиров
Диэтиловый эфир, С2Н5–О–С2Н5 («серный эфир»; в XVI веке его получали нагреванием этанола с концентрированной серной кислотой: ранее считалось, что образовавшийся эфир содержит серу), — при обычных условиях бесцветная, легковоспламеняющаяся жидкость с характерным сладковатым запахом и температурой кипения ниже нормальной температуры человеческого тела (+34,5 °С). Он чрезвычайно легко испаряется, отсюда и первоначальное название spiritus aetherene, что по-латыни означает «эфирный дух». Само же слово «эфир» происходит от греческого aither.
Используют его в качестве растворителя и экстрагента. Если эфир простоит значительное время на свету, то в результате процесса автоокисления в нем могут образовываться пероксиды. Диэтиловый эфир, применяемый для экстракции — извлечения органических веществ из водных растворов, — не должен содержать опасных пероксидов.
Простые виниловые эфиры СН2=СН–О–R (в отличие от винилового спирта) вполне устойчивы.
Этиленоксид — циклический простой эфир, представляющий собой бесцветный газ с температурой кипения 10,7 °С и характерным эфирным запахом, горючий, обладающий канцерогенными свойствами. Используется для полу-
201
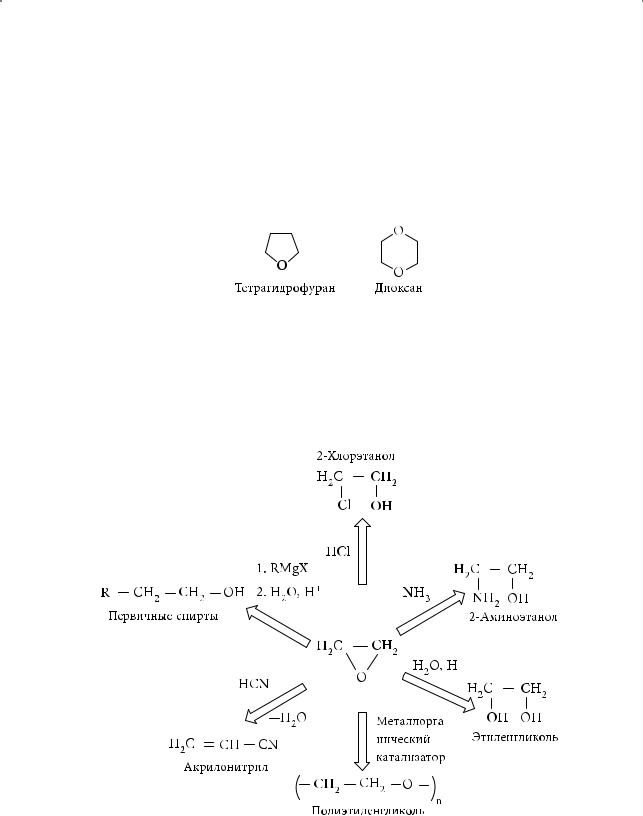
Глава 5. Галогенопроизводные углеводородов. Спирты. Фенолы
чения антифриза — этиленгликоля, также применяется в качестве добавки для стабилизации нитроцеллюлозы и нитроглицерина.
Отличительной особенностью другого простого циклического эфира — тетрагидрофурана (ТГФ) — является его склонность координироваться с катионами металлов. ТГФ — незаменимый растворитель при осуществлении многих ионных реакций. Циклический эфир 1,4-диоксан обладает уникальной для подобных соединений способностью смешиваться с водой, эфиром, бензолом, проявляя как гидрофильные, так и гидрофобные свойства:
Синтезы на основе этиленоксида
На основе этиленоксида в промышленных масштабах получают органические соединения различных классов, которые далее можно использовать в качестве растворителей, антифризов, мономеров для синтеза волокон, исходного сырья для получения лекарственных препаратов, пластмасс и т.д. Многие из перечисленных направлений синтеза на основе этиленоксида представлены на следующей схеме:
202

§ 34. Простые эфиры
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Чем объясняются низкие температуры кипения простых эфиров по сравнению со спиртами?
2.В трех неподписанных пробирках находятся бензиловый спирт (С6Н5СН2ОН),
п-крезол (СН3С6Н4ОН) и анизол (С6Н5ОСН3). К каким классам органических веществ относятся эти соединения? Как их различить, используя не более двух реактивов?
3.Какие продукты могут образоваться при нагревании смеси этанола и пропано- ла-1 с концентрированной серной кислотой. Напишите уравнения химических реакций и дайте названия образующимся продуктам.
4.Предложите метод синтеза бензилэтилового эфира (С6Н5СН2–О–С2Н5) с использованием в качестве исходных соединений бензола, этанола и любых неорганических реагентов.
5.Известно, что в результате окисления толуола сернокислым раствором перманганата калия при нагревании образуется бензойная кислота. При введении в реакционную систему незначительных количеств дибензо-18-крауна-6 реакция проходит в более мягких условиях и выход бензойной кислоты возрастает. Как вы можете это объяснить?
6.Напишите структурную формулу соединения состава С4Н10О, если известно, что оно реагирует с металлическим натрием с выделением водорода, при окислении образует альдегид, а в результате взаимодействия с концентрированной серной кислотой при нагревании образует алкен с разветвленным углеродным скелетом. Какие изомерные структуры этого соединения не удовлетворяют указанным условиям? Свой ответ аргументируйте.
7.В некотором органическом веществе массовые доли элементов углерода, водорода и кислорода составляют соответственно 78,5, 6,54 и 14,95 %. Выведите молекулярную формулу этого вещества и составьте структурные формулы четырех его изомеров, отвечающих условию задачи. Дайте им названия. Какие из этих изомеров будут реагировать с раствором хлорида железа(III)?
203
Соседние файлы в предмете Химия в школе
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
07.03.202134.24 Mб8Лидин Р.А. Справочник по общей и неорганической химии.pdf
- #