Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
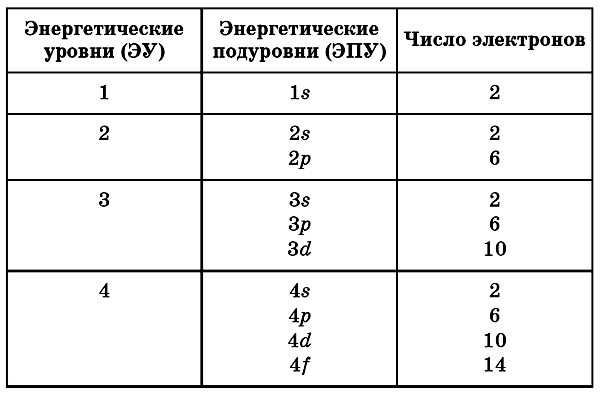
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
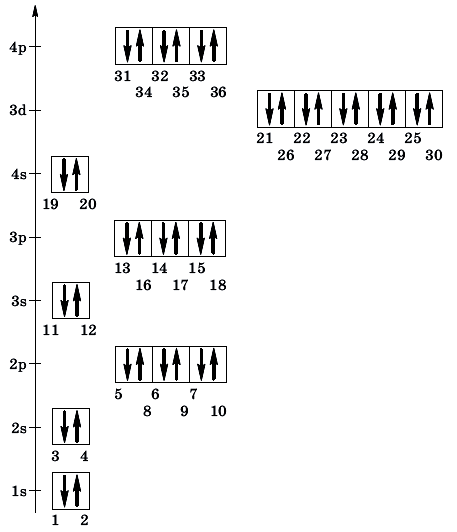
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
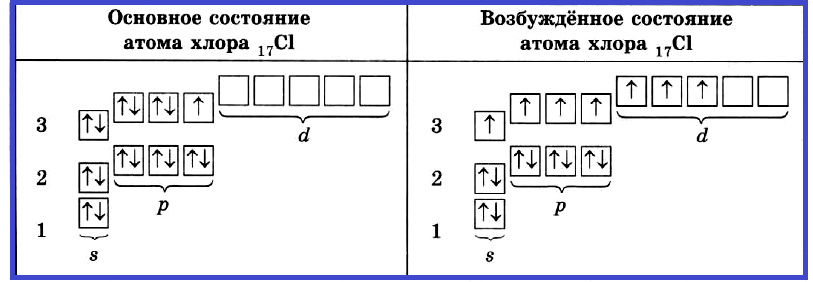
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
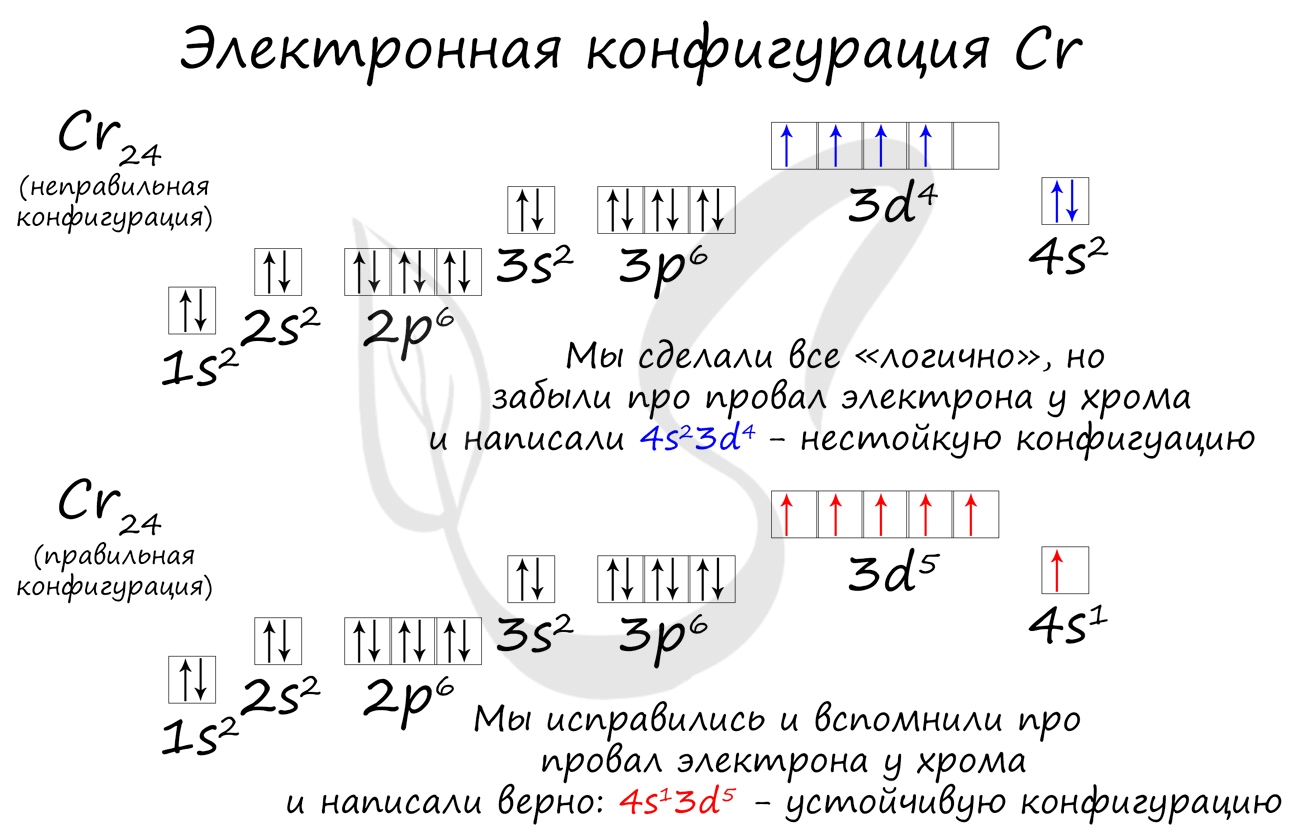
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
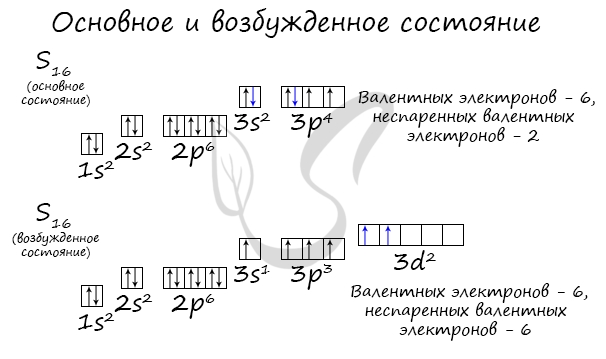
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Атом (греч: atomos – неделимый) – химически неделимая нейтральная частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Атомное ядро – состоит из нуклонов (лат. nucleus ядро ): протонов (греч. protos – первый) и нейтронов (греч. neitrum – ни то, ни другое).
Электронная оболочка – совокупность движущихся вокруг ядра отрицательно заряженных электронов.
Протон (p⁺) — частица в составе ядра, имеет положительный заряд, относительную массу 1, 0073.
Число протонов равно порядковому номеру и обозначается Z – заряд ядра.
Нейтрон (n⁰) – частица в составе ядра. Не имеет заряда. Относительная масса 1,0087.
Число нейтронов обозначается буквой N. Может меняться в атомах одного и того же элемента.
Электрон (е) – частица в составе электронной оболочки. Имеет отрицательный заряд, равный по величине, но противоположный по знаку заряду протона. Масса электрона примерно в 2000 раз меньше массы протона и практически не влияет на массу атома.
Так как атом — электронейтральная частица, то число протонов равно числу электронов
(число р⁺ = числу е):
N(e) = N(p⁺) = Z
Массовое число А (относительная атомная масса) складывается из числа протонов и нейтронов в ядре данного атома.
Число нейтронов равно разности массового числа и заряда ядра.
А = N(p⁺) + N(nº)
N(nº) = A – Z
Строение атома
Планетарная модель атома
Химический элемент – вид атомов с определѐнным зарядом ядра (количеством протонов).
Количество протонов неизменно, количество нейтронов может меняться.
Атомы с одинаковым зарядом ядра (количеством протонов), но разным числом нейтронов в ядре, т.е. разной массой, называются изотопами (нуклидами).
Один и тот же элемент может существовать в виде двух или нескольких изотопов. Все изотопы одного и того же элемента химически неотличимы.
Электронное строение атома
Электрон — уникальная элементарная частица: обладая свойствами, отличающими его от всех других частиц, он одновременно является и частицей, и волной, т.е. имеет двойственную природу.
С одной стороны, обладая малой массой, электрон проявляет свойства частицы. С другой стороны, электрон движется с такой высокой скоростью, что фактически «размазан» по атому, он находится не в одной конкретной точке, а образует «электронное облако».
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона называется электронной орбиталью.
КВАНТОВЫЕ ЧИСЛА
Состояние электрона в атоме описывается 4 квантовыми числами:
- Главное квантовое число n;
- Побочное (орбитальное) квантовое число l;
- Магнитное квантовое число ml;
- Спиновое квантовое число ms.
- ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО — n.
Главное квантовое число — n — определяет энергетический уровень электрона (равно номеру периода).
Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.
- ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО l
Определяет геометрическую форму атомной орбитали. Принимает любые целочисленные значения с l = 0 (l = n -1)
- МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО
определяет ориентацию орбитали в пространстве (ml). Принимает любые целочисленные значения от -1 до +1, включая 0.
( ml = 2l +1)
Для s-орбитали:
l=0, ml= 1(0) — одна равноценная ориентация в пространстве (одна орбиталь).
Для p-орбитали:
l=1, ml= 3 (-1,0,+1) — три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали:
l=2, ml= 5 (-2,-1,0,1,2) — пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали:
l=3, ml= 7 (-3,-2,-1,0,1,2,3) — семь равноценных ориентаций в пространстве (семь орбиталей).
- СПИНОВОЕ КВАНТОВОЕ ЧИСЛО – ms
На каждой орбитали могут максимально размещаться два электрона, обладающие равной энергией, но отличающиеся особым свойством, спином.
Графически орбиталь принято изображать в виде квадрата, а электроны — в виде стрелок, направленных вверх или вниз.
Стрелки, направленные в противоположные стороны, означают электроны с двумя противоположными спинами.
Следовательно, электроны в электронной оболочке занимают определенные
уровни (дом),
подуровни (этаж),
орбитали (квартира).
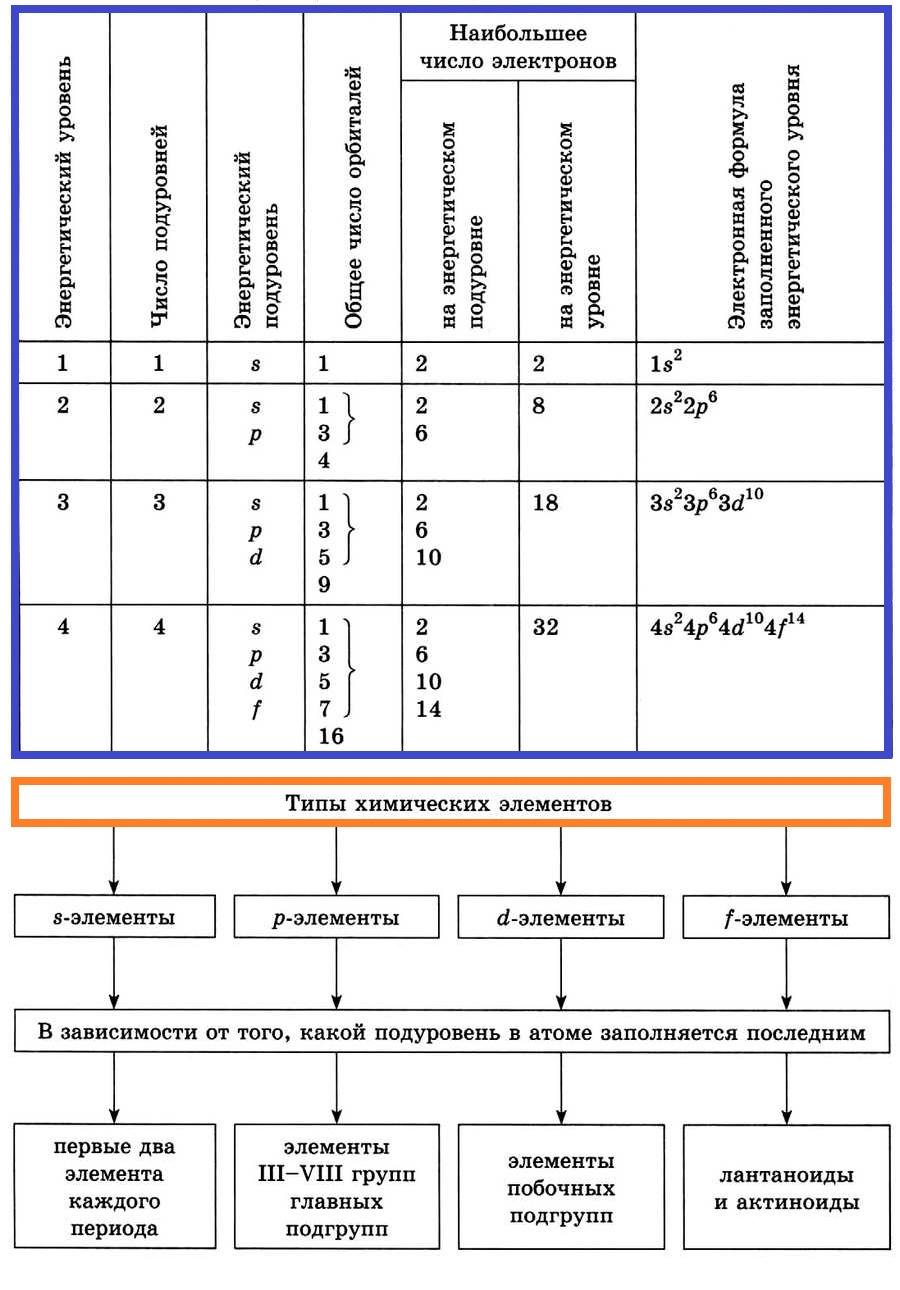
Подуровни состоят из одной или нескольких одинаковых по энергии орбиталей.
На каждой орбитали может быть не больше двух электронов.
На
s-подуровне (одна орбиталь) могут находиться два электрона,
p-подуровне (три орбитали) — шесть электронов ,
d-подуровне (пять орбиталей) — десять электронов.
Элементы, у которых последним заполняется s-подуровень, называются s –элементами, p-подуровень — p –элементами, d-подуровень — d –элементами.
ПРИНЦИПЫ ПОСТРОЕНИЯ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ ЭЛЕМЕНТА
Количество электронов в атоме элемента равно его порядковому номеру.
Количество энергетических уровней атома равно номеру периода, в котором расположен элемент.
Количество электронов на внешнем (валентном) уровне равно номеру группы, в которой расположен элемент.
При более подробном описании электронной конфигурации рассматривают не только количество электронов на данном энергетическом уровне, но и их распределение по подуровням. Каждая незаполненная орбиталь обозначается пустым квадратиком.
При заполнении орбиталей электронами используют следующие правила.
1. ПРИНЦИП МИНИМУМА ЭНЕРГИИ
Орбитали заполняются в порядке увеличения энергии, снизу вверх. Каждый электрон располагается так, чтобы его энергия была минимальной, т. е. среди свободных орбиталей он выбирает орбиталь с самой низкой энергией.
Порядок заполнения энергетических подуровней (см. рис.) можно запомнить в виде ряда:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
2. ПРИНЦИП ПАУЛИ
На каждой орбитали может находиться не более двух электронов. Если два электрона находятся на одной орбитали, то они обладают противоположными спинами (стрелки направлены в разные стороны). Такие электроны называют спаренными. Если на орбитали находится только один электрон, то его называют неспаренным.
3. ПРАВИЛО ХУНДА (ГУНДА)
Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
4s-орбиталь обладает меньшей энергией, чем 3d-орбиталь, поэтому в первую очередь электроны заполнят 4s-подуровень и лишь затем 3d-подуровень.
Для удобства запоминания порядка заполнения энергетических подуровней лучше воспользоваться следующей схемой: в каждой отдельной строке написать возможные типы орбиталей для каждого уровня, провести стрелки под углом 450 и «расселять» электроны по подуровням, ориентируясь по стрелкам сверху вниз.
ЗАПИСЬ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ АТОМА
Подробные электронные конфигурации атомов изображают двумя способами:
- графически, с помощью квадратиков со стрелками (часто называют энергетическими диаграммами);
- в строчку, когда перечисляются все занятые энергетические подуровни с указанием общего числа электронов на каждом из них.
Последовательность заполнения орбиталей и максимальное число электронов на каждом подуровне:
ПРОСКОК» ИЛИ «ПРОВАЛ» ЭЛЕКТРОНА
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома.
ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА
Все электронные конфигурации, о которых мы говорили выше, являются конфигурациями с наименьшей энергией и соответствуют основному состоянию атома.
Получив энергию извне (облучение или нагревание системы), один либо несколько электронов могут переходить на более высокий энергетический подуровень.
Состояние атома, при котором электрон из электронной пары с предыдущего подуровня «распаривается» и переходит на следующий подуровень, называется возбужденным состоянием атома.
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ
Валентность атома определяется числом неспаренных электронов.
При наличии свободных орбиталей электроны атома могут распариваться, перескакивать на на другой подуровень, т.е. атом переходит в возбужденное состояние, поэтому валентность может быть постоянной и переменной. При этом число неспаренных электронов, а, следовательно, число связей, образуемых атомом, увеличивается.
Высшая валентность всегда равна номеру группы.
Для определения низшей переменной валентности (количества свободных электронов) , которой чаще всего обладают неметаллы, необходимо из 8 вычесть номер группы.
Валентность зависит:
1. От количества электронов на внешнем уровне
2. От количества свободных неспаренных электронов
3. От наличия свободных орбиталей
Электронные формулы ионов
Ионы – заряженные частицы, они получаются из атомов путем отдачи электронов (тогда образуются катионы) или принятия электронов (образуются анионы).
Примеры:
S2- (16+2=18е)
P3+ (15-3=12е)
Na+ (11-1=10е)
Электронная формула иона получается путем добавления или вычитания электронов из электронной формулы атома ( до инертной оболочки – 8е).
1(Б) Тесты ЕГЭ ФИПИ 2015 к теме «Строение атома»
Материалы портала onx.distant.ru
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ
Периодический закон и периодическая система Д. И. Менделеева
Примеры решения задач
Задачи для самостоятельного решения
- почему водород помещают одновременно в первой и в седьмой группах периодической системы;
- почему у некоторых элементов (например, Cr и Cu) происходит «провал» внешнего s – электрона на предвнешнюю d – оболочку;
- что является основным различием в свойствах элементов главных и побочных подгрупп;
- какие электроны являются валентными для элементов главных и побочных подгрупп;
- чем обусловлено неравномерное увеличение энергии ионизации при переходе от Li к Ne;
- какое основание является более сильным: LiOH или KOH; какая кислота сильнее: HCl или HI.
В результате изучения данной темы вы научитесь:
- записывать электронные конфигурации элементов;
- устанавливать электронную структуру атома элемента по его положению в соответствующем периоде и подгруппе периодической системы, а значит, и его свойства;
- из рассмотрения электронной структуры невозбужденных атомов определять число электронов, которые могут участвовать в образовании химических связей, а также возможные степени окисления элементов;
- сравнивать относительную силу кислот и оснований.
Учебные вопросы:
1. Периодический закон Д.И. Менделеева
2. Периодическая система Д.И. Менделеева
3. Периодическая система и электронные конфигурации атомов
4. Типы химических элементов
5. Периодичность свойств атомов элементов
6. Кислотно-основные свойства соединений; схема Косселя
7. Окислительно-восстановительные свойства элементов и их соединений
1. Периодический закон Д.И. Менделеева
Периодический закон – величайшее достижение химической науки, основа всей современной химии. С его открытием химия перестала быть описательной наукой, в ней стало возможным научное предвидение.
Периодический закон открыт Д. И. Менделеевым в 1869 г. Ученый сформулировал этот закон так: «Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
Более детальное изучение строения вещества показало, что периодичность свойств элементов обусловлена не атомной массой, а электронным строением атомов.
Заряд ядра является характеристикой, определяющей электронное строение атомов, а следовательно, и свойства элементов. Поэтому в современной формулировке Периодический закон звучит так: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от порядкового номера (от величины заряда ядра их атомов).
Выражением Периодического закона является периодическая система элементов.
2. Периодическая система Д. И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра. Периоды 1, 2, 3, 4, 5, 6 содержат соответственно 2, 8, 8, 18, 18, 32 элемента. Седьмой период не завершен. Периоды 1, 2 и 3 называют малыми, остальные — большими.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородным газом (Ne, Ar, Kr, Xe, Rn), которому предшествует типичный неметалл. В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства, поскольку с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне.
В первом периоде, кроме гелия, имеется только один элемент — водород. Его условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Сходство водорода со щелочными металлами проявляется в том, что водород, как и щелочные металлы является восстановителем и, отдавая один электрон, образует однозарядный катион. Больше общего у водорода с галогенами: водород, как и галогены неметалл, его молекула двухатомна, он может проявлять окислительные свойства, образуя с активными металлами солеподобные гидриды, например, NaH, CaH2.
В четвертом периоде вслед за Са расположены 10 переходных элементов (декада Sc — Zn), за которыми находятся остальные 6 основных элементов периода (Ga — Кг). Аналогично построен пятый период. Понятие переходный элемент обычно используется для обозначения любого элемента с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположена вставная декада d–элементов (La — Hg), причем после первого переходного элемента La следуют 14 f–элементов — лантаноидов ( Се — Lu). После Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Таким образом, каждый элемент в периодической системе занимает строго определенное положение, которое отмечается порядковым, или атомным, номером.
В периодической системе по вертикали расположены восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Сходство элементов внутри каждой подгруппы — наиболее заметная и важная закономерность в периодической системе. В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические. При этом происходит увеличение устойчивости соединений элементов в низшей для данной подгруппы степени окисления. В побочных подгруппах – наоборот – сверху вниз металлические свойства ослабевают и увеличивается устойчивость соединений с высшей степенью окисления.
3. Периодическая система и электронные конфигурации атомов
Поскольку при химических реакциях ядра реагирующих атомов не изменяются, то химические свойства атомов зависят от строения их электронных оболочек.
Заполнение электронных слоев и электронных оболочек атомов происходит в соответствии с принципом Паули и правилом Хунда.
Принцип Паули (запрет Паули)
Два электрона в атоме не могут иметь четыре одинаковых квантовых числа (на каждой атомной орбитали может находиться не более двух электронов).
Принцип Паули определяет максимальное число электронов, обладающих данным главным квантовым числом n (т.е. находящихся на данном электронном слое): Nn = 2n2. На первом электронном слое (энергетическом уровне) может быть не больше 2 электронов, на втором – 8, на третьем – 18 и т. д.
В атоме водорода, например, имеется один электрон, который находится на первом энергетическом уровне в 1s – состоянии. Спин этого электрона может быть направлен произвольно (ms = +1/2 или ms = –1/2). Следует подчеркнуть еще раз, что первый энергетический уровень состоит из одного подуровня – 1s, второй энергетический уровень – из двух подуровней – 2s и 2р, третий – из трех подуровней – 3s, 3p, 3d и т.д. Подуровень, в свою очередь, содержит орбитали, число которых определяется побочным квантовым числом l и равно (2l + 1). Каждая орбиталь условно обозначается клеткой, находящийся на ней электрон – стрелкой, направление которой указывает на ориентацию спина этого электрона. Значит, состояние электрона в атоме водорода можно представить как 1s1 или изобразить в виде квантовой ячейки, рис. 1:
1s
Рис. 1. Условное обозначение электрона в атоме водорода на 1s орбитали
Для обоих электронов атома гелия n = 1, l = 0, ml = 0, ms = +1/2 и –1/2. Следовательно, электронная формула гелия 1s2. Электронная оболочка гелия завершена и очень устойчива. Гелий — благородный газ.
Согласно принципу Паули, на одной орбитали не может быть двух электронов с параллельными спинами. Третий электрон в атоме лития занимает 2s-орбиталь. Электронная конфигурация Li: 1s22s1, а у бериллия 1s22s2. Поскольку 2s-орбиталь заполнена, то пятый электрон у атома бора занимает 2р-орбиталь. При n = 2 побочное (орбитальное) квантовое число l принимает значения 0 и 1. При l = 0 (2s-состояние) ml = 0, а при l = 1 (2p – состояние) ml может быть равным +1; 0; –1. Состоянию 2р соответствуют три энергетические ячейки, рис. 2.
1s 2s
2p
Рис. 2. Расположение электронов атома бора на орбиталях
Для атома азота (электронная конфигурация 1s22s22p3 два электрона на первом уровне, пять — на втором) возможны два следующих варианта электронного строения, рис. 3:
1s 2s
2p
1s
2s
2p
а б
Рис. 3. Возможные варианты расположения электронов атома азота на орбиталях
В первой схеме, рис. 3а, суммарный спин равен 1/2 (+1/2 –1/2 +1/2), во второй (рис. 3б) суммарный спин равен 3/2 (+1/2 +1/2 +1/2).
Расположение спинов определяется правилом Хунда, которое гласит: заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным.
Таким образом, из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают различные орбитали. Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами.
Начиная с натрия, заполняется третий энергетический уровень с n = 3.
В атоме каждый электрон занимает свободную орбиталь с наиболее низкой энергией, отвечающей его наибольшей связи с ядром. В 1961 г. В.М. Клечковский сформулировал общее положение, согласно которому энергия электронных орбиталей возрастает в порядке увеличения суммы главного и побочного квантовых чисел (n + l), причем в случае равенства этих сумм, меньшей энергией обладает орбиталь с меньшим значением главного квантового числа n .
Последовательность энергетических уровней в порядке возрастания энергии примерно следующая:
1s < 2s < 2p < 3s < 3р < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p
Можно представить энергетический ряд орбиталей в виде схемы:
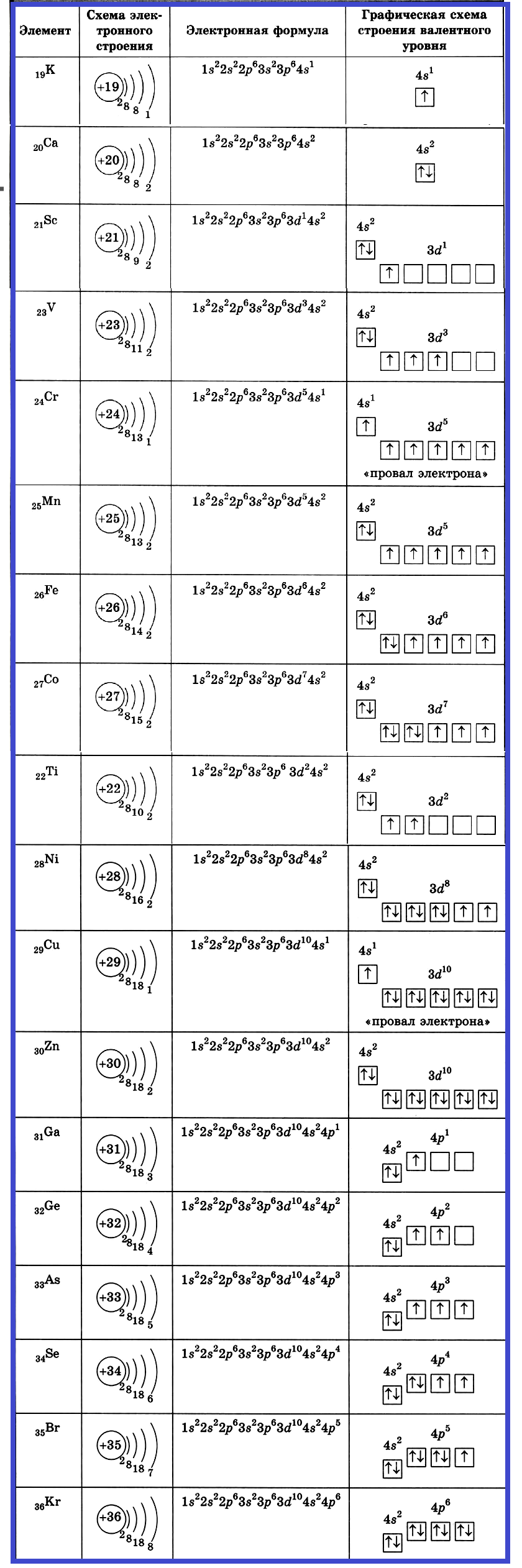
Рассмотрим распределение электронов на орбиталях атомов элементов четвертого периода. Строение атома калия:
+19K 1s22s22p63s23p64s1 1s 2s
2p
3s
3p
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s
После калия (электронная конфигурация 1s22s22p63s23p64s1) и кальция (электронная конфигурация 1s22s22p63s23p64s2) происходит заполнение электронами внутренней 3d-оболочки (переходные элементы Sc — Zn). Следует отметить существование двух аномалий: у атомов Сr и Сu на 4 s -оболочке находятся не два электрона, а один, т.е. происходит так называемый «провал» внешнего 4s-электрона на предшествующую 3d-оболочку. Электронное строение атома хрома можно представить следующим образом (рис. 4).
+24Cr [Ar]3d54s1 [Ar] 4s 3d
Рис. 4. Распределение электронов по орбиталям для атома хрома
Физическая причина «нарушения» порядка заполнения связана с различной проникающей способностью электронных орбиталей к ядру, особой устойчивостью электронных конфигураций d5 и d10, f7 и f14, отвечающих заполнению электронных орбиталей одним или двумя электронами, а также экранирующим действием внутренних электронных слоев заряда ядра.
Электронные конфигурации атомов Mn, Fe, Co, Ni, Cu и Zn отражены следующими формулами:
25Mn 1s22s22p63s23p63d54s2
26Fe 1s22s22p63s23p63d64s2
27Co 1s22s22p63s23p63d74s2
28Ni 1s22s22p63s23p63d84s2
29Cu 1s22s22p63s23p63d104s1
30Zn 1s22s22p63s23p63d104s2
После цинка, начиная с 31 элемента — галлия вплоть до 36 элемента — криптона продолжается заполнение четвертого слоя (4р – оболочки). Электронные конфигурации этих элементов имеют следующий вид:
31Ga 1s22s22p63s23p63d104s24p1
32Ge 1s22s22p63s23p63d104s24p2
33As 1s22s22p63s23p63d104s24p3
34Se 1s22s22p63s23p63d104s24p4
35Br 1s22s22p63s23p63d104s24p5,
36Kr 1s22s22p63s23p63d104s24p6
Следует отметить, что если не нарушается запрет Паули, в возбужденных состояниях электроны могут располагаться на других орбиталях атомов.
4. Типы химических элементов
Все элементы периодической системы подразделяются на четыре типа:
1. У атомов s–элементов заполняются s–оболочки внешнего слоя (n). К s–элементам относятся водород, гелий и первые два элемента каждого периода.
2. У атомов р–элементов электронами заполняются р–оболочки внешнего уровня (np). К р -элементам относятся последние 6 элементов каждого периода (кроме первого).
3. У d–элементов заполняется электронами d–оболочка второго снаружи уровня (n–1) d . Это элементы вставных декад больших периодов, расположенных между s– и p– элементами.
4. У f–элементов заполняется электронами f–подуровень третьего снаружи уровня (n–2) f . К семейству f–элементов относятся лантаноиды и актиноиды.
Из рассмотрения электронной структуры невозбужденных атомов в зависимости от порядкового номера элемента следует:
-
Число энергетических уровней (электронных слоев) атома любого элемента равно номеру периода, в котором находится элемент. Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах.
-
Номер периода совпадает с главным квантовым числом внешних электронов атома.
-
s– и p–элементы образуют главные подгруппы, d–элементы – побочные подгруппы, f–элементы образуют семейства лантаноидов и актиноидов. Таким образом, подгруппа включает элементы, атомы которых обычно имеют сходное строение не только внешнего, но и предвнешнего слоя (за исключением элементов, в которых имеет место «провал» электрона).
-
Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы. У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних оболочек. Это является основным различием в свойствах элементов главных и побочных подгрупп.
Элементы с валентными d– или f–электронами называются переходными.
Номер группы, как правило, равен высшей положительной степени окисления элементов, проявляемой ими в соединениях. Исключением является фтор – его степень окисления равна –1; из элементов VIII группы только для Os, Ru и Xe известна степень окисления +8.
5. Периодичность свойств атомов элементов
Такие характеристики атомов, как их радиус, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронным строением атома.
Различают радиусы атомов металлов и ковалентные радиусы атомов неметаллов. Радиусы атомов металлов вычисляются на основе межатомных расстояний, которые хорошо известны для большинства металлов на основе экспериментальных данных. При этом радиус атома металла равен половине расстояния между центрами двух соседних атомов. Аналогичным образом вычисляются ковалентные радиусы неметаллов в молекулах и кристаллах простых веществ. Чем больше атомный радиус, тем легче отрываются от ядра внешние электроны (и наоборот). В отличие от атомных радиусов, радиусы ионов – условные величины.
Слева направо в периодах величина атомных радиусов металлов уменьшается, а атомных радиусов неметаллов изменяется сложным образом, так как она зависит от характера химической связи. Во втором периоде, например, радиусы атомов сначала уменьшаются, а затем возрастают, особенно резко при переходе к атому благородного газа.
В главных подгруппах радиусы атомов увеличиваются сверху вниз, так как возрастает число электронных слоев.
Радиус катиона меньше радиуса соответствующего ему атома, причем с увеличением положительного заряда катиона его радиус уменьшается. Наоборот, радиус аниона всегда больше радиуса соответствующего ему атома. Изоэлектронными называют частицы (атомы и ионы), имеющие одинаковое число электронов. В ряду изоэлектронных ионов радиус снижается с уменьшением отрицательного и возрастанием положительного радиуса иона. Такое уменьшение имеет место, например в ряду: O2–, F–, Na+, Mg2+, Al3+.
Энергия ионизации– энергия, необходимая для отрыва электрона от атома, находящегося в основном состоянии. Она обычно выражается в электронвольтах (1 эВ = 96,485 кДж/моль). В периоде слева направо энергия ионизации возрастает с увеличением заряда ядра. В главных подгруппах сверху вниз она уменьшается, т. к. увеличивается расстояние электрона до ядра и возрастает экранирующее действие внутренних электронных слоев.
В таблице 1 приведены значения энергий ионизации (энергий отрыва первого, второго и т.д. электронов) для некоторых атомов.
Во втором периоде при переходе от Li к Ne энергия отрыва первого электрона возрастает (см. таблицу 1). Однако, как видно из таблицы, энергия ионизации возрастает неравномерно: у следующих за бериллием и азотом соответственно бора и кислорода наблюдается ее некоторое уменьшение, что обусловлено особенностями электронного строения атомов.
Внешняя s–оболочка бериллия полностью заполнена, поэтому у следующего за ним бора электрон поступает на р-орбиталь. Этот р-электрон менее прочно связан с ядром, чем s–электрон, поэтому отрыв р–электронов требует меньшей затраты энергии.
Таблица 1.
Энергии ионизации I атомов некоторых элементов
|
Атом |
I , эВ |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
Н Не Li Be В С N О F Ne Na Mg Al Si P S Cl Ar К Ca |
13,595 24,581 5,390 9,320 8,296 11,256 14,53 13,614 17,418 21,559 5,138 7,644 5,984 8,149 10,484 10,357 13,01 15,755 4,339 6,111 |
54,403 75,619 18,206 25,149 24,376 29,593 35,146 34,98 41,07 47,29 15,031 18,823 16,34 19,72 23,4 23,80 27,62 31,81 11,868 |
122,419 153,850 37,920 47,871 47,426 54,934 62,646 63,5 71,65 80,12 28,44 33,46 30,156 35,0 39,90 40,90 46,0 51,21 |
217,657 259,298 64,48 77,450 77,394 87,23 97,16 98,88 109,29 119,96 45,13 51,354 47,29 53,5 59,79 60,90 67,0 |
340,127 392,00 97,863 113,873 114,214 126,4 138,60 141,23 153,77 166,73 65,007 72,5 67,80 75,0 82,6 84,39 |
На каждой р-орбитали атома азота имеется по одному электрону. У атома кислорода электрон поступает на р-орбиталь, которая уже занята одним электроном. Два электрона, находящиеся на одной и той же орбитали, сильно отталкиваются, поэтому оторвать электрон от атома кислорода легче, чем от атома азота.
Наименьшее значение энергии ионизации имеют щелочные металлы, поэтому они обладают ярко выраженными металлическими свойствами, наибольшая величина энергии ионизации у инертных газов.
Сродство к электрону– энергия, выделяющаяся при присоединении электрона к нейтральному атому. Сродство к электрону, как и энергию ионизации, обычно выражают в электронвольтах. Наибольшее сродство к электрону – у галогенов, наименьшее – у щелочных металлов. В таблице 2 приведены значения сродства к электрону для атомов некоторых элементов.
Таблица 2.
Сродство к электрону атомов некоторых элементов
|
Атом |
Е, эВ |
Атом |
Е, эВ |
Атом |
Е, эВ |
Атом |
Е, эВ |
|
Н Не Li Be В |
0,754 0 0,620 0 0,28 |
С N О F Ne |
1,268 -0,07 1,46 3,398 0 |
Na Mg Al Si P |
0,546 0 0,46 1,385 0,074 |
S Cl Br I Se |
2,077 3,615 3,364 3,061 2,020 |
Электроотрицательность – способность атома в молекуле или ионе притягивать к себе валентные электроны других атомов. Электроотрицательность (ЭО) как количественная мера – приближенная величина. Предложено около 20 шкал электроотрицательностей, наибольшее признание из которых получила шкала, разработанная Л. Полингом. На рис. 5 приведены значения ЭО по Полингу.
Рис. 5. Электроотрицательность элементов (по Полингу)
Наиболее электроотрицательным из всех элементов по шкале Полинга является фтор. Его ЭО принята равной 4. Наименее электроотрицательный – цезий. Водород занимает промежуточное положение, поскольку при взаимодействии с одними элементами он отдает электрон, а при взаимодействии с другими – приобретает.
6. Кислотно-основные свойства соединений; схема Косселя
Для объяснения характера изменения кислотно-основных свойств соединений элементов Коссель (Германия) предложил использовать простую схему, основанную на предположении о том, что в молекулах существует чисто ионная связь и между ионами имеет место кулоновское взаимодействие. Схема Косселя описывает кислотно-основные свойства соединений, содержащих связи Э-Н и Э-О-Н, в зависимости от заряда ядра и радиуса образующего их элемента.
Схема Косселя для двух гидроксидов металлов, например, LiOH и KOH показана на рис. 7.
Рис. 7. Схема Косселя для LiOH и KOH
Как видно из представленной схемы, радиус иона Li+ меньше радиуса иона К+ и ОН— –группа связана прочнее с катионом лития, чем с катионом калия. В результате КОН будет легче диссоциировать в растворе и основные свойства гидроксида калия будут выражены сильнее.
Аналогичным образом можно проанализировать схему Косселя для двух оснований CuOH и Cu(OH)2. Поскольку радиус иона Cu2+ меньше, а заряд – больше, чем у иона Cu+, ОН— -группу будет прочнее удерживать ион Cu2+. В результате основание Cu(OH)2 будет более слабым, чем CuOH.
Таким образом, сила оснований возрастает при увеличении радиуса катиона и уменьшении его положительного заряда .
В главных подгруппах сверху вниз сила оснований увеличивается, поскольку в этом направлении возрастают радиусы ионов элементов. В периодах слева направо происходит уменьшение радиусов ионов элементов и увеличение их положительного заряда, поэтому в этом направлении сила оснований уменьшается.
Схема Косселя для двух бескислородных кислот, например, HCl и HI показана на рис. 8
Рис. 8. Схема Косселя для HCl и HI
Поскольку радиус хлорид-иона меньше, чем иодид-иона, ион Н+ прочнее связан с анионом в молекуле хлороводородной кислоты, которая будет слабее, чем иодоводородная кислота. Таким образом, сила бескислородных кислот возрастает с увеличением радиуса отрицательного иона .
Сила кислородсодержащих кислот изменяется противоположным образом. Она увеличивается с уменьшением радиуса иона и увеличением его положительного заряда. Рассмотрим схему Косселя для двух кислот HClO и HClO4.
| Кислота | Заряд хлора | Сила кислоты |
| HClO | +1 | Слабая кислота |
| HClO4 | +7 | Сильная кислота |
Ион Сl7+ прочно связан с ионом кислорода, поэтому протон легче будет отщепляться в молекуле НСlО4. В то же время связь иона Сl+ с ионом О2- менее прочная, и в молекуле НСlО протон будет сильнее удерживаться анионом О2-. В результате HClO4 будет более сильной кислотой, чем HClO.
Достоинством схемы Косселя является то, что она с использованием простой модели позволяет объяснить характер изменения кислотно-основных свойств соединений в ряду сходных веществ. Вместе с тем эта схема является чисто качественной. Она позволяет лишь сравнивать свойства соединений и не дает возможность определить кислотно-основные свойства произвольно выбранного одного соединения. Недостатком этой модели является то, что в ее основу положены только электростатические представления, в то время как в природе не существует чистой (стопроцентной) ионной связи.
7. Окислительно-восстановительные свойства элементов и их соединений
Изменение окислительно-восстановительных свойств простых веществ легко установить, рассматривая характер изменения электроотрицательности соответствующих элементов. В главных подгруппах сверху вниз электроотрицательность уменьшается, что приводит к уменьшению окислительных и увеличению в этом направлении восстановительных свойств. В периодах слева направо электроотрицательность возрастает. В результате в этом направлении восстановительные свойства простых веществ уменьшаются, а окислительные – возрастают. Таким образом, сильные восстановители располагаются в левом нижнем углу периодической системы элементов (калий, рубидий, цезий, барий), в то время как сильные окислители находятся в правом верхнем ее углу (кислород, фтор, хлор).
Окислительно-восстановительные свойства соединений элементов зависят от их природы, величины степени окисления элементов, положения элементов в периодической системе и ряда других факторов.
В главных подгруппах сверху вниз окислительные свойства кислородсодержащих кислот, в которых атомы центрального элемента имеют одинаковую степень окисления, уменьшаются. Сильными окислителями являются азотная и концентрированная серная кислоты. Окислительные свойства проявляются тем сильнее, чем больше положительная степень окисления элемента в соединении. Сильные окислительные свойства проявляют перманганат калия и дихромат калия.
В главных подгруппах восстановительные свойства простых анионов увеличиваются сверху вниз. Сильными восстановителями являются HI, H2S, иодиды и сульфиды.
Примеры решения задач
Пример 1. Составьте электронные формулы атомов в основном состоянии для следующих элементов: фосфор(15), кальций(20) и титан(22). В скобках указан порядковый номер элемента.
Решение. Фосфор находится в главной подгруппе пятой группы и в третьем периоде. Общее число электронов у этого атома равно 15, и они расположены на трех электронных слоях. Первые два электронных слоя атома фосфора заполнены полностью (электронная конфигурация атома Ne: 1s22s22p6 ), число электронов на третьем слое у фосфора равно номеру группы. Из этих электронов два располагаются на 3s-орбитали, а 3 – на 3р. Таким образом, электронная формула атома фосфора имеет вид:
15Р 1s22s22p63s23p3
Для составления электронной формулы атома кальция к электронной конфигурации атома Ar (1s22s22p63s23p6) необходимо добавить два электрона, которые располагаются на 4s–орбитали. В результате получаем следующую электронную формулу:
20Ca 1s22s22p63s23p64s2
Элемент титан расположен в побочной подгруппе 4 группы элементов и в четвертом периоде. Он относится к переходным элементам четвертого периода, у которых происходит заполнение 3d–оболочки, на которой находятся 2 электрона. Общее число электронов у атома титана равно 22. Для составления электронной формулы титана к электронной формуле кальция необходимо добавить два d–электрона ( 3d2 ):
22Ti 1s22s22p63s23p63d24s2
Пример 2. Определите тип (s, p, d, f) следующих элементов: марганец (25), стронций(38), церий(58) и свинец(82). В скобках указан порядковый номер элемента.
Решение. К s-элементам относятся первые два элемента — водород и гелий, а также элементы, находящиеся в главных подгруппах 1-й и 2-й групп элементов (подгруппа лития и подгруппа бериллия). Среди представленных элементов в эту категорию попадает стронций(38) . В главных подгруппах третьей-восьмой групп находятся р-элементы. В нашем случае это свинец(82) . Вставные декады элементов, образующие побочные подгруппы, относятся к типу d-элементов. Среди рассматриваемых элементов к этому типу относится марганец(25) . Наконец, находящиеся в шестом и седьмом периодах вставки из 14 элементов, следующие за лантаном(57) и актинием(89), относятся к f–элементам. Таким образом, f-элементом является церий(58) . Полученные данные представляем в виде таблицы.
|
Элемент |
Тип элемента |
|
Стронций (38) |
s |
|
Свинец (82) |
p |
|
Марганец (25) |
d |
|
Церий (58) |
f |
Пример 3. Расположите элементы в порядке увеличения их радиусов: Mg (12), Al (13), K (19), Ca (20). В скобках указан порядковый номер элемента.
Решение. Для элементов главных подгрупп радиусы атомов увеличиваются сверху вниз. В периодах же слева направо происходит уменьшение радиусов атомов. Таким образом, наименьший радиус будет иметь атом алюминия, а наибольший – атом калия. Радиус атома кальция меньше атома калия, но больше атома магния. В результате получаем следующий ряд, в котором элементы расположены в порядке увеличения радиуса: Al (13), Mg (12), Ca (20), K (19).
Пример 4. Используя схему Косселя определите, какое основание сильнее CsOH или Ba(OH)2.
Решение. Согласно схеме Косселя у более сильного основания радиус катиона должен быть больше, а заряд – меньше. В этом случае гидроксильная группа слабее удерживается катионом и легче происходит разрыв связи Э–ОН. В рассматриваемом случае радиус иона Cs+ больше, а заряд меньше чем у иона Ba2+ . Таким образом CsOH сильнее, чем Ba(OH)2 .
Пример 5. Используя схему Косселя определите, какая кислота является более сильной H2S или H2Se.
Решение. Сила бескислородных кислот увеличивается с ростом радиуса отрицательного иона, поскольку более крупному иону труднее удержать ион водорода. Поскольку радиус иона Se2– больше, чем иона S2– , H2Se сильнее, чем H2S.
Задачи для самостоятельного решения
| 1. | Составьте электронные формулы следующих элементов: магний (12), хлор (17) и железо (26). В скобках указан порядковый номер элемента.
12Mg: 1s22s22p63s2, |
||||||||||
| 2. | Определите тип (s, p, d, f) следующих элементов: галлий (31), технеций (43), европий (63) и радий (88). В скобках указан порядковый номер элемента.
|
||||||||||
| 3. | Расположите атомы элементов в порядке увеличения их радиусов: B (5), N (7), Si (14), P (15). В скобках указан порядковый номер элемента.
Радиусы атомов увеличиваются в ряду: N (7), B (5), P (15), Si (14). |
||||||||||
| 4. | Используя схему Косселя определите, какое основание сильнее Fe(OH)2 или Fe(OH)3.
Fe(OH)2 более сильное основание, чем Fe(OH)3. |
||||||||||
| 5. | Используя схему Косселя определите, какая кислота является более сильной H2SO3 или H2SeO3.
H2SO3 более сильная кислота, чем H2SeO3 |
Провал электрона. Внешние и валентные электроны
Чтобы получить доступ к бесплатным материалам, пожалуйста зарегистрируйтесь.
Извините, у Вас нет прав просматривать контент!
Регистрация
Войти
Современные представления о строении атома
Элемент ЕГЭ: 1.1 Современные представления о строении атома. 1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояние атомов.
Современные представления о строении атома
Атом – химически неделимая электронейтральная частица, которая состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Атомы не имеют заряда (нейтральны). Если атом присоединяет один или несколько электронов, он приобретает отрицательный заряд и превращается в анион. Если атом теряет один или несколько электронов, он приобретает положительный заряд и превращается в катион. Заряд иона указывают арабской цифрой и знаком после символа атома.
Состав ядра: А = Z + N, где А — массовое число; Z — протонное число (число протонов); N — число нейтронов.
Элементарные частицы
| Название | Обозначение | Масса | Заряд |
| Электрон |
ē |
≈ 0 | -1 |
| Протон |
р |
1 | +1 |
| Нейтрон |
n |
1 | 0 |
Порядковый номер элемента в периодической системе:
- Заряд ядра атома
- Число протонов в ядре атома
- Число электронов в атоме
Нуклиды – разновидности атомов с фиксированным массовым числом А, числом протонов Z и нейтронов N в ядре.
Основные положения квантовой теории строения атома:
- Дискретность энергии электрона
- Двойственная (корпускулярно-волновая) природа электрона
- Невозможность определения траектории электрона (принцип неопределенности)
Относительная атомная масса элемента (Ar)
Физическая величина, показывающая, во сколько раз средняя масса атомов данного элемента больше 1/12 части массы изотопа углерода 12С.
Атомные орбитали
Орбиталь — пространство вокруг ядра, в котором нахождение электрона наиболее вероятно (вероятность более 90%)
Порядок заполнения орбиталей в основном состоянии
1) Принцип наименьшей энергии. Электроны занимают в первую очередь орбитали, имеющие наименьшую энергию.
2) Принцип Паули. На каждой орбитали могут находиться не более двух электронов, причём спины их противоположны.
3) Правило Хунда. Орбитали заполняются электронами так, чтобы их суммарный спин был максимальным.
Спин электрона — свойство электрона, характеризующее его способность взаимодействовать с магнитным полем. Может принимать два значения (положительное и отрицательное).
Последовательность заполнения орбиталей электронами в основном состоянии:
Энергетические уровни и подуровни
Элементы, у которых идет заполнение s-подуровня, называют s-элементами.
Элементы, у которых заполняется р-подуровень, называют р-элементами.
Элементы, у которых заполняется d-подуровень, называют d-элементами.
Элементы, у которых заполняется f-подуровень, называют f-элементами.
Распределение электронов в атоме по энергетическим уровням (электронным слоям) и подуровням
Электроны, относящиеся к последнему энергетическому уровню, называют внешними (валентными) электронами.
Строение электронных оболочек атомов первых четырёх периодов
Распределение электронов по орбиталям атома называют электронной конфигурацией атома, или электронной формулой.
Строение элементов первого периода
Строение элементов второго периода
Строение элементов третьего периода
Строение элементов четвёртого периода
Электронные конфигурации d5 и d10 обладают повышенной устойчивостью, поэтому в атомах хрома и меди наблюдается «перескок» электрона с 4s-подуровня на 3d-подуровень («провал электрона»).
Основное и возбуждённое состояние атомов
Наиболее устойчивое состояние атома, в котором энергия его электронной оболочки минимальна, называется основным состоянием атома. Любые другие состояния атома называют возбужденными состояниями.
Для возможности перехода атома в возбуждённое состояние необходимо выполнение одновременно двух условий:
- наличие спаренных электронов;
- наличие вакантных орбиталей.
Таблица «Современные представления о строении атома. Кратко»
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Современные представления о строении атома». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Конспект урока в 11 классе «Основные сведения о строении атома»

![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)