Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Таблицы для ЕГЭ по химии
- 31.10.2020
Приводим таблицы, которые можно использовать на ЕГЭ по химии, эти таблицы можно использовать на ЕГЭ в любом году, входит в пакет разрешённых документов, т.е. то, чем можно пользоваться на ЕГЭ по химии.
Из года в год эти таблицы не меняются. В 2023 году поменялась только таблица растворимости — информацию обновили. Используйте ссылки ниже.
В состав документа входят:
- Таблица растворимости солей
- Таблица Менделеева
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
6 августа 2021
В закладки
Обсудить
Жалоба
ЕГЭ по химии: справочные материалы
Предложенный материал адресован абитуриентам, преподавателям химии и ученикам 8-11 классов.
Материал содержит справочные таблицы, тривиальные названия неорганических и органических соединений, краткие теоретические сведения о гидролизе, электролизе, тренажёр для повторения большого количества неорганических реакций.
spr-himiya.docx
spr-himiya.pdf
Автор: Аветисян Сатеник Вагеевна.
Таблицы ЕГЭ по химии
Ниже приведены таблицы, идентичные используемым на ЕГЭ по химии: «Периодическая система химических элементов Д.И.Менделеева»
«Растворимость солей, кислот и оснований в воде» и «Электрохимический ряд напряжений металлов»:
Таблицы ЕГЭ по химии
Ниже приведены таблицы, идентичные используемым на ЕГЭ по химии: «Периодическая система химических элементов Д.И.Менделеева»
«Растворимость солей, кислот и оснований в воде» и «Электрохимический ряд напряжений металлов»:
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодический закон звучал так: «Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы.» Периодическое изменение свойств элементов Менделеев связывал с атомной массой. Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.
Более поздние исследования показали, что свойства атомов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома.
Поэтому современная формулировка периодического закона звучит так:
«Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов«.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
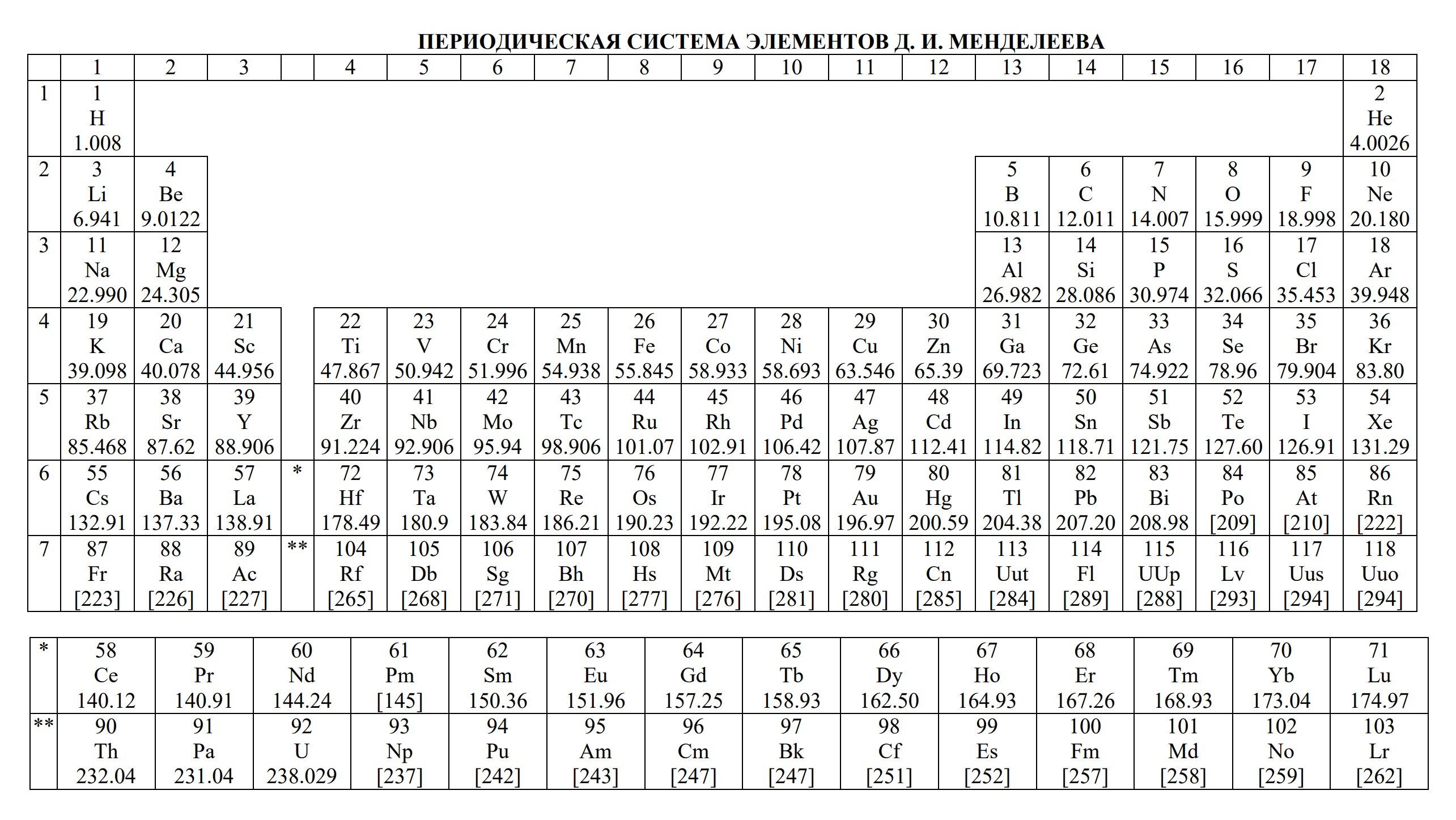
1. Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
Как следствие,
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
| Пример. Выберите три элемента малых периодов и расположите эти элементы в порядке уменьшения металлических свойств.
1) Li 2) Ca 3) Cs 4) N 5) S |
| Пример. Выберите три элемента одного периода и расположите эти элементы в порядке уменьшения неметаллических свойств.
1) Be 2) Ba 3) Mg 4) N 5) F |
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H+. Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номеру.
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Из строения атомов и электронных оболочек вытекают следующие закономерности:
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
2. Радиус атома
Рассмотрим, как меняется атомный радиус. Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
Мы говорим про орбитальный радиус изолированного атома .
Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
Например, в ряду атомов: F – Cl – Br – I количество заполненных энергетических уровней увеличивается, следовательно, орбитальный радиус также увеличивается.
Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
Например, в ряду Li – Be – B – C количество заполненных энергетических уровней, заряд ядра увеличивается, следовательно, орбитальный радиус также уменьшается.
В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.
| Пример. Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке увеличения радиуса атома
1) O 2) Se 3) F 4) S 5) Na |
|
Решение: В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S. В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142. Ответ: 142 |
| Пример. Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения радиуса атома
1) K 2) Li 3) F 4) B 5) Na |
|
Решение: В одном периоде Периодической системы находятся элементы литий Li, фтор F и натрий Na. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. Следовательно, правильный ответ: Li, B, F или 243. Ответ: 243 |
| Пример. Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения радиуса их атомов.
1) Ca 2) P 3) N 4) О 5) Ti |
|
Решение: p-элементы это фосфор Р, азот N, кислород О. В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. В группе — сверху вниз увеличивается. Следовательно, правильный ответ: P, N, O или 234. Ответ: 234 |
Рассмотрим закономерности изменения радиусов ионов: катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Например, радиус иона Na+ меньше радиуса атома натрия Na:
Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
Радиус аниона больше радиуса соответствующего атома.
Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
Например, радиус иона Cl– больше радиуса атома хлора Cl.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Например: частицы Na+ и F‒ содержат по 10 электронов. Но заряд ядра натрия +11, а у фтора только +9. Следовательно, радиус иона Na+ меньше радиуса иона F ‒.
3. Электроотрицательность
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.
По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
В главных подгруппах сверху вниз уменьшается электроотрицательность.
В периодах слева направо электроотрицательность увеличивается.
| Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности:
1) Mg 2) P 3) O 4) N 5) Ti |
|
Решение: Элементы-неметаллы – это фосфор Р, кислород О и азот N. Электроотрицательность увеличивается в группах снизу вверх и слева направо в периодах. Следовательно, правильный ответ: P, N, O или 243. Ответ: 243 |
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
1) As 2) P 3) Al 4) B 5) Na |
| Пример.Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
1) V 2) B 3) Li 4) C 5) He |
Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их
электроотрицательности.
1) Mg 2) P 3) N 4) O 5) Ti
4. Окислительные и восстановительные свойства
Химические свойства простых веществ определяются не только электроотрицательностью, но и особенностями строения (химической связью, кристаллической решеткой и др.). Поэтому лишь с некоторой степенью упрощения можно сказать, что электроотрицательность определяет окислительные и восстановительные свойства простых веществ.
Окислительные свойства — это способность принимать электроны.
В главных подгруппах сверху вниз уменьшаются окислительные свойства простых веществ.
В периодах слева направо окислительные свойства простых веществ увеличиваются.
Важно отметить, что эти закономерности работают только в некоторых рядах, чаще всего для похожих по строению веществ.
| Пример. Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания окислительных свойств соответствующих им простых веществ.
1) F 2) Al 3) Br 4) Zn 5) H |
Восстановительные свойства — это способность отдавать электроны.
В главных подгруппах сверху вниз увеличиваются восстановительные свойства простых веществ.
В периодах слева направо восстановительные свойства простых веществ уменьшаются.
А что насчет побочных подгрупп? В них расположены металлы. И как сравнивать восстановительные свойства металлов в главных подгруппах и в побочных подгруппах? Примерно сравнить восстановительные свойства простых веществ-металлов позволяет ряд активности металлов.
Слева направо восстановительные свойства металлов уменьшаются.
| Пример. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств этих металлов.
1) S 2) Na 3) Al 4) C 5) Mg |
| Пример. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств соответствующих им простых веществ. Запишите номера выбранных элементов в нужной последовательности. 1) Sn 2) K 3) B 4) C 5) Ca |
5. Сводная таблица свойств химических элементов и простых веществ
Итак, резюмируем свойства элементов и простых веществ.
Проверьте себя: как меняются по синим стрелкам следующие свойства:
| Свойство | Характер изменения |
| Металлические свойства | |
| Неметаллические свойства | |
| Окислительные свойства простых веществ | |
| Восстановительные свойства простых веществ | |
| Орбитальный радиус | |
| Электроотрицательность |
| Свойство | Характер изменения |
| Металлические свойства | увеличиваются |
| Неметаллические свойства | уменьшаются |
| Окислительные свойства простых веществ | уменьшаются |
| Восстановительные свойства простых веществ | увеличиваются |
| Орбитальный радиус | увеличивается |
| Электроотрицательность | уменьшается |
6. Кислотно-основные свойства оксидов и гидроксидов
Периодически меняются не только свойства элементов и простых веществ, но и свойства сложных соединений. Рассмотрим закономерности изменения свойств высших оксидов и гидроксидов химических элементов 3 периода.
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
|
основные свойства уменьшаются слева направо кислотные свойства увеличиваются слева направо |
||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
Легко заметить, что:
основные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
Аналогично изменяются свойства в главных подгруппах.
основные свойства высших оксидов и гидроксидов химических элементов увеличиваются сверху вниз в главных подгруппах
кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются снизу вверх в главных подгруппах
Проверьте себя: как меняются по синим стрелкам следующие свойства:
| Свойство | Характер изменения |
| Основные свойства высших оксидов | |
| Кислотные свойства высших оксидов | |
| Основные свойства высших гидроксидов | |
| Кислотные свойства высших гидроксидов |
| Свойство | Характер изменения |
| Основные свойства высших оксидов | увеличиваются |
| Кислотные свойства высших оксидов | уменьшаются |
| Основные свойства высших гидроксидов | увеличиваются |
| Кислотные свойства высших гидроксидов | уменьшаются |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых электронами заполнено одинаковое количество энергетических уровней, и расположите эти элементы в порядке уменьшения основных свойств их высших оксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 1) Li 2) N 3) Be 4) As 5) P |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых на внешнем энергетическом уровне содержится одинаковое количество электронов, и расположите эти элементы в порядке уменьшения основных свойств высших оксидов, которые образуют эти элементы.
1) Al 2) Sr 3) In 4) Tl 5) Ge |
| Пример. Из указанных в ряду химических элементов выберите три элемента, в атомах которых на внешнем энергетическом уровне содержится одинаковое количество электронов, и расположите эти элементы в порядке уменьшения основных свойств высших оксидов, которые образуют эти элементы.
1) Al 2) Sr 3) In 4) Tl 5) Ge |
| Пример.Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения кислотных свойств их высших оксидов.
1) Zn 2) C 3) Al 4) Cl 5) Ti |
7. Кислотно-основные свойства водородных соединений
Водород образует два типа бинарных соединений — солеобразные гидриды с металлами и летучие водородные соединения с неметаллами.
Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Свойства летучих водородных соединений изменяются нетипично.
Кислотные свойства водородных соединений неметаллов усиливаются от NH3 к HI
Основные свойства водородных соединений усиливаются от HI к аммиаку NH3
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке увеличения валентности в их летучих водородных соединениях.
1) Ne 2) Be 3) N 4) C 5) O |
| Пример. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке уменьшения кислотного характера их летучих водородных соединений.
1) Cl 2) Zn 3) N 4) S 5) Mg |
| Пример.Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке уменьшения кислотного характера их летучих водородных соединений.
1) Ca 2) Cl 3) Si 4) S 5) Mn |
Тренажер по теме «Периодический закон» — 10 вопросов, при каждом прохождении новые.
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением
периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов.
4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете
предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая
говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы
увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.

В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома,
соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг
атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны
«вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть
то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы,
то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена
конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен,
вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.

Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех
веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением
заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера
обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную
линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются,
вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных
кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между
молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а
HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще
запомнить 

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны).
Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает
к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий
расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе
выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на
себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации —
количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды,
ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру,
для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим,
что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене.
Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО.
Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.

Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко
найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
|
Ионы |
H+ |
NH4+ |
K+ |
Na+ |
Ag+ |
Ba2+ |
Ca2+ |
Mg2+ |
Zn2+ |
Mn2+ |
Cu2+ |
Pb2+ |
Hg2+ |
Fe2+ |
Fe3+ |
Al3+ |
|
O2– |
18 |
— |
94 |
62 |
232 |
153 |
56 |
40 |
81 |
71 |
80 |
223 |
217 |
72 |
160 |
102 |
|
OH– |
18 |
35 |
56 |
40 |
125 |
171 |
74 |
58 |
99 |
89 |
98 |
241 |
235 |
90 |
107 |
78 |
|
Cl– |
36,5 |
53,5 |
74,5 |
58,5 |
143,5 |
208 |
111 |
95 |
136 |
126 |
135 |
278 |
272 |
127 |
162,5 |
133,5 |
|
Br– |
81 |
98 |
119 |
103 |
188 |
297 |
200 |
184 |
225 |
215 |
224 |
367 |
361 |
216 |
296 |
267 |
|
I– |
128 |
145 |
166 |
150 |
235 |
391 |
294 |
278 |
319 |
309 |
318 |
461 |
455 |
310 |
437 |
408 |
|
S2– |
34 |
68 |
110 |
78 |
248 |
169 |
72 |
56 |
97 |
87 |
96 |
239 |
233 |
88 |
208 |
150 |
|
N0– 3 |
63 |
80 |
101 |
85 |
170 |
261 |
164 |
148 |
189 |
179 |
188 |
331 |
325 |
180 |
242 |
213 |
|
SO2– 3 |
82 |
116 |
158 |
126 |
296 |
217 |
120 |
104 |
145 |
135 |
144 |
287 |
281 |
136 |
352 |
294 |
|
SO2– 4 |
98 |
132 |
174 |
142 |
312 |
233 |
136 |
120 |
161 |
151 |
160 |
303 |
297 |
152 |
400 |
342 |
|
CO2– 3 |
62 |
96 |
138 |
106 |
276 |
197 |
100 |
84 |
125 |
115 |
124 |
267 |
261 |
116 |
292 |
234 |
|
SiO2– 3 |
78 |
112 |
154 |
122 |
292 |
213 |
116 |
100 |
141 |
131 |
140 |
283 |
277 |
132 |
340 |
282 |
|
PO3– 4 |
98 |
149 |
212 |
164 |
419 |
601 |
310 |
262 |
385 |
385 |
382 |
811 |
793 |
358 |
151 |
122 |
|
CH3COO– |
60 |
77 |
98 |
82 |
167 |
255 |
158 |
142 |
183 |
173 |
182 |
325 |
319 |
174 |
233 |
204 |
|
Радикалы |
-CH3 |
-C2H5 |
-C3H7 |
-C4H9 |
-CH2=CH- |
-C6H5 |
|
|
15 |
29 |
43 |
57 |
27 |
77 |
||
|
Функц. группы |
Метил |
Этил |
Пропил |
Бутил |
Винил |
Фенил |
|
|
-H |
1 |
16 |
30 |
44 |
58 |
28 |
78 |
|
-Cl |
35.5 |
50.5 |
64.5 |
78.5 |
92.5 |
62.5 |
112.5 |
|
-Br |
80 |
95 |
109 |
123 |
137 |
107 |
157 |
|
-C6H5 |
77 |
92 |
106 |
120 |
134 |
104 |
154 |
|
-OH |
17 |
32 |
46 |
60 |
74 |
– |
94 |
|
-CHO |
29 |
44 |
58 |
72 |
86 |
56 |
106 |
|
-COOH |
45 |
60 |
74 |
88 |
102 |
72 |
122 |
|
-NO2 |
46 |
61 |
75 |
89 |
103 |
73 |
123 |
|
-NH2 |
16 |
31 |
45 |
59 |
73 |
43 |
93 |
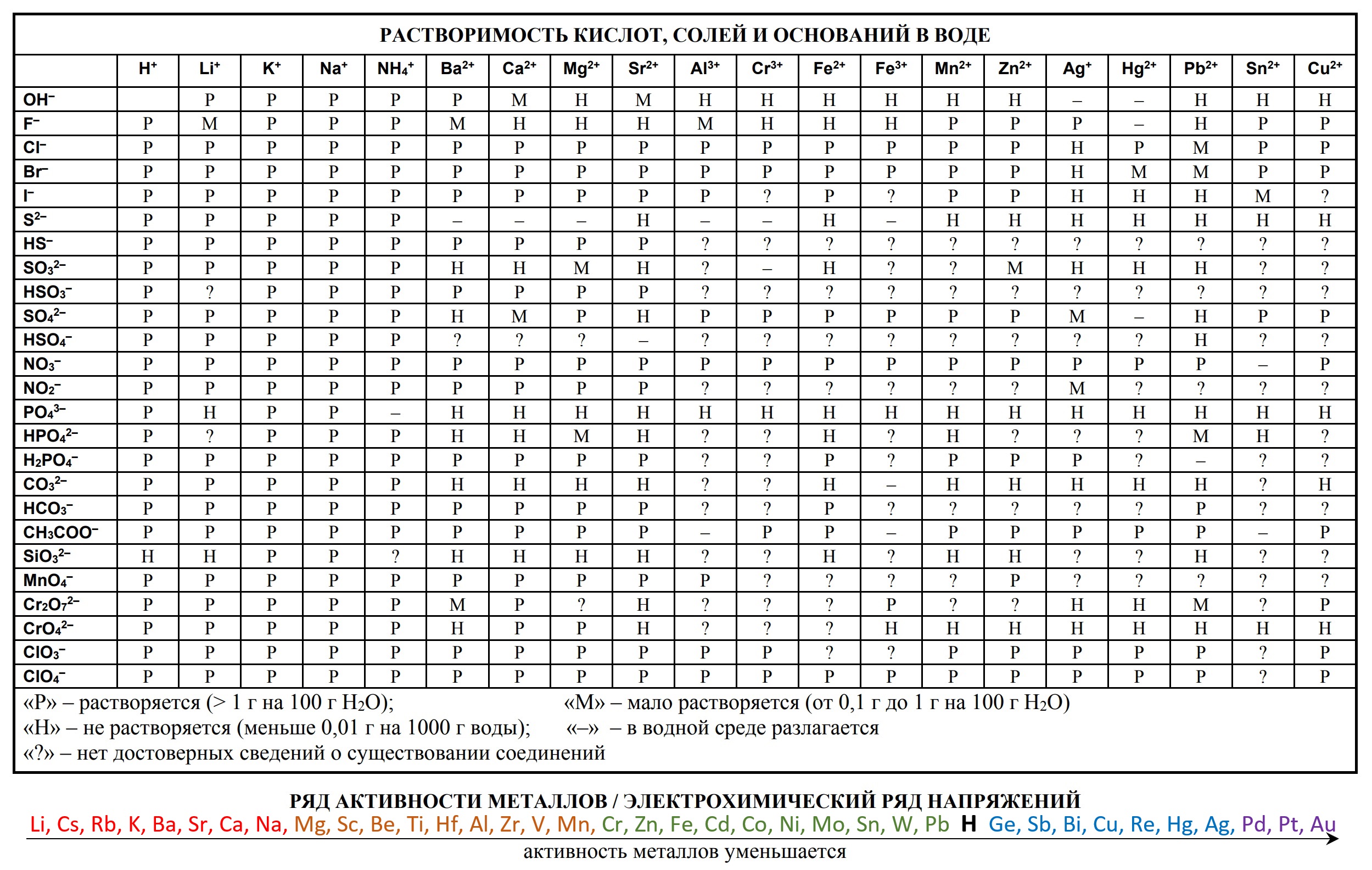
Растворимость
кислот, оснований, солей в воде, цвет осадка
|
ГИДРОЛИЗ СОЛЕЙ ПО КАТИОНУ |
||||||||||||||||||||||||||
|
КАТИОНЫ ГИДРОКСИДОВ (ОСНОВАНИЙ) |
||||||||||||||||||||||||||
|
СИЛЬНЫХ |
СЛАБЫХ |
АМФОТЕРНЫХ |
Слабоам—фотерных |
|||||||||||||||||||||||
|
ИОНЫ |
H+ |
K+ |
Na+ |
Li+ |
Ba2+ |
Ca2+ |
+ |
Mg2+ |
Fe2+ |
Ni2+ |
Mn2+ |
Ag+ |
Hg2+ |
Al3+ |
Cr3+ |
Be2+ |
Zn2+ |
Pb2+ |
Sn2+ |
Fe3+ |
Cu2+ |
|||||
|
OH– |
гидроксид |
Р |
Р |
Р |
Р |
М |
Р↑ |
Бл |
Бл |
3 |
Бл |
— |
— |
Бл |
Сз |
Бл |
Бл |
Бл |
Бл |
Бр |
С |
|||||
|
АНИОНЫ |
СИЛЬНЫХ |
NO– 3 |
нитрат |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Гд |
Р |
Р |
||
|
SO2– 4 |
сульфат |
Р |
Р |
Р |
Р |
Бл |
М |
Р |
Р |
Р |
Р |
Р |
М |
НГ |
Р |
Р |
Р |
Р |
Бл |
Р |
Р |
Р |
||||
|
I– |
иодид |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Ж |
К |
Р |
М |
Р |
Р |
Ж |
Ок |
— |
— |
||||
|
Br– |
бромид |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Бж |
М |
Р |
Р |
Р |
Р |
Бж |
Гд |
Р |
Р |
||||
|
Cl– |
хлорид |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Бл |
Р |
Р |
Р |
Р |
Р |
Бл |
Р |
Р |
Р |
||||
|
ГИДРОЛИЗ |
СЛАБЫХ |
SO2– 3 |
сульфит |
Р↑ |
Р |
Р |
Р |
Бл |
Бл |
Р |
М |
Сз |
3 |
Бл |
Бл |
— |
Гд |
Гд |
Гд |
Бл |
Бл |
— |
— |
НГ |
||
|
PO3– 4 |
ортофосфат |
Р |
Р |
Р |
Бл |
Бл |
Бл |
Р |
Бл |
Бл |
3 |
Бл |
Ж |
Бл |
Бл |
3 |
Бл |
Бл |
Бл |
Бл |
Бж |
Гл |
||||
|
CH3COO– |
ацетат |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Гд |
Р |
НГ |
Р |
Р |
Гд |
— |
Р |
||||
|
CO2– 3 |
карбонат |
Р↑ |
Р |
Р |
М |
Бл |
Бл |
Р |
Бл |
Бл |
НГ |
Бл |
Бж |
НГ |
Гд |
Гд |
НГ |
НГ |
НГ |
Гд |
Гд |
НГ |
||||
|
S2– |
сульфид |
Р↑ |
Р |
Р |
Р |
Р |
Р |
Р |
М |
Ч |
Ч |
Т |
Ч |
Ч |
Гд |
Гд |
Гд |
Бл |
Ч |
Бр |
— |
Ч |
||||
|
SiO2– 3 |
метасиликат |
Бл |
Р |
Р |
Бл |
Бл |
Бл |
— |
Бл |
Ср |
Гд |
Т |
— |
— |
Гд |
Гд |
Гд |
Рз |
Бл |
Гд |
Гд |
НГ |
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
Р — растворимые; Р↑ — летучие или распадаются с выделением газа; М
— малорастворимые; НГ— осадок основной
соли вследствие гидролиза; Гд — соль разлагается водой; черточка (—)
— вещество не существует.
Цвета осадков:
Бл — белый, Бж — бледно-желтый, Бр — бурый,
Гл — голубой,Ж — желтый, 3 — зеленый, К — красный, Ок —
оранжево-красный, Рз — розовый, С — синий, Сз — серовато-зеленый, Ср — серый,
Т — телесный, Ч — черный.
ОКРАСКА ИНДИКАТОРОВ В
РАЗЛИЧНЫХ СРЕДАХ
|
индикатор |
среда |
||
|
кислотная |
нейтральная |
щелочная |
|
|
лакмус |
красный |
фиолетовый |
синий |
|
фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
метилоранж |
красный |
оранжевый |
желтый |
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ
МЕТАЛЛОВ С КИСЛОТАМИ
|
Металлы Кислоты |
Активные |
Металлы средней |
Малоактивные металлы |
Благородные металлы |
|
|
K, Ba, Ca, Na, Mg |
Al, Fe, Cr |
Zn, |
Pb, Cu, Hg, Ag |
Au, Pt, Os, Ir |
|
|
H2SO4 конц. |
Соль + H2O + H2S ↑ 8K + 5H2SO4 = 4K2SO4 + 4H2O + H2S 4Ca + 5H2SO4 = 4CaSO4 + 4H2O + H2S |
Пассивирует металл (При нагревании Соль +H2O |
Соль +H2O + S или SO2 ↑ Zn + 2H2SO4 = ZnSO4 + 2H2O + SO2 |
Соль + H2O + SO2 ↑ 2Ag+2H2SO4(K)=Ag2SO4+SO2+2H2O Cu+2H2SO4=CuSO4+SO2+2H2O |
|
|
HNO3 конц. |
Соль + H2O + N2O или NO ↑ 4Ca + 10HNO3 = 4Ca(NO3)2 + 5H2O + N2O 8K + 10HNO3 = 8KNO3 + 5H2O + N2O |
Соль |
|||
|
HNO3 разб. |
Соль + H2O + N2O |
Соль + H2O + NO ↑ 3Zn+8HNO3=3Zn(NO3)2+4H2O+2NO 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O |
|||
|
HNO3 очень разб. |
Соль + H2O + NH3 (NH4NO3) 8K+10HNO3=8KNO3+5H2O+NH4NO3 8Na +9HNO3 =8NaNO3+3H2O+NH3 |
Соль + H2O + N2O 8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O 4Zn + 10HNO3 = 4Zn(NO3)2 + 5H2O + N2O |
Соль + H2O + NO ↑ 3Cu+8HNO3 =3Cu(NO3)2+2NO+4H2O 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O |
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД
НАПРЯЖЕНИЯ МЕТАЛЛОВ
|
ЭЛЕКТРОД |
Окислен- ная форма |
|
|||||||||||||||||||||
|
Li+ |
К+ |
Ва2+ |
Са2+ |
Na+ |
Mg2+ |
Be2+ |
Аl3+ |
Мn2+ |
Zn2+ |
Cr3+ |
Fe2+ |
Cd2+ |
Ni2+ |
Sn2+ |
Pb2+ |
Fe3+ |
2H+ |
Cu2+ |
Ag+ |
Hg2+ |
Au3+ |
||
|
Восстанов- ленная форма |
Li |
К |
Ва |
Са |
Na |
Mg |
Be |
Аl |
Мn |
Zn |
Cr |
Fe |
Cd |
Ni |
Sn |
Pb |
Fe |
H2 |
Cu |
Ag |
Hg |
Au |
|
|
|
|||||||||||||||||||||||
|
Е°, В |
-3,04 |
-2,92 |
-2,91 |
-2,87 |
-2,71 |
-2,37 |
-1,85 |
-1,66 |
-1,18 |
-0,76 |
-0,74 |
-0.45 |
-0,40 |
-0,26 |
-0,14 |
-0,13 |
-0,04 |
0,00 |
0,34 |
0,80 |
0,85 |
1,50 |
В ПЕРИОДЕ:
|
Металл IA группы |
Окраска пламени |
Металл IIА |
Окраска пламени |
|
Li |
Карминово-красная |
Be |
Нет |
|
Na |
Желтая |
Mg |
Нет |
|
K |
Фиолетовая |
Ca |
Оранжево-красная |
|
Rb |
Синевато-красная |
Sr |
Карминово-красная |
|
Cs |
Синяя |
Ba |
Желтовато-зеленая |
ОКРАСКА ПЛАМЕНИ СОЕДИНЕНИЯМИ ЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
ВЗАИМОСВЯЗЬ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
|
Металл |
Вода |
Оксид металла |
Основание |
Соль |
|
|
Неметалл |
Соль Fe+S=FeS |
— |
— |
— |
— |
|
Вода |
Щелочь + Н2 (1) 2Na + H2O=2NaOH+H2 |
— |
Щелочь (4) BaO+H2O=Ba(OH)2 |
— |
— |
|
Оксид неметалла |
— |
Кислота H2O+SO3=H2SO4 |
Соль CaO+CO2=CaCO3 |
Соль + вода 2NaOH+CO2=Na2CO3+ H2O |
— |
|
Кислота |
Соль + Н2 (2) Fe+HCl=FeCl2+H2 |
— |
Соль + вода CaO+2HCl=CaCl2+ H2O |
Соль + вода NaOH+HCl=NaCl+H2O |
Новая соль и новая BaCl2 +H2SO4=BaSO4+2HCl |
|
Соль |
Новая соль и |
Гидролиз некоторых |
— |
Новая |
Две новые BaCl2 +FeSO4=BaSO4+FeCl2 |
***
***
1.
С водой реагируют только активные металлы. Те, которые в ряду напряжения
металлов стоят до Mg.
2. С
разбавленными серной и соляной кислотой, фосфорной кислотой и некоторыми
другими кислотами реагируют только металлы, стоящие в ряду напряжения металлов
до Н2. Азотная кислота реагирует с металлами по-другому, водород
никогда не выделяется.
3.
Гидролизу не подвергаются соли, образованные сильной кислотой и сильным
основанием.
4.
С водой реагируют только оксиды тех металлов, которые образуют растворимые
основания (щелочи).
5.
Реакция протекает только, если в результате образуется нерастворимое соединение.
6.
Более сильная кислота вытесняет менее сильную из ее соли, менее летучая — более
летучую. Условие протекания реакции — образование осадка или газообразного
соединения.
7.
Условие протекания реакции — образование осадка или газообразного соединения.
8.
Более активный металл вытесняет менее активный из его соли (смотреть ряд
напряжения металлов).
ПОСЛЕДОВАТЕЛЬНОСТЬ
ЗАПОЛНЕНИЯ ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ
1S2/2S22P6/3S23P6/4S23d104P6/5S24d105P6/6S24f145d106P6/7S25f146d107P6/8S2…
СИЛЬНЫЕ И СЛАБЫЕ ЭЛЕКТРОЛИТЫ
|
Сильные |
Слабые |
|
1. Все растворимые соли. |
1. Все труднорастворимые соли. |
|
2. Неорганические кислоты: HCl, HBr, HI, HNO3,H2SO4, HClO3, НСlO4, Н2Сг2O7, НМnO4, HBrO3, HBrO4, H2SeO4, H2CrO4. |
2. Неорганические кислоты: H2S, H2SO3, HNO2, HCN, HF, H3PO4, H2ZnO2, H2CO3, HClO, HClO2, HCrO2, H2SiO3, Н3ВО3, H3PO3, H3AsO3, H3AsO4, H2Se, H2Te, H2SeO3, H2TeO3, HBrO, HIO. |
|
3. Щелочи: |
3. Амфотерные основания: Zn(OH)2, Al(OH)3,Сг(ОН)3. |
|
КОН, NaOH, Ba(OH)2, LiOH, |
4. Неамфотерные гидроксиды: Са(ОН)2, Mg(OH)2, Cu(ОН)2, Ni(OH)2. |
|
5. Органические кислоты: НСООН, СН3СООН, НООС-СООН, С6Н5ОН. |
|
|
6. NH4OH, H2O. |
|
|
Растворов солей, |
|
К(-): Меn++ne– → Мe0. Бескислородный анион (пример): A(+):S2 — 2e– → S0. Кислородсодержащий анион |
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Те Ni Sn Pb H Cu Hg Pt Au I группа II группа III группа I группа: К(-): 2Н20 + 2e– → Н2↑ +HO– Men+ + ne– → MeO II группа: К(-): {2H2O + 2e– → H2 ↑ +2HO– III группа: К(-): Меn+ + ne– → Ме0. Анион бескислородной кислоты (пример): A(+): S2- Кислородсодержащий анион А(+): 2Н2O+4e–→O2↑+4Н+. |
ОГЭ по ХИМИИ
2021 Продолжительность
3 часа (180 мин)
Максимальный
балл—40— Минимальный балл—9—К-во заданий—24
|
Вопрос |
К-во баллов |
|
|
Первая часть |
||
|
1-3, |
1балл |
|
|
4,9,10,12,17 |
2балла |
|
|
Вторая часть |
||
|
20,22 |
3 |
|
|
21,23 |
4 |
|
|
24(эксп) |
2 |
|
|
Баллы |
Оценка |
|
Меньше |
«2» |
|
9-17 |
«3» |
|
18-26 |
«4» |
|
27-34 |
«5» |
ЕГЭ по ХИМИИ 2021 Продолжительность —3,5-часа
(210 мин)Макс. балл—100 (60)-— Минимальный
балл—36 (13)—К-во заданий—35
|
Вопрос |
К-во баллов |
|
Первая часть |
|
|
1-6, |
1балл |
|
7-9, |
2 |
|
Вторая часть |
|
|
30, |
2 |
|
35 |
3 |
|
32, |
4 |
|
33 |
5 |
|
Баллы |
Оценка |
|
Меньше |
«2» |
|
36 — 55 |
«3» |
|
56-72 |
«4» |
|
73-100 |
«5» |
ТРИВИАЛЬНЫЕ НАЗВАНИЯ
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
п/п |
Тривиальное |
Химическое |
Формула |
|
1. |
Азурит |
Карбонат |
CuCO3.Cu(OH)2 |
|
2. |
Аланат |
Алюмогидрид лития |
Li[AlH4] |
|
3. |
Алебастр |
Сульфат кальция (полугидрат) |
CaSO4·2Н2О |
|
4. |
Аммонийная селитра |
Нитрат |
NH4NO3 |
|
5. |
Аммонал |
Нитрат |
NH4NO3 + Al + C |
|
6. |
Аммофос |
Гидро |
NH4H2PO4+(NH4)2HPO4 |
|
7. |
Ангидрит |
Сульфат кальция |
CaSO4 |
|
8. |
Ангидрон |
Перхлорат |
Mg(ClO4)2 |
|
9. |
Английская |
Декагидрат |
MgSO4·7Н2О |
|
10. |
Апатит |
Фосфат |
3Ca3(PO4)2.CaF2 |
|
11. |
Арсин |
Гидрид |
PH3 |
|
12. |
Баритовая селитра |
Нитрат |
Ва(NO3)2 |
|
13. |
Белая сажа |
Оксид |
SiO2 |
|
14. |
Белый графит |
Нитрид |
ВN(гекс |
|
15. |
Берлинская лазурь |
Смесь |
KFe[FeII(CN)6] |
|
16. |
Бертолетова соль |
Хлорат |
КСlO3 |
|
17. |
Болотный газ |
Метан |
СН4 |
|
18. |
Боразон |
Нитрид |
BN(куб.) |
|
19. |
Баритовая селитра |
Нитрат |
Ва(NO3)2 |
|
20. |
Баритовые белила |
Сульфат |
BaSO4 |
|
21. |
Белый графит |
Нитрид |
ВN(гекс.) |
|
22. |
Берлинская лазурь |
Смесь |
KFe[FeII(CN)6] |
|
23. |
Бертолетова соль |
Хлорат |
КСlO3 |
|
24. |
Боксит |
Дигидрат |
Аl2О3. 2H2O |
|
25. |
Болотный газ |
Метан |
СН4 |
|
26. |
Бура |
Декагидрат |
Na2B4O7·10H2О |
|
27. |
Бурый железняк |
Оксид железа (III) |
2Fe2O3.3H2O |
|
28. |
Бурый газ |
Оксид |
NO2 |
|
29. |
Ванадиевый купорос |
Гептагидрат |
VSO4·7H2O |
|
30. |
Веселящий газ |
Оксид |
N2O |
|
31. |
Водяной газ |
Оксид |
CO+H2 |
|
32. |
Гашеная известь |
Гидроксид |
Cа(ОН)2 |
|
33. |
Гипс |
Дигидрат |
CaSO4·2H2O |
|
34. |
Глауберова соль |
Декагидрат |
Na2SO4·10H2O |
|
35. |
Глина |
Оксиды |
Аl2О3 SiO2.nH2O |
|
36. |
Глинозем |
Оксид |
Аl2О3 |
|
37. |
Горный хрусталь |
Оксид |
SiO2 |
|
38. |
Горькая соль |
Гептагидрат |
MgSO4. 7H2O |
|
39. |
Гремучее серебро |
Нитрид |
Ag3N |
|
40. |
Гремучий газ |
Водород |
2H2 + O2 |
|
41. |
Двойной суперфосфат |
Дигидрофосфат |
Са(Н2РО4)2 |
|
42. |
Доломит |
Карбонаты |
СаCO3. MgCO3 |
|
43. |
Едкий барит |
Гидроксид |
Ва(ОН)2 |
|
44. |
Едкий натр |
Гидроксид |
NaOH |
|
45. |
Едкое кали |
Гидроксид |
КОН |
|
46. |
Железная окалина |
Оксиды |
Fe3O4 |
|
47. |
Железный колчедан |
Сульфид |
FeS2 |
|
48. |
Железный купорос |
Гептагидрат |
FeSO4·7H2O |
|
49. |
Желтая кровяная соль |
Гексацианоферрат |
K4[Fe(CN)6]·3Н2О |
|
50. |
Жженая магнезия |
Оксид |
MgO |
|
51. |
Жженый гипс |
Сульфат |
2CaSO4·H2O |
|
52. |
Известковая |
Нитрат |
Ca(NO3)2·H2O |
|
53. |
Известковая |
Раствор |
Ca(OH)2 |
|
54. |
Известняк |
CaCO3 |
|
|
55. |
Индийская |
Нитрат |
KNO3 |
|
56. |
Кальцинированная |
Карбонат |
Na2CO3 |
|
57. |
Кальцит |
Карбонат |
CaCO3 |
|
58. |
Каменная |
Хлорид |
NaCl |
|
59. |
Карбид |
Карбид |
CaC2 |
|
60. |
Карборунд |
Карбид |
SiC |
|
61. |
Каустик |
Гидроксид |
NaOH |
|
62. |
Кварц |
Оксид |
SiO2 |
|
63. |
Киноварь |
Сульфид |
HgS |
|
64. |
Кипелка |
Оксид |
CaО |
|
65. |
Кобальтовый |
Гептагидрат |
CoSO4·7H2O |
|
66. |
Красная |
Гексацианоферрат |
К3[Fе(СN)6] |
|
67. |
Корунд |
Оксид |
Аl2О3 |
|
68. |
Кремнезем |
Оксид |
SiO2 |
|
69. |
Криолит |
Фториды |
3NaF.AlF3 |
|
70. |
Летучая |
Гидроксид |
NH4OH |
|
71. |
Лисий |
Оксид |
NO2 |
|
72. |
Ляпис |
Нитраты |
AgNO3 |
|
73. |
Магниевая |
Нитрат |
Mg(NO3)2·H2O |
|
74. |
Магнезия |
Карбонат |
MgCO3 |
|
75. |
Малахит |
Гидроксокарбонат |
(CuОН)2CO3 |
|
76. |
Медный |
Пентагидрат |
CuSO4·5Н2О |
|
77. |
Мел, |
Карбонат |
CаCO3 |
|
78. |
Медный |
Сульфид |
Сu2S |
|
79. |
Натронная |
Нитрат |
NaNO3 |
|
80. |
Нашатырь |
Хлорид |
NH4Сl |
|
81. |
Нашатырный |
Гидроксид |
NH4ОН |
|
82. |
Негашеная |
Оксид |
CаО |
|
83. |
Никелевый |
Гептагидрат |
NiSO4·7Н2О |
|
84. |
Норвежская |
Нитрат |
Ca(NO3)2·H2O |
|
85. |
Олеум |
Р-р |
H2SO4 +SO3 |
|
86. |
Пиролюзит |
Оксид |
MnO2 |
|
87. |
Питьевая |
Гидрокарбонат |
NaHCO3 |
|
88. |
Плавиковая |
Фтороводород |
HF |
|
89. |
Поваренная |
Хлорид |
NaCl |
|
90. |
Поташ |
Карбонат |
K2CO3 |
|
91. |
Преципитат |
Дигидрат |
СаНРО4·2Н2О |
|
92. |
Пушонка |
Гидроксид |
Са(ОН)2 |
|
93. |
Рудничный |
Метан |
СН4 |
|
94. |
Свинцовый |
Хромат |
РbСrО4 |
|
95. |
Свинцовый |
Сульфат |
PbSO4 |
|
96. |
Свинцовый |
Тригидрат |
Pb(СН3СОО)2·3Н2О |
|
97. |
Сернистый |
Оксид |
SO2 |
|
98. |
Серный |
Оксид |
SO3 |
|
99. |
Силан |
Гидрид |
SiH4 |
|
100. |
Силикагель |
Гидрат |
SiO2·nH2O |
|
101. |
Сода |
Карбонат |
Na2CO3 |
|
102. |
Сода |
Гидрокарбонат |
NaHCO3 |
|
103. |
Сода |
Декагидрат |
Na2CO3·10Н2О |
|
104. |
Сода |
Гидроксид |
NaOH |
|
105. |
Сулема |
Хлорид |
HgCl2 |
|
106. |
Суперфосфат |
Гидрат |
Ca(H2PO4)2 |
|
107. |
Суперфосфат |
Дигидрофосфат |
Ca(H2PO4)2. |
|
108. |
Сусальное |
Тонкие |
пластинки |
|
109. |
Сухой |
Оксид |
СО2 |
|
110. |
Тальк |
Оксиды |
2MgO |
|
111. |
Титановые |
Оксид |
ТiO2 |
|
112. |
Угарный |
Оксид |
СО |
|
113. |
Углекислый |
Оксид |
СО2 |
|
114. |
Угольный |
Оксид |
СО2 |
|
115. |
Феррицианид |
Гексацианоферрат |
К3[Fе(СN)6] |
|
116. |
Ферроцианид |
Гексацианоферрат |
K4[Fe(CN)6] |
|
117. |
Хлорная |
Гипохлорит |
Ca(ClO)2 + CaCl2 |
|
118. |
Хлористое |
Хлорид |
FeCl2 |
|
119. |
Хлорное |
Хлорид |
FeCl3 |
|
120. |
Хромовый |
Гептагидрат |
CrSO4·7H2O |
|
121. |
Хромпик |
Бихроматы |
К2Сг2О7, |
|
122. |
Цементит |
Карбид |
Fe3C |
|
123. |
Цинковые |
Оксид |
ZnO |
|
124. |
Цинковая |
Сульфид |
ZnS |
|
125. |
Цинковый |
Гептагидрат |
ZnSO4·7H2O |
|
126. |
Циркониевые |
Оксид |
ZrO2 |
|
127. |
Чилийская |
Нитрат |
NaNO3 |
|
128. |
Ювелирная |
Пентагидрат |
Na2B4O7·5H2O |
ТРИВИАЛЬНЫЕ НАЗВАНИЯ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
Тривиальное |
Структурная формула |
Систематическое название |
|
Альдегид муравьиный, |
НСНО – |
метаналь |
|
Р-р формальдегида в н2о |
НСНО – |
формалин |
|
Альдегид уксусный |
СН3-СНО |
– этаналь |
|
Примечание: |
||
|
Аланин |
CH2–CH(NН2)–COOH |
α—аминопропионовая кислота |
|
Глицин |
H2N–CH2–COOH |
– аминоуксусная кислота |
|
Серин– |
ОН–СН2–СН(NН2)–COOH |
α-амино-β-оксипропионовая |
|
Тирозин |
ОН-С6Н4–СН2–СН(NН2)–COOH – |
β-(пара-оксифенил)-α-аминопропионовая |
|
Фенилаланин–- |
С6Н5–СН2–СН(NН2)–COOH |
α-амино |
|
Цистеин |
HS-СН2–СН(NН2)–COOH |
– |
|
ацетон |
СН3-С(О)-СН3 |
пропанон |
|
Виноградный сахар |
С6Н12О6 |
глюкоза |
|
Древесный спирт |
СН3ОН |
метанол |
|
Хлоропрен |
СН2=ССlСН=СН2 |
2-хлор-1,3-бутадиен |
|
Фенол (карболовая |
С6Н5-ОН |
– гидроксибензол |
|
Резорцин |
НО-С6Н4-ОН |
1,3-дигидроксибензол |
|
Плодовый сахар |
С6Н12О6 |
– фруктоза |
|
Пикриновая кислота |
НО-С6Н2-(NО2)3 |
2,4,6-тринитрофенол |
|
Парафины |
CnH2n+2 |
– алканы |
|
Ацетилен |
CH ≡ CH |
Этин |
|
Анилин |
|
Фениламин |
|
Бензиловый спирт |
|
|
|
Винилацетилен |
CH2 = CH — |
Бутен-1-ин-3 |
|
Дивинил |
H2C = CH — CH |
Бутадиен-1,3 |
|
Изобутан |
|
2-метилпропан |
|
Изопрен |
|
2-метилбутадиен-1,3 |
|
Крезол |
|
Метилфенол |
|
Ксилол |
|
Диметилбензол |
|
Пропилен |
CH2 = |
Пропен |
|
Стирол |
|
Винилбензол |
|
Толуол |
|
Метилбензол |
|
Хлоропрен |
|
2-хлорбутадиен-1,3 |
|
Кумол |
|
Изопропилбензол |
|
Пирогаллол |
|
1,2,3-тригидроксибензол |
|
Пирокатехин |
|
1,2-дигидроксибензол |
|
Этилен |
СH2 = CH2 |
Этен |
|
Глицерин |
|
Пропантриол |
|
Глицерат меди |
|
|
|
Нитроглицерин |
|
|
|
Этиленгликоль |
|
Этандиол |
|
Тротил* |
|
2,4,6 – тринитротолуол* |
|
Хлороформ |
СНСl3 – |
трихлорметан |
|
Фосген |
COCl2 — |
карбонил-хлорид, оксид-дихлорид углерода |
НАЗВАНИЯ
РАДИКАЛОВ, ИХ ФОРМУЛЫ
|
Название |
Структурная |
|
изопропил |
|
|
Бензил |
|
|
Винил |
H2C |
|
Фенил |
С6Н5— |
НАЗВАНИЯ
ОРГАНИЧЕСКИХ КИСЛОТ, СОЛЕЙ И ЭФИРОВ
|
Название кислоты |
Структурная формула |
Систематическое название |
Названия солей и эфиров |
|
Муравьиная кислота |
HCOOH |
Метановая |
Формиат |
|
Уксусная кислота |
CH3COOH |
Этановая |
Ацетат |
|
Пропионовая |
C2H5-COOH |
Пропановая |
Пропионат |
|
Масляная кислота |
C3H7-COOH |
Бутановая |
Бутират |
|
Валериановая |
C4H9-COOH |
Пентановая |
Валерат |
|
Капроновая |
C5H11-COOH |
Гексановая |
Капролат |
|
Щавелевая к-та |
HOOC-COOH |
Этандиовая |
Оксалат |
|
Бензойная к-та |
C6H5-COOH |
Фенилуксусная |
Бензоал |
|
Акриловая к-та |
H2C |
Пропеновая |
Акрилат |
|
Метакриловая кислота |
СН2=С(СН3)-СООН |
метилпропеновая |
|
|
Линолевая к-та |
С17H31СООН |
Линолеат |
|
|
Олеиновая |
С17H33СООН |
Олеат |
|
|
Пальмитиновая |
С15H31СООН |
Пальмитат |
|
|
Пикриновая |
|
2,4,6- |
Пикрат |
|
Стеариновая |
С17H35СООН |
Стеарат |
|
|
Фталевая |
|
1,2-бензолдикарбоновая |
Фталат |
|
Терефталевая кислота |
|
1,4-бензолдикарбоновая |
Терефталат |
|
. Изофталевая |
НООС-C6H4-COOH |
бензолдикарбоновая |
|
|
Молочная кислота |
|
2-гидроксипропановая |
Лактат |
|
Глицин |
H2N-CH2-COOH |
Аминоуксусная к-та |
Аминоацетат* |
|
Аланин |
|
2-аминопропионовая |
Аминопропиона |
ЦВЕТА НЕКОТОРЫХ ОКСИДОВ, ОСНОВАНИЙ И СОЛЕЙ
|
Белый |
Черный |
Желтый |
Бурый |
Серо(зеленый) |
Красный |
Голубой |
Розовый |
|
BaSO4 |
FeS |
AgBr |
Fe(OH)3 |
CuSiO3 |
HgI2 |
Cu(OH)2 |
Mn(OH)2 |
|
PbSO4 |
FeSiO3 |
AgI |
(CH3COO)3Fe |
Ni(OH)2 |
CuSO3 |
MnSiO3 |
|
|
Zn3(PO4)2 |
NiS |
Cr(OH)2 |
MnS |
Cr(OH)3 |
Cu2O |
MnCO3 |
|
|
AlPO4 |
CrPO4 |
FePO4 |
MnO2 |
Ni3(PO4)2 |
HgS |
||
|
ZnS |
CuS |
(CH3COO)2Sn |
NiCO3 |
Ag2CrO4 |
|||
|
H2SiO3 |
PbS |
BaCrO4 |
Fe(OH)2 |
Cu |
|||
|
Li3PO4 |
Ag2S |
Ag2CO3 |
Cr2O3 |
Fe2O3 |
|||
|
Ba3(PO4)2 |
CuO |
Ag3PO4 |
|||||
|
CaSO3 |
FeO |
PbI2 |
|||||
|
CaSO4 |
Fe3O4 |
||||||
|
(CH3COO)2Ca |
|||||||
|
CaCO3 |
|||||||
|
CaS |
|||||||
|
Mg(OH)2 |
|||||||
|
Al(OH)3 |
|||||||
|
Be(OH)2 |
|||||||
|
Pb(OH)2 |
|||||||
|
Sn(OH)2 |
|||||||
|
PbCl2 |
ЦВЕТА РАСТВОРОВ СОЛЕЙ
|
зеленый |
сине-голубой |
малиновый |
желто-бурый |
оранжевый |
лимонный |
|
Cr3+ |
Cu2+ |
MnO4− |
Fe3+ |
Cr2O7 2− |
CrO42− |
|
Fe2+ |
|||||
|
MnO42− |
Осадки
белого цвета образуют практически все нерастворимые соединения Ca, Ba, Mg, Al, Zn, Be,
Pb. Ag.
Осадки
белые, объемные
— Mg(OH)2, Zn(OH)2, Be(OH)2, Al(OH)3
Осадки белые,
мелкокристаллические — CaCO3 , ВaCO3 , MgCO3 , PbCO3, Са3(РО4)2 , Ва3(РО4)2 , Mg 3(РО4)2 ., ВaSO4,, Li3РО4, Li2SiO3, Pb SO4, ZnS
FeS, MnS, ZnS
реагируют с хлороводородом
CdS, CuS, HgS, PbS не реагируют с хлороводородом
ЦВЕТА НЕКОТОРЫХ СОЕДИНЕНИЙ
|
Соединения |
Соединения марганца |
Соединения |
Соединения |
|
Медь металлическая (красный или золотисто-красный) |
Перманганат калия, |
Оксид хрома (III), |
Хлорид серебра, |
|
|
Манганат калия, |
Оксид хрома (VI), |
Бромид серебра, |
|
Медный купорос, |
Диоксид марганца, |
Дихромат калия, |
Йодид серебра, AgI |
|
Малахит, |
|
Хромат калия, |
Фосфат серебра, |
|
Гидроксид меди (II), |
Хлорид марганца (II) |
Хромат бария |
Карбонат серебра |
|
ДРУГИЕ |
|||
|
Диоксид азота, |
(коричневая жидкость с красными парами) |
Йод, |
Сера, |
|
Красный фосфор, |
Белый фосфор, |
Оксид Fe2O3 |
Турнбулева Fe3[Fe(CN)6]2↓ |
|
Гидроксид Co(OH)2 |
Красная K3[Fe(CN)6] |
Желтая K4[Fe(CN)6] |
Берлинская Fe4[Fe(CN)6]3↓ |
Проскок электрона —
отступления от общей для большинства элементов последовательности заполнения
электронных оболочек (1s, 2s, 2p, 3s, 3p, 4s, 3d и так далее), связанные с тем,
что эти «нарушения правил» обеспечивают атомам некоторых элементов
меньшую энергию по сравнению с заполнением электронных оболочек «по
правилам». Объясняется это тем, что энергетически более
выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р3;
р6; d5; d10; f7; f14).
Поэтому в атомах нижеприведенных элементов, наблюдается заполнение d- подуровня
за счёт проскока (или провала) электрона с внешнего s- подуровня.
|
Элемент |
Электронная конфигурация |
|
|
теоретическая |
практическая |
|
|
Cu |
3d9 4s2 |
3d10 4s1 |
|
Ag |
4d9 5s2 |
4d10 5s1 |
|
Au |
5d9 6s2 |
5d10 6s1 |
|
Cr |
3d4 4s2 |
3d5 4s1 |
|
Mo |
4d45s2 |
4d5 5s1 |
ГИДРОЛИЗ
Гидролиз –
обменное взаимодействие веществ с водой, приводящее к их разложению.
Если
рассматривать соли, как продукты взаимодействия кислот и оснований, можно
выделить четыре типа солей и три случая гидролиза.
1. Соль
сильного основания (щелочи) и сильной кислоты (HCl, HClO4, HClO3,HNO3, H2SO4)
гидролизу не подвергается, среда раствора – нейтральная, рН=7.
2. Соль
сильного основания (щелочи) и слабой кислоты (HClO, HClO2,
HNO2, H2S, H2SiO3, HF,
H2CO3 включая
органические кислоты).
Гидролизуется
обратимо по аниону, среда раствора – щелочная, рН>7.
3. Соль
слабого основания (NH3∙H2O,
органические амины, нерастворимые гидроксиды металлов) и сильной кислоты
гидролизуется обратимо по катиону, среда раствора – кислая, рН<7.
4. Соль
слабого основания и слабой летучей кислоты гидролизуется обратимо по катиону и
аниону. Реакция среды зависит от относительной силы кислоты и основания, но
близка к нейтральной. Некоторые соли слабого основания и слабой летучей кислоты
(H2S, H2CO3, H2SO3)
гидролизуются по катиону и аниону необратимо с образованием соответствующей
кислоты и основания. Такие соли в таблице растворимости обозначены прочерками.
Среда раствора NaHCO3
–щелочная, рН>7, Na2HPO4– щелочная, рН>7, NaH2PO4–
кислая, рН<7
ЭЛЕКТРОЛИЗ
Электролиз –физико-химический окислительно-восстановительный
процесс, протекающий в растворах или расплавах электролитов под действием
электрического тока, заключающийся в выделении на электродах составных
частей растворённых веществ или других веществ — продуктов вторичных реакций на
электродах.
процесс на катоде K(-): катион принимает
электроны и восстанавливается
процесс на аноде A(+): анион отдает
электроны и окисляется
Электролиз
отличается от обычных окислительно-восстановительных реакций. При электролизе
полуреакции разделены в пространстве: восстановление происходит только на
катоде, а окисление – на противоположном электроде — аноде.
КАТОДНЫЕ
И АНОДНЫЕ ПРОЦЕССЫ
|
Li K Ca Na Mg Al |
Mn Zn Fe Ni Sn Pb |
Cu Hg Ag Pt Au |
|
Me+ne¯≠ 2H2O+2e¯=H2+2OH− |
Me+n+ne¯=Me0 2H2O+2e¯=H2+2OH− |
Me+n+ne¯=Me0 |
|
На катоде |
На в зависимости от |
На катоде |
|
Анод |
Кислотный остаток |
||
|
Бескислородный Cl−,Br−,I−,S2− |
Кислородсодержащий NO3−,SO42−,PO43−,F− |
||
|
на аноде окисляются |
на аноде окисляются |
||
|
нерастворимый |
Окисление аниона Ac m−−me¯=Ac0 |
В щелочной среде: 4OH−–4e¯→2H2O+O2 В кислой, нейтральной 2H2O–4e¯→4H++O2 |
|
|
растворимый |
Окисление металла |
ПОЛУЧЕНИЕ
НЕКОТОРЫХ МЕТАЛЛОВ ЭЛЕКТРОЛИЗОМ
Cu – раствор CuSO4, Cr – раствор CrSO4, Fe – раствор FeCl2, Ca – расплав CaCl2
Щелочные
и щелочноземельные металлы – расплав солей (чаще всего хлоридов).
НЕОРГАНИЧЕСКАЯ ХИМИЯ – ТРЕНАЖЕР
РЕАКЦИЙ (тестовый вариант)
1)
KMnO4 + HCl = … + …. + H2O + ….
2) Mg + HNO3(оч.разб.) = ….. + NH4NO3
+ ….
3) FeCl2 + HNO3(конц.) = Fe(NO3)3
+ HCl + …. + ….
4)
KI + H2SO4(конц.) = I2 + H2S
+ KHSO4 + …..
5) Cu + FeCl3 =
…+ ….
6) 3NO2 +
H2O = NO + …
7) I2 + K2SO3
+ KOH = … + K2SO4 + …

H2O = HCl + …
9) P +
HNO3 + H2O = H3PO4 + …
10) Fe2(SO4)3
+ KI = FeSO4 + …. + ….
11) I2 + HNO3(конц.) = HIO3 +
… + ….
12) Mg + H2SO4(конц.) = …+ … + H2O
13) HCOH
+ KMnO4 + H2SO4 = CO2 + …+ …. + …
14) HCl + K2Cr2O7
=…+ …. + …+ H2O
15) K2Cr2O7
+ Na2SO3 + H2O = Cr(OH)3 + ….+ KOH
16) NaNO2 + Na2Cr2O7
+ HNO3 = … + …. + 4H2O
17) FeS + HNO3(конц.) = Fe(NO3)3
+ H2SO4 + … + …
18) KNO2 + K2Cr2O7
+ HNO3 = …. + …… + H2O
19) P2O3
+ HNO3 + H2O = ….+ NO
20) SO2 + K2Cr2O7
+ H2SO4 = …+ …. + H2O
21) Si + 2KOH + H2O
= …. + … (to)
22) I2
+ Cl2 + H2O = HIO3 + HCl
23) H2S + Cl2
+ H2O = … + ….
24) FeCl3 + Na2S
= FeS + S + …
25) C + Ca3(PO4)2
+ SiO2 = … + …. + ..(to)
26) HBr + K2Cr2O7
= ….+ …. + H2O + KBr
27) Cr2(SO4)3
+ H2O2 + NaOH = Na2CrO4 + …+…
28) H2O2
+ KMnO4 + H2SO4 = O2 + MnSO4 +
… + ….
29) P4 + HNO3
= …+ …. + H2O
30)
NH3 + KMnO4(тв.) = N2 +
MnO2 + KOH + ….(to)
31)
Cl2
+KOH (хол)= KCl +… +H2O
32)
Cl2
+ KOH (гор)= KCl +… +H2O (для Br2, I2 тоже)
33) S +KOH = K2S + … + H2O
34) Si +NaOH + H2O
= … +H2
35) KMnO4
+ MnSO4 + H2O = … + K2SO4 + …
36) KMnO4
+ HCl = … + … + H2O + KCl
37) NaNO2
+ KMnO4 + H2SO4 = … + … + K2SO4
+ H2O
38) FeSO4
+ KMnO4 + H2SO4 = … + …+ K2SO4
+ H2O
39) KMnO4
+ H2S + …= … + MnSO4 + K2SO4 + H2O
40) KMnO4
+ Na2SO3 + H2SO4 = …+ …+ Na2SO4
+ H2O
41) SO2
+ KMnO4 + … = … + K2MnO4 + H2O
42) K2Cr2O7
+ H2S + H2SO4 = … + S + …+ H2O
43) K2Cr2O7
+ NaNO2 + H2SO4 = … + Cr2(SO4)3
+ …+ H2O
44) K2Cr2O7
+ KI + H2SO4 = … + … + K2SO4 + H2O
45) Mg + HNO3(оч.разб.) = …
+ … + H2O
46) Cr2(SO4)3
+ Br2 + NaOH = …+ Na2CrO4 + … + H2O
47) Al2S3
+ HNO3(конц.) = …
+ H2SO4 + … + H2O
48) FeSO4
+ HNO3 + H2SO4 = … + NO + H2O
49) FeCl2
+ HNO3(конц.) = …
+ HCl + …↑ + H2O
50) AlP +
HNO3(конц.) = H3PO4
+ …↑ + … +
H2O
51) FeSO4
+ KClO3 + H2SO4 = … + KCl + H2O
52) MnSO4
+ KClO3 + KOH = K2MnO4 + … + K2SO4
+ …
53) Al + K2Cr2O7
+ H2SO4 = … + Cr2(SO4)3
+ …+ H2O
54) P2O3
+ HClO3 + H2O = … + HCl
55) Cr2(SO4)3
+ KMnO4 + KOH = K2CrO4 + …+ K2SO4
+ …
56) Cr2O3
+ KNO3 + KOH = K2CrO4 + …+ H2O
57) NaNO2
+ NaI + H2SO4 = … ↑+ I2 + … + H2O
58) KI + H2SO4(конц.) = I2
+ …↑ +
KHSO4 + H2O
59) Cu +
FeCl3 = CuCl2 +…
60) PH3
+ HClO3 = … + HCl
61) NO2 +
H2O = …↑ + HNO3
62) I2
+ K2SO3 + KOH = KI + …+ H2O
63) NH3
+ KClO = N2 + … + …
64) P +
HClO3 + H2O = … + H3PO4
65) P +
HNO3 + H2O = …+ …↑
66) Ca(ClO)2
+ HCl = … + …↑ + H2O
67) H2S
+ HClO3 = S + … + H2O
68) Fe2(SO4)3
+ KI = FeSO4 + I2 + …↓
69) KMnO4
+ KI + H2O = …↓ + KIO3
+ …
70) I2
+ HNO3(конц.) = HIO3
+ …↑ + H2O
71) As2S3
+ HNO3 + H2O = H3AsO4 + …↑ + H2SO4
72) Mg + H2SO4(конц.) =
MgSO4 + …↑+ H2O
73) MnO2
+ KBr + H2SO4 = … + Br2 + … + H2O
74)
HCOH + KMnO4 + H2SO4
= …↑+ K2SO4
+ … + H2O
75) KNO2
+ KMnO4 + H2O = KNO3 + …↓ + KOH
76) NaClO
+ KI + H2SO4 = …↓+ NaCl + … + H2O
77)
KNO3 + KI + H2SO4
= NO + …↓ + K2SO4
+ …
78) HCl +
K2Cr2O7 = …↑ + CrCl3 + …+ H2O
79) Cr(OH)3
+ Cl2 + KOH = K2CrO4 + …+ H2O
80) K2MnO4
+ HCl = MnCl2 + …↑+ KCl
+ …
81) K2Cr2O7
+ Na2SO3 + H2O = Cr(OH)3 + … + KOH
82) KMnO4
+ KBr + H2SO4 = …+ Br2 + K2SO4
+ …
83) Zn +
KNO3 + KOH = …↑ + K2ZnO2
+ H2O
84) Fe(OH)3
+ Br2 + KOH = K2FeO4 + … + H2O
85) P2O3
+ KOH + NO2 = …↑ + K3PO4
+ …
86) KMnO4
+ NH3 = MnO2 + …↑ + KOH + …
87) Na2SO3
+ KMnO4 + H2O = Na2SO4 + …↓ + KOH
88) NaNO2
+ Na2Cr2O7 + HNO3 = …+ Cr(NO3)3
+ …
89) B +
HNO3(конц.) +
HF = NO + HBF4 + …
90) CuCl2
+ SO2 + H2O =… + HCl + H2SO4
91) PH3
+ AgNO3 + H2O = …↓ + H3PO4 + HNO3
92) NH3
+ KMnO4 + KOH = …↑ + K2MnO4
+ …
93) Zn +
KMnO4 + H2SO4 = ZnSO4 + MnSO4
+ … + …
94) KNO2
+ K2Cr2O7 + HNO3 = …+ Cr(NO3)3
+ …
95) FeS +
HNO3(конц.) =
Fe(NO3)3 + H2SO4 + …+ …
96) KIO3
+ KI + H2SO4 = …↓ + K2SO4 + …
97) NaCrO2
+ Br2 + NaOH = Na2CrO4 + … + H2O
98) Fe2(SO4)3
+ Na2SO3 + H2O = … + Na2SO4
+ H2SO4
99) P2O3+
H2Cr2O7 + H2O = … + CrPO4
100)
Si + HNO3 + HF = H2SiF6
+ …↑ + 8H2O
101)
Na2SO3(нед.) +
KIO3 + H2SO4 = …↓ + K2SO4
+ … + H2O
102)
CrBr3 + H2O2 +
NaOH = Na2CrO4 + … + H2O
103)
KMnO4 + PH3 + H2SO4
= H3PO4 + … + … + H2O
104)
SO2 + K2Cr2O7
+ H2SO4 = … + Cr2(SO4)3
+ …
105)
P2O3 + HNO3 +
H2O = H3PO4 + …↑
106)
NO + KClO + KOH = KNO3 + … + H2O
107)
PH3 + KMnO4 + H2SO4
= … + K2SO4 + … + H2O
108)
AsH3 + KMnO4 + H2SO4
= H3AsO4 + …+ MnSO4 + …
109)
CuI + H2SO4(конц.) = … + I2 + 4H2O + …↑
110)
Si + KOH + H2O = … + H2
(to)
111)
B + HNO3 (конц.) = H3BO3 + …↑
112)
NH3 + Br2 = …↑ + NH4Br
113)
P4 + KOH + H2O = …↑ + KH2PO2
114)
Al2O3 + C + Cl2
= … + CO(to)
115)
H2S + HClO = S + … + H2O
116)
KNO3(расплав) + P
= KNO2 + …
117)
I2 + Cl2 + H2O
= HIO3 + …
118)
H2S + Cl2 + H2O
= … + HCl
119)
Zn + H2S2O7 =
ZnSO4 + …↑ + 3H2O
120)
FeCl3 + Na2S = FeS + …↓ + …
121)
Na2S + NaNO3 + H2SO4
= NaHSO4 + …↑+ H2O
122)
Cr2O3 + NaNO3
+ Na2CO3 = Na2CrO4 + … + CO2
123)
C + Ca3(PO4)2
+ SiO2 = P + … + CaSiO3 (to)
124)
NaI + H2O2 + H2SO4
= Na2SO4 + …↓ + …
125)
HBr + K2Cr2O7
= CrBr3 + Br2 + … + …
126)
NH3 + KMnO4(тв.) = N2
+ MnO2 + … + …(to)
127)
FeCl3 + SO2 + 2H2O
= … + H2SO4 + …
128)
HMnO4 + H2S + H2SO4
= …↓ + MnSO4 + …
129)
KNO3 + Al + KOH + H2O = …↑ +
K[Al(OH)4]
130)
H2O2 + KMnO4 +
H2SO4 = …↑+MnSO4
+ … + H2O
131)
P4 + HNO3 = … + NO2
+ H2O
132)
NaClO + NaOH + Cr2O3 = Na2CrO4
+ … + …
133)
Na2SO3 + KMnO4
+ KOH = …+ Na2SO4 + H2O
134)
Cr2(SO4)3 + H2O2
+ NaOH = Na2CrO4 + … +…
135)
MgO(изб) + HCl → …
136)
K2O + ZnO (t)→ …
137)
FeO + CO2 = …
138)
Na2O + Al(OH)3
→ …+ H2O↑(t)
139)
Fe2O3 + C → Fe3O4
+ …↑(t)
140)
CaO + 3C → CaC2 + …↑(t)
141)
CaO + 2H2 → CaH2
+ …↑(t)
142)
BaO + O2 → …(t)
143)
NO2 + H2O →
HNO3 + …
144)
NO2 + H2O → … +
NO↑(t)
145)
ClO2 (изб) + H2O →
HClO3 + …
146)
ClO2 + H2O → +
HCl (t)
147)
P2O5(изб) + Ca(OH)2 →
… + H2O
148)
P2O5(изб) + Ca(OH)2
+ H2O → …
149)
CO2 + 2Mg(OH)2(изб) → … + H2O
150)
NO2 + NaOH → NaNO3
+ …+ H2O
151)
ClO2 + NaOH → NaClO3
+ NaClO2 + …
152)
CO2 + Be(OH)2 →
(BeOH)2CO3↓ + …
153)
CO2 + Cu(OH)2 →
…↓ + H2O
154)
SiO2 + CaCO3 →
CaSiO3 + …↑(t)
155)
P2O5 + Na2CO3 →
… + CO2↑
156)
P2O5 + HClO4(безводн) → … + HPO3
157)
P2O5 + HNO3(безводн) → … + HPO3
158)
CO2 + C (t)→ …↑
159)
SO3 + C → …↑ + CO↑
160)
H2O + C (t)→ …↑ + CO↑
161)
CO2 + Mg → C + …
162)
SiO2 + Mg (t)→ Si + …
163)
N2O + Mg (t)→ N2
+ …
164)
NO + O3 → NO2
+ O2
165)
O2 + O3 →
SO3 + O2
166)
NO2 + O3 →
N2O5 + …↑
167)
NO2 + O2 + H2O →
…
168)
SO2 + NO → N2↑
+ …
169)
SO2 + H2S →
…↓ + H2O
170)
SO2 + O2 + H2O →
…
171)
N2O + NH3 →
N2 + …
172)
CO2 + Na2O2 →
Na2CO3 + …↑
173)
NO2 + P → N2↑
+ …
174)
N2O + Cu (t)→ …↑ + Cu2O
175)
NO + Cu (t)→ …↑ + Cu2O
176)
N2O3 + Cu (t)→
N2↑ + …
177)
NO2 + Cu (t)→ N2↑
+ …
178)
N2O5 + Cu (t)→
N2↑ + …
179)
Fe3O4 +
HCl → … + … + H2O
180)
ZnO + NaOH(тв) → + H2O↑(t)
181)
ZnO + NaOH + H2O → …
182)
Al2O3 + K2CO3
→ … + CO2↑(t)
183)
Fe2O3 + Na2CO3
→ … + CO2↑(t)
184)
2KOH(тв) + Zn(OH)2
(t)→ …+ H2O↑
185)
NaOH(конц) + Fe(OH)3 →
…
186)
NaOH(тв) + Al2O3
→ …+ H2O↑(t)
187)
NaOH + Al2O3 +
H2O → …
188)
KOH + NaHCO3 → Na2CO3
+ …+ H2O
189)
NaOH + NH4HS → Na2S
+ … + H2O
190)
NaOH(изб) + NH4HS →
… + NH4OH + H2O
191)
Ca(OH)2 → … + H2O
(t)
192)
NaOH = … (t)
193)
LiOH (t)→ … + H2O
194)
Al + KOH + H2O → … +H2↑
195)
Zn + NaOH(тв) (t)→ … + H2↑
196)
Zn + NaOH + H2O → … +
H2↑
197)
Si + KOH + H2O → K2SiO3
+ …↑
198)
F2 + NaOH(разб) → NaF + OF2↑
+ …↑ + …
199)
P + 3NaOH + H2O → NaH2PO2
+ …↑
200)
Fe(OH)2 + O2 +
H2O → … (также для Cr)
201)
H3PO4 + Ca3(PO4)2 →
…
202)
H3PO4 + CaHPO4 →
…
203)
CO2 + H2O +
CaCO3 → …
204)
HCl(нед) + Na2[Zn(OH)4] →
… + Zn(OH)2↓ + H2O
205)
HCl(изб) + Na2ZnO2
→ … + ZnCl2 + H2O
206)
HCl(изб) + Na2[Zn(OH)4]
→ NaCl + … + H2O
207)
Zn + H2SO4(конц) → ZnSO4 + …↑
+ H2O
208)
Cu + H2SO4(конц) (t)→ CuSO4
+ …↑ + H2O
209)
Al + H2SO4(конц) (t)→ Al2(SO4)3
+ …↑ + …
210)
Ba + HNO3(конц) → 4Ba(NO3)2
+ N2O↑ + 5H2O
211)
Ag + HNO3(конц) → AgNO3
+ …↑ + H2O
212)
Ca + HNO3(разб) → … + NH4NO3
+ H2O
213)
Zn + HNO3(разб) → Zn(NO3)2
+ …↑ + H2O
214)
Zn + HNO3(разб) → Zn(NO3)2
+ N2O↑ + …
215)
Zn + HNO3(разб) → … + N2↑
+ H2O
216)
Zn + HNO3(оч.разб) → Zn(NO3)2
+ … + H2O
217)
H3PO4 → H4P2O7
+ … (t)
218)
H4P2O7
→ HPO3 + …(t)
219)
HNO3 → …↑ + O2
+ H2O (t)
220)
S + HNO3(разб) → H2SO4 + …↑
221)
S + HNO3(конц) → H2SO4 + …↑ + H2O
222)
S + H2SO4(конц) → SO2↑ + …↑ + H2O
223)
C + H2SO4(конц) → …↑ + …↑ + H2O
224)
C + HNO3(конц) → …↑ + …↑ + H2O
225)
P + HNO3(разб) + H2O → H3PO4 + …↑
226)
P + HNO3(конц) → HPO3 + …↑ + H2O
227)
S + Hal2 → HHal + …↓ (кроме F2)
228)
H2SO3 + Hal2
+ H2O → HHal + …(кроме F2)
229)
H2S + O2 → H2O
+ …↑ (горение)
230)
H2S + O2(недост) → H2O + S↓
231)
HBr + Cl2 → HCl + Br2↓
232)
HI + Cl2 → HCl + …↓
233)
HI + Br2 → HBr + …↓
234)
H2SO4(конц) + HBr → Br2↓ + …↑ + H2O
235)
H2SO4(конц) + HI → …↓ + …↑ + H2O
236)
H2SO4(конц) + H2S →…↓ + …↑ + H2O
237)
H2SO4(конц) + H2S → …↑ + H2O
238)
HNO3(конц) + H2S → …↓ + …↑ + H2O
239)
HNO3(конц) + SO2 → H2SO4 + …↑
240)
HNO3(конц) + HI → HIO3 + …↑ + H2O
241)
HNO3(конц) + HCl → …↑ + NO2↑ + H2O
242)
Al(OH)3 +Na2O →
…+ H2O↑ (t)
243)
Be(OH)2 + CO2 →
(BeOH)2CO3↓ + …
244)
Al2O3 +K2CO3 →
KAlO2 + …↑(t)
245)
Fe2O3 + Na2CO3 →
NaFeO2 + …↑(t)
246)
SiO2 + CaCO3 →
CaSiO3 + …↑(t)
247)
P2O5
+ Na2CO3 → Na3PO4 + …↑(t)
248)
Na2MnO4
+ Na2SO3 + H2O → MnO2↓ + … + NaOH
249)
Cu(NO3)2
+ H2O→ …↓ + O2↑ +… (электролиз)
250)
KI(тв.) + H2SO4
(конц.) → KHSO4 + …↓ + … ↑+ H2O
251)
Ca(OH)2 (изб) + (NH4)2HPO4
→ … + …↑ + H2O
252)
BaSO4 (тв.) + H2 → …↓
+ H2O (t)
253)
H2O2
+ CH3COOH → CO2 + …
254)
FeCl3
+ = K3[Fe(CN)6] +…
255)
AgI
+ KCN = K[Ag (CN)2] +…I
256)
(NH4)2Cr2O7
= …↑ +Cr2O3
+ … (t)
257)
NH4NO3
= …↑+ H2O
(t)
258)
NH4NO2
= …↑+ H2O
(t)
259)
NH4MnSO4
= …↑+ MnO2
+ … (t)
260)
(NH4)2CO3
= … +CO2 + … (t)
261)
K3N
+ HCl(изб) = KCl + …
262)
Ca3P2
+ H2O = Ca(OH)2 + …↑
263)
Al4C3
+ H2O = Al(OH)3 + …↑
264)
KH
+ HNO3 = KNO3 + …↑
265)
NaOH
+ CO = …
266)
4NaOH
+ CO + Cl2 = … + Na2CO3 + H2O
267)
SiH4
+ NaOH + H2O = Na2SiO3 + …↑
268)
FeCl3
+ Na2CO3 + H2O = NaCl + …↑+ …↓
269)
SiCl4
+ KOH = K2SiO3 +… + H2O
270)
K[Al(OH)4]
+ CO2 = K2CO3+ …↓+
H2O
НЕОРГАНИЧЕСКАЯ ХИМИЯ – ТРЕНАЖЕР РЕАКЦИЙ (полный вариант)
1) 2KMnO4
+ 16HCl = 2MnCl2 + 5Cl2 + 8H2O + 2KCl
2)
4Mg + 10HNO3(оч.разб.) =
4Mg(NO3)2 + NH4NO3 + 3H2O
3)
FeCl2 + 4HNO3(конц.) =
Fe(NO3)3 + 2HCl + NO2 + H2O
4) 8KI +
9H2SO4(конц.) =
4I2 + H2S + 8KHSO4 + 4H2O
5)
Cu + 2FeCl3 = CuCl2 +
2FeCl2
6)
3NO2 + H2O = NO +
2HNO3
7)
I2 + K2SO3 +
2KOH = 2KI + K2SO4 + H2O

6P + 5HClO3 + 9H2O =
5HCl + 6H3PO4
9) 3P +
5HNO3 + 2H2O = 3H3PO4 + 5NO
10)
Fe2(SO4)3 +
2KI = 2FeSO4 + I2 + K2SO4
11)
I2 + 10HNO3(конц.) =
2HIO3 + 10NO2 + 4H2O
12)
4Mg + 5H2SO4(конц.) =
4MgSO4 + H2S + 4H2O
13) 5HCOH
+ 4KMnO4 + 6H2SO4 = 5CO2 + 2K2SO4
+ 4MnSO4 + 11H2O
14)
14HCl + K2Cr2O7
= 3Cl2 + 2CrCl3 + 2KCl + 7H2O
15)
K2Cr2O7 + 3Na2SO3
+ 4H2O = 2Cr(OH)3 + 3Na2SO4 + 2KOH
16)
3NaNO2 + Na2Cr2O7
+ 8HNO3 = 5NaNO3 + 2Cr(NO3)3 + 4H2O
17)
FeS + 12HNO3(конц.) =
Fe(NO3)3 + H2SO4 + 9NO2
+ 5H2O
18)
3KNO2 + K2Cr2O7
+ 8HNO3 = 5KNO3 + 2Cr(NO3)3 + 4H2O
19) 3P2O3
+ 4HNO3 + 7H2O = 6H3PO4 + 4NO
20)
3SO2 + K2Cr2O7
+ H2SO4 = K2SO4 + Cr2(SO4)3
+ H2O
21)
Si + 2KOH + H2O = K2SiO3
+ 2H2 (to)
22) I2
+ 5Cl2 + 6H2O = 2HIO3 + 10HCl
23)
H2S + 4Cl2 + 4H2O
= H2SO4 + 8HCl
24)
2FeCl3 + 3Na2S = 2FeS + S
+ 6NaCl
25)
5C + Ca3(PO4)2
+ 3SiO2 = 2P + 5CO + 3CaSiO3 (to)
26)
14HBr + K2Cr2O7
= 2CrBr3 + 3Br2 + 7H2O + 2KBr
27) Cr2(SO4)3
+ 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4
+8H2O
28)
5H2O2 + 2KMnO4
+ 3H2SO4 = 5O2 + 2MnSO4 + K2SO4
+ 8H2O
29)
P4 + 20HNO3 = 4H3PO4
+ 20NO2 + 4H2O
30) 2NH3
+ 2KMnO4(тв.) = N2
+ 2MnO2 + 2KOH + 2H2O (to)
31)
Cl2
+2KOH (хол)= KCl +KClO +H2O
32)
3Cl2
+ 6KOH (гор)= 5KCl +KClO3 +3H2O (для Br2, I2
тоже)
33) 3S +6KOH = 2K2S + K2SO3
+ 3H2O
34) Si +2NaOH + H2O =
Na2SiO3
+2H2
35) 2KMnO4
+ 3MnSO4 + 2H2O = 5MnO2 + K2SO4
+ 2H2SO4
36) 2KMnO4
+ 16HCl = 2MnCl2 + 5Cl2 + 8H2O + 2KCl
37) 5NaNO2
+ 2KMnO4 + 3H2SO4 = 2MnSO4 + 5NaNO3
+ K2SO4 + 3H2O
38) 10FeSO4
+ 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3
+ 2MnSO4 + K2SO4 + 8H2O
39) 2KMnO4
+ 5H2S + 3H2SO4 = 5S + 2MnSO4 + K2SO4
+ 8H2O
40) 2KMnO4
+ 5Na2SO3 + 3H2SO4 = MnSO4
+ K2SO4 + 5Na2SO4 + 3H2O
41) SO2
+ 2KMnO4 + 4KOH = K2SO4 + 2K2MnO4
+ 2H2O
42) K2Cr2O7
+ 3H2S + 4H2SO4 = Cr2(SO4)3
+ 3S + K2SO4 + 7H2O
43) K2Cr2O7
+ 3NaNO2 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3
+ K2SO4 + 4H2O
44) K2Cr2O7
+ 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3
+ 4K2SO4 + 7H2O
45) 4Mg +
10HNO3(оч.разб.) =
4Mg(NO3)2 + NH4NO3 + 3H2O
46) Cr2(SO4)3
+ 3Br2 + 16NaOH = 6NaBr + 2Na2CrO4 + 3Na2SO4
+ 8H2O
47) Al2S3
+ 30HNO3(конц.) =
2Al(NO3)3 + 3H2SO4 + 24NO2
+ 12H2O
48) 6FeSO4
+ 2HNO3 + 3H2SO4 = 3Fe2(SO4)3
+ 2NO + 4H2O
49) FeCl2
+ 4HNO3(конц.) =
Fe(NO3)3 + 2HCl + NO2 + H2O
50) AlP +
11HNO3(конц.) = H3PO4
+ 8NO2 + Al(NO3)3 + 4H2O
51) 6FeSO4
+ KClO3 + 3H2SO4 = 3Fe2(SO4)3
+ KCl + 3H2O
52) 3MnSO4
+ 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4
+ 6H2O
53) 2Al +
K2Cr2O7 + 7H2SO4 = Al2(SO4)3
+ Cr2(SO4)3 + K2SO4 + 7H2O
54) 3P2O3
+ 2HClO3 + 9H2O = 6H3PO4 + 2HCl
55) Cr2(SO4)3
+ 6KMnO4 + 16KOH = 2K2CrO4 + 6K2MnO4
+ 3K2SO4 + 8H2O
56) Cr2O3
+ 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 +
2H2O
57) 2NaNO2
+ 2NaI + 2H2SO4 = 2NO + I2 + 2Na2SO4
+ 2H2O
58) 8KI +
9H2SO4(конц.) =
4I2 + H2S + 8KHSO4 + 4H2O
59) Cu +
2FeCl3 = CuCl2 + 2FeCl2
60) 3PH3
+ 4HClO3 = 3H3PO4 + 4HCl
61) 3NO2 +
H2O = NO + 2HNO3
62) I2
+ K2SO3 + 2KOH = 2KI + K2SO4 + H2O
63) 2NH3
+ 3KClO = N2 + 3KCl + 3H2O
64) 6P +
5HClO3 + 9H2O = 5HCl + 6H3PO4
65) 3P +
5HNO3 + 2H2O = 3H3PO4 + 5NO
66) Ca(ClO)2
+ 4HCl = CaCl2 + 2Cl2 + 2H2O
67) 3H2S
+ HClO3 = 3S + HCl + 3H2O
68) Fe2(SO4)3
+ 2KI = 2FeSO4 + I2 + K2SO4
69) 2KMnO4
+ KI + H2O = 2MnO2 + KIO3 + 2KOH
70) I2
+ 10HNO3(конц.) =
2HIO3 + 10NO2 + 4H2O
71) 3As2S3
+ 28HNO3 + 4H2O = 6H3AsO4 + 28NO +
9H2SO4
72) 4Mg +
5H2SO4(конц.) =
4MgSO4 + H2S + 4H2O
73) MnO2
+ 2KBr + 2H2SO4 = MnSO4 + Br2 + K2SO4
+ 2H2O
74)
5HCOH + 4KMnO4 + 6H2SO4
= 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O
75) 3KNO2
+ 2KMnO4 + H2O = 3KNO3 + 2MnO2 +
2KOH
76) NaClO
+ 2KI + H2SO4 = I2 + NaCl + K2SO4
+ H2O
77)
2KNO3 + 6KI + 4H2SO4
= 2NO + 3I2 + 4K2SO4 + 4H2O
78) 14HCl
+ K2Cr2O7 = 3Cl2 + 2CrCl3
+ 2KCl + 7H2O
79) 2Cr(OH)3
+ 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
80) K2MnO4
+ 8HCl = MnCl2 + 2Cl2 + 2KCl + 4H2O
81) K2Cr2O7
+ 3Na2SO3 + 4H2O = 2Cr(OH)3 + 3Na2SO4
+ 2KOH
82) 2KMnO4
+ 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 +
6K2SO4 + 8H2O
83) 4Zn +
KNO3 + 7KOH = NH3 + 4K2ZnO2 + 2H2O
84) 2Fe(OH)3
+ 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O
85) P2O3
+ 6KOH + 2NO2 = 2NO + 2K3PO4 + 3H2O
86) 2KMnO4
+ 2NH3 = 2MnO2 + N2 + 2KOH + 2H2O
87) 3Na2SO3
+ 2KMnO4 + H2O = 3Na2SO4 + 2MnO2
+ 2KOH
88) 3NaNO2
+ Na2Cr2O7 + 8HNO3 = 5NaNO3
+ 2Cr(NO3)3 + 4H2O
89) B +
HNO3(конц.) +
4HF = NO + HBF4 + 2H2O
90) 2CuCl2
+ SO2 + 2H2O = 2CuCl + 2HCl + H2SO4
91) PH3
+ 8AgNO3 + 4H2O = 8Ag + H3PO4 +
8HNO3
92) 2NH3
+ 6KMnO4 + 6KOH = N2 + 6K2MnO4 + 6H2O
93) 5Zn +
2KMnO4 + 8H2SO4 = 5ZnSO4 + 2MnSO4
+ K2SO4 + 8H2O
94) 3KNO2
+ K2Cr2O7 + 8HNO3 = 5KNO3
+ 2Cr(NO3)3 + 4H2O
95) FeS +
12HNO3(конц.) =
Fe(NO3)3 + H2SO4 + 9NO2
+ 5H2O
96) KIO3
+ 5KI + 3H2SO4 = 3I2 + 3K2SO4
+ 3H2O
97) 2NaCrO2
+ 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4H2O
98) Fe2(SO4)3
+ Na2SO3 + H2O = 2FeSO4 + Na2SO4
+ H2SO4
99) 3P2O3+
2H2Cr2O7 + H2O = 2H3PO4
+ 4CrPO4
100)
3Si + 4HNO3 + 18HF = 3H2SiF6
+ 4NO + 8H2O
101)
5Na2SO3(нед.) +
2KIO3 + H2SO4 = I2 + K2SO4
+ 5Na2SO4 + H2O
102)
2CrBr3 + 3H2O2
+ 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O
103)
8 KMnO4 + 5 PH3 + 12H2SO4
= 5H3PO4 + 8MnSO4 + 4K2SO4
+ 12H2O
104)
3SO2 + K2Cr2O7
+ H2SO4 = K2SO4 + Cr2(SO4)3
+ H2O
105)
3P2O3 + 4HNO3
+ 7H2O = 6H3PO4 + 4NO
106)
2NO + 3KClO + 2KOH = 2KNO3 + 3KCl +
H2O
107)
5PH3 + 8KMnO4 + 12H2SO4
= 5H3PO4 + 4K2SO4 + 8MnSO4
+ 12H2O
108)
5AsH3 + 8KMnO4 + 12H2SO4
= 5H3AsO4 + 4K2SO4 + 8MnSO4
+ 12H2O
109)
2CuI + 4H2SO4(конц.) = 2CuSO4 + I2 + 4H2O + 2SO2
110)
Si + 2KOH + H2O = K2SiO3
+ 2H2 (to)
111)
B + 3HNO3 = H3BO3
+ 3NO2
112)
8NH3 + 3Br2 = N2
+ 6NH4Br
113)
P4 + 3KOH + 3H2O = PH3
+ 3KH2PO2
114)
Al2O3 + 3C + 3Cl2
= 2AlCl3 + 3CO(to)
115)
H2S + HClO = S + HCl + H2O
116)
5KNO3(расплав) + 2P
= 5KNO2 + P2O5
117)
I2 + 5Cl2 + 6H2O
= 2HIO3 + 10HCl
118)
H2S + 4Cl2 + 4H2O
= H2SO4 + 8HCl
119)
8Zn + 5H2S2O7
= 8ZnSO4 + 2H2S + 3H2O
120)
2FeCl3 + 3Na2S = 2FeS + S
+ 6NaCl
121)
Na2S + 8NaNO3 + 9H2SO4
= 10NaHSO4 + 8NO2 + 4H2O
122)
Cr2O3 + 3NaNO3
+ 2Na2CO3 = 2Na2CrO4 + 3NaNO2
+ 2CO2
123)
5C + Ca3(PO4)2
+ 3SiO2 = 2P + 5CO + 3CaSiO3 (to)
124)
2NaI + H2O2 + H2SO4
= Na2SO4 + I2 + 2H2O
125)
14HBr + K2Cr2O7
= 2CrBr3 + 3Br2 + 7H2O + 2KBr
126)
2NH3 + 2KMnO4(тв.) = N2
+ 2MnO2 + 2KOH + 2H2O (to)
127)
2FeCl3 + SO2 + 2H2O
= 2FeCl2 + H2SO4 + 2HCl
128)
2HMnO4 + 5H2S + 2H2SO4
= 5S + 2MnSO4 + 8H2O
129)
3KNO3 + 8Al + 5KOH + 18H2O
= 3NH3 + 8K[Al(OH)4]
130)
5H2O2 + 2KMnO4
+ 3H2SO4 = 5O2 + 2MnSO4 + K2SO4
+ 8H2O
131)
P4 + 20HNO3 = 4H3PO4
+ 20NO2 + 4H2O
132)
3NaClO + 4NaOH + Cr2O3 =
2Na2CrO4 + 3NaCl + 2H2O
133)
Na2SO3 + 2KMnO4
+ 2KOH = 2K2MnO4 + Na2SO4 + H2O
134)
Cr2(SO4)3 + 3H2O2
+ 10NaOH = 2Na2CrO4 + 3Na2SO4 +8H2O
135)
MgO(изб) + HCl → Mg(OH)Cl
136)
K2O + ZnO
(t)→ K2ZnO2
137)
FeO + CO2 ≠
138)
Na2O +
2Al(OH)3 → 2NaAlO2 + 3H2O↑(t)
139)
3Fe2O3
+ C → 2Fe3O4 + CO↑(t)
140)
CaO + 3C → CaC2
+ CO↑(t)
141)
CaO + 2H2 →
CaH2 + H2O↑(t)
142)
2BaO + O2 → 2BaO2(t)
143)
2NO2 + H2O →
HNO3 + HNO2
144)
3NO2 + H2O
→ 2HNO3 + NO↑(t)
145)
2ClO2 + H2O →
HClO3 + HClO2
146)
6ClO2 + 3H2O
→ 5HClO3 + HCl (t)
147)
P2O5(изб) + 2Ca(OH)2 →
2CaHPO4 + H2O
148)
P2O5(изб) + Ca(OH)2
+ H2O → Ca(H2PO4)2
149)
CO2 +
2Mg(OH)2(изб) → (MgOH)2CO3 + H2O
150)
2NO2 + 2NaOH →
NaNO3 + NaNO2 + H2O
151)
2ClO2 +
2NaOH → NaClO3 + NaClO2 + H2O
152)
CO2 +
2Be(OH)2 → (BeOH)2CO3↓ + H2O
153)
CO2 +
2Cu(OH)2 → (CuOH)2CO3↓ + H2O
154)
SiO2 + CaCO3
→ CaSiO3 + CO2↑(t)
155)
P2O5
+ Na2CO3 → 2Na3PO4 + 2CO2↑
156)
P2O5 +
2HClO4(безводн) → Cl2O7 + 2HPO3
157)
P2O5
+ 2HNO3(безводн) → N2O5 + 2HPO3
158)
CO2 + C (t)→
2CO↑
159)
SO3 +
C → SO2 + CO↑
160)
H2O + C (t)→
H2↑ + CO↑
161)
CO2 +
2Mg → C + 2MgO
162)
SiO2 + 2Mg
(t)→ Si + 2MgO
163)
N2O + Mg
(t)→ N2 + MgO
164)
NO + O3 →
NO2 + O2
165)
O2 + O3 →
SO3 + O2
166)
2NO2 + O3 →
N2O5 + O2
167)
4NO2 + O2
+ 2H2O → 4HNO3
168)
2SO2 +
2NO → N2↑ + 2SO3
169)
SO2 + 2H2S →
3S↓ + 2H2O
170)
2SO2 + O2
+ 2H2O → 2H2SO4
171)
3N2O + 2NH3 →
4N2 + 3H2O
172)
2CO2 + 2Na2O2 →
2Na2CO3 + O2
173)
10NO2
+8P → 5N2↑ + 4P2O5
174)
N2O + 2Cu
(t)→ N2↑ + Cu2O
175)
2NO + 4Cu (t)→ N2↑
+ 2Cu2O
176)
N2O3
+ 3Cu (t)→ N2↑ + 3CuO
177)
2NO2 + 4Cu
(t)→ N2↑ + 4CuO
178)
N2O5
+ 5Cu (t)→ N2↑ + 5CuO
179)
Fe3O4
+ 8HCl → FeCl2 + 2FeCl3 + 4H2O
180)
ZnO + 2NaOH(тв) → Na2ZnO2
+ H2O↑(t)
181)
ZnO + 2NaOH + H2O →
Na2[Zn(OH)4]
182)
Al2O3
+ K2CO3 → KAlO2 + CO2↑(t)
183)
Fe2O3
+ Na2CO3 → 2NaFeO2 + CO2↑(t)
184)
2KOH(тв) + Zn(OH)2
(t)→ K2ZnO2 + 2H2O↑
185)
3NaOH(конц) + Fe(OH)3 →
Na3[Fe(OH)6]
186)
2NaOH(тв) + Al2O3
→ 2NaAlO2 + H2O↑(t)
187)
6NaOH + Al2O3
+ 3H2O → 2Na3[Al(OH)6]
188)
2KOH + 2NaHCO3 →
Na2CO3 + K2CO3 + 2H2O
189)
2NaOH + 2NH4HS →
Na2S + (NH4)2S + 2H2O
190)
2NaOH(изб) + NH4HS →
Na2S + NH4OH + H2O
191)
Ca(OH)2 →
CaO + H2O (t)
192)
NaOH ≠ (t)
193)
LiOH (t)→ Li2O
+ H2O
194)
2Al + 2KOH + 6H2O →
2K[Al(OH)4] +3H2↑
195)
Zn + 2NaOH(тв) (t)→ Na2ZnO2
+ H2↑
196)
Zn + 2NaOH + 2H2O →
Na2[Zn(OH)4] + H2↑
197)
Si + 2KOH + H2O →
K2SiO3 + 2H2↑
198)
4F2 + 6NaOH(разб) → 6NaF + OF2↑
+ O2↑ + 3H2O
199)
4P + 3NaOH + 3H2O →
3NaH2PO2 + PH3↑
200)
4Fe(OH)2 + O2
+ 2H2O → 4Fe(OH)3 (Cr)
201)
H3PO4
+ Ca3(PO4)2 → 3CaHPO4
202)
H3PO4
+ CaHPO4 → Ca(H2PO4)2
203)
CO2 + H2O
+ CaCO3 → Ca(HCO3)2
204)
2HCl(нед) + Na2[Zn(OH)4] →
2NaCl + Zn(OH)2↓ + 2H2O
205)
4HCl(изб) + Na2ZnO2
→ 2NaCl + ZnCl2 + 2H2O
206)
4HCl(изб) + Na2[Zn(OH)4]
→ 2NaCl + ZnCl2 + 4H2O
207)
4Zn + 5H2SO4(конц) → 4ZnSO4 +
H2S↑ + 4H2O
208)
Cu + 2H2SO4(конц) (t)→ CuSO4
+ SO2↑ + 2H2O
209)
2Al + 6H2SO4(конц) (t)→ Al2(SO4)3
+ 3SO2↑ + 6H2O
210)
4Ba + 10HNO3(конц) → 4Ba(NO3)2
+ N2O↑ + 5H2O
211)
Ag + 2HNO3(конц) → AgNO3
+ NO2↑ + H2O
212)
4Ca + 10HNO3(разб) → 4Ca(NO3)2
+ NH4NO3 + 3H2O
213)
3Zn + 8HNO3(разб) → 3Zn(NO3)2
+ 2NO↑ + 4H2O
214)
4Zn + 10HNO3(разб) → 4Zn(NO3)2
+ N2O↑ + 5H2O
215)
5Zn + 12HNO3(разб) → 5Zn(NO3)2
+ N2↑ + 6H2O
216)
4Zn + 10HNO3(оч.разб) → 4Zn(NO3)2
+ NH4NO3 + 3H2O
217)
2H3PO4
→ H4P2O7 + H2O (t)
218)
H4P2O7
→ 2HPO3 + H2O (t)
219)
4HNO3 → 4NO2
+ O2 + 2H2O (t)
220)
S + 2HNO3(разб) → H2SO4
+ 2NO↑
221)
S + 6HNO3(конц) → H2SO4
+ 6NO2↑ + 2H2O
222)
S + 2H2SO4(конц) → 3SO2↑ +
CO2↑ + 2H2O
223)
C + 2H2SO4(конц) → 2SO2↑ +
CO2↑ + 2H2O
224)
C + 4HNO3(конц) → 4NO2↑ +
CO2↑ + 2H2O
225)
P + 5HNO3(разб) + 2H2O →
3H3PO4 + 5NO↑
226)
P + 5HNO3(конц) → HPO3 +
5NO2↑ + 2H2O
227)
2S + Hal2 →
2HHal + S↓ (кроме F2)
228)
H2SO3
+ Hal2 + H2O → 2HHal + H2SO4 (кроме F2)
229)
2H2S + 3O2
→ 2H2O + 2SO2 (горение)
230)
2H2S + O2(недост) → 2H2O
+ 2S↓
231)
2HBr + Cl2 →
2HCl + Br2↓
232)
2HI + Cl2 →
2HCl + I2↓
233)
2HI + Br2 →
2HBr + I2↓
234)
H2SO4(конц) 2HBr → Br2↓
+ SO2↑ + 2H2O
235)
H2SO4(конц) + 8HI → 4I2↓
+ H2S↑ + 4H2O
236)
H2SO4(конц) + H2S → S↓
+ SO2↑ + 2H2O
237)
3H2SO4(конц) + H2S →
4SO2↑ + 4H2O
238)
2HNO3(конц) + H2S → S↓
+ 2NO2↑ + 2H2O
239)
2HNO3(конц) + SO2 → H2SO4
+ 2NO2↑
240)
6HNO3(конц) + HI → HIO3
+ 6NO2↑ + 3H2O
241)
2HNO3(конц) + 6HCl → 3Cl2↑
+ 2NO↑ + 4H2O
242)
2Al(OH)3 +Na2O
→ 2NaAlO2 + 3H2O↑ (t)
243)
2Be(OH)2 +
CO2 → (BeOH)2CO3↓ + H2O
244)
Al2O3
+K2CO3 → KAlO2 + CO2↑(t)
245)
Fe2O3
+ Na2CO3 → 2NaFeO2 + CO2↑(t)
246)
SiO2 + CaCO3 →
CaSiO3 + CO2↑(t)
247)
P2O5
+ Na2CO3 → 2Na3PO4 + 3CO2↑(t)
248)
Na2MnO4
+ Na2SO3 + H2O → MnO2↓ + Na2SO4
+ 2 NaOH
249)
Cu(NO3)2
+ 2H2O→ 2Cu↓ + O2↑ +4HNO3 (электролиз)
250)
8KI(тв.) + 9H2SO4
(конц.) → 8KHSO4 + 4 I2↓ + H2S + 4H2O
251)
3Ca(OH)2 (изб) + 2(NH4)2HPO4
→ Ca3(PO4)2 + 4NH3 + 6H2O
252)
BaSO4 (тв.) + 4H2 →
BaS + 4H2O (t)
253)
4H2O2 + CH3COOH → 2CO2 + 2H2O
254)
FeCl3
+ = K3[Fe(CN)6] +3KCl
255)
AgI
+ 2KCN = K[Ag (CN)2] +KI
256)
(NH4)2Cr2O7
= N2 +Cr2O3 + 4H2O (t)
257)
NH4NO3
= N2O+ 2H2O (t)
258)
NH4NO2
= N2+ 2H2O (t)
259)
2NH4MnSO4
= N2+ 2MnO2 + 4H2O (t)
260)
(NH4)2CO3
= 2NH3 +CO2 + H2O (t)
261)
K3N
+ 4HCl(изб) = 3KCl + NH4Cl
262)
Ca3P2
= 6H2O = 3Ca(OH)2 + 2PH3
263)
Al4C3
+ 12H2O = 4Al(OH)3 + 3CH4
264)
KH
+ HNO3 = KNO3 + H2
265)
NaOH
+ CO = HCOONa
266)
4NaOH
+ CO + Cl2 = 2NaCl + Na2CO3 + 2H2O
267)
SiH4
+ 2NaOH + H2O = Na2SiO3 + 4H2
268)
2FeCl3
+ 3Na2CO3 + 3H2O = 6NaCl + 3CO2 +
2Fe(OH)3
269)
SiCl4
+ 6KOH = K2SiO3 +4 KCl + 3H2O
270)
2K[Al(OH)4]
+ CO2 = K2CO3+ 2Al(OH)3+ H2O
ВЛИЯНИЕ
СРЕДЫ НА ПРОТЕКАНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ

Подготовка к ЕГЭ начинается с
психологического настроя на успех, обязательную сдачу ЕГЭ.
Поэтому не
лишними будут помощь психолога, советы родителей и учителей.
Теория к ЕГЭ. Методика самостоятельной подготовки к ЕГЭ
ТЕОРИЯ ДЛЯ СДАЮЩИХ ЕГЭ
Дopoнькин ЕГЭ. Химия. Большой справочник
Adobe Acrobat Document
7.6 MB
РАСПЕЧАТАТЬ И ИСПОЛЬЗОВАТЬ
Методические рекомендации по подготовке
Adobe Acrobat Document
375.5 KB
ПРОРАБОТАТЬ И ПРИНЯТЬ К СВЕДЕНИЮ
анализ типичных ошибок ЕГЭ-2019 г.pdf
Adobe Acrobat Document
771.7 KB
ПРОГРАММА ПОДГОТОВКИ К ЕГЭ ПО ХИМИИ.doc
Microsoft Word Document
129.5 KB
ВНИМАНИЕ
Тривиальные названия органических вещест
Adobe Acrobat Document
340.1 KB
Теория и тест для самостоятельной проработки.
Основные способы получения металлов.pptx
Microsoft Power Point Presentation
920.7 KB
Все свойства органических веществ.
Реакции к основным темам курса 10 класса
Microsoft Word Document
158.0 KB
Общие формулы. УЧИТЬ!!!
Общие формулы классов органических вещес
Adobe Acrobat Document
188.4 KB
Металлы. Соединения металлов. УЧИТЬ!!!
Свойства металлов и их соединений.docx
Microsoft Word Document
2.5 MB
Цепочки превращений.
Задание С3. Цепочки превращений..docx
Microsoft Word Document
674.8 KB
Теория по основным классам неорганических соединений.
Основные классы и их свойства.doc
Microsoft Word Document
880.0 KB
Нужно разобраться и выучить.
Ряд активности металлов.pdf
Adobe Acrobat Document
315.0 KB

Документация и подготовка к ЕГЭ
таблица ПСХЭ.doc
Microsoft Word Document
396.5 KB
Таблица растворимости некоторых веществ
Microsoft Word Document
578.5 KB

Дополнительная информация, теория к ЕГЭ
Адреса сайтов подготовки.
Материалы для подготовки к ОГЭ и ЕГЭ.doc
Microsoft Word Document
15.2 KB
Таблица. Качественные признаки веществ.d
Microsoft Word Document
44.8 KB
Ряд ЭО. Названия кислот и остатков. Степ
Microsoft Word Document
518.7 KB
Таблица ПСХЭ . С обозначением классов со
Microsoft Word Document
498.4 KB
цвета оксидов.doc
Microsoft Word Document
24.0 KB
Номенклатура неорганических веществ.doc
Microsoft Word Document
135.5 KB
Определение ионов. Качественные реакции.
Microsoft Word Document
51.0 KB
Часть представленных здесь материалов взята с
сайта учителя химии Сикорской О.Э.