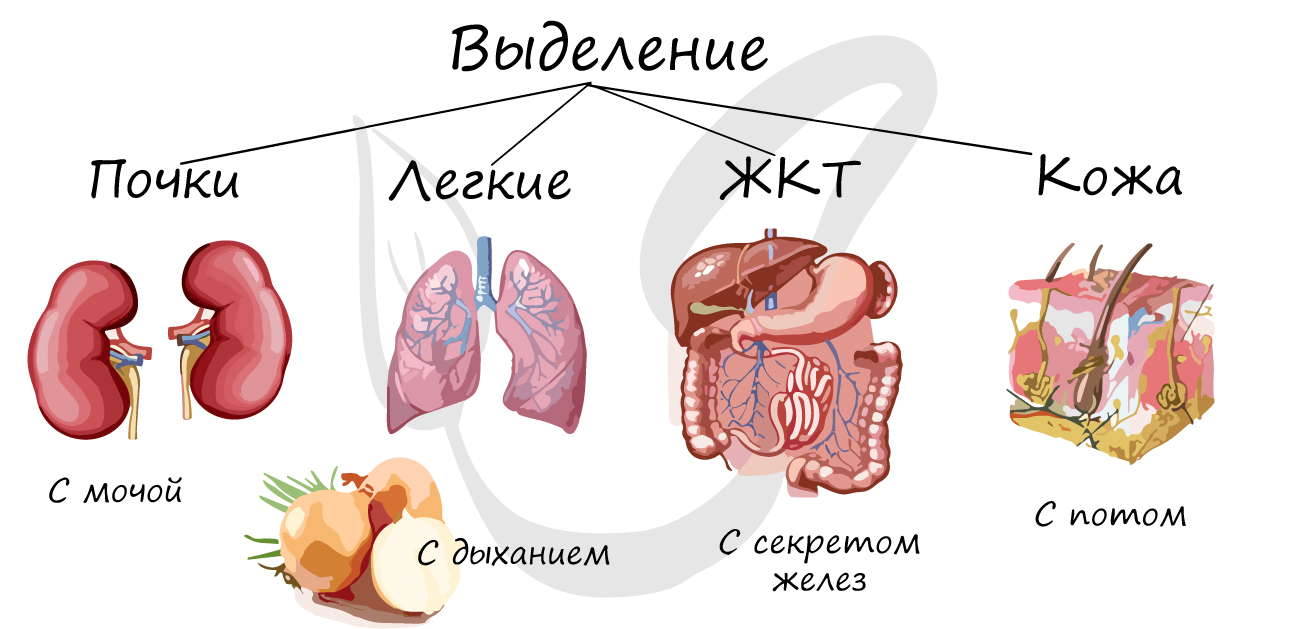
Выделение
Выделение — удаление конечных продуктов обмена веществ, которые не могут быть повторно использованы организмом, а так же вредных, чужеродных веществ, попавших в организм (яды, лекарства).
К органам, выполняющим функции выделения, относятся: почки, мочеточники,
мочевой пузырь, мочеиспускательный канал, а также легкие, желудочно-кишечный тракт, кожа.
Небольшая часть мочевины и мочевой кислоты, а также лекарства выводятся вместе с секретом желез желудочно-кишечного
тракта. Потовые железы кожи выделяют мочевую кислоту, соли, воду, мочевину. В процессе дыхания из легких
улетучивается углекислый газ, вода, алкоголь, эфиры.
Почкам принадлежит первое место в этом списке: они — главное звено системы мочеотделения, однако при различных болезнях почек (почечной недостаточности) их функция страдает, и компенсаторно возрастает выделение
через другие органы (ЖКТ, легкие, кожа). В этом случае у пациента может появляться неприятный запах мочевины от кожи, изо рта, что доставляет неудобства самим пациентам и их окружению.

Почки
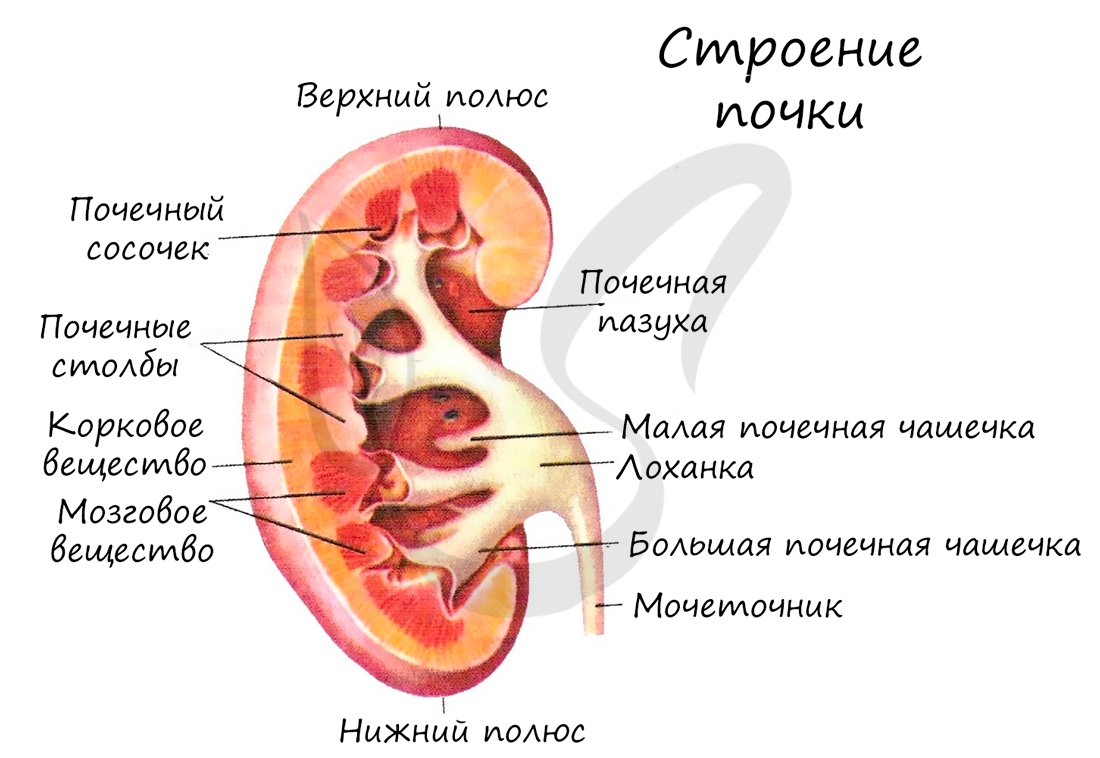
Представляют собой парные бобовидные образования, которые лежат на задней стенке брюшной полости по бокам от позвоночника.
Масса каждой почки — около 150 граммов. Снаружи покрыты соединительнотканной и жировой капсулами. Через ворота в почку входит
мочеточник, почечная артерия, вена, лимфатические сосуды и нервы.

На поперечном срезе почки хорошо различаются корковое и мозговое вещество. На периферии почки располагается слой коркового вещества, под
ним глубже лежат пирамиды, образующие мозговое вещество. Между пирамидами хорошо различимы почечные столбы — участки коркового вещества,
вдающиеся вглубь почки. Пирамида вместе с почечным столбом образует почечную долю.
Верхушка почечной пирамиды, обращенная внутрь, называется сосочек. Каждый сосочек усеян мелкими отверстиями, из которых
выделяется моча и поступает в самые начальные участки мочевых путей — малые почечные чашечки. Сливаясь между собой, малые
почечные чашечки образуют большие, которые сливаются в одну большую лоханку, переходящую в мочеточник.
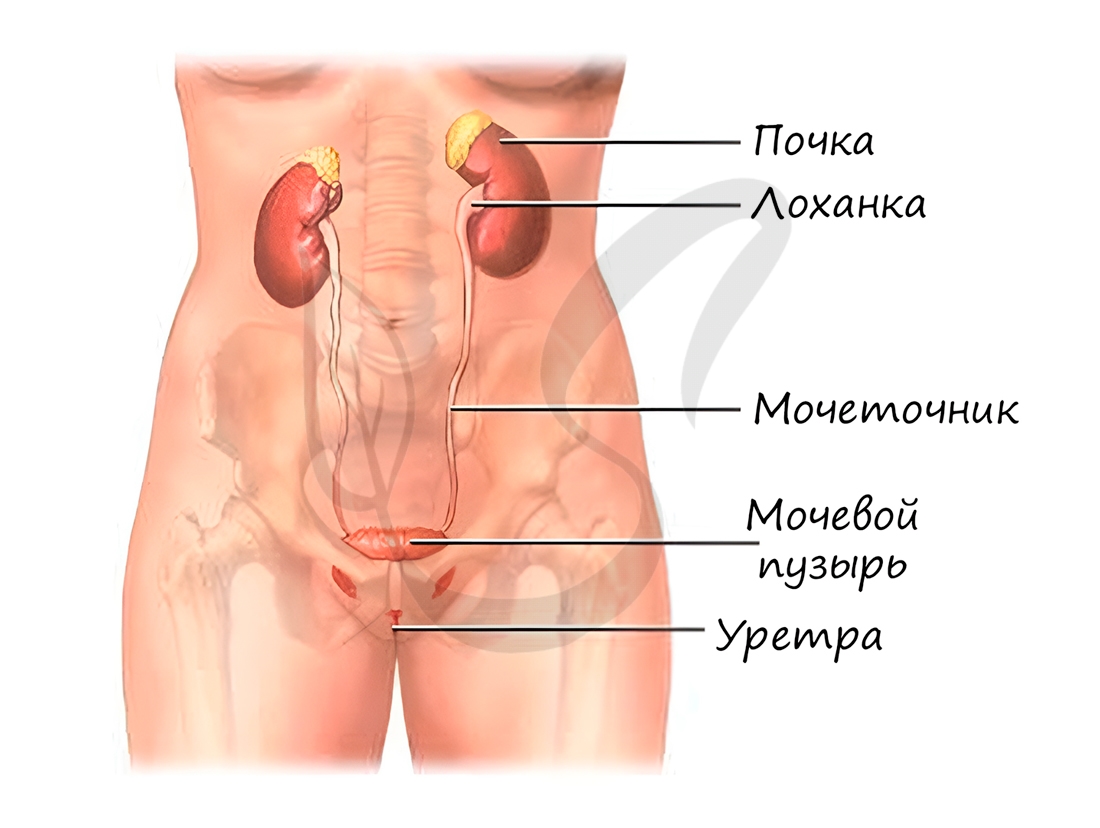
Выходя из ворот почек, мочеточники направляются вниз к мочевому пузырю — резервуару мочи. В мочевом пузыре моча
накапливается, его вместимость составляет около 500 мл. Далее моча направляется в мочеиспускательный канал (уретру),
который открывается во внешнюю среду наружным отверстием.

Функции почек
Вам уже известна основная функция почек — выделительная, скоро мы приступим к ее углубленному изучению, но сейчас коснемся других функций почек. Рекомендую вернуться еще раз к функциям почек по прочтении статьи.
- Удаление из организма конечных продуктов
- Регуляция артериального давления
- Регуляция эритроцитопоэза
- Обеспечение гомеостаза
- Участие в водно-солевом балансе
- Выделяя кислые или щелочные продукты, способствуют постоянству pH крови (водородный показатель)
Из организма удаляется мочевина, мочевая кислота, соли аммиака. Напомню, что мочевина образуется не в почках, а в печени, поэтому почки в данном случае играют роль фильтра.
Осуществляют регуляцию артериального давления за счет выделения биологически активного вещества — ренина (мы поговорим об этом, изучая нефрон)
Регулируют число эритроцитов, вырабатывая гормон эритропоэтин, который стимулирует образование эритроцитов
в красном костном мозге.
Поддерживают гомеостаз организма — постоянство внутренней среды.
Выделительная и кровеносная системы очень тесно взаимосвязаны, в чем мы убедимся по ходу изучения выделительной системы.
Нефрон
Нефрон (от гр. nephros — почка) — структурно-функциональная единица почки, состоящая из почечного тельца и канальцев.
В составе почечного тельца различают сосудистый клубочек (капиллярный, мальпигиев), и покрывающую его капсулу Боумена-Шумлянского.

Обращаю ваше особое внимание на разницу диаметра приносящей и выносящей артериол. Диаметр приносящей артериолы крупнее, чем
у выносящей, благодаря чему в сосудистом клубочке создается повышенное давление и осуществляется важнейший процесс — фильтрация.
Чем выше артериальное давление в сосудистом клубочке и капиллярной сети, тем интенсивнее идут процессы фильтрации и реабсорбции,
с которыми вы скоро познакомитесь.
Запомните, что в основе мочеобразования лежат три процесса: фильтрация, реабсорбция (вторичное всасывание) и секреция. Изучая их,
мы поймем, как функционирует нефрон, и разберем его строение.
- Фильтрация
- Реабсорбция (лат. re — обратное + лат. absorptio — всасывание)
- Секреция (лат. secretio — отделение)
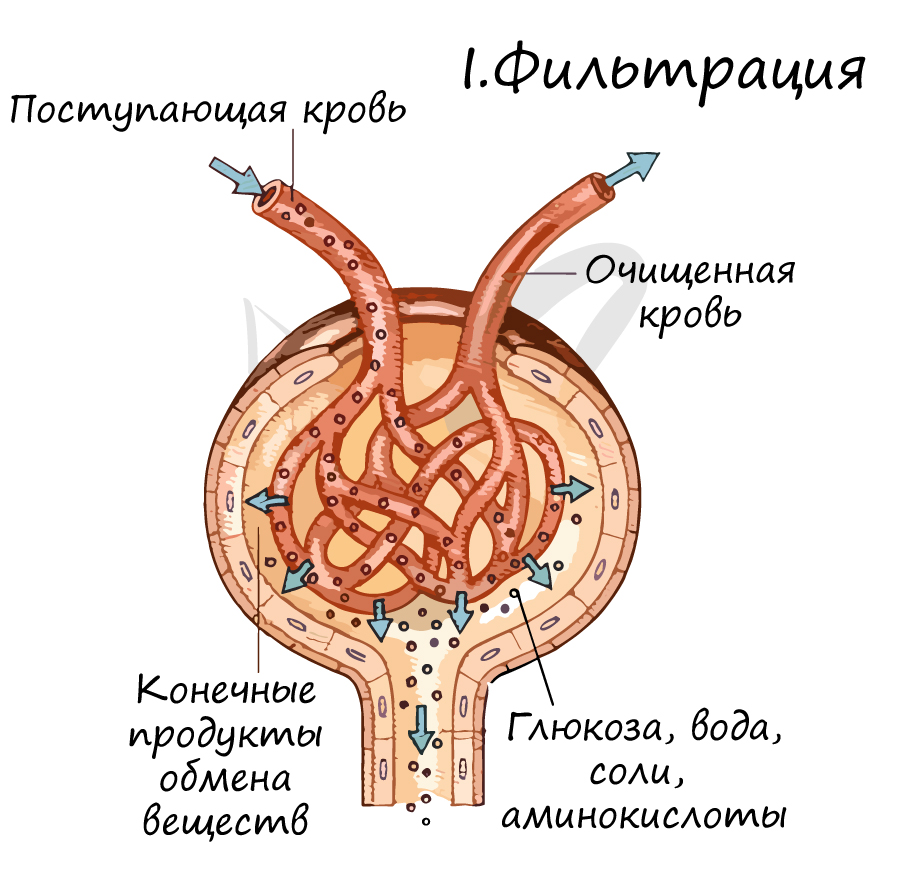
Лучше всего ассоциировать этот процесс с ситом, которое пропускает мелкие частички, а крупные не пропускает. Точно также и кровь
содержит мелкие молекулы — вода, глюкоза, мочевина и крупные компоненты — фибриноген, форменные элементы крови.
В результате процесса фильтрации получается первичная моча, не содержащая крупных белков и форменных элементов крови (эритро- ,
лейко- , тромбоцитов), близкая по составу к плазме крови. В день у человека образуется 150-180 литров первичной мочи, представляете,
если бы мы столько выделяли?
Не могу ни акцентировать ваше внимание на том факте, что в первичной моче оказывается очень много нужного и полезного нашему
организму. Вдумайтесь: через фильтр профильтровывается не только мочевина, но и глюкоза, вода, витамины, минеральные
соли. Потерять такие ценные вещества для организма было бы большой оплошностью, и следующий этап исправляет допущенную организмом «ошибку»
при фильтрации.
После прохождения капсулы Боумены-Шумлянского первичная моча попадает в проксимальные (от лат. proximus — ближний) и дистальные (от лат. distare — отстоять, далеко находиться) канальцы нефрона.
Эти канальцы оплетает густая сеть капилляров, образованная разветвленной выносящей артериолой.
Все нужные организму вещества: вода, глюкоза, соли, аминокислоты, витамины, гормоны — всасываются из просвета канальца нефрона обратно
в кровеносную систему (в капилляры, оплетающие канальцы нефрона). Таким образом, организм «исправляет ошибку» допущенную на этапе фильтрации.
Мочевина, мочевая кислота, креатинин — побочные продукты обмена веществ — обратно не всасываются, продолжая продвигаться по канальцам нефрона.
Процесс реабсорбции активно идет в изогнутой части канальцев нефрона — петле Генле, из которой в ткани мозгового вещества почки активно выходят ионы Na+, создавая высокое осмотическое давление. Это, в свою очередь, способствует перемещению воды из
просвета канальцев нефрона в кровеносную систему, то есть ее всасыванию (реабсорбции).

Мы добрались до третьего финального этапа мочеобразования. На этапе секреции происходит транспорт веществ из крови (капилляров,
оплетающих канальцы нефрона) в просвет канальцев нефрона.
Секреции подвергаются лекарственные вещества, излишки ионов K+ и Na+. Их секреция в канальцы нефрона необходима для поддержания постоянства внутренней среды — гомеостаза.
В результате реабсорбции и секреции из первичной мочи образуется вторичная, объем которой составляет 1-1,5 литра в сутки.
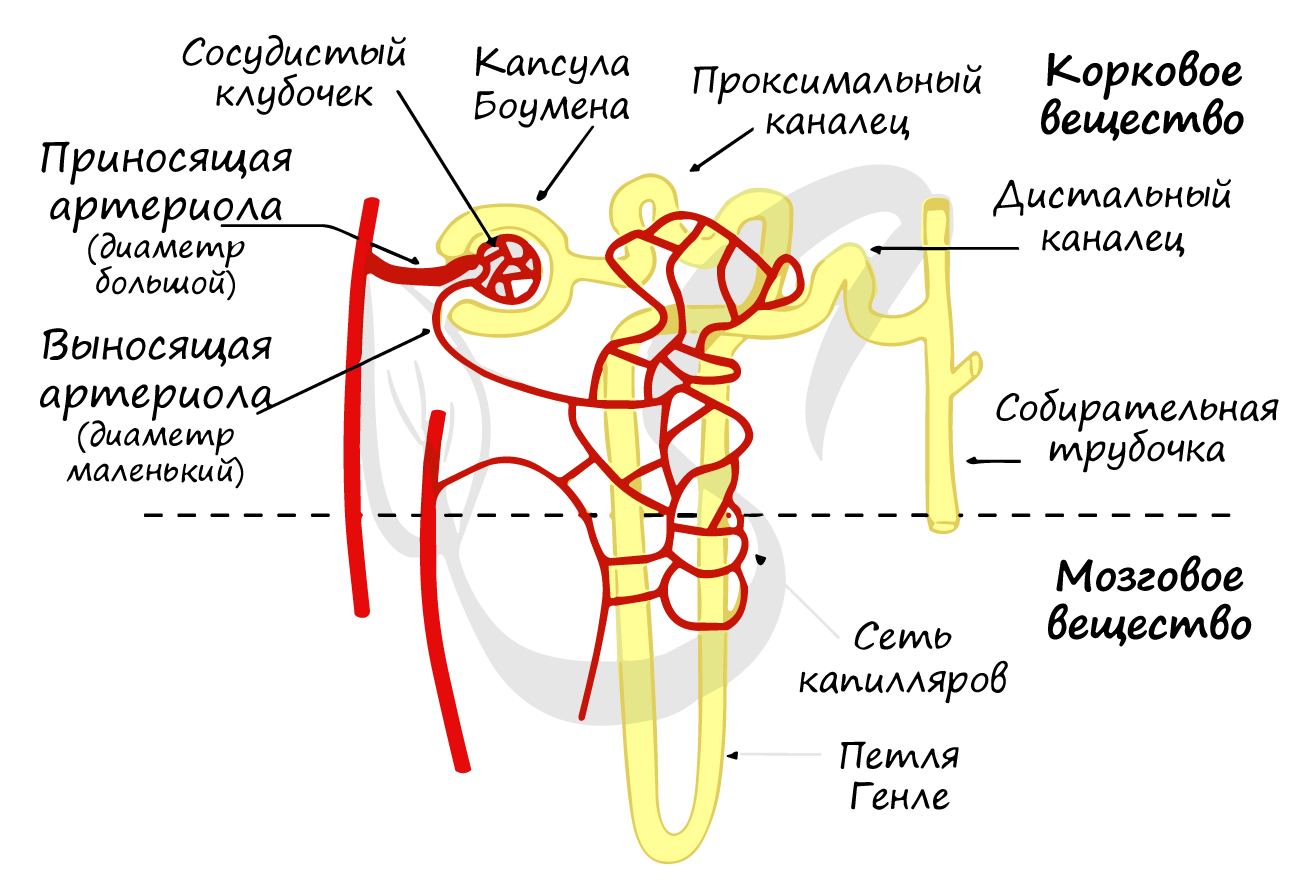
Вторичная моча через дистальные канальцы поступает в собирательные трубочки, куда таким же путем открываются дистальные канальцы
многих других нефронов. Собирательные трубочки открываются на верхушках почечных пирамид, из низ выделяется моча и поступает в малые,
затем в большие почечные чашечки, лоханку и далее в мочеточник.
Регуляция эритроцитопоэза и артериального давления
Эритроцитопоэз (от греч. «erythro — «красный» и poiesis — «делать») — процесс образования эритроцитов в красном костном
мозге. Оказывается, почки принимают в нем непосредственно участие, секретируя в кровь гормон эритропоэтин, который
способствует образованию эритроцитов в красном костном мозге.
При многих болезнях почек эритропоэтин в виде лекарственного препарата применяют, чтобы добиться увеличения числа
эритроцитов и устранить анемию (малокровие).

Почки регулируют уровень артериального давления, выделяя ренин (от лат. ren — почка). В конечном итоге это способствует
сужению кровеносных сосудов и росту артериального давления, которое играет ключевую роль в фильтрации — процессе мочеобразования.
Регуляция работы почек
На активность почек оказывают влияние симпатические и парасимпатические нервные волокна. Симпатические нервы способствуют
сужению почечных сосудов и повышению реабсорбции (количество мочи уменьшается), парасимпатические — расширению почечных сосудов и уменьшению реабсорбции (количество мочи увеличивается).
Также регуляция работы почек происходит гуморальным путем: с помощью гормонов гипофиза, надпочечников,
паращитовидных желез. Гипоталамус, тесно связанный с гипофизом, активирует высвобождение последним антидиуретического
гормона (АДГ) — вазопрессина, которые сужает почечные сосуды, тем самым повышая реабсорбцию.

Заболевания
Хорошо зная три основных процесса: фильтрацию,
реабсорбцию и секрецию, вы легко сможете предположить, на каком из этих этапов возникло нарушение работы почек.
Эффективность работы почек и их состояние можно легко оценить по анализу мочи. Сейчас вам следует ненадолго представить себя
врачом нефрологом 
Приходит заключение из лаборатории. В моче пациента найдены белок, кровь (эритроциты), гной (лейкоциты). Вам известно, что
форменные элементы крови и крупные белки в норме не проходят через «сито» на этапе фильтрации и не должны обнаруживаться в моче. Таким
образом, патология локализуется в почечном тельце.
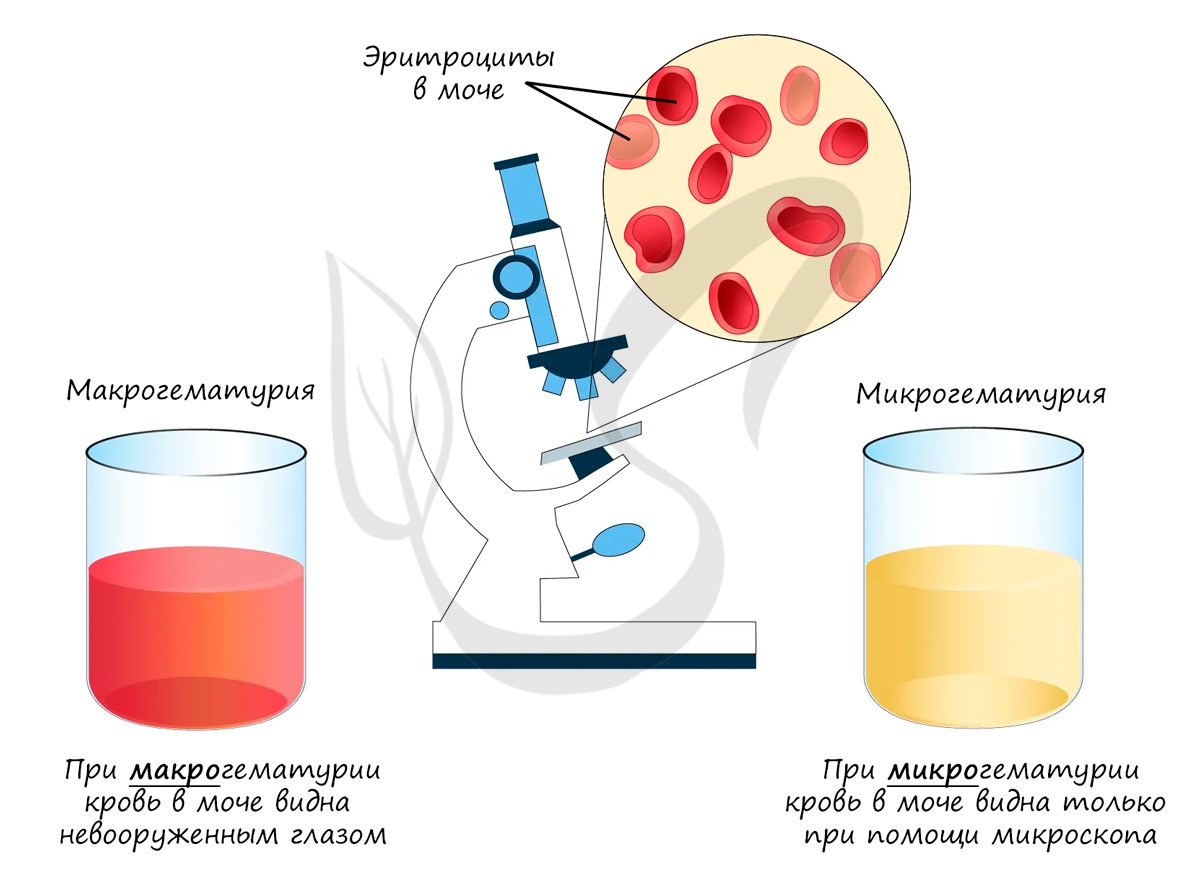
Следующее заключение, которое вам предстоит изучить, выглядит по-другому. Гноя, крови и белков в моче не обнаружено, однако
присутствует глюкоза (сахар). Такая находка может быть признаком сахарного диабета.
Зная, что глюкоза в норме профильтровывается на первом этапе — фильтрации, вы понимаете, что с фильтрацией все в порядке.
Нарушение возникло на следующей стадии — реабсорбции, ведь
глюкоза в норме должна всасываться обратно в кровь: ее не должно обнаруживаться в моче.
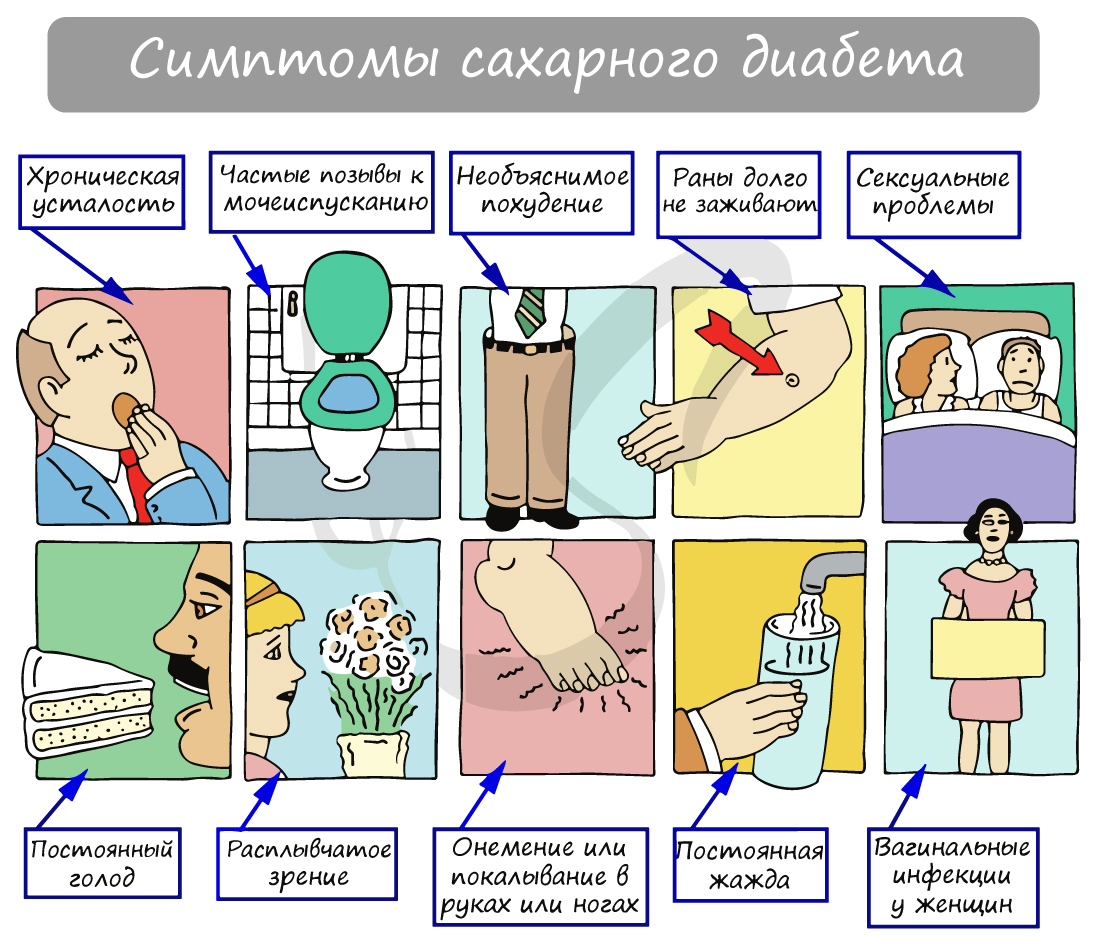
На схеме ниже вы можете наглядно увидеть симптомы, которые сопровождают сахарный диабет.
Этиологию (причины) и патогенез (механизм развития) сахарного диабета мы изучим, когда будем говорить об эндокринной
системе.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Главной железой эндокринной системы, является гипофиз. Этот орган имеет переднюю, промежуточную и заднюю долю, в каждой из которых вырабатываются гормоны.
Этот придаток мозга расположен внизу под мозгом в костном кармашке, называем из-за своей специфической формы турецким седлом. Гипофиз напрямую связан с другой мозговой областью – гипоталамусом, образуя гипоталамо-гипофизарную систему, регулирующую практически все функции организма.
Причины нарушения гормональной функции гипофиза
- Опухоли — это самая частая причина гипофизарных нарушений. Новообразование может быть злокачественным раком или доброкачественной аденомой.
- Травмы турецкого седла, в результате которых была нарушена целостность этой части мозга.
- Кровоизлияние, возникшее при разрыве кровеносных сосудов в гипофизарной области.
- Перенесенные мозговые инфекции — менингит, энцефалит.
- Последствия операций.
- Лучевое воздействие.
Консультация заведующей отделением в Университетской клинике, кандидата медицинских наук, врача-эндокринолога за 2000 рублей!
Гормоны передней доли
Адренокортикотропный (АКТГ) – вещество, регулирующее работу надпочечников. Его синтез контролирует ортикотропин-рилизинг-гормон (КРГ), вырабатываемый гипоталамусом и проникающий в гипофиз. Выделившийся АКТГ попадает в надпочечники и воздействует на их чувствительные клетки – рецепторы, стимулируя выработку многочисленных надпочечниковых гормонов.
Повышенный уровень АКТГ заставляет надпочечники работать в авральном режиме, производя большое количество гормональных веществ, особенно кортизола и кортизона. Это приводит к развитию болезни Иценко-Кушинга, при которой наблюдается ожирение с отложением жира на верхней части живота при достаточно худых ногах.
Симптомы повышенного адренокортикотропного гормона:
- Лицо больных становится лунообразным, красным;
- На теле появляются растяжки – стрии;
- Повышается давление;
- Кости становятся ломкими;
- Ранки плохо зарастают.
Диагностика и лечение в Университетской клинике уже на первом приеме!
Тиреотропный гормон ТТГ стимулирует работу щитовидной железы. Это вещество вырабатывается под действием тиреотропин-рилизинг-гормона, вырабатываемого гипофизом. Попадая на рецепторы железы, ТТГ стимулирует выработку щитовидных гормонов тироксина и трийодтиронина.
- При понижении выработки ТТГ у больных возникает гиперфункция щитовидки, сопровождающиеся повышением температуры, тревожностью, высоким давлением, выпучиванием глазных яблок, похудением.
- При повышении выработки ТТГ щитовидная железа работает плохо. Возникает гипофункция, называемая микседемой или слизистым отёком. Замедляются все обменные процессы в организме, в теле накапливается слизь, вода и токсины, что вызывает тяжёлые поражения организма, падение давления, угнетение работы органов.
Гонадотропные гормоны – фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ), вырабатываются под воздействием гонадотропин-рилизинг-гормона гиппоталамуса. ФСГ и ЛГ обеспечивают созревание яйцеклетки в яичниках и нормализуют менструальную функцию.
У мужчин это гормоны стимулируют выработку главного мужского гормона — тестостерона и созревание сперматозоидов внутри яичек. Гормональный дисбаланс этих двух веществ приводит к нарушению половой функции, женскому и мужскому бесплодию.
Соматотропный гормон (СТГ) — гормональное вещество, ответственное за рост организма. Больше всего его вырабатывается в детстве, когда ребенок быстро растет. Во взрослом возрасте секреция СТГ снижается.
Недостаток соматотропного гормона вызывает низкорослость (карликовость), а избыток — гигантизм. Особенно опасна гиперфункция этого гормона, возникающая в зрелом возрасте. В это время больной уже не может расти, поэтому у него возникает увеличение кистей, стоп, некоторых частей лица. Такое заболевание называется акромегалией.
Недостаток соматотропного гормона также приводит к нарушению жирового обмена и недостатка белка.
Пролактин — гормональное вещество, отвечающие за подготовку груди к лактации и кормлению.
Увеличение его концентрации вне лактационного периода называется галактореей и сопровождается выделением молока из сосков. У больных возникает лактационная аменорея, как при кормлении грудью, что не даёт возможность забеременеть. Женщины, больные галактореей, мучаются от постоянных выделений из груди.
Уникальный комплексный подход к женским проблемам, связанным с эндокринной гинекологией и общей эндокринологией. Записывайтесь в Университетскую клинику!
Гормоны задней доли
Гипофиз вырабатывает множество гормонов задней доли, часть которых недостаточно изучена. Сильнее всего влияют на организм человека следующие гормональные вещества, образующиеся в этой части мозгового придатка:
- Вазопрессин – антидиуретический гормон, регулирующий водный обмен, чувство жажды и почечную функцию. Под его воздействием почки начинают усиленно всасывать воду. Нормальная концентрация вазопрессина способствует формированию чувства насыщения жидкостью и правильного питьевого поведения. При недостатке развивается несахарный диабет — заболевание, при котором выделяется большое количество урины с низкой плотностью. Больной постоянно хочет пить и за сутки выделяет до 25 литров мочи.
- Окситоцин — гормон средней гипофизарной доли, играющий важную роль в процессе родов. При его недостатке возникает слабость родовой деятельности. Благодаря этому гормональному веществу в организме запускается процесс выработки грудного молока.
Гормон средней доли гипофиза
В этой небольшой гипофизарной части, представляющей собой тонкую прослойку между задней и передней долями, вырабатывается меланоцитстимулирующий гормон, защищающий клетки кожи от воздействия солнца.
Это вещество действует на клетки-миелоциты, стимулируя выделение пигмента — защитного механизма, направленного против разрушительного действия УФ-излучения. Именно на этом воздействии основан эффект загара.
Избыточное выделение выделения этого гормона приводит к образованию пигментных пятен. Такая ситуация возникает во время беременности и приеме некоторых лекарств, когда кожа приобретает повышенную чувствительность к солнечным лучам.
Отсутствие этого гормона, как правило, связано с генетическими аномалиями, Больные, имеющие белую кожу, не могут загорать, а сразу получают ожоги, попав на солнце. К сожалению, изменит генетику невозможно
Существует еще одна болезнь — гипопитуитаризм, при котором нарушается синтез всех гормонов гипофиза. В этом случае у детей наблюдается задержка развития, а у взрослых – тяжёлое поражение надпочечников и щитовидной железы, бесплодие, половая и менструальная дисфункция.
Диагностика и лечение гормональных нарушений гипофиза
Вначале проводится диагностика заболевания. Для этого пациент сдает анализы на гормоны, концентрация которых, возможно, была нарушена. В зависимости от симптомов, проверяется содержание тиреотропного, адренокортикотропного, соматотропного, гонадотропных гормонов, пролактина.
Это позволить выяснить, какое гормональное вещество вырабатывается неправильно.
При подозрении на гипофизарные патологии проводится томография гипофиза. Назначается УЗИ других эндокринных органов — щитовидной железы, надпочечников. Проводится УЗИ малого таза и мошонки для выяснения состояния яичек и яичников.
После постановки диагноза проводится лечение нарушений. Назначается гормонозаместительная терапия, при которой недостающие гормоны замещают искусственными гормоносодержащими средствами. При гиперфункции показаны лекарства, подавляющие избыточное воздействие гормонов.
Решение любых эндокринных проблем для женщин и мужчин в Университетской Клинике в Санкт-Петербурге!
С помощью современных медицинских технологий можно нормализовать гормональный фон при различных заболеваниях гипофиза. Для этого нужно только посетить клинику, обследоваться и выполнять лечение, назначенное эндокринологом.
Эндокринная система вместе с нервной составляет единое целое. Объединяющим и координирующим центром нейроэндокринной системы является область промежуточного мозга — гипоталамус, который не только проводит нервные импульсы, но и секретирует различные физиологические вещества [1].
Гипоталамус расположен на основании мозга и ограничен спереди перекрестом зрительных нервов, сзади — маммилярными телами, по бокам — расходящимися трактами зрительных нервов. Сверху в гипоталамическую область внедряется третий желудочек мозга, превращая гипоталамус в парный орган с симметричным расположением клеточных образований. В основании гипоталамуса располагается срединное возвышение, переходящее в ножку гипофиза.
Эндокринные функции гипоталамуса осуществляют преимущественно его передняя и медиальная части. Нервные клетки гипоталамуса группируются в многочисленные ядра, часть которых обладает секреторными свойствами. Крупноклеточные ядра переднего гипоталамуса (супраоптические и паравентрикулярные) связаны нервными волокнами с задней долей гипофиза. Многочисленные ядра медиобазального и части заднего гипоталамуса, часть паравентрикулярных, вентромедиальные и аркуатные — продуцируют нейросекрет в систему воротных вен гипофиза. Многочисленные комиссуральные пути гипоталамуса обеспечивают взаимодействие между нейроэндокринными ядрами. Нервные клетки паравентрикулярных и аркуатных ядер имеют многочисленные контакты с вышележащими структурами ЦНС.
Роль гипоталамуса в регуляции эндокринных функций была выяснена в 1955 г. Гиллемин впервые показал, что гипоталамический экстракт при введении его животным стимулирует секрецию гипофизом АКТГ. В 60-х годах XX века интенсивно исследовали влияние экстрактов гипоталамуса и срединного возвышения на секрецию гипофизом гормона роста (соматотропин, СТГ) и тиреотропного гормона (тиреотропин, ТТГ). Благодаря достижениям аналитической химии пептидов, разработке радиоиммунологических методов определения гормонов, развитию техники культивирования клеток сделан революционный скачок в исследованиях гипоталамической регуляции функций эндокринной системы.
Наличие в гипоталамусе специфических рецепторов к периферическим гормонам эндокринных желез и тропным гипофизарным гормонам определяет его особое положение в системах обратной связи. В гипоталамусе происходит переключение информации с нервно-медиаторного на нейрогормональный путь, которой составляют либерины и статины: кортиколиберин (АКТГ-рилизинг гормон, КРГ), люлиберин (гонадолиберин, ЛГ/ФСГ-рилизинг-гормон, ГнРГ), тиролиберин (ТРГ), соматолиберин (РГГР), соматостатин, меланолиберин, а также дофамин (ДА) и энкефалины, оказывающие влияние на функции гипофиза.
Гипоталамус является высшим вегетативным центром, осуществляющим сложную интеграцию и различных внутренних систем. В организме нет ни одной функции, к регуляции которой гипоталамус не имел бы отношения: он играет существенную роль в поддержании оптимального уровня обмена веществ (белкового, углеводного, жирового, водного и минерального) и энергии, в регуляции температурного баланса организма, деятельности пищеварительной, сердечно-сосудистой, выделительной, дыхательной и эндокринной систем.
Нейроэндокринологи имеют полное право рассматривать гипоталамус как главный нейроэндокринный орган, который осуществляет взаимосвязь между ЦНС и железами внутренней секреции. Он является интегрирующим звеном, пультом управления, на котором замыкаются все пути между ЦНС и эндокринной системой. Естественно, возникает вопрос, каким образом маленькая структура промежуточного мозга справляется со столь многочисленными функциями.
Для эндокринологов, в первую очередь, важен вопрос о регуляции гормональной системы.
Связь между гипофизом, который является основным продуцентом всех тропных гормонов (АКТГ, ТТГ, ЛГ, ФСГ, СТГ, пролактин) и гипоталамусом осуществляется через портальную систему сосудов, а также через гипоталамо-гипофизарный тракт — самый короткий, но хорошо очерченный пучок аксонов нейронов гипоталамуса. Волокна их берут начало в супраоптическом и паравентрикулярных ядрах и проходят через гипофизарную ножку к нейрогипофизу.
Биохимиками было показано существование в гипоталамусе специфических веществ, которые синтезируются нервными клетками и освобождаются в капилляры портальной системы, достигая передней доли гипофиза. На сегодняшний день выделено и охарактеризовано более 10 гипоталамических нейрогормонов, каждый из которых обладает специфическим влиянием (стимуляцией или торможением) секреции того или иного тропного гормона гипофиза. Такие соединения получили название ингибирующих и рилизинг-гормонов (либерины и статины), обладающие высокой специфичностью действия и чрезвычайно высокой биологической активностью. Установлена и подтверждена химическим синтезом их структура.
Основной точкой приложения гипоталамических рилизинг-гормонов являются клетки гипофиза, и некоторое время считалось, что каждый гормон стимулирует один тип клеток аденогипофиза, который в свою очередь синтезирует лишь один тропный гормон.
В дальнейшем было показано, что в ряде случаев гипоталамические гормоны стимулируют секрецию нескольких гипофизарных гормонов. Например, ТРГ усиливает выделение и ТТГ, и ПРЛ. ГнРГ способствует секреции ЛГ и ФСГ; соматостатин угнетает секрецию и гормона роста, и ТТГ. Каждый клеточный элемент аденогипофиза подвергается действию многих регуляторных факторов, и клетки в аденогипофизе не строго специализированы: в одной клетке могут синтезироваться несколько гормонов, например ЛГ и ФСГ, АКТГ и β-липотропин, СТГ и ПРЛ, но не ТТГ или ЛГ. Бифункциональность некоторых гормонов объясняется по-разному. Способность ГнРГ вызывать секрецию как ЛГ, так и ФСГ, причем несовпадающую по времени, определяется разной чувствительностью гонадотрофов, секретирующих ЛГ или ФСГ, а также длительностью воздействия с учетом влияния половых стероидов на гипофизарные клетки в разные стадии полового цикла. Большие концентрации эстрогенов в плазме, предшествующие овуляторному выбросу ЛГ, увеличивают чувствительность гипофиза к ГнРГ, а минимальные количества эстрогенов и прогестерона, секретируемого после овуляции, напротив, снижают эту чувствительность. Секреция ФСГ более чувствительна к ингибирующему эффекту эстрогенов. Нельзя исключить наличие в аденогипофизе и двух видов рецепторов. Одни из них характеризуются высоким сродством к ГнРГ и низкой связывающей способностью; за их счет осуществляется быстрая секреция ЛГ; вторые — более низким сродством к ГнРГ, но большей силой связывания, что и определяет более медленное освобождение ФСГ. Возможно существование двух различных нейрогормонов — ЛГ-РГ и ФСГ-РГ.
Анатомия и физиология гипофиза
Гипофиз расположен в турецком седле в основании черепа. Сверху он отделен от мозга выростом твердой мозговой оболочки. Гипофиз состоит из трех долей: передней, задней и средней (промежуточной). Последняя, как правило, анатомически не обособлена и вместе с передней входит в состав аденогипофиза, который составляет около 80% массы железы; задняя доля — нейрогипофиз — анатомически и функционально объединена со срединным возвышением, являющимся частью гипоталамуса. Аденогипофиз образуется из задней стенки ротовой полости зародыша (карман Ратке), задняя доля — из дивертикула дна третьего желудочка мозга.
Структурно-функциональная связь гипофиза с гипоталамусом осуществляется нервным и гуморальным путем. Нервные волокна из крупноклеточных гипофизотропных ядер гипоталамуса (паравентрикулярного и супраоптического) через срединное возвышение и ножку гипофиза достигают задней его доли. По аксонам этих клеточных ядер в заднюю долю гипофиза поступают окситоцин и вазопрессин. На стенках капилляров срединного возвышения оканчиваются терминали пептидергических волокон. Аксоны гипоталамических нейронов, идущие к аденогипофизу, прерываются на уровне срединного возвышения, где и происходит секреция гипоталамических статинов и либеринов.
Нейрогормоны попадают в переднюю долю гипофиза с кровотоком по системе воротных вен гипофиза. Стенки каппиляров, образуемых ветвями верхних гипофизарных артерий в срединном возвышении, проницаемы для рилизинг-гормонов. Концентрация последних в крови воротных вен гипофиза во много раз выше, чем в периферической крови.
Кровоток через переднюю долю гипофиза значительнее, чем через любой другой орган, что, наряду с высоким содержанием нейрогормонов в крови сосудов гипофиза, создает оптимальные условия для регуляции функций аденогипофиза и зависимых от него эндокринных желез. Задняя доля гипофиза снабжается кровью нижних гипофизарных артерий.
Являясь анатомически целостным органом, гипофиз образован двумя онтогенетически разными образованиями: передним (железистым) и задним (нервным). Клетки аденогипофиза разделяются по своей гистологической окраске на базофилы, ацидофилы (эозинофилы), хромофобы. Однако выявление специализированных клеток—лактотрофов, тиреотрофов, соматотрофов, кортикотрофов, гонадотрофов, продуцирующих соответствующие гормоны, осуществляется иммуноцитохимическим методом, выявляющим специализацию клеток с помощью высокоспецифических антител к конкретному гормону. Большую часть популяции аденогипофизоцитов составляют лактотрофы и соматотрофы. Обнаруживаются и камбиальные элементы, способные при необходимости дифференцироваться в те или иные специализированные клетки.
Гипофиз как центральный орган эндокринной системы получает афферентную и эфферентную информацию. Из срединного возвышения по сосудам портальной системы в аденогипофиз поступает кровь, содержащая гипоталамические нейрогормоны. К гипофизу поступает также большое количество гормонов периферических эндокринных желез и биологически активных метаболитов. Переработка этой информации позволяет гипофизу осуществлять тонкую интегральную функцию и посылать периферическим эндокринным железам адекватные, строго дозированные регуляторные сигналы путем выделения в кровь тропных гормонов. Периферические эндокринные железы, реагируя на тропные гормоны гипофиза, секретируют в кровь собственные гормоны, регулирующие биохимические процессы в тканях-мишенях. Циркулирующие в крови гормоны и биологически активные метаболиты контактируют со всеми структурами нейроэндокринной системы: ЦНС, гипоталамусом, гипофизом, другими железами внутренней секреции, клетками АПУД-системы (которые присутствуют в различных органах и тканях и продуцируют полипептидные гормоны за счет поглощения и декарбоксилирования предшественников аминов).
Главным в механизме действия гипоталамических гормонов является их избирательное взаимодействие с рецепторами, локализованными на плазматических мембранах аденогипофизарных клеток; конформационные изменения гормон-рецепторных комплексов приводят к изменению активности ферментных систем клеточных мембран. Посредником в дальнейшей передаче гормонального сигнала, направленного на секрецию и синтез аденогипофизарных гормонов, является цАМФ, которым активирует цАМФ-зависимую протеинкиназу. Изменение проницаемости плазматических мембран, происходящее под влиянием рилизинг-гормонов, способствует проникновению в клетку экзогенного Са2+, необходимого для секреции тропных гормонов.
Вопрос и о локализации биосинтеза гипоталамических гормонов окончательно не решен. Имеются данные об их образовании в нервных окончаниях — синаптосомах, так как именно в них обнаруживается скопление этих гормонов и биогенных аминов. В настоящее время биогенным аминам отводится главная роль в регуляции секреции и синтеза гипоталамических гормонов. В гипоталамусе присутствуют специфические рецепторы гормонов и периферических аминорецепторов.
Воспринимая регуляторные сигналы сверху, железа ускоряет или тормозит выделение собственного гормона и, более того, она получает информацию о результатах действия ее гормонов на периферии. Механизм такой организации эндокринной железы, называемой в литературе принципом обратной связи (положительной и отрицательной), был впервые сформулирован М.М. Завадовским (1935). Он обеспечивает надежность работы нейроэндокринной системы в организме. Классическим примером может служить функционирование щитовидной железы, когда ТТГ стимулирует секрецию тиреоидных гормонов, которые в свою очередь, достигнув высоких концентраций в крови, тормозят секрецию гипофизом ТТГ. Обратная связь реализуется на четырех уровнях (ЦНС, гипоталамус, гипофиз, сама железа), и в ней различают длинные, короткие и ультракороткие звенья. Эндокринные регуляторы — гормоны дистантного действия — достигают своих целевых объектов с кровотоком.
Концентрация и ритм секреции гормонов определяют направленность действия и точку приложения в организме. Так, эстрогены, стимулируя секрецию пролактина гипофизом, увеличивают выделение ДА гипоталамусом, что приводит к торможению лактотропной функции гипофиза. На телах нейронов, синтезирующих ДА, обнаружены рецепторы эстрадиола. В этом процессе участвуют и метаболические регуляторы, такие как глюкоза [10].
В одной и той же железе имеется возможность обмена химической информацией между клетками, в которой принимают участие и гормоны. Показано, в частности, наличие рецепторов инсулина на альфа-клетках, секретирующих глюкогон (паракринная регуляция). Биологически активные вещества, в том числе гормоны, могут выделяться и связываться рецепторами той же клетки (аутокринная регуляция).
Чувствительность тканей к конкретному гормону определяется количеством специфических рецепторов, связывающих этот гормон. Высокие концентрации гормона, связывая большую часть рецепторов, снижают их биосинтез и уровень активных форм рецепторов, что предохраняет клетки-мишени от чрезмерного гормонального воздействия. Возможна и ситуация, когда гормон увеличивает концентрации собственных рецепторов.
Гормон может влиять не только на свои рецепторы, но и на рецепторы других гормонов. Так, ПРЛ стимулирует образование рецепторов ЛГ и ФСГ в гонадах, тиреоидные гормоны влияют на уровень эстрогенных и катехоламиновых рецепторов и т.д. Обратная связь реализуется довольно быстро, что обеспечивает постоянный относительный гомеостаз в организме; замедление или ускорение этого процесса свидетельствует о развитии патологического процесса.
Нарушения гормональной рецепции ведут к развитию патологического процесса (например, инсулинорезистентность при ожирении и сахарном диабете 2-го типа).
В срединном возвышении обнаружены многочисленные синаптические и аксональные контакты нейронов, вырабатывающих нейропептиды, а также анастомозы между капиллярами сосудов, идущими к аденогипофизу и нейрогипофизу, что и обеспечивает тесное взаимодействие различных эндокринных подсистем (гипоталамус—гипофиз—кора надпочечников, гипоталамус—гипофиз—щитовидная железа, гипоталамус—гипофиз—гонады и др.).
Главным достижением нейроэндокринологии последних лет является доказательство причастности нейромедиаторов к нейроэндокринной интеграции действия нейросекреторных нейронов, регулирующих секрецию тропных гормонов гипофиза. К ним относятся норадреналин (НА), адреналин (А), ДА, серотонин, гистамин, гамма-аминомасляная кислота (ГАМК), ацетилхолин, соматостатин, ТРГ, КРГ, соматолиберин и многие другие соединения. Все эти вещества несут нейрогенную информацию, необходимую для нормального функционирования нейросекреторных нейронов, регулирующих секрецию тропных гормонов гипофиза. Прежде всего это люлиберинпродуцирующие нейроны, регулирующие выделение ЛГ и ФСГ, нейроны, секретирующие пролактинингибирующий гормон, ТРГ, вазоактивный интестинальный полипептид, а также ДА. Полное понимание нейроэндокринного контроля требует точного знания топографии нейросекреторных и обычных проводниковых нейронов. Необходимо определить главные проекции нейронов и идентифицировать нейромедиаторы, содержащиеся в них. Обнаружены синапсы между норадренергическими нейронами и ГАМК-содержащими нейронами в этой области. Следует отметить также возможность несинаптического взаимодействия катехолсодержащих нейронов в ЦНС.
Дофаминергические нейроны, иннервирующие гипоталамус, имеют клеточные тела в трех областях мозга: во-первых, это тубероинфундибулярные нейроны, которые составляют 3—5% клеточных тел нейронов аркуатной области и обозначаются как А12. Терминали этих нейронов обнаружены в срединном возвышении в тесном контакте с первичными капиллярами гипофизарного портального сплетения. Эти нейроны выделяют большое количество ДА в портальную кровь и играют ведущую роль в регуляции секреции ПРЛ, а также ГнРГ. Две другие группы дофаминергических нейронов расположены в каудальном таламусе, заднем гипоталамусе и перивентрикулярных ядрах. Диффузное распределение дофаминергических нейронов в гипоталамусе затрудняет изучение их роли в регуляции секреции гонадотропинов и других тропных гормонов.
Изложение контрольных функций адренергических нейронов в секреции гонадотропинов целесообразно начать с их роли в регуляции пульсирующего выделения ЛГ, которая определяется квантовым выделением ГнРГ. Большинство исследователей, занимающихся этой проблемой, приходят к выводу, что норадренергические нейроны в физиологических условиях включаются в этот процесс, хотя на отдельных нейронах обнаружены адренергические рецепторы, активация которых вызывает торможение пульсирующего выделения ЛГ. Направленность действия ДА-нейронов зависит, скорее всего, от уровня половых гормонов.
При изучении роли биогенных аминов в регуляции овуляторного выброса гонадотропинов особое внимание обращается на значение половых гормонов в активации или торможении катехолсодержащих нейронов в системе обратной связи. На модели овариэктомированных крыс с имплантацией эстрадиола показано, что выброс ЛГ каждые 24 ч сопровождается увеличением скорости обмена НА в преоптической и аркуатной областях и супрахиазматических ядрах, а также срединном возвышении. Аналогичные данные получены и в опытах на интактных животных, у которых отмечено увеличение скорости обмена НА в преоптической области во 2-й половине проэструса, т.е. во время овуляторного выброса ЛГ, тогда как в другие стадии цикла подобных изменений в обмене НА в этой области не зарегистрировано. О негативном действии эстрадиола на обмен НА свидетельствуют эксперименты на овариэктомированных животных, у которых скорость обмена НА в преоптической области увеличивалась через 3 сут, а введение эстрадиола приводило к снижению скорости его обмена в этой области и срединном возвышении уже через 3 ч. Действие эстрогенов на обмен НА может осуществляться как непосредственно на уровне норадренергических нейронов, содержащих эстрогенные рецепторы, так и через опиоидные или ГАМК-содержащие интернейроны, которые также содержат рецепторы стероидных гормонов. Скорость обмена адреналина в некоторых областях гипоталамуса также увеличивается одновременно с овуляторным выбросом ЛГ. Это касается, главным образом, медиобазального гипоталамуса и преоптической области. Возникает вопрос о степени сродства адренергических рецепторов нейронов к половым гормонам в ходе менструального цикла.
Влияние половых гормонов на активность дофаминергических нейронов проявляется менее отчетливо. Дело в том, что изменение состояния тубероинфундибулярных дофамин-содержащих нейронов теснее связано с секрецией ПРЛ. Введение эстрогенов повышает уровень ПРЛ, который в свою очередь усиливает обмен ДА в этих нейронах. Показано также наличие рецепторов к эстрадиолу в дофаминергических клеточных телах нейронов аркуатного ядра и повышение скорости обмена ДА в этом ядре и срединном возвышении во второй половине стадии проэструса. В преоптической области изменения дофаминергической активности в это время не наблюдается. Овариэктомия незначительно влияет на обмен ДА в некоторых областях гипоталамуса, тогда как введение эстрадиола вызывает снижение обмена ДА в преоптической области и срединном возвышении и увеличение в медиобазальном гипоталамусе.
Имеется ряд сообщений о влиянии катехоламинергических агентов на овуляторный выброс ЛГ в проэструсе и вызванный эстрогенами выброс ЛГ. Начало этим исследованиям было положено в 1950 г. Сойером, который показал, что α-адренергические антагонисты блокируют овуляцию у крыс. В дальнейшем были исследованы более специфические фармакологические агенты, такие как α-метил-р-тирозин и диэтилдитиокарбомат, блокирующие синтез НА и А соответственно. Они тормозили овуляторный выброс ЛГ. Блокада α-адренергических рецепторов также прерывает овуляцию, причем наиболее эффективным является препарат празозин, избирательно блокирующий подтип α1-рецепторов, тогда как блокада другого подтипа рецепторов (α2) пипероксаном неэффективна.
Приведенные данные позволяют утверждать, что норадренергические и адренергические нейроны включаются в стимуляцию овуляторного выброса ЛГ, и действие их опосредуется через α1-адренергические рецепторы, локализованные в основном в медиобазальной преоптической области гипоталамуса. Роль дофаминсодержащих нейронов в регуляции овуляторного выброса ЛГ спорна: введение относительно специфического антагониста ДА пимозина в утренние часы проэструса снижало выброс ЛГ у крыс во второй половине дня. Этот же препарат, введенный женщинам за 2 ч до ожидаемого выброса ЛГ в середине менструального цикла, снижает величину выброса. В другом случае внутрижелудочковое введение ДА в проэструсе у крыс способствует увеличению уровня ЛГ в крови. Исследования in vitro также дают спорные результаты. Так, перфузия ДА фрагментов медиобазального гипоталамуса самцов крыс увеличивает выделение ГнРГ, которое блокируется введением антагониста α-адренергических рецепторов (фентоламина), но не антагониста ДА (пимозина). ДА обладает способностью ускорять выделение НА из терминалей срединного возвышения, но не влияет на обратный захват и обмен НА. Противоречивые данные затрудняют интерпретацию роли и значения ДА в решении системы ГнРГ—ЛГ.
Серотонинергическая система ЦНС представляет собой популяцию нейронов ствола мозга, которые берут начало в ядрах шва среднего мозга. Аркуатные ядра получают плотную серотонинергическую иннервацию, тесно контактирующую с дофаминергическими клеточными телами аркуатного ядра и медиальной зоны инсепта. Описаны контакты между нейрональными элементами, содержащими ГнРГ и серотонин, в преоптической области, концевой пластинке и срединном возвышении. Серотонин обнаружен в нервных окончаниях, локализованных вокруг больших кровеносных сосудов аденогипофиза, а также в секреторных гранулах гонадотрофов. Причастность серотонина к регуляции гонадотропной функции гипофиза доказана многочисленными исследованиями. Он может как стимулировать, так и тормозить эту функцию в зависимости от гормонального фона. Действие серотонина на секрецию ЛГ и овуляцию опосредовано регуляцией секреции ГнРГ нейросекреторными нейронами. Серотонинергическая система является одной из многих нейросекреторных систем, тесно связанных с гонадотропинрегулирующей системой преоптикопереднего и медиобазального отделов гипоталамуса и срединного возвышения. Половые гормоны модулируют активность этой нейротрансмиттерной системы. Анализ роли нейромедиаторов адренергического ряда в регуляции гонадотропной функции гипофиза позволяет утверждать, что НА следует рассматривать в качестве ведущего агента в регуляции секреции ЛГ, основной точкой приложения которого является преоптическая область. ДА реализует свой эффект через аркуатную область гипоталамуса, а серотонин играет роль синхронизирующего агента.
Новый класс соединений, выделяемых в группу пептидных нейромедиаторов, вносит свой вклад в наши представления об участии нервной системы в регуляции эндокринных функций гипофиза. Обнаружение регуляторных пептидов, общих как для нервной, так и для эндокринной систем, вызвало революцию в наших представлениях. Возникло новое направление исследований — психонейроэндокринология.
Практически каждый из перечисленных выше нейропептидов причастен к регуляции секреции гонадотропинов, ПРА, АКТГ, ТТГ. Большинство из них обнаружено в медиобазальном гипоталамусе. Нейропептиды, выделяясь в гипофизарную портальную систему, действуют на несколько типов аденогипофизарных клеток и, кроме того, взаимодействуют с многими нейромедиаторами непептидной природы, поступающими в медиобазальный гипоталамус из других структур, что в свою очередь обеспечивает их прямое или опосредованное действие на гормональный контроль.
Гипоталамические нейроны, продуцирующие нейропептиды, составляют общую систему. Большинство их клеточных тел локализовано в паравентрикулярных ядрах, медиальной перивентрикулярной области и аркуатных ядрах. Незначительная часть таких нейронов обнаружена в преоптической области и супрахиазматических ядрах. Бóльшая часть всех этих нейронов заканчивается в области срединного возвышения. Аксональные коллатерали иннервируют ряд гипоталамических и экстрагипоталамических структур. Нервные клетки паравентрикулярных и аркуатных ядер в свою очередь имеют многочисленные контакты с большим числом других структур ЦНС, что и определяет их стратегическую позицию в координации гормональной регуляции, а также ряда поведенческих реакций. Особенно это касается полового поведения, требующего синхронизации поведенческих компонентов с процессами менструального цикла. Окончания нейронов, синтезирующих нейропептиды, тесно контактируют не только с перикарионами, вырабатывающими нейротрансмиттеры, но и с нейронами, синтезирующими нейропептиды. Например, ГнРГ-продуцирующие нейроны и их волокна могут оканчиваться на аналогичных клеточных телах; имеют место также аксо-аксональные контакты.
Учитывая большое число нейропептидов, принимающих участие в регуляции репродуктивной системы, целесообразно сгруппировать их по месту синтеза. Такими группами могут быть: 1) нейропептиды, продуцируемые нейронами, локализованными, главным образом, в преоптической области (соматостатин, ГнРГ, тахикинины, нейротензин, предсердный натрийуретический гормон); 2) нейропептиды, продуцируемые нейронами аркуатной области (панкреатический нейропептид, пептид YY, нейропептид Y); 3) нейропептиды, синтезирующиеся в перикарионах паравентрикулярных или супраоптических ядер (ТРГ, КРГ, холецистокинин, вазопрессин, окситоцин, ангиотензин, брадикинин, бомбезин); 4) гастроинтестинальные пептиды (ВИП, гастроинтестинальный пептид); 5) семейство опиоидных пептидов.
Механизм действия этих нейропептидов как на гипоталамическом, так и на гипофизарном уровне можно проследить на примере модуляции секреции гонадотропинов, ПРЛ, окситоцина, т.е. тех гормонов, которые имеют отношение к репродуктивной функции. Например, соматостатин, который обнаружен во многих структурах ЦНС и главным действием которого является угнетение продукции гормона роста и частично ТТГ и ПРЛ, способен изменять активность нейромедиаторных систем мозга, вызывая блокаду секреции ГнРГ.
Группа классических пептидов (тахикинины А и Б, субстанция Р) стимулирует выделение ПРЛ и тормозит выделение гормона роста. Пептид нейротензин широко распространен в ЦНС и проявляет свой эффект за счет стимуляции секреции инсулина, ингибиции секреции глюкагона и модуляции гастроинтестинальной перистальтики. Внутрижелудочковое введение нейротензина снижает уровень ЛГ в крови, что делает возможным его участие в контроле гонадотропной функции гипофиза. Предсердный натрийуретический гормон угнетает выделение вазопрессина и может стимулировать выделение ЛГ и пролонгировать действие ГнРГ. Семейство панкреатических пептидов также причастно к функционированию репродуктивной системы, они чаще всего блокируют секрецию ЛГ и снижают частоту пульсации ГнРГ в срединном возвышении.
Пептиды, синтезирующиеся в паравентрикулярных и супрахиазматических ядрах, основными из которых являются вазопрессин и окситоцин, наиболее активно влияют на репродуктивную систему. Основная гормональная функция вазопрессина на уровне аденогипофиза — стимуляция выделения АКТГ за счет усиления действия КРГ. Имеются данные о тормозном влиянии вазопрессина на секрецию ПРЛ за счет повышения обмена ДА в тубероинфундибулярных нейронах. Стимулирующий эффект вазопрессина на выделение ПРЛ может опосредоваться опиатными нейронами. ТРГ, синтезирующийся в паравентрикулярных ядрах, помимо своего прямого действия на секрецию ТТГ, способен стимулировать выделение ПРЛ и гормона роста, и его эффект усиливается под влиянием эстрогенов. ТРГ также оказывает влияние на обмен нейромедиаторов в мозге. Из группы гастроинтестинальных пептидов следует выделить вазоактивный интестинальный полипептид (ВИП), основное нейроэндокринное действие которого сводится к стимуляции выделения ПРЛ, а также гормона роста и ТТГ. Этот эффект является эстрогензависимым.
Особое внимание в регуляции гонадотропной функции гипофиза в последние годы уделяется опиоидным пептидам. Главным действием опиоидов является их способность повышать выделение ПРЛ и гормона роста и блокировать секрецию ЛГ, ФСГ и ТТГ. Они специфически ингибируют овуляторный выброс ЛГ и ФСГ. Опиаты способны регулировать амплитуду и частоту пульсации ЛГ за счет модуляции гипоталамического пейсмекера, контролирующего периодичность активации ГнРГ-продуцирующих нейронов. Влияние опиатов на секрецию ЛГ опосредовано повышением секреции ПРЛ. Опиаты блокируют тоническую секрецию ГнРГ на фоне высокого уровня ПРЛ. Регуляция процессов биосинтеза и секреции ПРЛ, как и ЛГ, опиоидными пептидами осуществляется через специфические рецепторы.
Приведенные выше данные о влиянии различных нейромедиаторов адренергической природы и нейропептидов ставят вопрос о том, каким образом разные вещества с различными механизмами действия координируют работу репродуктивной системы. В ряде случаев отмечен синергизм их действия как на гипоталамическом, так и на гипофизарном уровне, в других — антагонизм их влияния. Можно отметить параллелизм в действии различных медиаторов, вырабатываемых в одних и тех же структурах. В настоящее время наблюдается быстрый прогресс в изучении химии и нейроанатомии нейросекреторных нейронов, участвующих в регуляции репродуктивной функции.
В настоящее время цельное представление о функционировании гипоталамо-гипофизарной системы распалось на отдельные направления исследований с использованием новых специфических методических приемов. Интенсивно используются достижения смежных дисциплин, таких как иммунология. Показана тесная взаимосвязь нейроэндокринной и иммунной систем в различные периоды жизни и при различных физиологических состояниях. Например, с возрастом снижается реакция иммунной системы и параллельно снижается активность гормона роста. При беременности снижается секреция пролактина и окситоцина и повышается секреция половых гормонов — эстрогенов, прогестерона. Доказана взаимосвязь нервной, иммунной и эндокринной систем регуляции секреции инсулина. Разработка фундаментальных аспектов нейроэндокринологии открывает широкие перспективы лечения нарушений репродуктивной системы, заболеваний щитовидной железы или надпочечников гормональными средствами или препаратами, обладающими нейрогенными свойствами. Такими препаратами могут быть производные нейромедиаторов адренергической, холинергической природы, а также нейропептиды.
Начиная с конца 50-х годов прошлого столетия внимание исследователей всего мира все больше стало привлекать изучение воздействия гормональных факторов на функцию головного мозга. В результате многочисленных исследований родилась новая наука — психонейроэндокринология. Ее задачами является изучение вопросов, связанных с влиянием гормонов на высшие функции мозга, — от молекулярного уровня до различных сторон психической деятельности.
Проблема воздействия гормональных факторов на высшие интегративные функции мозга чрезвычайно сложна как по существу, так и в силу отсутствия объективной модели, отражающей зависимость между уровнем гормонов в организме и его влиянием на когнитивные функции.
Показано, что гормоны, взаимодействуя с нейромедиаторами, образуют на уровне ЦНС единую координирующую нейрогуморальную систему, контролирующую интегративную деятельность головного мозга. Нарушение биосинтеза или обмена нейромедиаторов, нарушения их взаимодействия с соответствующими рецепторами могут играть патогенетическую роль в развитии ряда нервно-психических состояний. Сложились устойчивые представления о том, что функция гормонов в ЦНС связана с контролем экспресии гормонзависимых генов и регуляции таких процессов, как развитие и старение мозга, регенерация, адаптация, память.
Различают геномный и негеномный механизм действия гормонов. Полипептидные гормоны действуют на специфические рецепторные зоны мембраны клетки. Связывание лиганда поверхностными рецепторами клетки индуцирует внутриклеточный сигнал (цАМФ и/или кальций) и приводит к быстрому результату (активации остеокластов, секреции кортизола и т.п.). Трансдукция сигнала полипептидных гормонов может вовлекать фосфатидилиновый путь или фосфорилирование рецепторов.
Стероидные и тиреоидные гормоны проявляют свое действие главным образом через специфические внутричерепные связывающие белки, которые взаимодействуют с элементами генов клеток-мишеней, что сопровождается изменением транскрипции специфических генов.
Гипофиз — главный регулятор функционирования эндокринных желез
В аденогипофизе секретируются следующие гормоны: ТТГ, АКТГ, ЛГ и ФСГ, которые оказывают стимулирующее влияние соответственно на клетки щитовидной железы, коры надпочечников и половые железы. Попадая в кровь, гормоны периферических желез активизируют деятельность всех органов и тканей организма, в том числе и аденогипофиза. Осуществляя обратную связь, они блокируют избыточное поступление тропных гормонов гипофиза. Наступает равновесие между мутацией гормонов гипофиза и потребностью организма в гормонах периферических желез. Несколько иной результат наблюдается в отношении ПРА и гормона роста, не имеющих специализированного целевого органа, секреция которого оказывала бы тормозной эффект на выделение этих гормонов. Помимо блокирующего эффекта гормонов периферических желез на синтез и секрецию тропных гормонов гипофиза, аналогичным эффектом обладают также ингибиторные факторы гипоталамического происхождения.
Синдромы эндокринной недостаточности, обусловленные полным или частичным выпадением функций передней и задней долей гипофиза, обозначаются как гипопитуаризм. Гипофункция гипофиза может быть следствием поражения самого гипофиза или гипоталамуса. Результат один — сниженная секреция гипофизарных гормонов с последующим дефицитом гормонов периферических желез.
Уровень гормона роста в крови в норме очень низок, но увеличивается при физической нагрузке, во время сна и при стрессе. Наиболее надежные стимулирующие тесты для данного гормона — индуцированная инсулином гипогликемия, инфузия аргинина или введение L-допа. Эти тесты сопровождаются увеличением секреции гипоталамического соматолиберина.
Секреция пролактина у здоровых людей обычно низкая в течение дня, увеличивается во сне, при стрессе и родах. В клинике используют провоцирующий тест с внутривенным введением ТРГ

Снаружи тело гипофиза покрыто соединительнотканной капсулой. Размеры гипофиза достаточно индивидуальны (10-17) х 16 х (5-10) мм, масса у мужчин составляет около 0,5-0,6 г, у женщин – около 0,6-0,7 г. Будучи анатомически единым образованием, гипофиз делится на две доли. Передняя доля (аденогипофиз) крупнее, она занимает 70-80% всей массы гипофиза и включает три части: дистальную, бугорную и промежуточную. В задней доле (нейрогипофиз) различают нервную часть и воронку.
Строение гипофиза
Физиологическая роль гипофиза обусловливает особенности его кровоснабжения. Нижние гипофизарные артерии отходят от внутренних сонных артерий. Верхние гипофизарные артерии отходят от сосудов артериального круга, направляются к серому бугру и воронке, где образуют между собой анастомоз и распадаются на капилляры, проникающие в ткань. На этих капиллярах заканчиваются разветвления аксонов нейросекреторных клеток гипоталамуса, образуя синапсы. Здесь нейросекрет выделяется в кровь. Из петель этой сети формируются воротные венулы, идущие по бугорковой части к передней доле гипофиза, где переходят в широкие синусоидные капилляры. Эти капилляры образуют вторичную гемокапиллярную сеть, оплетающую группы секреторных клеток. Капилляры вторичной сети, сливаясь, образуют выносящие вены, по которым кровь (с гормонами передней доли) выносится из гипофиза. Задняя доля гипофиза снабжается кровью в основном за счёт нижних гипофизарных артерий. Между верхними и нижними артериями существуют анастомозы.
Клетки передней доля гипофиза называются аденоцитами. Существует 2 типа аденоцидов:
- хромофильные аденоциты – крупные клетки, которые хорошо окрашиваются красителями;
- хромофобные аденоциты – мелкие клетки, слабо окрашиваются.
Среди хромофильных аденоцитов различают ацидофильные – клетки овальной формы, окрашивающиеся кислыми красителями в розовый цвет, а также крупные базофильные клетки, окрашивающиеся основными красителями и богатые глюкопротеидными включениями. Задняя часть передней доли, расположенная в виде прослойки между ней и задней долей, рассматривается как промежуточная часть. Она образована многослойным эпителием, среди клеток которого находятся пузырьки (псевдофолликулы).
Задняя доля образована клетками эпендимы (питуицитами), мелкими многоотростчатыми клетками и нервными волокнами, аксонами клеток супраоптического и паравентрикулярного ядер гипоталамуса, разветвления которых оканчиваются на капиллярах задней доли. Воронка гипофиза, соединяясь с воронкой гипоталамуса, образует ножку гипофиза.
Функции гипофиза
Функции гипофиза обусловлены действием выделяемых им гормонов. Посредством выделения этих веществ осуществляются: регуляция синтеза и секреции гормонов гипофизозависимыми эндокринными железами (надпочечники, половые железы); синтез и секреция меланинов; регуляция роста и созревания органов; координация функций различных органов (почки, матка, молочные железы).
В передней доле гипофиза синтезируются так называемые тропные гормоны:
- соматотропин (соматотропный гормон, гормон роста);
- тиреотропин (тиреотропный гормон);
- адренокортикотропный гормон (АКТГ);
- гонадотропные гормоны (фолликулотропин, лютеотропин);
- лактогенный гормон (пролактин);
- меланоцитостимулирующий гормон (меланоцитогропин).
Эти гормоны регулируют синтез и секрецию гормонов гипофизозависимых желез по принципу обратной связи: при снижении концентрации определённого гормона в крови клетки аденогипофиза выделяют сигнальный гормон, который стимулирует образование гормона этой железой, а повышение его уровня в крови приводит к замедлению секреции сигнального гормона.
В промежуточной части вырабатываются липотропные факторы гипофиза, оказывающие влияние на мобилизацию и утилизацию жиров в организме. Нейросекреторные клетки ядер гипоталамуса вырабатывают вазопрессин и окситоцин, которые транспортируются в заднюю долю гипофиза, откуда разносятся кровью.
Соматотропин секретируется не постоянно, а периодически, 3-4 раза вдень. Секреция его увеличивается во время голодания, тяжёлого физического труда и во время сна. С возрастом выработка соматотропина заметно уменьшается, однако сохраняется в течение всей жизни. Гормон роста оказывает двойное воздействие на клетки организма: в клетках усиливается распад накопленных углеводов и жиров, а также их мобилизация для энергетического и пластического обмена, под влиянием выработанных печенью соматомединов усиливается рост костей, синтез белка и деление клеток.
Недостаточная секреция соматотропина приводит к карликовости при сохранении нормального телосложения. Избыточная секреция – к гигантизму. Если гиперсекреция начинается у человека уже в зрелом возрасте, то развивается акромегалия. При этом непропорционально удлиняются конечности, нос и подбородок, язык и пищеварительные органы.
Адренокортикотропный гормон стимулирует выделение кортикостероидов клетками коркового вещества надпочечников. Секреция этого гормона усиливается при некоторых эмоциональных состояниях (страх, гнев, хронический стресс).
Тиреотропный гормон регулирует выделение гормонов щитовидной железы. Он активирует аденилатциклазу и увеличивает поглощение йода клетками железы. Помимо этого тиреотропин оказывает влияние на белковый обмен – увеличивает синтез белков, нуклеиновых кислот, а также увеличивает количество и размер тиреоидных клеток.
Гонадотропные гормоны стимулируют функции половых желез. Фолликулотропин регулирует у женщин развитие фолликулов в яичниках, а у мужчин – образование сперматозоидов и развитие простаты. Лютеотропин стимулирует выработку андрогенов (андростендиол, тестостерон и пр.) и эстрогенов (эстрадиол, эстриол и др.).
Пролактин увеличивает продукцию прогестерона в жёлтом теле яичника и продукцию молока (лактацию). Физиологическая роль этого гормона окончательно не выяснена, но почти все его известные эффекты связаны с размножением.
Меланоцитотронин регулирует распределение пигмента меланина и обусловливает, таким образом, окраску волос и кожи. Пигментные пятна при беременности и усиленная пигментация кожи у пожилых людей возникают в результат гиперфункции промежуточной доли гипофиза.
Вазопрессин участвует в регуляции мочеобразования, усиливая обратное всасывание воды из первичной мочи, обеспечивает водно-солевой гомеостаз организма.
Окситоцин стимулирует гладкую мускулатуру матки во время родов и секрецию молока. Он вызывает сокращение миоэпителиальных клеток, окружающих альвеолы и протоки молочной железы, благодаря чему молоко выделяется из груди.
С нарушениями функции гипофиза обращайтесь к врачу-эндокринологу в Краснодаре.
Гипофиз — маленькая железа, которая расположена в голове и управляет огромным количеством функций организма. Природа надежно защитила его от внешнего воздействия, но осталась бессильна перед внутренними изменениями. Слепота, бесплодие, нарушения в половой сфере, выпадение волос, неприятные изменения внешности — это далеко не всегда последствия хронических болезней или негативного влияния извне. Подобные проблемы нередко вызывает аденома гипофиза.
Что это такое? Каковы первые «звоночки»? Как диагностировать болезнь и как лечить? На эти и другие вопросы отвечает кандидат медицинских наук, доцент кафедры неврологии и нейрохирургии БелМАПО, нейрохирург высшей квалификационной категории медицинского центра «Томография» Владимир Журавлев.
Владимир Журавлев
кандидат медицинских наук, доцент, врач-нейрохирург
высшей квалификационной категории медицинского центра «Томография»
— Что из себя представляет гипофиз?
— Гипофиз — это самая удивительная железа внутренней секреции в нашем организме. По размеру и форме она напоминает фасолину, около 15 мм. Спрятан гипофиз в самом защищенном месте головы, в центре основания черепа, в изолированном костном ложе — турецком седле.
— Каковы его функции?
— Эта маленькая «фасолина» выделяет гормоны, которые управляют всеми эндокринными железами нашего организма. В зоне его ответственности обмен веществ в организме, формирование скелета и мышечной массы, рост, репродуктивная функция. Кроме того, управляя надпочечниками, гипофиз обеспечивает адекватную реакцию организма на все внешние воздействия — сопротивляемость стрессу. На самом деле функций у гипофиза значительно больше и все они различны в зависимости от возрастного и физиологического периодов жизни.
В детстве на первый план выходит соматотропная функция. С латинского это слово переводится как «построение тела». Здесь имеется в виду рост, увеличение мышечной массы и другие неотъемлемые изменения организма, связанные с этим процессом.
В подростковом периоде происходит гормональная перестройка, называемая пубертатным периодом. Развиваются вторичные половые признаки. В этот период особо важную роль играют гонадотропные гормоны гипофиза, регулирующие функцию половых желез ребенка. Так формируются тип телосложения, особенности отложения жировой ткани, оволосение и многие другие особенности нашего организма.
Это формирование завершается способностью организма вырабатывать здоровые половые клетки или, иными словами, способностью продолжать род.
В общем, у железы очень много задач. Сбой в ее функционировании вызывает серьезные проблемы. Просто представьте, что сломался процессор, отвечающий за работу всей компьютерной системы.
— По каким признакам можно понять, что появились проблемы с гипофизом?
— Первые «звоночки» может увидеть педиатр или терапевт.
В детском возрасте ребенок может перестать расти. Остановка в росте, особенно на фоне развития других проблем — например, ожирения, артериальной гипертензии, не свойственной возрасту, и т.д. Эти симптомы могут указывать на нарушение регуляции работы эндокринной системы.
Во взрослом возрасте это может проявляться в изменении телосложения и внешности человека, например:
- меняются, укрупняются черты лица, пальцы и кисти рук, стопы, язык. Данные проявления являются симптомами акромегалии;
- лицо становится «лунообразным», руки и ноги — очень худыми, а жир перераспределяется на туловище: на живот и грудь. Симптоматика характерна для болезни Иценко-Кушинга;
- появляются сухость и истончение кожи, очень легко образуются синяки.
- повышается артериальное давление.
В возрастном периоде старше 60 лет клиническая картина опухолей гипофиза менее яркая, и заподозрить болезнь становится труднее.
Как правило, среднее время от появления первых симптомов наличия аденомы гипофиза до установления диагноза у взрослых занимает: у женщин — около 1 года, у мужчин — 6 лет.
Дело в том, что одним из первых симптомов у молодых людей являются нарушения половой функции. У женщины же, например, нарушается менструальный цикл. В таких случаях она, как правило, не затягивает и своевременно обращается за консультацией к врачу. Если у мужчины снижается либидо, то далеко не каждый сразу идет с жалобами на снижение половой функции к специалисту.
При проблемах с зачатием также чаще всего в первую очередь обследуется женщина. Хотя проблема может быть в мужском бесплодии из-за дисфункции гипофиза.
— Что такое аденома гипофиза?
Доброкачественная аденома гипофиза — это целая группа опухолей, различных по своей природе, симптомам, течению заболевания и прогнозам. Аденомы гипофиза занимают третье место по частоте встречаемости среди всех внутричерепных опухолей.
Их можно условно разделить на две группы:
- гормональнонеактивные (несекретирующие гормоны);
- гормональноактивные (продуцирующие избыточное количество гормонов гипофиза).
По размерам выделяют:
- микроаденомы (до 10 мм);
- макроаденомы (более 10 мм).
Основные типы гормональноактивных аденом гипофиза, в зависимости от того, какой гормон продуцирует аденома, следующие:
- пролактиномы — секретирующие гормон пролактин;
- соматотропиномы — продуцирующие соматотропный гормон. Заболевание называется акромегалия;
- тиреотропиномы — секретируют тиреотропный гормон. Он способствует повышению функции щитовидной железы. Название патологии — тиреотоксикоз;
- аденокортикотропиномы — продуцируют адренокортикотропный гормон, который стимулирует надпочечники. Вызывает болезнь Кушинга.
Также существуют аденомы гипофиза, провоцирующие сразу несколько гормонов.
Чаще всего встречаются аденомы гормональнонеактивные, которые не продуцируют гормоны, и пролактиномы — вырабатывающие гормон пролактин. На их долю приходится примерно по 40%.
Изображение МРТ макроаденомы гипофиза
— Каковы клинические проявления аденомы гипофиза?
— К сожалению, аденомы гипофиза не имеют присущих именно им характерных симптомов. Поэтому диагностировать их достаточно непросто.
Симптомы могут быть следующими:
- головная боль;
- общая слабость, снижение артериального давления;
- ухудшение зрения, выпадение полей зрения, снижение остроты;
- изменения внешности, не связанные с пищевым поведением.
Клиническая картина гормональноактивных опухолей гипофиза различается в зависимости от гиперсекреции конкретного гормона.
Пролактиномы — наиболее часто встречающиеся гормональноактивные аденомы гипофиза. Проявляются по-разному, в зависимости от возраста и пола пациента:
- у женщин имеются нарушения менструального цикла и связанное с этим бесплодие;
- у мужчин и женщин снижается либидо, потенция, отмечается бесплодие;
- увеличение молочных желез, галакторея (самопроизвольное истечение молока из молочных желез вне связи с процессом кормления ребенка).
— По каким причинам возникает такая опухоль?
— Вопрос до конца не изучен. Существует теория, что дело в «поломке» определенных генов. Почему происходит эта «поломка», ученым до конца неизвестно.
— Какой врач может диагностировать аденому?
— Из-за многообразия симптомов пациент может обращаться к врачам десятка специальностей. Последовательность диагностики зависит от профиля специалиста, к которому обратился пациент.
Если заболевание дебютирует в детском возрасте, с первыми жалобами (низкорослость) столкнутся педиатры.
Гипофиз является органом, регулирующим функцию эндокринной системы. И потому наиболее вероятно, что взрослый пациент сперва обратится к эндокринологу. А нарушения менструальной функции приведут женщину к врачу-гинекологу.
Подтверждением диагноза являются:
- МРТ головного мозга и гипофиза;
- лабораторная диагностика (исследование гормонов гипофиза и периферических эндокринных желез);
- консультация эндокринолога для определения функционального состояния эндокринной системы и гормональной активности аденомы;
- осмотр офтальмолога (исследование остроты и полей зрения).
В лечении аденом гипофиза также принимает участие несколько врачей:
- нейрохирург;
- эндокринолог;
- офтальмолог;
- и, возможно, врачи других специальностей, например: гинекологи, онкологи, радиологи.
— Какое возможно лечение?
В качестве методов лечения используются следующие:
1. Хирургическое удаление опухоли.
В настоящий момент самым современным и эффективным является транссфеноидальный эндоскопический метод удаления опухоли (удаление осуществляется через нос).
2. Лучевое лечение.
Назначается, когда:
- проведение операции невозможно. Например, при наличии абсолютных противопоказаний из-за болезней сердца, почек и др.);
- операцию невозможно выполнить по техническим причинам (расположение опухоли и ее распространение в сосудисто-нервные структуры не позволит удалить опухоль полностью);
- проведенная ранее операция оказалась неэффективной (нет достижения гормональной компенсации после удаления опухоли).
В качестве вариантов лечения используют так называемые стереотаксические методы, когда излучение подается непосредственно на опухоль, с максимально точной фокусировкой, с минимальным воздействием на окружающие ткани. В нашей стране существуют такие методы лечения:
- радиохирургия (когда вся доза лучевого воздействия подается за один сеанс);
- радиотерапия (когда лечение разбито на несколько сеансов). Радиохирургическое лечение проводится с помощью специальной установки, которая называется «Гамма-нож».
3. Медикаментозная терапия.
Применяется при пролактиномах. Такой метод лечения позволяет контролировать до 90% всех пролактином. Есть лекарственные средства, применяемые при других аденомах, но их назначение проводится индивидуально в каждом случае консилиумом нескольких специалистов.
Представляют потенциальную опасность и нуждаются в лечении:
- гормональноактивные аденомы гипофиза;
- аденомы гипофиза, размеры которых превышают размеры того места, из которого они исходят, то есть эти опухоли распространяются на смежные отделы мозга. Они начинают сдавливать зрительные нервы (они проходят рядом). В таком случае падает зрение, что может привести к слепоте.
Гормональнонеактивные аденомы маленьких размеров (до 10 мм), выявленные случайно, чаще всего — на МРТ при обследовании по какому-либо другому поводу. Их называют «случайные находки». Для них даже имеется специальный термин — инциденталома. Такие опухоли, как правило, не растут в течение жизни, не имеют никаких симптомов и нуждаются только в динамическом наблюдении.
В принятии решения по выбору метода лечения аденомы гипофиза используется мультидисциплинарный подход (участие врачей различных специальностей).
Прогнозы по лечению аденомы гипофиза нужно давать индивидуально в каждом конкретном случае.
— Есть ли возможность родить ребенка при пролактиноме?
— Очень важный момент. Нельзя путать ситуацию, которая называется «гиперпролактинемия», с пролактиномой.
При гиперпролактинемии в крови много гормона пролактина, но причиной этому аденома гипофиза не является.
Как уже было сказано ранее, пролактинома — это гормональноактивная аденома гипофиза, которая секретирует избыток гормона пролактина. Отличить эти состояния может врач-эндокринолог. Как и назначить адекватное лечение.
Самым информативным способом для выявления опухолей является МРТ. А вот прогноз по восстановлению фертильности в таких случаях различный.
Основной симптом при пролактиноме — аменорея (отсутствие менструаций) и бесплодие.
При проведении лечения агонистами дофамина опухоль уменьшается в размерах и восстанавливается нормальная гормональная секреция.
Таким образом, в ряде случаев возможно восстановление фертильности (способности забеременеть и родить). Но, к сожалению, такое происходит не всегда, так как регуляция деятельности эндокринных желез очень сложная.
— Что будет, если аденому гипофиза не лечить?
— Как я уже говорил, некоторые виды аденомы вовсе не требуют лечения. У каждого четвертого человека на Земле гипофиз имеет внутри себя какую-либо особенность (кисты, уплотнения, рубцы, зоны атрофии или или гиперплазии, микроаденомы без гормональной активности и др.). Но далеко не всегда здоровье в этом случае находится под угрозой. Бывает, что гормональнонеактивная аденома просто присутствует, но никакого влияния на организм не оказывает. В таких случаях необходимо проводить периодическое наблюдение.
Требуют лечения:
- Гормональноактивные аденомы гипофиза, которые вызывают гормональные нарушения и неуклонно прогрессируют. Потому отсутствие своевременного лечения может привести к развитию тяжелых, иногда летальных осложнений. Например, при акромегалии из-за нарушений работы сердца может развиться инфаркт миокарда или инсульт.
- Гормональнонеактивные макроаденомы, которые при увеличении размеров могут сдавливать зрительные нервы, что может приводить к развитию слепоты. К сожалению, такая утрата зрения безвозвратна. Сдавление других отделов мозга может приводить к смещению мозга внутри черепа и развитию кровоизлияний или инсульта.
Кстати
Бывают опухоли с крайне агрессивным ростом. Их нужно лечить быстро, по возможности использовать метод полного хирургического удаления в сочетании с лучевым лечением.
— Какие виды операций применяются для удаления аденом гипофиза?
— Возможны два вида оперативного вмешательства:
- традиционная краниотомия — трепанация черепа и удаление опухоли с использованием операционного микроскопа. Этот метод используется все реже, в основном при распространении опухоли и невозможности провести операцию через нос;
- транссфеноидальное эндоскопическое удаление. Современный малоинвазивный метод, при котором операция проводится через нос. Около 95% аденом гипофиза сегодня удаляются именно так. На сегодняшний день этот метод в мире является самым эффективным, безопасным, сокращает время операции и облегчает последующее восстановление.
— Операции выполняются под общим наркозом?
— В обязательном порядке.
— Бывают ли ситуации, когда операции противопоказаны?
— Да, противопоказания для операций имеются. Среди них:
- инфекционные заболевания, находящиеся в активной фазе. Например, грипп или ОРВИ также заставляют врачей отложить операцию;
- нарушение свертываемости крови;
- некомпенсированные проблемы сердечно-сосудистой системы и других внутренних органов, требующие коррекции.
— Долго ли проходит реабилитация после операции?
— В среднем она длится месяц. Около недели после операции пациент находится в больнице. Потом отправляется домой, но посещает эндокринолога, невролога. А также, если необходимо, офтальмолога и других специалистов.
Как правило, после операции пациенты продолжают вести прежний образ жизни. Возвращаются к труду и привычным занятиям.
— Существует ли профилактика аденомы гипофиза?
— Относительно данной проблемы лучшая профилактика — это самоконтроль. Не стоит пренебрегать положенными по возрасту обследованиями. Регулярно контролируйте уровень сахара в крови, артериальное давление, следите за массой тела. Своевременно проходите медосмотры. Если чувствуете недомогание, не тяните, обращайтесь к врачу. Любая проблема быстрее и легче решается на ранних этапах.
Будьте здоровы!
Фото: Дмитрий Рыщук

Гипоталамо-гипофизарная система принимает непосредственное участие в поддержании оптимального уровня обмена веществ и энергии, в регуляции температурного баланса, функционировании желез внутренней секреции и координации основных процессов жизнедеятельности. Важнейшим механизмом нейроэндокринной регуляции является соматотропная функция, обеспечивающая оптимальный уровень интенсивности функциональной и пролиферативной деятельности всех клеток организма, а также реализацию программы эмбрионального и постнатального развития особи. Конечный рост человека является результатом функционального единства воздействия наследственных, гормональных и гуморальных факторов, среди которых следует выделить гормон роста и висцеральные инсулиноподобные ростовые факторы, непосредственно обеспечивающие поддержание в тканях и органах физиологическую скорость синтетических и репаративных процессов. Чрезмерная активность соматотропной функции (независимо от инициирующей причины) сопровождается патологическим умножением клеточной массы организма, снижением видовой специализации тканей, развитием системных и обменных нарушений, способствующих формированию полиорганопатии, ранней инвалидизации и преждевременной смерти пациентов. Ниже представлены сведения по анатомическому строению гипофиза и организации соматотропной функции.
Гипофиз является сложной секреторной железой, состоящей из различных типов гормональноактивных и вспомогательных клеток, деятельность которых представляется архиважной для роста и развития организма, поддержания гомеостаза и обеспечения репродукции. Первые зачатки гипофиза млекопитающих обнаруживаются на 4-5-й неделе эмбрионального развития, тогда как видовая дифференцировка гипофизоцитов завершается к 20-й неделе внутриутробного периода. Структурная закладка гипофиза начинается с выроста эпителия, выстилающего крышу ротовой полости. Одновременно от дна III желудочка промежуточного мозга навстречу растущему эпителию начинает выпячиваться зачаток воронки. Дистальная часть эпителиального выроста (карман Ратке), достигнув зачатка воронки, дает начало аденогипофизу. При этом передняя часть кармана Ратке образует переднюю долю, тогда как задняя часть формирует среднюю (промежуточную) долю, которая вплотную прилегает к задней доле гипофиза. Полость аденомера может сохраняться в виде щели, отделяющей переднюю долю гипофиза от промежуточной. У человека гипофизарная щель отсутствует и потому передняя и промежуточная доли тесно соприкасаются между собой. Таким образом, аденогипофиз первично закладывается у зародыша как железа внешней секреции с последующей атрофией проксимальной части гипофизарного кармана, соответствующей выводному протоку. (Рис.1.1)
Рис. 1.1. Морфогенез гипофиза.
Анатомически гипофиз представляет собой красновато-серое образование бобовидной формы, располагающееся на основании черепа в седловидной костной полости, называемой турецким седлом, которая является частью клиновидной кости. Сзади седло ограничено спинкой седла, боковые углы которого образуют задние отклоненные отростки. В норме поперечный размер гипофиза составляет 10-17 мм, переднезадний – 5-15 мм, вертикальный – 5-10 мм. Объем гипофиза достигает 0,5 см3. Форма гипофиза варьирует от яйцевидной до полностью сферической. Снаружи гипофиз покрыт твёрдой мозговой оболочкой, которая натягивается между отростками клиновидной кости и спинкой седла, формируя диафрагму турецкого седла. В центре диафрагмы имеется небольшое отверстие, через которое проходит гипофизарная ножка, связывающая гипофиз с серым бугром гипоталамуса. С боковых сторон гипофиз окружён пещеристыми синусами. Рис.1.2.
Средняя масса гипофиза составляет около 600 мг (с колебаниями от 400 до 900 мг). Во время беременности наблюдается физиологическое увеличение массы гипофиза до 1 г, поэтому у многократно рожавших женщин объем гипофиза значительно больше, чем у мужчин сходного возраста. По мере старения размеры гипофиза уменьшаются, в его ткани усиливается интерстициальный фиброз, происходит отложение амилоида и гемосидерина.
В гипофизе человека различают 2 доли: переднюю железистую долю, составляющую 70% массы железы (аденогипофиз) и заднюю нейроглиальную долю (нейрогипофиз), имеющие различное строение и происхождение. Аденогипофиз условно разделяют на переднюю дистальную, воронкообразную и промежуточную части. Промежуточная доля у человека является рудиментарной, анатомически, как правило, не обособлена и вместе с передней долей входит в состав аденогипофиза.
Рис.1.2. Анатомия гипофиза
Микроскопически передняя доля гипофиза представляет собой систему кубовидных клеток, расположенных рядом с венозными синусами с фенестрированным эпителием. По отношению к стандартным красителям в составе железистой массы аденогипофиза выделяют хромофобные и обладающие секреторной активностью хромофильные клетки. Хромофобные клетки представляют собой гетерогенную популяцию аденоцитов, составляющих 50-60% от общего числа клеток передней доли гипофиза, в норме лишенных характерной зернистости и признаков секреторной активности.
Хромофильные клетки, по характеру окрашивания секреторных гранул, подразделяются на ацидофильные (синоним — эозинофильные) и базофильные аденоциты. В морфо-функциональную группу ацидофильных клеток, составляющих 30-35% от общего числа гипофизоцитов, входят соматотрофы, маммосоматотрофы и пролактотрофы. В свою очередь, среди базофильных клеток, на долю которых приходится 4-10% от общего клеточного состава, по признаку секреторной активности выделяют тиреотрофы, кортикотрофы и гонадотрофы.
Задняя доля гипофиза (нейрогипофиз) является эндокринным органом, который аккумулирует гормоны (вазопрессин и окситоцин), секретируемые в ядрах переднего гипоталамуса и переходящие по аксонам супраоптических и паравентрикулярных нейронов в нейрогипофиз. Нейрогипофиз имеет нейроглиальное строение и состоит из эпендимных клеток — питуицитов и аксонов нейронов паравентрикулярных и супраоптических ядер гипоталамуса, а также кровеносных капилляров, телец Геринга — расширений аксонов нейросекреторных клеток гипоталамуса, соединительнотканной стромы. Питуициты выполняют трофическую и поддерживающую функции, а также регулируют секрецию нейропептидов из терминалей аксонов в гемокапилляры.
Кровоснабжение гипофиза весьма обильно и осуществляется ветвями внутренней сонной артерии, а также ветвями артериального (виллизиева) круга головного мозга. Портальная система гипофиза с нисходящим направлением тока крови от гипоталамуса, где она наполняется гипоталамическими рилизинг-гормонами, к гипофизу является важным морфо-функциональным компонентом сложного механизма нейрогуморального регулирования тропных функций аденогипофиза. Из гипофиза кровь оттекает через возвратные венулы, поднимаясь по ножке гипофиза в срединное возвышение и другие отделы гипоталамуса, и далее в глубокие вены мозга. Наличие такого обратного тока крови дает возможность гормонам передней и задней доли гипофиза попадать в гипоталамус и регулировать его работу. Кровоснабжение задней доли гипофиза осуществляется нижней гипофизарной артерией. Кровь от задней доли оттекает в латеральные вены и по возвратным венам через срединное возвышение поступает в глубокие вены мозга. Рис.1.3.
Рис.1.3. Кровоснабжение гипофиза.
1. Сосуды гипоталамуса;
2. Первичное сплетение портальной системы гипофиза;
3. Длинные портальные вены гипофиза;
4.Короткие портальные вены гипофиза;
5, 7, 11, 16. Вены, выносящие кровь к дуральному синусу;
6.Капиллярное сплетение воронкообразного отростка;
8, 9. Латеральная и медиальная ветви нижней артерии гипофиза;
10. Нижняя артерия гипофиза;
12,13 Передняя и задняя ветви верхней артерии гипофиза;
14. Верхняя артерия гипофиза;
15. Трабекулярная артерия;
17.Трабекула (перекладина);
18. Вторичное сплетение портальной системы гипофиза.
Иннервация гипофиза осуществляется не от гипоталамуса, а посредством симпатических волокон сопровождающих гипофизарные артерии. Начало им дают постганглионарные волокна, идущие через внутреннее сонное сплетение, связанное с верхними шейными узлами. В заднюю долю проникают нейросекреторные волокна гипоталамо-гипофизарного тракта, идущие от супраоптического и паравентрикулярного ядер гипоталамуса.
Носители соматотропной функции
К непосредственным гормональным носителям соматотропной функции прежде всего следует отнести гормон роста (ГР, соматотропный гормон, соматотропин, СТГ) и инсулиноподобные ростовые факторы (ИРФ) – ИРФ-I и ИРФ-II, которые, вместе с соответствующим рецепторным аппаратом и комплексом связующих белков, составляют морфо-функциональную ось, принимающую непосредственное участие в интеграции разнонаправленных метаболических процессов, способствующих:
- эмбриональному и постнатальному росту, а также и морфо-функциональному развитию особи,
- поддержанию гомеостаза клеточного пула,
- активизации функциональной и митотической клеточной деятельности,
- тканевой интеграции и регенерации.
Реализация соматотропной функции зависит с одной стороны от интенсивности продукции гормональных сигналов, тогда как с другой, – от степени тканевой чувствительности к гормональному воздействию, зависящей от представленности и аффинности рецепторного аппарата. Тканевая чувствительность оценивается по состоянию рецепторов к ключевым лигандам (соматолиберину, соматостатину, ГР, ИРФ), число и активность которых, хотя и являются генетически детерминированными, однако могут изменяться под воздействием различных внешних и внутренних причин. [7-9]
В системной регуляции анаболических и ростовых процессов особое место принадлежит гормону роста и группе зависимых от ГР белков, выполняющих посредническую роль в реализации его биологического эффекта. К гормонам-посредникам в первую очередь относятся инсулиноподобные ростовые факторы (ИРФ-I и ИРФ-II), главная функция которых заключается в стимулирующем воздействии на функциональную и митотическую деятельность клеток, что обеспечивает поддержание необходимого баланса клеточной массы органов и тканей, и своевременную возобновляемость распадающихся внутри- и внеклеточных структур в процессе жизнедеятельности организма.
Гормон роста (ГР)
Гормон роста является составным членом гормонального цитокинового суперсемейства, в состав которого также входят пролактин, плацентарный лактоген, пролиферин и пролиферин-связанный белок. Наиболее представленной формой гипофизарного гормона роста, составляющей около 75% от общего числа гомологичных полимеров, является биологически активный мономер ГР, имеющий молекулярную массу (М.м.) 22 кДа и состоящий из 191 аминокислотного остатка. Другой альтернативной сплайсинговой формой гипофизарного ГР является одноцепочечный полипептид с М.м. 20 кДа, состоящий из 176 аминокислотных остатков (little-ГР). От нативного гормона little-ГР отличается отсутствием участка полипептидной цепи, состоящего из 15 аминокислот в положении 32-46, что отражается в относительном снижении его ростовой и иммунологической активности.
У здоровых людей содержание изоформы ГР с М.м 22 кДа составляет 343,7+.421,5 пг/мл (18,6-1820), изоформы ГР с М.м. 20 кДа – 30,7+37,5 пг/мл (2,4-205 пг/мл). Таким образом, содержание изоформы в 20 кДа составляет 10% от общего пула. Введение рекомбинантного 22 кДа ГР в норме способствует быстрому снижению концентрации мономера 20 кДа ГР. Выявление в крови спортсмена лишь моноформы ГР в 22 кДа указывает на искусственный характер происхождения соматотропина и приеме ГР в качестве допинга.
Также следует упомянуть о присутствии в крови человека такой изоформы гормона роста, как big-ГР, которая представляет собой димерную молекулу с молекулярной массой 44 кДа и практически лишенную ростовой и пролиферативной активности. Остальные формы ГР (дезаминированные и N-ацетилированные молекулы, а также олигомерные пептиды) синтезируются в незначительных количествах. [10]
Таким образом, человеческий гормон роста представляет собой не моноформу, а скорее целое семейство белковых субстанций, объединяющее несколько мономерных белков, гомо- и гетерополимерные соединения, пептидные фрагменты, а также комплексы со связывающими белками. Суммарную биологическую активность этой полипептидной смеси, состоящей из десятков соединений, трудно однозначно оценить, поскольку отдельные молекулярные формы отличаются между собой по степени рецепторной аффинности. Поэтому неудивительно, что различные методы исследования ГР могут давать неодинаковые результаты. Относительно биологической значимости присутствия в крови множественных форм на сегодняшний день четких данных нет, поскольку пока отсутствуют методики изолированного выделения и изучения отдельных структурных форм гормона роста.
Структура гормона роста человека является очень сходной со структурой плацентарного лактогена с М.м. 22 кДа, который также состоит из 191 аминокислоты, содержит 2 дисульфидных мостика, но отличается от ГР 29 аминокислотными остатками. Гомология по первичной структуре составляет 85%. Эти данные свидетельствуют об эволюционной близости обоих гормонов, которые, однако, существенно отличаются по своему биологическому действию. В период беременности плацента человека, кроме плацентарного лактогена, способна секретировать и другие формы гормона роста: гликозилированный плацентарный вариант ГР с М.м. 25 кДа и второй гликозилированный плацентарный вариант ГР с М.м. 24-26 кДа. В отличие от пульсирующего характера секреции гипофизарных изоформ ГР, секреция плацентарного ГР не является ритмической, а прогрессивно увеличивается по мере развития беременности [11].
Синтез, хранение и секрецию гормона роста осуществляют ацидофильные (эозинофильные) клетки передней доли гипофиза – соматотрофы, на долю которых приходится, по различным литературным данным, от 35 до 50% от всей клеточной массы гипофиза. Ацидофильные клетки располагаются преимущественно в латеральных отделах аденогипофиза и характеризуются множественными округлыми секреторными гранулами размерами от 300 до 700 нм в диаметре, содержащими ГР в виде высокомолекулярных полимеров. Общее количество гормона роста в аденогипофизе составляет 5-15 мг, что примерно составляет 5-10% от его сухого веса. В течение суток в гипофизе синтезируется 500-800 мкг ГР.
Важным показателем функциональной активности соматотрофов является скорость секреции ГР, которая в препубертатном возрасте составляет 29, в раннем пубертате – 20, в позднем пубертате – 60, постпубертатном периоде – 19 и во взрослом состоянии – 17 (мкг/кг) в сутки.
Время полужизни ГР человека в циркуляции колеблется от 15 до 45 мин, а скорость метаболического клиренса (СМК) от 90 до 160 мл/мин/м2 . Мономерный гормон роста фильтруется в клубочках почек и катаболизируется в проксимальных канальцах. Экскреция ГР с мочой составляет 0,01% от его общего количества, фильтрующегося в почках. СМК ГР снижается при микседеме, хронической почечной недостаточности, циррозе печени, сахарном диабете [12].
Гипоталамические рилизинг-факторы
Важную роль в становлении и функционировании соматотропной функции играют гипоталамические нейропептиды. Согласно направленности физиологического действия эти нейропептиды были названы: соматолиберин и соматостатин. Поступая в портальную систему гипофиза и взаимодействуя со специфическими рецепторами на поверхности соматотрофов, они оказывают, соответственно, стимулирующее или ингибирующее действие на продукцию ГР [7].
Соматолиберин (СЛ)
Гормон роста-рилизинг гормон (ГР-РГ, соматолиберин, соматокринин) способствует стимуляции синтеза и секреции ГР соматотропными клетками гипофиза. В гипоталамусе человека идентифицированы 2 изоформы ГР-РГ, состоящие из 44 и 40 АК.
Соматолиберин осуществляет первичный контроль соматотропной функции путем повышения генной транскрипции, биосинтеза и секреции ГР, а также скорости пролиферации соматотрофов.
Примерно 70% от суточного секреторного пула ГР приходится на период сна. Секрецию соматолиберина (и соответственно, продукцию гормона роста) стимулируют физические упражнения, стресс, прием белковой пищи, введение аминокислот (аргинина и лейцина), продолжительное голодание, нарушение всасывания пищи. Из биологически активных соединений стимулирующим действием на секрецию СТГ обладают: грелин, агонисты дофаминэргических рецепторов, ?-адреномиметики, эндорфины, энкефалины, галанин, нейротензин, вазоактивный интестинальный пептид, мотилин, холецистокинин, глюкагон. Напротив, гипергликемия и гиперлипидемия (посредством выброса соматостатина) ингибируют продукцию гормона роста.
У взрослых людей, независимо от половой принадлежности, содержание соматолиберина в плазме составляет 10-60 нг/л (в среднем 21 нг/л). Внутривенное введение ГР-РГ добровольцам вызывает дозозависимое высвобождение ГР из клеток аденогипофиза. Максимальной стимулирующей дозой ГР-РГ является 1 мкг/кг. Уже через 5 минут после в/в инъекции отмечается более чем 20-кратное повышение содержания ГР в крови с максимумом на 15-45 минутах и с возвращением к исходным значениям через 90-120 минут.
Соматостатин (СС)
Другим гипоталамическим фактором, влияющим на продукцию ГР, является гормон роста-ингибирующий гормон (соматостатин, (СС)), В отличие от соматолиберина, соматостатин ингибирует секрецию гормона роста, блокируя, таким образом, реализацию соматотропной функции. В настоящее время выделены две основные структурные изоформы СС, отличающиеся между собой по числу аминокислотных остатков, составляя, соответственно, 14 и 28 АК. Оба пептида образуются путем протеолиза молекулы пропептида, состоящей из 92 аминокислот. Первая форма, состоящая из 14 аминокислот, вырабатывается преимущественно в головном мозге (в том числе в гипоталамусе), тогда как вторая – клетками желудочно-кишечного тракта. Несмотря на структурную схожесть, изоформы СС осуществляют свое действие через различные рецепторы [13,14].
Биологический эффект соматостатина реализуется через специфические рецепторы, относящиеся к семейству рецепторов, ассоциированных с нуклеотидрегуляторным Gi-белком. Мембранные рецепторы соматостатина выявляются практически во всех тканях организма и отличаются устойчивостью к деградации. К настоящему времени выявлено 5 подтипов соматостатиновых рецепторов (ССР-в), которые экспрессированы в различных органах и тканях, причем подтип 2 имеет 2 сплайсинговых варианта (2а и 2b), различающихся по длине цитоплазматического окончания СООН. В гипофизе преимущественно представлены 2-й и 5-й подтипы, в меньшей степени, — 1-й, 3-й и 4-й подтипы соматостатиновых рецепторов. Изоформа соматостатина, состоящая из 28 аминокислотных остатков, преимущественно связывается с рецепторами 5-го подтипа [15].
В результате образования комплекса соматостатина с внеклеточным доменом специфического рецептора его трансмембранные и внутриклеточные домены меняют свою конфигурацию, приобретая, таким образом, способность взаимодействовать с ингибирующим нуклеотидрегуляторным Gi-белком, тормозящим превращение гуанозинтрифосфата (ГТФ) в гуанозиндифосфат (ГДФ). В дальнейшем происходит диссоциация комплекса, приводящая к ингибированию каталитической субъединицы рецептора. Блокирование активности аденилат циклазы приводит к «открытию» калиевых каналов, что способствует повышению концентрации ионов калия в цитоплазме, поляризации клеточной мембраны и блокированию внутриклеточного доступа ионов кальция. Результатом такого взаимодействия является уменьшение внутриклеточного содержания цАМФ и концентрации Ca2+ , что в итоге приводит к снижению скорости секреции ГР [16].
Следует отметить, что если соматолиберин способен стимулировать как синтез, так и секрецию ГР, то соматостатин ингибирует только секреторные процессы, не влияя на синтез ГР. Фазовое воздействие этих гипоталамических регуляторных пептидов на соматотропные клетки, как полагают, обеспечивает характерный суточный ритм секреции ГР. При этом соматолиберин определяет преимущественно амплитуду секреторного импульса ГР, тогда как соматостатин модулирует срок и продолжительность его возникновения.
В свою очередь деятельность гипоталамических центров, секретирующих соматолиберин и соматостатин, находится под контролем вышележащих отделов ЦНС и регулируется с помощью различных нейромедиаторов, таких, как дофамин, адреналин, норадреналин, серотонин и др. Конечное действие того или иного нейротрансмиттера на секрецию ГР гипофизом, как правило, является результатом модуляции тонуса, как ГР-РГ-секретирующих, так и соматостатин-секретирующих нейронов [17].
Инсулиноподобные ростовые факторы
Основное биологическое действие гормона роста осуществляется благодаря посреднической деятельности инсулиноподобных ростовых факторов (ИРФ-I и ИРФ-II), с помощью которых ГР реализует свои биологические эффекты на уровне тканей. ИРФ-I и ИРФ-II содержат в своем составе, соответственно, 70 и 67 аминокислот и имеют молекулярную массу 7,6 и 7,5 кДа. Примерно 75-85% от общего количества ИРФ-I продуцируется клетками печени. Остальная часть тканевой продукции приходится на клетки почек, сердца, гипофиза, мозга, желудочно-кишечного тракта, селезенки, надпочечников, кожи, мышц и хрящевой ткани [18].
В целом, концентрация ИРФ-I объективно отражает степень секреторной активности ГР и напрямую коррелирует с его содержанием в крови. При значительном повышении уровня ГР в сыворотке крови (более 20 нг/мл) содержание ИРФ-I выходит на плато в диапазоне 600-800 нг/мл. Чувствительность метода определения ИРФ-I при диагностике акромегалии составляет 100%, специфичность – 97% [19].
Следует отметить, что ГР стимулирует образование не только ИРФ, но и специфических ИРФ-связывающих белков (ИРФСБ), семейство которых к настоящему времени насчитывает 6 разновидностей белковых молекул (ИРФСБ — 1-6), обладающих сходной структурой и имеющих молекулярную массу от 24 до 31 кДа. ИРФСБ принимают непосредственное участие в регуляции функциональной активности ИРФ, обеспечивая: а) их внутрисосудистое резервирование, б) пролонгацию периода полувыведения, в) внутри- и внесосудистый транспорт, г) защиту от ИРФ-вызванной гипогликемии, д) ограничение биодоступности свободной фракции ИРФ в тканях, е) модулирующее взаимодействие ИРФ со специфическими рецепторами. Выявлено, что ИРФ обладают большим сродством с ИРФСБ, чем с собственными рецепторами, что предупреждает возникновение спонтанной активизации внутриклеточных сигнальных путей. Повышение содержания в крови ИРФСБ сопровождается соответствующим уменьшением доли свободных фракций ИРФ, что проявляется ограничением их биологического действия, нарушением процессов органогенеза и задержкой роста [20] .
В свободной форме находится лишь 1% от общего пула ИРФ. К настоящему времени выявлены два комплекса ИРФ/ИРФСБ, один из которых имеет молекулярную массу 40-50 кДа, другой — 150 кДа. 70-80% от общего количества ИРФ-I и ИРФ-II в сыворотке крови циркулирует в составе комплекса 150 кДа. Образование последнего происходит при участии лишь одного из шести ИРФСБ, а именно ИРФСБ-3, а также еще одного компонента, именуемого в английском переводе «acid-labile subunit» (ALS). Эта кислото-лабильная субъединица (КЛС) представляет собой гликопротеин с молекулярной массой 84-86 кДа, который сам по себе не связывается с изолированными ИРФ или ИРФСБ-3, однако активно объединяется с комплексом ИРФ/ИРФСБ-3, в результате чего происходит формирование стабильного трехкомпонентного соединения «ИРФ/ИРФСБ-3/КЛС», являющегося основной транспортной формой для ИРФ-I. Стимулирующее действие ГР способствует секреции гепатоцитами ИРФ-I и КЛС. В свою очередь ИРФ-I активизируют экспрессию ИРФСБ-3 эндотелиальными клетками печени. Все 3 компонента (ИРФ-I, ИРФСБ-3 и КЛС) находятся в крови в эквимолярном соотношении [21].
В составе такого комплекса период полужизни ИРФ в плазме существенно увеличивается, составляя 15-20 часов, что значительно превышает период полужизни нативного ГР, обеспечивая, таким образом, более воспроизводимые результаты гормонального анализа. Для сравнения длительность периода полужизни свободных форм ИРФ составляет менее 10 мин, а несвязанных молекул ИРФСБ — от 30 до 90 мин [22].
У человека ведущим, связывающим ИРФ белком является ИРФСБ-3, который связывает более 95% циркулирующего ИРФ-I и ИРФ-II.Экспрессия ИРФСБ-1 ограничена и его печеночная продукция находится под супрессивным контролем инсулина.
Инсулиноподобные ростовые факторы (ИРФ-I и ИРФ-II) относятся к многочисленному семейству ростовых факторов, главная функция которых заключается в передаче стимулирующего воздействия ГР на различные ткани, проявляющегося в активизации функциональной, митотической и репаративной клеточной деятельности. Следствием тонического воздействия ГР/ИРФ оси на организм является постоянство притока клеточной массы, поддержание видовой специализации тканей и оперативное воспроизводство постоянно распадающихся внутри- и внеклеточных структур. Связывание ИРФ со специфическими рецепторами инициирует разнонаправленный каскад взаимосвязанных внутриклеточных процессов, способствующих переводу клеток в активное состояние, накоплению гликогена, стимуляции белкового синтеза, поддержанию видовой специализации, митогенезу, ингибированию апоптоза. Такая многогранность биологического действия ИРФ достигается благодаря их активизирующему влиянию на субстратную утилизацию и энергопродукцию с образованием в цитозоле достаточного пула макроэргов, обеспечивающего функциональную активность, как отдельных клеток, так и объединяющих их морфо-функциональных образований, — тканей и органов [23].
У здорового человека максимальное содержание ИРФ-I в сыворотке крови наблюдается в середине пубертатного периода, после завершения которого, продукция ИРФ-I начинает постепенно уменьшаться. Это снижение продолжается в течение всей последующей жизни человека. Параллельно с возрастным падением уровней ГР и ИРФ-I отмечается снижение концентрации ИРФСБ-3. Возрастные особенности проявляются и в изменении тканевой чувствительности к ГР, которая также уменьшается по мере старения организма [24].
Положительное влияние на продукцию ИРФ-I оказывают инсулин, паратгормон, половые стероиды. Инсулин контролирует печеночную продукцию ИРФ-I и поэтому сохранение рецепторной чувствительности гепатоцитов к инсулину является условием их полноценной секреторной деятельности. Паратгормон регулирует продукцию ИРФ-I в костях, а половые стероиды являются главными модуляторами локальной секреции ИРФ-I в репродуктивной системе. Эстрогены, с одной стороны, стимулируют продукцию ГР, тогда как с другой, — снижают чувствительность соматотрофов к ИРФ-I. Поэтому у женщин уровни ИРФ-I и ИРФ-II несколько ниже, чем у мужчин, причем это различие наиболее показательно проявляется в период пубертатного развития. Физиологический контроль за пролиферативной деятельностью осуществляется, либо через систему отрицательной обратной связи между содержанием ИРФ-I и скоростью секреции ГР, либо на тканевом уровне путем конкурентного ингибирования связи ИРФ с соответствующими рецепторами [25].
Гормон роста стимулирующие пептиды (ГРСП)
Помимо вышепредставленных компонентов в регуляции продукции ГР принимают участие различные низко молекулярные соединения, которые представляют собой недавно открытую группу пептидов и химических субстанций, способных через специфические рецепторы стимулировать соматотропную функцию. Эти соединения стали именовать гормон роста-стимулирующими пептидами (ГРСП) или секретагогами ГР. Полагают, что действие ГРСП может осуществляться либо посредством стимуляции продукции соматолиберина, либо путем ингибирования секреции соматостатина. Имеются факты, указывающие на возможность прямого влияния секретагогов на соматотропные клетки аденогипофиза [26].
Наиболее изученным соединением из группы секретагогов ГР является грелин, представляющий собой 28-аминокислотный пептид, обладающий также орексигенным (стимулирующим аппетит) действием. Грелин образуется из белка прогрелина, состоящего из 117 аминокислот, и продуцируется энтероэндокринными клетками слизистой желудка. ГР-стимулирующее и орексигенное действия грелина осуществляется через специфические рецепторы, которые располагаются, как в гипоталамусе (аркуатном ядре), так и в гипофизе. Воздействие грелина на продукцию ГР реализуется двумя способами: через повышение продукции соматолиберина и путем непосредственной стимуляции секреторной активности соматотрофов. [27].
В норме у человека содержание грелина в плазме крови составляет 117.2 фмоль/мл. У взрослых концентрация грелина существенно повышается перед основными приемами пищи и постепенно снижается через 30-90 мин после еды. Показано, что голодание, а также инсулиновая гипогликемия являются естественным стимулятором секреции грелина, тогда как прием пищи или введение глюкозы сопровождается снижением его уровня. Эти данные указывают на то, что данный пептид принимает активное участие в эндогенной регуляции энергетического баланса и углеводного гомеостаза [28].
Основная часть грелина синтезируется в периферических тканях, прежде всего, клетками области дна желудка. Некоторые количества грелина обнаружены в поджелудочной железе, почках, иммунной системе, плаценте, тестикулах, легких, гипоталамусе и гипофизе. Установлены возрастные особенности чувствительности гипоталамо-гипофизарной системы человека к стимулирующему действию секретагогов, которая максимальна в период пубертата и постепенно снижается по мере старения [29].
Грелин является физиологическим регулятором секреции ГР. Увеличение амплитуды секреторной волны ГР, наблюдаемое при введении секретагогов, осуществляется посредством нескольких возможных механизмов: а) стимуляции продукции соматолиберина, б) повышения чувствительности соматотрофов к действию соматолиберина, в) снижения высвобождения соматостатина, г) блокирования рецепторной чувствительности к соматостатину [28].
Таким образом, ГР вместе с гипоталамическими рилизинг-факторами , секретогогами и ИРФ представляют собой гормонально-гуморальную ось, которая вместе с рецепторным аппаратом и связующими белками составляет комплексную морфо-функциональную систему, реализующую в организме высокоразвитых животных и человека соматотропную функцию. (Рис. 1.4.)
Рис.1.4. Регуляция соматотропной функции
В отличие от большинства других гипофизарных гормонов, ГР не имеет специфического тканевого органа, поскольку действует одновременно на множество тканей и в различных напарвлениях. Физиологическое действие ГР проявляется в усилении ростовой, липолитической, инсулиноподобной и антиинсулиновой активности, активизации анаболической и пролиферативной активности всех клеток организма. Наиболее изученным действием ГР является его стимулирующее воздействие на линейный рост особи и метаболические процессы в клетках. У детей и подростков основное влияние ГР и ИРФ-1 направлено на стимуляцию эндохондральной оссификации эпифизарных ростовых пластинок и ускорение продольного роста костей (преимущественно длинных трубчатых костей). Эпифизарная ростовая пластинка представляет собой хрящевую структуру, располагающуюся между окостеневшим эпифизом и костью метафиза. В зависимости от степени созревания в ней выделяют несколько функцииональных зон: зародышевая, зона пролиферации, гипертрофическая зона и зона кальцификации. (Рис.1.5.)
Рис 1.5. Эпифизарная ростовая пластинка А – зародышевая зона, В – пролиферативная зона, С, D- гипертрофическая зона, Е–зона кальцификации
Прехондроциты зародышевого слоя представляют собой редко делящуюся популяцию клеток, являющихся предшественниками эпифизарных хондроцитов. В этой зоне наблюдается наименьшее соотношение клеточно-матриксного объема. Клетки пролиферативной зоны располагаются в виде столбиков, вытянутых параллельно продольной оси кости, волокна коллагена здесь также вытянуты в продольном направлении, окружая столбики активно делящихся хондроцитов. В гипертрофической зоне отмечается увеличение клеточного объема и постепенное замещение коллагена II типа на короткие цепочки коллагена Х типа, специфичного для кальцифицирующегося хряща. В зоне кальцификации происходит процесс минерализации, который инициируется в области сосудов, располагающихся во внеклеточном матриксе между клетками гипертрофической зоны. Ширина эпифизарной ростовой пластинки обычно пропорциональна интенсивности деления клеток и, соответственно, скорости продольного роста. По мере созревания костной ткани клетки зародышевой зоны подвергаются дифференцировке и начинают распространяться в зону пролиферации. Затем в гипертрофической зоне и зоне кальцификации клетки претерпевают дегенеративные изменения и инкорпорируются в кость метафиза, что приводит к закрытию зон роста.
Стимулирующее влияние ГР на процесс остеогенеза заключается в ускорении пролиферации прехондроцитов за счет укорочения (примерно на 50%) продолжительности клеточного цикла, что обеспечивает более скорый переход к митозу. Активизация митотической активности клеток хрящевой ткани осуществляется благодаря посредническому действию инсуноподобных ростовых факторов. Помимо ростовой функции ГР активирует обмен костной ткани, вызывая усиление остеообразования и утолщение кортикального слоя. Параллельно с положительным влиянием на активность остеобластов, ГР и ИРФ-1 воздействуют и на популяцию остеокластов, стимулируя процесс остео резорбции. Сочетанное действие этих клеточных систем с доминированием остеообразования способствует активизации ремоделирования костной ткани. При акромегалии концентрация остекальцина положительно коррелирует с содержанием ГР и концентрацией ИРФ-1, тогда как адекватное лечение способствует нормализации этих показателей.
Отмечено влияние ГР на тканевой состав тела. Повышение его содержания в крови способствует увеличению соотношения между тощей и жировой массой тела. Вызываемое ГР усиление энергетического обмена обусловлено повышением мобилизации жира из депо, усилением транспорта свободных жирных кислот в печень и увеличением скорости их окисления. Липолитическое действие осуществляется благодаря присутствию в молекуле ГР жиромобилизующего пептида 31-44 с М.м. 5 кДа. Таким образом, гормон роста обладает анаболическим и адипокинетическим действием. Благодаря липолитическому эффекту в организме создаются условия для использования жирных кислот в тканевом обмене, сохраняя при этом необходимые резервы углеводов.
Воздействие ГР на углеводный обмен является комплексным, поскольку описано как инсулиноподобное, так и контринсулярное действие гормона. Первое из них выражается в стимуляции внутриклеточного транспорта глюкозы и аминокислот, активизации липогенеза и белкового синтеза. В течение первых 30 мин после введения ГР отмечается небольшое и картковременное снижение уровня гликемии. Напротив, отсроченный эффект от введения ГР, продолжающийся более 3-х часов, характеризуется континсулярным действием, как на органном, так и тканевом уровнях, которое проявляется повышением липолиза, замедлением периферической утилизации глюкозы и активизацией печеночной продукции глюкозы в кровь. Выявлено, что ГР ингибирует экспрессию гена, кодирующего синтез транспортера глюкозы 1 (ГЛЮТ-1). Неслучайно инсулинорезистентность является одним из типичных клинических проявлений акромегалии. У большинства больных акромегалией выявляется повышение скорости печеночной продукции глюкозы, подтверждая, что ГР ингибирует биологическое действие инсулина [30].
Таким образом, накопленные экспериментальные и клинические данные убедительно доказывают, что саморегулируемая соматотропная функция играет ведущую роль в формировании, развитии и поддержании функциональной активности всех тканей и органов, поэтому ее нарушение неминуемо повлечет за собой развитие в организме множественных и сочетанных изменений, оказывающих негативное влияние на состояние здоровья и качество жизни пациентов.
Источник:
Пронин В.С. Современная стратегия диагностики и лечения соматотропином / В. С. Пронин, Ю. Е. Потешкин, Е. П. Гитель, И. В. Васильева, Белышева Е С, М. Е. Морозова, Д. Е. Колода, С. Э. Мошенина, Е. В. Чаплыгина, Е. Л. Соркина, Е. В. Пронин, К. Ю. Жеребчикова, Н. А. Чуброва – Москва: “Гэотар- Медиа,” 2013.
Гормоны – вещества, вырабатываемые железами внутренней секреции и выделяемые в кровь, механизм их действия. Эндокринная система – совокупность эндокринных желез, обеспечивающих выработку гормонов. Половые гормоны.
Для нормальной жизнедеятельности человеку нужно множество веществ, которые поступают из внешней среды (пища, воздух, вода) или синтезируются внутри организма. При недостатке этих веществ в организме возникают различные нарушения, которые могут приводить к серьезным заболеваниям. К числу таких веществ, синтезируемых эндокринными железами внутри организма, относятся гормоны.
|
Большинство гормонов вырабатываются железами внутренней секреции. |
|||
Прежде всего следует отметить, что у человека и животных есть два типа желез. Железы одного типа – слезные, слюнные, потовые и другие – выделяют вырабатываемый ими секрет наружу и называются экзокринными (от греческого exo – вне, снаружи, krino – выделять). Железы же второго типа выбрасывают синтезируемые в них вещества в омывающую их кровь. Эти железы назвали эндокринными (от греческого endon – внутри), а вещества, выбрасываемые в кровь, – гормонами.
Таким образом, гормоны (от греческого hormaino – приводить в движение, побуждать) – биологически активные вещества, вырабатываемые эндокринными железами (смотри рисунок 1.5.15) или специальными клетками в тканях. Такие клетки можно обнаружить в сердце, желудке, кишечнике, слюнных железах, почках, печени и в других органах. Гормоны высвобождаются в кровоток и оказывают действие на клетки органов-мишеней, находящихся на удалении, либо непосредственно на месте их образования (местные гормоны).
Гормоны вырабатываются в небольших количествах, но длительное время сохраняются в активном состоянии и с током крови разносятся по всему организму. Основные функции гормонов это:
– поддержание внутренней среды организма;
– участие в обменных процессах;
– регуляция роста и развития организма.
Полный перечень гормонов и их функции представлены в таблице 1.5.2.
Таблица 1.5.2. Основные гормоны
| Гормон | Какой железой вырабатывается | Функция |
|---|---|---|
| Адренокортикотропный гормон | Гипофиз | Управляет секрецией гормонов коры надпочечников |
| Альдостерон | Надпочечники | Участвует в регуляции водно-солевого обмена: удерживает натрий и воду, выводит калий |
| Вазопрессин (антидиуретический гормон) | Гипофиз | Регулирует количество выделяемой мочи и вместе с альдостероном контролирует артериальное давление |
| Глюкагон | Поджелудочная железа | Повышает уровень глюкозы в крови |
| Гормон роста | Гипофиз | Управляет процессами роста и развития; стимулирует синтез белков |
| Инсулин | Поджелудочная железа | Понижает уровень глюкозы в крови; влияет на обмен углеводов, белков и жиров в организме |
| Кортикостероиды | Надпочечники | Оказывают действие на весь организм; обладают выраженными противовоспалительными свойствами; поддерживают уровень сахара в крови, артериальное давление и мышечный тонус; участвуют в регуляции водно-солевого обмена |
| Лютеинизирующий гормон и фолликулостимулирующий гормон | Гипофиз | Управляют детородными функциями, в том числе выработкой спермы у мужчин, созреванием яйцеклетки и менструальным циклом у женщин; ответственны за формирование мужских и женских вторичных половых признаков (распределение участков роста волос, объем мышечной массы, строение и толщина кожи, тембр голоса и, возможно, даже черты личности) |
| Окситоцин | Гипофиз | Вызывает сокращение мышц матки и протоков молочных желез |
| Паратгормон | Паращитовидные железы | Управляет формированием костей и регулирует выведение кальция и фосфора с мочой |
| Прогестерон | Яичники | Готовит внутреннюю оболочку матки для внедрения оплодотворенной яйцеклетки, а молочные железы — к выработке молока |
| Пролактин | Гипофиз | Вызывает и поддерживает выработку молока в молочных железах |
| Ренин и ангиотензин | Почки | Контролируют артериальное давление |
| Тиреоидные гормоны | Щитовидная железа | Регулируют процессы роста и созревания, скорость обменных процессов в организме |
| Тиреотропный гормон | Гипофиз | Стимулирует выработку и секрецию гормонов щитовидной железы |
| Эритропоэтин | Почки | Стимулирует образование эритроцитов |
| Эстрогены | Яичники | Управляют развитием женских половых органов и вторичных половых признаков |
Строение эндокринной системы. На рисунке 1.5.15 изображены железы, которые вырабатывают гормоны: гипоталамус, гипофиз, щитовидная железа, паращитовидные железы, надпочечники, поджелудочная железа, яичники (у женщин) и яички (у мужчин). Все железы и клетки, выделяющие гормоны, объединены в эндокринную систему.
Эндокринная система работает под контролем центральной нервной системы и совместно с ней осуществляет регуляцию и координацию функций организма. Общим для нервных и эндокринных клеток является выработка регулирующих факторов.
С помощью выделения гормонов эндокринная система, вместе с нервной, обеспечивает существование организма как единого целого. Рассмотрим такой пример. Если бы не было эндокринной системы, то весь организм представлял бы собой бесконечно запутанную цепь “проводов” – нервных волокон. При этом по множеству “проводов” пришлось бы последовательно отдавать одну-единственную команду, которую можно передать в виде одной “команды”, переданной “по радио”, сразу многим клеткам.
Эндокринные клетки производят гормоны и выделяют их в кровь, а клетки нервной системы (нейроны) вырабатывают биологически активные вещества (нейромедиаторы – норадреналин, ацетилхолин, серотонин и другие), выделяющиеся в синаптические щели.
Связующим звеном между эндокринной и нервной системами служит гипоталамус, являющийся одновременно и нервным образованием, и эндокринной железой.
|
Гипоталамус – высший центр эндокринной системы. |
|||
Он контролирует и объединяет эндокринные механизмы регуляции с нервными, являясь также мозговым центром вегетативной нервной системы. В гипоталамусе находятся нейроны, способные вырабатывать особые вещества – нейрогормоны, регулирующие выделение гормонов другими эндокринными железами. Центральным органом эндокринной системы является также гипофиз. Остальные эндокринные железы относят к периферическим органам эндокринной системы.
Как видно из рисунка 1.5.16, в ответ на информацию, поступающую от центральной и вегетативной нервной системы, гипоталамус выделяет специальные вещества – нейрогормоны, которые “дают команду” гипофизу ускорить или замедлить выработку стимулирующих гормонов.
Рисунок 1.5.16 Гипоталамо-гипофизарная система эндокринной регуляции:
ТТГ — тиреотропный гормон; АКТГ — адренокортикотропный гормон; ФСГ — фолликулостимулирующий гормон; ЛГ — лютенизирующий гормон; СТГ — соматотропный гормон; ЛТГ — лютеотропный гормон (пролактин); АДГ — антидиуретический гормон (вазопрессин)
Кроме того, гипоталамус может посылать сигналы непосредственно периферическим эндокринным железам без участия гипофиза.
К основным стимулирующим гормонам гипофиза относятся тиреотропный, адренокортикотропный, фолликулостимулирующий, лютеинизирующий и соматотропный.
Тиреотропный гормон действует на щитовидную и паращитовидные железы. Он активизирует синтез и выделение тиреоидных гормонов (тироксина и трийодтиронина), а также гормона кальцитонина (который участвует в кальциевом обмене и вызывает снижение содержания кальция в крови) щитовидной железой.
Паращитовидные железы вырабатывают паратгормон, который участвует в регуляции обмена кальция и фосфора.
Адренокортикотропный гормон стимулирует выработку кортикостероидов (глюкокортикоидов и минералокортикоидов) корковым веществом надпочечников. Кроме того, клетки коркового вещества надпочечника вырабатывают андрогены, эстрогены и прогестерон (в небольших количествах), ответственные, наряду с аналогичными гормонами половых желез, за развитие вторичных половых признаков. Клетки мозгового вещества надпочечника синтезируют адреналин, норадреналин и дофамин.
Фолликулостимулирующий и лютеинизирующий гормоны стимулируют половые функции и выработку гормонов половыми железами. Яичники женщин продуцируют эстрогены, прогестерон, андрогены, а яички мужчин – андрогены.
Соматотропный гормон стимулирует рост организма в целом и его отдельных органов (в том числе рост скелета) и выработку одного из гормонов поджелудочной железы – соматостатина, подавляющего выделение поджелудочной железой инсулина, глюкагона и пищеварительных ферментов. В поджелудочной железе имеются 2 вида специализированных клеток, сгруппированных в виде мельчайших островков (островки Лангерганса смотри рисунок 1.5.15, вид Г). Это альфа-клетки, которые синтезируют гормон глюкагон, и бета-клетки, продуцирующие гормон инсулин. Инсулин и глюкагон регулируют углеводный обмен (то есть уровень глюкозы в крови).
Стимулирующие гормоны активизируют функции периферических эндокринных желез, побуждая их к выделению гормонов, участвующих в регуляции основных процессов жизнедеятельности организма.
Интересно, что избыток гормонов, вырабатываемых периферическими эндокринными железами, подавляет выделение соответствующего “тропного” гормона гипофиза. Это яркая иллюстрация универсального регулирующего механизма в живых организмах, обозначаемого как отрицательная обратная связь.
Помимо стимулирующих гормонов, гипофиз вырабатывает также гормоны, непосредственно участвующие в контроле жизненных функций организма. К таким гормонам относятся: соматотропный гормон (о котором мы уже упоминали выше), лютеотропный гормон, антидиуретический гормон, окситоцин и другие.
Лютеотропный гормон (пролактин) контролирует выработку молока в молочных железах.
Антидиуретический гормон (вазопрессин) задерживает выведение жидкости из организма и повышает артериальное давление крови.
Окситоцин вызывает сокращение матки и стимулирует выделение молока молочными железами.
Недостаток гормонов гипофиза в организме компенсируют лекарственными средствами, которые восполняют их дефицит или имитируют их действие. К таким препаратам относятся в частности Нордитропин® Симплекс® (фирма “Novo Nordisk”), оказывающий соматотропное действие; Менопур (фирма “Ferring”), обладающий гонадотропными свойствами; Минирин® и Реместип® (фирма “Ferring”), действующие подобно эндогенному вазопрессину. Лекарства применяют и в тех случаях, когда по каким-то причинам нужно подавить активность гормонов гипофиза. Так, препарат Декапептил депо (фирма “Ferring”) блокирует гонадотропную функцию гипофиза и подавляет высвобождение лютеинизирующего и фоликулостимулирующего гормонов.
Уровень некоторых гормонов, контролируемых гипофизом, подвержен циклическим колебаниям. Так, менструальный цикл у женщин определяется месячными колебаниями уровня лютеинизирующего и фолликулостимулирующего гормонов, которые вырабатываются в гипофизе и воздействуют на яичники. Соответственно уровень гормонов яичников – эстрогенов и прогестерона – колеблется в таком же ритме. Каким образом гипоталамус и гипофиз управляют этими биоритмами – до конца не ясно.
Есть и такие гормоны, выработка которых изменяется по еще не понятным до конца причинам. Так, уровень кортикостероидов и гормона роста почему-то колеблется в течение суток: достигает максимума утром, а минимума – в полдень.
Механизм действия гормонов. Гормон связывается рецепторами в клетках-мишенях, при этом активируются внутриклеточные ферменты, что приводит клетку-мишень в состояние функционального возбуждения. Избыточное количество гормона действует на вырабатывающую его железу или через вегетативную нервную систему на гипоталамус, побуждая их к снижению выработки этого гормона (опять отрицательная обратная связь!).
|
Дружная и слаженная работа всех органов эндокринной системы является залогом нормальной жизнедеятельности нашего организма. |
|||
Наоборот, любой сбой в синтезе гормонов или нарушение функций эндокринной системы приводит к неприятным для здоровья последствиям. Например, при недостатке соматотропина, выделяемого гипофизом, ребенок остается карликом.
Всемирной организацией здравоохранения установлен рост среднего человека – 160 см (у женщин) и 170 см ( у мужчин). Человек ниже 140 см или выше 195 см считается уже очень низким или очень высоким. Известно, что римский император Маскимилиан имел рост 2,5 м, а египетская карлица Агибе была ростом всего 38 см!
Недостаток гормонов щитовидной железы у детей приводит к развитию умственной отсталости, а у взрослых – к замедлению обмена веществ, снижению температуры тела, появлению отеков.
Известно, что при стрессе увеличивается выработка кортикостероидов и развивается “синдром недомогания”. Возможности организма приспосабливаться (адаптироваться) к стрессу во многом зависят от способности эндокринной системы быстро отвечать снижением выработки кортикостероидов.
При недостатке инсулина, производимого поджелудочной железой, возникает тяжелое заболевание – диабет.
Стоит отметить, что по мере старения (естественного угасания организма) складываются различные соотношения гормональных компонентов в организме.
Так наблюдается уменьшение образование одних гормонов и увеличение других. Уменьшение активности эндокринных органов происходит с разной скоростью: к 13-15 годам – наступает атрофия вилочковой железы, концентрация в плазме крови тестостерона у мужчин постепенно снижается уже после 18 лет, секреция эстрогенов у женщин уменьшается после 30 лет; продукция гормонов щитовидной железы ограничивается только к 60-65 годам.
Половые гормоны. Существуют два вида половых гормонов – мужские (андрогены) и женские (эстрогены). В организме и у мужчин, и у женщин присутствуют оба вида. От их соотношения зависит развитие половых органов и формирование вторичных половых признаков в подростковый период (увеличение грудных желез у девочек, появление волос на лице и огрубение голоса у мальчиков и тому подобное). Вам, наверное, приходилось видеть на улице, в транспорте старушек с грубым голосом, усиками и даже бородкой. Объясняется это достаточно просто. С возрастом у женщин снижается выработка эстрогенов (женских половых гормонов), и может случиться, что мужские половые гормоны (андрогены) станут преобладать над женскими. Отсюда – и огрубение голоса, и избыточное оволосение (гирсутизм).
Как известно мужчины, больные алкоголизмом страдают выраженной феминизацией (вплоть до увеличения грудных желез) и импотенцией. Это тоже результат протекания гормональных процессов. Многократный прием алкоголя мужчинами приводит к подавлению функции яичек и снижению в крови концентрации мужского полового гормона – тестостерона, которому мы обязаны чувством страсти и полового влечения. Одновременно надпочечники увеличивают выработку веществ, близких по строению к тестостерону, но не оказывающих на мужскую половую систему активирующего (андрогенного) действия. Это обманывает гипофиз, и он уменьшает свое стимулирующее влияние на надпочечники. В результате выработка тестостерона еще более уменьшается. При этом введение тестостерона мало помогает, так как в организме алкоголика печень превращает его в женский половой гормон (эстрон). Получается, что лечение только ухудшит результат. Так что мужчинам приходится выбирать, что для них важнее: секс или алкоголь.
Трудно переоценить роль гормонов. Их работу можно сравнить с игрой оркестра, когда любой сбой или фальшивая нота нарушают гармонию. На основе свойств гормонов создано много лекарственных препаратов, применяемых при тех или иных заболеваниях соответствующих желез. Более подробная информация о гормональных препаратах представлена в главе 3.3.















