Всего: 16 1–16
Добавить в вариант
В результате реакции тримеризации ацетилена объёмом 26,88 л (н.у) получили 23,4 г бензола. Вычислите массовую долю выхода продукта реакции (%) от теоретически возможного. (Запишите число с точностью до целых.)
Источник: Демонстрационная версия ЕГЭ—2022 по химии
Из 200 кг карбоната кальция при взаимодействии с азотной кислотой был получен нитрат кальция массой 311,6 кг. Вычислите выход (%) данной реакции. (Запишите число с точностью до целых.)
Из смеси 1 м3 угарного газа и 2 м3 водорода получен 1 кг метанола. Чему равен выход метанола (в %)? Объёмы газов даны при нормальных условиях. (Запишите число с точностью до целых.)
При пиролизе 56 л метана образовалось 16,8 л ацетилена. Объёмы газов измерены при одинаковых условиях. Вычислите выход продукта реакции (в %). Ответ запишите с точностью до целых.
Источник: СтатГрад: Тренировочная работа 06.02.2023. Вариант ХИ2210301.
Водород смешали с избытком азота, ввели в реактор для синтеза аммиака и добавили катализатор. Масса образовавшегося аммиака оказалась в 2 раза больше исходной массы водорода. Рассчитайте выход аммиака (в % от теоретического). (Запишите число с точностью до десятых.)
Водород смешали с избытком азота, ввели в реактор для синтеза аммиака и добавили катализатор. Выход аммиака составил 26,5%. Во сколько раз масса образовавшегося аммиака больше исходной массы водорода? (Запишите число с точностью до десятых.)
Вычислите объём водорода (л), который можно получить при разложении 224 л метана до простых веществ, если выход реакции равен 80%. Объёмы газов измерены при одинаковых нормальных условиях. (Запишите число с точностью до десятых.)
При окислении 150 л оксида углерода(II) образовалось 123,2 л оксида углерода(IV). Вычислите объемную долю примесей (%) в исходном угарном газе. Объёмы газов измерены при одинаковых нормальных условиях. (Запишите число с точностью до десятых.)
При разложении нитрата меди(II) образовалось 11,2 л оксида азота(IV). Вычислите объёмную долю (%) образовавшегося кислорода. Объёмы газов измерены при одинаковых нормальных условиях. (Запишите число с точностью до целых.)
При полном сгорании 120 л аммиака выделилось 56 л азота. Вычислите объёмную долю (%) примесей в исходном аммиаке. Объемы газов измерены при одинаковых и нормальных условиях. (Запишите число с точностью до целых.)
Сколько литров аммиака (н. у.) потребуется для получения 90 г карбамида по реакции с углекислым газом, если выход продукта составляет 60%? (Запишите число с точностью до целых.)
При окислении 215 л аммиака в присутствии катализатора выделилось 212,8 л оксида азота(II). Вычислите объемную долю (%) примесей в исходном аммиаке. Объемы газов измерены при нормальных, одинаковых условиях. (Запишите число с точностью до сотых.)
При разложении 68 г нитрата серебра образовалось 8 л оксида азота(IV). Вычислите выход реакции (%). Объемы газов измерены при нормальных условиях. (Запишите число с точностью до десятых.)
При окислении 175 л аммиака в присутствии катализатора выделилось 134,4 л оксида азота(II). Вычислите объемную долю (%) примесей в исходном аммиаке. Объемы газов измерены при одинаковых нормальных условиях. (Запишите число с точностью до десятых.)
При разложении нитрата цинка образовалось 33,6 л кислорода. Вычислите объёмную долю (%) образовавшегося оксида азота(IV). Объёмы газов измерены при одинаковых нормальных условиях. (Запишите число с точностью до целых.)
При разложении нитрата цинка образовалось 22,4 л кислорода. Вычислите объёмную долю (%) образовавшегося оксида азота(IV). Объёмы газов измерены при одинаковых нормальных условиях. (Запишите число с точностью до десятых.)
Всего: 16 1–16
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Выход продукта реакции η — это отношение практически полученной массы (количества вещества, объема) продукта к теоретической (рассчитанной по уравнению реакции) массе (количеству вещества, объему) этого продукта:
Задания с полным ответом с решениями
1. Сколько граммов оксида серы(IV) образуется при сжигании 10 г технической серы, содержащей 96% чистой серы, если выход реакции составляет 90%?
2. Карбонат кальция массой 48 г, содержащий в качестве примеси 4% сульфата кальция, обработали избытком раствора соляной кислоты. Определите объем полученного газа, если выход реакции составил 95%.
3. Определите объем сернистого газа в литрах (н.у.), образовавшегося при обжиге 180 г пирита, содержащего 92% FeS2, если выход реакции составил 93,8%. Ответ запишите в виде целого числа без указания единиц измерения.
4. Сколько граммов карбоната кальция необходимо подвергнуть термическому разложению, чтобы выделившийся углекислый газ образовал с избытком гидроксида бария осадок массой 9,85 г, если выход реакции разложения карбоната кальция равен 90%, а выход реакции взаимодействия углекислого газа с гидроксидом бария равен 95%?
5. Пронитровали 60 г ароматического углеводорода. Образовавшееся единственное мононитропроизводное восстановили железом в кислой среде и получили с выходом 76,7% вещество, которое полностью поглощает газ, выделяющийся при действии избытка концентрированной серной кислоты на 29,25 г хлорида натрия. Определите исходный углеводород.
6. Определите массу простого эфира, которая получится из 100 г этанола, если реакция дегидратации протекает с выходом 85%.
7. Технический цинк массой 124 г, содержащий в качестве примеси 2% оксида цинка, обработали избытком раствора соляной кислоты. Определите объем полученного газа, если выход реакции составил 93,1%.
8. Определите массовую долю примесей в угле, если при сгорании 42 г угля было получено с выходом 85% 60 л (н.у.) углекислого газа.
9. Определите массу бензола, который можно получить из ацетилена, полученного при взаимодействии 19,2 г карбида кальция с избытком воды, если выход ацетилена составляет 83,3%, а выход бензола — 84,6%.
10. Массовая доля целлюлозы в древесине равна 50%. Какая масса раствора спирта, содержащего 10% воды, может быть получена при гидролизе 100 кг древесных опилок и брожения полученной глюкозы, если выход этанола в процессе брожения равен 75%?
Ответы на задания раздела 4.3.8
1. 17,3 г 2. 9,8 л 3. 58 л 4. 5,84 г 5. С7Н8 6. 68,4 г 7. 39 л 8. 0,10 9. 5,5 г 10. 23,7 кг
Решения заданий раздела 4.3.8
Решение 1. Предварительно определим массу чистой серы в 10 г технической серы:
Определим количество вещества серы:
Из уравнения S + О2 = SO2 видно, что v(SO2) = v(S) = 0,3 моль.
Отсюда m(SO2) = v ∙ M = 0,3 ∙ 64 = 19,2 г. Имея mтеор. = 19,2 г, η = 0,9 и формулу находим:
Ответ: 17,3 г.
Решение 2. Поскольку смесь состоит из СаСО3 и CaSО4, то
Отсюда v(CaCО3) = m/М = 46,1/100 = 0,461 моль.
Записываем уравнение реакции:
Видно, что vтеор.(CO2) = v(CaCO3) = 0,461 моль.
С учетом выхода углекислого газа находим
Отсюда
Ответ: 9,8 л.
Решение 3. Находим массу и количество вещества FeS2 в пирите:
Запишем уравнение реакции:
Из уравнения реакции находим:
Из формулы η = vnpакт/vтеор находим:
Находим объем газа:
Ответ: 58 л.
Решение 4. Записываем уравнения реакций:
Находим количество вещества осадка — карбоната бария:
Находим
Из уравнения (2) видно, что для получения одного моля ВаСО3 надо взять один моль СО2, значит, для получения 0,0526 моль ВаСО3 надо практически взять 0,0526 моль СО2.
Таким образом, при разложении СаСО3 надо практически получить vnpaкт(CО2) = 0,0526 моль.
Отсюда
Из уравнения (1) видно, что для получения 0,0584 моль СО2 надо иметь такое же количество вещества СаСО3, то есть v(CaCО3) = 0,0584 моль.
Отсюда масса необходимого карбоната кальция равна:
Ответ: 5,84 г.
Решение 5. Общая формула гомолога бензола: СnН2n-6.
Из уравнений реакций (4) и (3) видно, что
Поскольку реакция по уравнению (2) шла не количественно, а с определенным выходом η, находим
Из уравнений реакций (2) и (1) видно, что Отсюда
Формула углеводорода — С7Н8. Углеводород — толуол.
Ответ: С7Н8.
Решение 6. Находим:
По уравнению реакции находим количество вещества эфира:
Видно, что
Находим теоретическую массу эфира:
Практически получено
Ответ: 68,4 г.
Решение 7. Поскольку технический цинк — это смесь цинка и оксида цинка, то
Отсюда v(Zn) = m/М = 121,5/65 = 1,87 моль.
Записываем уравнение реакции:
Видно, что vтeор(H2) = v(Zn) = 1,87 моль.
С учетом выхода водорода находим
Отсюда
Ответ: 39 л.
Решение 8. Определим теоретически возможный объем и количество вещества углекислого газа. Из формулы находим:
Отсюда
Запишем уравнение реакции: С + О2 = СО2.
Из уравнения реакции находим v(C) = v(CО2) = 3,15 моль.
Отсюда
Находим массу примесей и массовую долю примесей в угле:
Ответ: 0,10.
Решение 9. Записываем уравнения реакций:
Находим v(CaC2) = m/М = 19,2/64 = 0,30 моль.
Из уравнения (1) видно, что
С учетом выхода ацетилена находим
Из уравнения (2) видно, что
С учетом выхода бензола находим Отсюда
Ответ: 5,5 г.
Решение 10. Находим массу целлюлозы в древесине: При этом
Записываем уравнения реакций:
Из уравнения (1) видно, что
Из уравнения (2) видно, что
С учетом выхода этанола находим
Отсюда а
Ответ: 23,7 кг.
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
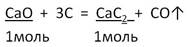 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
4 мая 2021
В закладки
Обсудить
Жалоба
В данной брошюре собраны задания 34 из второй части экзаменационной работы по химии.
По итогам ЕГЭ по химии 2020 года возникло много вопросов при решении 34 задания. Это задания повышенной сложности. Правильно выполненное 34 задание дает выпускнику 4 балла. Выполнить такое задание выпускник должен за 10-15 минут. Выпускник выполняет следующие расчеты при решении 34 задачи: «Расчеты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного. Расчеты массовой доли (массы) химического соединения в смеси» (из спецификации КИМа 2020 года). При этом выпускник должен учитывать, что продукты реакции могут покидать сферу реакции в виде осадка или газа, чтобы правильно рассчитать массу конечного раствора. Задачи, решенные в данной брошюре, помогут выпускникам понять логические приемы при решении задач и быстрее выполнить подобное задание на ЕГЭ. Данный материал помогает выпускникам освоить некоторые типы задач повышенного уровня сложности.
34himiya.docx
34himiya.pdf
Автор: Наталья Алексеевна Черноиванова.
Скачать материал

Скачать материал


- Сейчас обучается 66 человек из 32 регионов


- Сейчас обучается 111 человек из 49 регионов


- Курс добавлен 13.12.2022


Описание презентации по отдельным слайдам:
-
1 слайд
Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного
-
-
-
-
-
-
-
8 слайд
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
Решение
Находим по ПСХЭ молярные массы подчёркнутых веществ
M(Mg) = 24 г/моль
M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль
Находим количество вещества реагента по формулам -
9 слайд
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
Решение
Находим по ПСХЭ молярные массы подчёркнутых веществ
M(Mg) = 24 г/моль
M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль
Находим количество вещества реагента по формулам
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль -
10 слайд
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
Решение
вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции -
11 слайд
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
Решение
m = ν · M
mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) =
= 120 г/моль · 0,05 моль = 6 г -
12 слайд
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
Решение
Находим массовую (объёмную) долю выхода продукта по формуле -
13 слайд
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
Решение(MgSO4)=(5,5г ·100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим -
14 слайд
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Дано:
m(CaO) = 16,8 г

=80% или 0,8____________________
Найти:
m практ (CaC2) = ?
Решение
Находим по ПСХЭ молярные массы подчёркнутых веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC2) = 40 + 2 · 12 = 64г/моль -
15 слайд
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Дано:
m(CaO) = 16,8 г

=80% или 0,8____________________
Найти:
m практ (CaC2) = ?
Решение
Находим количество вещества реагента по формулам
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль -
16 слайд
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Дано:
m(CaO) = 16,8 г

=80% или 0,8____________________
Найти:
m практ (CaC2) = ?
Решение
вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции -
17 слайд
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Дано:
m(CaO) = 16,8 г

=80% или 0,8____________________
Найти:
m практ (CaC2) = ?
Решение
Находим массовую (объёмную) долю выхода продукта по формуле
m практич (CaC2) = 0,8 · 19,2 г = 15,36 гОтвет: m практич (CaC2) = 15,36 г
-
18 слайд
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
= 85% или 0,85
___________________
Найти:
m(Na2CO3) =?
Решение
Находим по ПСХЭ молярные массы веществ, если это необходимо
M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль
Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы -
19 слайд
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
= 85% или 0,85
___________________
Найти:
m(Na2CO3) =?
Решение
Vтеоретич(CO2) =
= 28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6 (л) / 22,4 (л/моль) =
=1,5 моль
Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. -
20 слайд
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
= 85% или 0,85
___________________
Найти:
m(Na2CO3) =?
Решение
Находим количество вещества реагента по УХР
следовательно
ν(Na2CO3) = ν(CO2) = 1,5 моль -
21 слайд
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
= 85% или 0,85
___________________
Найти:
m(Na2CO3) =?
Решение
Определяем массу (объём) реагента по формуле:
m = ν · M
V = ν · Vm
m = ν · M
m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г
Ответ -
22 слайд
Задача №1.
При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
-
23 слайд
Задача № 2
Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 155 089 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы

- 03.02.2020
- 290
- 6
- 03.02.2020
- 327
- 2

- 03.02.2020
- 198
- 3





Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Управление персоналом и оформление трудовых отношений»
-
Курс повышения квалификации «Методика написания учебной и научно-исследовательской работы в школе (доклад, реферат, эссе, статья) в процессе реализации метапредметных задач ФГОС ОО»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Основы построения коммуникаций в организации»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Управление ресурсами информационных технологий»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Управление сервисами информационных технологий»
-
Курс профессиональной переподготовки «Управление информационной средой на основе инноваций»
-
Курс профессиональной переподготовки «Техническая диагностика и контроль технического состояния автотранспортных средств»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
Определение выхода продукта реакции
Массовая (объемная,мольная доля) выхода продукта реакции — 
• Количество продуктов реакции,которое получается из реагентов по уравнению реакции- это теоретическое количество (масса,объем,количество вещества).В формуле их обозначают соответственно mтеор,Vтеор,nтеор
• Количество продуктов реакции,которое реально получено -это практическое количество (масса,объем,количество вещества).В формуле их обозначают соответственно mпр,Vпр,nпр
• Практические данные всегда меньше теоретических,тк на практике неизбежны потери
• Выход продукта реакции можно измерять в процентах или в долях единицы
1.При хлорировании 112 л метана (н.у.) получено 255 г дихлорметана.Определите выход реакции
2.Определите выход реакции каталитического окисления аммиака кислородом,если при окислении 10 моль аммиака получено 200 л оксида азота(II)
3.0,64 кг оксида кальция прокалили с кремнеземом.В результате реакции получили 1,024 кг силиката кальция.Определите выход продукта реакции в % с точностью до целых
4.Из 36 г метанола дегидратацией получили 24 г диметилового эфира.Рассчитайте выход реакции дегидратации.
5.При бромировании 5,4 г дивинила избытком брома получено 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции в %
6.Из 69 г этанола получено 36,85 г бутадиена-1,3.Определите массовую долю практического выхода продукта реакции
7.Определите объем метана,который потребуется для получения 63 л ацетилена (н.у.),если выход реакции составляет 85%
8.Какое количество аммиака получится при действии избытка р-ра гидроксида натрия на 500 г сульфата аммония,если выход реакции составляет 70%?
9.Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
10. объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
11. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
12. Найти массу нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
13. При термическом разложении незагрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложения и объем (н.у.) образовавшегося углекислого газа.
14 .Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.

























