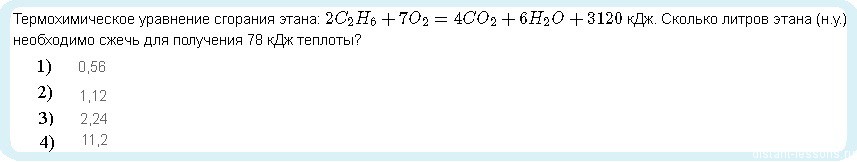Всего: 46 1–20 | 21–40 | 41–46
Добавить в вариант
Задания Д28 № 774
В соответствии с термохимическим уравнением
для получения 10,8 г серебра необходимо затратить теплоту в количестве
1) 31,7 кДж
2) 158,5 кДж
3) 5,3 кДж
4) 15,85 кДж
При полном восстановлении 48 г оксида железа(III) избытком алюминия выделилось 256,2 кДж теплоты. Вычислите теплоту реакции
(в кДж на моль
)
В расчётах используйте целые относительные атомные массы элементов. Ответ дайте в кДж с точностью до целых.
Термохимическое уравнение горения этана имеет следующий вид:
Сколько теплоты выделится при полном сгорании 12 г этана? Ответ дайте в кДж в виде целого числа.
Термохимическое уравнение горения бутана имеет следующий вид:
Сколько теплоты выделится при полном сгорании 23,2 г бутана? Ответ дайте в кДж в виде целого числа.
Дано термохимическое уравнение реакции разложения дихромата аммония:
В результате реакции выделилось 75 кДж теплоты. Сколько граммов оксида хрома(III) образовалось? Ответ округлите до ближайшего целого числа.
Дано термохимическое уравнение реакции синтеза мочевины:
В результате реакции выделилось 25 кДж теплоты. Сколько граммов мочевины образовалось? Ответ округлите до ближайшего целого числа.
Окисление диоксида серы протекает в соответствии с термохимическим уравнением
Вычислите количество теплоты, которое выделится при окислении 268,8 л (н. у.) диоксида серы. Ответ дайте в кДж с точностью до целых.
Источник: ЕГЭ по химии 2020. Досрочная волна. Вариант 2
Определите количество теплоты, которое выделилось в результате взаимодействия 14 г оксида кальция с водой в соответствии с термохимическим уравнением реакции:
Ответ дайте в кДж с точностью до десятых.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 1
Определите количество теплоты, которое выделится при сгорании 11,2 л угарного газа (при н. у.) в соответствии с термохимическим уравнением:
Ответ дайте в кДж с точностью до десятых.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
Восстановление оксида железа(III) протекает в соответствии с термохимическим уравнением реакции:
Вычислите количество теплоты, которое поглотилось при восстановлении 10 моль оксида железа(III). Ответ дайте в кДж с точностью до целых.
Вычислите количество теплоты, выделяющееся при разложении 51,2 г нитрита аммония в соответствии с термохимическим уравнением реакции:
Запишите число с точностью до десятых.
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
В реакцию, термохимическое уравнение которой
вступило 88 г углекислого газа. Вычислите количество теплоты, которое выделится при этом. Ответ дайте в кДж с точностью до целых.
Источник: ЕГЭ по химии 2017. Досрочная волна
Термохимическое уравнение горения алюминия имеет вид
В результате реакции выделилось 502,5 кДж теплоты. Сколько граммов алюминия вступило в реакцию? Ответ округлите до десятых.
Термохимическое уравнение горения хрома имеет вид:
В результате реакции выделилось 342 кДж теплоты. Сколько граммов хрома вступило в реакцию? Ответ округлите до десятых.
Дано термохимическое уравнение:
Сколько литров этилена (н. у.) надо сжечь, чтобы получить 500 кДж теплоты? Ответ округлите до ближайшего целого числа.
Дано термохимическое уравнение:
В результате реакции выделилось 257,5 кДж теплоты. Сколько граммов металла сгорело? Ответ округлите до целых.
Дано термохимическое уравнение:
В результате реакции выделилось 2480 кДж теплоты. Сколько граммов металла сгорело? Ответ округлите до целых.
Обжиг известняка протекает в соответствии с термохимическим уравнением
Определите количество теплоты (в кДж), которое потребовалось для реакции, если в результате выделилось 640 мл газа (н. у.)? (Запишите число с точностью до десятых.)
Термохимическое уравнение сгорания ацетилена имеет вид:
Сколько теплоты (в кДж) выделится при сжигании 5,6 л (н. у.) ацетилена? (Запишите число с точностью до целых.)
Горение угарного газа описывается термохимическим уравнением:
Сколько литров в пересчёте на н. у.) потребуется для получения 70,75 кДж теплоты по этой реакции? (Запишите число с точностью до десятых.)
Всего: 46 1–20 | 21–40 | 41–46
Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + Q
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
n(C6H12O6) = m(C6H12O6) / M(C6H12O6) = 45 г / 180 г/моль = 0,25 моль
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
0,25 / 1 = 700 / Q
Решая которое, находим, что:
Q = 2800 кДж
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
n(Al2O3) = m(Al2O3) / M(Al2O3) = 68 г / 102 г/моль = 0,667 моль
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
4 моль Al2O3 — 3330 кДж
0,667 моль Al2O3 — x кДж
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
x = 4 моль
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
C + O2 = CO2 + Q
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
2KNO3 → 2KNO2 + O2 – Q
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
4NH3 + 3O2 → 2N2 + 6H2O + Q
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения. Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
2Аl + 3/2О2 → Аl2О3 + 1675 кДж
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
4Аl + 3О2 → 2Аl2О3 + 3350 кДж
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
СН4 + 2О2 → СО2 + 2Н2О + 802 кДж
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
N2 + O2 → 2NО – 180 кДж
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
m (H2O)=108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
S(ромб) + O2(г) = SO2(г) + 296 кДж,
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Q = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Определение теплового эффекта химической реакции
В процессе химической реакции связи в исходных веществах разрываются и образуются новые связи, благодаря чему образуются новые вещества — продукты реакции. Разрыв связи протекает с поглощением энергии, а образование — с выделением, то есть химические реакции сопровождаются энергетическими эффектами.
Как правило, энергия выделяется или поглощается в виде теплоты, поэтому мы говорим, что протекание химической реакции сопровождается тепловым эффектом.
Тепловой эффект химической реакции — это количество теплоты, которое поглощается или выделяется в результате протекания химической реакции.
Если исходные вещества были менее устойчивыми (поглощается небольшое количество энергии), а образуются устойчивые (выделяется большое количество энергии), то в результате химической реакции выделяется тепловой эффект.
И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты.
Рассмотрим эти процессы на рисунке:
В зависимости от того, выделяется или поглощается теплота, различают два типа химических реакций: экзотермические и эндотермические.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Экзотермические реакции
Экзотермические реакции протекают с выделением теплоты.
Запоминаем
Q — обозначение теплового эффекта химической реакции.
Единица измерения — килоджоули (кДж) или джоули (Дж).
1 кДж = 1 000 Дж.
В экзотермических реакциях количество выделившейся теплоты указывают со знаком «+».
Например, при сгорании угля:
C(тв) + O2 (г) = CO2 (г) + Q.
Чтобы запустить эту и некоторые другие реакции, нужна инициация, или, проще говоря, пинок. В случае с реакцией горения угля это нагрев (поджигание).
К экзотермическим реакциям относятся реакции горения и реакции соединения.
Реакции горения
Пример — реакция горения метана в атмосфере кислорода:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
Реакции соединения
Пример — образование воды из двух простых веществ, при этом выделяется 484 кДж:
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж.
Исключение
При образовании оксида азота (II) и йодоводорода реакции протекают с поглощением теплоты:
N2 (г) + O2 (г) = 2NO (г) − 180 кДж.
Эндотермические реакции
Эндотермические реакции протекают с поглощением теплоты. Количество поглощенной теплоты указывают со знаком «−».
К эндотермическим реакциям чаще всего относят реакции разложения.
Например, реакции разложения нитрата калия и карбоната кальция:
2KNO3(тв) → 2KNO2(тв) + O2 (г) – Q;
CaCO3(тв) = CaO(тв) + CO2 (г) − 170 кДж.
Термохимические уравнения
Уравнения реакций, в которых указано количество выделившейся теплоты, называют термохимическими.
В термохимических уравнениях всегда указывают агрегатные состояния веществ, так как от этого зависит значение теплового эффекта.
Важно
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
Рассмотрим термохимическое уравнение сгорания газа метана:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
Глядя на уравнение, можно сделать вывод, что при сгорании 1 моля газообразного метана в 2 молях газообразного кислорода выделяется 802 кДж теплоты сгорания.
Теплота сгорания — это количество теплоты, выделяющееся при горении 1 моля вещества.
Если в реакцию вступит в 5 раз больше метана, чем в представленном термохимическом уравнении, то есть не 1 моль метана, а 5, то тепловой эффект будет пропорционально больше, то есть не 802 кДж, а 802 ⨯ 5 = 4 010 кДж.
Практика
Рассмотрим несколько термохимических расчетов для типовых заданий.
Задача 1
Рассчитайте количество теплоты, выделившейся в результате реакции образования метана, термохимическое уравнение которой —
C(тв) + 2H2 (г) = CH4 (г) + 76 кДж,
из: а) 0,3 моля углерода; б) 2,4 г углерода; в) 2,24 л водорода.
Решение.
Важно помнить, что количество теплоты, которая выделяется в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
а) Из термохимического уравнения видно, что при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,3 моля С выделяется x кДж.
Составим уравнение и решим его:
1 моль × х = 76 кДж × 0,3 моля;
.
б) Для начала найдем количество вещества прореагировавшего углерода. Для этого разделим его массу m на молярную массу M:
.
Молярная масса углерода равна 12 г/моль (значение из таблицы Менделеева).
Тогда
.
В соответствии с термохимическим уравнением при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,2 моля выделяется х кДж.
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,2 моля;
.
в) Для начала найдем количество вещества вступившего в реакцию водорода. Для этого разделим его объем V на молярный объем Vm:
.
Молярный объем любого вещества равен 22,4 л/моль.
Тогда
.
В соответствии с термохимическим уравнением при взаимодействии 2 молей H выделяется 76 кДж, тогда при взаимодействии 0,1 моля выделяется х кДж.
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,1 моля;
.
Задача 2
В результате реакции, термохимическое уравнение которой —
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж,
выделилось 1 360 кДж. Вычислите: а) объем (н. у.) вступившего в реакцию кислорода; б) массу образовавшейся воды.
Решение.
а) В соответствии с термохимическим уравнением при взаимодействии
1 моля кислорода выделяется 484 кДж, тогда при взаимодействии
х молей кислорода выделяется 1 360 кДж.
Этой пропорции соответствует уравнение:
1 моль × 1 360 кДж = 484 кДж × х молей;
.
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
V = n(H) × Vm, где Vm — молярный объем;
V(H) = 2,81 моля × 22,4 л/моль = 62,95 л.
б) В соответствии с термохимическим уравнением при взаимодействии
2 молей воды выделяется 484 кДж, тогда при взаимодействии
х молей кислорода выделяется 1 360 кДж.
Этой пропорции соответствует уравнение:
2 моля × 1 360 кДж = 484 кДж × х молей;
.
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
m(H2O) = n(H2O) × M(H2O), где M — молярная масса;
M(H2O) = 1 × 2 + 16 × 1 = 18 г/моль;
m(H2O) = 5,62 моля × 18 г/моль = 101,16 г.
Еще больше задач, да еще и в интерактивном формате — на онлайн-курсах по химии в школе Skysmart.
Вопросы для самопроверки
-
Что такое тепловой эффект?
-
На какие типы делятся реакции по тепловому эффекту?
-
Приведите примеры реакций, которые протекают с выделением теплоты.
-
Какие уравнения называют термохимическими?
-
Рассчитайте количество теплоты, которая выделится при сгорании 0,7 моля метана. Термохимическое уравнение реакции:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
Расчет объёмных отношений газов при химических реакциях. Тепловой эффект химических реакций.
1. Определите объём (н.у.) оксида азота (II), который образуется при реакции 50 л (н.у.) азота с избытом кислорода. Ответ: ____ л (Запишите число с точностью до целых.)
Решение
N2 + O2 = 2NO
По закону объёмных отношений «Объёмы газов, вступивших в реакцию и образовавшихся в результате реакции, относятся между собой как небольшие целые числа»
V(NO)/V(N2) = 2/1
V(NO) = 50*2 =100л
Ответ: 100л
2. Определите объём (н.у.) оксида углерода (IV), который образуется при сжигании 50 л (н.у.) пропана в избытке кислорода.
Ответ: ____ л (Запишите число с точностью до целых.)
Решение
C3H8 + 5O2= 3CO2 + 4H2O
V(C3H8)/V(CO2) = 1/3
V (CO2) = 3*50 = 150 л
Ответ: 150л
3. Определите объём (н.у.) газа, который образуется при взаимодействии 50 л (н.у.) оксида азота(II) с избытком кислорода. Ответ: ____ л (Запишите число с точностью до целых.
Решение
2NO + O2 = 2NO2
V(NO)/V(NO2) = 1/1
V(NO2) = 50л
4. Определите объём (н.у.) газа, который образуется при взаимодействии 50 л (н.у.) оксида углерода (II) с избытком кислорода. Ответ: ____ л (Запишите число с точностью до целых.)
Решение
2СO + O2 = 2СO2
V(NO)/V(NO2) = 1/1
V(NO2) = 50л
Ответ: 50л
5. При взаимодействии оксида серы (IV) c 5,6 л (н.у.) кислорода в соответствии с
уравнением 2SO2(г) + O2(г) = 2SO3(г) + Q
выделилось 19 кДж теплоты. Определите тепловой эффект этой реакции.
(Запишите число с точностью до целых.) Ответ: ____ кДж
Решение
n(SO2)=V/Vm=5,6/22,4 = 0,25 моль
0,25 моль O2 – выделяется 19 кДж теплоты
1 моль O2 – выделяется х кДж теплоты
x =19/0,25 = 76 кДж
Ответ: 76 кДж
6. Какой объём (н.у.) оксида углерода (IV) (в литрах) образуется при окислении 2 л (н.у.) оксида углерода (II) кислородом воздуха?
Ответ: ____ л (Запишите число с точностью до целых.)
Решение
2СO + O2 = 2СO2
V(СO)/V(CO2) = 1/1
V(СO2) = 2л
Ответ: 2л
7. Какой объём (н.у.) оксида углерода (II) (в литрах) можно окислить 27 л (н.у.) кислорода?
Ответ: ____ л (Запишите число с точностью до целых.)
Решение
2СO + O2 = 2СO2
V(СO)/V(O2) = 2/1
V(СO) = 2*27 = 54л
Ответ: 54л
8. Какой объём (н.у.) кислорода (в литрах) необходим для получения 80 л (н.у.) оксида углерода (IV) из угля? Ответ: ____ л (Запишите число с точностью до целых.)
Решение
С + O2 = СO2
n(СO2) =V/Vm = 80/22.4= 3,57 моль
n(O2) = n(СO2) = 3,57 моль
V(O2) = n *Vm = 3,57 моль* 22,4 л/моль = 80л
Ответ: 80л
9. Какой объём (н.у.) кислорода (в литрах) необходим для полного сгорания 28 л (н.у.) метана? Ответ: ____ л (Запишите число с точностью до целых.)
Решение
СН4 + 2О2 = СО2 + 2Н2О
V(СН4)/V(O2) = 1/2
V(O2) =2* V(СН4) = 28* 2= 56л
Ответ: 56л
10. Какой объём (н.у.) кислорода (в литрах) необходим для получения 95 л (н.у.) оксида серы (IV) из серы? Ответ: ____ л (Запишите число с точностью до целых.)
S + O2 = SO2
n(SO2) = 95/22,4=4,24 моль
n(O2) = n(SO2) = 4,24 моль
V(O2) = 4,24 моль* 22,4л/моль = 95л
Ответ: 95л
11. В результате реакции, термохимическое уравнение которой
MgCO3(тв) = MgO(тв) + CO2(г) – 102 кДж,
выделилось 4,48 л (н.у.) углекислого газа. Определите количество теплоты (в
килоджоулях), затраченной при этом.
Ответ: ____ кДж (Запишите число с точностью до десятых.)
Решение
n(CO2) =4,48/22,4 = 0,2 моль
Выделилось 0,2 моль CO2 – затрачено х кДж теплоты
Выделилось 1 моль CO2 – затрачено 102 кДж теплоты
х = 0,2 * 102 = 20,4 кДж
Ответ: 20,4 кДж
12. В результате реакции, термохимическое уравнение которой
FeO(тв) + H2(г) = Fe(тв) + H2O(ж) – 21 кДж
израсходовалось 10 г водорода. Определите количество теплоты (в килоджоулях), затраченной при этом. Ответ: ____ кДж (Запишите число с точностью до целых.)
Решение
n(H2) =10/2 = 5 моль
Израсходовано 5 моль H2 – затрачено х кДж теплоты
Выделилось 1 моль H2 – затрачено 21 кДж теплоты
х = 5 * 21 = 105 кДж
Ответ: 105 кДж
13. Какой объём (н.у.) оксида серы (IV) (в литрах) теоретически может
прореагировать с 39 л (н.у.) кислорода?
Ответ: ____ л (Запишите число с точностью до целых.)
Решение
2SO2 + O2 =2SO3
V(SO2)/V(O2) = 2/1
V(SO2) = 2* V(O2) = 2*39 = 78 л
Ответ: 78 л
14. Вычислите объём (н.у.) азота (в литрах), образующегося при горении 10 л
(н.у.) аммиака. Ответ: ____ л (Запишите число с точностью до целых.)
Решение
4NH3 + 3O2 = 2N2 + 6H2O
V(NH3)/V(N2) =2/1
V(N2) = ½ V(NH3)
V(N2) =10/2 = 5л
Ответ:5л
Реакции с тепловым эффектом
20-Янв-2014 | Нет комментариев | Лолита Окольнова
Вопрос А28 ЕГЭ по химии — задача, и один из вариантов предложенных в тесте задач —
Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции
Абсолютно любая химическая реакция идет либо с поглощением, либо с выделением энергии в виде тепла.
Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного моля реагента или (реже) для моля продукта реакции. Такая величина называется тепловым эффектом реакции.
Тепловой эффект реакции (ΔН) зависит от природы реагирующих веществ, от количества этих веществ и их агрегатного состояния, от температуры.
- экзотермические реакции (+Q) — протекают с выделением энергии (тепла);
- Эндотермические (-Q) — наоборот, поглощают энергию (теплоту).
Если приведен пример реакции горения, то тепловой эффект такой реакции называют теплотой сгорания.
Теплоту сгорания относят к 1 молю вещества
дана реакция с тепловым эффектом:
Давайте рассмотрим на примерах такие задачи
Дана реакция с тепловым эффектом: +3120 кДж — тепло, выделяющееся при сгорании 2 моль этана
Составляем пропорцию:
3120 кДж — 2 моль этана
78 кДж — х моль
х= 78 • 2 3120 = 0,05 моль
Т.е. для получения 78 кДж теплоты необходимо сжечь 0,05 моль этана.
При нормальных условиях 1 моль любого газа занимает объем 22.4 лмоль. Следовательно,
V(C2H6)= n• 22.4 = 0,05 моль • 22.4 лмоль = 1,12 л
Ответ: 2)
Как видите, почти все задачи по химии сводятся к нахождению количества моль вещества, а уже после этого можно найти «все, что ЕГЭ угодно» — массу, объем, тепловой эффект и т.д.
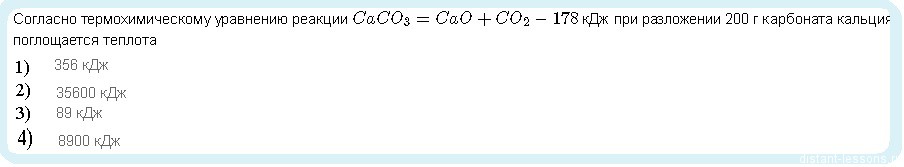
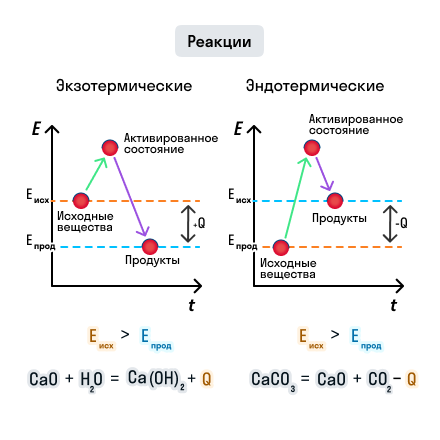
Нам дано 200 u карбоната кальция. Нужно найти количество моль:
n= m Mr
n(CaCO3) = 200 г 100 гмоль = 2 моль
При разложении 1 моль карбоната выделяется 178 кДж теплоты, а при 2 моль — в 2 раза больше — 356 кДж
Ответ: 1)

СH4 + 2O2 = CO2 + 2H2O
Реакция с тепловым эффектом 892 кДж — расчет ведется на 1 моль вещества (метана).
Найдем количество моль метана, соответствующее заданному объему: n = V 22.4 лмоль = 0,25 моль
1 моль метана — 892 кдЖ
0,25 моль — х
х = 223 кДж
- ЕГЭ вопрос А28 — Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции
Обсуждение: «Реакции с тепловым эффектом»
(Правила комментирования)
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
Вычисление теплового эффекта химических реакций
Энергия химических соединений сосредоточена главным образом в химических связях. Особенностью химических реакций является то, что они сопровождаются поглощением или выделением энергии.
Тепловой эффект химической реакции
Любая химическая реакция зависит от разрыва одних химических связей и образования других. Когда в результате химической реакции при образовании новых связей выделяется энергии больше, чем требовалось для разрушения «старых» связей в исходных веществах, то избыток энергии выделяется как тепло. Примером могут служить реакции горения. Например, природный газ (метан CH₄) сгорает в кислороде воздуха с выделением большого количества теплоты.
Реакции, протекающие с выделением теплоты, называются экзотермическими. Если реакция экзотермическая, то содержание энергии в исходных реагентах больше, чем в продуктах реакции. Теплота выделяется в окружающую среду и энергия реакционной системы уменьшается, тогда тепловой эффект будет отрицательным.
В другом случае, если реакция протекает с поглощением теплоты, то такая реакция называется эндотермической. Для эндотермических реакций содержание энергии в исходных реагентах меньше, чем в продуктах реакции. Теплота поступает в систему, энергия системы увеличивается, тепловой эффект H будет положительным.
Тепловой эффект реакции ΔH (энтальпия) – это разница между содержанием энергии в исходных реагентах и конечных продуктах реакции.
Тепловой эффект реакции записывают отдельно от химического уравнения.
2Mg+O2=2MgO;
∆Н= -1250 кДж.
Тепловой эффект реакции определяют для вещества количеством 1 моль, поэтому в термохимическом уравнении допускается и дробный коэффициент:
С+Н2О=СО+Н2;
∆Н=+131,4кДж.
Н2+0,5О2→Н2О+285,8кДж.
Термохимические уравнения
Область химии, занимающаяся изучением тепловых эффектов химических реакций, называется термохимией. Уравнения химических реакций, при которых приведен тепловой эффект, называют термохимическими уравнениями.
В термохимических уравнениях, в отличие от обычных химических уравнений, обязательно указывают агрегатные состояния веществ (жидкое «г.», твердое «тв.» или газообразное «г.»). Это связано с тем, что одно и то же вещество в разных агрегатных состояниях имеет разную энтальпию. Поэтому химическая реакция с участием одинаковых веществ, но в разном агрегатном состоянии, имеет разный тепловой эффект.
Тепловой эффект реакции в термохимических уравнениях обозначают двумя способами:
- указывают только знак ΔΗ – если нужно указать, является ли реакция экзо- или эндотермической:
2Na(тв.)+2H2O(p.)=2NaOH(тв.)+H2(г.);
∆H<0.
СаСО3(тв.)=СаО(тв.)+СО2(г.);
∆H˃0.
- указывают количественное значение – при необходимости проведения расчетов:
2Na(тв.)+2H2O(p.)=2NaOH(тв.)+H2(г.);
∆H=-281кДж/моль.
СаСО3(тв.)=СаО(тв.)+СО2(г.);
∆H=+177кДж/моль.
Изменение энтальпии, приведенное в термохимическом уравнении, – это та же часть химического уравнения, как и формулы веществ, и поэтому подчиняется тем же соотношениям. Например, для уравнения горения этана:
2C2H6(г.)+7O2(г.)=4СO2(г.)+6Н2O(p.)
∆H=3120 кДж/моль.
Расчеты по термохимическим уравнениям
Приведем несколько примеров термохимических расчётов.
Задача 1
При разложении 222 г кальция гидроксида поглощается 2955 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Решение
- Записываем термохимическое уравнение реакции разложения Са(OH)₂: Са(ОН)2=СаО+Н2О
Данное уравнение соответствует разложению 1 моль Са(ОН)₂, то есть 74 г.
- Рассчитаем количество вещества Ca(OH)₂:
v(Cа(ОН)2)=(m(Ca(OH)2))/(M(Ca(OH)2))=222 г/74 г/моль = 3моль.
- Количество теплоты, что соответствует 1 моль Са(ОН)₂, определим по пропорции:
на разложение 3 моль Са(ОН)₂ потрачено 2955 кДж теплоты, а на разложение 1 моль Са(ОН)₂ – x кДж теплоты. Отсюда:
х=(1моль*2955КДж)/3моль=985кДж.
Термохимическое уравнение разложения Са(ОН)₂ имеет такой вид:
Задача 2
2С2Н2 (г)+5О2 (г) = 4СО2 (г)+2Н2О (р),
Са(ОН)2 = СаО + Н2О,
∆Н0298 = 985 кДж.
Термохимическое уравнение сгорания ацетилена такое:
∆Н0298 = -2520 кДж.
Сколько теплоты выделится в результате сгорания 5 л (н. у.) ацетилена?
Решение
Из термохимического уравнения реакции:
в результате сгорания 2 моль С₂Н₂, то есть 2 • 22,4 л, выделяется 2520 кДж теплоты, х = 5л*2520 кДж/44,8 л = 281,25 кДж
тогда в результате сгорания 5 л С₂Н₂ выделится x кДж теплоты. Отсюда
Ответ: 281,25 кДж.
Задача 3
Термохимическое уравнение реакции получения фосфор (V) оксида:
4Р(тв)+5О2(г)=2Р2О5(тв),
∆Н0298= -2984 кДж
Рассчитайте массу фосфора и обьем кислорода (н. у.), которые вступили в реакцию, если при этом выделилось 746 кДж теплоты.
Решение
- Записываем термохимическое уравнение горения фосфора и подставляем данные:
- Вычисляем:
M(Р)=х=4*31 г*746кДж/2984 кДж = 31 г;
V(O2)=y=5*22,4 л*746 кДж/2984 кДж =28 л.
Ответ: 31 г; 28 л.
Закон Гесса
На основе широких и систематических исследований химических реакций, сопровождающихся выделением или поглощением теплоты, Г. Гесс сформулировал такой закон:
тепловой эффект химической реакции не зависит от пути её протекания, а зависит только от природы и агрегатного состояния (твердого, жидкого, газообразного) исходных веществ и продуктов реакции.
Другими словами, тепловой эффект любой химической реакции не зависит от того, образовалось ли соединение сразу из исходных веществ, или его образование произошло вследствие течения ряда последовательных реакций. Это можно объяснить на примере превращения углерода (графита) в карбон(IV) оксид:
Все указанные реакции происходят с выделением теплоты, то есть являются экзотермическими. Согласно закону Гесса:
∆Н1+∆Н2=∆Н,
-110,5 кДж-285,5 кДж = -396 кДж.
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.